Тема 17. Соединения алюминия. | 9 класс
Часть I
1. В земной коре алюминий занимает 3 место по содержанию среди всех элементов и 1 – среди металлов.
Массовая доля его в земной коре составляет 9%.
2. Заполните таблицу «Природные соединения алюминия».
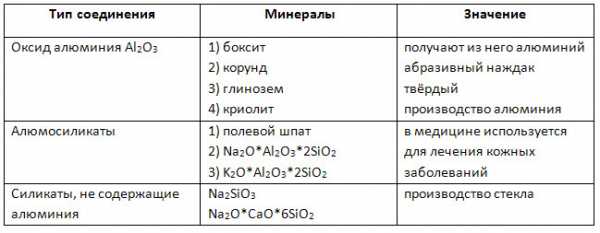
3. Оксид алюминия Al2O3 имеет атомную кристаллическую решётку и построен за счёт ионной химической связи.
Поэтому характеризуется следующими физическими свойствами: белое вещество с очень высокой температурой плавления.
Получение:
Имеет амфотерный характер, поэтому взаимодействует и с кислотами, и с щелочами (напишите уравнение возможных реакций в молекулярной, полной и сокращённой ионной формах).
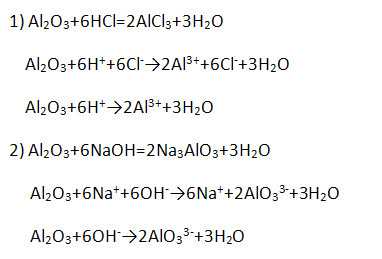
4. Гидроксид алюминия Al(OH)3 является амфотерным соединением и проявляет как основные, так и кислотные свойства (напишите уравнение возможных реакций в молекулярной, полной и сокращённой ионной формах).
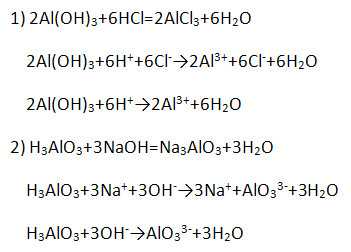
Получают при взаимодействии солей алюминия (изб.) с щелочами, например:
Часть II
1. Запишите два молекулярных уравнения реакций, соответствующих сокращённому ионному уравнению:
2. Запишите два молекулярных уравнения реакций, соответствующих сокращённому ионному уравнению:
3. Запишите два молекулярных уравнения реакций, соответствующих сокращённому ионному уравнению:
4. Дополните цепочку переходов. Составьте уравнения реакций, с помощью которых можно осуществить превращения по схеме:
Первую реакцию рассмотрите с позиций окисления-восстановления, остальные – в свете ТЭД.
5. Составьте кроссворд (около 10 слов) в особой тетради на тему «Соединения алюминия в ювелирном деле», используя Интернет.

Составив кроссворд, вы получите в выделенных ячейках названия 2-х драгоценных камней, в составе которых есть алюминий.
1. Минерал, алюминат бериллия; зеленовато-желтый, реже бесцветный, красивый и долговечный в огранке.
2. Оксид алюминия, очень богатый алюминием минерал.
3. Основное сырье для получения алюминия; глиноподобная, часто каменистая порода, в качестве примесей в которой обычно присутствуют оксиды кремния, титана, железа и ряд других соединений.
4. Синий драгоценный камень; одна из разновидностей минерала корунда.
6. Водный алюмосиликат, являющейся основной составной частью каолинов и глин.
7. Ценный камень, желтого, оранжевого, красного, фиолетового, синего, голубого, зеленого или черного цвета массой не более 10 карат.
8. Продукт воздействия на алюмосиликаты природных кислых вод, представляет собой алюминиевые квасцы.
9. Камень с вкраплениями золотистого пирита, напоминающий звездное небо; благодаря своему необычному цвету и возможности полировки до зеркального блеска, он широко применяется в наши дни (краска, фрески, бусы, вазочки, украшения и др.).
6. Напишите сочинение «Художественный образ вещества или процесса» по химии алюминия.
superhimik.ru
Al(OH)3 + NaOH = ? уравнение реакции
В зависимости от того, в каких условиях (в растворе или при сплавлении твердых веществ) протекает реакция между вышеуказанными соединениями Al(OH)3 + NaOH = ? могут образовываться различные продукты. Так, в случае протекания реакции в растворе образуется комплексная соль гексагидроксоалюминат натрия, в случае сплавления же – алюминат натрия и вода. Молекулярное уравнение реакции имеет вид:
Ионное уравнение можно записать только для реакции взаимодействия веществ в растворе:
Теперь переходим к решению задачи. Первоначально рассчитаем количество молей веществ, вступивших в реакцию (; ):
Это означает, что гидроксид натрия находится в избытке и дальнейшие расчеты производим по гидроксиду алюминия.
Согласно уравнению реакции
значит
Тогда масса алюмината натрия будет равна (молярная масса – 82 g/mole):
Al(OH)3 + KOH = ? уравнение реакции
В результате взаимодействия гидроксида калия с гидроксидом алюминия, проявляющим амфотерные свойства, из-за чего эта реакция и становится возможной (Al(OH)3 + KOH = ?) может происходить образование разных продуктов. Так, если реакцию проводили в концентрированном растворе гидроксида калия, то получается комплексная соль тетрагидроксоалюминат калия; в случае же разбавленного раствора щелочи образуется двойная соль алюминат калия и вода (обмен). Молекулярные уравнения реакции имеют вид:
Запишем ионные уравнения, учитывая, что вода и гидроксид алюминия на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Гидроксид алюминия представляет собой термически неустойчивый порошок белого цвета. Не растворяется в воде. Он существует в виде четырех полиморфных модификаций, каждую из которых можно выделить при конкретной температуре.
Гидроксид алюминия – типичный амфотерный гидроксид. С кислотами он образует соли, содержащие катион алюминия, со щелочами – алюминаты; при взаимодействии с водными растворами щелочей образуются гидроксоалюминаты; при нагревании до температуры выше гидроксид алюминия разлагается.
ru.solverbook.com
Урок 10. Алюминий – HIMI4KA

Алюминий — химический элемент третьей группы, третьего периода, следовательно, строение его атома можно изобразить схемой:
Имея на внешнем уровне атома три валентных электрона, алюминий проявляет постоянную валентность III.
Алюминий — мягкий, лёгкий металл. Очень пластичный: вытягивается в тончайшую проволоку, прокатывается в фольгу толщиной всего 0,005 мм. В такую фольгу упаковывают шоколад. Сплавы алюминия с другими металлами имеют высокую прочность, сравнимую со сталью (например, дуралюмин), в то же время они существенно легче. Из таких сплавов делают самолёты, поэтому алюминий называют «крылатым металлом».
Алюминий — очень активный металл, он мгновенно окисляется на воздухе:
причем оксидная плёнка покрывает его поверхность тончайшим слоем. Прочная оксидная плёнка предохраняет алюминий от коррозии, например, алюминиевые предметы не взаимодействуют с водой. Но, если разрушить оксидную плёнку, алюминий активно реагирует с водой, даже при нормальных условиях:
Алюминий активно реагирует с неметаллами:
Вопрос. Почему атом йода принял только один электрон?
Задание 10.1. Составьте уравнения реакций алюминия с серой, азотом (N2).
Алюминий может вытеснять некоторые металлы из их оксидов:
Этот процесс называется «алюминотермия» и применяется для получения некоторых металлов из их оксидов. В результате этого процесса выделяется значительное количество теплоты, так что металл получается в расплавленном состоянии. Поэтому алюминотермия используется для сварки некоторых металлов.
Особенность алюминия заключается в том, что он может реагировать и с кислотами, и со щелочами, т. е. проявляет амфотерные свойства:
В последней реакции получилась соль метаалюминиевой кислоты, которая в свободном состоянии не выделена.
Задание 10.2. Расставьте коэффициенты в последнем уравнении реакции, пользуясь методом электронного баланса.
Такие же амфотерные свойства проявляют и оксид алюминия, и гидроксид алюминия. Другими словами, оксид алюминия реагирует и с кислотами, и со щелочами. Поскольку в химических реакциях особенно легко реагируют вещества с противоположными свойствами, при взаимодействии с кислотами оксид алюминия ведет себя как обычный основный оксид.
Задание 10.3. Составьте уравнение реакции оксида алюминия с серной кислотой.
При взаимодействии со щелочами оксид алюминия ведет себя как кислотный оксид. А в этом случае, необходимо выяснить, какая кислота соответствует данному оксиду.
Вспомните или см. урок 2.1:
Вопрос. Можно ли в алюминиевой посуде длительное время хранить кислые щи? Щелочные растворы?
Такие же амфотерные свойства проявляет и гидроксид алюминия, т. е. он растворяется и в кислотах, и в щелочах:
Обратите внимание: поскольку здесь гидроксид алюминия реагирует со щёлочью (основанием), он проявляет свойства кислоты и мы формально записываем его состав в «кислотном» виде, т. е. атомы водорода записываются впереди.
Задание 10.4. Составьте уравнения реакций гидроксида алюминия с серной кислотой и гидроксидом кальция. Запишите оба уравнения в ионном виде.
Очень важно понимать, что осадок гидроксида алюминия растворяется в избытке щелочи. Поэтому при получении осадка гидроксида алюминия нужно к щёлочи прибавлять избыток растворимой соли алюминия. Если действовать наоборот, то лишняя щёлочь тут же растворит гидроксид алюминия и осадок не получится. Растворение осадка гидроксида алюминия в избытке щёлочи является качественным признаком присутствия солей алюминия в данном растворе.
Необходимо отметить, что все вышеприведенные реакции взаимодействия алюминия и его соединений со щелочами происходят при сплавлении (без воды). В растворах щелочей происходит растворение этих веществ, что приводит к образованию комплексных соединений:
При этом атом алюминия входит в состав прочного комплексного иона, который практически не диссоциирует.
Поэтому растворение алюминия* в растворе щёлочи можно выразить уравнением:
* Аналогичными амфотерными свойствами обладают цинк и его соединения.
Задание 10.5. Расставьте коэффициенты в последнем уравнении реакции, пользуясь методом электронного баланса.
Аналогичными свойствами обладает цинк, его оксид и гидроксид.
Алюминий занимает третье место (после кислорода и кремния) по распространённости на нашей планете и первое место среди металлов. Он входит в состав гранита, глины, драгоценных камней (основу сапфира, аметиста, рубина составляет оксид алюминия). Практическое применение находит как сам алюминий, так и его сплавы, а также некоторые его соли. Так, сульфат алюминия применяется для очистки питьевой воды.
Вопрос. Какие сплавы алюминия вам известны? Где они применяются? (См. урок 8.2.)

Выводы
Алюминий — амфотерный металл, причем некоторые его соединения (оксид, гидроксид) также амфотерны. Поскольку посуда из алюминия встречается на каждой кухне, эти свойства алюминия должен знать каждый и помнить: в алюминиевой посуде кислые и солёные продукты, щелочные растворы хранить нельзя!
