Алюминий и его реакция с водой
[Deposit Photos]Впервые алюминий был получен лишь в начале XIX века. Cделал это физик Ганс Эрстед. Свой эксперимент он проводил с амальгамой калия, хлоридом алюминия и ртутью.
Кстати, название этого серебристого материала произошло от латинского слова «квасцы», потому что именно из них добывается этот элемент.
Квасцы [Wikimedia]Квасцы – это природные минералы на основе металлов, которые объединяют в своем составе соли серной кислоты.
Раньше алюминий считался драгоценным металлом и стоил на порядок дороже, чем золото. Объяснялось это тем, что металл было довольно сложно отделить от примесей. Так что позволить себе украшения из алюминия могли только богатые и влиятельные люди.
Но в 1886 году Чарльз Холл придумал метод по добыче алюминия в промышленном масштабе, что резко удешевило этот металл и позволило применять его в металлургическом производстве. Промышленный метод заключался в электролизе расплава криолита, в котором растворен оксид алюминия.
Алюминий — очень востребованный металл, ведь именно из него изготавливаются многие вещи, которыми человек пользуется в быту.
Применение алюминия
Благодаря ковкости и легкости, а также защищенности от коррозии, алюминий является ценным металлом в современной промышленности. Из алюминия изготавливают не только кухонную посуду — он широко используется в авто- и авиастроительстве.
Также алюминий является одним из самых недорогих и экономичных материалов, так как его можно использовать бесконечно, переплавляя ненужные алюминиевые предметы, например, банки.
Металлический алюминий безопасен, но его соединения могут оказывать токсическое действие на человека и животных (особенно хлорид, ацетат и сульфат алюминия).
Физические свойства алюминия
Алюминий — достаточно легкий металл серебристого цвета, который может образовывать сплавы с большинством металлов, особенно с медью, магнием и кремнием. Также он весьма пластичен, его без труда можно превратить в тонкую пластинку или же фольгу. Температура плавления алюминия = 660 °C, а температура кипения — 2470 °C.
Химические свойства алюминия
При комнатной температуре металл покрывается прочной пленкой оксида алюминия Al₂O₃, которая защищает его от коррозии.
С окислителями алюминий практически не реагирует из-за защищающей его оксидной пленки. Однако ее можно легко разрушить, чтобы металл проявил активные восстановительные свойства. Разрушить оксидную пленку алюминия можно раствором или расплавом щелочей, кислотами или же с помощью хлорида ртути.
Разрушить оксидную пленку алюминия можно раствором или расплавом щелочей, кислотами или же с помощью хлорида ртути.
Благодаря восстановительным свойствам алюминий нашел применение в промышленности — для получения других металлов. Этот процесс называется алюмотермией. Такая особенность алюминия заключается во взаимодействии с оксидами других металлов.
Алюмотермическая реакция с участием оксида железа (III) [Wikimedia]Например, рассмотрим реакцию с оксидом хрома:
Cr₂O₃ + Al = Al₂O₃ + Cr.
Алюминий хорошо вступает в реакцию с простыми веществами. Например, с галогенами (за исключением фтора) алюминий может образовать иодид, хлорид, или бромид алюминия:
2Al + 3Cl₂ → 2AlCl₃
С другими неметаллами, такими как фтор, сера, азот, углерод и т.д. алюминий может реагировать только при нагревании.
Также серебристый металл вступает в реакцию и со сложными химическими веществами.
Al(ОН)₃ + NaOH = Na[Al(OH)₄]),
так и металлический алюминий или же оксид алюминия:
2Al + 2NaOH + 6Н₂О = 2Na[Al(OH)₄] + ЗН₂.
Al₂O₃ + 2NaOH + 3H₂O = 2Na[Al(OH)₄]
С агрессивными кислотами (например, с серной и соляной) алюминий реагирует довольно спокойно, без воспламенения.
Если опустить кусочек металла в соляную кислоту, то пойдет медленная реакция — сначала будет растворяться оксидная пленка — но затем она ускорится. Алюминий растворяется в соляной кислоте с выделением водорода. В результате реакции получается хлорид алюминия:
Al₂O₃ + 6HCl = 2AlCl₃ + 3H₂O
2Al + 6HCl → 2AlCl₃ + 3H₂.
Хлорид алюминия [Wikimedia]
Реакция алюминия с водой
Если опустить алюминиевую стружку в обычную воду, ничего не произойдет, потому что алюминий защищен оксидной пленкой, которая не дает этому металлу вступить в реакцию.
Только сняв защитную пленку хлоридом ртути, можно получить результат. Для этого металл нужно вымачивать в растворе хлорида ртути на протяжении двух минут, а затем хорошо его промыть. В результате получится амальгама, сплав ртути и алюминия:
3HgCI₂ + 2Al = 2AlCI₃ + 3Hg
Причем она не удерживается на поверхности металла. Теперь, опустив очищенный металл в воду, можно наблюдать медленную реакцию, которая сопровождается выделением водорода и образованием гидроксида алюминия:
2Al + 6H₂O = 2Al(OH)₃ + 3H₂.
Гидроксид алюминия не разлагается при нагревании. Гидроксид алюминия — вещество с интересными свойствами
Гидроксид алюминия — химическое вещество, которое представляет собой соединение оксида алюминия с водой. Может пребывать в жидком и твердом состояниях. Жидкий гидроксид является желеподобным прозрачным веществом, которое очень плохо растворяется в воде. Твердый гидроксид представляет собой кристаллическое вещество белого цвета, которое обладает пассивными химическими свойствами и не реагирует практически ни с одним другим элементом или соединением.
Жидкий гидроксид является желеподобным прозрачным веществом, которое очень плохо растворяется в воде. Твердый гидроксид представляет собой кристаллическое вещество белого цвета, которое обладает пассивными химическими свойствами и не реагирует практически ни с одним другим элементом или соединением.
Получение гидроксида алюминия
Получение гидроксида алюминия происходит благодаря химической реакции обмена. Для этого используют водный раствор аммиака и какую-либо соль алюминия, чаще всего хлорид алюминий. Таким образом получают жидкое вещество. Если необходим твердый гидроксид, через растворенную щелочь тетрагидроксодиакваалюмината натрия пропускают диоксид углерода. Многих любителей экспериментов волнует вопрос, как получить гидроксид алюминия в домашних условиях? Для этого достаточно приобрести в специализированном магазине необходимые реагенты и химическую посуду.
Для получения твердого вещества понадобится еще и специально оборудование, так что лучше остановиться на жидком варианте. При проведении реакции необходимо использовать хорошо проветриваемое помещение, так как одним из побочных продуктов может быть газ или вещество с резким запахом, который может негативно сказаться на самочувствии и здоровье человека. Работать стоит в специальных защитных перчатках, так как большинство кислот при попадании на кожу вызывают химические ожоги. Не лишним будет позаботиться и о защите для глаз в виде специальных очков. Приступая к любому делу, в первую очередь необходимо думать об обеспечении безопасности!
При проведении реакции необходимо использовать хорошо проветриваемое помещение, так как одним из побочных продуктов может быть газ или вещество с резким запахом, который может негативно сказаться на самочувствии и здоровье человека. Работать стоит в специальных защитных перчатках, так как большинство кислот при попадании на кожу вызывают химические ожоги. Не лишним будет позаботиться и о защите для глаз в виде специальных очков. Приступая к любому делу, в первую очередь необходимо думать об обеспечении безопасности!
Свежесинтезированный гидроксид алюминия реагирует с большинством активных кислот и щелочей. Именно поэтому для его получения используют аммиачную воду, чтобы сохранить образованное вещество в чистом виде. При использовании для получения кислоты или щелочи необходимо максимально точно рассчитать пропорцию элементов, иначе при избытке полученный гидроксид алюминия взаимодействует с остатками непоглощенной основы и полностью растворяется в ней. Это происходит из-за высокого уровня химической активности алюминия и его соединений.
В основном, гидроксид алюминия получают из бокситовой руды с высоким содержанием оксида металла. Процедура позволяет быстро и относительно дешево отделить полезные элементы от пустой породы. Реакции гидроксида алюминия с кислотами приводят к восстановлению солей и образованию воды, а с щелочами — к получению комплексных гидрооксоалюминиевых солей. Твердый гидроксид методом сплавки соединяют с твердыми щелочами с образованием метаалюминатов.
Основные свойства вещества
Физические свойства гидроксида алюминия: плотность — 2,423 грамм на сантиметр кубический, уровень растворяемости в воде — низкий, цвет — белый либо прозрачный. Вещество может существовать в четырех полиморфных вариантах. Под воздействием низких температур образуется альфа-гидроксид, называемый байеритом. Под воздействие нагревания можно получить гамма-гидроксид или гиббсит. Оба вещества имеют кристаллическую молекулярную решетку с водородными межмолекулярными типами связи. Также встречаются еще две модификации — бета-гидроксид или нордстандрит и триклинный гибсит. Первая получается путем прокаливания байерита или гиббсита.Второй отличается от остальных видов триклинным, а не монообразным строением кристаллической решетки.
Первая получается путем прокаливания байерита или гиббсита.Второй отличается от остальных видов триклинным, а не монообразным строением кристаллической решетки.
Химические свойства гидроксида алюминия: молярная масса — 78 моль, в жидком состоянии хорошо растворяется в активных кислотах и щелочах, при нагревании разлагается, обладает амфотерными признаками. В промышленности в подавляющем большинстве случаев используется именно жидкий гидроксид, так как благодаря высокому уровню химической активности, он легко поддается обработки и не требует использования катализаторов или специальных условий протекания реакции.
Амфотерность гидроксида алюминия проявляется в двойственности его природы. Это означает, что в различных условиях он может проявлять кислотные либо щелочные свойства. Когда гидроксид принимает участие в реакции как щелочь, образуется соль, в которой алюминий является положительно заряженным катионом. Выступая в качестве кислоты, гидроксид алюминия на выходе также образует соль. Но в этом случае металл уже играет роль отрицательно заряженного аниона. Двойственная природа открывает широкие возможности по применению данного химического соединения. Оно используется в медицине для изготовления лекарственных препаратов, назначаемых при нарушении кислотно-щелочного баланса в организме.
Но в этом случае металл уже играет роль отрицательно заряженного аниона. Двойственная природа открывает широкие возможности по применению данного химического соединения. Оно используется в медицине для изготовления лекарственных препаратов, назначаемых при нарушении кислотно-щелочного баланса в организме.
Гидроксид алюминия входит в состав вакцин в качестве вещества, усиливающего иммунную реакцию организма на раздражитель. Нерастворимость осадка гидроксида алюминия в воде позволяет использовать вещество в водоочистных целях. Химическое соединение является очень сильным адсорбентом, который позволяет извлекать из состава воды большое количество вредных элементов.
Применение в промышленности
Применение гидроксида в промышленности связано с получением чистого алюминия. Технологический процесс начинается с обработки руды, содержащей оксид алюминия, который по завершению процесса переходит в гидроксид. Выход продукции в данной реакции достаточно высок, так что после завершения остается практически голая порода. Далее проводится операция разложения гидроксида алюминия.
Далее проводится операция разложения гидроксида алюминия.
Процедура не требует специальных условий, так как вещество хорошо разлагается при нагревании до температуры свыше 180 градусов по Цельсию. Этот этап позволяет выделить оксид алюминия. Это соединение является базовым или вспомогательным материалом для изготовления большого количества промышленных и бытовых изделий. При необходимости получения чистого алюминия используют процесс электролиза с добавлением в раствор криолита натрия. Катализатор забирает из оксида кислород, и чистый алюминий оседает на катоде.
Гидроокись алюминия
Химические свойства
Химическая формула Гидроксида Алюминия: Al(OH)3 . Это химическое соединение оксида алюминия с водой. Синтезируют в виде белого желеобразного вещества, которое плохо растворимо в воде. У гидроксида имеются 4 кристаллические модификации: нордстрандит (β) , моноклинный (γ) гиббсит , байерит (γ) и гидрагилит . Также существует аморфное вещество, состав которого варьируется: Al2O3 nh3O.
Химические свойства. Соединение проявляет амфотерные свойства. Гидроксид Алюминия реагирует с щелочами: при реакции с гидроксидом натрия
Получение Гидроксида Алюминия. Химическое соединение получают из солей Al при их взаимодействии с водным раствором щелочи в недостатке, избегая избытка. К хлориду алюминия AlCl3 прибавляют натрия гидроксид – в результате требуемое вещество выпадает в виде белого осадка и дополнительно образуется хлорид натрия .
Также средство можно получить с помощью реакции водорастворимой соли алюминия с карбонатом щелочного металла. Например, к хлориду алюминия прибавить
Например, к хлориду алюминия прибавить
Применение:
- используют для очистки воды в качестве адсорбента;
- можно синтезировать сульфат алюминия при взаимодействии гидроксида Al и серной кислоты ;
- в качестве адъюванта при изготовлении вакцины;
- в медицине в виде антацида ;
- при изготовлении пластика и прочих материалов в виде подавителя процессов горения.
Фармакологическое действие
Антацидное, адсорбирующее, обволакивающее.
Фармакодинамика и фармакокинетика
Гидроксид Алюминия нейтрализует соляную кислоту, разлагая ее на хлорид алюминия и воду. Вещество постепенно повышает рН желудочного сока до 3-4,5 и удерживает на этом уровне в течение нескольких часов. Кислотность желудочного сока значительно снижается, угнетается его протеолитическая активность. При проникновении в щелочную среду кишечника средство образует ионы хлора и фосфаты, которые не всасываются, ионы
При проникновении в щелочную среду кишечника средство образует ионы хлора и фосфаты, которые не всасываются, ионы
Показания к применению
Лекарство используют:
- для лечения 12-перстной кишки и желудка;
- при хроническом при нормальной и повышенной секреторной функции желудка во время обострения;
- во время терапии грыжи пищеводного отверстия диафрагмы;
- для устранения дискомфорта и болезненных ощущений в области желудка;
- при после употребления алкоголя, кофе или никотина, некоторых лекарств;
- при несоблюдении диеты.
Противопоказания
Средство нельзя принимать:
- пациентам с ;
- при серьезных заболеваниях почек.
Побочные действия
После приема Гидроксида Алюминия побочные реакции развиваются редко. Наиболее вероятно возникновение . Вероятность развития побочного действия можно снизить, если дополнительно принять .
Инструкция по применению (Способ и дозировка)
Гидроксид Алюминия назначают для приема внутрь. Лекарство чаще всего принимают в виде суспензии, с концентрацией активного компонента 4%. Как правило, принимают по 1 или 2 чайным ложкам препарата, 4 или 6 раз в сутки. Продолжительность лечения зависит от болезни и рекомендаций врача.
Лекарство чаще всего принимают в виде суспензии, с концентрацией активного компонента 4%. Как правило, принимают по 1 или 2 чайным ложкам препарата, 4 или 6 раз в сутки. Продолжительность лечения зависит от болезни и рекомендаций врача.
Передозировка
Данные о передозировке средством отсутствуют.
Взаимодействие
При сочетании препарата с трисиликатом магния наблюдается оптимизация антацидного действия и снижается констипационное действие лекарства от изжоги.
Особые указания
Особую осторожность соблюдают при лечении пациентов с нарушениями фосфорного обмена.
Внешний вид вещества гидроксид алюминия следующий. Как правило, это вещество белого, студневидного вида, хотя встречаются варианты присутствия в кристаллическом или аморфном состоянии. Например, в высушенном виде оно кристаллизуется в белые кристаллы, которые не растворяются ни в кислотах, ни в щелочах.
Гидроокись алюминия может быть представлена и мелкокристаллическим порошком белого цвета. Допустимо присутствие розового и серого оттенков.
Допустимо присутствие розового и серого оттенков.
Химическая формула соединения — Al(OH)3. Соединение и воды образуют гидроксид которого также определяются во многом элементами, входящими в его состав. Получают это соединение посредством проведения реакции взаимодействия соли алюминия и разбавленной щелочи, при этом следует не допускать их переизбытка. Получаемый в ходе данной реакции осадок гидроксида алюминия затем может взаимодействовать с кислотами.
Гидроокись алюминия взаимодействует с водным раствором гидрооксида рубидия, сплавом этого вещества, гидроокисью цезия, карбонатом цезия. Во всех случаях выделяется вода.
Гидроокись алюминия обладает равной 78,00, практически не растворяется в воде. Плотность вещества составляет 3,97 грамм/см3. Будучи амфотерным веществом, гидроксид алюминия взаимодействует с кислотами, при этом, в результате реакций получаются средние соли и выделяется вода. При вступлении в реакции со щелочами появляются комплексные соли — гидроксоалюминаты, например, К. Метаалюминаты образуются, если гидроксид алюминия сплавлять с безводными щелочами.
Метаалюминаты образуются, если гидроксид алюминия сплавлять с безводными щелочами.
Как и все амфотерные вещества, кислотные и основные свойства одновременно гидроокись алюминия показывает при взаимодействии с а также со щелочами. В этих реакциях при растворении гидроксида в кислотах происходит отщепление ионов самого гидроксида, а при взаимодействии со щелочью — отщепляется ион водорода. Чтобы увидеть это, можно, например, провести реакцию, в которой участвуют гидроксид алюминия, Для ее проведения необходимо в пробирку засыпать немного опилок алюминия и залить небольшим количеством гидроксида натрия, не больше 3 миллилитров. Пробирку следует плотно закрыть пробкой, и начать медленный подогрев. После этого, закрепив пробирку на штативе, надо собрать выделенный водород в другую пробирку, предварительно надев ее на капиллярное приспособление. Примерно через минуту пробирку следует снять с капилляра и поднести к пламени. Если в пробирке собран чистый водород — горение будет происходить спокойно, в том же случае, если в нее попал воздух — произойдет хлопок.
Получают гидроксид алюминия в лабораториях несколькими способами:
Путем реакции взаимодействия солей алюминия и щелочных растворов;
Способом разложения нитрида алюминия под воздействием воды;
Путем пропускания углерода через специальный гидрокомплекс, содержащий Al(ОН)4;
Воздействием гидрата аммиака на соли алюминия.
Промышленное получение связано с переработкой бокситов. Используются также технологии воздействия на алюминатные растворы карбонатами.
Применяется гидроокись алюминия в изготовлении минеральных удобрений, криолита, различных медицинских и фармакологических препаратов. В химическом производстве вещество используют для получения фтористого и сернистого алюминия. Незаменимо соединение при производстве бумаги, пластмасс, красок и много другого.
Медицинское применение обусловлено позитивным действием препаратов, содержащих данный элемент в лечении желудочных расстройств, повышенной кислотности организма, язвенных заболеваний.
При обращении с веществом, следует остерегаться вдыхания его паров, так как они вызывают сильное поражение легких. Будучи слабодействующим слабительным, опасно в больших дозах. При коррозии вызывает алюминоз.
Будучи слабодействующим слабительным, опасно в больших дозах. При коррозии вызывает алюминоз.
Само вещество достаточно безопасно, так как не вступает в реакции с окислителями.
Неорганическое вещество, щелочь алюминия, формула Al(OH) 3 . Встречается в природе, входит в состав бокситов.
Свойства
Существует в четырех кристаллических модификациях и в виде коллоидного раствора, гелеобразного вещества. Реактив почти не водорастворим. Не горит, не взрывается, не ядовит.
В твердом виде — мелкокристаллический рыхлый порошок, белый или прозрачный, иногда с легким серым или розовым оттенком. Гелеобразный гидроксид тоже белый.
Химические свойства у твердой и гелеобразной модификации отличаются. Твердое вещество достаточно инертно, не вступает в реакции с кислотами, щелочами, другими элементами, но может образовывать метаалюминаты в результате сплавления с твердыми щелочами или карбонатами.
Гелеобразное вещество проявляет амфотерные свойства, то есть реагирует и с кислотами, и со щелочами. В реакции с кислотами образуются соли алюминия соответствующей кислоты, со щелочами — соли другого типа, алюминаты. Не вступает в реакции с раствором аммиака.
В реакции с кислотами образуются соли алюминия соответствующей кислоты, со щелочами — соли другого типа, алюминаты. Не вступает в реакции с раствором аммиака.
При нагревании гидроксид разлагается на оксид и воду.
Меры предосторожности
Реактив относится к четвертому классу опасности, считается пожаробезопасным и практически безопасным для человека и окружающей среды. Осторожность нужно проявлять только с аэрозольными частицами в воздухе: пыль оказывает раздражающее воздействие на органы дыхания, кожу, слизистые оболочки.
Поэтому на рабочих местах, где возможно образование большого количества пыли гидроксида алюминия, сотрудники должны использовать средства защиты для органов дыхания, глаз и кожи. Следует наладить контроль содержания в воздухе рабочей зоны вредных веществ по методике, утвержденной ГОСТом.
Помещение должно быть оборудовано приточно-вытяжной вентиляцией, а при необходимости — местными аспирационными отсосами.
Хранят твердую гидроокись алюминия в многослойных бумажных мешках или другой таре для сыпучих продуктов.
Применение
В промышленности реактив используется для получения чистого алюминия и производных алюминия, например, оксида алюминия, сернокислого и фтористого алюминия .
— Оксид алюминия, получаемый из гидроксида, применяется для получения искусственных рубинов для нужд лазерной техники, корундов — для сушки воздуха, очистки минеральных масел, для производства наждака.
— В медицине используется как обволакивающее средство и антацид длительного действия для нормализации кислотно-щелочного баланса ЖКТ человека, для лечения язвенной болезни желудка и двенадцатиперстной кишки, гастро-эзофагеального рефлюкса и некоторых других заболеваний.
— В фармакологии входит в состав вакцин для усиления иммунной реакции организма на воздействие введенной инфекции.
— В водоочистке — как адсорбент, помогающий удалять из воды различные загрязнения. Гидроксид активно вступает в реакции с веществами, которые нужно удалить, образуя нерастворимые соединения.
— В химпроме используется как экологичный антипирен для полимеров, силиконов, каучуков, лакокрасочных материалов — чтобы ухудшить их горючесть, способность к возгоранию, подавить выделение дыма и токсичных газов.
— В производстве зубной пасты, минеральных удобрений, бумаги, красителей, криолита.
Химия алюминия. Важнейшие соединения алюминия Химическая формула гидроксида алюминия
Неорганическое вещество, щелочь алюминия, формула Al(OH) 3 . Встречается в природе, входит в состав бокситов.
Свойства
Существует в четырех кристаллических модификациях и в виде коллоидного раствора, гелеобразного вещества. Реактив почти не водорастворим. Не горит, не взрывается, не ядовит.
В твердом виде — мелкокристаллический рыхлый порошок, белый или прозрачный, иногда с легким серым или розовым оттенком. Гелеобразный гидроксид тоже белый.
Химические свойства у твердой и гелеобразной модификации отличаются. Твердое вещество достаточно инертно, не вступает в реакции с кислотами, щелочами, другими элементами, но может образовывать метаалюминаты в результате сплавления с твердыми щелочами или карбонатами.
Гелеобразное вещество проявляет амфотерные свойства, то есть реагирует и с кислотами, и со щелочами. В реакции с кислотами образуются соли алюминия соответствующей кислоты, со щелочами — соли другого типа, алюминаты. Не вступает в реакции с раствором аммиака.
В реакции с кислотами образуются соли алюминия соответствующей кислоты, со щелочами — соли другого типа, алюминаты. Не вступает в реакции с раствором аммиака.
При нагревании гидроксид разлагается на оксид и воду.
Меры предосторожности
Реактив относится к четвертому классу опасности, считается пожаробезопасным и практически безопасным для человека и окружающей среды. Осторожность нужно проявлять только с аэрозольными частицами в воздухе: пыль оказывает раздражающее воздействие на органы дыхания, кожу, слизистые оболочки.
Поэтому на рабочих местах, где возможно образование большого количества пыли гидроксида алюминия, сотрудники должны использовать средства защиты для органов дыхания, глаз и кожи. Следует наладить контроль содержания в воздухе рабочей зоны вредных веществ по методике, утвержденной ГОСТом.
Помещение должно быть оборудовано приточно-вытяжной вентиляцией, а при необходимости — местными аспирационными отсосами.
Хранят твердую гидроокись алюминия в многослойных бумажных мешках или другой таре для сыпучих продуктов.
Применение
В промышленности реактив используется для получения чистого алюминия и производных алюминия, например, оксида алюминия, сернокислого и фтористого алюминия .
— Оксид алюминия, получаемый из гидроксида, применяется для получения искусственных рубинов для нужд лазерной техники, корундов — для сушки воздуха, очистки минеральных масел, для производства наждака.
— В медицине используется как обволакивающее средство и антацид длительного действия для нормализации кислотно-щелочного баланса ЖКТ человека, для лечения язвенной болезни желудка и двенадцатиперстной кишки, гастро-эзофагеального рефлюкса и некоторых других заболеваний.
— В фармакологии входит в состав вакцин для усиления иммунной реакции организма на воздействие введенной инфекции.
— В водоочистке — как адсорбент, помогающий удалять из воды различные загрязнения. Гидроксид активно вступает в реакции с веществами, которые нужно удалить, образуя нерастворимые соединения.
— В химпроме используется как экологичный антипирен для полимеров, силиконов, каучуков, лакокрасочных материалов — чтобы ухудшить их горючесть, способность к возгоранию, подавить выделение дыма и токсичных газов.
— В производстве зубной пасты, минеральных удобрений, бумаги, красителей, криолита.
Одним из наиболее широко используемых в промышленности веществ является гидроксид алюминия. В этой статье о нем и пойдет речь.
Что такое гидроксид?
Это химическое соединение, которое образуется при взаимодействии оксида с водой. Существует три их разновидности: кислотные, основные и амфотерные. Первые и вторые разделяются на группы в зависимости от их химической активности, свойств и формулы.
Что такое амфотерные вещества?
Амфотерными могут быть оксиды и гидроксиды. Это такие вещества, для которых характерно проявлять как кислотные, так и основные свойства, в зависимости от условий реакции, используемых реагентов и т. д. К амфотерным оксидам относятся два вида оксида железа, оксид марганца, свинца, бериллия, цинка, а также алюминия. Последний, кстати, чаще всего получают из его гидроксида. К амфотерным же гидроксидам можно отнести гидроксид бериллия, железа, а также гидроксид алюминия, который мы сегодня и рассмотрим в нашей статье.
Физические свойства гидроксида алюминия
Данное химическое соединение представляет собой твердое белое вещество. Оно не растворяется в воде.
Гидроксид алюминия — химические свойства
Как уже было сказано выше, это наиболее яркий представитель группы амфотерных гидроксидов. В зависимости от условий реакции, он может проявлять как основные, так и кислотные свойства. Данное вещество способно растворяться в кислотах, при этом образуется соль и вода.
К примеру, если смешать его с хлорной кислотой в равном количестве, то получим алюминий хлорид с водой также в одинаковых пропорциях. Также еще одно вещество, с которым реагирует гидроксид алюминия, — гидроксид натрия. Это типичный основной гидроксид. Если смешать в равных количествах рассматриваемое вещество и раствор гидроксида натрия, то получим соединение под названием тетрагидроксоалюминат натрия. В его химической структуре содержится атом натрия, атом алюминия, по четыре атома оксигена и гидрогена. Однако при сплавлении этих веществ реакция идет несколько по-другому, и образуется уже не это соединение. В результате данного процесса можно получить метаалюминат натрия (в его формулу входят по одному атому натрия и алюминия и два атома оксигена) с водой в равных пропорциях, при условии, если смешать одинаковое количество сухих гидроксидов натрия и алюминия и подействовать на них высокой температурой. Если же смешать его с гидроксидом натрия в других пропорциях, можно получить гексагидроксоалюминат натрия, который содержит три атома натрия, один атом алюминия и по шесть оксигена и гидрогена. Для того чтобы образовалось данное вещество, нужно смешать рассматриваемое вещество и раствор гидроксида натрия в пропорциях 1:3 соответственно. По описанному выше принципу можно получить соединения под названием тетрагидроксоалюминат калия и гексагидроксоалюминат калия. Также рассматриваемое вещество подвержено разложению при воздействии на него очень высоких температур. Вследствие такого рода химической реакции образуется оксид алюминия, который также обладает амфотерностью, и вода.
Однако при сплавлении этих веществ реакция идет несколько по-другому, и образуется уже не это соединение. В результате данного процесса можно получить метаалюминат натрия (в его формулу входят по одному атому натрия и алюминия и два атома оксигена) с водой в равных пропорциях, при условии, если смешать одинаковое количество сухих гидроксидов натрия и алюминия и подействовать на них высокой температурой. Если же смешать его с гидроксидом натрия в других пропорциях, можно получить гексагидроксоалюминат натрия, который содержит три атома натрия, один атом алюминия и по шесть оксигена и гидрогена. Для того чтобы образовалось данное вещество, нужно смешать рассматриваемое вещество и раствор гидроксида натрия в пропорциях 1:3 соответственно. По описанному выше принципу можно получить соединения под названием тетрагидроксоалюминат калия и гексагидроксоалюминат калия. Также рассматриваемое вещество подвержено разложению при воздействии на него очень высоких температур. Вследствие такого рода химической реакции образуется оксид алюминия, который также обладает амфотерностью, и вода. Если взять 200 г гидроксида и нагреть его, то получим 50 г оксида и 150 г воды. Кроме своеобразных химических свойств, данное вещество проявляет также и обычные для всех гидроксидов свойства. Оно вступает во взаимодействие с солями металлов, которые имеют более низкую химическую активность, нежели алюминий. Для примера можно рассмотреть реакцию между ним и хлоридом меди, для которой нужно взять их в соотношении 2:3. При этом выделится водорастворимый хлорид алюминия и осадок в виде гидроксида купрума в пропорциях 2:3. Также рассматриваемое вещество реагирует и с оксидами подобных металлов, для примера можно взять соединение той же меди. Для проведения реакции потребуется гидроксид алюминия и оксид купрума в соотношении 2:3, в результате чего получим алюминий оксид и гидроксид меди. Свойствами, которые были описаны выше, также обладают и другие амфотерные гидроксиды, такие как гидроксид железа или бериллия.
Если взять 200 г гидроксида и нагреть его, то получим 50 г оксида и 150 г воды. Кроме своеобразных химических свойств, данное вещество проявляет также и обычные для всех гидроксидов свойства. Оно вступает во взаимодействие с солями металлов, которые имеют более низкую химическую активность, нежели алюминий. Для примера можно рассмотреть реакцию между ним и хлоридом меди, для которой нужно взять их в соотношении 2:3. При этом выделится водорастворимый хлорид алюминия и осадок в виде гидроксида купрума в пропорциях 2:3. Также рассматриваемое вещество реагирует и с оксидами подобных металлов, для примера можно взять соединение той же меди. Для проведения реакции потребуется гидроксид алюминия и оксид купрума в соотношении 2:3, в результате чего получим алюминий оксид и гидроксид меди. Свойствами, которые были описаны выше, также обладают и другие амфотерные гидроксиды, такие как гидроксид железа или бериллия.
Что такое гидроксид натрия?
Как видно выше, существует много вариантов химических реакций гидроксида алюминия с гидроксидом натрия. Что же это за вещество? Это типичный основной гидроксид, то есть химически активная, растворимая в воде основа. Он обладает всеми химическими свойствами, которые характерны для основных гидроксидов.
Что же это за вещество? Это типичный основной гидроксид, то есть химически активная, растворимая в воде основа. Он обладает всеми химическими свойствами, которые характерны для основных гидроксидов.
То есть он может растворяться в кислотах, к примеру, при смешивании натрий гидроксида с хлорной кислотой в равных количествах можно получить пищевую соль (хлорид натрия) и воду в пропорции 1:1. Также данный гидроксид вступает в реакции с солями металлов, которые обладают более низкой химической активностью, нежели натрий, и их оксидами. В первом случае происходит стандартная реакция обмена. При добавлении к нему, к примеру, хлорида серебра, образуется хлорид натрия и гидроксид серебра, который выпадает в осадок (реакция обмена осуществима только в случае, если одно из веществ, полученных в ее результате, будет осадком, газом либо водой). При добавлении к натрий гидроксиду, например, оксида цинка, получаем гидроксид последнего и воду. Однако намного более специфическими являются реакции данного гидроксида AlOH, которые были описаны выше.
Получение AlOH
Когда мы уже рассмотрели основные его химические свойства, можно поговорить о том, как же его добывают. Основной способ получения данного вещества — проведение химической реакции между солью алюминия и натрий гидроксидом (может использоваться и калий гидроксид).
При такого рода реакции образуется сам AlOH, выпадающий в белый осадок, а также новая соль. Например, если взять алюминий хлорид и добавить к нему в три раза больше гидроксида калия, то полученными веществами будут рассматриваемое в статье химическое соединение и в три раза больше хлорида калия. Также существует метод получения AlOH, который предусматривает проведение химической реакции между раствором соли алюминия и карбонатом основного металла, для примера возьмем натрий. Для получения гидроксида алюминия, кухонной соли и углекислого газа в пропорциях 2:6:3 необходимо смешать хлорид алюминия, карбонат натрия (соду) и воду в соотношении 2:3:3.
Где используется алюминий гидроксид?
Гидроксид алюминия находит свое применение в медицине.
Благодаря его способности нейтрализовать кислоты, препараты с его содержанием рекомендуются при изжоге. Также его выписывают при язвах, острых и хронических воспалительных процессах кишечника. Кроме того, гидроксид алюминия используют в изготовлении эластомеров. Также он широко применяется в химической промышленности для синтеза оксида алюминия, алюминатов натрия — эти процессы были рассмотрены выше. Кроме того, его часто используют во время очистки воды от загрязнений. Также данное вещество широко применяется в изготовлении косметических средств.
Где применяются вещества, которые можно получить с его помощью?
Оксид алюминия, который может быть получен вследствие термического разложения гидроксида, используется при изготовлении керамики, применяется в качестве катализатора для проведения разнообразных химических реакций. Тетрагидроксоалюминат натрия находит свое использование в технологии окрашивания тканей.
Внешний вид вещества гидроксид алюминия следующий. Как правило, это вещество белого, студневидного вида, хотя встречаются варианты присутствия в кристаллическом или аморфном состоянии. Например, в высушенном виде оно кристаллизуется в белые кристаллы, которые не растворяются ни в кислотах, ни в щелочах.
Как правило, это вещество белого, студневидного вида, хотя встречаются варианты присутствия в кристаллическом или аморфном состоянии. Например, в высушенном виде оно кристаллизуется в белые кристаллы, которые не растворяются ни в кислотах, ни в щелочах.
Гидроокись алюминия может быть представлена и мелкокристаллическим порошком белого цвета. Допустимо присутствие розового и серого оттенков.
Химическая формула соединения — Al(OH)3. Соединение и воды образуют гидроксид которого также определяются во многом элементами, входящими в его состав. Получают это соединение посредством проведения реакции взаимодействия соли алюминия и разбавленной щелочи, при этом следует не допускать их переизбытка. Получаемый в ходе данной реакции осадок гидроксида алюминия затем может взаимодействовать с кислотами.
Гидроокись алюминия взаимодействует с водным раствором гидрооксида рубидия, сплавом этого вещества, гидроокисью цезия, карбонатом цезия. Во всех случаях выделяется вода.
Гидроокись алюминия обладает равной 78,00, практически не растворяется в воде. Плотность вещества составляет 3,97 грамм/см3. Будучи амфотерным веществом, гидроксид алюминия взаимодействует с кислотами, при этом, в результате реакций получаются средние соли и выделяется вода. При вступлении в реакции со щелочами появляются комплексные соли — гидроксоалюминаты, например, К. Метаалюминаты образуются, если гидроксид алюминия сплавлять с безводными щелочами.
Плотность вещества составляет 3,97 грамм/см3. Будучи амфотерным веществом, гидроксид алюминия взаимодействует с кислотами, при этом, в результате реакций получаются средние соли и выделяется вода. При вступлении в реакции со щелочами появляются комплексные соли — гидроксоалюминаты, например, К. Метаалюминаты образуются, если гидроксид алюминия сплавлять с безводными щелочами.
Как и все амфотерные вещества, кислотные и основные свойства одновременно гидроокись алюминия показывает при взаимодействии с а также со щелочами. В этих реакциях при растворении гидроксида в кислотах происходит отщепление ионов самого гидроксида, а при взаимодействии со щелочью — отщепляется ион водорода. Чтобы увидеть это, можно, например, провести реакцию, в которой участвуют гидроксид алюминия, Для ее проведения необходимо в пробирку засыпать немного опилок алюминия и залить небольшим количеством гидроксида натрия, не больше 3 миллилитров. Пробирку следует плотно закрыть пробкой, и начать медленный подогрев. После этого, закрепив пробирку на штативе, надо собрать выделенный водород в другую пробирку, предварительно надев ее на капиллярное приспособление. Примерно через минуту пробирку следует снять с капилляра и поднести к пламени. Если в пробирке собран чистый водород — горение будет происходить спокойно, в том же случае, если в нее попал воздух — произойдет хлопок.
После этого, закрепив пробирку на штативе, надо собрать выделенный водород в другую пробирку, предварительно надев ее на капиллярное приспособление. Примерно через минуту пробирку следует снять с капилляра и поднести к пламени. Если в пробирке собран чистый водород — горение будет происходить спокойно, в том же случае, если в нее попал воздух — произойдет хлопок.
Получают гидроксид алюминия в лабораториях несколькими способами:
Путем реакции взаимодействия солей алюминия и щелочных растворов;
Способом разложения нитрида алюминия под воздействием воды;
Путем пропускания углерода через специальный гидрокомплекс, содержащий Al(ОН)4;
Воздействием гидрата аммиака на соли алюминия.
Промышленное получение связано с переработкой бокситов. Используются также технологии воздействия на алюминатные растворы карбонатами.
Применяется гидроокись алюминия в изготовлении минеральных удобрений, криолита, различных медицинских и фармакологических препаратов. В химическом производстве вещество используют для получения фтористого и сернистого алюминия. Незаменимо соединение при производстве бумаги, пластмасс, красок и много другого.
Незаменимо соединение при производстве бумаги, пластмасс, красок и много другого.
Медицинское применение обусловлено позитивным действием препаратов, содержащих данный элемент в лечении желудочных расстройств, повышенной кислотности организма, язвенных заболеваний.
При обращении с веществом, следует остерегаться вдыхания его паров, так как они вызывают сильное поражение легких. Будучи слабодействующим слабительным, опасно в больших дозах. При коррозии вызывает алюминоз.
Само вещество достаточно безопасно, так как не вступает в реакции с окислителями.
2s 2p 3s 3p
Электронная конфигурация алюминия в возбужденном состоянии :
+13Al * 1s 2 2s 2 2p 6 3s 1 3p 2 1s 2s 2p 3s 3p
Алюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки , защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии .
Физические свойства
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.
Обладает высокой тепло- и электропроводностью.
Температура плавления 660 о С, температура кипения 1450 о С, плотность алюминия 2,7 г/см 3 .
Нахождение в природе
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Бокситы Al 2 O 3 · H 2 O (с примесями SiO 2 , Fe 2 O 3 , CaCO 3) — гидрат оксида алюминия
Корунд Al 2 O 3 . Красный корунд называют рубином, синий корунд называют сапфиром.
Способы получения
Алюминий образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970 о С) Na 3 AlF 6 , а затем подвергуют электролизу с углеродными электродами . При растворении в расплаве криолита оксид алюминия распадается на ионы:
При растворении в расплаве криолита оксид алюминия распадается на ионы:
Al 2 O 3 → Al 3+ + AlO 3 3-
На катоде происходит восстановление ионов алюминия :
К: Al 3+ +3e → Al 0
На аноде происходит окисление алюминат-ионов :
А: 4AlO 3 3- — 12e → 2Al 2 O 3 + 3O 2
Суммарное уравнение электролиза расплава оксида алюминия:
2Al 2 O 3 → 4Al + 3O 2
Лабораторный способ получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl 3 + 3K → 4Al + 3KCl
Качественные реакции
Качественная реакция на ионы алюминия — взаимодействие избытка солей алюминия с щелочами . При этом образуется белый аморфный осадок гидроксида алюминия .
Например , хлорид алюминия взаимодействует с гидроксидом натрия :
При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината :
Al(OH) 3 + NaOH = Na
Обратите внимание , если мы поместим соль алюминия в избыток раствора щелочи , то белый осадок гидроксида алюминия не образуется, т. к. в избытке щелочи соединения алюминия сразу переходят в комплекс :
к. в избытке щелочи соединения алюминия сразу переходят в комплекс :
AlCl 3 + 4NaOH = Na
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также выпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl 3 + 3 NH 3 · H 2 O = Al(OH) 3 ↓ + 3 NH 4 Cl
Al 3+ + 3 NH 3 · H 2 O = Al(OH) 3 ↓ + 3 NH 4 +
Видеоопыт взаимодействия раствора хлорида алюминия с раствором аммиака можно посмотреть
Химические свойства
1. Алюминий – сильный восстановитель . Поэтому он реагирует со многими неметаллами .
1.1. Алюминий реагируют с галогенами с образованием галогенидов :
1.2. Алюминий реагирует с серой с образованием сульфидов :
2Al + 3S → Al 2 S 3
1.3. Алюминий реагируют с фосфором . При этом образуются бинарные соединения — фосфиды :
При этом образуются бинарные соединения — фосфиды :
Al + P → AlP
Алюминий не реагирует с водородом .
1.4. С азотом алюминий реагирует при нагревании до 1000 о С с образованием нитрида :
2Al +N 2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия :
4Al + 3C → Al 4 C 3
1.6. Алюминий взаимодействует с кислородом с образованием оксида :
4Al + 3O 2 → 2Al 2 O 3
Видеоопыт взаимодействия алюминия с кислородом воздуха (горение алюминия на воздухе) можно посмотреть .
2. Алюминий взаимодействует со сложными веществами:
2.1. Реагирует ли алюминий с водой ? Ответ на этот вопрос вы без труда найдете, если покопаетесь немного в своей памяти. Наверняка хотя бы раз в жизни вы встречались с алюминиевыми кастрюлями или алюминиевыми столовыми приборами. Такой вопрос я любил задавать студентам на экзаменах. Что самое удивительное, ответы я получал разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
Такой вопрос я любил задавать студентам на экзаменах. Что самое удивительное, ответы я получал разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
Тем не менее, несложно понять, что алюминий все-таки с водой в обычных условиях (да и при нагревании) не взаимодействует . И мы уже упоминали, почему:из-за образования оксидной пленки . А вот если алюминий очистить от оксидной пленки (например, амальгамировать ), то он будет взаимодействовать с водой очень активно с образованием гидроксида алюминия и водорода :
2Al 0 + 6H 2 + O → 2Al +3 ( OH) 3 + 3H 2 0
Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути (II ):
Видеоопыт взаимодействия амальгамы алюминия с водой можно посмотреть .
2. 2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом . При этом образуются соль и водород.
2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом . При этом образуются соль и водород.
Например , алюминий бурно реагирует с соляной кислотой :
2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV) , сульфат алюминия и вода :
2Al + 6H 2 SO 4(конц.) → Al 2 (SO 4) 3 + 3SO 2 + 6H 2 O
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота :
10Al + 36HNO 3 (разб) → 3N 2 + 10Al(NO 3) 3 + 18H 2 O
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония :
8Al + 30HNO 3(оч. разб.) → 8Al(NO 3) 3 + 3NH 4 NO 3 + 9H 2 O
разб.) → 8Al(NO 3) 3 + 3NH 4 NO 3 + 9H 2 O
2.5. Алюминий – амфотерный металл, поэтому он взаимодействует с щелочами . При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород :
2Al + 2NaOH + 6H 2 O → 2Na + 3H 2
Видеоопыт взаимодействия алюминия со щелочью и водой можно посмотреть .
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода :
2Al + 6NaOH → 2Na 3 AlO 3 + 3H 2
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → NaAlO 2 + 3H 2 + Na 2 O
2.6. Алюминий восстанавливает менее активные металлы из оксидов . Процесс восстановления металлов из оксидов называется алюмотермия .
Например , алюминий вытесняет медь из оксида меди (II). Реакция очень экзотермическая:
Еще пример : алюминий восстанавливает железо из железной окалины , оксида железа (II, III) :
8Al + 3Fe 3 O 4 → 4Al 2 O 3 + 9Fe
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия , нитратами и нитритами в щелочной среде, перманганатами , соединениями хрома (VI):
2Al + 3Na 2 O 2 → 2NaAlO 2 + 2Na 2 O
8Al + 3KNO 3 + 5KOH + 18H 2 O → 8K + 3NH 3
10Al + 6KMnO 4 + 24H 2 SO 4 → 5Al 2 (SO 4) 3 + 6MnSO 4 + 3K 2 SO 4 + 24H 2 O
2Al + NaNO 2 + NaOH + 5H 2 O → 2Na + NH 3
Al + 3KMnO 4 + 4KOH → 3K 2 MnO 4 + K
4Al + K 2 Cr 2 O 7 → 2Cr + 2KAlO 2 + Al 2 O 3
Алюминий – ценный промышленный металл, который опдвергается вторичной переработке. Узнать подробнее о приеме алюминия на переработку, а также об актуальных ценах на данный вид металла можно
.
Узнать подробнее о приеме алюминия на переработку, а также об актуальных ценах на данный вид металла можно
.
Способы получения
Оксид алюминия можно получить различными методами :
1. Горением алюминия на воздухе:
4Al + 3O 2 → 2Al 2 O 3
2. Разложением гидроксида алюминия при нагревании :
3. Оксид алюминия можно получить разложением нитрата алюминия :
Химические свойстваОксид алюминия — типичный амфотерный оксид . Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодествии оксида алюминия с основными оксидами образуются соли-алюминаты .
Например , оксид алюминиявзаимодействует с оксидом натрия :
Na 2 O + Al 2 O 3 → 2NaAlO 2
2. Оксид алюминия взаимодействует При этом в расплаве образуются соли —алюминаты, а в растворе – комплексные соли . При этом оксид алюминия проявляет кислотные свойства .
При этом оксид алюминия проявляет кислотные свойства .
Например , оксид алюминиявзаимодействует с гидроксидом натрия в расплаве с образованием алюмината натрия и воды :
2NaOH + Al 2 O 3 → 2NaAlO 2 + H 2 O
Оксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината :
Al 2 O 3 + 2NaOH + 3H 2 O → 2Na
3. Оксид алюминия не взаимодействует с водой.
4. Оксид алюминия взаимодействуетс кислотными оксидами (сильных кислот). При этом образуются соли алюминия. При этом оксид алюминия проявляет основные свойства .
Например , оксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
Al 2 O 3 + 3SO 3 → Al 2 (SO 4) 3
5. Оксид алюминия взаимодействует с растворимыми кислотами с образованием средних и кислых солей .
Например серной кислотой :
Al 2 O 3 + 3H 2 SO 4 → Al 2 (SO 4) 3 + 3H 2 O
6. Оксид алюминия проявляет слабые окислительные свойства .
Оксид алюминия проявляет слабые окислительные свойства .
Например , оксид алюминия реагирует с гидридом кальция с образованием алюминия , водорода и оксида кальция :
Al 2 O 3 + 3CaH 2 → 3CaO + 2Al + 3H 2
Электрический ток восстанавливает алюминий из оксида (производство алюминия):
2Al 2 O 3 → 4Al + 3O 2
7. Оксид алюминия — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната натрия :
Al 2 O 3 + Na 2 CO 3 → 2NaAlO 2 + CO 2
Гидроксид алюминияСпособы получения
1. Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия .
Например , хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония :
AlCl 3 + 3NH 3 + 3H 2 O = Al(OH) 3 + 3NH 4 Cl
2. Пропусканием углекислого газа , сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Пропусканием углекислого газа , сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Na + СО 2 = Al(OH) 3 + NaНCO 3
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na на составные части: NaOH и Al(OH) 3 . Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH) 3 не реагирует с СО 2 , то мы записываем справа Al(OH) 3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия .
Например , хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия :
AlCl 3 + 3KOH (недост) = Al(OH) 3 ↓+ 3KCl
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами . Сульфиды, карбонаты и сульфиты алюминия в водном растворе.
Сульфиды, карбонаты и сульфиты алюминия в водном растворе.
Например: бромид алюминия реагирует с карбонатом натрия . При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
2AlBr 3 + 3Na 2 CO 3 + 3H 2 O = 2Al(OH) 3 ↓ + CO 2 + 6NaBr
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
2AlCl 3 + 3Na 2 S + 6H 2 O = 2Al(OH) 3 + 3H 2 S + 6NaCl
Химические свойства
1. Гидроксид алюминия реагирует с растворимыми кислотами . При этом образуются средние или кислые соли , в зависимости от соотношения реагентов и типа соли.
Например азотной кислотой с образованием нитрата алюминия :
Al(OH) 3 + 3HNO 3 → Al(NO 3) 3 + 3H 2 O
Al(OH) 3 + 3HCl → AlCl 3 + 3H 2 O
2Al(OH) 3 + 3H 2 SO 4 → Al 2 (SO 4) 3 + 6H 2 O
Al(OH) 3 + 3HBr → AlBr 3 + 3H 2 O
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот .
Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия :
2Al(OH) 3 + 3SO 3 → Al 2 (SO 4) 3 + 3H 2 O
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли —алюминаты, а в растворе – комплексные соли . При этом гидроксид алюминия проявляет кислотные свойства .
Например , гидроксид алюминиявзаимодействует с гидроксидом калия в расплаве с образованием алюмината калия и воды :
2KOH + Al(OH) 3 → 2KAlO 2 + 2H 2 O
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината :
Al(OH) 3 + KOH → K
4. Г идроксид алюминия разлагается при нагревании :
2Al(OH) 3 → Al 2 O 3 + 3H 2 O
Видеоопыт взаимодействия гидроксида алюминия с соляной кислотой и щелочами (амфотерные свойства гидроксида алюминия) можно посмотреть .
Нитрат и сульфат алюминия
Нитрат алюминия при нагревании разлагается на оксид алюминия , оксид азота (IV) и кислород :
4Al(NO 3) 3 → 2Al 2 O 3 + 12NO 2 + 3O 2
Сульфат алюминия при сильном нагревании разлагается аналогично — на оксид алюминия , сернистый газ и кислород :
2Al 2 (SO 4) 3 → 2Al 2 O 3 + 6SO 2 + 3O 2
Комплексные соли алюминия
Для описания свойств комплексных солей алюминия — гидроксоалюминатов , удобно использоваться следующий прием: мысленно разбейте тетрагидроксоалюминат на две отдельные молекулы — гидроксид алюминия и гидроксид щелочного металла.
Например , тетрагидроксоалюминат натрия разбиваем на гидроксид алюминия и гидроксид натрия:
Na разбиваем на NaOH и Al(OH) 3
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы алюминия реагируют с кислотными оксидами .
Например , гидроксокомплекс разрушается под действием избытка углекислого газа . При этом с СО 2 реагирует NaOH с образованием кислой соли (при избытке СО 2), а амфотерный гидроксид алюминия не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Na + CO 2 → Al(OH) 3 ↓ + NaHCO 3
Аналогично тетрагидроксоалюминат калия реагирует с углекислым газом:
K + CO 2 → Al(OH) 3 + KHCO 3
По такому же принципу тетрагидроксоалюминаты реагирует с сернистым газом SO 2:
Na + SO 2 → Al(OH) 3 ↓ + NaHSO 3
K + SO 2 → Al(OH) 3 + KHSO 3
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид алюминия реагирует с сильными кислотами.
Например , с соляной кислотой :
Na + 4HCl (избыток) → NaCl + AlCl 3 + 4H 2 O
Правда, под действием небольшого количества (недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида алюминия кислоты не будет хватать:
Na + НCl (недостаток) → Al(OH) 3 ↓ + NaCl + H 2 O
Аналогично с недостатком азотной кислоты выпадает гидроксид алюминия:
Na + HNO 3(недостаток) → Al(OH) 3 ↓ + NaNO 3 + H 2 O
Комлекс разрушается при взамодействии с хлорной водой (водным раствором хлора) Cl 2:
2Na + Cl 2 → 2Al(OH) 3 ↓ + NaCl + NaClO
При этом хлор диспропорционирует .
Также комплекс может прореагировать с избытком хлорида алюминия . При этом выпадает осадок гидроксида алюминия:
AlCl 3 + 3Na → 4Al(OH) 3 ↓ + 3NaCl
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-алюминат:
Na → NaAlO 2 + 2H 2 O
K → KAlO 2 + 2H 2 O
Гидролиз солей алюминия
Растворимые соли алюминия и сильных кислот гидролизуются по катиону . Гидролиз протекает ступенчато и обратимо , т.е. чуть-чуть:
I ступень: Al 3+ + H 2 O = AlOH 2+ + H +
II ступень: AlOH 2+ + H 2 O = Al(OH) 2 + + H +
III ступень: Al(OH) 2 + + H 2 O = Al(OH) 3 + H +
Однако сульфиды, сульфиты, карбонаты алюминия и их кислые соли гидролизуются необратимо , полностью , т.е. в водном растворе не существуют, а разлагаются водой :
Al 2 (SO 4) 3 + 6NaHSO 3 → 2Al(OH) 3 + 6SO 2 + 3Na 2 SO 4
2AlBr 3 + 3Na 2 CO 3 + 3H 2 O → 2Al(OH) 3 ↓ + CO 2 + 6NaBr
2Al(NO 3) 3 + 3Na 2 CO 3 + 3H 2 O → 2Al(OH) 3 ↓ + 6NaNO 3 + 3CO 2
2AlCl 3 + 3Na 2 CO 3 + 3H 2 O → 2Al(OH) 3 ↓ + 6NaCl + 3CO 2
Al 2 (SO 4) 3 + 3K 2 CO 3 + 3H 2 O → 2Al(OH) 3 ↓ + 3CO 2 + 3K 2 SO 4
2AlCl 3 + 3Na 2 S + 6H 2 O → 2Al(OH) 3 + 3H 2 S + 6NaCl
Алюминаты
Соли, в которых алюминий является кислотным остатком (алюминаты) — образуются из оксида алюминия при сплавлении с щелочами и основными оксидами:
Al 2 O 3 + Na 2 O → 2NaAlO 2
Для понимания свойств алюминатов их также очень удобно разбить на два отдельных вещества.
Например, алюминат натрия мы раделим мысленно на два вещества: оксид алюминия и оксид натрия.
NaAlO 2 разбиваем на Na 2 O и Al 2 O 3
Тогда нам станет очевидно, что алюминаты реагируют с кислотами с образованием солей алюминия :
KAlO 2 + 4HCl → KCl + AlCl 3 + 2H 2 O
NaAlO 2 + 4HCl → AlCl 3 + NaCl + 2H 2 O
NaAlO 2 + 4HNO 3 → Al(NO 3) 3 + NaNO 3 + 2H 2 O
2NaAlO 2 + 4H 2 SO 4 → Al 2 (SO 4) 3 + Na 2 SO 4 + 4H 2 O
Под действием избытка воды алюминаты переходят в комплесные соли:
KAlO 2 + H 2 O = K
NaAlO 2 + 2H 2 O = Na
Бинарные соединения
Сульфид алюминия под действием азотной кислоты окисляется до сульфата:
Al 2 S 3 + 8HNO 3 → Al 2 (SO 4) 3 + 8NO 2 + 4H 2 O
либо до серной кислоты (под действием горячей концентированной кислоты ):
Al 2 S 3 + 30HNO 3(конц. гор.) → 2Al(NO 3) 3 + 24NO 2 + 3H 2 SO 4 + 12H 2 O
Сульфид алюминия разлагается водой :
Al 2 S 3 + 6H 2 O → 2Al(OH) 3 ↓ + 3H 2 S
Карбид алюминия также разлагается водой при нагревании на гидроксид алюминия и метан :
Al 4 C 3 + 12H 2 O → 4Al(OH) 3 + 3CH 4
Нитрид алюминия разлагается под действием минеральных кислот на соли алюминия и аммония:
AlN + 4HCl → AlCl 3 + NH 4 Cl
Также нитрид алюминия разлагается под действием воды :
AlN + 3H 2 O → Al(OH) 3 ↓ + NH 3
Оксид
алюминия – Al2O3. Физические свойства: оксид
алюминия – белый аморфный порошок или
очень твердые белые кристаллы. Молекулярная
масса = 101,96, плотность – 3,97 г/см3,
температура плавления – 2053 °C, температура
кипения – 3000 °C.
Физические свойства: оксид
алюминия – белый аморфный порошок или
очень твердые белые кристаллы. Молекулярная
масса = 101,96, плотность – 3,97 г/см3,
температура плавления – 2053 °C, температура
кипения – 3000 °C.
Химические свойства: оксид алюминия проявляет амфотерные свойства – свойства кислотных оксидов и основных оксидов и реагирует и с кислотами, и с основаниями. Кристаллический Аl2О3 химически пассивен, аморфный – более активен. Взаимодействие с растворами кислот дает средние соли алюминия, а с растворами оснований – комплексные соли – гидроксоалюминаты металлов:
При сплавлении оксида алюминия с твердыми щелочами металлов образуются двойные соли – метаалюминаты (безводные алюминаты):
Оксид алюминия не взаимодействует с водой и не растворяется в ней.
Получение: оксид алюминия получают методом восстановления алюминием металлов из их оксидов: хрома, молибдена, вольфрама, ванадия и др. – металлотермия , открытый Бекетовым :
Применение: оксид
алюминия применяется для производства
алюминия, в виде порошка – для огнеупорных,
химически стойких и аб-разивных
материалов, в виде кристаллов – для
изготовления лазеров и синтетических
драгоценных камней (рубины, сапфиры и
др. ), окрашенных примесями оксидов других
металлов – Сr2О3 (красный цвет), Тi2О3 и
Fe2О3 (голубой цвет).
), окрашенных примесями оксидов других
металлов – Сr2О3 (красный цвет), Тi2О3 и
Fe2О3 (голубой цвет).
Гидроксид алюминия – А1(ОН)3 . Физические свойства: гидроксид алюминия – белый аморфный (гелеобразный) или кристаллический. Почти не растворим в воде; молекулярная масса – 78,00, плотность – 3,97 г/см3.
Химические свойства: типичный амфотерный гидроксид реагирует:
1) с кислотами, образуя средние соли: Al(ОН)3 + 3НNO3 = Al(NO3)3 + 3Н2О;
2) с растворами щелочей, образуя комплексные соли – гидроксоалюминаты: Al(ОН)3 + КОН + 2Н2О = К.
При сплавлении Al(ОН)3 с сухими щелочами образуются метаалюминаты: Al(ОН)3 + КОН = КAlO2 + 2Н2О.
Получение:
1) из солей алюминия под действием раствора щелочей: AlСl3 + 3NaOH = Al(ОН)3 + 3Н2О;
2) разложением нитрида алюминия водой: AlN + 3Н2О = Аl(ОН)3 + NН3?;
3) пропусканием СО2 через раствор гидроксокомплекса: [Аl(ОН)4]-+ СО2 = Аl(ОН)3 + НСО3-;
4)
действием на соли Аl гидратом аммиака;
при комнатной температуре образуется
Аl(ОН)3.
62. Общая характеристика подгруппы хрома
Элементы подгруппы
хрома занимают
промежуточное положение в ряду переходных
металлов. Имеют высокие температуры
плавления и кипения, свободные места
на электронных орбиталях. Элементы хром и молибден обладают
нетипичной электронной структурой –
на внешней s-орбитали имеют один электрон
(как у Nb из подгруппы VB). У этих элементов
на внешних d– и s-орбиталях находится 6
электронов, поэтому все орбитали
заполнены наполовину, т. е. на каждой
находится по одному электрону. Имея
подобную электронную конфигурацию,
элемент обладает особенной стабильностью
и устойчивостью к окислению. Вольфрам имеет
более сильную металлическая связь,
нежели молибден .
Степень окисления у элементов подгруппы
хрома сильно варьирует. В надлежащих
условиях все элементы проявляют
положительную степень окисления от 2
до 6, максимальная степень окисления
соответствует номеру группы. Не все
степени окисления у элементов стабильны,
у хрома самая стабильная – +3.
Все элементы образуют оксид MVIO3, известны также оксиды с низшими степенями окисления. Все элементы данной подгруппы амфотерны – образуют комплексные соединения и кислоты.
Хром, молибден и вольфрам востребованы в металлургии и электротехнике. Все рассматриваемые металлы покрываются пассивирующей оксидной пленкой при хранении на воздухе или в среде кислоты-окислителя. Удалив пленку химическим или механическим способом, можно повысить химическую активность металлов.
Хром. Элемент получают из хромитной руды Fe(CrO2)2, восстанавливая углем: Fe(CrO2)2 + 4C = (Fe + 2Cr) + 4CO?.
Чистый хром получают восстановлением Cr2O3 с помощью алюминия или электролиза раствора, содержащего ионы хрома. Выделяя хром с помощью электролиза, можно получить хромовое покрытие, используемое в качестве декоративных и защитных пленок.
Из хрома получают феррохром, применяемый при производстве стали.
Молибден. Получают
из сульфидной руды. Его соединения
используют при производстве стали. Сам
металл получают при восстановлении его
оксида. Прокаливая оксид молибдена с
железом, можно получить ферромолибден.
Используют для изготовления нитей и
трубок для обмотки печей и электроконтактов.
Сталь с добавлением молибдена используют
в автомобильном производстве.
Сам
металл получают при восстановлении его
оксида. Прокаливая оксид молибдена с
железом, можно получить ферромолибден.
Используют для изготовления нитей и
трубок для обмотки печей и электроконтактов.
Сталь с добавлением молибдена используют
в автомобильном производстве.
Вольфрам. Получают из оксида, добываемого из обогащенной руды. В качестве восстановителя используют алюминий или водород. Получившийся вольфрам в идее порошка впоследствии формуют при высоком давлении и термической обработке (порошковая металлургия). В таком виде вольфрам используют для изготовления нитей накаливания, добавляют к стали.
Опыты по химии. Алюминий | Подготовка к ЦТ и ЕГЭ по химии
Чтобы поделиться, нажимайте
Амфотерные свойства гидроксида алюминия
Получим гидроксид алюминия Al(OH)3, чтобы исследовать его свойства. Для этого раствор хлорида алюминия соединяем с раствором аммиака. Выпадает осадок гидроксида алюминия.
AlCl3 + 3 NH3 · H2O = Al(OH)3 ↓ + 3 NH4Cl
Al3+ + 3 NH3 · H2O = Al(OH)3 ↓ + 3 NH4+
Убедимся в том, что гидроксид алюминия ‑ амфотерное основание. В одну из пробирок добавим раствор щелочи. Осадок гидроксида растворяется.
В одну из пробирок добавим раствор щелочи. Осадок гидроксида растворяется.
Al(OH)3 + NaOH = Na[Al(OH)4]
Во вторую пробирку добавляем раствор соляной кислоты. Осадок гидроксида алюминия растворяется, как и в предыдущей пробирке.
Al(OH)3 +3HCl = AlCl3 + 3H2O
Гидроксиды, которые реагируют с растворами и кислот, и щелочей, называются амфотерными. Гидроксид алюминия – типичный амфотерный гидроксид»».
Оборудование: пробирки, штатив для пробирок, пипетка.
Техника безопасности.
Требуется соблюдение правил обращения со щелочами, кислотами и аммиаком. При попадании раствора щелочи на кожу, промыть водой и 2% раствором уксусной кислоты. При попадании раствора кислоты на кожу, промыть водой и 2% раствором питьевой соды.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Взаимодействие алюминия с водой
Алюминий — активный металл, но из-за прочной оксидной пленки на его поверхности не окисляется и не реагирует при обычных условиях с водой. Но если убрать с поверхности оксидную пленку, алюминий будет активно взаимодействовать с водой. Кусочки алюминия помещаем в раствор хлорида ртути (II) и выдерживаем 1-2 минуты.
3HgCI2 + 2Al = 2AICI3 + 3Hg
На поверхности алюминия образуется амальгама – сплав ртути с алюминием. Амальгама не удерживается на поверхности металла, обнажая его. Сливаем раствор соли ртути с амальгамированного алюминия и наливаем в стакан воду. Алюминий, лишившись защитной пленки, взаимодействует с водой, в процессе реакции образуются водород и гидроксид алюминия:
Сливаем раствор соли ртути с амальгамированного алюминия и наливаем в стакан воду. Алюминий, лишившись защитной пленки, взаимодействует с водой, в процессе реакции образуются водород и гидроксид алюминия:
2Al + 6H2O = 2Al(OH)3 + 3H2
Оборудование: стаканы химические, палочка стеклянная.
Техника безопасности. Соблюдать особую осторожность при работе с раствором хлорида ртути (II). Не допускать попадания раствора на кожу. Все остатки соединений ртути обезвредить.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Взаимодействие алюминия с кислородом воздуха
Если нарушить оксидную пленку, то алюминий быстро окисляется, покрываясь рыхлым слоем оксида.
4Al + 3O2 = 2Al2O3
Оксид ртути разрушает оксидную пленку на алюминии. Алюминиевую пластинку натрем порошком оксида ртути. Оксид ртути ядовитый порошок. Поэтому используем резиновые перчатки. Через некоторые время наблюдаем, как поверхность алюминия покрывается белым рыхлым налетом оксида.
Оборудование: алюминиевая пластинка, вата, перчатки резиновые.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами. Работать только в резиновых перчатках.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Взаимодействие алюминия со щелочью и водой
Алюминий ‑ активный металл, однако из-за прочной оксидной пленки его активность мало заметна. Алюминий не реагирует с водой, на поверхности металла – плотная пленка оксида. Пленку оксида можно удалить щелочью. Когда пленка растворяется, металл начинает бурно реагировать со щелочью, выделяется водород.
Алюминий не реагирует с водой, на поверхности металла – плотная пленка оксида. Пленку оксида можно удалить щелочью. Когда пленка растворяется, металл начинает бурно реагировать со щелочью, выделяется водород.
2Al + 2KOH + 6H2O = 2 K[Al(OH)4] + 3H2↑
Проверим, будет ли действовать вода на освобожденный от оксидной пленки алюминий. Удалим щелочь и промоем поверхность металла. Свободный от оксидной пленки алюминий реагирует с водой. Выделяется водород и образуется нерастворимый гидроксид алюминия.
2Al + 6H2O = 2 Al(OH)3 ↓ + 3H2↑
Мы увидели, что если нарушить плотную естественную оксидную пленку алюминия, он легко разрушается даже в воде. Поэтому алюминиевую посуду не рекомендуется чистить средствами, содержащими щелочь, так как при этом алюминиевые изделия быстро теряют привлекательность, а в посуде из алюминия быстро образуются дырки.
Оборудование: химические стаканы.
Техника безопасности. Требуется соблюдение правил обращения со щелочами и горючими газами. При попадании раствора щелочи на кожу, промыть водой и 2% раствором уксусной кислоты.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Горение алюминия на воздухе.
Алюминий — активный металл, но из-за очень прочной оксидной пленки на его поверхности не реагирует при обычных условиях с водой и не окисляется. Однако если алюминий перевести в раздробленное состояние — алюминиевую пыль, то он легко сгорает на воздухе. Поместим в пробирку немного алюминиевой пыли и закроем ее пробкой с двумя трубками, одна из которых доходит почти до дна, а другая заканчивается недалеко от пробки. По длинной трубке подадим в пробирку ток воздуха. Струю воздуха, выходящую из короткой трубки и содержащую частички алюминия, направим в пламя горелки. Попадая в пламя, алюминий сгорает яркими вспышками.
Струю воздуха, выходящую из короткой трубки и содержащую частички алюминия, направим в пламя горелки. Попадая в пламя, алюминий сгорает яркими вспышками.
4Al + 3O2 = 2Al2O3
Оборудование: штатив, пробирка с боковым отростком, газоотводная трубка, горелка, штапель.
Техника безопасности. Соблюдать правила пожарной безопасности и правила работы с нагревательными приборами. Не направлять пламя в сторону находящихся рядом людей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Демонстрация оксидной пленки алюминия
На поверхности алюминий покрыт тонкой и прочной пленкой оксида. Оксидная пленка предотвращает дальнейшее окисление алюминия. Для демонстрации оксидной пленки закрепим алюминиевую проволоку в лапке штатива. Нагреем алюминий. При температуре 660 °С алюминий плавится и кончик проволоки провисает. Но расплавленный металл не капает. «Мешочек» оксида удерживает расплавленный алюминий. Температура плавления оксида алюминия 2055 °С.
Оксидная пленка предотвращает дальнейшее окисление алюминия. Для демонстрации оксидной пленки закрепим алюминиевую проволоку в лапке штатива. Нагреем алюминий. При температуре 660 °С алюминий плавится и кончик проволоки провисает. Но расплавленный металл не капает. «Мешочек» оксида удерживает расплавленный алюминий. Температура плавления оксида алюминия 2055 °С.
Оборудование: штатив, горелка, пинцет или тигельные щипцы.
Техника безопасности. Соблюдать правила работы с нагревательными приборами. Во избежание попадания расплавленного алюминия на поверхность стола, на рабочую поверхность помещают теплоизолирующую прокладку.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Обнаружение ионов алюминия
Ионы алюминия можно обнаружить при помощи раствора аммиака. К раствору хлорида алюминия добавляем раствор аммиака. Выпадает полупрозрачный студенистый осадок гидроксида алюминия.
Выпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3 NH3 · H2O = Al(OH)3 ↓ + 3 NH4Cl
Al3+ + 3 NH3 · H2O = Al(OH)3 ↓ + 3 NH4+
Реакция с аммиаком ‑ качественная реакция на ион алюминия.
Оборудование: пробирка, штатив для пробирок, пипетка.
Техника безопасности.
Требуется соблюдение правил обращения с раствором аммиака. Не вдыхать газообразный аммиак.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Гидроксид алюминия. Химия алюминия Разложение гидроксида алюминия при нагревании уравнение реакции
Одним из наиболее широко используемых в промышленности веществ является гидроксид алюминия. В этой статье о нем и пойдет речь.
В этой статье о нем и пойдет речь.
Что такое гидроксид?
Это химическое соединение, которое образуется при взаимодействии оксида с водой. Существует три их разновидности: кислотные, основные и амфотерные. Первые и вторые разделяются на группы в зависимости от их химической активности, свойств и формулы.
Что такое амфотерные вещества?
Амфотерными могут быть оксиды и гидроксиды. Это такие вещества, для которых характерно проявлять как кислотные, так и основные свойства, в зависимости от условий реакции, используемых реагентов и т. д. К амфотерным оксидам относятся два вида оксида железа, оксид марганца, свинца, бериллия, цинка, а также алюминия. Последний, кстати, чаще всего получают из его гидроксида. К амфотерным же гидроксидам можно отнести гидроксид бериллия, железа, а также гидроксид алюминия, который мы сегодня и рассмотрим в нашей статье.
Физические свойства гидроксида алюминия
Данное химическое соединение представляет собой твердое белое вещество. Оно не растворяется в воде.
Оно не растворяется в воде.
Гидроксид алюминия — химические свойства
Как уже было сказано выше, это наиболее яркий представитель группы амфотерных гидроксидов. В зависимости от условий реакции, он может проявлять как основные, так и кислотные свойства. Данное вещество способно растворяться в кислотах, при этом образуется соль и вода.
К примеру, если смешать его с хлорной кислотой в равном количестве, то получим алюминий хлорид с водой также в одинаковых пропорциях. Также еще одно вещество, с которым реагирует гидроксид алюминия, — гидроксид натрия. Это типичный основной гидроксид. Если смешать в равных количествах рассматриваемое вещество и раствор гидроксида натрия, то получим соединение под названием тетрагидроксоалюминат натрия. В его химической структуре содержится атом натрия, атом алюминия, по четыре атома оксигена и гидрогена. Однако при сплавлении этих веществ реакция идет несколько по-другому, и образуется уже не это соединение. В результате данного процесса можно получить метаалюминат натрия (в его формулу входят по одному атому натрия и алюминия и два атома оксигена) с водой в равных пропорциях, при условии, если смешать одинаковое количество сухих гидроксидов натрия и алюминия и подействовать на них высокой температурой.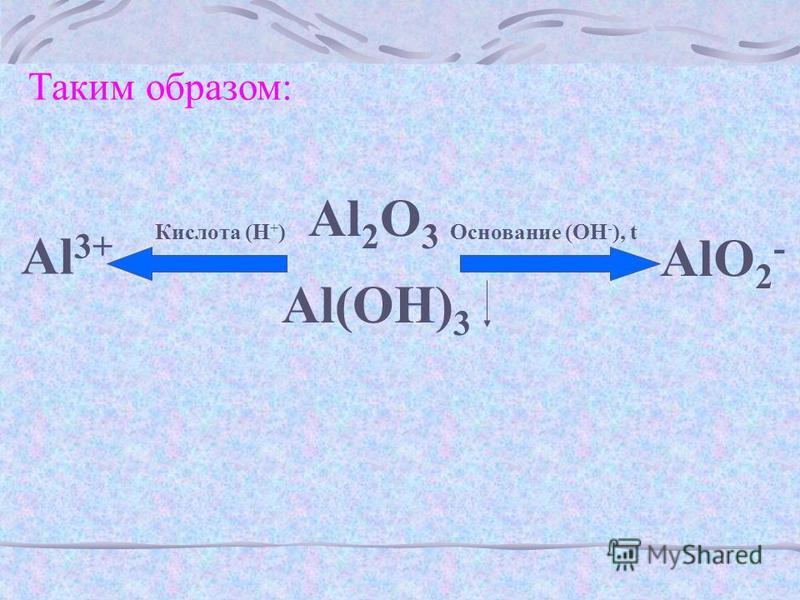 Если же смешать его с гидроксидом натрия в других пропорциях, можно получить гексагидроксоалюминат натрия, который содержит три атома натрия, один атом алюминия и по шесть оксигена и гидрогена. Для того чтобы образовалось данное вещество, нужно смешать рассматриваемое вещество и раствор гидроксида натрия в пропорциях 1:3 соответственно. По описанному выше принципу можно получить соединения под названием тетрагидроксоалюминат калия и гексагидроксоалюминат калия. Также рассматриваемое вещество подвержено разложению при воздействии на него очень высоких температур. Вследствие такого рода химической реакции образуется оксид алюминия, который также обладает амфотерностью, и вода. Если взять 200 г гидроксида и нагреть его, то получим 50 г оксида и 150 г воды. Кроме своеобразных химических свойств, данное вещество проявляет также и обычные для всех гидроксидов свойства. Оно вступает во взаимодействие с солями металлов, которые имеют более низкую химическую активность, нежели алюминий. Для примера можно рассмотреть реакцию между ним и хлоридом меди, для которой нужно взять их в соотношении 2:3.
Если же смешать его с гидроксидом натрия в других пропорциях, можно получить гексагидроксоалюминат натрия, который содержит три атома натрия, один атом алюминия и по шесть оксигена и гидрогена. Для того чтобы образовалось данное вещество, нужно смешать рассматриваемое вещество и раствор гидроксида натрия в пропорциях 1:3 соответственно. По описанному выше принципу можно получить соединения под названием тетрагидроксоалюминат калия и гексагидроксоалюминат калия. Также рассматриваемое вещество подвержено разложению при воздействии на него очень высоких температур. Вследствие такого рода химической реакции образуется оксид алюминия, который также обладает амфотерностью, и вода. Если взять 200 г гидроксида и нагреть его, то получим 50 г оксида и 150 г воды. Кроме своеобразных химических свойств, данное вещество проявляет также и обычные для всех гидроксидов свойства. Оно вступает во взаимодействие с солями металлов, которые имеют более низкую химическую активность, нежели алюминий. Для примера можно рассмотреть реакцию между ним и хлоридом меди, для которой нужно взять их в соотношении 2:3. При этом выделится водорастворимый хлорид алюминия и осадок в виде гидроксида купрума в пропорциях 2:3. Также рассматриваемое вещество реагирует и с оксидами подобных металлов, для примера можно взять соединение той же меди. Для проведения реакции потребуется гидроксид алюминия и оксид купрума в соотношении 2:3, в результате чего получим алюминий оксид и гидроксид меди. Свойствами, которые были описаны выше, также обладают и другие амфотерные гидроксиды, такие как гидроксид железа или бериллия.
При этом выделится водорастворимый хлорид алюминия и осадок в виде гидроксида купрума в пропорциях 2:3. Также рассматриваемое вещество реагирует и с оксидами подобных металлов, для примера можно взять соединение той же меди. Для проведения реакции потребуется гидроксид алюминия и оксид купрума в соотношении 2:3, в результате чего получим алюминий оксид и гидроксид меди. Свойствами, которые были описаны выше, также обладают и другие амфотерные гидроксиды, такие как гидроксид железа или бериллия.
Что такое гидроксид натрия?
Как видно выше, существует много вариантов химических реакций гидроксида алюминия с гидроксидом натрия. Что же это за вещество? Это типичный основной гидроксид, то есть химически активная, растворимая в воде основа. Он обладает всеми химическими свойствами, которые характерны для основных гидроксидов.
То есть он может растворяться в кислотах, к примеру, при смешивании натрий гидроксида с хлорной кислотой в равных количествах можно получить пищевую соль (хлорид натрия) и воду в пропорции 1:1. Также данный гидроксид вступает в реакции с солями металлов, которые обладают более низкой химической активностью, нежели натрий, и их оксидами. В первом случае происходит стандартная реакция обмена. При добавлении к нему, к примеру, хлорида серебра, образуется хлорид натрия и гидроксид серебра, который выпадает в осадок (реакция обмена осуществима только в случае, если одно из веществ, полученных в ее результате, будет осадком, газом либо водой). При добавлении к натрий гидроксиду, например, оксида цинка, получаем гидроксид последнего и воду. Однако намного более специфическими являются реакции данного гидроксида AlOH, которые были описаны выше.
Также данный гидроксид вступает в реакции с солями металлов, которые обладают более низкой химической активностью, нежели натрий, и их оксидами. В первом случае происходит стандартная реакция обмена. При добавлении к нему, к примеру, хлорида серебра, образуется хлорид натрия и гидроксид серебра, который выпадает в осадок (реакция обмена осуществима только в случае, если одно из веществ, полученных в ее результате, будет осадком, газом либо водой). При добавлении к натрий гидроксиду, например, оксида цинка, получаем гидроксид последнего и воду. Однако намного более специфическими являются реакции данного гидроксида AlOH, которые были описаны выше.
Получение AlOH
Когда мы уже рассмотрели основные его химические свойства, можно поговорить о том, как же его добывают. Основной способ получения данного вещества — проведение химической реакции между солью алюминия и натрий гидроксидом (может использоваться и калий гидроксид).
При такого рода реакции образуется сам AlOH, выпадающий в белый осадок, а также новая соль. Например, если взять алюминий хлорид и добавить к нему в три раза больше гидроксида калия, то полученными веществами будут рассматриваемое в статье химическое соединение и в три раза больше хлорида калия. Также существует метод получения AlOH, который предусматривает проведение химической реакции между раствором соли алюминия и карбонатом основного металла, для примера возьмем натрий. Для получения гидроксида алюминия, кухонной соли и углекислого газа в пропорциях 2:6:3 необходимо смешать хлорид алюминия, карбонат натрия (соду) и воду в соотношении 2:3:3.
Например, если взять алюминий хлорид и добавить к нему в три раза больше гидроксида калия, то полученными веществами будут рассматриваемое в статье химическое соединение и в три раза больше хлорида калия. Также существует метод получения AlOH, который предусматривает проведение химической реакции между раствором соли алюминия и карбонатом основного металла, для примера возьмем натрий. Для получения гидроксида алюминия, кухонной соли и углекислого газа в пропорциях 2:6:3 необходимо смешать хлорид алюминия, карбонат натрия (соду) и воду в соотношении 2:3:3.
Где используется алюминий гидроксид?
Гидроксид алюминия находит свое применение в медицине.
Благодаря его способности нейтрализовать кислоты, препараты с его содержанием рекомендуются при изжоге. Также его выписывают при язвах, острых и хронических воспалительных процессах кишечника. Кроме того, гидроксид алюминия используют в изготовлении эластомеров. Также он широко применяется в химической промышленности для синтеза оксида алюминия, алюминатов натрия — эти процессы были рассмотрены выше.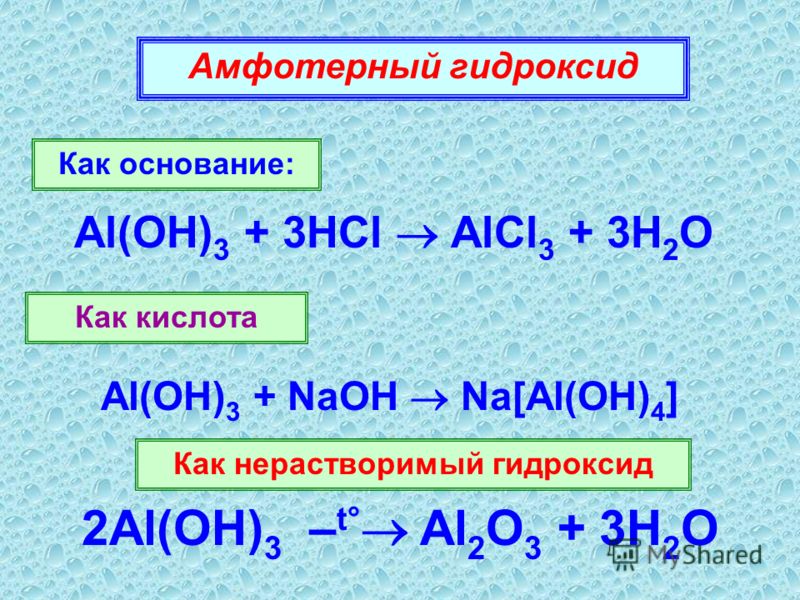 Кроме того, его часто используют во время очистки воды от загрязнений. Также данное вещество широко применяется в изготовлении косметических средств.
Кроме того, его часто используют во время очистки воды от загрязнений. Также данное вещество широко применяется в изготовлении косметических средств.
Где применяются вещества, которые можно получить с его помощью?
Оксид алюминия, который может быть получен вследствие термического разложения гидроксида, используется при изготовлении керамики, применяется в качестве катализатора для проведения разнообразных химических реакций. Тетрагидроксоалюминат натрия находит свое использование в технологии окрашивания тканей.
Неорганическое вещество, щелочь алюминия, формула Al(OH) 3 . Встречается в природе, входит в состав бокситов.
Свойства
Существует в четырех кристаллических модификациях и в виде коллоидного раствора, гелеобразного вещества. Реактив почти не водорастворим. Не горит, не взрывается, не ядовит.
В твердом виде — мелкокристаллический рыхлый порошок, белый или прозрачный, иногда с легким серым или розовым оттенком. Гелеобразный гидроксид тоже белый.
Химические свойства у твердой и гелеобразной модификации отличаются. Твердое вещество достаточно инертно, не вступает в реакции с кислотами, щелочами, другими элементами, но может образовывать метаалюминаты в результате сплавления с твердыми щелочами или карбонатами.
Гелеобразное вещество проявляет амфотерные свойства, то есть реагирует и с кислотами, и со щелочами. В реакции с кислотами образуются соли алюминия соответствующей кислоты, со щелочами — соли другого типа, алюминаты. Не вступает в реакции с раствором аммиака.
При нагревании гидроксид разлагается на оксид и воду.
Меры предосторожности
Реактив относится к четвертому классу опасности, считается пожаробезопасным и практически безопасным для человека и окружающей среды. Осторожность нужно проявлять только с аэрозольными частицами в воздухе: пыль оказывает раздражающее воздействие на органы дыхания, кожу, слизистые оболочки.
Поэтому на рабочих местах, где возможно образование большого количества пыли гидроксида алюминия, сотрудники должны использовать средства защиты для органов дыхания, глаз и кожи. Следует наладить контроль содержания в воздухе рабочей зоны вредных веществ по методике, утвержденной ГОСТом.
Следует наладить контроль содержания в воздухе рабочей зоны вредных веществ по методике, утвержденной ГОСТом.
Помещение должно быть оборудовано приточно-вытяжной вентиляцией, а при необходимости — местными аспирационными отсосами.
Хранят твердую гидроокись алюминия в многослойных бумажных мешках или другой таре для сыпучих продуктов.
Применение
В промышленности реактив используется для получения чистого алюминия и производных алюминия, например, оксида алюминия, сернокислого и фтористого алюминия .
— Оксид алюминия, получаемый из гидроксида, применяется для получения искусственных рубинов для нужд лазерной техники, корундов — для сушки воздуха, очистки минеральных масел, для производства наждака.
— В медицине используется как обволакивающее средство и антацид длительного действия для нормализации кислотно-щелочного баланса ЖКТ человека, для лечения язвенной болезни желудка и двенадцатиперстной кишки, гастро-эзофагеального рефлюкса и некоторых других заболеваний.
— В фармакологии входит в состав вакцин для усиления иммунной реакции организма на воздействие введенной инфекции.
— В водоочистке — как адсорбент, помогающий удалять из воды различные загрязнения. Гидроксид активно вступает в реакции с веществами, которые нужно удалить, образуя нерастворимые соединения.
— В химпроме используется как экологичный антипирен для полимеров, силиконов, каучуков, лакокрасочных материалов — чтобы ухудшить их горючесть, способность к возгоранию, подавить выделение дыма и токсичных газов.
— В производстве зубной пасты, минеральных удобрений, бумаги, красителей, криолита.
Гидроксид алюминия, характеристика, свойства и получение, химические реакции.
Гидроксид алюминия – неорганическое вещество, имеет химическую формулу Al(OH) 3 .
Краткая характеристика гидроксида алюминия:
Гидроксид алюминия – неорганическое вещество белого цвета.
Химическая формула гидроксида алюминия Al(OH) 3 .
Плохо растворяется в воде.
Обладает способностью адсорбировать различные вещества.
Модификации гидроксида алюминия:
Известны 4 кристаллические модификации гидроксида алюминия : гиббсит, байерит, дойлеит и нордстрандит.
Гиббсит обозначается γ-формой гидроксида алюминия, а байерит – α-формой гидроксида алюминия .
Гиббсит является наиболее химически стабильной формой гидроксида алюминия .
Физические свойства гидроксида алюминия:
| Наименование параметра: | Значение: |
| Химическая формула | Al(OH) 3 |
| Синонимы и названия иностранном языке для гидроксида алюминия α-формы | potassium hydroxide (англ.) aluminum hydroxide α-form (англ.) байерит (рус.) |
| Синонимы и названия иностранном языке для гидроксида алюминия γ-формы | potassium hydroxide (англ.) aluminium hydroxide (англ.) aluminum hydroxide (англ.) hydrargillite (англ. гиббсит (рус.) гидраргиллит (рус.) |
| Тип вещества | неорганическое |
| Внешний вид гидроксида алюминия α-формы | бесцветные моноклинные кристаллы |
| Внешний вид гидроксида алюминия γ-формы | белый моноклинные кристаллы |
| Цвет | белый, бесцветный |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность гидроксида алюминия γ-формы (состояние вещества – твердое вещество, при 20 °C), кг/м 3 | 2420 |
| Плотность гидроксида алюминия γ-формы (состояние вещества – твердое вещество, при 20 °C), г/см 3 | 2,42 |
| Температура разложения гидроксида алюминия α-формы, °C | 150 |
| Температура разложения гидроксида алюминия γ-формы, °C | 180 |
| Молярная масса, г/моль | 78,004 |
* Примечание:
— нет данных.
Получение гидроксида алюминия:
Гидроксид алюминия получают в результате следующих химических реакций:
- 1. в результате взаимодействия хлорида алюминия и гидроксида натрия :
AlCl 3 + 3NaOH → Al(OH) 3 + 3NaCl.
Гидроксид алюминия получают также при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка.
- 2. в результате взаимодействия хлорида алюминия, карбоната натрия и воды :
2AlCl 3 + 3Na 2 CO 3 + 3H 2 O → 2Al(OH) 3 + 3CO 2 + 6NaCl.
При этом гидроксид алюминия выпадает в виде белого студенистого осадка.
Гидроксид алюминия получают также при взаимодействии водорастворимых солей алюминия с карбонатами щелочных металлов.
Химические свойства гидроксида алюминия. Химические реакции гидроксида алюминия:
Гидроксид алюминия обладает амфотерными свойствами, т. е. обладает как основными, так и кислотными свойствами.
Химические свойства гидроксида алюминия аналогичны свойствам гидроксидов других амфотерных металлов. Поэтому для него характерны следующие химические
реакции:
Поэтому для него характерны следующие химические
реакции:
1. реакция гидроксида алюминия с гидроксидом натрия:
Al(OH) 3 + NaOH → NaAlO 2 + 2H 2 O (t = 1000 °C),
Al(OH) 3 + 3NaOH → Na 3 ,
Al(OH) 3 + NaOH → Na.
В результате реакции образуются в первом случае – алюминат натрия и вода, во втором – гексагидроксоалюминат натрия, в третьем – тетрагидроксоалюминат натрия. В третьем случае в качестве гидроксида натрия
2. реакция гидроксида алюминия с гидроксидом калия:
Al(OH) 3 + KOH → KAlO 2 + 2H 2 O (t = 1000 °C),
Al(OH) 3 + KOH → K.
В результате реакции образуются в первом случае – алюминат калия и вода, во втором – тетрагидроксоалюминат калия. Во втором случае в качестве гидроксида калия используется концентрированный раствор.
3. реакция гидроксида алюминия с азотной кислотой:
Al(OH) 3 + 3HNO 3 → Al(NO 3) 3 + 3H 2 O.
В результате реакции образуются нитрат алюминия и вода .
Аналогично проходят реакции гидроксида алюминия и с другими кислотами.
4. реакция гидроксида алюминия с фтороводородом:
Al(OH) 3 + 3HF → AlF 3 + 3H 2 O,
6HF + Al(OH) 3 → H 3 + 3H 2 O.
В результате реакции образуются в первом случае – фторид алюминия и вода, во втором – гексафтороалюминат водорода и вода. При этом фтороводород в первом случае в качестве исходного вещества используется в виде раствора.
5. реакция гидроксида алюминия с бромоводородом:
Al(OH) 3 + 3HBr → AlBr 3 + 3H 2 O.
В результате реакции образуются бромид алюминия и вода .
6. реакция гидроксида алюминия с йодоводородом:
Al(OH) 3 + 3HI → AlI 3 + 3H 2 O.
В результате реакции образуются йодид алюминия и вода .
7. реакция термического разложения гидроксида алюминия:
Al(OH) 3 → AlO(OH) + H 2 O (t = 200 °C),
2Al(OH) 3 → Al 2 O 3 + 3H 2 O (t = 575 °C).
В результате реакции образуются в первом случае – метагидроксид алюминия и вода, во втором – оксид алюминия
и вода.
8. реакция гидроксида алюминия и карбоната натрия:
2Al(OH) 3 + Na 2 CO 3 → 2NaAlO 2 + CO 2 + 3H 2 O.
В результате реакции образуются алюминат натрия, оксид углерода (IV) и вода.
10. реакция гидроксида алюминия и гидроксида кальция:
Ca(OH) 2 + 2Al(OH) 3 → Ca 2 .
В результате реакции образуется тетрагидроксоалюмината кальция .
Применение и использование гидроксида алюминия:
Гидроксид алюминия используется при очистке воды (как адсорбирующее вещество), в медицине, в качестве наполнителя в зубной пасте (как абразивное вещество), пластиках и пластмассах (как антипирен).
Примечание: © Фото //www.pexels.com, //pixabay.com
Алюминий — элемент 13-й (III)группы периодической таблицы химических элементов с атомным номером 13. Обозначается символом Al. Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Оксид алюминия Al2O3 — в природе распространён как глинозём, белый тугоплавкий порошок, по твердости близок к алмазу.
Оксид алюминия – природное соединение, может быть получен из бокситов или при термическом разложении гидроксидов алюминия:
2Al(OH)3 = Al2O3 + 3h3O;
Al2O3 — амфотерный оксид, химически инертен, благодаря своей прочной кристаллической решетке. Он не растворяется в воде, не взаимодействует с растворами кислот и щелочей и может реагировать лишь с расплавленной щелочью.
Около 1000°С интенсивно взаимодействует со щелочами и карбонатами щелочных металлов с образованием алюминатов:
Al2O3 + 2KOH = 2KAlO2 + h3O; Al2O3 + Na2CO3 = 2NaAlO2 + CO2.
Другие формы Al2O3 более активны, могут реагировать с растворами кислот и щелочей, α-Al2O3 взаимодействует лишь с горячими концентрированными растворами:Al2O3 + 6HCl = 2AlCl3 + 3h3O;
Амфотерные свойства оксида алюминия проявляются при взаимодействии с кислотными и основными оксидами с образованием солей:
Al2O3 + 3SO3 = Al2(SO4)3 (основные свойства),Al2O3 + Na2O = 2NaAlO2 (кислотные свойства).
Гидрокси́д алюми́ния, Al(OH)3 — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами. Получают при взаимодействии солей алюминия с водными растворами щёлочи: AlCl3+3NaOH=Al(OH)3+3NaCl
Гидроксид алюминия – типичное амфотерное соединение, свежеполученный гидроксид растворяется в кислотах и щелочах:
2Al(OH)3 + 6HCl = 2AlCl3 + 6h3O. Al(OH)3 + NaOH + 2h3O = Na.
При нагревании разлагается, процесс дегидратации довольно сложен и схематично может быть представлен следующим образом:
Al(OH)3 = AlOOH + h3O. 2AlOOH = Al2O3 + h3O.
Алюминаты — соли, образующиеся при действии щёлочи на свежеосаждённый гидроксид алюминия:Al(ОН)3 + NaOH = Na (тетрагидроксоалюминат натрия)
Алюминаты получают также при растворении металлического алюминия (или Al2O3) в щелочах:2Al + 2NaOH + 6Н2О = 2Na + ЗН2
Гидроксоалюминаты образуются при взаимодействии Al(OH)3 с избытком щелочи: Al(OH)3 + NaOH (изб) = Na
Соли алюминия. Из гидроксида алюминия можно получить практически все соли алюминия. Почти все соли алюминия хорошо растворимы в воде; плохо растворяется в воде фосфат алюминия.
Из гидроксида алюминия можно получить практически все соли алюминия. Почти все соли алюминия хорошо растворимы в воде; плохо растворяется в воде фосфат алюминия.
В растворе соли алюминия показывают кислую реакцию. Примером может служить обратимое воздействие с водой хлорида алюминия:
AlCl3+3Н2O«Аl(ОН)3+3НСl
Практическое значение имеют многие соли алюминия. Так, например, безводный хлорид алюминия АlСl3 используется в химической практике в качестве катализатора при переработке нефти
Сульфат алюминия Al2(SO4)3 18Н2O применяется как коагулянт при очистке водопроводной воды, а также в производстве бумаги.
Широко используются двойные соли алюминия — квасцы KAl(SO4)2 12h3O, NaAl(SO4)2 12h3O, Nh5Al(SO4)2 12h3O и др. — обладают сильными вяжущими свойствами и применяются при дублении кожи, а также в медицинской практике как кровоостанавливающее средство.
Применение — Благодаря комплексу свойств широко распространён в тепловом оборудовании.- Алюминий и его сплавы сохраняют прочность при сверхнизких температурах. Благодаря этому он широко используется в криогенной технике.- алюминий — идеальный материал для изготовления зеркал.- В производстве строительных материалов как газообразующий агент.- Алитированием придают коррозионную и окалиностойкость стальным и другим сплавам, — Сульфид алюминия используется для производства сероводорода.- Идут исследования по разработке пенистого алюминия как особо прочного и лёгкого материала.
Благодаря этому он широко используется в криогенной технике.- алюминий — идеальный материал для изготовления зеркал.- В производстве строительных материалов как газообразующий агент.- Алитированием придают коррозионную и окалиностойкость стальным и другим сплавам, — Сульфид алюминия используется для производства сероводорода.- Идут исследования по разработке пенистого алюминия как особо прочного и лёгкого материала.
В качестве восстановителя — Как компонент термита, смесей для алюмотермии- В пиротехнике.- Алюминий применяют для восстановления редких металлов из их оксидов или галогенидов. (Алюминотермия)
Алюминотермия. — способ получения металлов, неметаллов (а также сплавов) восстановлением их оксидов металлическим алюминием.
Реакции алюминия
Химические свойства алюминия
Химические свойства алюминия определяются его положением в периодической системе химических элементов.
Ниже представлены основные химические реакции алюминия с другими химическими элементами. Эти реакции определяют основные химические свойства алюминия.
Эти реакции определяют основные химические свойства алюминия.
С чем реагирует алюминий
Простые вещества:
- галогены (фтор, хлор, бром и иодин)
- сера
- фосфор
- азот
- углерод
- кислород (горение)
Сложные вещества:
- вода
- минеральные кислоты (соляная, фосфорная)
- серная кислота
- азотная кислота
- щелочи
- окислители
- оксиды менее активных металлов (алюмотермия)
С чем не реагирует алюминий
Алюминий не реагирует:
- с водородом
- в обычных условиях – с концентрированной серной кислотой (из-за пассивации – образования плотной оксидной пленки)
- в обычных условиях – с концентрированной азотной кислотой (также из-за пассивации)
См. подробнее по химии алюминия
Алюминий и воздух
Обычно поверхность алюминия всегда покрыта тонким слоем оксида алюминия, который защищает ее от воздействия воздуха, точнее, кислорода. Поэтому считается, что алюминий не вступает в реакцию с воздухом. Если же этот оксидный слой повреждается или удаляется, то свежая поверхность алюминия реагирует с кислородом воздуха. Алюминий может гореть в кислороде ослепительно белым пламенем с образованием оксида алюминия Al2O3.
Поэтому считается, что алюминий не вступает в реакцию с воздухом. Если же этот оксидный слой повреждается или удаляется, то свежая поверхность алюминия реагирует с кислородом воздуха. Алюминий может гореть в кислороде ослепительно белым пламенем с образованием оксида алюминия Al2O3.
Реакция алюминия с кислородом:
- 4Al + 3O2 —> 2Al2O3
Алюминий и вода
Алюминий реагирует с водой по следующим реакциям [2]:
- 2Al + 6H2O = 2Al(OH)3 + 3H2 (1)
- 2Al + 4H2O = 2AlO(OH) + 3H2 (2)
- 2Al + 3H2O = Al2O3 + 3H2 (3)
В результате этих реакций образуются, соответственно, следующие соединения алюминия:
- модификация гидроксида алюминия байерит и водород (1)
- модификация гидроксида алюминия богемит и водород (2)
- оксид алюминия и водород (3)
Эти реакции, кстати, представляют большой интерес при разработке компактных установок для получения водорода для транспортных средств, которые работают на водороде [2].
Все эти реакции являются термодинамически возможными при температуре от комнатной до температуры плавления алюминия 660 ºС. Все они являются также экзотермическими, то есть происходят с выделением тепла [2]:
- При температуре от комнатной до 280 ºС наиболее устойчивым продуктом реакции является Al(OH)3.
- При температуре от 280 до 480 ºС наиболее устойчивым продуктом реакции является AlO(OH).
- При температуре выше 480 ºС наиболее устойчивым продуктом реакции является Al2O3.
Таким образом, оксид алюминия Al2O3 становится термодинамически более устойчивым, чем Al(OH)3 при повышенной температуре. Продуктом реакции алюминия с водой при комнатной температуре будет гидроксид алюминия Al(OH)3.
Реакция (1) показывает, что алюминий должен самопроизвольно реагировать с водой при комнатной температуре. Однако на практике кусок алюминия, опущенный в воду, не реагирует с водой в условиях комнатной температуры и даже в кипящей воде. Дело в том, что алюминий имеет на поверхности тонкий когерентный слой оксида алюминия Al2O3. Эта оксидная пленка прочно удерживается на поверхности алюминия и предотвращает его реакцию с водой. Поэтому, чтобы начать и поддерживать реакцию алюминия с водой при комнатной температуре необходимо постоянно удалять или разрушать этот оксидный слой [2].
Дело в том, что алюминий имеет на поверхности тонкий когерентный слой оксида алюминия Al2O3. Эта оксидная пленка прочно удерживается на поверхности алюминия и предотвращает его реакцию с водой. Поэтому, чтобы начать и поддерживать реакцию алюминия с водой при комнатной температуре необходимо постоянно удалять или разрушать этот оксидный слой [2].
Алюминий и галогены
Алюминий бурно реагирует со всем галогенами – это:
- фтор F
- хлор Cl
- бром Br и
- иодин (йод) I,
с образованием соответственно:
- фторида AlF3
- хлорида AlCl3
- бромида Al2Br6 и
- иодида Al2Br6.
Реакции водорода со фтором, хлором, бромом и иодином:
- 2Al + 3F2 → 2AlF3
- 2Al + 3Cl2 → 2AlCl3
- 2Al + 3Br2 → Al2Br6
- 2Al + 3l2 → Al2I6
Алюминий и кислоты
Алюминий активно вступает в реакцию с разбавленными кислотами: серной, соляной и азотной, с образованием соответствующих солей: сернокислого алюминия Al2SO4, хлорида алюминия AlCl3 и нитрата алюминия Al(NО3)3.
Реакции алюминия с разбавленными кислотами:
- 2Al + 3H2SO4 —> Al2(SO4)3 + 3H2
- 2Al + 6HCl —> 2AlCl3 + 3H2
- 2Al + 6HNO3 —> 2Al(NO3)3 + 3H2
С концентрированными серной и соляной кислотами при комнатной температуре не взаимодействует, при нагревании реагирует с образованием соли, окислов и воды.
Алюминий и щелочи
Алюминий в водном растворе щелочи – гидроксида натрия – реагирует с образованием алюмината натрия.
Реакция алюминия с гидроксидом натрия имеет вид:
- 2Al + 2NaOH + 10H2O —> 2Na[Al(H2O)2(OH)4] + 3H2
Все важнейшие реакции с алюминием
Для полноты информации приводим перечень основных реакций с участием алюминия из фундаментальной книги про алюминий [3]:
Важнейшие реакции с участием алюминия [3]
Источники:
1. Chemical Elements. The first 118 elements, ordered alphabetically / ed. Wikipedians – 2018
Chemical Elements. The first 118 elements, ordered alphabetically / ed. Wikipedians – 2018
2. Reaction of Aluminum with Water to Produce Hydrogen /John Petrovic and George Thomas, U.S. Department of Energy, 2008
3. Тринадцатый элемент: Энциклопедия / А. Дроздов – Библиотека РУСАЛа, 2007.
Гидроксид алюминия реагирует с серной кислотой с образованием химического вещества класса 11 CBSE
Ответ
Проверено
147,3 тыс.+ просмотров
Подсказка: Имейте в виду, что гидроксид алюминия представляет собой соединение, которое является основным по своей природе и содержит алюминий. С другой стороны, природа серной кислоты довольно коррозионная и имеет высококислотный состав. Он действует как окислитель и дегидратирующий агент при более высоких концентрациях. Таким образом, в этом случае одно соединение является кислотой, а другое — основным соединением.
Полный ответ:
Сначала разберемся, какие реагенты и продукты образуются в уравнении, затем приступим к составлению его сбалансированного уравнения.
Даны реагенты этой реакции:
Гидроксид алюминия, Серная кислота
Нам также даны продукты:
Сульфат алюминия, Вода
В реакции участвуют реагенты, один из которых является кислым (Серная кислота), а другой является основным ( Гидроксид алюминия), в результате чего образовались продукты – соль (сульфат алюминия) и вода.
Такую реакцию можно назвать реакцией нейтрализации из-за участия кислоты и основания.
Данную реакцию можно записать в терминах их химических формул:
$ Al{(OH)_3}{\;_{(водн.)}} + {H_2}S{O_4}{\;_{(водн.)} } \to A{l_2}{(S{O_4})_3}{\;_{(водн.)}} + {H_2}O{\;_{(l)}} $
Здесь соединения:
$ Al{(OH)_3} $ — Гидроксид алюминия
$ {H_2}S{O_4} $ — Серная кислота
$ A{l_2}{(S{O_4})_3} $ — Сульфат алюминия
$ {H_2}O $ — Вода
В реакции мы видим, что образовались продукты:
— Алюминий занял место водорода в серной кислоте с образованием сульфата алюминия.
— Водород из серной кислоты в сочетании с гидроксидом, присутствующим в гидроксиде алюминия, с образованием воды.
Таким образом, в приведенной выше реакции произошли два замещения с образованием продуктов, следовательно, это реакция двойного замещения.
Теперь, чтобы сбалансировать это уравнение, мы должны убедиться, что число атомов каждого элемента одинаково на стороне реагента и на стороне продукта.
Мы уравновесим атомы водорода и кислорода только в конце, так как они будут продолжать меняться.
Итак, сначала мы попытаемся сбалансировать металлический алюминий: $ Al $
Со стороны продукта есть два атома алюминия, поэтому мы можем также поместить два атома алюминия со стороны реагента:
$ 2Al{(OH)_3} {\;_{(водн.)}} + {H_2}S{O_4}{\;_{(водн.)}} \to A{l_2}{(S{O_4})_3}{\;_{(водн. )}} + {H_2}O{\;_{(l)}} $
Теперь мы можем попытаться сбалансировать элемент серы: $ S $
На стороне продукта три атома серы, поэтому мы можем поместить три атома серы на стороне реагента также:
$ 2Al{(OH)_3}{\;_{(водн.)}} + 3{H_2}S{O_4}{\;_{(водн.)}} \to A{l_2}{(S{O_4} )_3}{\;_{(aq)}} + {H_2}O{\;_{(l)}} $
Теперь мы видим, что на стороне реагента двенадцать атомов водорода и восемнадцать атомов кислорода. Одновременно со стороны продукта имеем два атома водорода и тринадцать атомов кислорода.
Одновременно со стороны продукта имеем два атома водорода и тринадцать атомов кислорода.
Сначала попробуем сбалансировать водород, так как он проще: } \to A{l_2}{(S{O_4})_3}{\;_{(aq)}} + 6{H_2}O{\;_{(l)}} $
Теперь, когда мы сбалансировали водород , мы можем перейти к балансировке кислорода.
На стороне реагента восемнадцать атомов кислорода, а теперь на стороне продукта восемнадцать атомов. Таким образом, мы видим, что кислород также сбалансирован в уравнении.
Таким образом, окончательное сбалансированное химическое уравнение для данной реакции имеет вид: } \to A{l_2}{(S{O_4})_3}{\;_{(водн.)}} + 6{H_2}O{\;_{(l)}} $ .
Примечание:
В данном сценарии мы обсуждали реакции двойного смещения, так что теперь мы рассмотрим реакции одинарного смещения. Когда любой элемент из первого соединения замещает другой элемент из второго соединения, происходит одна реакция замещения. Металл может заменить только другой металл, точно так же неметалл может заменить только другой неметалл.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим радиусом атомов Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из нижеперечисленного имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды A Химический класс кальция 12 JEE_Main
Тенденции сомнений
Гидроксид алюминия | Сульфат алюминия
Гидроксид алюминия, состав которого представляет собой Al(OH)3, встречается в природе в следующих формах: гиббсит, являющийся минералом, и дойлеит, нордстрандит и байерит, все из которых являются редкими полиморфными формами. Основываясь на его свойствах, мы можем сказать, что гидроксид алюминия является антацидом. Он имеет различные применения, основным из которых является медицинское применение.
Основываясь на его свойствах, мы можем сказать, что гидроксид алюминия является антацидом. Он имеет различные применения, основным из которых является медицинское применение.
Химические свойства
Существует множество различных форм оксида алюминия, включая как кристаллические, так и некристаллические формы. Это электрический изолятор, что означает, что он не проводит электричество, а также имеет относительно высокую теплопроводность. Кроме того, твердость корунда в его кристаллической форме делает его пригодным в качестве абразива. Высокая температура плавления оксида алюминия делает его хорошим огнеупорным материалом для футеровки высокотемпературных приборов, таких как печи, топки, мусоросжигательные заводы, реакторы различного типа и тигли. Химическая формула гидроксида алюминия: Al(OH)₃.
Свойства гидроксида алюминия
Очищенный гидроксид алюминия представляет собой объемистый порошок белого цвета или гранулы с плотностью около 2,42 г/мл. Гидроксид алюминия не растворяется в воде, а растворяется только в основаниях и кислотах. Вы можете ожидать, что гидроксид алюминия будет действовать как амфотерное вещество в воде. Если присутствует сильное основание, гидроксид алюминия будет действовать как кислота. А если присутствует сильная кислота, то она будет действовать как сильное основание.
Гидроксид алюминия не растворяется в воде, а растворяется только в основаниях и кислотах. Вы можете ожидать, что гидроксид алюминия будет действовать как амфотерное вещество в воде. Если присутствует сильное основание, гидроксид алюминия будет действовать как кислота. А если присутствует сильная кислота, то она будет действовать как сильное основание.
С гидроксидом алюминия следует обращаться с осторожностью, так как его воздействие может вызвать раздражение. Однако будут присутствовать только незначительные и остаточные повреждения. Что касается воспламеняемости, гидроксид алюминия не воспламеняется и не горит. Кроме того, гидроксид алюминия не реакционноспособен, поэтому устойчив как в условиях огня, так и в воде.
Применение гидроксида алюминия
Гидроксид алюминия имеет множество применений; некоторые люди считают, что это использование действительно бесконечно. Просто чтобы проиллюстрировать широту применения, мы можем сказать, что гидроксид алюминия используется в качестве протравы в красителях, очистителя воды, ингредиента для косметики и даже в качестве элемента для процессов в фотографии. Есть также приложения второстепенного характера в керамике и строительстве. Но наиболее важной областью применения гидроксида алюминия является медицина.
Есть также приложения второстепенного характера в керамике и строительстве. Но наиболее важной областью применения гидроксида алюминия является медицина.
Применение в медицине
Учитывая, что гидроксид алюминия способен нейтрализовать кислоты, он служит природным антацидом. Гидроксид алюминия также обладает очень полезным свойством, так как стимулирует иммунную систему человека. Кроме того, с использованием гидроксида алюминия готовят различные вакцины, в том числе те, которые используются для лечения гепатита В, гепатита А и столбняка. Он также может быть использован для лечения пациентов с почками, у которых высокий уровень фосфатов в крови из-за почечной недостаточности. Это полезное свойство существует благодаря способности гидроксида алюминия связываться с фосфатами. После связывания с гидроксидом алюминия фосфаты легко вымываются из организма человека.
Применение в косметике
Существуют различные применения гидроксида алюминия в области косметики. Гидроксид алюминия чаще всего используется для производства губной помады, декоративной косметики и других средств по уходу за кожей. Там он используется потому, что абсолютно стабилен и не токсичен для человека. Иногда производители косметики на основе гидроксида алюминия также используют гидроксид алюминия для производства очищающих средств для кожи, средств для загара, лосьонов для тела и увлажняющих средств. Средства личной гигиены, например, шампуни, зубные пасты, дезодоранты и многие другие, также предполагают использование гидроксида алюминия. Гидроксид алюминия также иногда используется для защиты кожи человека.
Гидроксид алюминия чаще всего используется для производства губной помады, декоративной косметики и других средств по уходу за кожей. Там он используется потому, что абсолютно стабилен и не токсичен для человека. Иногда производители косметики на основе гидроксида алюминия также используют гидроксид алюминия для производства очищающих средств для кожи, средств для загара, лосьонов для тела и увлажняющих средств. Средства личной гигиены, например, шампуни, зубные пасты, дезодоранты и многие другие, также предполагают использование гидроксида алюминия. Гидроксид алюминия также иногда используется для защиты кожи человека.
Применение в промышленности
Производство бетона невозможно без гидроксида алюминия. На стадии производства бетона в цемент добавляют гидроксид алюминия. Это также очень полезно, потому что цемент с добавлением гидроксида алюминия быстро высыхает, если он подвергается воздействию тепла. Керамика и стекло как промышленного, так и бытового назначения изготавливаются с использованием гидроксида алюминия. Самое полезное свойство гидроксида алюминия при добавлении его в стекло состоит в том, что он делает стекло термостойким. Это возможно потому, что, как уже упоминалось, гидроксид алюминия не воспламеняется и имеет высокую температуру плавления. Гидроксид алюминия в сочетании с полимерами является очень хорошим антипиреном.
Самое полезное свойство гидроксида алюминия при добавлении его в стекло состоит в том, что он делает стекло термостойким. Это возможно потому, что, как уже упоминалось, гидроксид алюминия не воспламеняется и имеет высокую температуру плавления. Гидроксид алюминия в сочетании с полимерами является очень хорошим антипиреном.
Использование в текстильной промышленности
Не забывайте, что гидроксид алюминия не растворяется в воде. По этой причине его можно применять в текстиле, добавляя его для производства водонепроницаемой одежды. Кроме того, когда необходимо привязать к ткани цвета растительных красителей, гидроксид алюминия также будет очень кстати. В этом случае в качестве протравы используется гидроксид алюминия. Любая морилка используется в случаях, когда ткани устойчивы к красителям. В таких ситуациях протрава позволяет проникнуть красителю в ткань. Другой пример использования гидроксида алюминия — это когда он используется для придания огнестойкости некоторым красителям.
Другие области применения
Учитывая, насколько активно гидроксид алюминия используется в различных областях, мы не могли не упомянуть и другие области его применения. Помимо того, что мы уже упоминали выше, гидроксид алюминия, как и любое другое соединение алюминия, используется для очистки воды от частиц и разного рода примесей. При производстве чернил гидроксид алюминия действует как наполнитель и консервант. Гидроксид алюминия также можно использовать в качестве хроматографии в лабораториях для разделения химических веществ на различные соединения.
Реакции у людей
В отличие от некоторых других соединений алюминия, гидроксид алюминия не вызывает побочных реакций у людей, по крайней мере, у большинства людей. Он очень широко используется во многих сферах жизни и имеет множество применений в домашнем использовании и промышленности. Большинство людей могут не знать, что такое гидроксид алюминия или где это соединение используется, но мы уже знаем это, и полезные свойства гидроксида алюминия очевидны для всех, кто интересуется этой темой.
Медицинские меры предосторожности при использовании гидроксида алюминия
Неудивительно, что наиболее важным применением гидроксида алюминия является его медицинское применение. Несмотря на то, что гидроксид алюминия относительно безопасен для человека и применяется в различных сферах жизни человека, пероральное введение гидроксида алюминия следует проводить с осторожностью. Всегда рекомендуется проконсультироваться с врачом перед началом приема гидроксида алюминия или в случае возникновения каких-либо проблем во время приема.
Если у вас есть какие-либо проблемы со здоровьем, связанные с почками, включая камни, запор или заболевание, вам следует обратиться к врачу или получить консультацию фармацевта, прежде чем принимать какое-либо лекарство, содержащее гидроксид алюминия. Кроме того, совет врача также необходим, если вы обезвожены или регулярно употребляете алкоголь. Категорически не рекомендуется принимать гидроксид алюминия более двух недель без консультации с врачом. Кроме того, вы не должны принимать какие-либо другие лекарства при приеме гидроксида алюминия.
Кроме того, вы не должны принимать какие-либо другие лекарства при приеме гидроксида алюминия.
Если вы беременны или планируете забеременеть во время лечения гидроксидом алюминия, вы должны проконсультироваться с врачом. То же самое следует сделать, если вы кормящая мать. Воздействие гидроксида алюминия на грудного ребенка может быть вредным. По этой причине вам следует проконсультироваться с врачом в такой ситуации.
Как принимать гидроксид алюминия?
Вы должны принимать это соединение алюминия только так, как это указано на его этикетке или как это прописал ваш врач. Не превышайте дозу, назначенную врачом, и не принимайте гидроксид алюминия дольше, чем было предписано.
Чтобы убедиться, что ваша доза точна, отмерьте ее ложкой или чашкой для лекарств вместо обычной ложки. У вас нет специального медицинского прибора для измерения? Купите его или попросите своего врача предоставить его. Гидроксид алюминия следует запивать полным стаканом воды. Обычно гидроксид алюминия принимают перед сном или между приемами пищи. Не принимайте его дольше двух месяцев, если ваш врач не посоветовал вам иначе. Гидроксид алюминия следует хранить вдали от тепла, света и влаги.
Обычно гидроксид алюминия принимают перед сном или между приемами пищи. Не принимайте его дольше двух месяцев, если ваш врач не посоветовал вам иначе. Гидроксид алюминия следует хранить вдали от тепла, света и влаги.
Не волнуйтесь, если вы пропустили дозу. Обычно гидроксид алюминия не следует принимать регулярно, но если это так, принимайте его, как только вспомните о нем. Но если время для следующей дозы почти пришло, пропустите пропущенную дозу. В случае передозировки гидроксидом алюминия следует обратиться в токсикологическую службу или вызвать скорую медицинскую помощь. Симптомами передозировки гидроксидом алюминия являются потеря веса, изменения настроения, спутанность сознания, запор и мочеиспускание реже, чем обычно, или полное отсутствие мочеиспускания.
Побочные эффекты гидроксида алюминия
Существуют некоторые побочные эффекты приема гидроксида алюминия. Некоторые из них требуют, чтобы вы обратились за неотложной медицинской помощью, включая аллергические реакции, такие как крапивница, отек и затрудненное дыхание. Вам также следует прекратить прием гидроксида алюминия и немедленно обратиться к врачу, если у вас сильный запор или боль в желудке, черный, дегтеобразный или кровянистый стул, боль при мочеиспускании, кашель с кровью, чувство усталости, слабость в мышцах или потеря аппетита. Существуют и другие побочные эффекты приема гидроксида алюминия, поэтому в случае возникновения любого из них немедленно обратитесь к врачу.
Вам также следует прекратить прием гидроксида алюминия и немедленно обратиться к врачу, если у вас сильный запор или боль в желудке, черный, дегтеобразный или кровянистый стул, боль при мочеиспускании, кашель с кровью, чувство усталости, слабость в мышцах или потеря аппетита. Существуют и другие побочные эффекты приема гидроксида алюминия, поэтому в случае возникновения любого из них немедленно обратитесь к врачу.
Формула гидроксида алюминия
h4AlO3
Свойства гидроксида алюминия
Молярная масса: 78,00 г/моль
твердый
гидроксид алюминия
Гидроксид алюминия , Al(OH) 3 , является наиболее стабильной формой алюминия в нормальных условиях. Дополнительные рекомендуемые знанияХимияГиббситимеет типичную структуру гидроксида металла с водородными связями. Он состоит из двойных слоев гидроксильных групп с ионами алюминия, занимающими две трети октаэдрических отверстий между двумя слоями. [1] Гидроксид алюминия является амфотерным. Растворяется в кислоте с образованием Al(H 2 O) 6 3+ или продуктов его гидролиза. Он также растворяется в сильной щелочи с образованием Al(OH) 4 — . Гидроксид алюминия получают в процессе Байера в качестве промежуточного продукта при производстве металлического алюминия. ФармакологияФармакологически это соединение используется в качестве антацида под такими названиями, как Alu-Cap, Aludrox или Pepsamar. Гидроксид реагирует с избытком кислоты в желудке, снижая его кислотность. Это снижение кислотности содержимого желудка может, в свою очередь, облегчить симптомы язвы, изжоги или диспепсии. Он также может вызвать запор и поэтому часто используется с карбонатом магния, который обладает уравновешивающим слабительным действием. Это соединение также используется для контроля уровня фосфатов в крови людей, страдающих почечной недостаточностью. Гидроксид алюминия включен в качестве адъюванта в некоторые вакцины (например, Alhydrogel ), поскольку он способствует индукции хорошего ответа антител (Th3). Однако его способность стимулировать клеточный (Th2) иммунный ответ незначительна, что важно для защиты от многих патогенов (Petrovsky and Aguilar, 2004). Поскольку поражения головного мозга, обнаруживаемые при болезни Альцгеймера, содержат алюминий, есть опасения, что потребление избыточных соединений алюминия может вызвать или способствовать развитию этого и других нейродегенеративных заболеваний (Perl, 2006, Kawahara, 2005). Плотник Д.О. Влияние металлов на нервную систему человека и животных. Int J Occup Med Environ Health. 2001;14(3):209-18. Гэлбрейт, А; Буллок, С.; Маниас, Э. Хант, Б. и Ричардс, А. (1999). Основы фармакологии: текст для медицинских сестер и медицинских работников. Харлоу: Pearson Education Ltd., стр. 482. Кавахара М. Влияние алюминия на нервную систему и его возможная связь с нейродегенеративными заболеваниями. Дж. Альцгеймера Дис. 2005 ноябрь;8(2):171-82; обсуждение 209-15. Perl DP, Moalem S. Алюминий и болезнь Альцгеймера, личный взгляд через 25 лет. Дж. Альцгеймера Дис. Петровский Н., Агилар Ю.С. Вакцинные адъюванты: современное состояние и перспективы. Иммунол Селл Биол. 2004 г., октябрь; 82 (5): 488–96. | ||||||||||||||||||||||||||||||||||||||||||||||
| Эта статья находится под лицензией GNU Free Documentation License. Он использует материал из статьи Википедии «гидроксид алюминия». Список авторов есть в Википедии. | ||||||||||||||||||||||||||||||||||||||||||||||
Гидроксид алюминия-Ataman kimya
CAS Номер: 21645-51-2
EC Номер: 244-492-7
Молекулярная формула: Al (OH) 3
Моликулярный вес: 78.00
. встречается в природе как минерал гиббсит (также известный как гидраргиллит) и его три гораздо более редких полиморфных модификации: байерит, дойлеит и нордстрандит.Гидроксид алюминия амфотерен, т. е. обладает как основными, так и кислотными свойствами.
Близкими родственниками являются гидроксид алюминия и оксид алюминия или оксид алюминия (Al2O3), последний из которых также является амфотерным.
Эти соединения вместе являются основными компонентами алюминиевых рудных бокситов.
Гидроксид алюминия – природный минерал. Гидроксид алюминия является антацидом.
Гидроксид алюминия используется для лечения изжоги, расстройства желудка, повышенной кислотности желудка или кислотного расстройства желудка.
Гидроксид алюминия также используется для снижения уровня фосфатов у людей с определенными заболеваниями почек.
Гидроксид алюминия также может использоваться для целей, не указанных в данном руководстве.
Гидроксид алюминия получают из раствора алюмината по методу Байера и фильтруют.
Гидроксид алюминия представляет собой неорганическую соль, используемую в качестве антацида.
Гидроксид алюминия представляет собой основное соединение, нейтрализующее соляную кислоту в желудочном секрете.
Последующее повышение pH может ингибировать действие пепсина.
Увеличение ионов бикарбоната и простагландинов также может оказывать цитопротекторное действие.
Гидроксид алюминия является антацидом, что означает, что он нейтрализует избыток желудочной кислоты, связанный с расстройством желудка.
Гидроксид алюминия также помогает защитить слизистую оболочку желудка от кислотного раздражения.
Гидроксид алюминия также может уменьшить количество фосфатов, которые ваше тело поглощает из пищи, которую вы едите.
Гидроксид алюминия соединяется с фосфатом в желудке, который затем удаляется, а не всасывается.
Хотя гидроксид алюминия иногда назначают с этой целью людям с некоторыми заболеваниями почек, обычно вместо него используют другие лекарства.
Гидроксид алюминия представляет собой перорально активную основную форму алюминия, используемую в качестве адъюванта.
Адъювантные исследования на основе гидроксида алюминия, включая эффект репозитория, профагоцитарный эффект и активацию провоспалительного пути NLRP3.
Гидроксид алюминия является наиболее широко используемым неорганическим антипиреном в мире.
Гидроксид алюминия является экономически эффективным и нетоксичным антипиреном, который может использоваться в самых разнообразных формовочных смесях, таких как резина, полиэфирные и эпоксидные композиты, пенополиуретаны, составы на основе латекса, силикон, настенные покрытия, проволока и кабели.
Гидроксид алюминия представляет собой неорганическую соль, используемую в качестве антацида.
Гидроксид алюминия является основным соединением, которое действует путем нейтрализации соляной кислоты в желудочном секрете.
Последующее повышение pH может ингибировать действие пепсина.
Повышение уровня ионов бикарбоната и простагландинов также может оказывать цитопротекторное действие.
Гидроксид алюминия с аморфной структурой и высоким значением удельной поверхности по БЭТ.
Гидроксид алюминия получают химическим осаждением в водной среде и имеет содержание щелочи менее 2% (Na2O)
Гидроксид алюминия имеет различные применения, главным из которых является медицинское применение.
Гидроксид алюминия представляет собой измельченное или мелкокристаллическое нерастворимое в воде твердое вещество.
Гидроксид алюминия используется, в частности, для телекоммуникационных кабелей и кабелей для передачи данных, а также для кабелей бытовой техники в качестве антипирена.
Гидроксид алюминия, в частности, его дымоподавляющие и нетоксичные свойства, которые делают его одним из самых популярных антипиренов.
Гидроксид алюминия считается наиболее важным минеральным антипиреном в мире, и, благодаря отсутствию галогенов, он безвреден для окружающей среды и характеризуется высокой эффективностью в качестве подавителя дымовых газов.
Этот минерал производится из боксита в соответствии с процессом Байера.
Помимо огнезащитных свойств, превосходными характеристиками гидроксида алюминия являются его высокая степень белизны и низкая степень твердости.
Кроме того, дегидратация происходит при 200°С.
Гидроксид алюминия представляет собой антацид, доступный в безрецептурных (OTC) лекарствах, которые облегчают изжогу, кислотное расстройство желудка, кислый желудок и расстройство желудка.
Гидроксид алюминия можно найти в лекарствах от изжоги, которые содержат более одного антацидного активного ингредиента.
Гидроксид алюминия также можно найти в лекарствах, которые лечат другие симптомы, например газы.
Гидроксид алюминия (Aluminic), встречающийся в природе в виде минерала гиббсита, является амфотерным (т. е. обладает как основными, так и кислотными свойствами).
Гидроксид алюминия используется для лечения симптомов повышенной кислотности желудка, таких как изжога, расстройство желудка, кислый желудок или кислотное расстройство желудка; также снижают уровень фосфатов у людей с определенными заболеваниями почек.
Гидроксид алюминия Al(OH)3 является наиболее стабильной формой алюминия в нормальных условиях.
Гидроксид алюминия встречается в природе в виде минерала гиббсита (также известного как гидраргиллит).
Близкими родственниками являются гидроксид оксида алюминия AlO(OH) и оксид алюминия Al2O3, отличающиеся только потерей воды.
Вместе эти соединения являются основными компонентами алюминиевых рудных бокситов.
Гидроксид алюминия представляет собой кристаллический источник алюминия с высокой нерастворимостью в воде для использования в средах с более высоким (базовым) pH.
Гидроксид алюминия широко распространен в природе и является одной из наиболее широко изучаемых молекул в физической химии. Гидроксидные соединения имеют разнообразные свойства и применение: от основного катализа до обнаружения диоксида углерода.
Гидроксид алюминия, белое твердое вещество, представляет собой типичный амфотерный гидроксид, нерастворимый в воде, но растворимый в кислоте или щелочи.
Гидроксид алюминия может быть преобразован в глинозем после нагревания на воздухе для обезвоживания, что важно для производства глинозема.
Гидроксид алюминия является широко используемым химическим продуктом, и он в основном используется в качестве пластиковых и полимерных наполнителей, антипиренов и связующих покрытий, наполнителей из эпоксидной смолы, наполнителей для зубных паст, ингредиентов для стекла, а также в качестве наполнителей и покрытий для бумаги.
Гидроксид алюминия также может быть использован для производства серной кислоты Алюминий, квасцы, фторид алюминия и алюминат натрия, а также для синтеза молекулярного сита.
Гель и осушающий гель гидроксида алюминия могут быть использованы в медицине в качестве антацидов для нейтрализации желудочной кислоты и защиты язвенной поверхности при лечении язвенной болезни желудка и двенадцатиперстной кишки и повышенной кислотности.
ПРИМЕНЕНИЕ ГИДРОКСИДА АЛЮМИНИЯ:
Гидроксид алюминия имеет много преимуществ, включая крупномасштабное производство, адекватное сырье, высокую чистоту продукта и хорошую растворимость в кислоте.
Следовательно, гидроксид алюминия можно использовать в качестве важного сырья для получения солей алюминия, таких как алюминат бария, сульфат алюминия и так далее.
Порошок гидроксида алюминия обычно считается идеальным огнезащитным наполнителем для пластмасс, ненасыщенных полиэфиров, каучука и других органических полимеров из-за его наполняющих, огнезащитных и дымоудаляющих функций, а также нетоксичных свойств.
Механизм огнестойкости гидроксида алюминия заключается в следующем: когда температура превышает 200 ℃, гидроксид алюминия начинает осуществлять эндотермическое разложение и выделяет три кристалла воды, а скорость его разложения достигает наибольшего значения при 250 ℃.
Эта реакция является сильной эндотермической реакцией, тем самым препятствуя повышению температуры полимера, снижая скорость его разложения и производя только водяной пар, не выделяя токсичных и вредных газов.
Гидроксид алюминия может превращаться в оксид алюминия, обладающий высокой термической химической стабильностью, термической прочностью, сопротивлением ползучести и диэлектрическими свойствами, а также низким коэффициентом теплового расширения.
Глинозем является важным материалом для синтеза керамики.
В процессе синтеза керамики мы можем контролировать фазообразование композита путем активации гидроксида алюминия и управления процессом кристаллизации.
Гидроксид алюминия существует в воде в основном в форме Al(OH)4-, который может осаждать токсичные тяжелые металлы в сточных водах методом соосаждения для достижения эффекта очистки воды после дополнительной фильтрации.
Гидроксид алюминия имеет большую удельную поверхность и может адсорбировать на своей поверхности коллоиды, взвешенные вещества, красители и органические вещества в сточных водах.
Гидроксид алюминия может нейтрализовать желудочную кислоту и не токсичен, поэтому он всегда используется в качестве народной медицины для лечения желудка.
Гидроксид алюминия в качестве адъюванта также может улучшить иммуногенность вакцины, механизм действия которой заключается в следующем: гидроксид алюминия адсорбирует антиген на своей поверхности, что позволяет антигену медленно высвобождаться, так что он может играть роль увеличения эффективности.
При получении гидроксида алюминия мы можем получать различные целевые продукты с различной площадью поверхности, объемом пор, структурой пор и кристаллической структурой, регулируя температуру, концентрацию и рН реагентов, которые можно эффективно использовать в качестве носителя катализатора для гидрирование ненасыщенных карбонильных соединений и получение фуллеренов и тому подобное.
Гидроксид алюминия имеет высокую белизну, ультратонкий размер частиц, а также полную кристаллическую форму и хорошо совместим с отбеливающими агентами.
Гидроксид алюминия в качестве аддитивного покрытия и смолы может эффективно улучшить белизну, непрозрачность, гладкость и абсорбцию чернил мелованной бумагой.
— Огнезащитный наполнитель:
Гидроксид алюминия также находит применение в качестве огнезащитного наполнителя для полимеров.
Для этих целей выбран гидроксид алюминия, потому что он бесцветен (как и большинство полимеров), недорог и обладает хорошими огнезащитными свойствами.
Гидроксид магния и смеси хунтита и гидромагнезита используются аналогичным образом.
Гидроксид алюминия разлагается при температуре около 180 ° C (356 ° F), поглощая при этом значительное количество тепла и выделяя водяной пар.
В дополнение к тому, что он ведет себя как антипирен, он очень эффективен в качестве средства подавления дыма в широком диапазоне полимеров, особенно в полиэфирах, акрилах, этиленвинилацетате, эпоксидных смолах, ПВХ и каучуке.
-Прекурсор соединений алюминия:
Гидроксид алюминия является сырьем для производства других соединений алюминия: специального кальцинированного оксида алюминия, сульфата алюминия, полиалюминийхлорида, хлорида алюминия, цеолитов, алюмината натрия, активированного оксида алюминия и нитрата алюминия.
Свежеосажденный гидроксид алюминия образует гели, что является основой для применения солей алюминия в качестве флокулянтов при очистке воды.
Этот гель со временем кристаллизуется. Гели гидроксида алюминия можно дегидратировать (например, с использованием смешивающихся с водой неводных растворителей, таких как этанол) с образованием порошка аморфного гидроксида алюминия, который легко растворим в кислотах. Нагревание превращает его в активированный оксид алюминия, который используется в качестве осушителя, адсорбента при очистке газов и носителя катализатора.
-Фармацевтика:
Гидроксид алюминия под общим названием «альгельдрат» используется в качестве антацида у людей и животных (в основном кошек и собак).
Гидроксид алюминия предпочтительнее других альтернатив, таких как бикарбонат натрия, потому что Al(OH)3, будучи нерастворимым, не увеличивает pH желудка выше 7 и, следовательно, не вызывает секрецию избыточной кислоты желудком.
Гидроксид алюминия реагирует с избытком кислоты в желудке, снижая кислотность содержимого желудка, что может облегчить симптомы язвы, изжоги или диспепсии.
Такие продукты могут вызвать запор, поскольку ионы алюминия подавляют сокращения гладкомышечных клеток желудочно-кишечного тракта, замедляя перистальтику и удлиняя время, необходимое для прохождения стула через толстую кишку.
Некоторые такие продукты сформулированы так, чтобы свести к минимуму такие эффекты за счет включения равных концентраций гидроксида магния или карбоната магния, которые обладают уравновешивающим слабительным действием.
Это соединение также используется для контроля гиперфосфатемии (повышенный уровень фосфатов или фосфора в крови) у людей и животных, страдающих почечной недостаточностью.
В норме почки фильтруют избыток фосфатов из крови, но почечная недостаточность может привести к накоплению фосфатов.
Соль алюминия при попадании в организм связывается с фосфатом в кишечнике и снижает количество фосфора, которое может быть абсорбировано.
Осажденный гидроксид алюминия включается в качестве адъюванта в некоторые вакцины (например, вакцину против сибирской язвы).
Одним из известных брендов адъюванта гидроксида алюминия является Alhydrogel производства Brenntag Biosector.
Гидроксид алюминия сильно привлекает определенные типы моноцитов, которые дифференцируются в дендритные клетки.
Гидроксид алюминия, по-видимому, способствует индукции хорошего ответа Th3, поэтому он полезен для иммунизации против патогенов, которые блокируются антителами.
Однако он обладает небольшой способностью стимулировать клеточные (Th2) иммунные ответы, что важно для защиты от многих патогенов, а также он бесполезен, когда антиген основан на пептидах.
ПРИМЕНЕНИЕ ГИДРОКСИДА АЛЮМИНИЯ:
Гидроксид алюминия имеет множество применений; некоторые люди считают, что это использование действительно бесконечно.
Просто чтобы проиллюстрировать широту применения, мы можем сказать, что гидроксид алюминия используется в качестве протравы в красителях, очистителя воды, ингредиента для косметики и даже в качестве элемента для процессов в фотографии.
Имеются также второстепенные применения в керамике и строительстве.
Но наиболее важной областью применения гидроксида алюминия является медицина.
Адъювант гидроксида алюминия используется в парентеральных человеческих и ветеринарных вакцинах.
Гидроксид алюминия активирует иммунные реакции Th3, включая реакции антител IgG и IgE.
Гидроксид алюминия также используется для выделения некоторых компонентов сыворотки, таких как факторы свертывания крови.
Гидроксид алюминия (Al(OH)3) имеет несколько медицинских применений.
Гидроксид алюминия используется в качестве антацида для лечения изжоги, а также кислотного расстройства желудка (рефлюкс-эзофагит).
Также известно, что гидроксид алюминия обладает заживляющими свойствами при язвенной болезни.
У пациентов с почечной недостаточностью, у которых наблюдается повышенный уровень фосфатов в сыворотке крови (гиперфосфатемия), Al(OH)3 используется в качестве фосфатсвязывающего средства.
Al(OH)3 является амфотерным соединением, что означает, что он может реагировать как основание или как кислота.
При применении в качестве антикислотного средства Al(OH)3 реагирует с любым избытком желудочной кислоты (в основном HCl) с образованием AlCl3 и воды.
-Используется для приготовления водонепроницаемых тканей, чернил, стекла, бумажных наполнителей, протравы, очищающих средств, различных солей алюминия и т.д.
-Широко используется для пластмасс, резины, смолы, краски, краски и т.д.
-Используется для поддержки катализатора и отделение паровой жидкости
-Используется в нефтяной, химической промышленности, производстве удобрений, природного газа и защите окружающей среды для увеличения точек распределения газа или жидкости и защиты низкопрочного катализатора.
-Используется в качестве протравы и реагентов для анализа.
— Используется в качестве загустителя для чернил и сырья для производства алюминиевой соли, эмали, керамики, изделий из стекла и смазки.
-Также используется для приготовления различных носителей катализатора.
— Гель гидроксида алюминия можно использовать для лечения язвы двенадцатиперстной кишки, язвы желудка и гиперацидной эмболии.
— Кроме того, также используется в водонепроницаемых тканях, бумажных наполнителях, протравах и очищающих средствах.
— Используется для печатных красок, пигментов для рисования, цветных карандашей и резиновой упаковки.
— Используется в водонепроницаемых тканях, чернилах, стеклянной посуде, бумажной упаковке, протравах, очищающих средствах, а также используется в производстве алюминиевой соли, смазочных материалов.
— Используется для гравиметрического определения содержания калия.
— Используются в качестве адсорбентов, эмульгаторов, ионообменников, хроматографических аналитов и протрав.
— Используется для приготовления огнеупорных, стеклянных и гончарных изделий, а также осаждения пигмента и водонепроницаемой ткани.
— Также используется для производства солей алюминия.
— Применение в медицине:
Учитывая, что гидроксид алюминия способен нейтрализовать кислоты, он служит природным антацидом.
Гидроксид алюминия также обладает очень полезным свойством, так как стимулирует иммунную систему человека.
Кроме того, с использованием гидроксида алюминия готовят различные вакцины, в том числе для лечения гепатита В, гепатита А и столбняка.
Гидроксид алюминия также может быть использован для лечения больных с заболеваниями почек, у которых наблюдается повышенный уровень фосфатов в крови из-за почечной недостаточности.
Эта полезная функция существует благодаря способности гидроксида алюминия связываться с фосфатами.
После связывания с гидроксидом алюминия фосфаты легко вымываются из организма человека.
— Применение в косметике:
Существуют различные области применения гидроксида алюминия в области косметики.
Гидроксид алюминия чаще всего используется для производства губной помады, декоративной косметики и других средств по уходу за кожей.
Гидроксид алюминия используется там, потому что гидроксид алюминия абсолютно стабилен и не токсичен для людей.
Иногда производители косметики на основе гидроксида алюминия также используют гидроксид алюминия для производства очищающих средств для кожи, средств для загара, лосьонов для тела и увлажняющих средств.
Продукты личной гигиены, например, шампуни, зубные пасты, дезодоранты и многие другие, также включают использование гидроксида алюминия.
Гидроксид алюминия также иногда используется для защиты кожи человека.
— Применение в промышленности:
Производство бетона невозможно без гидроксида алюминия. На стадии производства бетона в цемент добавляют гидроксид алюминия.
Гидроксид алюминия также очень полезен, потому что цемент с добавлением гидроксида алюминия быстро высыхает, если он подвергается воздействию тепла.
Керамика и стекло промышленного и бытового назначения изготавливаются с использованием гидроксида алюминия.
Самое полезное свойство гидроксида алюминия при добавлении гидроксида алюминия к стеклу состоит в том, что гидроксид алюминия делает стекло термостойким.
Гидроксид алюминия возможен, поскольку, как уже упоминалось, гидроксид алюминия не воспламеняется и имеет высокую температуру плавления.
Гидроксид алюминия в сочетании с полимерами является очень хорошим антипиреном.
— Использование в текстильной промышленности:
Не забывайте, что гидроксид алюминия не растворяется в воде.
По этой причине гидроксид алюминия можно применять в текстиле путем добавления гидроксида алюминия для производства водонепроницаемой одежды.
Кроме того, когда гидроксид алюминия необходим для связывания цветов растительных красителей с тканью, гидроксид алюминия также будет очень полезен.
В этом случае в качестве протравы используется гидроксид алюминия.
Любая протрава применяется в случаях, когда ткани устойчивы к красителям.
В таких ситуациях протрава позволяет проникнуть красителю в ткань.
Другой пример использования гидроксида алюминия — это когда гидроксид алюминия используется для придания огнестойкости некоторым красителям.
-Другие области применения:
Учитывая, насколько активно гидроксид алюминия используется в различных областях, мы не могли не упомянуть и другие области его применения.
Помимо того, что мы уже упоминали выше, гидроксид алюминия, как и любое другое соединение алюминия, используется для очистки воды от частиц и разного рода примесей.
При производстве красок гидроксид алюминия действует как наполнитель и консервант.
Гидроксид алюминия также можно использовать в качестве хроматографии в лабораториях для разделения химических веществ на различные соединения.
СВОЙСТВА ГИДРОКСИДА АЛЮМИНИЯ:
Очищенный гидроксид алюминия представляет собой объемистый порошок белого цвета или гранулы с плотностью около 2,42 г/мл.
Гидроксид алюминия не растворяется в воде, а растворяется только в основаниях и кислотах.
Гидроксид алюминия действует в воде как амфотерное вещество.
Если присутствует сильное основание, гидроксид алюминия будет действовать как кислота.
А если присутствует сильная кислота, то она будет действовать как сильное основание.
С гидроксидом алюминия следует обращаться с осторожностью, так как его воздействие может вызвать раздражение.
Однако будут присутствовать только незначительные остаточные повреждения.
Что касается воспламеняемости, гидроксид алюминия не воспламеняется и не горит.
Кроме того, гидроксид алюминия не реакционноспособен, поэтому устойчив как в условиях огня, так и в воде.
-низкая степень твердости,
-плотность 2,4 г/см3
-высокая степень белизны (цветность Y > 94)
-коэффициент термического расширения 15*10-6К-1 (при темп. 20 –300°С)
-Платная замедляющая среда
Физические и химические свойства гидроксида алюминия:
-Molecular: 99,9 %
-П: <20nm
-Molecular: Al (OH) 3
-MOLECULEC 2
-Molecular: AL (OH) 3 -MOLECULER. Вес: 78 г/моль
Вес: 78 г/моль
-форма: порошок
-color: белый
-плотность: 2,42 г/см
-300 ° C C
-Vapor Давление: <0,1 HPA
Solubility: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость: Согласимость. Нерастворим в воде
ХИМИЧЕСКИЕ СВОЙСТВА ГИДРОКСИДА АЛЮМИНИЯ:
Существует множество различных форм оксида алюминия, включая как кристаллические, так и некристаллические формы.
Гидроксид алюминия является электрическим изолятором, что означает, что гидроксид алюминия не проводит электричество, а гидроксид алюминия также обладает относительно высокой теплопроводностью.
Кроме того, в кристаллической форме корунд, твердость гидроксида алюминия делает его пригодным в качестве абразива.
Высокая температура плавления оксида алюминия делает гидроксид алюминия хорошим огнеупорным материалом для футеровки высокотемпературных приборов, таких как печи, печи, мусоросжигательные заводы, реакторы различного типа и тигли.
Химическая формула гидроксида алюминия: Al(OH)₃.
Гидроксид алюминия Al(OH)3, также известный как тригидроксид алюминия, тригидрат алюминия, гидрат алюминия, гидратированный оксид алюминия и гидратированный оксид алюминия, представляет собой нерастворимый в воде порошок от белого до беловато-желтого цвета с удельным весом 2,42.
Гидроксид алюминия используется в качестве основы для пигментов, в качестве водоотталкивающего средства в текстильных покрытиях и в качестве антацида в медицине.
Гидроксид алюминия растворим в соляной или серной кислотах или в гидроксиде натрия.
Адъювант гидроксида алюминия представляет собой белый гидрогель, который медленно осаждается и образует прозрачный супернатант.
СТРУКТУРА ГИДРОКСИДА АЛЮМИНИЯ:
Гидроксид алюминия состоит из двойных слоев гидроксильных групп с ионами алюминия, занимающими две трети октаэдрических отверстий между двумя слоями.
Распознаются четыре полиморфа.
Все слои состоят из октаэдрических звеньев гидроксида алюминия с водородными связями между слоями.
Полиморфы различаются по расположению слоев.
МЕХАНИЗМ ДЕЙСТВИЯ АЛЮМИНИЯ ГИДРОКСИДА:
Алюминия гидроксид представляет собой основную неорганическую соль, которая действует путем нейтрализации соляной кислоты в желудочном секрете.
Гидроксид алюминия медленно растворяется в желудке и реагирует с соляной кислотой с образованием хлорида алюминия и воды.
Гидроксид алюминия также ингибирует действие пепсина за счет повышения рН и за счет адсорбции.
ХРАНЕНИЕ ГИДРОКСИДА АЛЮМИНИЯ:
Адъювант гидроксида алюминия стабилен не менее 2 лет при хранении при температуре 4–308℃ в хорошо закрытых инертных контейнерах.
Нельзя допускать замерзания гидроксида алюминия, так как структура гидратированного коллоида будет необратимо повреждена.
Храните все лекарства в недоступном для детей месте.
Хранить в прохладном, сухом месте, вдали от прямых источников тепла и света.
СИНОНИМ:
алюминий; тригидроксид
Высушенный гель гидроксида алюминия
Гель гидроксида алюминия, высушенный
тригидроксид алюминия
гидроксид алюминия
Гидроксид алюминия
Сухой гидроксид алюминия
Гидроксид алюминия, высушенный
Гель гидроксида алюминия, высушенный
КЕМБЛ1200706
DTXSID2036405
НИОСХ/БД0708000
Ди-мю-гидрокситетрагидроксидиалюминий
АФ-260
АКОС015
Алюминий, ди-мю-гидрокситетрагидроксиди-
DB06723
БД07080000
Что такое токсичность гидроксида алюминия?
Что такое токсичность гидроксида алюминия? Пресс
Введите
искать
iCliniq / Статьи о здоровье / Токсичные химические вещества / Что такое токсичность гидроксида алюминия?
Первая помощь и Чрезвычайные ситуации Данные провереныНаписано
Доктор Лиана. Дж. К. Беатрис
Дж. К. Беатрис
и медицинский
рассмотрен доктором Каушалом БхавсаромОпубликовано 08 августа 2022 г. — 4 мин чтения
Abstract
Токсичность гидроксида алюминия возникает, когда избыток алюминия накапливается в кровотоке из-за чрезмерного всасывания или приема внутрь. Читайте ниже, чтобы узнать больше.
Содержание
Каковы применения гидроксида алюминия в медицине?
Какие существуют лекарственные формы гидроксида алюминия?
Каков механизм действия гидроксида алюминия?
Какими способами выводится алюминий из организма?
Кто подвержен риску отравления гидроксидом алюминия?
Каковы симптомы отравления гидроксидом алюминия?
Какие меры необходимо принять для предотвращения отравления алюминием?
Как диагностируется токсичность гидроксида алюминия?
Как лечить отравление гидроксидом алюминия?
Введение:
Гидроксид алюминия, также называемый гидратированным оксидом алюминия, является общедоступным соединением алюминия. Это безрецептурный препарат. Он доступен в различных формах и используется для лечения различных желудочных заболеваний, кожной сыпи и т. д. У здоровых людей гидроксид алюминия практически не поглощает алюминий при вдыхании, пероральном приеме или через кожу. Но у некоторых людей наблюдаются нарушения всасывания алюминия из-за передозировки, каких-либо сопутствующих заболеваний и т. д. Некоторые люди проявляют гиперчувствительность (аллергические реакции) к гидроксиду алюминия из-за ранее известной непереносимости соединений алюминия.
Это безрецептурный препарат. Он доступен в различных формах и используется для лечения различных желудочных заболеваний, кожной сыпи и т. д. У здоровых людей гидроксид алюминия практически не поглощает алюминий при вдыхании, пероральном приеме или через кожу. Но у некоторых людей наблюдаются нарушения всасывания алюминия из-за передозировки, каких-либо сопутствующих заболеваний и т. д. Некоторые люди проявляют гиперчувствительность (аллергические реакции) к гидроксиду алюминия из-за ранее известной непереносимости соединений алюминия.
Каково применение гидроксида алюминия в медицине?
Фармакологическое применение гидроксида алюминия:
Гидроксид алюминия используется для лечения таких симптомов, как изжога, расстройство желудка, расстройство желудка и т. д., связанных с пептической язвой, путем нейтрализации избытка вырабатываемой желудочной кислоты и защиты слизистой оболочки желудка от кислых выделений.
Применяется для лечения кожных высыпаний, мелких ран, прыщей, раздраженной кожи и т.
 д.
д.Действует как средство для защиты кожи от кожной сыпи, вызванной использованием подгузников.
Помогает контролировать гиперфосфатемию (повышенный уровень фосфатов в крови).
Он используется в виде жидкости для полоскания рта для лечения орального мукозита, вызванного химиотерапией.
Кроме того, он широко используется в качестве адъюванта в нескольких вакцинах.
Помимо использования в качестве лекарственного средства, гидроксид алюминия используется в производстве различного медицинского оборудования, такого как;
Абатменты для зубных имплантатов.
Стенты для лечения трахеомаляции.
Искусственные протезы тазобедренного сустава.
Он также используется в качестве красителя для полиметилметакрилатного цемента и шовных материалов.
Какие существуют лекарственные формы гидроксида алюминия?
Фармакологически гидроксид алюминия доступен в различных формах, таких как таблетки, суспензия, капсулы, жидкости для полоскания рта, мази и т. д. Рекомендуемая доза гидроксида алюминия для лечения пептических язв составляет от 5 до 30 мл между приемами пищи или перед сном, а при гиперфосфатемии — 300 мл. до 600 мг 3 раза в сутки для взрослых и от 50 до 150 мг для детей. Гидроксид алюминия следует принимать только по назначению врача. Дозировка зависит от массы тела, индивидуальных потребностей и сопутствующих заболеваний.
д. Рекомендуемая доза гидроксида алюминия для лечения пептических язв составляет от 5 до 30 мл между приемами пищи или перед сном, а при гиперфосфатемии — 300 мл. до 600 мг 3 раза в сутки для взрослых и от 50 до 150 мг для детей. Гидроксид алюминия следует принимать только по назначению врача. Дозировка зависит от массы тела, индивидуальных потребностей и сопутствующих заболеваний.
Каков механизм действия гидроксида алюминия?
При приеме в качестве антацида он нейтрализует рН секретируемых желудочных кислот, таких как пепсин, и защищает слизистую оболочку желудка от повреждений и раздражения.
При нанесении в виде мази для местного применения образует гидрофильный слой на поверхности кожи и действует как защитный барьер от инфекции и накопления бактерий.
При использовании в качестве адъюванта в вакцинах он стимулирует макрофаги (разновидность лейкоцитов, присутствующих в крови), вызывая воспалительные реакции, тем самым помогая организму вырабатывать лучший иммунитет против антигена.

Какими способами выводится алюминий из организма?
Алюминий, присутствующий в организме, большую часть времени находится в стационарном состоянии, поэтому последовательная экскреция алюминия происходит при приеме внутрь гидроксида алюминия. При пероральном введении алюминий выводится в основном с калом, а при системном введении алюминий выводится с мочой. При наличии основного заболевания этот процесс выделения нарушается.
Кто подвержен риску отравления гидроксидом алюминия?
Наиболее распространенные факторы риска, связанные с токсичностью гидроксида алюминия, включают:
Люди со сниженной функцией почек.
Пациенты, длительно принимающие гидроксид алюминия.
Работа в зоне с повышенным воздействием алюминия.
Случайная передозировка наркотиками.
Каковы симптомы отравления гидроксидом алюминия?
Начальные побочные эффекты, связанные с гидроксидом алюминия, включают;
Тошнота, рвота и запор.

Снижение уровня фосфатов до ненормального уровня.
Меловой вкус.
Боль в животе.
Боль при мочеиспускании.
Черный дегтеобразный стул.
Спутанность сознания.
Мышечная слабость.
Когда проглоченный гидроксид алюминия становится токсичным, возникают следующие симптомы;
Какие меры необходимо принять для предотвращения отравления алюминием?
Прежде чем получить рецепт на гидроксид алюминия, вы должны сообщить своему врачу о следующем;
Аллергия на гидроксид алюминия.
Гиперчувствительность к солям алюминия в анамнезе.
В анамнезе или в настоящее время проблемы с почками.
В анамнезе недавнее желудочное кровотечение, сердечная недостаточность, цирроз печени и др.
Беременность или планирование беременности.

Алюминий вызывает лекарственные взаимодействия при приеме с некоторыми лекарствами, поэтому важно сообщить медицинскому работнику о других принимаемых лекарствах.
Использование гидроксида алюминия в качестве лекарства в течение более длительного периода времени не рекомендуется; вместо этого его следует принимать только как временную меру.
Желательно и безопасно принимать гидроксид алюминия до или только через два часа после приема любых других лекарств, чтобы предотвратить лекарственные взаимодействия, поскольку гидроксид алюминия взаимодействует с различными лекарствами и добавками.
Как диагностируется токсичность гидроксида алюминия?
Оценка риска токсичности алюминия путем сбора надлежащего анамнеза потребления алюминия и любых предыдущих реакций на алюминий.
Анализы крови показывают повышенный уровень альбумина в крови.
Анализ крови на алюминий или тест на токсичность алюминия проводится для исключения избыточного количества алюминия в крови.

Анализ мочи и анализ кала проверяют уровень выделяемого алюминия.
При биопсии кости присутствие алюминия в костном мозге указывает на токсичность.
Как лечить токсичность гидроксида алюминия?
Начальным лечением токсичности гидроксида алюминия является прекращение приема гидроксида алюминия, что обычно приводит к нормализации уровня алюминия.
В некоторых случаях, когда уровни сывороточного альбумина очень высоки, необходимо введение антидота для устранения избытка алюминия. Дефероксамин (лекарство, обычно используемое при передозировке железа и алюминия) вводят в качестве антидота, который подвергается процессу хелатирования (процессу, в котором определенные соединения вступают в реакцию с ионами металлов с образованием водорастворимого комплекса), что облегчает выведение избытка алюминия.
Заключение:
Отравление гидроксидом алюминия — несерьезное состояние, которое обычно проходит после отмены препарата, хотя правильная диагностика заболевания играет важную роль в лечении этого состояния. Оценка риска перед назначением гидроксида алюминия может в значительной степени предотвратить токсичность.
Оценка риска перед назначением гидроксида алюминия может в значительной степени предотвратить токсичность.
- Токсичность алюминия
https://www.winchesterhospital.org/health-library/article?id=164929 - ОЦЕНКА РИСКА ДЛЯ ЗДОРОВЬЯ ЧЕЛОВЕКА АЛЮМИНИЯ, ОКСИДА АЛЮМИНИЯ И ГИДРОКСИДА АЛЮМИНИЯ
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2782734/
Последнее рассмотрение по адресу:
08 августа 2022 — Чтение через 4 мин.
РЕЙТИНГ
Поставьте свою оценку
❤ 15
Доктор Каушал Бхавсар
Пульмонология (врачи-астматологи)
Метки:- Токсичные химические вещества
- Токсичность гидроксида алюминия
Всестороннее медицинское второе мнение. Отправьте свое дело
Самые популярные статьи
У вас есть вопрос о токсичных химических веществах или токсичности гидроксида алюминия?
Спросите врача онлайн * гарантированный ответ в течение 4 часов.
Отказ от ответственности: Никакой контент, опубликованный на этом веб-сайте, не предназначен для замены профессиональной медицинской диагностики, консультации или лечения квалифицированным врачом. Обратитесь за советом к своему врачу или другому квалифицированному медицинскому работнику, если у вас возникнут вопросы относительно ваших симптомов и состояния здоровья, чтобы поставить полный медицинский диагноз. Не откладывайте и не пренебрегайте обращением за профессиональной медицинской консультацией из-за того, что вы прочитали на этом сайте. Прочтите наш редакционный процесс, чтобы узнать, как мы создаем контент для статей и запросов о здоровье.
Гидроксид алюминия, характеристика, свойства и получение, химические реакции
Гидроксид алюминия, характеристика, свойства и получение, химические реакции.
Гидроксид алюминия является неорганическим веществом и имеет химическую формулу Al(OH)3.
Краткое описание гидроксида алюминия
Модификация гидроксида алюминия
Физические свойства гидроксида алюминия
Получение гидроксида алюминия
Химические свойства гидроксида алюминия
Химическая реакция гидроксида алюминия
Применение и использование гидроксида алюминия
Краткое описание гидроксида алюминия: белого цвета.

Химическая формула гидроксида алюминия Al(OH)3.
Плохо растворим в воде.
Обладает способностью адсорбировать различные вещества.
Модификация гидроксида алюминия:
4 известные кристаллические модификации гидроксида алюминия: гиббсит, байерит, дойлеит и нордстрандит.
Гиббсит обозначается γ-формой гидроксида алюминия, а байерит – α-формой гидроксида алюминия.
Гиббсит представляет собой наиболее химически стабильную форму гидроксида алюминия.
Физические свойства гидроксида алюминия:
| Имя параметра: | Значение: |
| Химическая формула | Ал(ОН)3 |
| Синонимы и названия на иностранных языках для α-формы гидроксида алюминия | гидроксид калия (англ.) гидроксид алюминия α-форма (англ.). байерит (рус.) |
| Синонимы и названия на иностранных языках для гидроксида алюминия в γ-форме | гидроксид калия (англ. ) )гидроксид алюминия (англ.) гидроксид алюминия (англ.). гидраргиллит (англ.). гиббсит (рус.) гидраргиллит (рус.) |
| Тип вещества. | неорганический |
| Внешний вид гидроксида алюминия α-форма | бесцветные моноклинные кристаллы |
| Внешний вид гидроксида алюминия и γ-форм | белые моноклинные кристаллы |
| Цвет | белый, бесцветный |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °С и атмосферном давлении 1 атм.) | твердый |
| Плотность гидроксида алюминия в γ-форме (состояние – твердое, при 20 °С), кг/м3 | 2420 |
| Плотность гидроксида алюминия в γ-форме (состояние вещества – твердое, при 20 °С) г/см3 | 2,42 |
| Температура разложения гидроксида алюминия α-форма, °С | 150 |
| Температура разложения гидроксида алюминия и γ-форм, °С | 180 |
| Молярная масса, г/моль | 78 004 |
* Примечание:
— нет данных.
Получение гидроксида алюминия:
Гидроксид алюминия получают в результате следующих химических реакций:
1. взаимодействие хлорида алюминия и гидроксида натрия :
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl.
Гидроксид алюминия осаждается в виде белого желеобразного осадка.
Гидроксид алюминия получают также при взаимодействии солей алюминия с водным раствором щелочи, не допуская избытка.
2. взаимодействие хлорида алюминия, карбоната натрия и воды :
2AlCl3 + 3Na2CO3 + 3h3O → 2Al(OH)3 + 3CO2 + 6NaCl.
Гидроксид алюминия осаждается в виде белого желеобразного осадка.
Гидроксид алюминия получают также при взаимодействии водорастворимых солей алюминия с карбонатами щелочных металлов.
Химические свойства гидроксида алюминия. Химическая реакция гидроксида алюминия:
Гидроксид алюминия обладает амфотерными свойствами, т.е. обладает как основными, так и кислотными свойствами.
Химические свойства гидроксида алюминия аналогичны свойствам амфотерных гидроксидов других металлов. Так для него характерны следующие химические реакции:
1. реакция гидроксида алюминия с гидроксидом натрия:
Al(OH)3 + NaOH → NaAlO2 + 2h3O (t = 1000 °C),
Al(OH)3 + 3NaOH → Na3[Al( OH)6],
Al(OH)3 + NaOH → Na[Al(OH)4].
В результате реакции образуются в первом случае – алюминат натрия и вода, во втором – гексагидроксоантимонат натрия, в третьем – тетрагидроалюминат натрия. В третьем случае в качестве гидроксида натрия используется концентрированный раствор.
2. реакция гидроксида алюминия с гидроксидом калия:
Al(OH)3 + KOH → KAlO2 + 2h3O (t = 1000 °C),
Al(OH)3 + KOH → K[Al(OH) )4].
В результате реакции образуется в первом случае алюминат калия и вода, во втором тетрагидроалюминат калия. Во втором случае в качестве гидроксида калия используется концентрированный раствор.
3. реакция гидроксида алюминия с азотной кислотой:
Al(OH)3 + 3HNO3 → Al(NO3)3 + 3h3O.
В результате реакции образуется нитрат алюминия и вода .
Аналогично протекают реакции гидроксида алюминия и других кислот.
4. реакция гидроксида алюминия с фтористым водородом:
Al(OH)3 + 3HF → AlF3 + 3h3O,
6HF + Al(OH)3 → h4[AlF6] + 3h3O.
В результате реакции образуется в первом случае – фторид алюминия и вода, во втором – гексафторалюминат водорода и вода. Фтор в первом случае в качестве исходного вещества используют в виде раствора.
5. реакция гидроксида алюминия с бромвалератом:
Al(OH)3 + 3HBr → AlBr3 + 3h3O.
В результате реакции образуется бромид алюминия и вода.
6. реакция гидроксида алюминия с йодовидоном:
Al(OH)3 + 3HI → AlI3 + 3h3O.
В результате реакции йодида образуются алюминий и вода.

 )
)