Гидроксид алюминия
Гидроксид алюминия — химическое вещество, которое представляет собой соединение оксида алюминия с водой. Может пребывать в жидком и твердом состояниях. Жидкий гидроксид является желеподобным прозрачным веществом, которое очень плохо растворяется в воде. Твердый гидроксид представляет собой кристаллическое вещество белого цвета, которое обладает пассивными химическими свойствами и не реагирует практически ни с одним другим элементом или соединением.
Получение гидроксида алюминия
Получение гидроксида алюминия происходит благодаря химической реакции обмена. Для этого используют водный раствор аммиака и какую-либо соль алюминия, чаще всего хлорид алюминий. Таким образом получают жидкое вещество. Если необходим твердый гидроксид, через растворенную щелочь тетрагидроксодиакваалюмината натрия пропускают диоксид углерода. Многих любителей экспериментов волнует вопрос, как получить гидроксид алюминия в домашних условиях? Для этого достаточно приобрести в специализированном магазине необходимые реагенты и химическую посуду.
Для получения твердого вещества понадобится еще и специально оборудование, так что лучше остановиться на жидком варианте. При проведении реакции необходимо использовать хорошо проветриваемое помещение, так как одним из побочных продуктов может быть газ или вещество с резким запахом, который может негативно сказаться на самочувствии и здоровье человека. Работать стоит в специальных защитных перчатках, так как большинство кислот при попадании на кожу вызывают химические ожоги. Не лишним будет позаботиться и о защите для глаз в виде специальных очков. Приступая к любому делу, в первую очередь необходимо думать об обеспечении безопасности!
Свежесинтезированный гидроксид алюминия реагирует с большинством активных кислот и щелочей. Именно поэтому для его получения используют аммиачную воду, чтобы сохранить образованное вещество в чистом виде. При использовании для получения кислоты или щелочи необходимо максимально точно рассчитать пропорцию элементов, иначе при избытке полученный гидроксид алюминия взаимодействует с остатками непоглощенной основы и полностью растворяется в ней. Это происходит из-за высокого уровня химической активности алюминия и его соединений.
Это происходит из-за высокого уровня химической активности алюминия и его соединений.
В основном, гидроксид алюминия получают из бокситовой руды с высоким содержанием оксида металла. Процедура позволяет быстро и относительно дешево отделить полезные элементы от пустой породы. Реакции гидроксида алюминия с кислотами приводят к восстановлению солей и образованию воды, а с щелочами — к получению комплексных гидрооксоалюминиевых солей. Твердый гидроксид методом сплавки соединяют с твердыми щелочами с образованием метаалюминатов.
Основные свойства вещества
Физические свойства гидроксида алюминия: плотность — 2,423 грамм на сантиметр кубический, уровень растворяемости в воде — низкий, цвет — белый либо прозрачный. Вещество может существовать в четырех полиморфных вариантах. Под воздействием низких температур образуется альфа-гидроксид, называемый байеритом. Под воздействие нагревания можно получить гамма-гидроксид или гиббсит. Оба вещества имеют кристаллическую молекулярную решетку с водородными межмолекулярными типами связи.
Химические свойства гидроксида алюминия: молярная масса — 78 моль, в жидком состоянии хорошо растворяется в активных кислотах и щелочах, при нагревании разлагается, обладает амфотерными признаками. В промышленности в подавляющем большинстве случаев используется именно жидкий гидроксид, так как благодаря высокому уровню химической активности, он легко поддается обработки и не требует использования катализаторов или специальных условий протекания реакции.
Амфотерность гидроксида алюминия проявляется в двойственности его природы. Это означает, что в различных условиях он может проявлять кислотные либо щелочные свойства. Когда гидроксид принимает участие в реакции как щелочь, образуется соль, в которой алюминий является положительно заряженным катионом.
Гидроксид алюминия входит в состав вакцин в качестве вещества, усиливающего иммунную реакцию организма на раздражитель. Нерастворимость осадка гидроксида алюминия в воде позволяет использовать вещество в водоочистных целях. Химическое соединение является очень сильным адсорбентом, который позволяет извлекать из состава воды большое количество вредных элементов.
Применение в промышленности
Применение гидроксида в промышленности связано с получением чистого алюминия. Технологический процесс начинается с обработки руды, содержащей оксид алюминия, который по завершению процесса переходит в гидроксид. Выход продукции в данной реакции достаточно высок, так что после завершения остается практически голая порода. Далее проводится операция разложения гидроксида алюминия.
Выход продукции в данной реакции достаточно высок, так что после завершения остается практически голая порода. Далее проводится операция разложения гидроксида алюминия.
Процедура не требует специальных условий, так как вещество хорошо разлагается при нагревании до температуры свыше 180 градусов по Цельсию. Этот этап позволяет выделить оксид алюминия. Это соединение является базовым или вспомогательным материалом для изготовления большого количества промышленных и бытовых изделий. При необходимости получения чистого алюминия используют процесс электролиза с добавлением в раствор криолита натрия. Катализатор забирает из оксида кислород, и чистый алюминий оседает на катоде.
Разновидности Гидрооксидов Алюминия в Природе
Гидроксид алюминия
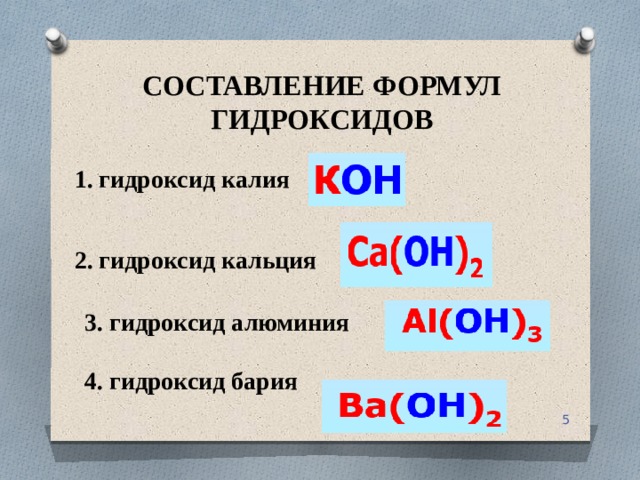
Гидроксид алюминия в природе встречается в двух возможных формах: тригидроксид Al (OH)3 и моногидроксид ALOOH. Каждый из представленных видов характеризуется наличием кристаллических разновидностей.
Тригидроксид алюминия отличается тремя полиморфными кристаллическими разновидностями:
- гидраргиллит;
- байерит;
- нордстрандит.

Моногидрит алюминия имеет две основных разновидности:
- бёмит;
- диаспор.
Гидраргиллит
Гидраргиллит представляет собой основу гидраргиллитовых бокситов и латеритов. Последние ‒ это продукты, которые образовались в результате выветривания известняка. В чистом виде гидраргиллит добывают на Урале в продуктах изменения нефелина или в пустотах тальковых сланцев.
Искусственным способом получить данный элемент можно во время производства глинозема. В таком случае осуществляется разложение алюминатных растворов, когда температура составляет выше +40 градусов.
Кристаллы гидраргиллита, полученные за счет применения метода Байера, характеризуются формой пластинок и призм. Кристаллы, полученные путем карбонизации алюминатных растворов, имеют форму прямоугольных пластин или клиновидную форму удлиненного типа.
Характер
агрегирования кристаллов, полученных после декомпозиции алюминатных растворов ‒
листовато-пластинчатый. В таком гидроксиде всевозможные добавки равномерно
расположены по всей поверхности материала.
Характер агрегирования кристаллов, которые были получены при карбонизации растворов ‒ радиально-лучистый. В этом гидроксиде кристаллы расположены в центральной части и направлены в разные стороны. Новые кристаллообразные элементы будут сфокусированы уже по радиальным направлениям.
Кристаллы гидраргиллита могут быть разных цветовых оттенков:
- белый;
- светло-розовый;
- светло-зеленый;
- светло-бурый.
При этом все кристаллы имеют стеклянный блеск.
В зарубежной технической литературе гидраргиллит достаточно часто встречается под названием гиббсит.
Химический состав гидраргиллита: Al2O3*3H2O = 2Al (OH)3.
Одним из первых, кто предложил модель кристаллической структуры гидраргиллита, был Паулинг.
Структура гидраргиллита состоит из нескольких слоев, между которыми находится лист ионов алюминия.
Байерит
Байерит ‒ это искусственно созданный минерал. Его добывают из кислых растворов солей алюминия, когда отмечают повышенный pH.
Такой материал выделяется в результате:
- Карбонизации алюминатных растворов, в составе которых содержится порядка 200 г/л оксида алюминия в условиях комнатной температуры.
- Самостоятельного разложения данных растворов при комнатной температуре.
- Старения коллоидного гидроксида алюминия.
В природе байерит содержится в известняках, где минерал представлен в виде волокон. Такие известняки были найдены в Израиле. В Украине минерал отыскали в коре выветривания амфиболитов.
По своим размерам кристаллы данного минерала достаточно мелкие. Они характеризуются клиноподобной формой, а также встречаются варианты в форме иглы. В результате создаются агрегаты, которые прозвали соматоидами.
По химическому составу байерит абсолютно идентичный с гидраргиллитом: Al (OH)
3.Что
касается конкретной структуры байерита, на сегодняшний день не существует
единого мнения. Некоторые ученые считали, что этот минерал по своей структуре
напоминает гидраргиллит и также характеризуется тремя слоями.
Однако на сегодня многие придерживаются мнения, что байерит все же имеет много общего со структурой гидраргиллита. Отличие заключается лишь в расположении слоев октаэдров.
Нордстрандит
Изначально этот минерал был получен искусственным путем, но немного позже было выяснено, что норстрандит встречается также и в природе.
Искусственным путем минерал впервые получил Нордстранд, когда происходил процесс обработки металлического алюминия или геля гидроксида алюминия с применением растворов диаминового этилена на основе воды. В чистом виде представленный минерал также добывали в процессе старения хелатообразующих агентов в условиях, при которых мог бы получиться байерит, если бы не были использованы эти агенты.
В
природе минерал встречается достаточно редко. Впервые его отыскали на острове
Гуам в порах красного миоценового известняка в участке, где он контактировал с
базальтом, что уже успел обветриться.
Отличить представленный минерал достаточно просто, он имеет вид кристаллов ‒ бесцветных или белого цвета, которые отличаются разнообразными формами. По сравнению с кристаллами гидраргиллита, эти кристаллы имеют более крупные размеры и волнистую структуру. Еще одно отличие нордстрандита от гидраргиллита заключается в отсутствии кристаллической решетки ионов щелочных металлов. От байерита такой минерал отличается следующим: при использовании щелочей или 2%-ного раствора алюмината калия он все равно не превращается в гидраргиллит.
Во
время открытия такой разновидности тригидроксида алюминия Нордстранд прозвал ее
байеритом-II
или рандомитом. Свое название нордстрандит получил уже после проведения
Международного симпозиума по глинозему, который проходил в Мюнстере.
Бёмит
Бёмит ‒ минерал, который впервые открыл немецкий минералог И. Бём. Он отыскал такой минерал в бокситах, а потому и назвал его бокситом. Немного позже Лаппаран отыскал данный минерал в бокситах Франции, а также в бокситовых глинах в Шотландии. На Урале бёмит можно встретить в темно-красных и зеленовато-серых бокситах, представленных в виде миниатюрных кристаллов.
Бёмит также можно получить и искусственным путем, если приготовить раствор азотнокислого алюминия, что будет дополнительно подкисленным азотной кислотой. Представленный раствор необходимо подогреть до температуры 320-360 градусов с учетом давления, что варьируется от 200 до 300 ат.
Бёмит ‒ это моногидроксид алюминия, а его химический состав выглядит следующим образом: Al2O3*H2O = 2AlOOH.
Удельный вес минера составляет 3-3,2 г/см3, а показатели твердости ‒ 3,01-4,00.
Бёмит не имеет ярко-выраженного цветового оттенка, а в бокситах отличается светло-желтым оттенком. Чаще всего его можно встретить в мелкодисперсном виде, он находится в скрытокристаллической или слабокристаллической форме.
Чаще всего его можно встретить в мелкодисперсном виде, он находится в скрытокристаллической или слабокристаллической форме.
Структура бёмита
О кристаллической структуре минерала впервые рассказали Рейхерт и Йостом. Она подразумевает наличие двойных слоев «гофрированного» типа кислородных октаэдров. По центу находятся ионы алюминия.
Также, в структуре минера находятся атомы кислорода сразу нескольких видов:
- Атомы, которые расположены посередине слоев. Они разделяются четырьмя октаэдрами.
- Наружные атомы, что разделяются только двумя октаэдрами.
Каждый из наружных атомов кислорода соединен посредством надежной водородной связи с несколькими аналогичными атомами, которые находятся в соседнем слое. Двойные слои были созданы таким образом, что на каждую элементарную ячейку рассчитано по два слоя. В результате в бёмите около 50% от общего количества атомов кислорода не принимают участия в водородной связи.
По сравнению с
гидраргиллитом, в котором каждый ион находится в окружении шести гидроксильных
групп, в бёмите ионы Al3+
расположены в окружении четырех кислородных ионов, а также двух гидроксилов.
Помимо известного бёмита отмечают еще одну менее популярную метастабильную моногидроксидную форму ‒ псевдобёмит. Он является изоморфной формой бёмита и имеет достаточно много отличительных свойств.
Псевдобёмит подразумевает собой соединение состава Al2O3*x H2O, где 2<x>1. В составе псевдобёмита содержится на 30-100% больше воды, чем необходимо согласно формуле AlOOH. Такое большое количество воды связано с прочными водородными связями, которые имеются между слоями решетки. Поэтому псевдобёмит невозможно рассматривать в качестве коллоидного слабокристаллизованного бёмита.
Диаспор
Диаспор ‒ это составной элемент диаспоровых, а также диаспор-бёмитовых бокситов. В чистом виде такой минерал отыскали в наждачных копях США и Греции, на Урале, в Узбекистане. Получить диаспор можно искусственным путем, если на протяжении долгого времени выдерживать бёмит в условиях температурного режима от +280 градусов.
Кристаллы
отличаются пластинчатой формой. Иногда можно встретить игольчатые и чешуйчатые,
а также призматическую форму. Такие различные формы объясняются всевозможными
температурными показателями и особенностями среды, где находится диаспор. Ведь
именно от этих показателей напрямую зависит скорость процесса кристаллизации.
Иногда можно встретить игольчатые и чешуйчатые,
а также призматическую форму. Такие различные формы объясняются всевозможными
температурными показателями и особенностями среды, где находится диаспор. Ведь
именно от этих показателей напрямую зависит скорость процесса кристаллизации.
Что касается цветовых оттенков, диаспор может быть представлен в белом, розовом, светло-фиолетовом, желтовато-буром, коричневом и зеленовато-сером оттенках.
Диаспор имеет аналогичный бёмиту состав: Al2O3*H2O = 2AlOOH. Удельный вес варьируется от 3,2 до 3,5 г/см3, а показатели твердости составляют ‒ от 6,5 до 7,25.
Самая простая ячейка состоит из четырех формульных единиц AlOOH. Точно также, как и бёмит, диаспор кристаллизуется в орторомбической или же орто-дипирамидальной системе.
Кристаллическую структуру такого элемента предложили Дефландром и Такане.
В основе находятся слои, что состоят из кислородных атомов. Ионы алюминия находятся в октаэдрическом положении и расположены между слоями. Таким образом, удалось получить целые ленты октаэдров.
Таким образом, удалось получить целые ленты октаэдров.
Характерная особенность диаспора заключается в отсутствии воды. Из каждой пары кислородных атомов один атом кислорода достаточно прочно связан с атомом водорода, поэтому отмечают следующую формулу диаспор: AlO*(OH).
Таким образом, все вышеперечисленные разновидности гидроксидов алюминия считаются слоистыми типами минералов, которые были собраны на основе октаэдрических алюмогидроксилксилородных слоев. Все минералы, кроме бёмита, расположены в гексагональном или же псевдогексагональном порядке. Между ними сохраняется надежная водородная связь.
По возрастанию и стабильности все три вида тригидроксида алюминия расположены в следующем порядке: нордстрандит → байерит → гидраргиллит.
Гидроксид алюминия в природе расположен в следующем порядке: диаспор → бёмит → гидраргиллит.
Превращения и равновесные состояния в системе Al
2O3 ‒ H2OРазновидности три- и моно- гидроксидов алюминия могут превращаться друг в друга, если были соблюдены определенные для этого условия. Было отмечено, что чаще всего подобные превращения наблюдаются внутри отдельно взятого ряда элементов, чем из одного ряда в другой.
Было отмечено, что чаще всего подобные превращения наблюдаются внутри отдельно взятого ряда элементов, чем из одного ряда в другой.
Исходя из этого, Габер классифицировал гидроксид алюминия, выделяя две основных группы:
- γ-ряд, куда относится бёмит и гидраргиллит;
- α-ряд, куда относится корунд и диаспор.
Процесс превращения осуществляется при нагревании до температуры от +500 градусов и больше.
В природе образование гидроксидов алюминия происходит в такой последовательности: аморфный гель Al3+ → псевдобёмит → байерит → гидраргиллит.
Если речь идет о нейтральной и кислой среде обитания, тогда псевдобёмит может превратиться в бёмит, а в условиях щелочной среды ‒ в байерит.
В
результате активного влияния атмосферного давления гидроксиды алюминия могут с
легкостью превращаться один в другой, а после ‒ в оксид алюминия. Последнее
превращение происходит в процессе тонкого измельчения, что часто сопровождается
последующей дегидратацией, а также разрушением структурного и морфологического
типа. После тонкого измельчения на поверхности гидроксидов можно увидеть
активные молекулы, что характеризуются большим количеством свободной энергии.
Именно этот аспект становится значимым при частичной аморфизации поверхности и
дальнейшем превращении байерита, гидраргиллита и бёмита в амфорный продукт, а
уже потом в определенную форму Al2O3.
После тонкого измельчения на поверхности гидроксидов можно увидеть
активные молекулы, что характеризуются большим количеством свободной энергии.
Именно этот аспект становится значимым при частичной аморфизации поверхности и
дальнейшем превращении байерита, гидраргиллита и бёмита в амфорный продукт, а
уже потом в определенную форму Al2O3.
Границы термической устойчивости гидроксидов алюминия и Al2O3 заметно отличаются между собой. К примеру, Вейц и Лаубенгауэр детально изучили особенности структуры в условиях температурных показателей, что варьируются от 100 до 500 градусов.
Таким образом, были получены следующие данные:
- Байерит достаточно устойчив в равновесных условиях при наличии воды, температура которой не выше 155 градусов.
- Гидраргиллит характеризуется отличной устойчивостью в аналогичных условиях, что и байерит. Если температура воды повышается, он может превратиться в бёмит.
- Бёмит
демонстрирует свою устойчивость при температурах от 155 до 280 градусов.

- Стабильность диаспора наблюдается в условиях температурных показателей от 280 до 450 градусов. Если температура увеличивается, он превращается в корунд.
- Форма γ отличается стабильностью при температуре от 100 до 500 градусов.
- Форма α Al2O3 стабильна, если температурные показатели выше 450 градусов.
Термическое разложение гидроксид алюминия
Многие исследователи спорят о том, как именно происходит такой сложный процесс разложения гидроксидов алюминия. Большинство придерживаются мнения, что разложение осуществляется в два этапа:
- До температуры 340 градусов отмечают наличие двух молекул кристаллизационной воды. Таким образом, гидраргиллит превращается в бёмит.
- Когда
температурные показатели увеличиваются до 600 градусов, отмечают выделение
последней молекулы воды и бёмит переходит в следующую форму ‒ безводный
глинозем. Если подогреть такой глинозем до температуры 900 градусов, он
становится полноценным корундом.

Многочисленные исследования подтвердили, что в первую очередь происходит выделение порядка 0,5 молей кристаллизационной воды, когда температурные показатели варьируются от 167 до 270 градусов. После этого выделяется еще 1,5 моля воды, когда отмечают температуру от 240 до 420 градусов. Последняя молекула воды выделятся, когда температура увеличивается до 420-580 градусов.
При увеличении температурных показателей прокаливания гидраргиллита его структура становится упорядоченной. Однако отмечают существенные изменения в физическом и структурном плане. Поэтому исследования доказали кардинальные изменения в таких характеристиках, как:
- удельный вес;
- пористость структуры;
- гидрофильность;
- насыпной вес;
- удельная поверхность;
- дисперсионный состав;
- оптические свойства.
Термическое разложение гидраргиллитов
В случае сильного обезвоживания гидраргиллита под воздействием воздушных масс внутри кристаллов образовывается повышенное давление водяных паров. Их воздействие на материал можно сравнить с действием насыщенного водяного пара в гидротермальных условиях. В таком случае происходит образование бёмита.
Их воздействие на материал можно сравнить с действием насыщенного водяного пара в гидротермальных условиях. В таком случае происходит образование бёмита.
При малейшем понижении давления водяных паров процесс создания бёмита постепенно замедляется. Это приводит к тому, что гидраргиллит в обезвоженном виде при температурных показателях от 300 до 400 градусов превращается в Al2O3.
Термическое разложение байерита осуществляется подобно процессу изменения гидраргиллита: через бёмит и через промежуточные стадии Al2O3 в корунд.
Что касается термограммы нордстрандита, она имеет много общего с показателями природного гидраргиллита. Однако отмечают одно существенное отличие: наличие большей интенсивности эндотермического эффекта при температурных показателях от 500 до 600 градусов. Это объясняется дегидратацией созданного бёмита.
Термические
превращения, которые были проведены Русселем и Кохраном, исключают
θ-модификацию Al2O3. От размеров частиц бёмита зависит дальнейшая реакционноспособность и
направление реакции термического процесса разложения. Переход бёмита к корунду
является достаточно сложным процессом, так по своей структуре это два
совершенно разных элемента.
От размеров частиц бёмита зависит дальнейшая реакционноспособность и
направление реакции термического процесса разложения. Переход бёмита к корунду
является достаточно сложным процессом, так по своей структуре это два
совершенно разных элемента.
Диаспор при нагревании до температуры от 450 градусов и больше превращается в корунд. Ведь такие элементы характеризуются похожими структурами.
По материалам книги «Глинозем и пути содержания в нем примесей», А. А. Ханамирова, издательство АН Армянской ССР, Ереван, 1983 г.
Гидроксид алюминия | AMERICAN ELEMENTS®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Наименование продукта: Гидроксид алюминия
Номер продукта: Все применимые коды продуктов American Elements, например. АЛ-ОН-02 , АЛ-ОН-025 , АЛ-ОН-03 , АЛ-ОН-035 , АЛ-ОН-04 , AL-OH-05
Номер CAS: 21645-51-2
Соответствующие установленные области применения вещества: Научные исследования и разработки
Сведения о поставщике:
American Elements
10884 Weyburn Ave.
Los Angeles, CA
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи: 9000 7
Внутренний, Северная Америка: + 1 800-424-9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси
Классификация в соответствии с Регламентом (ЕС) № 1272/2008
G HS07
Раздражение кожи. 2 ч415 Вызывает раздражение кожи.
Раздражение глаз. 2A h419 Вызывает серьезное раздражение глаз.
STOT SE 3 h435 Может вызывать раздражение дыхательных путей.
Классификация согласно Директиве 67/548/ЕЕС или Директиве 1999/45/ЕС
Xi; Раздражающее средство
R36/37/38: Раздражает глаза, дыхательные пути и кожу.
Информация об особых опасностях для человека и окружающей среды:
Н/Д
Опасности, не классифицированные иначе
Нет доступных данных
Элементы маркировки
Маркировка в соответствии с Регламентом (ЕС) № 1272/2008
Вещество классифицируется и маркируется в соответствии с регламентом CLP.
Пиктограммы, обозначающие опасности
GHS07
Сигнальное слово: Осторожно
Предупреждения об опасности
h415 Вызывает раздражение кожи.
h419 Вызывает серьезное раздражение глаз.
h435 Может вызывать раздражение дыхательных путей.
Меры предосторожности
P261 Избегать вдыхания пыли/дыма/газа/тумана/паров/аэрозолей.
P280 Пользоваться защитными перчатками/защитной одеждой/средствами защиты глаз/лица.
P305+P351+P338 ПРИ ПОПАДАНИИ В ГЛАЗА: Осторожно промывать глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскать.
P304+P340 ПРИ ВДЫХАНИИ: Вынести пострадавшего на свежий воздух и обеспечить комфорт для дыхания.
P405 Магазин заперт.
P501 Утилизируйте содержимое/контейнер в соответствии с местными/региональными/национальными/международными нормами.
Классификация WHMIS
D2B – Токсичный материал, вызывающий другие токсические эффекты0024 Другие опасности
Результаты оценки PBT и vPvB
PBT: N/A
vPvB: N/A
РАЗДЕЛ 3.
 СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ
СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ Вещества
CAS № / Название вещества :
21645-51-2 Гидроксид алюминия
Идентификационный номер(а):
Номер ЕС: 244-492-7
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
Описание мер первой помощи
При вдыхании:
Обеспечить пострадавшего свежим воздухом. Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Немедленно обратитесь к врачу.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь к врачу.
При попадании в глаза:
Промыть открытые глаза в течение нескольких минут под проточной водой. Проконсультируйтесь с врачом.
При проглатывании:
Обратиться за медицинской помощью.
Информация для врача
Наиболее важные симптомы и эффекты, как острые, так и замедленные
Данные отсутствуют
Указание на необходимость немедленной медицинской помощи и специального лечения
Данные отсутствуют
РАЗДЕЛ 5.
 ПРОТИВОПОЖАРНЫЕ МЕРЫ
ПРОТИВОПОЖАРНЫЕ МЕРЫ Средства пожаротушения
Подходящие средства пожаротушения
Продукт не воспламеняется. Используйте меры пожаротушения, подходящие для окружающего огня.
Особые опасности, исходящие от вещества или смеси
Если этот продукт вовлечен в пожар, могут быть выделены следующие вещества:
Пар оксида металла
Рекомендации для пожарных
Защитное снаряжение:
Надеть автономный респиратор.
Носите полностью защитный непроницаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры предосторожности для персонала, защитное снаряжение и порядок действий в чрезвычайных ситуациях
Использовать средства индивидуальной защиты. Держите незащищенных людей подальше.
Обеспечьте достаточную вентиляцию.
Меры предосторожности по охране окружающей среды:
Не допускайте попадания материала в окружающую среду без официального разрешения.
Не допускайте попадания продукта в канализацию, канализационные системы или другие водотоки.
Не допускайте проникновения материала в землю или почву.
Методы и материалы для локализации и очистки:
Обеспечить достаточную вентиляцию.
Предотвращение вторичных опасностей:
Никаких специальных мер не требуется.
Ссылка на другие разделы
См. Раздел 7 для информации о безопасном обращении
См. Раздел 8 для информации о средствах индивидуальной защиты.
Информацию об утилизации см. в Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в плотно закрытой таре.
Обеспечьте хорошую вентиляцию на рабочем месте.
Информация о защите от взрывов и пожаров:
Продукт не воспламеняется
Условия безопасного хранения, включая любые несовместимости
Требования, которым должны соответствовать складские помещения и емкости:
Особых требований нет.
Информация о хранении в одном общем хранилище:
Хранить вдали от прочных оснований.
Дополнительная информация об условиях хранения:
Держите контейнер плотно закрытым.
Хранить в прохладном сухом месте в хорошо закрытых контейнерах.
Конкретное конечное применение
Данные отсутствуют
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Дополнительная информация о конструкции технических систем: не менее 100 футов в минуту.
Параметры управления
Компоненты с предельными значениями, требующими контроля на рабочем месте:
21645-51-2 Гидроксид алюминия (100,0%)
REL (США) Долгосрочное значение: 2 мг/м 3 as Al
TLV (США) Долговременное значение: 1* мг/м 3 as Al;*вдыхаемая фракция
EL (Канада) Долговременное значение: 10 мг/м 3
Дополнительная информация: Нет данных
Средства контроля воздействия
Средства индивидуальной защиты
Соблюдайте типичные меры защиты и гигиены при обращении с химическими веществами.
Хранить вдали от пищевых продуктов, напитков и кормов.
Немедленно снимите всю испачканную и загрязненную одежду.
Мыть руки перед перерывами и по окончании работы.
Избегать попадания в глаза и на кожу.
Поддерживайте эргономически подходящую рабочую среду.
Дыхательное оборудование:
Используйте подходящий респиратор при наличии высоких концентраций.
Защита рук:
Непроницаемые перчатки
Осмотрите перчатки перед использованием.
Пригодность перчаток должна определяться как материалом, так и качеством, последнее из которых может варьироваться в зависимости от производителя.
Время проникновения через материал перчаток (в минутах): Нет доступных данных
Защита глаз: Защитные очки
Защита тела: Защитная рабочая одежда.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физико-химических свойствах
Внешний вид:
Форма: Порошок
Цвет: Белый
Запах: Нет данных
Порог запаха: Нет данных.
pH: нет данных
Точка плавления/диапазон плавления: данные отсутствуют
Точка/диапазон кипения: данные отсутствуют
Температура сублимации/начало: данные отсутствуют
Воспламеняемость (твердое вещество, газ): Данные отсутствуют.
Температура воспламенения: Данные отсутствуют.
Температура разложения: Данные отсутствуют.
Самовоспламенение: Данные отсутствуют.
Опасность взрыва: Данные отсутствуют.
Пределы взрываемости:
Нижний: Данные отсутствуют
Верхний: Данные отсутствуют
Давление паров: Н/Д
Плотность: Данные отсутствуют
Относительная плотность: Данные отсутствуют.
Плотность пара: н/д
Скорость испарения: н/д
Растворимость в воде (H 2 O): данные отсутствуют
Коэффициент распределения (н-октанол/вода): данные отсутствуют.
Вязкость:
Динамическая: Н/Д
Кинематика: Н/Д
Другая информация
Нет данных
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность
Нет данных
Химическая стабильность
Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать:
Разложение не происходит, если используется и хранится в соответствии со спецификациями.
Возможность опасных реакций
Опасные реакции не известны
Условия, которых следует избегать
Нет данных
Несовместимые материалы:
Основания
Опасные продукты разложения:
Пары оксидов металлов
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ 90 004
Информация о токсикологическом воздействии
Острая токсичность :
Реестр токсических эффектов химических веществ (RTECS) содержит данные об острой токсичности компонентов этого продукта.
Значения LD/LC50, важные для классификации: Нет данных
Раздражение или коррозия кожи: Вызывает раздражение кожи.
Раздражение или коррозия глаз: Вызывает серьезное повреждение глаз.
Сенсибилизация: Сенсибилизирующие эффекты неизвестны.
Мутагенность зародышевых клеток: Эффекты неизвестны.
Канцерогенность:
Данные по классификации канцерогенных свойств этого материала от EPA, IARC, NTP, OSHA или ACGIH отсутствуют.
Репродуктивная токсичность: Эффекты неизвестны.
Специфическая токсичность для системы органов-мишеней — многократное воздействие: Эффекты неизвестны.
Специфическая токсичность для системы органов-мишеней — однократное воздействие: Может вызывать раздражение дыхательных путей.
Опасность при вдыхании: Эффекты неизвестны.
От подострой до хронической токсичности:
Реестр токсических эффектов химических веществ (RTECS) содержит данные о токсичности при многократном приеме этого вещества.
Дополнительная токсикологическая информация:
Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Акватоксичность:
Нет данных
Стойкость и способность к разложению
Нет данных
Биоаккумулятивный потенциал
Нет данных
Подвижность в почве
Нет данных
Дополнительная экологическая информация:
Не допускать попадания материала в окружающую среду без официального разрешения.
Не допускайте попадания неразбавленного продукта или больших количеств в грунтовые воды, водотоки или канализационные системы.
Избегайте попадания в окружающую среду.
Результаты оценки PBT и vPvB
PBT: н/д
vPvB: н/д
Другие побочные эффекты
Данные отсутствуют
РАЗДЕЛ 13. СООБРАЖЕНИЯ ПО УТИЛИЗАЦИИ
Методы обработки отходов
Рекомендация
Обратитесь к официальным правилам для обеспечения надлежащей утилизации.
Неочищенная упаковка:
Рекомендация:
Утилизация должна производиться в соответствии с официальными правилами.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
Номер ООН
DOT, ADN, IMDG, IATA
N/A
Собственное отгрузочное наименование ООН
DOT, ADN, IMDG, IATA
N/A
Класс опасности при транспортировке (с)
DOT, ADR, ADN, IMDG, IATA
Class
N/A
Группа упаковки
DOT, IMDG, IATA
N/A
Опасности для окружающей среды:
N/A
Особые меры предосторожности для пользователя
N/A
Транспортировка навалом согласно Приложению II к MARPOL73/78 и IBC Code
N/A
Транспорт/Дополнительная информация:
DOT
Морской загрязнитель (DOT):
№
РАЗДЕЛ 15.
 НОРМАТИВНАЯ ИНФОРМАЦИЯ
НОРМАТИВНАЯ ИНФОРМАЦИЯ Правила техники безопасности, охраны здоровья и окружающей среды / законодательство, относящееся к данному веществу или смеси
Национальные правила
Все компоненты этого продукта перечислены в Реестре химических веществ Агентства по охране окружающей среды США.
Все компоненты этого продукта перечислены в Канадском перечне веществ для внутреннего потребления (DSL).
Раздел 313 SARA (списки конкретных токсичных химических веществ)
Вещество не указано в списке.
Предложение 65 штата Калифорния
Предложение 65 — Химические вещества, вызывающие рак
Вещество не указано в списке.
Prop 65 — Токсичность развития
Вещество не указано.
Prop 65 — Токсичность для развития, женщины
Вещество не указано.
Prop 65 — Токсичность для развития, мужчины
Вещество не указано.
Информация об ограничении использования:
Только для использования технически квалифицированными лицами.
Прочие правила, ограничения и запретительные положения
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (ЕС) № 1907/2006.
Вещество не указано.
Условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) в отношении производства, размещения на рынке и использования.
Вещество не указано.
Приложение XIV Регламента REACH (требуется разрешение на использование)
Вещество не указано.
REACH — Предварительно зарегистрированные вещества
Вещество указано.
Оценка химической безопасности:
Оценка химической безопасности не проводилась.
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (ДОСТИГАЕМОСТЬ). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Формула гидроксида алюминия – структура, производство и применение
Гиббсит (также известный как гидраргиллит) и три его более редких полиморфных модификации байерит, дойлеит и нордстрандит являются примерами гидроксида алюминия, Al(OH)3. Гидроксид алюминия является амфотерным, что означает, что он может быть как основным, так и кислым. Гидроксид оксида алюминия AlO(OH) и оксид алюминия или оксид алюминия (Al2O3), который также является амфотерным, тесно связаны между собой. Эти химические вещества являются основными компонентами боксита алюминиевой руды.
Химическая формула гидроксида алюминия
Химическая формула гидроксида алюминия/молекулярная формула гидроксида алюминия: Al(OH)3.
Структурная формула гидроксида алюминия
Al(OH)3 состоит из двух слоев гидроксильных групп, две трети октаэдрических отверстий которых заполнены ионами алюминия. Было идентифицировано четыре полиморфа. Во всех них присутствуют слои октаэдрических звеньев гидроксида алюминия с водородными связями между ними. Слои укладываются по-разному в полиморфах. Кристаллы Al(OH)3 во всех формах имеют гексагональную форму.
[Изображение будет загружено в ближайшее время]
Как мы уже обсуждали химическую формулу гидроксида алюминия. Давайте посмотрим на структурную формулу гидроксида алюминия.
Производство
Метод Байера, который включает растворение бокситов в гидроксиде натрия при температуре до 270 °C (518 °F), позволяет получить почти весь коммерчески используемый гидроксид алюминия. Бокситовые хвосты удаляют, а гидроксид алюминия осаждают из оставшегося раствора алюмината натрия. Прокаливание может превратить этот гидроксид алюминия в оксид алюминия или оксид алюминия.
Из-за остаточного гидроксида натрия остаток или бокситовые хвосты, которые в основном представляют собой оксид железа, очень едкие. Раньше он хранился в лагунах, что привело к трагедии на глиноземном заводе Айка в Венгрии в 2010 году, когда прорвало дамбу и девять человек утонули. Еще 122 человека получили лечение от химических ожогов. Грязь покрыла 40 квадратных километров (15 квадратных миль) земли и добралась до Дуная. Несмотря на то, что буровой раствор считался нетоксичным из-за низкого содержания тяжелых металлов, раствор, с которым его смешивали, имел pH 13.
1. Огнезащитный наполнитель
Гидроксид алюминия также используется в полимерах в качестве огнезащитного наполнителя. Поскольку он бесцветен (как и другие полимеры), доступен по цене и обладает высокими огнезащитными свойствами, он используется для этих целей. Таким же образом применяют комбинации хунтита и гидромагнезита, а также гидроксид магния. Он разлагается при температуре около 180 ° C (356 ° F), поглощая при этом много тепла и выделяя водяной пар. Он исключительно эффективен в качестве средства подавления дыма в широком диапазоне полимеров, включая полиэфиры, акрилы, этиленвинилацетат, эпоксидные смолы, ПВХ и каучук, а также действует как антипирен.
Он исключительно эффективен в качестве средства подавления дыма в широком диапазоне полимеров, включая полиэфиры, акрилы, этиленвинилацетат, эпоксидные смолы, ПВХ и каучук, а также действует как антипирен.
2. Прекурсор соединений алюминия
Гидроксид алюминия используется для производства специального кальцинированного оксида алюминия, сульфата алюминия, полиалюминийхлорида, хлорида алюминия, цеолитов, алюмината натрия, активированного оксида алюминия и нитрата алюминия, а также других соединений алюминия.
Свежеосажденный гидроксид алюминия образует гели, которые являются основой для использования солей алюминия в качестве флокулянтов при очистке воды. Со временем этот гель кристаллизуется. Дегидратация гелей гидроксида алюминия (например, с использованием смешивающихся с водой неводных растворителей, таких как этанол) дает аморфный порошок гидроксида алюминия, растворимый в кислоте. При нагревании он превращается в активированные оксиды алюминия, которые используются в качестве осушителей, адсорбентов при очистке газов и каталитических носителей.
3. Фармацевтические препараты
Гидроксид алюминия используется как антацидом у людей и животных (в основном у кошек и собак). Его рекомендуют по сравнению с другими вариантами, такими как бикарбонат натрия, потому что Al(OH)3 нерастворим и, следовательно, не повышает pH желудка выше 7 и, таким образом, не заставляет желудок выделять избыточную кислоту. Alu-Cap, Aludrox, Gaviscon и Pepsamar — некоторые из торговых марок. Он реагирует с избытком кислоты в желудке, снижая кислотность содержимого желудка и, возможно, облегчая симптомы язвы, изжоги и диспепсии.
Эта молекула также используется для лечения гиперфосфатемии (высокий уровень фосфата или фосфора в крови) у людей и животных с почечной недостаточностью. Избыток фосфата обычно отфильтровывается из крови почками, но почечная недостаточность может вызвать накопление фосфата.
 При употреблении соль алюминия связывается с фосфатом в кишечнике, уменьшая количество фосфора, которое может быть поглощено.
При употреблении соль алюминия связывается с фосфатом в кишечнике, уменьшая количество фосфора, которое может быть поглощено.Некоторые прививки содержат осажденный гидроксид алюминия в качестве адъюванта (например, вакцина против сибирской язвы). Alhydrogel компании Brenntag Biosector является одним из самых известных брендов адъюванта на основе гидроксида алюминия. Поскольку он эффективно поглощает белок, он помогает стабилизировать вакцины, предотвращая осаждение белков вакцины или их прилипание к стенкам контейнера во время хранения. Гидроксид алюминия иногда называют «квасцами», это название относится к любому из многочисленных сульфатов.
Гидроксид алюминия в составе вакцин стимулирует иммунную систему, вызывая выделение мочевой кислоты, что является сигналом иммунологической опасности. К этому привлекаются определенные типы моноцитов, которые развиваются в дендритные клетки.





 При употреблении соль алюминия связывается с фосфатом в кишечнике, уменьшая количество фосфора, которое может быть поглощено.
При употреблении соль алюминия связывается с фосфатом в кишечнике, уменьшая количество фосфора, которое может быть поглощено.