Гидроксид Алюминия Оптимизированный (ALOLT 730)
Гидроксид алюминия оптимизированный по вязкости — тригидрат алюминия, который представлен белого цвета. Показатели мягкости продукции составляют 2,5 соответствии со шкалой Мооса.
Гидроксид алюминия оптимизированный по вязкости способен терять влагу в размере 35% при температуре, показатели которой варьируются от 200 до 400 градусов. Температура кипения составляет около 3000 градусов.
Основная сфера применения:
- в процессе производства ПВХ;
- для кабельной изоляции;
- полиэфирных смол;
- бумаги и краски;
- полиуретанов;
- термопластов;
- водной дисперсии;
- эпоксидных компаундов.
Гидроксид оптимизированный по вязкости активно используется в строительной сфере, в архитектуре, косметологии и медицине, а также в процессе очистки воды. Этот материал принято считать экологически чистым, так как он абсолютно нетоксичен.
Документация
| МАРКА | ALOLT 704 | ALOLT 710 | ALOLT 714 | ALOLT 720 | ALOLT 730 | |
| Al(OH)3 * | % | min. 99.5 99.5 | min. 99.5 | min. 99.5 | min. 99.5 | min. 99.5 |
| SiO2 | % | max. 0.03 | max. 0.03 | max. 0.03 | max. 0.03 | max. 0.03 |
| Fe2O3 | % | max. 0.03 | max. 0.03 | max. 0.03 | max. 0.03 | max. 0.03 |
| Na2O total | % | max. 0.3 | max. 0.3 | max. 0.3 | max. 0.3 | max. 0.3 |
| Влажность | % | max. 0.4 | max. 0.3 | max. 0.3 | max. 0.3 | max. 0.3 |
| Насыпная плотность | kg/m³ | max. 650 | max. 750 | max. 750 | max. 850 | max. 900 900 |
| Белизна | % | min. 95 | min. 91 | min. 92 | min. 90 | min. 90 |
| Маслопоглощение | ml/100g | max. 23 | max. 20 | max. 22 | max. 18 | max. 16 |
| Средняя величина частиц d50 | µm | 4 | 10 | 14 | 15 | 18 |
| > 45 µm (мокрый ситовой ан-с) | % | max. 0.5 | max. 20 | max. 5 | max. 35 | max. 60 |
| > 200 µm (мокрый ситовой ан-с) | % | max. 0.1 |
ООО «ЛИВ-УНИКОН»
+38 050-341-62-82
liv-unikon. com.ua
com.ua
No Comments shpilman
Гидроксид алюминия
Внешний вид вещества гидроксид алюминия следующий. Как правило, это вещество белого, студневидного вида, хотя встречаются варианты присутствия в кристаллическом или аморфном состоянии. Например, в высушенном виде оно кристаллизуется в белые кристаллы, которые не растворяются ни в кислотах, ни в щелочах.
Гидроокись алюминия может быть представлена и мелкокристаллическим порошком белого цвета. Допустимо присутствие розового и серого оттенков.
Химическая формула соединения — Al(OH)3. Соединение оксида алюминия и воды образуют гидроксид алюминия, химические свойства которого также определяются во многом элементами, входящими в его состав. Получают это соединение посредством проведения реакции взаимодействия соли алюминия и разбавленной щелочи, при этом следует не допускать их переизбытка. Получаемый в ходе данной реакции осадок гидроксида алюминия затем может взаимодействовать с кислотами.
Гидроокись алюминия взаимодействует с водным раствором гидрооксида рубидия, сплавом этого вещества, гидроокисью цезия, карбонатом цезия. Во всех случаях выделяется вода.
Гидроокись алюминия обладает молекулярной массой равной 78,00, практически не растворяется в воде. Плотность вещества составляет 3,97 грамм/см3. Будучи амфотерным веществом, гидроксид алюминия взаимодействует с кислотами, при этом, в результате реакций получаются средние соли и выделяется вода. При вступлении в реакции со щелочами появляются комплексные соли – гидроксоалюминаты, например, К[Al(ОН)4(Н2О)2]. Метаалюминаты образуются, если гидроксид алюминия сплавлять с безводными щелочами.
Как и все амфотерные вещества, кислотные и основные свойства одновременно гидроокись алюминия показывает при взаимодействии с сильными кислотами, а также со щелочами. В этих реакциях при растворении гидроксида в кислотах происходит отщепление ионов самого гидроксида, а при взаимодействии со щелочью – отщепляется ион водорода.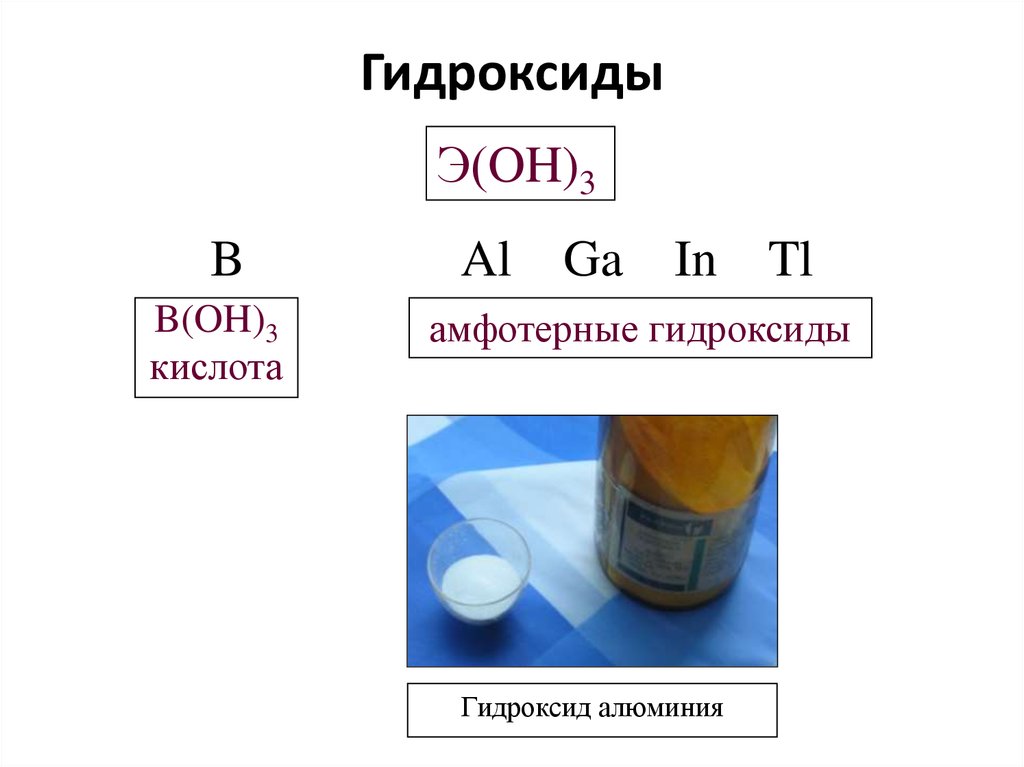 Чтобы увидеть это, можно, например, провести реакцию, в которой участвуют гидроксид алюминия, гидроксид натрия. Для ее проведения необходимо в пробирку засыпать немного опилок алюминия и залить небольшим количеством гидроксида натрия, не больше 3 миллилитров. Пробирку следует плотно закрыть пробкой, и начать медленный подогрев. После этого, закрепив пробирку на штативе, надо собрать выделенный водород в другую пробирку, предварительно надев ее на капиллярное приспособление. Примерно через минуту пробирку следует снять с капилляра и поднести к пламени. Если в пробирке собран чистый водород – горение будет происходить спокойно, в том же случае, если в нее попал воздух – произойдет хлопок.
Чтобы увидеть это, можно, например, провести реакцию, в которой участвуют гидроксид алюминия, гидроксид натрия. Для ее проведения необходимо в пробирку засыпать немного опилок алюминия и залить небольшим количеством гидроксида натрия, не больше 3 миллилитров. Пробирку следует плотно закрыть пробкой, и начать медленный подогрев. После этого, закрепив пробирку на штативе, надо собрать выделенный водород в другую пробирку, предварительно надев ее на капиллярное приспособление. Примерно через минуту пробирку следует снять с капилляра и поднести к пламени. Если в пробирке собран чистый водород – горение будет происходить спокойно, в том же случае, если в нее попал воздух – произойдет хлопок.
Получают гидроксид алюминия в лабораториях несколькими способами:
— путем реакции взаимодействия солей алюминия и щелочных растворов;
— способом разложения нитрида алюминия под воздействием воды;
— путем пропускания углерода через специальный гидрокомплекс, содержащий Al(ОН)4;
— воздействием гидрата аммиака на соли алюминия.
Промышленное получение связано с переработкой бокситов. Используются также технологии воздействия на алюминатные растворы карбонатами.
Применяется гидроокись алюминия в изготовлении минеральных удобрений, криолита, различных медицинских и фармакологических препаратов. В химическом производстве вещество используют для получения фтористого и сернистого алюминия. Незаменимо соединение при производстве бумаги, пластмасс, красок и много другого.
Медицинское применение обусловлено позитивным действием препаратов, содержащих данный элемент в лечении желудочных расстройств, повышенной кислотности организма, язвенных заболеваний.
При обращении с веществом, следует остерегаться вдыхания его паров, так как они вызывают сильное поражение легких. Будучи слабодействующим слабительным, опасно в больших дозах. При коррозии вызывает алюминоз.
Само вещество достаточно безопасно, так как не вступает в реакции с окислителями.
Что такое гидроксид алюминия, Cas No 21645-51-2 Руководство
Методы производства
Метод бикарбоната аммония сочетает серную кислоту с алюминиевым порошком или алюминиевой золой для получения сульфата алюминия, а затем подвергается двойной реакции разложения с аммонием. бикарбоната для получения гидроксида алюминия. Его 2Al(OH)3+3h3SO4→A12(SO4)3+6h3OA12(SO4)3+6Nh5HCO3→2AI(OH)3++3(Nh5)2SO4+6CO2↑Алюминат натрия едкий натр и зола алюминия до 2:1 реакцию проводят при соотношении выше 100°С с получением раствора алюмината натрия. Серную кислоту и золу алюминия подвергают взаимодействию в соотношении 1,25:1 при 110°С с получением раствора сульфата алюминия. Затем раствор алюмината натрия и раствор сульфата алюминия нейтрализуют до рН 6,5 с образованием осадка гидроксида алюминия, промывают водой и фильтруют под давлением, сушат при 70-80°С в течение 12 часов, а затем измельчают с получением готового продукта гидроксида алюминия. . A12O3+2NaOH→2NaAO2+h3OAl2O3+3h3SO4→A12(SO4)3+3h3O6NaAIO2+A12(SO4)3+12h3O→8Al(OH)3↓+3Na2SO4 метод восстановления После фильтрации и удаления примесей он реагирует с карбонатом натрия с образованием алюминия. гидроксид, который затем фильтруют, промывают и сушат с получением продукта гидроксида алюминия. Его 2A1C13+3Na2CO3+3h3O→2AI(OH)3↓+6NaCl+3CO2↑
бикарбоната для получения гидроксида алюминия. Его 2Al(OH)3+3h3SO4→A12(SO4)3+6h3OA12(SO4)3+6Nh5HCO3→2AI(OH)3++3(Nh5)2SO4+6CO2↑Алюминат натрия едкий натр и зола алюминия до 2:1 реакцию проводят при соотношении выше 100°С с получением раствора алюмината натрия. Серную кислоту и золу алюминия подвергают взаимодействию в соотношении 1,25:1 при 110°С с получением раствора сульфата алюминия. Затем раствор алюмината натрия и раствор сульфата алюминия нейтрализуют до рН 6,5 с образованием осадка гидроксида алюминия, промывают водой и фильтруют под давлением, сушат при 70-80°С в течение 12 часов, а затем измельчают с получением готового продукта гидроксида алюминия. . A12O3+2NaOH→2NaAO2+h3OAl2O3+3h3SO4→A12(SO4)3+3h3O6NaAIO2+A12(SO4)3+12h3O→8Al(OH)3↓+3Na2SO4 метод восстановления После фильтрации и удаления примесей он реагирует с карбонатом натрия с образованием алюминия. гидроксид, который затем фильтруют, промывают и сушат с получением продукта гидроксида алюминия. Его 2A1C13+3Na2CO3+3h3O→2AI(OH)3↓+6NaCl+3CO2↑
Применение
В основном используется в качестве активного лекарственного средства в антацидных составах, а также в производстве красок для озер, чернил, стекла, очистки сточных вод и антипиренов.
1. Химическое сырье
Гидроксид алюминия имеет много преимуществ, включая крупномасштабное производство, адекватное сырье, высокую чистоту продукта и хорошую растворимость в кислоте. Следовательно, гидроксид алюминия можно использовать в качестве важного сырья для получения солей алюминия, таких как алюминат бария, сульфат алюминия и так далее.
2. Антипирены
Порошок гидроксида алюминия обычно считается идеальным огнезащитным наполнителем для пластмасс, ненасыщенных полиэфиров, каучука и других органических полимеров из-за его наполняющих, огнезащитных и дымоудаляющих функций, а также нетоксичных свойств. Механизм огнестойкости гидроксида алюминия заключается в следующем: когда температура превышает 200 ℃, гидроксид алюминия начинает осуществлять эндотермическое разложение и выделяет три кристалла воды, а скорость его разложения достигает наибольшего значения при 250 ℃.
Эта реакция является сильной эндотермической реакцией, тем самым препятствуя повышению температуры полимера, снижая скорость его разложения и производя только водяной пар, не выделяя токсичных и вредных газов.
3. Керамика
Гидроксид алюминия может превращаться в оксид алюминия, обладающий высокой термической химической стабильностью, термической прочностью, сопротивлением ползучести и диэлектрическими свойствами, а также низким коэффициентом теплового расширения. Глинозем является важным материалом для синтеза керамики. В процессе синтеза керамики мы можем контролировать фазообразование композита путем активации гидроксида алюминия и управления процессом кристаллизации.
4. Очистка сточных вод
Гидроксид алюминия существует в воде в основном в форме Al(OH)4-, который может осаждать токсичные тяжелые металлы в сточных водах методом соосаждения для достижения эффекта очистки воды после дополнительной фильтрации. Гидроксид алюминия имеет большую удельную поверхность и может адсорбировать на своей поверхности коллоиды, взвешенные вещества, красители и органические вещества в сточных водах.
5. Медицина
Гидроксид алюминия может нейтрализовать желудочную кислоту и не токсичен, поэтому он всегда используется в качестве народной медицины для лечения желудка. Гидроксид алюминия в качестве адъюванта также может улучшить иммуногенность вакцины, механизм действия которой заключается в следующем: гидроксид алюминия адсорбирует антиген на своей поверхности, что позволяет антигену медленно высвобождаться, так что он может играть роль увеличения эффективности.
Гидроксид алюминия в качестве адъюванта также может улучшить иммуногенность вакцины, механизм действия которой заключается в следующем: гидроксид алюминия адсорбирует антиген на своей поверхности, что позволяет антигену медленно высвобождаться, так что он может играть роль увеличения эффективности.
6. Носитель катализатора
При получении гидроксида алюминия мы можем получать различные целевые продукты с различной площадью поверхности, объемом пор, структурой пор и кристаллической структурой, регулируя температуру, концентрацию и рН реагентов, которые можно эффективно использовать в качестве носитель катализатора для гидрирования ненасыщенных карбонильных соединений и получения фуллеренов и т.п.
7. Бумажная промышленность
Гидроксид алюминия имеет высокую белизну, ультратонкий размер частиц, а также полную кристаллическую форму и обладает сильной совместимостью с отбеливающим агентом. Гидроксид алюминия в качестве аддитивного покрытия и смолы может эффективно улучшить белизну, непрозрачность, гладкость и абсорбцию чернил мелованной бумагой. В основном используется в качестве активного лекарственного средства в антацидных препаратах, а также в производстве красок для озер, чернил, стекла, очистки сточных вод и антипиренов. гидроксид алюминия — неорганическое соединение, используемое для уменьшения прозрачности продукта. Он также используется разработчиками рецептур в качестве увлажнителя, а также для смягчения, разглаживания и защиты кожи. Кроме того, он помогает контролировать вязкость продукта. часто встречается в масках для лица и средствах для макияжа.
В основном используется в качестве активного лекарственного средства в антацидных препаратах, а также в производстве красок для озер, чернил, стекла, очистки сточных вод и антипиренов. гидроксид алюминия — неорганическое соединение, используемое для уменьшения прозрачности продукта. Он также используется разработчиками рецептур в качестве увлажнителя, а также для смягчения, разглаживания и защиты кожи. Кроме того, он помогает контролировать вязкость продукта. часто встречается в масках для лица и средствах для макияжа.
Гиббсайт
ГиббсайтМинерал Описание
Гиббсит представляет собой минерал гидроксида алюминия из группы оксидов и гидроксидов,
со структурной формулой [Al(OH) 3 ]. Структура Гиббсайта состоит
путем укладки октаэдрических листов гидроксида алюминия. Каждый слой состоит
октаэдрически (шестикратно) координированных катионов Al  Этот тип октаэдрической занятости
называется диоктаэдрическим.
Этот тип октаэдрической занятости
называется диоктаэдрическим.
Для аналогичных структур с двухвалентными катионами (например, брусит) каждый гидроксил связан с тремя катионами, и все октаэдрические позиции заполнены. Это называется триоктаэдрический минерал. Результатом такого расположения является нейтральный лист без превышение или дефицит заряда. Следовательно, межслойный заряд не удерживается. ионы между листами и прочно удерживать листы вместе. Листы удерживаются вместе только слабыми водородными и ван-дер-ваальсовыми связями, и это приводит к очень мягкий и легко раскалываемый минерал.
В нормальном гиббсите ионы гидроксила обращены друг к другу в последовательных слоях.
Слои слегка смещены для получения моноклинной симметрии. Незначительные замены
Fe 3+ для Al 3+ обычны в гиббсите. Кристаллы гиббсита
обычно очень маленькие (<2 мкм в диаметре), таблитчатые и часто слоистые,
показаны псевдогексагональные очертания. Иногда они могут быть зернистыми. Компактный
пластинчатые агрегаты или, реже, волокнистые массы, могут встречаться в виде завитков или сталактитов.
формы. Цвет может быть белым, серым, желтым, красным и коричневым, хотя большинство цветов
кроме белого или серого, обусловлены следами (гидр)оксидов железа.
Иногда они могут быть зернистыми. Компактный
пластинчатые агрегаты или, реже, волокнистые массы, могут встречаться в виде завитков или сталактитов.
формы. Цвет может быть белым, серым, желтым, красным и коричневым, хотя большинство цветов
кроме белого или серого, обусловлены следами (гидр)оксидов железа.
Выделение функций
Нажмите на кнопки ниже, чтобы выделить определенные функции.
Возникновение и использование
Гиббсит — вторичный минерал, в основном тропического и субтропического происхождения.
Бокситы являются основной алюминиевой рудой и обычно содержат большое количество
одного или нескольких из этих (гидр)оксидов Al. Месторождения бокситов встречаются во многих районах.
зоны тропиков и субтропиков.
Значение в почвенной среде
Гиббсит на сегодняшний день является наиболее распространенным кристаллическим (гидр)оксидом алюминия в почвенной среде.
Это основной минерал в почвах тропиков и субтропиков, где он может быть
преобладающий минерал в глинистой фракции. Почвы могли образоваться в условиях интенсивного
выветривания из различных исходных материалов, либо изверженных, метаморфических
или осадочного происхождения. Он также может существовать в менее выветренных почвах, где он
был унаследован от исходных материалов, и его содержание обычно умирает, с
сопутствующее увеличение количества глинистых минералов, таких как каолинит.
