Реакция хлорид натрия и соляная кислота
Известен в быту под названием поваренной соли , основным компонентом которой и является. Хлорид натрия в значительном количестве содержится в морской воде , придавая ей солёный вкус [ источник не указан дней ]. Встречается в природе в виде минерала галита каменной соли. Чистый хлорид натрия представляет собой бесцветные кристаллы, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Поиск данных по Вашему запросу:
Схемы, справочники, даташиты:
Прайс-листы, цены:
Обсуждения, статьи, мануалы:
Дождитесь окончания поиска во всех базах.
По завершению появится ссылка для доступа к найденным материалам.
Содержание:
- Занимательные опыты
- § 4.
Хлороводород. Соляная кислота и хлориды
Карбонат натрия и соляная кислота уравнение реакции - Диоксид хлора — DIOX-A 10 Технология кислота-хлорит
- Реакция взаимодействия хлорида натрия и серной кислоты
- Хлорид натрия
ПОСМОТРИТЕ ВИДЕО ПО ТЕМЕ: 30. Взаимодействие соляной кислоты с раствором хлорида натрия
Занимательные опыты
Сорокин В. Задачи химических олимпиад. Решение качественных задач по определению веществ, находящихся в склянках без этикеток, предполагает проведение ряда операций, по результатам которых можно определить, какое вещество находится в той или иной склянке.
Для записи мысленного эксперимента используется специальная таблица-матрица, в ней обозначены формулы определяемых веществ по горизонтали и вертикали. В местах пересечения формул взаимодействующих веществ записываются предполагаемые результаты наблюдений: — выделение газа, — выпадение осадка, указываются изменения цвета, запаха или отсутствие видимых изменений.
Если по условию задачи возможно применение дополнительных реактивов, то результаты их использования лучше записать перед составлением таблицы — число определяемых веществ в таблице может быть таким образом сокращено. Решение задачи будет, следовательно, состоять из следующих этапов: — предварительное обсуждение отдельных реакций и внешних характеристик веществ; — запись формул и предполагаемых результатов попарных реакций в таблицу, — проведение эксперимента в соответствии с таблицей в случае экспериментальной задачи ; — анализ результатов реакций и соотнесение их с конкретными веществами; — формулировка ответа задачи.
Необходимо подчеркнуть, что мысленный эксперимент и реальность не всегда полностью совпадают, так как реальные реакции осуществляются при определенных концентрации, температуре, освещении например, при электрическом свете AgCl и AgBr идентичны. Мысленный эксперимент часто не учитывает многих мелочей. Реальная ситуация не всегда согласуется с теоретическим прогнозом, и в этой главе таблицы-матрицы»идеала» и «реальности» иногда будут отличаться. А чтобы разбираться в том, что же происходит на самом деле, ищите всякую возможность работать руками экспериментально на уроке или факультативе помните при этом о требованиях техники безопасности.
Пример 1. В пронумерованных склянках содержатся растворы следующих веществ: нитрата серебра, соляной кислоты, сульфата серебра, нитрата свинца, аммиака и гидроксида натрия.
Не используя других реактивов, определите, в какой склянке раствор какого вещества находится. Для решения задачи составим таблицу-матрицу, в которую будем заносить в соответствующие квадратики ниже пересекающей ее диагонали данные наблюдения результатов сливания веществ одних пробирок с другими. Наблюдение результатов последовательного приливания содержимого одних пронумерованных пробирок ко всем другим:.
Наблюдение результатов последовательного приливания содержимого одних пронумерованных пробирок ко всем другим:.
Запишем далее уравнения протекающих реакций в тех случаях, когда наблюдаются изменения в реакционной системе выделение газа, осадка, изменение цвета и занесем формулу наблюдаемого вещества и соответствующий квадратик таблицы-матрицы выше пересекающей ее диагонали:.
Таким образом, на основании пяти опытов различаем вещества, находящиеся в пронумерованных пробирках. Пример 2. В восьми пронумерованных пробирках от 1 до 8 без надписей содержатся сухие вещества: нитрат серебра 1 , хлорид алюминия 2 , сульфид натрия 3 , хлорид бария 4 , нитрат калия 5 , фосфат калия 6 , а также растворы серной 7 и соляной 8 кислот.
Как, не имея никаких дополнительных реактивов, кроме воды, различить эти вещества? Прежде всего растворим твердые вещества в воде и отметим пробирки, где они оказались.
Составим таблицу-матрицу как в предыдущем примере , в которую будем заносить данные наблюдения результатов сливания веществ одних пробирок с другими ниже и выше пересекающей ее диагонали. В правой части таблицы введем дополнительную графу»общий результат наблюдения», которую заполним после окончания всех опытов и суммирования итогов наблюдений по горизонтали слева направо см. По тому, сколько раз выпадает осадок и выделяется газ, однозначно определяются все реагенты.
В правой части таблицы введем дополнительную графу»общий результат наблюдения», которую заполним после окончания всех опытов и суммирования итогов наблюдений по горизонтали слева направо см. По тому, сколько раз выпадает осадок и выделяется газ, однозначно определяются все реагенты.
В данной задаче решение может быть более простым — любой из растворов кислот позволяет сразу выделить сульфид натрия, им определяются нитрат серебра и хлорид алюминия.
Нитратом серебра определяются среди оставшихся трех твердых веществ хлорид бария и фосфат калия, хлоридом бария различают соляную и серную кислоты. Пример 3. В четырех пробирках без этикеток находятся бензол, хлоргексан, гексан и гексен.
Используя минимальные количества и число реактивов, предложите метод определения каждого из указанных веществ. Определяемые вещества между собой не реагируют, таблицу попарных реакций нет смысла составлять.
Существует несколько методов определения данных веществ, ниже приведен один из них.
Бензол отличается от гексана по замерзанию в ледяной воде у С 6 Н 6 т. В два одинаковых химических стакана налиты равные объемы: в один воды, в другой — разбавленного раствора серной кислоты. Как, не имея под рукой никаких химических реактивов, различить эти жидкости пробовать растворы на вкус нельзя?
Как распознать эти вещества, используя только один химический реактив? Распознавание по внешнему виду исключается. В четырех пронумерованных пробирках находятся сухие оксид меди II , сажа, хлорид натрия и хлорид бария.
Как, пользуясь минимальным количеством реактивов, определить, в какой из пробирок находится какое вещество? Ответ обоснуйте и подтвердите уравнениями соответствующих химических реакций.
Как можно определить содержимое каждой пробирки, если имеется только набор пустых пробирок, вода и горелка? Предложите план анализа. В четырех пробирках без надписей находятся водные растворы гидроксида натрия, соляной кислоты, поташа и сульфата алюминия. Предложите способ определения содержимого каждой пробирки, не применяя дополнительных реактивов.
В пронумерованных пробирках находятся растворы гидроксида натрия, серной кислоты, сульфата натрия и фенолфталеин. Как различить эти растворы, не пользуясь дополнительными реактивами? В банках без этикеток находятся следующие индивидуальные вещества: порошки железа, цинка, карбоната кальция, карбоната калия, сульфата натрия, хлорида натрия, нитрата натрия, а также растворы гидроксида натрия и гидроксида бария.
В Вашем распоряжении нет никаких других химических реактивов, в том числе и воды.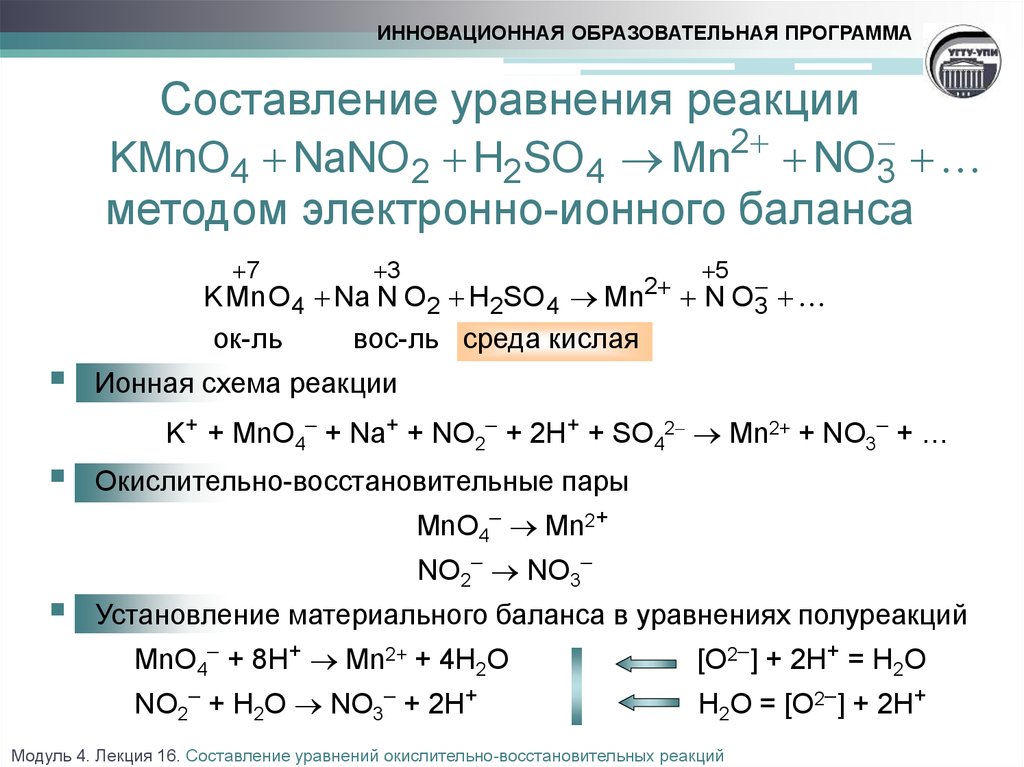 Составьте план определения содержимого каждой банки. В четырех пронумерованных банках без этикеток находятся твердые оксид фосфора V 1 , оксид кальция 2 , нитрат свинца 3 , хлорид кальция 4.
Составьте план определения содержимого каждой банки. В четырех пронумерованных банках без этикеток находятся твердые оксид фосфора V 1 , оксид кальция 2 , нитрат свинца 3 , хлорид кальция 4.
Определить, в какой из банок находится каждое из указанных соединений, если известно, что вещества 1 и 2 бурно реагируют с водой, а вещества 3 и 4 растворяются в воде, причем полученные растворы 1 и 3 могут реагировать со всеми остальными растворами с образованием осадков. В пяти пробирках без этикеток находятся растворы гидроксида, сульфида, хлорида, йодида натрия и аммиака. Как определить эти вещества при помощи одного дополнительного реактива?
Приведите уравнения химических реакций. Как распознать растворы хлорида натрия, хлорида аммония, гидроксида бария, гидроксида натрия, находящиеся в сосудах без этикеток, используя лишь эти растворы? В восьми пронумерованных пробирках находятся водные растворы соляной кислоты, гидроксида натрия, сульфата натрия, карбоната натрия, хлорида аммония, нитрата свинца, хлорида бария, нитрата серебра.
Используя индикаторную бумагу и проводя любые реакции между растворами в пробирках, установить, какое вещество содержится в каждой из них. В двух пробирках имеются растворы гидроксида натрия и сульфата алюминия.
Как их различить, по возможности, без использования дополнительных веществ, имея только одну пустую пробирку или даже без нее? В пяти пронумерованных пробирках находятся растворы перманганата калия, сульфида натрия, бромная вода, толуол и бензол.
Как, используя только названные реактивы, различить их? Используйте для обнаружения каждого из пяти веществ их характерные признаки укажите их ; дайте план проведения анализа. Напишите схемы необходимых реакций.
В шести склянках без наименований находятся глицерин, водный раствор глюкозы, масляный альдегид бутаналь , гексен-1, водный раствор ацетата натрия и 1,2-дихлорэтан. Имея в качестве дополнительных химических реактивов только безводные гидроксид натрия и сульфат меди, определите, что находится в каждой склянке. Для определения воды и серной кислоты можно использовать различие в физических свойствах: температурах кипения и замерзания, плотности, электропроводности, показателе преломления и т.
Для определения воды и серной кислоты можно использовать различие в физических свойствах: температурах кипения и замерзания, плотности, электропроводности, показателе преломления и т.
Самое сильное различие будет в электропроводности. Прильем к порошкам в пробирках соляную кислоту. Серебро не прореагирует. Единственным реактивом может быть, например, разбавленная серная кислота H 2 SO 4 :. С сажей и NaCl разбавленная серная кислота не взаимодействует. Составим таблицу попарных взаимодействий указанных реагентов. Исходя из представленной таблицы по числу выпадения осадка и выделения газа можно определить все вещества.
Попарно смешивают все растворы Пара растворов, дающая малиновую окраску, — NaOH и фенолфталеин Малиновый раствор прибавляют в две оставшиеся пробирки. Там, где окраска исчезает, — серная кислота, в другой — сульфат натрия.
Остается различить NaOH и фенолфталеин пробирки 1 и 2. Из пробирки 1 прибавляют каплю раствора к большому количеству раствора 2. Из пробирки 2 — каплю раствора прибавляют к большому количеству раствора 1. В обоих случаях— малиновое окрашивание. К растворам А и Б прибавляют по 2 капли раствора серной кислоты. Там, где окраска исчезает, содержалась капля NaOH. Если окраска исчезает в растворе А, то NaOH — в пробирке 1.
В обоих случаях— малиновое окрашивание. К растворам А и Б прибавляют по 2 капли раствора серной кислоты. Там, где окраска исчезает, содержалась капля NaOH. Если окраска исчезает в растворе А, то NaOH — в пробирке 1.
Растворы могут реагировать друг с другом следующим образом:. Раствор 3 — Pb NO 3 2 также образует осадки со всеми другими растворами. В общем случае выпадение большинства осадков будет зависеть от порядка сливания растворов и избытка одного из них в большом избытке Н 3 РО 4 фосфаты свинца и кальция растворимы.
Задача имеет несколько решений, два из которых приведены ниже. Для распознавания этих веществ следует провести реакции всех растворов друг с другом:. Составляем таблицу:. В пустую пробирку наливают один из растворов и приливают каплю другого. С л у ч а й п е р в ы й : образовался осадок и сразу растворился, или вовсе не образовался:. С л у ч а й в т о р о й : осадок образовался и не растворился. По цвету определяют КМпО 4 розово-фиолетовый и бромную воду желтая или красно-бурая.
Оставшееся вещество — бензол. Прибавим последовательно сульфат меди и избыток гидроксида натрия ко всем веществам. С гексеном-1, ацетатом натрия, 1,2-дихлорэтаном реакция идти не будет, но в водном растворе ацетата натрия сульфат меди растворится.
§ 4. Хлороводород. Соляная кислота и хлориды
Реакции ионного обмена идут до конца, если: выпадает осадок, выделяется газ, образуется вода. Не забывайте при написании уравнений в ионном виде проверять все вещества на растворимость. Нерастворимые вещества на ионы не раскладывают. Реакция между какой парой веществ сопровождается одновременным выпадением осадка и образованием воды? Реакция между какой парой веществ сопровождается одновременным выделением газа и образованием воды? Какая пара ионов не может одновременно присутствовать в растворе?
Реакция взаимодействия между веществами карбонат натрия и соляная кислота уравнение реакции, которой имеет следующий вид (см. ниже).
Карбонат натрия и соляная кислота уравнение реакции
Соляная кислота хлористоводородная кислота — водный раствор хлористого водорода HCl, представляет собой прозрачную бесцветную жидкость с острым запахом хлористого водорода. Техническая кислота имеет желтовато-зеленый цвет из-за примесей хлора и солей железа. Концентрированная кислота на воздухе «дымит», так как выделяющийся газообразный HCl образует с водяным паром мельчайшие капельки соляной кислоты. Соляная кислота не горюча, не взрывоопасна. Она является одной из самых сильных кислот , растворяет с выделением водорода и образованием солей — хлоридов все металлы, стоящие в ряду напряжений до водорода. Хлориды образуются и при взаимодействии соляной кислоты с окислами и гидроокисями металлов. С сильными окислителями она ведет себя как восстановитель. Соли соляной кислоты — хлориды, за исключением AgCl, Hg2Cl2, хорошо растворимы в воде. К ней устойчивы стекло, керамика, фарфор, графит, фторопласт. Получают соляную кислоту растворением в воде хлористого водорода, который синтезируют или непосредственно из водорода и хлора или получают действием серной кислоты на хлорид натрия.
Техническая кислота имеет желтовато-зеленый цвет из-за примесей хлора и солей железа. Концентрированная кислота на воздухе «дымит», так как выделяющийся газообразный HCl образует с водяным паром мельчайшие капельки соляной кислоты. Соляная кислота не горюча, не взрывоопасна. Она является одной из самых сильных кислот , растворяет с выделением водорода и образованием солей — хлоридов все металлы, стоящие в ряду напряжений до водорода. Хлориды образуются и при взаимодействии соляной кислоты с окислами и гидроокисями металлов. С сильными окислителями она ведет себя как восстановитель. Соли соляной кислоты — хлориды, за исключением AgCl, Hg2Cl2, хорошо растворимы в воде. К ней устойчивы стекло, керамика, фарфор, графит, фторопласт. Получают соляную кислоту растворением в воде хлористого водорода, который синтезируют или непосредственно из водорода и хлора или получают действием серной кислоты на хлорид натрия.
Диоксид хлора — DIOX-A 10 Технология кислота-хлорит
Рабочая инструкция к уроку «Хлороводород. Составьте структурную и электронную формулы хлороводорода. Вычислите относительную плотность хлороводорода по воздуху. Определите тип связи. Результаты занесите в таблицу.
Составьте структурную и электронную формулы хлороводорода. Вычислите относительную плотность хлороводорода по воздуху. Определите тип связи. Результаты занесите в таблицу.
Разделы: Химия. Выработка знаний, умений и навыков, необходимых для изучения данной темы, начинается с ответа на вопросы о свойствах ионов, об отличии в строении атомов и образованных ими ионов.
Реакция взаимодействия хлорида натрия и серной кислоты
Метиламин реагирует с хлорметаном реакция алкилирования с образованием диметиламина:. Метиламин взаимодействует с соляной кислотой с образованием соли:. Диметиламин взаимодействует с соляной кислотой с образованием соли:. Диметиламин реагирует с бромметаном реакция алкилирования с образованием триметиламина:. Пропиламин реагирует с серной кислотой с образованием соли:. Глицин аминоуксусная кислота взаимодействует с гидроксидом натрия с образованием глицината натрия натриевой соли аминоуксусной кислоты :.
Хлорид натрия
Отвечая на вопросы любознательных учеников, зарабатывай баллы, которые можно потратить на подарок себе или другу! Ответ или решение 1 Полякова Наталия. Реакция между кислотой и солью идет до конца, если в ее результате выпадает осадок, образуется вода или газ. Реакции между соляной кислотой и сульфатом натрия, хлоридом натрия и нитратом натрия не происходят, так как это соли сильных кислот и все продукты их взаимодействия будут растворимы. Соляная кислота сильнее карбонатной и вытесняет ее из соли — карбоната натрия. Спасибо 0. Знаешь ответ?
Реакция между кислотой и солью идет до конца, если в ее результате выпадает осадок, образуется вода или газ. Реакции между соляной кислотой и сульфатом натрия, хлоридом натрия и нитратом натрия не происходят, так как это соли сильных кислот и все продукты их взаимодействия будут растворимы. Соляная кислота сильнее карбонатной и вытесняет ее из соли — карбоната натрия. Спасибо 0. Знаешь ответ?
Гидрокарбонат аммония и хлорид натрия в своей реакции образуют осадок в виде пищевой соды. Карбонат натрия в реакции с соляной кислотой.
С уверенностью можно сказать, что, по крайней мере, одно химическое соединение в довольно чистом виде имеется в каждом доме, в каждой семье. Это — поваренная соль или как ее называют химики — хлорид натрия NaCl. Известно, что, уходя из таежного приюта, для случайных путников охотники непременно оставляют спички и соль. Поваренная соль совершенно необходима для жизнедеятельности организма человека и животных.
Хлорид натрия известен в быту под названием поваренной соли , основным компонентом которой он является. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита каменная соль. Чистый хлорид натрия имеет вид бесцветных кристаллов, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита каменная соль. Чистый хлорид натрия имеет вид бесцветных кристаллов, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
В бутылочку из-под вина лучше шампанского кладут несколько кусочков мрамора или мела, приливают разведенной соляной кислоты и закрывают пробкой не слишком туго. В целях предосторожности бутылочку заворачивают в полотенце.
Содержание статьи Физические свойства Реакции взаимодействия карбоната натрия Применение кальцинированной соды Производители и стоимость. Карбонат натрия производиться в виде белого порошкообразного вещества. В простонародье это вещество называют кальцинированной содой, в международном производстве применяют название Sodium carbonate. Соду использовали еще в древних временах, первыми ее нашли египтяне. Они использовали ее для мытья посуды и для производства стекольных изделий. Зачастую ее находили в соляных пластах, которые находились под землей.
Зачастую ее находили в соляных пластах, которые находились под землей.
Соли соляной кислоты называются хлоридами. В году британский химик Гемфри Дэви получил хлороводород из водорода и хлора, таким образом установив его состав. Возникновение промышленного производства соляной кислоты связано с технологией получения карбоната натрия : на первой стадии этого процесса поваренную соль вводили в реакцию с серной кислотой, в результате чего выделялся хлороводород.
неорганическая химия — Разница между бикарбонатом натрия и карбонатом натрия, реагирующими с HCl
Задать вопрос
спросил
Изменено 4 года, 7 месяцев назад
Просмотрено 2к раз
$\begingroup$
В лаборатории мы выполнили процесс Solvay, где нам нужно было произвести карбонат натрия в качестве конечного продукта. Есть определенный шаг, когда мы помещаем что-то в печь, и после этого мы ожидаем, что продукт будет бикарбонатом натрия ($\ce{NaHCO3}$). Этот продукт не упоминается в инструкциях; его просто называют «сухим продуктом». После этого шага нас просили добавить 2 капли $\ce{HCl}$ к небольшому количеству сухого продукта в часовом стекле. Наконец, мы должны повторить шаг с часовым стеклом, используя $\ce{NaHCO3}$ и $\ce{Na2CO3}$.
Есть определенный шаг, когда мы помещаем что-то в печь, и после этого мы ожидаем, что продукт будет бикарбонатом натрия ($\ce{NaHCO3}$). Этот продукт не упоминается в инструкциях; его просто называют «сухим продуктом». После этого шага нас просили добавить 2 капли $\ce{HCl}$ к небольшому количеству сухого продукта в часовом стекле. Наконец, мы должны повторить шаг с часовым стеклом, используя $\ce{NaHCO3}$ и $\ce{Na2CO3}$.
Проведя эти 3 эксперимента, я заметил одно и то же (пузыри). Я думаю, что реакции были такими:
$$\ce{NaHCO3 + HCl -> NaCl + CO2 + h3O}$$
и для третьей (т.к. я добавлял $\ce{HCl}$ по каплям в $ \ce{Na2CO3}$, $\ce{Na2CO3}$ было в избытке):
$$\ce{Na2CO3 + HCl -> NaHCO3 + NaCl}$$
и далее:
$$\ce{Na2CO3 + HCl -> NaCl + CO2 + h3O}$$
Я считаю, что целью трех экспериментов было определить, что сухой продукт представляет собой $\ce{NaHCO3}$, но после добавления $\ce{HCl}$ я наблюдали абсолютно одно и то же (пузырьки) для обоих известных реагентов. Поэтому я в замешательстве относительно того, каким должен быть мой ответ.
Поэтому я в замешательстве относительно того, каким должен быть мой ответ.
- неорганическая химия
- кислотно-основная
$\endgroup$
2
$\begingroup$
Мне кажется, что целью 3 опытов с HCl была не идентификация сухого продукта. Вы можете просто написать реакции, которые вы наблюдали, в этом, наверное, и был смысл.
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
What, How to Balance & FAQs – Lambda Geeks
Процесс превращения реагентов в два или более различных продукта называется химической реакцией. Давайте подробно рассмотрим, как HCl реагирует с NaHCO 9.0073 3 .
Хлористый водород классифицируется как сильная кислота, которая при реакции с бикарбонатом натрия, который на самом деле является слабым основанием, будет выделять соль и воду. Бикарбонат натрия ( NaHCO 3 ) представляет собой кристаллическое твердое вещество с моноклинной кристаллической структурой, но естественным образом выходит в виде порошка.
Мы подробно обсудим важные механизмы реакции, такие как окислительно-восстановительный потенциал, осаждение, тип реакции, межмолекулярные силы, уравновешивание химического уравнения и т. д.
Что является продуктом HCl и NaHCO 3 HCl и NaHCO 3 реагируют с образованием хлорида натрия (NaCl), двуокиси углерода (CO 2 ) и воды (3 H 2 2 900 выпущен. Химическое уравнение реакции выглядит следующим образом;
Химическое уравнение реакции выглядит следующим образом;
HCl + NaHCO 3 = NaCl + H 2 O + CO 2 .
Тип реакции HCl и NaHCO 3HCl + NaHCO 3 представляет собой реакцию нейтрализации, в которой кислота (HCl) и основание (NaHCO 3 ) реагируют с образованием соли и воды .
HCl (водн.) + NaHCO 3 (водн.) = NaCl (водн.) + H 2 O (л) + CO 2 (г)
Как сбалансировать HCl и NaHCO 3Ниже приведены шаги, необходимые для балансировки химического уравнения:
- Шаг 1: Напишите общее химическое уравнение:
- HCl + NaHCO 3 = NaCl + H 2 O + CO 2 .
- Шаг 2: Теперь, как мы видим, атомы на стороне реагента такие же, как и на стороне продукта.

- Поэтому нет необходимости балансировать данное химическое уравнение, так как оно уже сбалансировано.
NaHCO 3 концентрация NaHCO титруется относительно Na неизвестна0073 3 в данном растворе. Следующие этапы включают титрование HCl и NaHCO 3 .
Apparatus Used:We need,
- Burette
- Burette holder
- Beaker
- Conical flask
- Volumetric flask
Лучшим индикатором рассматриваемого титрования является Метилоранж.
Процедура:- Промойте, ополосните и заполните бюретку раствором NaHCO 3 и запишите начальное показание бюретки.

- Пипеткой отберите 10 мл раствора HCl и перенесите его в промытую колбу для титрования.
- Добавьте 2-3 капли индикатора метилового оранжевого в колбу для титрования.
- Теперь начните добавлять по каплям раствор бикарбоната натрия в колбу для титрования, пока цвет не станет светло-розовым.
- Запишите окончательные показания бюретки и найдите объем раствора бикарбоната натрия, использованного для нейтрализации раствора HCl.
- Повторите эксперимент, чтобы получить больше показаний.
- Неизвестную концентрацию можно найти по формуле S 1 V 1 = S 2 V 2 .
результирующее ионное уравнение:
HCO 3 — (AQ. ) + H + (AQ.) = CO 2 (G) + H 2 O (L)
) + H + (AQ.) = CO 2 (G) + H 2 O (L)
7777777777. и (L)
777777777777777. и
77777777777777777777777777777. и
77777777777777777777777777777777777.
3 сопряженная параВ этой реакции
HCl (водн.) + NaHCO 3 (водн.) = NaCl (водн.) + 7 O 4 CO 29073 H 2 (ж)
- Конъюгированная пара HCl = Cl –
- Conjugate pair of H 2 O = OH –
- Conjugate pair of NaHCO 3 = HCO 3 –
- There is no conjugate pair available for NaCl
Межмолекулярные силы в данной реакции перечислены следующим образом-
HCl0073 3 (aq.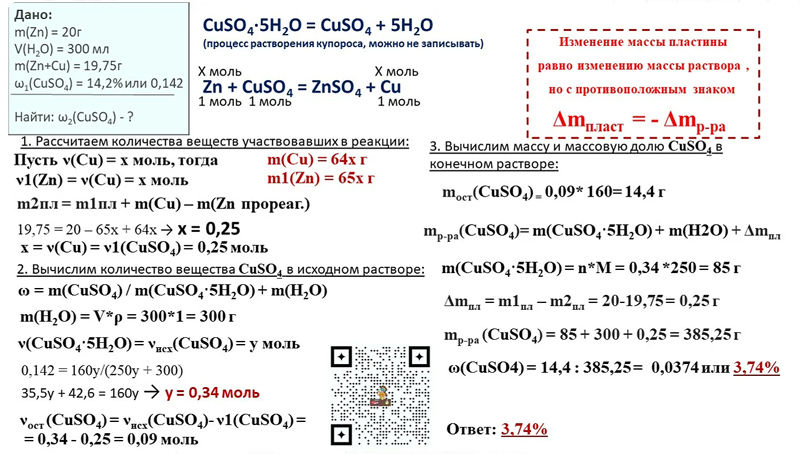 ) = NaCl (aq.) + H 2 O (L) + CO 2 (G)
) = NaCl (aq.) + H 2 O (L) + CO 2 (G)

 Хлороводород. Соляная кислота и хлориды
Хлороводород. Соляная кислота и хлориды


