NaHCO3 + HCl = ? уравнение реакции
В результате растворения навески гидрокарбоната натрия в соляной кислоте (NaHCO3 + HCl = ?) произошло образование средней соли – хлорида натрия и воды, а также выделение углекислого газа. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что газообразные вещества и вода на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Переходим к решению задачи. Первоначально рассчитаем количество молей веществ, вступивших в реакцию (; ):
Это означает, что соляная кислота находится в избытке и дальнейшие расчеты производим по гидрокарбонату натрия.
Согласно уравнению реакции
значит
Тогда масса хлорида натрия будет равна (молярная масса – 58,5 g/mole):
Согласно уравнению реакции
значит
Тогда объем выделившегося углекислого газа будет равен:
ru.solverbook.com
Сода. NaHCO3. Бикарбонат натрия. Натрий двууглекислый. Питьевая сода.
Сода. NaHCO3. Бикарбонат натрия. Натрий двууглекислый. Питьевая сода.
Здесь все собрано из институтских тетрадей и то, что я выписывала для себя из интернета.
Гидрокарбонат натрия NaHCO3, Сода или по другому: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый — это соль, да не просто!, а кислая натриевая соль угольной кислоты (H2CO3 слабая двухосновная кислота).
Соль впервые описана в 1801 немецким аптекарем Б. Розе
В соответствии с основностью угольная кислота даёт два ряда солей: средние — карбонаты с анионом CO32- (водные растворы имеют !сильнощелочную реакцию) и кислые — гидрокарбонаты с анионом HCO3— — (водные растворы имеют !!слабощелочную реакцию).
Здесь нужно учитывать все параметры, и связи, и плотность, и т.п.
Стабильность гидрокарбонатов растет при переходе от Na+ к Cs+. Ионы НСО3— обычно объединяются водородными связями с образованием цепочек.
NaHCO3 — плотность 2,16—2,22 г/см3. При нагревании около 50 °С начинает отщепляться 002, а при 100—150 °С полностью разлагается, превращаясь в Na2CO3.
Мы растворяем соду в воде, опять –если вода до 50 °С, действие одно, это гидролиз соли: обратимое взаимодействие соли с водой, приводящее к образованию слабого электролита, а от 80-150 °С получается уже Na2CO3.
Вода хотя и в малой степени, но диссоциирует:
H2O H+ + OH–.
Когда концентрации ионов H+ и гидроксид-ионов OH– равны между собой, [H+] = [OH–], то среда нейтральная, если [H+] > [OH–] – среда кислая, если [Н+] < [ОН–] – среда щелочная.
Гидрокарбонат натрия реагирует с соляной кислотой, с образованием соли и угольной кислоты. Угольная кислота очень слабая, крайне неустойчивое соединение, поэтому оно тут же распадается на углекислый газ и воду:
NaHCO3 + HCl → NaCl + H2CO3
H2CO3 → H2O + CO2↑
Так происходит, если мы соду растворили в теплой воде (до 50 градусов)
А если растворяем соду в горячей воде, то уже образуется карбонат натрия, и в этом случае, водный раствор имеет уже сильнощелочную реакцию. Гидролиз.
Температура. Поскольку реакция гидролиза эндотермическая, то повышение температуры смещает равновесие в системе вправо, степень гидролиза возрастает.
Концентрация соли. равновесие в системе смещается вправо, в соответствии с принципом Ле Шателье, но степень гидролиза уменьшается. Понять это поможет константа равновесия.
Добавки посторонних веществ могут влиять на положение равновесия в том случае, когда эти вещества реагируют с одним из участников реакции.
Степень гидролиза можно увеличить, и , например, чтобы сделать щелочной моющий раствор бельевой соды более активным, мы его нагреваем – степень гидролиза карбоната натрия при этом возрастает.
Сода относится к антацидам. Взаимодействуя с соляной кислотой, сода устраивает в желудке «химлабораторию». В итоге вырабатывается уг-лекислый газ, «нападающий» на стенки желудка. Защищаясь, желудок вырабатывает новую дозу сока и соляной кислоты — на это требуется 20 минут.
Современные исследования
В организме роль соды заключается в нейтрализации кислот, повышении щелочных резервов организма в поддержании в норме кислотно-щелочного равновесия.
У человека показатель кислотности pH крови должен находиться в норме в пределах 7,35-7,47. Если pH меньше 6,8 (очень кислая кровь, сильнейший ацидоз), то наступает смерть организма.
Причинами ацидоза являются яды в пище, воде и воздухе, лекарства, пестициды. Большое самоотравление людей психическими ядами происходит от страха, беспокойства, раздражения, недовольства, зависти, злобы, ненависти, которые сейчас очень усилены благодаря нарастающим волнам Космического Огня. При потере психической энергии почки не могут удерживать в крови высокую концентрацию соды, которая при этом теряется вместе с мочой. Это другая причина ацидоза: потеря психической энергии ведет к потере щелочей (соды).
Сода, уничтожая ацидоз, повышает щелочные резервы организма, сдвигает кислотно-щелочное равновесие в щелочную сторону (pH примерно 1,45 и выше). В щелочном организме происходит активация воды, т.е. диссоциация ее на ионы Н+ и OH- за счет аминных щелочей, аминокислот, белков, ферментов, нуклеотидов РНК и ДНК. В активированной воде, насыщенной огненной энергией организма, улучшаются все биохимические процессы: ускоряется синтез белка, быстрее обезвреживаются яды, активнее работают ферменты и аминные витамины, лучше действуют аминные лекарства, имеющие огненную природу и биологически активные вещества.
Здоровый организм для пищеварения вырабатывает сильно щелочные пищеварительные соки. Пищеварение в двенадцатиперстной кишке происходит в щелочной среде под действием соков: панкреатический сок, желчь, сок бруттнеровой железы и сок слизистой оболочки двенадцатиперстной кишки. Все соки имеют высокую щелочность. Панкреатический сок имеет pH=7,8-9,0. Ферменты панкреатического сока действуют только в щелочной среде. Желчь в норме имеет щелочную реакцию pH=7,50-8,50. Секрет толстого кишечника имеет сильно щелочную среду pH=8,9-9,0. При сильном ацидозе желчь становится кислой pH=6,6-6,9 вместо нормы pH=7,5-8,5. Это ухудшает пищеварение, что приводит к отравлению организма продуктами плохого пищеварения, образованию камней в печени, желчном пузыре, кишечнике и почках. В кислой среде спокойно живут глисты опистархоза, острицы, аскариды, цепни и др. В щелочной среде они гибнут. В кислом организме слюна кислая pH=5,7-6,7, что приводит к медленному разрушению эмали зубов. В щелочном организме слюна щелочная: pH=7,2-7,9 и зубы не разрушаются.
Сода, нейтрализуя избыточные кислоты, повышает щелочные резервы организма, делает мочу щелочной, что облегчает работу почек (сберегает психическую энергию), сберегает глутаминовую аминокислоту, предотвращает отложение камней в почках.
Замечательным свойством соды является то, что избыток её легко выводится почками, давая щелочную реакцию мочи
В щелочной среде с активированной водой многократно возрастает биохимическая активность аминных витаминов: В1 (тиамин, кокарбоксилаза), В4 (холин), В5 или РР (никотиномид), В6 (пиридоксаль), В12 (кобимамид). Витамины, имеющие огненную природу могут полностью проявлять её только в щелочной среде.
Для улучшения всасывания соды из кишечника её принимают с горячим молоком. В кишечнике сода реагирует с аминокислотами молока, образуя щелочные натриевые соли аминокислот, которые легче, чем сода всасываются в кровь, повышая щелочные резервы организма.
Для борьбы с аскаридами и острицами применяют аминную щёлочь пиперазин, дополняя его клизмами соды . Сода применяется при отравлении метанолом, этиловым спиртом, формальдегидом, карбофосом, хлорофосом, белым фосфором, фосфином, фтором, йодом, ртутью и свинцом, для отвыкания от курения: полоскание рта густым раствором соды или обмазывание полости рта содой со слюной: сода кладётся на язык, растворяется в слюне и вызывает отвращение к табаку при курении. Дозы малые, чтобы не нарушать пищеварения.
В письме от 1 января 1935 г. Е.И. Рерих писала: “Вообще Владыка очень советует всем приучаться принимать соду два раза в день. Это изумительное предохранительное средство от многих тяжких заболеваний, в частности, от рака” (Письма Елены Рерих, т. 3, с. 74). 4 января 1935г.: “Я принимаю её ежедневно, иногда при сильном напряжении, до восьми раз в день по кофейной ложке. Причём я просто высыпаю её на язык и запиваю водой. Также замечательно хорошо действует при всех простудах и напряжениях центров горячее, но не прокипяченное молоко с содой” (Письма, т. 3, с 75). «Хорошо и деткам давать соду в горячем молоке» (П6, 20, 1). 18 июля 1935 г.: “Затем советую вам ежедневно принимать два раза в день двууглекислую соду. При болях в подложечке (напряжение в солнечном сплетении) приемы соды незаменимы. Да и вообще, сода – самое благодетельное средство, она предохраняет от всевозможных заболеваний, начиная от рака, но нужно приучить себя принимать её ежедневно без пропусков…Также при ломоте и горении в горле незаменимо горячее молоко, но не вскипевшее, а также с содою. Обычная пропорция кофейная ложка на стакан. Очень советуйте всем соду. Также наблюдайте, чтобы желудок не был обременен, и кишечник чист” (П, 18.06.35).
«Для ослабления диабета принимают соду…молоко с содою всегда хорошо…» (МО3, 536).
«Явление переполнения психической энергией вызывает многие симптомы как в конечностях, так в горле и желудке. Сода полезна, чтобы вызвать разряжение, также горячее молоко…» (С, 88).
«При раздражении и волнении Советую молоко во всех видах, как обычное противоядие. Сода укрепляет действие молока» (С, 534). «При волнении – прежде всего, недоедание и валериан, и, конечно, молоко с содою» (С, 548)
(лечение кашля) «…Мускус и горячее молоко будут хорошим предохранителем. Насколько холодное молоко не соединяется с тканями, настолько же горячее с содою проникает в центры…» (МО1, 58)
«Сода полезна и смысл ее так близок огню. Сами содовые поля назывались пеплом Великого Пожара. Так в древности люди уже знали особенности соды. Поверхность Земли покрыта содою на широкое употребление» (МО3, 595).
«Запоры лечат различными способами, упуская из вида самый простой и естественный, а именно: простую пищевую соду с горячим молоком. В данном случае действует металл натрий
«Напряжение огненное отражается на некоторых функциях организма. Так, в этом случае для правильной работы кишечника необходима сода, принимаемая в горячем молоке… Сода тем хороша, что не вызывает раздражения кишечника» (ГАЙ11, 515).
«К обычному очищению кишечника можно добавить регулярный прием питьевой соды, которая обладает способностью нейтрализовать многие яды…» (ГАЙ12, 147.М.А.Й.)
1 июня 1936 г. Елена Рерих писала: “Но сода получила повсеместное признание, и сейчас ею увлекаются особенно в Америке, где она применяется чуть ли не против всех болезней… Нам указано принимать соду два раза в день, также как валериан, не пропуская ни одного дня. Сода предупреждает многие заболевания, включая даже рак” (Письма, т.3, с. 147).
8 июня 1936 г.: “Вообще, сода полезна почти при всех болезнях и является предохранителем от многих заболеваний, потому не опасайтесь принимать её, также как и валериан” (Письма, т.2, с. 215). «Это изумительное предохранительное средство от многих тяжких заболеваний, в частности, от рака. Я слышала о случае излечения застарелого наружного рака засыпанием его содою. Когда мы вспомним, что сода входит, как главный ингредиент, в состав нашей крови, то становится понятным ее благодетельное действие. При огненных явлениях сода незаменима» (П 3, 19, 1).
О дозах приёма Е.И. Рерих писала: “Доза соды для мальчика (диабетика в 11 лет) – четверть чайной ложки четыре раза в день” (Письма, т.3, с. 74). “Один английский доктор… применил простую соду от всяких воспалительных и простудных заболеваний, включая воспаление легких. Причем он давал её в довольно больших дозах чуть ли не по чайной ложке до четырех раз в день на стакан молока или воды. Конечно, английская чайная ложка меньше нашей русской. Моя семья при всех простудах, особенно при ларингите и крупозном кашле употребляет горячее молоко с содой. На чашку молока кладем чайную ложку соды” (Письма, т. 3, с. 116). “Если вы не принимали ещё соду, то начните по маленьким дозам, по пол кофейной ложечке два раза в день. Постепенно можно будет увеличить эту дозу. Лично я принимаю ежедневно две-три полные кофейные ложечки. При болях в солнечном сплетении и тягости в желудке принимаю и значительно больше. Но всегда следует начинать с малых доз” (Письма, т.3, с. 309).
14 июня 1965 г. Б.Н. Абрамов записал от Матери Агни Йоги: “Интересно отметить, как чуткие организмы уже реагируют на огненную напряженность. И хорошо, если кто уже умеет регулировать в своем организме эти приливы огненных энергий. Сода может оказаться истинной панацеей” (Г.А.Й., т.6, с.119, п. 220).
Сода и щёлочи имеют огненную природу. “Сода полезна, и смысл её так близок Огню. Сами содовые поля назывались пеплом Великого Пожара” (М.О., ч.3, п.595).
О пользе соды для растений говорится: “Утром можно полить растения, добавляя в воду щепоть соды. При закате нужно полить с раствором валериана” (А.Й., п. 387).
В пище человека “не нужно кислоты искусственных приготовлений” (А.Й., п. 442), т.о. явно сказано о вреде искусственных кислот, но искусственные щелочи (сода и бикарбонат калия) намного полезнее хлорида и оротата калия.
!!!! Принимать соду необходимо натощак, за 20-30 мин. до еды (нельзя сразу же после еды – может быть обратный эффект). Начинать с малых доз – 1/5 чайной ложки, постепенно увеличивать дозу, доводя до 1/2 чайной ложки. Можно развести соду в одном стакане тепло-горячей кипяченой воды (горячего молока) либо принять в сухом виде, запивая (обязательно!) горячей водой или молоком (один стакан). Принимать 2-3 р. в день.
Метастазы это такие же плодовые тела «грибные» уже по всей «грибнице». Созрев, метастазы отрываются и разносятся по всему организму, ищут слабое место и растут снова. А слабое место это кислая среда в организме, различные воспаления в органах и системах. Вот и получается, чтобы вылечить рак и для его профилактики, нужно поддерживать в организме определенную среду .
РН-среда, или водородный показатель. При рождении он составляет 7,41 РН, а умирает человек с показателем 5,41-4,5. На всю жизнь ему отведено 2 единицы. Рак возникает при снижении водородного показателя до величины 5,41. Самая большая активность лимфатических клеток по уничтожению раковых заболеваний проявляется при РН 7,4. Однако обычно вокруг клеток, пораженных раком , существует более кислая среда , которая препятствует активности лимфатических клеток.
В в кислой среде более часто возникают злокачественные новообразования слизистой оболочки пищевода. Замечено, что во многих странах возрастание потребления газированных прохладительных напитков сопровождалось параллельным увеличением распространенности рака пищевода.
Нормальное состояние внутренних жидкостей человеческого организма — слабо-щелочное. Кислая среда — благоприятная среда для буйного роста бактерий и раковых клеток.
СОДА — ПЕПЕЛ БОЖЕСТВЕННОГО ОГНЯ
«Сода полезна,и смысл ее близок огню.Сами содовые поля назывались пеплом великого Пожара. Так в древности люди уже знали особенности соды. Поверхность Земли покрыта содой на широкое употребление» |
Сода-универсальное средство по своей доступности в применении как в пищевом рационе, так и в медицине. Но ее изумительные предохранительные и целительные свойства еще недостаточно осознаны и не столь широко применяются. А ведь гидрокарбонат натрия (или сода) входит, как главный инградиент, в состав нашей крови. (Об этом указывала Е.И.Рерих). Сода входит в состав плазмы крови, а также лимфоплазмы, в которой находятся лимфоциты. Возможно, сода энергетически питает лимфоциты — клетки, ответственные за иммунный ответ организма.
Среди людей бытует превратное мнение,иногда поддерживаемое и медиками, что длительный и частый прием соды оказывает отрицательное воздействие на работу слизистой оболочки желудка. А прием ее людям с пониженной кислотообразующей функцией желудка или анацидном состоянием его противопоказан, что неверно. Это доказано лабораторными исследованиями на кафедре физиологии человека и животных в Гомельском госуниверситете в 1982 г.; о влиянии соды на кислотообразование, на работу слизистой желудка (на собаках с фистулами желудка). Опытным путем подтверждено, что питьевая сода, обладая кислотонейтрализующим действием, не оказывает ни возбуждающего, ни тормозящего влияния на кислотовыделительную функцию желудка. Следовательно, прием соды может быть рекомендован при любом состоянии кислотности желудка, в т.ч. при гастрите с пониженной кислотностью.
Сода с химической точки зрения представляет собой соединение катиона натрия и аниона гидрокарбоната, которое при введении в организм активно включается в коррекцию кислото-щелочного равновесия. Оказалось, что сода способна выравнивать кислотно-щелочное равновесие в организме, восстанавливать обмен веществ в клетках, улучшать усвоение кислорода тканями, а также препятствовать потере жизненно необходимого калия. Помогает сода при изжоге, при морской болезни, при простудах, при сердечных заболеваниях и головных болях, при кожных заболеваниях. При многих тяжелых заболеваниях в клетках и тканях организма наблюдается ацидоз (или закисление организма), недостаток катионов калия и избыток натрия, что приводит к подавлению энергетических биохимических обменных процессов в клетках (тормозится цикл Кребса), снижению усвоения кислорода, уменьшению жизнеспособности как каждой клетки, так и всего организма. Положительное оздоравливающее действие соды уникально. Благодаря введению анионов угольной кислоты (НСО ) повышается щелочной резерв организма: анион угольной кислоты выводит через почки избыток анионов хлора и натрия, что приводит к уменьшению отеков, снижению повышенного давления, в результате чего повышается валентность тканевых буферных систем, что создает условие для вхождения катиона калия в клетки, и тем самым объясняется калийсберегающий эффект соды.
В результате в клетках восстанавливаются и повышаются биохимические и энергетические процессы,увеличивается гемодинамика и усвоение кислорода тканями, что приводит к улучшению самочувствия и трудоспособности.
К этим выводам пришли медики на кафедре терапии центрального института усовершенствования врачей в Москве (Я.П.Цаленчук,Г.П.Шульцев и др. Журнал «Терапевтический архив» N7 1976 г, N7 1978 г), которые изучали применение гидрокарбоната натрия при хроническом гломерулонефрите, пиелонефрите, хронической почечной недостаточности внутривенным и ректальным способами, что вызвало изменение в состоянии здоровья больных, увеличением кислотовыделительной функции почек, увеличением клубочковой фильтрации, снижением артериального давления, уменьшением остаточного азота в крови, уменьшением отеков.
При тяжелом шоке получены хорошие результаты лечения внутриартериальным введением раствора соды. В практике наблюдался случай быстрого и эффективного купирования отека легких с тяжелым течением инфаркта миокарда после внутривенного введения 4% р-ра соды 200,0.
Отмечено положительное действие соды при болезнях движения, или морской болезни. Гидрокарбонат натрия повышает устойчивость вестибулярного анализатора к действию угловых ускорений,угнетая вращательный и послевращательный нистагм (А.М.Сутов,И.Р.Веселов,»Космическая медицина и авиокосмическая медицина» N3 1978г).
Авторы статьи утверждают, что положительный эффект обусловлен повышением потребления кислорода тканями, нормализацией деятельности сердечно-сосудистой системы, повышением натрий- и хлоруреза. Установлено, что гидрокарбонат натрия обладает четким калийсберегающим свойством.
Проведено наблюдение за показаниями общего и биохимического анализа крови после трехмесячного приема соды с валерианом. Примечательно увеличение как общего количества лейкоцитов (белых клеток крови,имеющими непосредственную связь с тонким телом) на 1,4 10 /л, так и непосредственно лимфоцитов, отвечающим за состояние клеточного иммунитета, на 37%. Биохимический анализ показал возрастание электролитов (до приема соды показатели были несколько снижены), повышение уровня белка до верхних границ нормы (при отсутствии в пищевом рационе мясных и рыбных продуктов в течении 7 лет).
svetafonseca.livejournal.com
Чудодейственная сила «соды» в фармакотерапии … Возможно ли это? | Официальный сайт Л. Розломия
«Чудодейственная сила» соды в фармакотерапии …
Возможно ли это?
В последнее десятилетие всё больше появляется информации о лечении содой многих заболеваний. Привлекающими внимание читателей являются заголовки статей:
— «Сода – Целительная сила!»
— «Лечение содой!»
— «Оздоровление содой!»
— «Польза соды!»
— «Сода – универсальное Лекарство от многих болезней!»
— «Роль соды и щелочей в защите здоровья людей!»
— «Пищевая сода — божественное средство!»
— «Пищевая сода – панацея от многих бед!»
Авторы пишут, что при длительном приёме внутрь соды пищевой можно ощелачивать не только содержимое желудка(?!), но и другие секретируемые жидкости организма, при этом, якобы, «восстанавливаются нарушенные структуры и функции отдельных органов, не затрагивается системный рН фактор и не существует опасности(?!) для всего организма».
С этой целью ПИЩЕВУЮ СОДУ рекомендуют использовать при метаболическом ацидозе, инфекциях, интоксикациях, сахарном диабете, для профилактики и лечения рака, выведения радиоактивных изотопов из организма, профилактики радиоактивного заражения организма и лечения многих других заболеваний.
Проанализировав данные о применении, как медицинского препарата «натрия гидрокарбоната», так и «Соды пищевой», полученные из разных источников, а также ссылаясь на собственные исследования, выстраиваю свой взгляд и предположения относительно «универсальности действия соды» в фармакотерапии заболеваний человека.
В первую очередь, не будем путать названия химических веществ и разберёмся, что включает в себя понятие — «СОДА».
СОДА — общее название технических натриевых солей угольной кислоты.
Прежде всего, это карбонаты натрия:
Na2CO3 (карбонат натрия) сода кальцинированная (или углекислая), называемая в быту стиральной, или бельевой содой;
Na2CO3·10h3O (декагидрат карбоната натрия, содержит 62,5% кристаллизационной воды) — сода кристаллическая; иногда выпускается в виде Na2CO3·h3O или Na2CO3·7h3O;
NaHCO3 (гидрокарбонат натрия) — «Сода пищевая».
Содой также называют и NaOH (гидроксид натрия, едкий натр, щёлочь), но это — сода каустическая, являющаяся сильной щёлочью.
Однако это абсолютно разные по свойствам химические вещества под одним названием — «СОДА»!
Предполагаю, что в публичных статьях имеется подмена понятий, относящаяся к двум препаратам: соде, как медицинскому препарату с соответствующим назначением, и соде пищевой, со своими специфическими свойствами.
Сравним выпускаемую производством готовую (аптечную) продукцию гидрокарбоната натрия в порошке для медицинских (Рис. 1.) и пищевых целей(Рис. 2.).

Рис. 1.

Рис. 2.
В медицине применяют гидрокарбонат натрия (NaHCO3) высокой степени очистки в соответствии с требованиями Государственной Фармакопеи XI издания (массовая доля NaHCO
Для определения целевого назначения гидрокарбоната натрия (медицинский препарат), необходимо заглянуть в рецептурный справочник Машковского М. Д. («Лекарственные средства», 1985г., т.2, стр. 113),.
По фармакологическим свойствам гидрокарбонат натрия относится к группам: «Регуляторы кислотно-щелочного равновесия и водно-электролитного баланса», «Антациды», «Плазмозамещающие и перфузионные растворы».
Выпускается препарат в порошке, таблетках, свечах, растворах для инъекций, а также в составе некоторых лекарственных препаратов.
На упаковке «Сода пищевая» — далее по тексту «СОДА», указан ГОСТ2156-76. В соответствии с изменениями №2 от 01.09.1986к ГОСТ2156-76 от 01.04.1979 порошок соды содержит массовую долю NaHCO3 не менее 99,0%, массовую долю Na 2CO3 не более 0,7 % , а остальное количество — хлориды, сульфаты, железо, кальций, мышьяк и нерастворимые в воде вещества(!).
Следовательно, по своему составу СОДА для пищевых целей резко отличается от гидрокарбоната натрия, используемого в медицине.
Рекомендовано применять пищевую СОДУ, как разрыхлитель Е-500, при изготовлении кондитерских изделий и в хлебопечении.
Итак, мы имеем два вещества, относящихся к классу щелочей. Постараемся последовательно ознакомиться со свойствами каждого из них.
Для понимания поведения в организме гидрокарбоната натрия (медицинского препарата), считаю важным заглянуть в раздел химии.
Как химическое вещество, гидрокарбонат натрия — это кислая натриевая соль угольной кислоты.
Рассмотрим аспекты химических свойств гидрокарбоната натрия. Здесь имеют значение такие параметры, как: химическая чистота препарата, качество воды и температура, при которой происходит растворение.
Перед приёмом вовнутрь, порошок гидрокарбоната натрия необходимо предварительно растворить в воде.
Здесь важно отметить, что при температуре воды до 50°С происходит гидролиз гидрокарбоната, приводящий к образованию слабого электролита (водный раствор имеет слабощелочную реакцию).
В результате, получившаяся угольная кислота (очень слабое и крайне неустойчивое соединение) тут же распадается на углекислый газ(!) и воду: H2CO3 = CO2↑ + H2O, которые совершенно безвредны для организма.
При температуре разведения 80 °С и выше происходит разложение соды с получением карбоната с анионами CO32- (водные растворы которых имеют сильнощелочную реакцию, ввиду появления в растворе NaOH (!) ).
NaHCO3 + HOH<=> NaOH + H2CO3
Эти химические вещества могут угрожать организму!
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
CO32- + HOН ↔ HCO3— + OH—
CO32- + H+ ↔ HCO3—
Следует отметить, что при растворении фармакопейного гидрокарбоната натрия в дистиллированной воде химические реакции протекают с образованием ионов гидрокарбоната (НСО—3 ). При инъекционном введении 1% — 5% раствора гидрокарбоната натрия эти свойства сохраняются, восстанавливается кислотно-основное равновесие в тех жидкостях организма, которые в норме должны были иметь щелочную реакцию, а стали кислыми, т.е. восстанавливается системный рН фактор.
Но это — теоретически! В последние годы в литературе большое внимание привлекает дискуссия о коррекции рН с помощью натрия гидрокарбоната в связи с его способностью вызывать ряд побочных эффектов. Неэффективность лекарственного средства объясняется его способностью образовывать диоксид углерода (СО2 — углекислый газ), который может диффундировать в клетки, где при участии воды образуются ионы водорода и в крови появляется дополнительный лактат. Всё это приводит к усугублению расстройств кислотно-щелочного состояния, вызывает артериальную гипотензию и снижение сердечного выброса. Поэтому количество ионов гидрокарбоната (HCO3—), необходимое для коррекции рН, вычисляют по формуле: Дефицит HCO3— = 0,5 х масса тела (кг) х (желаемое количество HCO3— — количество HCO3— в сыворотке крови).
Содержание HCO3— в сыворотке крови, поддерживающее рН > 7,2, зависит от парциального давления рCO 2 в крови артериальной, т.к. H+(мэкв/л) = 24 х (рCO2 / HCO3—).
Нормальные показатели по крови: рН = 7,35 – 7,45; рCO2 = 36 – 44 мм рт ст.; содержание HCO3— = 22 – 25 мэкв/л.
Можно сделать вывод, что дозированное применение раствора натрия гидрокарбоната затруднительно, т.к. перед инъекционным введением антацида необходима информация об уровнях рН и рCO2 в артериальной крови.
Теперь рассмотрим, что же происходит, если в качестве растворителя СОДЫ пищевой предлагается водопроводная вода или вода, расфасованная в упаковки из полимерных материалов. По результатам многочисленных исследований содержание вредных химических веществ, поступающих и образующихся в воде в процессе ее обработки в системе водоснабжения, следующее: хлор, фтор, соли магния, кальция, натрия, окисленное железо, серная и соляная кислоты, полифосфаты, хлорорганические соединения, диоксины, формальдегид, полиакриламид, кремнекислота и другие химические соединения.
Вода, расфасованная в упаковки из полимерных материалов, кроме неорганических веществ, может также содержать ацетон, изопропанол, бензол, формальдегид, этилацетат.
Учитывая реакционную способность СОДЫ, при растворении её в указанных растворителях, происходят химические реакции с отдельными компонентами воды с образованием соединений с другими свойствами(!) или с выпадением осадков. Возникают вопросы:
— Представляет ли серьёзную опасность для организма раствор пищевой СОДЫ в таком составе растворителей?
— Возможен ли лечебный эффект «содового коктейля»?
Этот фактор заслуживает особого внимания! Такие характеристики, как химический состав порошка «соды» и компонентный состав воды имеют определяющее значение при приёме растворов через рот, ректально или вагинально.
Теперь настало время обсудить вопрос, касающийся количества СОДЫ, которое рекомендуется публичными изданиями для лечения заболеваний. В рецептуре указано, что для приёма вовнутрь следует насыпать (не взвешивая!) порошок (1 ч.л. с горкой или без горки, ½ ч.л. и т.д.) в ёмкость и растворить его в воде.
Предположим, мы согласились на этот рискованный шаг исцеления и чётко следуем рекомендациям.
Теоретически приступаем к «химической атаке» содой на желудочно-кишечный тракт, органы и системы организма.
При этом возникают вопросы:
— Соляная кислота желудочного сока «друг или враг»?
— Как точно установить начальное рН и, соответственно, содержание количества соляной кислоты в желудке на момент приёма раствора СОДЫ?
— Следует ли нейтрализовать (!) всю кислоту в желудке или же только её определённую часть? Как установить эту границу, или и в этом случае — «на глазок»?
— Какие из реагентов должны быть в избытке, а какие в недостатке, чтобы не нарушить кислотно-основное равновесие, структуру и функции ЖКТ?
— Каким может быть результат от бесконтрольного применения СОДЫ?
В первую очередь, обратим внимание на особенности желудочно-кишечного тракта и пищеварительной системы в целом, и проанализируем готовность желудка к «приёму химического агрессора».
В желудке ионы гидрокарбоната(!) (HCO3–) секретируются клетками поверхностного эпителия, что обеспечивает образование естественного «слизисто—щелочного барьера», предотвращающего повреждающее воздействие на клетки слизистой оболочки желудка избытком соляной кислоты и пепсина. Выделяющаяся соляная кислота должна соприкасаться только с компонентами пищи, и не более! Для этого и создаётся специальная слизь, пропускающая кислоту только в одном направлении. В процессах генерации и поддержания секреции ионов гидрокарбоната (НСО3—), важную роль играет фермент карбоангидраза.
Таким образом, в слое слизи поддерживается определённое значение водородного показателя рН, при этом, на поверхности обращенной в просвет желудка, среда кислая, а у эпителиоцитов — нейтральная, или слабощелочная.
Рассмотрим схему внутреннего слоя желудка.
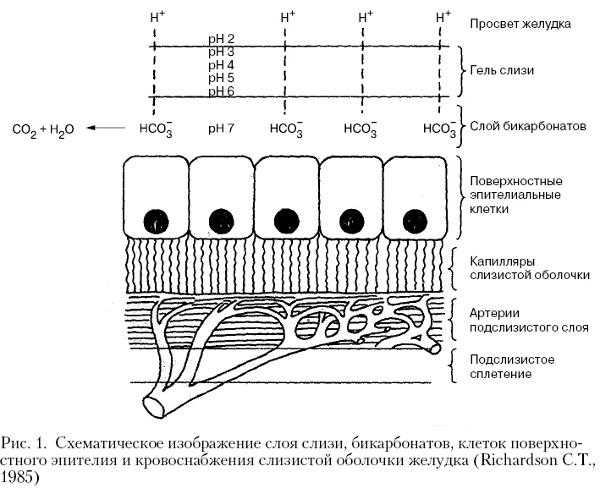
При попадании раствора в желудок, СОДА резко снижает выработку фермента карбоангидразы, и выработка слизи приостанавливается, а слизистая оболочка желудка остаётся без защиты от соляной кислоты. Обращаю внимание на очень слабую корреляцию между рН желудочного содержимого и рН непосредственно на поверхности слизистой оболочки желудка! В результате такого длительного щелочного действия на слизистой желудка появляются эрозии.
Всем известно, что в желудке обработка пищи протекает под действием соляной кислоты.
Перенасыщение содой приводит к нейтрализации соляной кислоты и нарушению всех! процессов желудочного пищеварения.
Имеются доказательства того, что соляная кислота желудочного сока играет роль не только в пищеварении, но и обладает выраженными антибактериальными свойствами. При повышении рН желудочного содержимого до 4,0 и выше (что является итогом «содотерапии»!) бактерии в желудке размножаются и образуют колонии, которые приводят к тяжёлым осложнениям (пневмония, септицемия).
В двенадцатиперстной кишке пищеварение происходит в щелочной среде под действием панкреатического сока, желчи и сока слизистой оболочки двенадцатиперстной кишки. Первая задача этих жидкостей нейтрализовать кислоту химуса, поступающего из желудка.
В связи с тем, что избыток соляной кислоты может приводить к закислению организма, а избыток щёлочи, наоборот, к его ощелачиванию, следует помнить, что организм самостоятельно использует все возможные ресурсы для поддержания баланса рH в виде саморегуляции.
Из курса физиологии известно, что показатели рН крови и прочих наших внутренних жидкостей стабильны и изменяются очень незначительно. Для кислотно-щелочного равновесия в организме необходимо поддерживать нормативные показатели:
— pH артериальной крови = 7,35–7,45;
-pH венозной крови = 7,26–7,36;
— pH лимфы = 7,35–7,40;
— pH межклеточной жидкости = 7,26–7,38;
-pH внутрисуставной жидкости = 7,3;
— рН панкреатического сока имеет =7,8-9,0;
— рН желчи =7,50-8,50;
— рН секрета толстого кишечника имеет сильнощелочную среду = 8,9-9,0;
(Большая Медицинская Энциклопедия, изд. 2, т. 12, ст. Кислотно-щелочное равновесие, с. 857).
Обращаю внимание! Для желудочного содержимого нет точного значения рН, которого необходимо достичь!
Вывод: показатели pН внеклеточной, внутриклеточной и других жидкостей организма жестко выдерживаются в узких границах, так как только в этих условиях возможна работа большинства ферментов. Для каждого фермента существует свой интервал pH! Даже незначительные изменения pH в ту или иную сторону вызывают снижение активности ферментов, уменьшение скорости протекания биохимических процессов и развитие патологии.
СОДА, попадая в желудок, взаимодействует с соляной кислотой в эквивалентных количествах (в молях — 1 : 1). Учитывая молекулярные массы реагирующих веществ (М.м. NaHCO3 – 84, М.м. HCl – 36,5), для полного взаимодействия реагентов требуется (из расчёта на 1 литр воды) 84,0 грамма гидрокарбоната натрия и 36,5 грамма соляной кислоты желудка.
В связи с этим, возникает вопрос. Предусмотрены ли авторами эти соотношения в рекомендациях по дозировке СОДЫ?
Кроме этого, ионы гидрокарбоната необратимо реагируют с ионами водорода с образованием воды и углекислого газа:
NaHCO3 + HCl= NaCl + H2CO3
H+ + HCO3–= Н2CO3
H2CO3 → H2O + CO2↑
Реакция протекает быстро, т.е. в течение 15-20 минут происходит увеличение внутрижелудочного рН до 7 и выше(!).
Этот процесс вызывает развитие «синдрома отдачи» за счёт возбуждения рецепторов слизистой оболочки желудка и усиления выделения гастрина, способствующего вторичному повышению секреции соляной кислоты.
Этим обусловлено физиологически оправданное применение медицинской соды в случаях временной гиперсекреторной деятельности желудка, чтобы избежать рефлюкса (изжоги), раздражения (эрозирования) слизистой желудка до выяснения причин гиперсекреции и их устранения. К сожалению, в официальной медицине большинство врачей не ищут причину желудочной гиперсекреции, а превращают скоропомощное назначение антацидов, в том числе и гидрокарбоната натрия, в «лечение».
При избытке или недостатке в организме ионов гидрокарбоната или диоксида углерода развиваются многочисленные расстройства, в результате которых нарушается функциональная взаимосвязь между различными системами организма.
Однако нельзя считать правильным, что кислая среда – это всегда плохо, а щелочная – это всегда хорошо.
Водородные показатели среды могут быть физиологически нормальными или патологическими(!).
Состояние «закисленности» организма называется метаболическим ацидозом, а состояние «защелачивания» — метаболическим алкалозом.
Физиологами Павловым, Сеченовым, Боткиным и др. доказано, что здоровый организм сам устраняет незначительные изменения рН крови, состав межклеточной жидкости и электролитов.
В процесс коррекции нарушений и восстановления физиологической рН в тканях организма могут включаться микроэлементы, витамины, ферменты и компенсаторные механизмы, действие которых направлено на то, чтобы свести к минимуму изменения рН или нормализовать его величину. Однако постоянная нагрузка на компенсаторные системы, такая, как применение СОДЫ, может привести к их декомпенсации, что, в первую очередь, проявится нарушениями обмена веществ, как в отдельных клетках, так и в масштабе целого организма.
При патологических нарушениях реакциями системы компенсации являются:
Центральные хеморецепторы, которые обладают чувствительностью к изменениям уровня диоксида углерода (СО2), а изменение их активности играет роль первичной стимуляции дыхания, при этом происходит усиление интенсивности легочной вентиляции и удаление при выдохе избытка СО2.
Применение СОДЫ в целях (якобы) ликвидации ацидоза, приводит к обратной реакции — повышению рН (закислению) и угнетению вентиляции лёгких. В этом случае начинает действовать хеморецепторный механизм регуляции дыхания, при котором резко возрастает парциальное давление рСО2 в крови (накопление углекислого газа в крови и тканях, приводящих к ацидозу).
Как известно, коэффициент диффузии СО2(проникновения углекислоты из межклеточной жидкость в кровь венозных капилляров), в отличие от гидрокарбоната натрия, высок, и, быстро проникая в цереброспинальную жидкость, СО2 вызывает парадоксальное снижение ее рН (ацидоз!)
В результате такого «лечения» СОДОЙ, могут развиться ряд неврологических симптомов, вплоть до появления судорог, сопора и комы.(Posner J.В., Plum F., 1967г.).
Регуляция дыхательной функции лёгких контролируется автономной нервной системой. Расстройства дыхания вызывает метаболическую компенсаторную реакцию со стороны почек.
2. Система почек отвечает за поддержание нормального уровня ионов НСО3– в организме, и, в случае их недостатка, происходит добавочный синтез ионов НСО3– и почечная экскреция (удаление, нейтрализация) ионов Н+.
Применение СОДЫ нарушает это равновесие, приводя к отложению кислых солей и общему закислению организма.
В большинстве популярных публикаций сообщают, что «химиотерапию содой нужно проводить длительно». Однако никаких обоснований к этим рекомендациям нет. Нет данных о критерии (показателе) пролонгированного применения СОДЫ.
Чтобы постоянно поддерживать искусственно вызванный алкалоз (защелачивание) в организме, назначают длительное применение СОДЫ, не осознавая, что «действие равно противодействию», что это путь в тупик.
3. Внеклеточные и внутриклеточные буферные системы организма вступают в действие практически моментально(!), противодействуя резким изменениям концентрации ионов Н+ за счёт химического связывания кислот другими ионами.
Бикарбонатная буферная система состоит из диоксида углерода (СО2) и из ионов гидрокарбоната (НСО3–) в соотношении 1 : 20. Функции этой системы связаны с включением лёгочных дыхательных компенсаторных механизмов и почек.
Гемоглобиновая буферная система неразрывно связана с системой дыхания, и также оказывает влияние на интенсивность внутриклеточного образования ионов Н+ и НСО3–.
По своему механизму эта система предохраняет венозную (!) кровь от накопления ионов Н +, то есть от «закисления». Однако если насильственно (при «помощи» СОДЫ) сдвинуть рН в сторону ощелачивания, буферная система будет направлена на повышение концентрации ионов водорода, приводя организм к закислению.
4. Гормоны разносятся кровью ко всем клеткам и контролируют практически все процессы в организме. Они принимают участие в обеспечении всех основных функций каждой клетки организма.
Ряд гормонов активны при рН выше 7,0 (щелочная среда), тогда как другие проявляют максимальную активность при рН ниже 7,0 (кислая среда)!
Бесконтрольное вмешательство в кислотно-щелочное равновесие может привести к глобальному сбою и расстройству не только на функциональном уровне, но и на органическом, приводя ткани к дегенерации и деструкции.
Кроме предполагаемого создания избыточной щелочной среды (рН > 7), разрушающее влияние окажут на органы и системы организма продукты самой реакции(!), к которым относятся: катионы натрия (Na+), анионы хлора (Cl—), диоксид углерода (СО2) и другие химические соединения!
При нарушении стабильности водно-электролитного и кислотно-щелочного равновесия в организме изменяются концентрации ионов водорода (Н+) в составе внутриклеточной и внеклеточной жидкости.
При этом отмечаются патологические нарушения в виде снижения активности белков плазмы крови, ферментов клеточных мембран и цитоплазмы, снижение наработки АТФ в клетке и растворимости(!) неорганических и органических молекул.
Избыток катионов натрия (Na+) при приёме СОДЫ нарушает функции мембранного натрий-калиевого насоса (эту функцию выполняет фермент Na+, К+ — АТФаза), изменяет трансмембранный — К+, Н+ — обмен и активацию секреции альдостерона(!), приводящую к задержке Na+.
Результатом разбалансированного СОДОЙ биохимического процесса является снижение концентрации ионов калия в сыворотке крови ниже 3,5 мэкв/л с последующим развитием метаболического алкалоза, гипокалиемии и гипернатриемии.
Риск алкалоза особенно высок у пациентов с нарушением функции почек. Основными клиническими проявлениями являются: тошнота, рвота, боль в животе, головная боль, беспокойство, повышение артериального давления, сердечная недостаточность и отёки (избыточная задержка натрия).
Выделение и накопление в процессе реакции нейтрализации углекислого газа способствует растяжению стенки желудка и развитию болевого синдрома, а у больных с глубоким язвенным дефектом возможны желудочные кровотечения. Углекислый газ вызывает также метеоризм.
Пищевая сода, поступающая перорально (через рот), претерпевает в организме многоступенчатые изменения, которые могут привести к тому, что в нужное место поступит очень мало исходного вещества, зато возрастает опасность, что СОДА и образуемые при её использовании побочные продукты распада, вызовут биохимическую травму и тяжелейшие осложнения.
К нежелательным проявлениям, особенно на первых этапах «лечения СОДОЙ», можно отнести слабость, озноб, ломоту в теле, тошноту и рвоту, потерю аппетита.
Особый резонанс получил миф о применении ПИЩЕВОЙ СОДЫ в онкологии.
Ознакомившись с информацией, выстроим цепочку предположений относительно целесообразности использования пищевой соды в целях профилактики и лечения онкологических заболеваний.
Как утверждают врачи-онкологи, первичные факторы, провоцирующие онкологию, имеются практически у большей части населения. Отсутствие симптомов не означает, что в организме нет её изначального развития.
Опухолевые клетки существенно отличаются от обычных клеток сильно выраженным анаэробным гликолизом (протекающим без участия кислорода), и всё заканчивается образованием спирта.
У нормальных аэробных клеток спирт окисляется с образованием остатка уксусной кислоты. А это существенно их отличает по кислотно-щелочному балансу.
При интенсивном развитии опухоли нарастают процессы интоксикации всего организма. Чем глубже заходит онкологический процесс, тем сильнее аутоинтоксикация.
Одной из причин интоксикации является отмирание наиболее старых онкологических клеток.
Кроме этого, есть предположение, что интоксикация происходит при определённой реакции среды (рН) из-за выделения недоокисленных продуктов (ацетонов, альдегидов, кетонов, а также гидроперекисей и т. д.).
Если клетки опухоли создают вокруг себя рН отличную от здоровых клеток, то они выделяют метаболиты кислотной или щелочной направленности(!).
По типу конечных метаболитов, гликолиз может быть спиртовым, уксуснокислым, молочнокислым или маслянокислым.
Здоровые клетки в присутствии кислорода переводят пировиноградную кислоту до СО2 и воды. Если же кислорода нет или не работают митохондрии, то она превращается в этиловый спирт.
При выделении спиртов происходит «перезащелачивание» тканей в районе опухоли. В таком случае позволительно спросить, каким образом ионы гидрокарбоната (назначаемого в виде растворов соды) будут оказывать влияние на сдерживание опухоли?
Изложенные обстоятельства могут быть использованы, как аргумент против слишком активной терапии пищевой содой.
Для того, чтобы наступили изменения на уровне тканей органов, системы органов и организма, необходима квалифицированная медицинская помощь.
Назначение, дозировка и лекарственная форма гидрокарбоната натрия для каждого пациента зависят только от клинических проявлений и тяжести заболевания, результатов лабораторной диагностики и возрастных особенностей.
Кислотно-щелочное равновесие можно регулировать по назначению врача некоторыми лекарственными средствами, природными минеральными водами, содержащими гидрокарбонаты и другими средствами.
Судебно-медицинский врач эксперт-химик
Васильева Н. В.
rozlomiy.ru
Сода. NaHCO3. Бикарбонат натрия. Натрий двууглекислый. Питьевая сода.
Здесь все собрано из институтских тетрадей и то, что я выписывала для себя из интернета.
Гидрокарбонат натрия NaHCO3, Сода или по другому: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый — это соль, да не просто!, а кислая натриевая соль угольной кислоты (H2CO3 слабая двухосновная кислота).
Соль впервые описана в 1801 немецким аптекарем Б. Розе
В соответствии с основностью угольная кислота даёт два ряда солей: средние — карбонаты с анионом CO32- (водные растворы имеют !сильнощелочную реакцию) и кислые — гидрокарбонаты с анионом HCO3— — (водные растворы имеют !!слабощелочную реакцию).
Здесь нужно учитывать все параметры, и связи, и плотность, и т.п.
Стабильность гидрокарбонатов растет при переходе от Na+ к Cs+. Ионы НСО3— обычно объединяются водородными связями с образованием цепочек.
NaHCO3 — плотность 2,16—2,22 г/см3. При нагревании около 50 °С начинает отщепляться 002, а при 100—150 °С полностью разлагается, превращаясь в Na2CO3.
Мы растворяем соду в воде, опять –если вода до 50 °С, действие одно, это гидролиз соли: обратимое взаимодействие соли с водой, приводящее к образованию слабого электролита, а от 80-150 °С получается уже Na2CO3.
Вода хотя и в малой степени, но диссоциирует:
H2O H+ + OH–.
Когда концентрации ионов H+ и гидроксид-ионов OH– равны между собой, [H+] = [OH–], то среда нейтральная, если [H+] > [OH–] – среда кислая, если [Н+] < [ОН–] – среда щелочная.
Гидрокарбонат натрия реагирует с соляной кислотой, с образованием соли и угольной кислоты. Угольная кислота очень слабая, крайне неустойчивое соединение, поэтому оно тут же распадается на углекислый газ и воду:
NaHCO3 + HCl → NaCl + H2CO3
H2CO3 → H2O + CO2↑
Так происходит, если мы соду растворили в теплой воде (до 50 градусов)
А если растворяем соду в горячей воде, то уже образуется карбонат натрия, и в этом случае, водный раствор имеет уже сильнощелочную реакцию. Гидролиз.
Температура. Поскольку реакция гидролиза эндотермическая, то повышение температуры смещает равновесие в системе вправо, степень гидролиза возрастает.
Концентрация соли. равновесие в системе смещается вправо, в соответствии с принципом Ле Шателье, но степень гидролиза уменьшается. Понять это поможет константа равновесия.
Добавки посторонних веществ могут влиять на положение равновесия в том случае, когда эти вещества реагируют с одним из участников реакции.
Степень гидролиза можно увеличить, и , например, чтобы сделать щелочной моющий раствор бельевой соды более активным, мы его нагреваем – степень гидролиза карбоната натрия при этом возрастает.
Сода относится к антацидам. Взаимодействуя с соляной кислотой, сода устраивает в желудке «химлабораторию». В итоге вырабатывается уг-лекислый газ, «нападающий» на стенки желудка. Защищаясь, желудок вырабатывает новую дозу сока и соляной кислоты — на это требуется 20 минут.
Современные исследования
В организме роль соды заключается в нейтрализации кислот, повышении щелочных резервов организма в поддержании в норме кислотно-щелочного равновесия.
У человека показатель кислотности pH крови должен находиться в норме в пределах 7,35-7,47. Если pH меньше 6,8 (очень кислая кровь, сильнейший ацидоз), то наступает смерть организма.
Причинами ацидоза являются яды в пище, воде и воздухе, лекарства, пестициды. Большое самоотравление людей психическими ядами происходит от страха, беспокойства, раздражения, недовольства, зависти, злобы, ненависти, которые сейчас очень усилены благодаря нарастающим волнам Космического Огня. При потере психической энергии почки не могут удерживать в крови высокую концентрацию соды, которая при этом теряется вместе с мочой. Это другая причина ацидоза: потеря психической энергии ведет к потере щелочей (соды).
Сода, уничтожая ацидоз, повышает щелочные резервы организма, сдвигает кислотно-щелочное равновесие в щелочную сторону (pH примерно 1,45 и выше). В щелочном организме происходит активация воды, т.е. диссоциация ее на ионы Н+ и OH- за счет аминных щелочей, аминокислот, белков, ферментов, нуклеотидов РНК и ДНК. В активированной воде, насыщенной огненной энергией организма, улучшаются все биохимические процессы: ускоряется синтез белка, быстрее обезвреживаются яды, активнее работают ферменты и аминные витамины, лучше действуют аминные лекарства, имеющие огненную природу и биологически активные вещества.
Здоровый организм для пищеварения вырабатывает сильно щелочные пищеварительные соки. Пищеварение в двенадцатиперстной кишке происходит в щелочной среде под действием соков: панкреатический сок, желчь, сок бруттнеровой железы и сок слизистой оболочки двенадцатиперстной кишки. Все соки имеют высокую щелочность. Панкреатический сок имеет pH=7,8-9,0. Ферменты панкреатического сока действуют только в щелочной среде. Желчь в норме имеет щелочную реакцию pH=7,50-8,50. Секрет толстого кишечника имеет сильно щелочную среду pH=8,9-9,0. При сильном ацидозе желчь становится кислой pH=6,6-6,9 вместо нормы pH=7,5-8,5. Это ухудшает пищеварение, что приводит к отравлению организма продуктами плохого пищеварения, образованию камней в печени, желчном пузыре, кишечнике и почках. В кислой среде спокойно живут глисты опистархоза, острицы, аскариды, цепни и др. В щелочной среде они гибнут. В кислом организме слюна кислая pH=5,7-6,7, что приводит к медленному разрушению эмали зубов. В щелочном организме слюна щелочная: pH=7,2-7,9 и зубы не разрушаются.
Сода, нейтрализуя избыточные кислоты, повышает щелочные резервы организма, делает мочу щелочной, что облегчает работу почек (сберегает психическую энергию), сберегает глутаминовую аминокислоту, предотвращает отложение камней в почках.
Замечательным свойством соды является то, что избыток её легко выводится почками, давая щелочную реакцию мочи
В щелочной среде с активированной водой многократно возрастает биохимическая активность аминных витаминов: В1 (тиамин, кокарбоксилаза), В4 (холин), В5 или РР (никотиномид), В6 (пиридоксаль), В12 (кобимамид). Витамины, имеющие огненную природу могут полностью проявлять её только в щелочной среде.
Для улучшения всасывания соды из кишечника её принимают с горячим молоком. В кишечнике сода реагирует с аминокислотами молока, образуя щелочные натриевые соли аминокислот, которые легче, чем сода всасываются в кровь, повышая щелочные резервы организма.
Для борьбы с аскаридами и острицами применяют аминную щёлочь пиперазин, дополняя его клизмами соды . Сода применяется при отравлении метанолом, этиловым спиртом, формальдегидом, карбофосом, хлорофосом, белым фосфором, фосфином, фтором, йодом, ртутью и свинцом, для отвыкания от курения: полоскание рта густым раствором соды или обмазывание полости рта содой со слюной: сода кладётся на язык, растворяется в слюне и вызывает отвращение к табаку при курении. Дозы малые, чтобы не нарушать пищеварения.
В письме от 1 января 1935 г. Е.И. Рерих писала: “Вообще Владыка очень советует всем приучаться принимать соду два раза в день. Это изумительное предохранительное средство от многих тяжких заболеваний, в частности, от рака” (Письма Елены Рерих, т. 3, с. 74). 4 января 1935г.: “Я принимаю её ежедневно, иногда при сильном напряжении, до восьми раз в день по кофейной ложке. Причём я просто высыпаю её на язык и запиваю водой. Также замечательно хорошо действует при всех простудах и напряжениях центров горячее, но не прокипяченное молоко с содой” (Письма, т. 3, с 75). «Хорошо и деткам давать соду в горячем молоке» (П6, 20, 1). 18 июля 1935 г.: “Затем советую вам ежедневно принимать два раза в день двууглекислую соду. При болях в подложечке (напряжение в солнечном сплетении) приемы соды незаменимы. Да и вообще, сода – самое благодетельное средство, она предохраняет от всевозможных заболеваний, начиная от рака, но нужно приучить себя принимать её ежедневно без пропусков…Также при ломоте и горении в горле незаменимо горячее молоко, но не вскипевшее, а также с содою. Обычная пропорция кофейная ложка на стакан. Очень советуйте всем соду. Также наблюдайте, чтобы желудок не был обременен, и кишечник чист” (П, 18.06.35).
«Для ослабления диабета принимают соду…молоко с содою всегда хорошо…» (МО3, 536).
«Явление переполнения психической энергией вызывает многие симптомы как в конечностях, так в горле и желудке. Сода полезна, чтобы вызвать разряжение, также горячее молоко…» (С, 88).
«При раздражении и волнении Советую молоко во всех видах, как обычное противоядие. Сода укрепляет действие молока» (С, 534). «При волнении – прежде всего, недоедание и валериан, и, конечно, молоко с содою» (С, 548)
(лечение кашля) «…Мускус и горячее молоко будут хорошим предохранителем. Насколько холодное молоко не соединяется с тканями, настолько же горячее с содоюпроникает в центры…» (МО1, 58)
«Сода полезна и смысл ее так близок огню. Сами содовые поля назывались пеплом Великого Пожара. Так в древности люди уже знали особенности соды. Поверхность Земли покрыта содою на широкое употребление» (МО3, 595).
«Запоры лечат различными способами, упуская из вида самый простой и естественный, а именно: простую пищевую соду с горячим молоком. В данном случае действует металл натрий
«Напряжение огненное отражается на некоторых функциях организма. Так, в этом случае для правильной работы кишечника необходима сода, принимаемая в горячем молоке… Сода тем хороша, что не вызывает раздражения кишечника» (ГАЙ11, 515).
«К обычному очищению кишечника можно добавить регулярный прием питьевой соды, которая обладает способностью нейтрализовать многие яды…» (ГАЙ12, 147.М.А.Й.)
1 июня 1936 г. Елена Рерих писала: “Но сода получила повсеместное признание, и сейчас ею увлекаются особенно в Америке, где она применяется чуть ли не против всех болезней… Нам указано принимать соду два раза в день, также как валериан, не пропуская ни одного дня. Сода предупреждает многие заболевания, включая даже рак” (Письма, т.3, с. 147).
8 июня 1936 г.: “Вообще, сода полезна почти при всех болезнях и является предохранителем от многих заболеваний, потому не опасайтесь принимать её, также как и валериан” (Письма, т.2, с. 215). «Это изумительное предохранительное средство от многих тяжких заболеваний, в частности, от рака. Я слышала о случае излечения застарелого наружного рака засыпанием его содою. Когда мы вспомним, что сода входит, как главный ингредиент, в состав нашей крови, то становится понятным ее благодетельное действие. При огненных явлениях сода незаменима» (П 3, 19, 1).
О дозах приёма Е.И. Рерих писала: “Доза соды для мальчика (диабетика в 11 лет) – четверть чайной ложки четыре раза в день” (Письма, т.3, с. 74). “Один английский доктор… применил простую соду от всяких воспалительных и простудных заболеваний, включая воспаление легких. Причем он давал её в довольно больших дозах чуть ли не по чайной ложке до четырех раз в день на стакан молока или воды. Конечно, английская чайная ложка меньше нашей русской. Моя семья при всех простудах, особенно при ларингите и крупозном кашле употребляет горячее молоко с содой. На чашку молока кладем чайную ложку соды” (Письма, т. 3, с. 116). “Если вы не принимали ещё соду, то начните по маленьким дозам, по пол кофейной ложечке два раза в день. Постепенно можно будет увеличить эту дозу. Лично я принимаю ежедневно две-три полные кофейные ложечки. При болях в солнечном сплетении и тягости в желудке принимаю и значительно больше. Но всегда следует начинать с малых доз” (Письма, т.3, с. 309).
14 июня 1965 г. Б.Н. Абрамов записал от Матери Агни Йоги: “Интересно отметить, как чуткие организмы уже реагируют на огненную напряженность. И хорошо, если кто уже умеет регулировать в своем организме эти приливы огненных энергий. Сода может оказаться истинной панацеей” (Г.А.Й., т.6, с.119, п. 220).
Сода и щёлочи имеют огненную природу. “Сода полезна, и смысл её так близок Огню. Сами содовые поля назывались пеплом Великого Пожара” (М.О., ч.3, п.595).
О пользе соды для растений говорится: “Утром можно полить растения, добавляя в воду щепоть соды. При закате нужно полить с раствором валериана” (А.Й., п. 387).
В пище человека “не нужно кислоты искусственных приготовлений” (А.Й., п. 442), т.о. явно сказано о вреде искусственных кислот, но искусственные щелочи (сода и бикарбонат калия) намного полезнее хлорида и оротата калия.
!!!! Принимать соду необходимо натощак, за 20-30 мин. до еды (нельзя сразу же после еды – может быть обратный эффект). Начинать с малых доз – 1/5 чайной ложки, постепенно увеличивать дозу, доводя до 1/2 чайной ложки. Можно развести соду в одном стакане тепло-горячей кипяченой воды (горячего молока) либо принять в сухом виде, запивая (обязательно!) горячей водой или молоком (один стакан). Принимать 2-3 р. в день.
Метастазы это такие же плодовые тела «грибные» уже по всей «грибнице». Созрев, метастазы отрываются и разносятся по всему организму, ищут слабое место и растут снова. А слабое место это кислая среда в организме, различные воспаления в органах и системах. Вот и получается, чтобы вылечить рак и для его профилактики, нужно поддерживать в организме определенную среду .
РН-среда, или водородный показатель. При рождении он составляет 7,41 РН, а умирает человек с показателем 5,41-4,5. На всю жизнь ему отведено 2 единицы. Рак возникает при снижении водородного показателя до величины 5,41. Самая большая активность лимфатических клеток по уничтожению раковых заболеваний проявляется при РН 7,4. Однако обычно вокруг клеток, пораженных раком , существует более кислая среда , которая препятствует активности лимфатических клеток.
В кислой среде более часто возникают злокачественные новообразования слизистой оболочки пищевода. Замечено, что во многих странах возрастание потребления газированных прохладительных напитков сопровождалось параллельным увеличением распространенности рака пищевода.
Нормальное состояние внутренних жидкостей человеческого организма — слабо-щелочное. Кислая среда — благоприятная среда для буйного роста бактерий и раковых клеток.
Источник: Профессиональная ассоциация висцеральных терапевтов.
Похожие статьи:
massage30.info
Гидрокарбонат натрия | Info-Farm.RU
Бикарбонат натрия или натрий гидрокарбонат — химическое соединение с формулой NaHCO 3. Бикарбонат натрия — белое твердое вещество. Имеет слегка соленый щелочной вкус, напоминающий вкус стиральной соды (карбонат натрия). Естественная форма — минерал нахколит. Бикарбонат натрия является одним из компонентов минерального соды и находится во многих минеральных источниках. Он находится в растворенном виде в желчи, где он служит для нейтрализации кислотности соляной кислоты, которая производится в желудке и выводится в двенадцатиперстную кишку тонкого кишечника. Это вещество известно с давних времен и широко используется. В разговорной речи, ее называют питьевая сода.
История
Древние египтяне использовали природные месторождения соды, смесь, состоящую главным образом из карбоната натрия, бикарбоната декагидрат, и натрия. Сода использовалась в качестве средства для чистки, как мыло. Широко используется с 1800-х годов в коммерческом рыболовстве, чтобы предотвратить порчу свеже-пойманной рыбы.
Производство
NaHCO 3 в основном производится реакцией хлорида натрия, аммиака и углекислого газа в воде. Карбонат кальция используется как источник CO 2 и, как следствие оксида кальция. Используется для восстановления аммиака из хлористого аммония. Производство около 100.000 тонн / год (по состоянию на 2001 г.).
NaHCO 3 может быть получен в результате реакции углекислого газа с водным раствором с гидроксидом натрия Первичная реакция производит карбонат натрия:
- СО 2 + 2NaOH → Na 2 CO 3 + H 2 O
Дальнейшее добавление двуокиси углерода образует бикарбонат натрия, который при достаточно высокой концентрации будет оседать:
- Na 2 CO 3 + СО 2 + H 2 O → 2NaHCO 3
Добыча
Природные месторождения нахколину (NaHCO 3) найдены в пластах эоцена (55.8-33.9 млн лет) в Колорадо. Нахколин наносился как осадок в периоды высокого испарения в водоеме. Сода коммерчески добываемого растворением нахколину в горячей воде и восстанавливается естественным процессом кристаллизации при охлаждении.
Химические свойства
Бикарбонат натрия — амфотерна соединение. Водные растворы имеют слабощелочной свойства в связи с образованием углекислоты и гидроксид-иона. Реакция бикарбоната натрия и кислоты образует соли и углекислоту, которая легко разлагается на углекислый газ и воду:
- NaHCO 3 + HCl → NaCl + H 2 CO 3
- H 2 CO 3 → H 2 O + CO 2
Бикарбонат натрия вступает в реакцию с уксусной кислотой, с образованием ацетата натрия, воды и углекислого газа:
- NaHCO 3 + СН 3 COOH → CH 3 COONa + H 2 O + CO 2
Бикарбонат натрия вступает в реакцию с основами, такими как гидроксид натрия с образованием карбонатов:
- NaHCO 3 + NaOH → Na 2 CO 3 + H 2 O
Бикарбонат натрия вступает в реакцию с карбоксильной группой белков, по созданию СО2. Эта реакция используется для проверки наличия карбоксильных групп.
Термическое разложение
Выше 70 ° С, бикарбонат натрия постепенно распадается на карбонат натрия, воду и углекислый газ. Разложение при температуре 200 ° C:
- 2NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2
Большинство бикарбонатов вступает в реакцию дегидратации. При дальнейшем нагревании превращается в оксид натрия (при температуре около 1000 ° С.):
- Na 2 CO 3 → Na 2 O + CO 2
Эти преобразования используются при использования NaHCO 3 в пожаротушения («BC порошок») как порошкообразный огнетушитель.
Применение
Кухня
Бикарбонат натрия преимущественно используется в кулинарии для выпечки, в качестве разрыхлителя. Он вступает в реакцию с кислыми компонентами жидкого теста, выпуская углекислый газ, который вызывает расширение теста и формирует характерные текстуры в блинах, пирогах, хлебе и другие хлебобулочных изделиях. Многие виды выпечки содержат бикарбонат натрия в сочетании с одним или несколькими кислыми фосфатами (которые особенно хорошо вступают в реакцию).
Бикарбонат натрия иногда используется в приготовлении овощей, чтобы размягчить их, хотя это вышло из моды, так как большинство людей теперь предпочитают свежие, так как они содержат больше питательных веществ. И все же, все еще используется в азиатской кухне, чтобы розмякшиты мясо. Бикарбонат натрия может реагировать с кислотами в продуктах питания, в том числе с витамином С (L-аскорбиновая кислота).
Термическое разложение бикарбоната натрия действует как разрыхлитель, выпуская углекислый газ при высоких температурах. Образование углекислого газа начинается при температуре выше 80 ° C.
Нейтрализация кислот и оснований
Многие лаборатории держат бикарбонат натрия под рукой, поскольку он проявляет амфотерные свойства, реагируя с кислотами и основаниями. Кроме того, он относительно безвреден в большом количестве, следовательно, нет ничего плохого в использовании избытка бикарбоната натрия. Широкий спектр его использования вызванный его нейтрализующими свойствами, в частности для сокращения распространения белого фосфора с зажигательными пулями внутри раны, для повышения pH воды (увеличение общей щелочности), где содержатся высокие концентрации хлора (2-5 промилле) в плавательных бассейнах и аквариумах.
Медицинское применение
Как лечебное средство соду применяют:
- для смягчения кашля: сода способствует разжижению мокроты;
- в виде полосканий при боли в горле как бактерицидное и противовоспалительное средство;
- при внезапном нападении аритмии (слабый раствор соды поможет успокоить сердцебиение)
- при гипертонии (выводит жидкость из организма, тем самым помогая снизить артериальное давление)
- для пополнения потерянной жидкости организмом: при поносах, рвоте;
- для снятия зуда при укусах насекомых;
- для чистки кишечника (клизмы с раствором соды)
- при простуде (ингаляции содовым раствором)
- при конъюнктивитах (промывают глаза слабым раствором соды)
- при лечении грибковых заболеваний ног (примочки из слабого раствора соды)
- для очистки и отбеливания зубов;
- для размягчения ороговевшей кожи на локтях и ступнях ног (теплые ванночки с содой)
- при изжоге (как препарат, активно нейтрализует соляную кислоту в желудке).
Бикарбонат натрия может быть использован в первой медицинской помощи, при лечении ожогов, для предотвращения образования пузырей и рубцов. Это связано с эндотермическим реакцией, которая происходит между бикарбонатом натрия и водой. Натрий бикарбонат обладает антисептическими свойствами. Он используется также для лечения гиперкалиемии. Так как бикарбонат натрия может привести к алкалоза, его иногда используют для лечения передозировки аспирина. Аспирина нужно кислую среду для надлежащего поглощения и щелочная среда предотвращает поглощению в случае передозировки. Бикарбонат натрия также используется в лечении передозировки антидепрессантами. Он может также применяться местно в виде пасты, чтобы уменьшить укусы насекомых.
Личная гигиена
Бикарбонат натрия может быть использован как эксфолиант. Его частицы округлой и тонкой текстуры идеально подходят для пилинга. Сода как отшелушивающий скраб удаляет бесцветные клетки кожи, пострадавших от гиперпигментации и рубцов.
Бикарбонат натрия также используется в качестве ингредиента в жидкостях для полоскания рта. Он работает как механический очиститель для на зубов и десен, нейтрализует производство кислоты во рту, а также в качестве антисептика, чтобы предотвратить заражение инфекциями.
Паста, произведенная из бикарбоната натрия и 3% перекиси водорода, может быть использована в качестве альтернативы пастам без фтору.Паста с бикарбонатом натрия в сочетании с другими ингредиентами может быть использована в качестве сухого или влажного дезодоранта. Сода может быть использована и как шампунь.
Пищевая сода в спорте
Небольшие количества бикарбоната натрия полезны в качестве добавки для спортсменов в скоростно-событий на основе, как и средние дистанции бега, продолжительностью от одной до семи минут. Но передозировки представляет серьезную опасность, поскольку бикарбонат натрия слаботоксичный. Кроме того, такая практика приводит к значительному увеличению натрия в рационе.
Как очищающее средство
Паста из соды может быть очень эффективной в уборке и очищены. Для очистки алюминиевых объектов, использование бикарбоната натрия не рекомендуется, поскольку он уничтожает тонкий защитный инертный слой оксида и делает этот металл очень реактивным. Разведение в теплой воде может удалить пятна из серебра.
Соду обычно добавляют при стирке в качестве смягчения, а также для удаления запахов с одежды. Бикарбонат натрия также эффективен в удалении пятен от чая и кофе в чашках при разведении с теплой водой.
Как биопестицидов
Бикарбонат натрия может быть эффективным способом контроля роста грибка, и в Соединенных Штатах зарегистрирован как биопестицидов.
Разное
Бикарбонат натрия может быть использован для тушения небольших пожаров которые были вызывании возгоранием жира или возгоранием электричества. Тем не менее, он не может быть использован при пожарах глубоких фритюрниц, это может привести к разбрызгивания масла.
Его можно вводить в бассейны, спа, и садовые пруды для поднятия рН уровня. Он слаб дезинфицирующее средство, и может быть эффективным фунгицидом против некоторых организмов.
Так как он действует в качестве нейтрализующего агента, то он может быть использован для поглощения запахов, вызванных сильными кислотами. Это его свойство используется для поглощения запаха в старых книгах.
Производство в Украине
Единственным производителем пищевой соды в Украине до 2010 года был Лисичанский содовый завод. В этом же году производство заводе остановилось в связи с банкротством. Начиная с 2013 года основным производителем пищевой соды в стране становится Крымский содовый завод.
ПАО «Крымский содовый завод» занимает около 80% украинского рынка кальцинированной соды и более 2% мирового. В 2013 году завод выпустил 582 тыс. Тонн соды кальцинированной, в том числе сода марки «А» — 427,5 тыс. Тонн, 24,4 тыс. Тонн пищевой соли, а также более 4 тыс. Тонн пищевой соды. С 2004 года «Крымский содовый завод» входит в международную группу компаний Group DF.
Видео по теме
Изображения по теме
info-farm.ru
Гидрокарбонат натрия соляная кислота — Геморрой
Как известно, даже самые прекрасные и полезные вещи могут быть использованы во зло и разрушение (в том числе — и саморазрушение)
Как известно «яд от лекарства отличается лишь дозой».
Поэтому к употреблению соды нужно подходить очень внимательно и вдумчиво.
Иначе даже ТАКОЙ продукт, как сода, навредит здоровью. Повредит даже не смотря на то, что сода — это ПЕПЕЛ БОЖЕСТВЕННОГО ОГНЯ
О СОДЕ ИЗ РАЗНЫХ ИСТОЧНИКОВ
прежде всего здесь то, что собрал А.Т.Огулов, я же лишь дополнял
Бикарбонат натрия NaHCO3, сода (или по другому: питьевая сода, пищевая сода, гидрокарбонат натрия, натрий двууглекислый) — это натриевая соль угольной кислоты (h3CO3 — слабая двухосновная кислота).
Название «сода» происходит от sodium — так в английском и французском языках называется элемент натрий.
Натриевых солей, которые имеют в своем названии слово «сода» существует несколько: кальцинированная сода (карбонат натрия), каустическая сода (гидроксид натрия, или «едкий натр»), стиральная сода (декагидрат карбоната натрия) и пищевая сода (гидрокарбонат натрия).
Сода впервые описана в 1801 немецким аптекарем Б. Розе
В соответствии с основностью, угольная кислота даёт два ряда солей: средние — карбонаты с анионом CO32- (водные растворы имеют сильнощелочную реакцию) и кислые — гидрокарбонаты с анионом HCO3- (водные растворы имеют слабощелочную реакцию).
При растворении соды в воде, если вода до 50 °С, то это гидролиз соли: обратимое взаимодействие соли с водой, приводящее к образованию слабого электролита, а от 80-150°С получается уже Na2CO3 — карбонат натрия, и в этом случае, водный раствор имеет уже сильнощелочную реакцию.
Поскольку реакция гидролиза эндотермическая, то повышение температуры смещает равновесие в системе вправо (в щелочную сторону), и степень гидролиза возрастает.
Таким образом, степень гидролиза можно увеличить, и например, чтобы сделать щелочной моющий раствор бельевой соды более активным, мы его нагреваем – степень гидролиза карбоната натрия при этом возрастает.
Гидрокарбонат натрия реагирует с соляной кислотой, с образованием соли и угольной кислоты. Угольная кислота очень слабая, крайне неустойчивое соединение, поэтому оно тут же распадается на углекислый газ и воду:
NaHCO3 + HCl > NaCl + h3CO3
h3CO3 > h3O + CO2^
Таким образом, с точки зрения метаболизма, сода относится к антацидам — антикислотным препаратам.
Взаимодействуя с соляной кислотой, сода устраивает в желудке «веселый пшик». В итоге вырабатывающийся углекислый газ «нападает» на стенки желудка.
Защищаясь, желудок вырабатывает новую дозу сока и соляной кислоты, и это дает дополнительное раздражение стенкам желудка.
Это явление известно как кислотный рикошет.
Поэтому применять соду надо только на пустой желудок, ибо в пустом желудке среда не кислая, а нейтральная.
Кислая среда в нем образуется только в связи с приемом пищи.
Кстати, именно с этим моментом связаны негативные опыты людей относительно соды.
Если человек слишком увлекается содой для понижения кислотности желудка (скажем, при классической изжоге), то со временем он может получить проблемы со стенками желудка.
В организме роль бикрбоната натрия заключается в нейтрализации кислот, повышении щелочных резервов организма в поддержании в норме кислотно-щелочного равновесия.
У человека показатель кислотности pH крови должен находиться в норме в пределах 7,35-7,47.
Если pH меньше 6,8 (очень кислая кровь, сильнейший ацидоз), то наступает смерть организма.
Причинами ацидоза являются кислотные компоненты в пище, воде и воздухе, лекарства, пестициды, стрессы.
При продолжительном стрессе почки не могут удерживать в крови высокую концентрацию щелочей, которые при этом теряются вместе с мочой.
Бикарбонат натрия, уничтожая ацидоз, повышает щелочные резервы организма, сдвигает кислотно-щелочное равновесие в щелочную сторону (pH примерно 7,45 и выше).
В щелочном организме происходит активация воды, т.е. диссоциация ее на ионы Н+ и OH- за счет аминных щелочей, аминокислот, белков, ферментов, нуклеотидов РНК и ДНК.
В активированной воде улучшаются все биохимические процессы: ускоряется синтез белка, быстрее обезвреживаются яды, активнее работают ферменты и аминные витамины, лучше действуют аминные лекарства и биологически активные вещества.
Здоровый организм для пищеварения вырабатывает сильно щелочные пищеварительные соки.
Пищеварение в двенадцатиперстной кишке происходит в щелочной среде под действием соков: панкреатический сок, желчь, сок бруттнеровой железы и сок слизистой оболочки двенадцатиперстной кишки. Все эти соки имеют высокую щелочность.
Панкреатический сок имеет pH=7,8-9,0.
Ферменты панкреатического сока действуют только в щелочной среде.
Желчь в норме имеет щелочную реакцию pH=8,50-8,80.
Секрет толстого кишечника имеет сильно щелочную среду pH=8,9-9,0.
При сильном ацидозе желчь становится кислой pH=6,6-6,9 вместо нормы pH=8,5-8,8.
Это ухудшает пищеварение, что приводит к отравлению организма продуктами плохого пищеварения, образованию камней в печени, желчном пузыре, кишечнике и почках.
В кислой среде спокойно живут глисты, описторхи, острицы, аскариды, цепни и др.
В щелочной среде они гибнут.
В кислом организме слюна кислая pH=5,7-6,7, что приводит к медленному разрушению эмали зубов.
В щелочном организме слюна щелочная: pH=7,2-7,9 и зубы не разрушаются.
Бикарбонат натрия, нейтрализуя избыточные кислоты, повышает щелочные резервы организма, делает мочу щелочной, что облегчает работу почек, сберегает глутаминовую аминокислоту, предотвращает отложение камней в почках.
Замечательным свойством бикарбоната натрия, является то, что избыток его легко выводится почками, давая щелочную реакцию мочи
В щелочной среде с активированной водой многократно возрастает биохимическая активность аминных витаминов: В1 (тиамин, кокарбоксилаза), В4 (холин), В5 или РР (никотиномид), В6 (пиридоксин), В12 (кобаламид).
Все эти витамины могут полностью проявляться только в щелочной среде.
При употреблении соды, улучшения её всасывания из кишечника, её можно принимать не только с горячей водой, но и с горячим молоком.
В этом случае, в кишечнике сода реагирует с аминокислотами молока, образуя щелочные натриевые соли аминокислот, которые легче, чем сода всасываются в кровь, повышая щелочные резервы организма.
Конечно, речь идет только о цельном натуральном молоке, а не о пастеризованном или стерилизованном молоке из современных супермаркетов.
Для борьбы с аскаридами и острицами применяют аминную щёлочь пиперазин, дополняя его содовыми клизмами.
Не нашли то, что искали? Воспользуйтесь поиском:
Source: studopedia.ru
gemorroy.uef.ru
Натрий гидрокарбонат — Справочник химика 21
НАТРИЯ ГИДРОКАРБОНАТ, см. Натрия карбонат. [c.181]НАТРИЙ УГЛЕКИСЛЫЙ КИСЛЫЙ (НАТРИЙ БИКАРБОНАТ, НАТРИЙ ГИДРОКАРБОНАТ, НАТРИЙ ДВУУГЛЕКИСЛЫЙ) [c.276]
Основными примесями в технической соде являются хлорид натрия, гидрокарбонаты натрия и аммония, сульфат натрия, соли железа (II), карбонаты кальция и магния, вода. От каких примесей сода может быть освобождена нагреванием Приведите уравнения реакций. [c.14]
Количественное определение. Помещают 0,15 г растертого в порошок листа в колбу объемом 100 мл. Добавляют 30,0 мл воды, перемешивают, взвешивают и помещают в водяную баню при 80—90°С. Нагревают в колбе с обратным холодильником в течение 15 мин. Дают остыть, взвешивают и доводят до первоначальной массы водой. Центрифугируют и переносят 20,0 мл надосадочной жидкости в делительную воронку объемом 150 мл. Добавляют 0,1 мл соляной кислоты ( — 70 г/л) ИР и встряхивают с 3 порциями хлороформа Р, по 15 мл каждая. Дают слоям разделиться и удаляют хлороформный слой. Добавляют 0,10 г натрия гидрокарбоната Р и встряхивают 3 мин. Центрифугируют и переносят 10,0 мл надосадочной жидкости в колбу объемом 100 мл с круглым основанием и горлом из матового стекла. Добавляют 20 мл раствора хлорида железа (III) (65 г/л) [c.323]
Объем микстуры составляет 221 мл. Ее готовят с применением сухого экстракта термопсиса (1 1), который помещают в подставку в количестве 0,1 г и растворяют в 170 мп воды. Раствор процеживают в отпускную склянку, содержащую 20 мл-5% раствора натрия гидрокарбоната (1 20) и 10 мл 10% раствора натрия бензоата (1 10), после чего добавляют предварительно смешанные алтейный сироп (20 мл) и нашатырно-анисовые капли (1 мл). [c.223]
Угольная кислота, карбонат кальция, карбонат натрия, гидрокарбонат кальция — 19 [c.284]
Карбонат натрия, гидроксид натрия, гидрокарбонат натрия. Поташ, [c.87]
Таким образом, в этом случае получается гидрокарбонат натрия. Из этого уравнения совершенно ясно, что получение гидрокарбоната натрия требует большего количества угольной кислоты, чем требуется для образования карбоната натрия. Гидрокарбонат натрия образуется из карбоната натрия и угольной кислоты. [c.268]
Насыщенные растворы. В некоторых сравнительно-редких случаях применяют в качестве лекарств насыщенные-растворы тех или иных лекарственных препаратов. Таков, например, насыщенный раствор натрия гидрокарбоната, иногда, применяемый в виде ушных капель. [c.174]
Чувствительность индикатора по отношению к катионам серебра зависит еще от способа наблюдения за появлением розовой окраски, концентрации хромата, pH раствора и присутствия посторонних солей. При 20″ С чувствительность хромата 3-iO при 80° С 2-10 . Величина pH раствора меняется от 6,3 до 10,5. Раствор должен быть бесцветным по тимолфталеину. Если анализируемый раствор имеет кислую реакцию, то его перед титрованием нейтрализуют небольшим избытком тетрабората натрия, гидрокарбоната натрия или калия, окисью магния или карбонатом кальция. Еке эти реактивы должны быть проверены на отсутствие хлорид-иона. Нельзя пользоваться для нейтрализации карбонатами натрия и калия, так как даже малая концентрация карбонат-ионов может вызвать осаждение карбоната серебра при последующем титровании раствора. [c.428]
Натрий гидрокарбонат см. Натрий углекислый кислый [c.341]
Оборудование и реактивы к опытам Т0.29—10.38. Штатив с пробирками. Горелка с треногой и керамическим треугольником. Фарфоровый тигель. Два стакана на. 200—25(0 мл. Тигельные щипцы. Тугоплавкие пробирки. Металлический штатив с лапками. Колонка (трубка) с активированным углем. Аппарат Киппа, заряженный мрамором и соляной кислотой. Сухие реактивы сахарный песок, оксид меди (I), активированный уголь (можно из противогаза), хлорид бария, хлорид стронция, хлорид кальция, карбонат натрия, гидрокарбонат натрия, нитрат меди (II), соляная кислота (2 н.), известковая вода.. Этиловый спирт. Фенолфталеин. Нейтральный лакмус. [c.176]
Хранение. Натрия гидрокарбонат следует хр ить в хорошо укупоренной таре. [c.210]
Для приготовления этого лекарства необходимо взять 2 г натрия гидрокарбоната, 0,5 г натрия бензоата, 20 мл простого сиропа и 100 мл дистиллированной воды. В итоге должно быть получено 120 мл микстуры. [c.159]
Общее требование. Натрия гидрокарбонат содержит не менее [c.210]
Реактивы. Нафталин 6,4 г, серная кислота (с1 — 1,84 г/см ) 6 мл, хлорид натрия, гидрокарбонат натрия [c.136]
Вещества, растворимые в хлороформе. Растворяют 0,25 г испытуемого вещества в 150 мл воды, добавляют 5 мл насыщенного раствора натрия гидрокарбоната Р и экстрагируют 3 порциями хлороформа Р, по 20 мл каждая. Промывают собранные вместе хлороформные экстракты 10 мл воды, фильтруют раствор хлороформа в химический стакан, промывают фильтр 2 порциями хлороформа Р, по 5 мл каждая, и добавляют промывную жидкость к фильтрату. Выпаривают собранные вместе фильтрат и промывную жидкость на водяной бане и высушивают остаток 1 ч при 105 °С масса остатка не должна превышать 5 мг (2,0%). Добавляют к остатку 10 мл воды остаток не растворяется. Затем добавляют 1 мл соляной кислоты ( — 70 г/л) ИР остаток растворяется. [c.371]
Разбавленные растворы солей сульфат натрия, сульфит натрия, сульфид натрия, карбонат натрия, гидрокарбонат натрия, ортофосфат натрия, гидроортофосфат натрия, дигидроортофосфат натрия, ацетат натрия, хлорид аммония, хлорид алюминия, сульфат цинка(П), сульфат меди(И), сульфат хрома(1И)-калия. [c.47]
Дополнительная информация. Натрия гидрокарбонат имеет соленый и слегка щелочной вкус. Устойчив на воздухе, но медленно разрушается во влажном воздухе. [c.210]
Исходя из указанного, сначала приготовляют раствор натрия гидрокарбоната, в котором затем растворяют осарсол. Лекарство-оформляют как наружное, содержащее ядовитое вещество. [c.174]
Установка титра. Около 0,2 г (точная навеска) сульфанило-вой кислоты, дважды перекристаллизованной из воды и высушенной при температуре 120 °С до постоянной массы, помещают в толстостенный стакан, прибавляют 0,1 г натрия гидрокарбоната, растворяют в 10 мл воды, прибавляют 60 мл воды, 10 мл разведенной хлористоводородной кислоты, 1 г калия бромида и далее поступают, как указано в статье Нитритометрия (ГФ XI, вып. [c.71]
Оборудование и реактивы. Штатив с пробирками. Горелка. Про-мыва.лка с дистиллированной водой. Три мерные колбы с пробками вместимостью 50 мл, три бюретки на 50 мл с исходными растворами н одна бюретка с дистиллированной водой. рН-метр. Растворы соляная кислота (2 н.), гидроксид натрия (2 и), сульфат алюминия, хлорвд железа (III), карбонат натрия, гидрокарбонат натрия, нитрат калия, ацетат натрия, гидрофосфат натрия, дигидрофосфат натрия,. фосфат натрия. Исходные растворы уксусной кислоты с точными концентрациями, близкими к 2 н., 1 н., и 0,2 н. Раствор метилового оранжевого, фенолфталеина. Раствор комбинированного индикатора (см. Приложение, табл. II). рН-индикаторная бумага. Сухие соли ацетат натрия, силикат натрия, карбонат натрия, сульфат алюминия, хлорид цинка, ацетат аммония, хлорид калия. Буферные растворы с pH от 2 до 10. [c.119]
Взмучивание дает хорошие результаты при суспендировании в водных средах основных солей висмута, окисей цинка и магния, кальция фосфата, карбоната и глицерофосфата, каолина, натрия гидрокарбоната, железа глицерофосфата, сульфаниламидов. Оно может быть применено для растирания гидрофобных лекарственных веществ в невязких жирных маслах, но практически непригодно для приготовления суспензий на касторовом масле или глицерине. [c.197]
Точную навеску порошка растертых драже, таблеток или количество таблеток, покрытых оболочкой, растертых в порошок, указанных в соответствующих частных статьях, взбалтывают в горячей воде ири подогревании на водяной бане, количественно переносят в мерную колбу вместимостью 500 мл, охлаждают, доводят объем раствора водой до метки и фильтруют первые 10 мл отбрасывают. Из полученного раствора готовят раствор второго разведения с таким расчетом, чтобы содержание в нем рибофлавина было около 0,0004 мг в 1 мл. В кюветы флуориметра помещают в одну — 10 мл испытуемого раствора, в другую— 10 мл раствора рабочего стандартного образца рибофлавина и измеряют флюоресценцию при длине волны около 440 нм. Параллельно в другие кюветы помещают в одну — 10 мл испытуемого раствора и в другую — 10 мл раствора рабочего стандартного образца рибофлавина, в каждую прибавляют по 0,1 г натрия гидрокарбоната и натрия гидросульфита, перемешивают и измеряют флюоресценцию растворов. [c.47]
Установка титра. Около 5 г натрия гидрокарбоната прокаливают до постоянной массы при температуре от 280 до 300 °С на песчаной бане в платиновом тигле, перемешивая время от времени платиновой проволокой. [c.74]
Реактивы и оборудование этиловый спирт (этанол) уксусная кислота 5%-ная NaOH, 10%-ный раствор в метиловом спирте реактив Пау-чи свинца ацетат (раствор) HaSOj (конц.) сульфат закисиого железа цинковая пыль натрия гидрокарбонат нодОД н. раствор крахмал. [c.61]
Реактивы н-Бутиловый спирт 16 мл, бромпд калия 25 г, серная кислота (d — 1,84 г/см ), гидросульфит натрия, гидрокарбонат натрия, хлорид кальция [c.81]
По своему действию на организм соли щелочных металлов можно разделить на 2 группы щелочные, например карбонаты, проявляющие антацидное действие, т. е. нейтрализующие избыточную кислотность (фармакопейный препарат —натрия гидрокарбонат ЫаНСОз) и нейтральные соли (соли серной кислоты, галогеноводородных кислот и фосфорной кислоты). [c.135]
Натрия гидрокарбоната раствор (40 г/л)ИР. Раствор гидрокарбоната натрия Р, содержащий около 42 г NaH Os в 1 л (приблизительно 0,5 моль/л). [c.334]
Количественное определение. Помещают 0,15 г растертого в порошок плода в колбу объемом 100 мл. Добавляют 30,0 мл воды, перемешивают, взвешивают и помещают в водяную баню при 80—90 °С. Нагревают с обратным холодильником в течение 15 мин. Дают остыть, взвешивают и доводят до первоначальной массы водой. Центрифугируют и переносят 20,0 мл надосадочной жидкости в делительную воронку объемом 150 мл. Добавляют 0,1 мл соляной кислоты (—70 г/л) ИР и встряхивают с 3 порциями хлороформа Р, по 15 мл каждая. Дают слоям разделиться и удаляют хлороформный слой. Добавляют 0,10 г натрия гидрокарбоната Р и встряхивают в течение 3 мин. Центрифугируют и переносят 10,0 мл надосадочной жидкости в колбу объемом 100 мл с круглым основанием и горлом из матового стекла. Добавляют 20 мл раствора хлор, да железа (И1) (65 г/л) ИР и перемешивают. Нагревают 20 мин с обратным холодильником на водяной бане с уровнем воды выше уровня жидкости в колбе добавляют 1 мл соляной кислоты ( — 420 г/л) ИР и нагревают еще 20 мин, часто встряхивая для растворения осадка. Охлаждают, переносят смесь в делительную воронку и встряхивают с 3 порциями, по 25 мл, эфира Р, предварительно использованного для ополаскивания колбы. Собирают эфирные слои и промывают 2 порциями воды, по 15 мл каждая. Переносят эфирные слои в мерную колбу и разводят до 100 мл эфиром Р. Осторожно выпаривают 10,0 мл досуха и растворяют остаток в 10,0 мл раствора, содержащего 5 мг ацетата магния Р в 1 мл метанола Р. Измеряют поглощение этого раствора в кювете с толщиной слоя 1 см при максимуме около 515 нм против контрольной кюветы, содержащей метанол Р. Рассчитывают в процентах содержание гидроксиантраценовых производных (сеннозид В), используя величину поглощаемости 24,0 ИГсм =240) по формуле 1,25 AfW, где Л — поглощение при 515 нм и W—масса исследуемого материала в граммах. [c.326]
Применение стабилизаторов основано на резком угнетении процессов разложения препаратов вследствие главным образом связывания различных химических соединений, активирующих деструкцию лекарственных веществ и присутствующих в растворе в ничтожных количествах или переходящих в раствор-из материалов упаковки, например из стекла. Так, для связывания щелочных компонентов стекла, вымываемых в растворг широко применяются слабые растворы минеральных кислот,, чаще других — хлористоводородной. Таким способом удается значительно повысить стабильность большой группы препаратов, являющихся солями сильных кислот и слабых оснований (новокаин, цититон, морфин и т. д.). Прибавлением слабых растворов щелочи (обычно раствора натрия гидроокиси и натрия гидрокарбоната) удается повысить стабильность в растворах препаратов, являющихся солями сильных оснований и слабых кислот (кофеин-бензоат натрия, никотиновая кислота, натрия тиосульфат). [c.31]
Технология указанных порошков весьма проста. Неизмель-ченными отпускаются те вещества, которые больные перед употреблением растворяют и которые по своей природе являются достаточно мелкодисперсными (каолин, ликоподий, крахмал, натрия гидрокарбонат и др.). Во всех остальных случаях лекарственные вещества измельчают так, как описано в общей части. [c.130]
Глицерин (Gly erinum). В медицинской практике обычно применяют глицерин, содержащий 12—16% воды. Это бесцветная, прозрачная, но имеющая запаха вязкая жидкость сладковатого вкуса, обладающая выраженной растворяющей способностью в отношении значительного числа лекарственных веществ. В глицерине хорошо растворяются танин, атропина сульфат, калия йодид, гексаметилентетрамин, анестезин, борная кислота, ацетилсалициловая кислота, натрия гидрокарбонат, цинка сульфат и т. д. Глицерин нерастворим в жирных маслах, практически нерастворим в эфире, но смешивается во всех соотношениях с водой и этиловым спиртом. Препарат весьма гигроскопичен. Обычно растворение лекарственных веществ в глицерине ведут при нагревании на водяной бане (40-50 С). [c.157]
Осарсол очень мало растворим в воде, но хорошо растворяется в растворах едких ш елочей и в растворе натрия гидрокарбоната, причем в последнем случае в растворе протекает реакция, нейтрализации. [c.174]
В склянку для отпуска отмеривают 80 мл дистиллированной воды, 40 мл 20% раствора кальция хлорида и 80 мл 5% раствора натрия гидрокарбоната, используя бюреточную установку. В результате при смешении растворов солей прописанных веществ образуется тонкая суспензия кальция карбоната. [c.200]
В щелочной среде, создаваемой нашатырно-анисовыми каплями и натрия гидрокарбонатом, происходит разложение гликози-да арбутина, содержащегося в толокнянке, с выведением хлопьевидного осадка продуктов разложения. [c.321]
Осарсол нерастворим в воде, но выход из затруднения можно найти, использовав его способность растворяться в растворах щелочей, карбонатов и гидрокарбонатов щелочных металлов. Для этого натрия гидрокарбонат растворяют в воде и понемногу добавляют осарсол при постепенном взбалтывании. Йод и калия йодрщ растворяют в 3—4 каплях воды в ступке, смешивают с глицерином, после чего добавляют раствор осарсола. [c.324]
Являясь сложной лекарственной формой, гранулы состоят, как правило, из лекарственных и вспомогательных веществ. В качестве вспомогательных веществ применяют сахар, молочный сахар, натрия гидрокарбонат, виннокаменную кислоту, альция гидрофосфат, крахмал, декстрин, глюкозу, тальк, сахарный сироп, этиловый спирт, воду, пищевые красители и другие вещества. [c.344]
Аналитическая химия (1973) — [ c.35 , c.53 , c.65 , c.68 , c.170 , c.369 , c.391 ]
Пособие по химии для поступающих в вузы 1972 (1972) — [ c.261 ]
Химия (1978) — [ c.234 ]
Большой энциклопедический словарь Химия изд.2 (1998) — [ c.362 ]
Справочник Химия изд.2 (2000) — [ c.281 , c.318 ]
Химия справочное руководство (1975) — [ c.27 ]
Вредные химические вещества Неорганические соединения элементов 1-4 групп (1988) — [ c.31 , c.33 , c.34 , c.35 , c.458 ]
Курс неорганической химии (1963) — [ c.219 , c.222 ]
Общая химия 1982 (1982) — [ c.441 ]
Общая химия 1986 (1986) — [ c.427 ]
Машинный расчет физико химических параметров неорганических веществ (1983) — [ c.119 , c.127 , c.135 , c.146 , c.150 , c.164 , c.165 , c.183 , c.196 ]
Общая химия (1974) — [ c.262 , c.264 ]
Курс аналитической химии Издание 5 (1982) — [ c.215 , c.222 ]
Общая химия Издание 18 (1976) — [ c.436 , c.438 ]
Общая химия Издание 22 (1982) — [ c.441 ]
Справочник по общей и неорганической химии (1997) — [ c.6 , c.59 , c.78 , c.107 , c.111 ]
Основы общей химии Том 2 Издание 3 (1973) — [ c.199 ]
Курс неорганической химии (1972) — [ c.197 , c.199 ]
chem21.info


