Формула Гипохлорита натрия структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: ClNaO
Химический состав Гипохлорита натрия
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| Cl | Хлор | 35.453 | 1 | 47,6% |
| Na | Натрий | 22.99 | 1 | 30,9% |
| O | Кислород | 15.999 | 1 | 21,5% |
Молекулярная масса: 74.442
Гипохлори́т на́трия (натрий хлорноватистокислый) — NaOCl, неорганическое соединение, натриевая соль хлорноватистой кислоты. Тривиальное (историческое) название водного раствора соли — «лабарракова вода» или «жавелевая вода».
История открытия
В 1774 году шведским химиком Карлом Вильгельмом Шееле был открыт хлор. Спустя 11 лет в 1785 году (по другим данным — в 1787 году), другой химик, француз Клод Луи Бертолле, обнаружил, что водный раствор этого газа (см.
Cl+H2O=HCl+HOCl
Небольшое Парижское предприятие Societé Javel, открытое в 1778 году на берегах Сены и возглавляемое Леонардом Альбаном (англ. Leonard Alban), адаптировало открытие Бертолле к промышленным условиям и начало выпуск белильной жидкости, растворяя газообразный хлор в воде. Однако получаемый продукт был очень нестабильным, поэтому в 1787 году процесс был модифицирован. Хлор стали пропускать через водный раствор поташа (карбоната калия), в результате чего образовывался стабильный продукт, обладающий высокими отбеливающими свойствами. Альбан назвал его «Eau de Javel» («жавелевая вода»). Новый продукт стал моментально популярен во Франции и Англии из-за лёгкости его перевозки и хранения.
В 1820 году французский аптекарь Антуан Лабаррак (фр. Antoine Germain Labarraque) заменил поташ на более дешёвую каустическую соду (гидроксид натрия). Получившийся раствор гипохлорита натрия получил название «Eau de Labarraque» («лабарракова вода»). Он стал широко использоваться для отбеливания и дезинфекции.
Он стал широко использоваться для отбеливания и дезинфекции.
Несмотря на то, что дезинфицирующие свойства гипохлорита были обнаружены в первой половине XIX века, использование его для обеззараживания питьевой воды и очистки сточных вод началось только в конце века. Первые системы водоочистки были открыты в 1893 году в Гамбурге; в США первый завод по производству очищенной питьевой воды появился в 1908 году в Джерси-Сити.
Физические свойства
Безводный гипохлорит натрия представляет собой неустойчивое бесцветное кристаллическое вещество.
Элементный состав: Na (30,9 %), Cl (47,6 %), O (21,5 %).
Хорошо растворим в воде: 53,4 г в 100 граммах воды (130 г на 100 г воды при 50 °C).
У соединения известно три кристаллогидрата:
- моногидрат NaOCl · H2O — крайне неустойчив, разлагается выше 60 °C, при более высоких температурах — со взрывом
- NaOCl · 2,5H2O — более устойчив, плавится при 57,5 °C.

пентагидрат NaOCl · 5H2O — наиболее устойчивая форма, представляет собой бледно-зеленовато-жёлтые (технического качества — белые) ромбические кристаллы (a = 0,808 нм, b = 1,606 нм, c = 0,533 нм, Z = 4). Не гигроскопичен, хорошо растворим в воде (в г/100 граммов воды, в пересчёте на безводную соль): 26 (−10 °C), 29,5 (0 °C), 38 (10 °C), 82 (25 °C), 100 (30 °C). В воздухе расплывается, переходя в жидкое состояние, из-за быстрого разложения. Температура плавления: 24,4 °C (по другим данным: 18 °C), при нагревании (30—50 °C) разлагается.
Плотность водного раствора гипохлорита натрия при 18 °C:
| 1% | 2% | 4% | 6% | 8% | 10% | 14% | |
|---|---|---|---|---|---|---|---|
| Плотность, г/л | 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 |
| 18 % | 22 % | 26 % | 30 % | 34 % | 38 % | 40 % | |
| 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Температура замерзания водных растворов гипохлорита натрия различных концентраций:
| 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % | |
|---|---|---|---|---|---|---|---|---|
| Температура замерзания, С | −1,0 | −2,2 | −4,4 | −7,5 | −10,0 | −13,9 | −19,4 | −29,7 |
Термодинамические характеристики гипохлорита натрия в бесконечно разбавленном водном растворе:
- стандартная энтальпия образования, ΔHo298: −350,4 кДж/моль;
- стандартная энергия Гиббса, ΔGo298: −298,7 кДж/моль.

Химические свойства
Разложение и диспропорционирование
Гипохлорит натрия — неустойчивое соединение, легко разлагающееся с выделением кислорода.Самопроизвольное разложение медленно происходит даже при комнатной температуре: за 40 суток пентагидрат (NaOCl · 5H
Гидролиз и разложение в водных растворах
Растворяясь в воде, гипохлорит натрия диссоциирует на ионы. Так как хлорноватистая кислота (HOCl) очень слабая (pKa = 7,537), гипохлорит-ион в водной среде подвергается гидролизу.
Именно наличие хлорноватистой кислоты в водных растворах гипохлорита натрия объясняет его сильные дезинфицирующие и отбеливающие свойства. Водные растворы гипохлорита натрия неустойчивы и со временем разлагаются даже при обычной температуре (0,085 % в сутки).
Окислительные свойства
Водный раствор гипохлорита натрия — сильный окислитель, вступающий в многочисленные реакции с разнообразными восстановителями, независимо от кислотно-щелочного характера среды.
Идентификация
Среди качественных аналитических реакций на гипохлорит-ион можно отметить выпадение коричневого осадка метагидроксида при добавлении при комнатной температуре испытуемого образца к щелочному раствору соли одновалентного таллия (предел обнаружения 0,5 мкг гипохлорита).
Другой вариант — иодкрахмальная реакция в сильнокислой среде и цветная реакция с 4,4’-тетраметилдиаминодифенилметаном или n, n’-диокситрифенилметаном в присутствии бромата калия.
Коррозионное воздействие
Гипохлорит натрия оказывает довольно сильное коррозионное воздействие на различные материалы, о чём свидетельствуют приведённые ниже данные:
| Материал | Концентрация NaOCl, масс. % | Форма воздействия | Температура, °C | Скорость и характер коррозии |
|---|---|---|---|---|
| Алюминий | 10; pH>7 | водный раствор | 25 | > 10 мм/год |
| Медь | 20 | водный раствор | 25 | > 10 мм/год |
| Медные сплавы | 10 | водный раствор | 25 | > 10 мм/год |
| Никель | 34 | водный раствор | 25 | 0,1—3,0 мм/год |
Физиологическое действие и воздействие на окружающую среду
NaOCl одно из лучших известных средств, проявляющих благодаря гипохлорит-иону сильную антибактериальную активность. Он убивает микроорганизмы очень быстро и уже в очень низких концентрациях. Наивысшая бактерицидная способность гипохлорита проявляется в нейтральной среде, когда концентрации HClO и гипохлорит-анионов ClO− приблизительно равны (см. подраздел «Гидролиз и разложение в водных растворах»). Разложение гипохлорита сопровождается образованием ряда активных частиц и, в частности, синглетного кислорода, обладающего высоким биоцидным действием. Образующиеся частицы принимают участие в уничтожении микроорганизмов, взаимодействуя с биополимерами в их структуре, способными к окислению. Исследованиями установлено, этот процесс аналогичен, тому что происходит естественным образом во всех высших организмах. Некоторые клетки человека (нейтрофилы, гепатоциты и др.) синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями. Дрожжеподобные грибы, вызывающие кандидоз, Candida albicans, погибают in vitro в течение 30 секунд при действии 5,0—0,5%-го раствора NaOCl; при концентрации действующего вещества ниже 0,05 % они проявляют устойчивость спустя 24 часа после воздействия.
Он убивает микроорганизмы очень быстро и уже в очень низких концентрациях. Наивысшая бактерицидная способность гипохлорита проявляется в нейтральной среде, когда концентрации HClO и гипохлорит-анионов ClO− приблизительно равны (см. подраздел «Гидролиз и разложение в водных растворах»). Разложение гипохлорита сопровождается образованием ряда активных частиц и, в частности, синглетного кислорода, обладающего высоким биоцидным действием. Образующиеся частицы принимают участие в уничтожении микроорганизмов, взаимодействуя с биополимерами в их структуре, способными к окислению. Исследованиями установлено, этот процесс аналогичен, тому что происходит естественным образом во всех высших организмах. Некоторые клетки человека (нейтрофилы, гепатоциты и др.) синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями. Дрожжеподобные грибы, вызывающие кандидоз, Candida albicans, погибают in vitro в течение 30 секунд при действии 5,0—0,5%-го раствора NaOCl; при концентрации действующего вещества ниже 0,05 % они проявляют устойчивость спустя 24 часа после воздействия.
 Растворы NaOCl могут быть опасны при ингаляционном воздействии из-за возможности выделения токсичного хлора (раздражающий и удушающий эффект). Прямое попадание гипохлорита в глаза, особенно при высоких концентрациях, может вызвать химический ожог и даже привести к частичной или полной потере зрения. Бытовые отбеливатели на основе NaOCl могут вызвать раздражение кожи, а промышленные привести к серьёзным язвам и отмиранию ткани. Приём внутрь разбавленных растворов (3—6 %) гипохлорита натрия приводит обычно только к раздражению пищевода и иногда ацидозу, в то время как концентрированные растворы способны вызвать довольно серьёзные повреждения, вплоть до перфорации желудочно-кишечного тракта. Несмотря на свою высокую химическую активность, безопасность гипохлорита натрия для человека документально подтверждена исследованиями токсикологических центров Северной Америки и Европы, которые показывают, что вещество в рабочих концентрациях не несёт каких-либо серьёзных последствий для здоровья после непреднамеренного проглатывания или попадания на кожу.
Растворы NaOCl могут быть опасны при ингаляционном воздействии из-за возможности выделения токсичного хлора (раздражающий и удушающий эффект). Прямое попадание гипохлорита в глаза, особенно при высоких концентрациях, может вызвать химический ожог и даже привести к частичной или полной потере зрения. Бытовые отбеливатели на основе NaOCl могут вызвать раздражение кожи, а промышленные привести к серьёзным язвам и отмиранию ткани. Приём внутрь разбавленных растворов (3—6 %) гипохлорита натрия приводит обычно только к раздражению пищевода и иногда ацидозу, в то время как концентрированные растворы способны вызвать довольно серьёзные повреждения, вплоть до перфорации желудочно-кишечного тракта. Несмотря на свою высокую химическую активность, безопасность гипохлорита натрия для человека документально подтверждена исследованиями токсикологических центров Северной Америки и Европы, которые показывают, что вещество в рабочих концентрациях не несёт каких-либо серьёзных последствий для здоровья после непреднамеренного проглатывания или попадания на кожу. Также подтверждено, что гипохлорит натрия не является мутагенным, канцерогенным и тератогенным соединением, а также кожным аллергеном. Международное агентство по изучению рака пришло к выводу, что питьевая вода, прошедшая обработку NaOCl, не содержит человеческих канцерогенов.
Также подтверждено, что гипохлорит натрия не является мутагенным, канцерогенным и тератогенным соединением, а также кожным аллергеном. Международное агентство по изучению рака пришло к выводу, что питьевая вода, прошедшая обработку NaOCl, не содержит человеческих канцерогенов.Пероральная токсичность соединения:
- Мыши: ЛД50 (англ. LD50) = 5800 мг/кг;
- Человек (женщины): минимально известная токсическая доза англ. (англ. TDLo) = 1000 мг/кг.
Внутривенная токсичность соединения:
- Человек: минимально известная токсическая доза (англ. TDLo) = 45 мг/кг.
При обычном бытовом использовании гипохлорит натрия распадается в окружающей среде на поваренную соль, воду и кислород. Другие вещества могут образоваться в незначительном количестве. По заключению Шведского института экологических исследований, гипохлорит натрия, скорее всего, не создаёт экологических проблем при его использовании в рекомендованном порядке и количествах. Гипохлорит натрия не представляет угрозы с точки зрения пожароопасности.
Гипохлорит натрия не представляет угрозы с точки зрения пожароопасности.
Промышленное производство
Мировое производство
Оценка мирового объёма производства гипохлорита натрия представляет определённую трудность в связи с тем, что значительная его часть производится электрохимическим способом по принципу «in situ», то есть на месте его непосредственного потребления (речь идёт об использовании соединения для дезинфекции и подготовки воды). По данным на 2005 год, приблизительный глобальный объём производства NaOCl составил около 1 млн тонн, при этом почти половина этого объёма была использована для бытовых, а другая половина — для промышленных нужд.
Обзор промышленных способов получения
Выдающиеся отбеливающие и дезинфекционные свойства гипохлорита натрия привели к интенсивному росту его потребления, что в свою очередь дало стимул для создания крупномасштабных промышленных производств.
В современной промышленности существует два основных метода производства гипохлорита натрия:
- химический метод — хлорирование водных растворов гидроксида натрия;
- электрохимический метод — электролиз водного раствора хлорида натрия.
Применение
Обзор направлений использования
Гипохлорит натрия является безусловным лидером среди гипохлоритов других металлов, имеющих промышленную значимость, занимая 91 % мирового рынка. Почти 9 % остаётся за гипохлоритом кальция, гипохлориты калия и лития имеют незначительные объёмы использования.
Весь широкий спектр использования гипохлорита натрия можно разбить на три условные группы:
- использование для бытовых целей;
- использование для промышленных целей;
- использование в медицине.
Бытовое использование включает в себя:
- использование в качестве средства для дезинфекции и антибактериальной обработки;
- использование для отбеливания тканей;
- химическое растворение санитарно-технических отложений.

Промышленное использование включает в себя:
- промышленное отбеливание ткани, древесной массы и некоторых других продуктов;
- промышленная дезинфекция и санитарно-гигиеническая обработка;
- очистка и дезинфекция питьевой воды для систем коммунального водоснабжения;
- очистка и обеззараживание промышленных стоков;
- химическое производство.
По оценке экспертов IHS, около 67 % всего гипохлорита натрия используется в качестве отбеливателя и 33 % для нужд дезинфекции и очистки, причём последнее направление имеет тенденцию к росту. Наиболее распространённое направление промышленного использования гипохлорита (60 %) — дезинфекция промышленных и бытовых сточных вод. Общий глобальный рост объёмов промышленного потребления NaOCl в 2012—2017 гг оценивается в 2,5 % ежегодно. Рост мирового спроса на гипохлорит натрия для бытового использования в 2012—2017 гг оценивается примерно в 2 % ежегодно.
Применение в бытовой химии
Гипохлорит натрия находит широкое применение в бытовой химии и входит в качестве активного ингредиента многочисленных средств, предназначенных для отбеливания, очистки и дезинфекции различных поверхностей и материалов. В США примерно 80 % всего гипохлорита, используемого домохозяйствами, приходится на бытовое отбеливание. Обычно, в быту применяются растворы с концентрацией в диапазоне от 3 до 6 % гипохлорита. Коммерческая доступность и высокая эффективность действующего вещества определяет его широкое использование различными производственными компаниями, где гипохлорит натрия или средства на его основе выпускаются под различными торговыми марками.
Применение в медицине
Использование гипохлорита натрия для дезинфекции ран впервые было предложено не позднее 1915 года. В современной медицинской практике антисептические растворы гипохлорита натрия используются, в основном, для наружного и местного применения в качестве противовирусного, противогрибкового и бактерицидного средства при обработке кожи, слизистых оболочек и ран. Гипохлорит активен в отношении многих грамположительных и грамотрицательных бактерий, большинства патогенных грибов, вирусов и простейших, хотя его эффективность снижается в присутствии крови или её компонентов. Низкая стоимость и доступность гипохлорита натрия делает его важным компонентом для поддержания высоких гигиенических стандартов во всём мире. Это особенно ярко проявляется в развивающихся странах, где использование NaOCl стало решающим фактором для остановки холеры, дизентерии, брюшного тифа и других водных биотических заболеваний. Так, при вспышке холеры в странах Латинской Америки и Карибского бассейна в конце XX века благодаря гипохлориту натрия удалось свести к минимуму заболеваемость и смертность, что было сообщено на симпозиуме по тропическим болезням, проводимого под эгидой Института Пастера. Для медицинских целей в России гипохлорит натрия используется в качестве 0,06%-го раствора для внутриполостного и наружного применения, а также раствора для инъекций. В хирургической практике он применяется для обработки, промывания или дренирования операционных ран и интраоперационной санации плевральной полости при гнойных поражениях; в акушерстве и гинекологии — для периоперационной обработки влагалища, лечения бартолинита, кольпита, трихомониаза, хламидиоза, эндометрита, аднексита и т.
Гипохлорит активен в отношении многих грамположительных и грамотрицательных бактерий, большинства патогенных грибов, вирусов и простейших, хотя его эффективность снижается в присутствии крови или её компонентов. Низкая стоимость и доступность гипохлорита натрия делает его важным компонентом для поддержания высоких гигиенических стандартов во всём мире. Это особенно ярко проявляется в развивающихся странах, где использование NaOCl стало решающим фактором для остановки холеры, дизентерии, брюшного тифа и других водных биотических заболеваний. Так, при вспышке холеры в странах Латинской Америки и Карибского бассейна в конце XX века благодаря гипохлориту натрия удалось свести к минимуму заболеваемость и смертность, что было сообщено на симпозиуме по тропическим болезням, проводимого под эгидой Института Пастера. Для медицинских целей в России гипохлорит натрия используется в качестве 0,06%-го раствора для внутриполостного и наружного применения, а также раствора для инъекций. В хирургической практике он применяется для обработки, промывания или дренирования операционных ран и интраоперационной санации плевральной полости при гнойных поражениях; в акушерстве и гинекологии — для периоперационной обработки влагалища, лечения бартолинита, кольпита, трихомониаза, хламидиоза, эндометрита, аднексита и т. п.; в оториноларингологии — для полосканий носа и горла, закапывания в слуховой проход; в дерматологии — для влажных повязок, примочек, компрессов при различных видах инфекций. В стоматологической практике гипохлорит натрия наиболее широко применяется в качестве антисептического ирригационного раствора (концентрация NaOCl 0,5—5,25 %) в эндодонтии. Популярность NaOCl определяется общедоступностью и дешевизной раствора, а также бактерицидным и противовирусным эффектом в отношении таких опасных вирусов как ВИЧ, ротавирус, вирус герпеса, вирусы гепатита A и B. Имеются данные об использовании гипохлорита натрия для лечения вирусных гепатитов: он обладает широким спектром противовирусных, детоксикационных и антиоксидантных эффектов. Растворы NaOCl можно использовать в целях стерилизации некоторых медицинских изделий, предметов ухода за больными, посуды, белья, игрушек, помещений, твёрдой мебели, сантехнического оборудования. Из-за высокой коррозионной активности, гипохлорит не применяют для металлических приборов и инструментов.
п.; в оториноларингологии — для полосканий носа и горла, закапывания в слуховой проход; в дерматологии — для влажных повязок, примочек, компрессов при различных видах инфекций. В стоматологической практике гипохлорит натрия наиболее широко применяется в качестве антисептического ирригационного раствора (концентрация NaOCl 0,5—5,25 %) в эндодонтии. Популярность NaOCl определяется общедоступностью и дешевизной раствора, а также бактерицидным и противовирусным эффектом в отношении таких опасных вирусов как ВИЧ, ротавирус, вирус герпеса, вирусы гепатита A и B. Имеются данные об использовании гипохлорита натрия для лечения вирусных гепатитов: он обладает широким спектром противовирусных, детоксикационных и антиоксидантных эффектов. Растворы NaOCl можно использовать в целях стерилизации некоторых медицинских изделий, предметов ухода за больными, посуды, белья, игрушек, помещений, твёрдой мебели, сантехнического оборудования. Из-за высокой коррозионной активности, гипохлорит не применяют для металлических приборов и инструментов. Отметим также применение растворов гипохлорита натрия в ветеринарии: они используются для дезинфекции животноводческих помещений.
Отметим также применение растворов гипохлорита натрия в ветеринарии: они используются для дезинфекции животноводческих помещений.
Промышленное применение
Применение в качестве промышленного отбеливателя
Использования гипохлорита натрия в качестве отбеливателя является одним из приоритетных направлений промышленного использования наряду с дезинфекцией и очисткой питьевой воды. Мировой рынок только в этом сегменте превышает 4 млн тонн. Обычно, для промышленных нужд в качестве отбеливателя используются водные растворы NaOCl, содержащие 10—12 % действующего вещества. Гипохлорит натрия широко используется в качестве отбеливателя и пятновыводителя в текстильном производстве и промышленных прачечных и химчистках. Он может быть безопасно использован для многих видов тканей, включая хлопок, полиэстер, нейлон, ацетат, лён, вискозу и другие. Он очень эффективен для удаления следов почвы и широкого спектра пятен в том числе, кровь, кофе, трава, горчица, красное вино и т. д. Гипохлорит натрия также используется в целлюлозно-бумажной промышленности для отбелки древесной массы. Отбелка с использованием NaOCl обычно следует за этапом хлорирования и является одной из ступеней химической переработки древесины, используемой для достижения высокой степени белизны целлюлозы. Обработку волокнистых полуфабрикатов проводят в специальных башнях гипохлоритной отбелки в щелочной среде (pH 8—9), температуре 35—40 °C, в течение 2—3 часов. В течение этого процесса происходит окисление и хлорирование лигнина, а также разрушение хромофорных групп органических молекул.
д. Гипохлорит натрия также используется в целлюлозно-бумажной промышленности для отбелки древесной массы. Отбелка с использованием NaOCl обычно следует за этапом хлорирования и является одной из ступеней химической переработки древесины, используемой для достижения высокой степени белизны целлюлозы. Обработку волокнистых полуфабрикатов проводят в специальных башнях гипохлоритной отбелки в щелочной среде (pH 8—9), температуре 35—40 °C, в течение 2—3 часов. В течение этого процесса происходит окисление и хлорирование лигнина, а также разрушение хромофорных групп органических молекул.
Применение в качестве промышленного дезинфицирующего средства
Широкое применение гипохлорита натрия в качестве промышленного дезинфицирующего средства связано, прежде всего, со следующими направлениями:
- дезинфекция питьевой воды перед подачей в распределительные системы городского водоснабжения;
- дезинфекция и альгицидная обработка воды плавательных бассейнов и прудов;
- обработка бытовых и промышленных сточных вод, очистка от органических и неорганических примесей;
- в пивоварении, виноделии, молочной промышленности — дезинфекция систем, трубопроводов, резервуаров;
- фунгицидная и бактерицидная обработка зерна;
- дезинфекция воды рыбохозяйственных водоёмов;
- дезинфекция технических помещений.

Гипохлорит как дезинфектант входит в состав некоторых средств для поточной автоматизированной мойки посуды и некоторых других жидких синтетических моющих средств. Промышленные дезинфицирующие и отбеливающие растворы выпускаются многими производителями под различными торговыми марками.
Использование для дезинфекции воды
Окислительная дезинфекция с помощью хлора и его производных — едва ли не самый распространённый практический метод обеззараживания воды, начало массового использование которого многими странами Западной Европы, США и Россией датируется первой четвертью XX века.
Использование гипохлорита натрия в качестве дезинфицирующего агента взамен хлора является перспективным и обладает рядом существенных преимуществ:
- реагент может быть синтезирован электрохимическим методом непосредственно на месте использования из легкодоступной поваренной соли;
- необходимые показатели качества питьевой воды и воды для гидротехнических сооружений могут быть достигнуты за счёт меньшего количества активного хлора;
- концентрация канцерогенных хлорорганических примесей в воде после обработки существенно меньше;
- замена хлора на гипохлорит натрия способствует улучшению экологической обстановки и гигиенической безопасности[79]:[стр.
 36].
36]. - гипохлорит обладает более широким спектром биоцидного действия на различные типы микроорганизмов при меньшей токсичности;
Для целей очистки бытовой воды используются разбавленные растворы гипохлорита натрия: типовая концентрация активного хлора в них составляет 0,2—2 мг/л против 1—16 мг/л для газообразного хлора[80]. Разбавление промышленных растворов до рабочей концентрации производят непосредственно на месте.
Также с технической точки зрения, принимая во внимание условие использования в РФ, эксперты отмечают:
- существенно более высокую степень безопасности технологии производства реагента;
- относительную безопасность хранения и транспортировки до места использования;
- лояльные требования к технике безопасности при работе с веществом и его растворами на объектах;
- неподведомственность технологии обеззараживания воды гипохлоритом Ростехнадзору РФ.
Использование гипохлорита натрия для дезинфекции воды в России становится все более популярным и активно внедряется в практику ведущими промышленными центрами страны. Так, в конце 2009 года, в Люберцах началось строительство завода по производству NaOCl мощностью 50 тыс. тонн/год для нужд Московского городского хозяйства. Правительством Москвы было принято решение о переводе систем обеззараживания воды московских станции водоподготовки с жидкого хлора на гипохлорит натрия (с 2012 г.). Завод по производству гипохлорита натрия будет введён в эксплуатацию в 2015 г.
Так, в конце 2009 года, в Люберцах началось строительство завода по производству NaOCl мощностью 50 тыс. тонн/год для нужд Московского городского хозяйства. Правительством Москвы было принято решение о переводе систем обеззараживания воды московских станции водоподготовки с жидкого хлора на гипохлорит натрия (с 2012 г.). Завод по производству гипохлорита натрия будет введён в эксплуатацию в 2015 г.
Производство гидразина
Гипохлорит натрия используется в так называемом процесса Рашига (англ. Raschig Process, окисление аммиака гипохлоритом) — основном промышленном способе получения гидразина, открытого немецким химиком Фридрихом Рашигом в 1907 году. Химия процесса выглядит следующим образом: на первой стадии аммиак окисляется до хлорамина, который затем, реагирует с аммиаком, образуя собственно гидразин.
Прочие направления использования
Среди прочих направлений использования гипохлорита натрия отметим:
- в промышленном органическом синтезе или гидрометаллургическом производстве для дегазации токсичных жидких и газообразных отходов, содержащих циановодород или цианиды;
- окислитель для очистки сточных вод промышленных предприятий от примесей сероводорода, неорганических гидросульфидов, сернистых соединений, фенолов и др.
 ;
; - в электрохимических производствах в качестве травителя для германия и арсенида галлия;
- в аналитической химии как реагент для фотометрического определения бромид-иона;
- в пищевой и фармацевтической промышленности для получения пищевого модифицированного крахмала;
- в военном деле как средство для дегазации боевых отравляющих веществ, таких как иприт, льюизит, зарин и V-газы.
ICSC 0482 — ГИПОХЛОРИТ НАТРИЯ (ВОДНЫЙ РАСТВОР, АКТИВНЫЙ ХЛОР
ICSC 0482 — ГИПОХЛОРИТ НАТРИЯ (ВОДНЫЙ РАСТВОР, АКТИВНЫЙ ХЛОР| ГИПОХЛОРИТ НАТРИЯ (ВОДНЫЙ РАСТВОР, АКТИВНЫЙ ХЛОР | ICSC: 0482 |
| Апрель 2017 |
| CAS #: 7681-52-9 | |
| UN #: 1791 |
|
| EINECS #: 231-668-3 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее. При пожаре выделяет раздражающие или токсичные пары (или газы). Нагревание приводит к повышению давления с риском взрыва. При пожаре выделяет раздражающие или токсичные пары (или газы). Нагревание приводит к повышению давления с риском взрыва. |
В случае возникновения пожара в рабочей зоне, использовать надлежащие средства пожаротушения. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЯ ТУМАНА! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. Боли в горле. | Применять вентиляцию. | Свежий воздух, покой. Обратиться за медицинской помощью. |
| Кожа | Покраснение. Боль. | Защитные перчатки. | Сначала промыть большим количеством воды в течение не менее 15 минут, затем удалить загрязненную одежду и снова промыть. обратиться за медицинской помощью . |
| Глаза | Покраснение. Боль. | Использовать средства защиты глаз. | Промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений). Обратиться за медицинской помощью. |
| Проглатывание | Ощущение жжения. Боль в горле. Кашель. Боль в животе. Рвота. Диарея. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. НЕ вызывать рвоту. Дать выпить один или два стакана воды. Обратиться за медицинской помощью. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Индивидуальная защита: респиратор с фильтром для неорганических газов и паров, подходящий для концентрации в вещества в воздухе. НЕ допускать попадания этого химического вещества в окружающую среду. Вентилировать. НеметаллическиеКак можно быстрее собрать пролитую жидкость в емкости с крышками. Смыть остаток большим количеством воды. НЕ допускать попадания этого химического вещества в окружающую среду. Вентилировать. НеметаллическиеКак можно быстрее собрать пролитую жидкость в емкости с крышками. Смыть остаток большим количеством воды. |
Согласно критериям СГС ООН ОСТОРОЖНО Может вызывать коррозию металловВызывает раздражение кожи и глаз Очень токсично для водной флоры и фауны Транспортировка |
| ХРАНЕНИЕ | |
| Отдельно от кислот. См. химические опасности. Прохладное место. Хранить в темноте. Хорошо закрывать. Хранить только в оригинальной упаковке. | |
| УПАКОВКА | |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| ГИПОХЛОРИТ НАТРИЯ (ВОДНЫЙ РАСТВОР, АКТИВНЫЙ ХЛОР | ICSC: 0482 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: NaClO |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| Вещество очень токсично для водных организмов. Это вещество попадает в окружающую среду при нормальном использовании. Однако следует проявлять большую осторожность, чтобы избежать какого-либо дополнительного высвобождения, например, при ненадлежащем удалении. |
| ПРИМЕЧАНИЯ |
|---|
Household bleaches usually contain about 5% sodium hypochlorite (about ph21, irritant), and more concentrated bleaches contain 10-15% sodium hypochlorite (about ph23, corrosive). Промойте загрязненную одежду большим количеством воды ввиду опасности возгорания Also consult ICSC #1119 (Sodium hypochlorite, active chlorine >10%). |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС Символ: Xi; R: 31-36/38; S: (1/2)-28-45-50-61; Примечание: B |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Хлорид натрия — это… Что такое Хлорид натрия?
| Хлорид натрия | |
| Общие | |
|---|---|
| Традиционные названия | обычная соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит[1] |
| Химическая формула | NaCl |
| Физические свойства | |
| Молярная масса | 58,44277 г/моль |
| Плотность | 2,165 г/см³ |
| Термические свойства | |
| Температура плавления | 800,8 °C |
| Температура кипения | 1465 °C |
Молярная теплоёмкость (ст. усл.) усл.) | 50,8 Дж/(моль·К) |
| Удельная теплота испарения | 170,85 кДж/моль Дж/кг |
| Удельная теплота плавления | 28,68 кДж/моль Дж/кг |
| Химические свойства | |
| pKa | 6,7–7,3 |
| Растворимость в воде | 35,6 (0 °C) 35,9 (25 °C) 39,1 (100 °C) г/100 мл |
| Растворимость в метаноле | 14,9 г/100 мл |
| Растворимость в аммиаке | 21,5 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,5442 (589 нм) |
| Структура | |
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) |
| Кристаллическая структура | гранецентрированная кубическая, cF8 |
| Классификация | |
Рег. номер CAS номер CAS | [7647-14-5] |
| Рег. номер PubChem | 5234 |
| Рег. номер EINECS | 231-598-3 |
| SMILES | [Na+].[Cl-] |
| RTECS | VZ4725000 |
| Безопасность | |
| ЛД50 | 3000–8000 мг/кг |
| NFPA 704 | |
Хлори́д на́трия — химическое соединение NaCl, натриевая соль соляной кислоты, хлористый натрий.
Хлорид натрия известен в быту под названием поваренной соли, основным компонентом которой он является. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита (каменная соль).
Чистый хлорид натрия имеет вид бесцветных кристаллов, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Нахождение в природе и производство
В природе хлорид натрия встречается в виде минерала галита, который образует залежи каменной соли среди осадочных горных пород, прослойки и линзы на берегах солёных озёр и лиманов, соляные корки в солончаках и на стенках кратеров вулканов и в сольфатарах. Огромное количество хлорида натрия растворено в морской воде. Мировой океан содержит 4 × 10 15 тонн NaCl, то есть из каждой тысячи тонн морской воды можно получить в среднем 1,3 тонны хлорида натрия. Следы NaCl постоянно содержатся в атмосфере в результате испарения брызг морской воды. В облаках на высоте полтора километра 30 % капель, больших 10 мкм по размеру, состоят из NaCl. Также он найден в кристаллах снега[2].
Наиболее вероятно, что первое знакомство человека с солью произошло в лагунах теплых морей или на соляных озёрах, где на мелководье соленая вода интенсивно испарялась под действием высокой температуры и ветра, а в осадке накапливалась соль. По образному выражению Пифагора, «соль была рождена благородными родителями: солнцем и морем»[3].
Галит
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решетку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2, 2 г / см ³, а твёрдость по шкале Мооса — 2. Бесцветный, прозрачный минерал, со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и т. п.[4]
Каменная соль
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (желтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, йодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и т. д.[4]
Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, йодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и т. д.[4]
По условиям формирования месторождений каменную соль подразделяют на следующие виды[4]:
- рассолы современных соляных бассейнов
- соляные подземные воды
- залежи минеральных солей современных соляных бассейнов
- ископаемые залежи (важнейшие для промышленности).
Морская соль
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |
При испарении морской воды при температуре 20 — 35 ° C в осадке сначала кристаллизуются наименее растворимые соли — карбонаты кальция и магния и сульфат кальция. Затем выпадают более растворимые сульфаты натрия и магния, хлориды натрия, калия и магния, и после них — сульфаты калия и магния. Последовательность кристаллизации солей и состав осадка может несколько варьироваться в зависимости от температуры, скорости испарения и других условий. В промышленности морскую соль получают из морской воды, в основном методом обычного выпаривания. Она отличается от каменной соли значительно большим содержанием других химических солей, минералов и различных микроэлементов, в первую очередь йода, калия, магния и марганца. Соответственно, она отличается от хлорида натрия и по вкусу — горько-солёный привкус ей придают соли магния. Она используется в медицине: при лечении кожных заболеваний, таких как псориаз. Как лечебное вещество в аптечной и обычной торговой сети, распространённым продуктом является соль с Мёртвого моря. В очищенном виде этот вид соли также предлагается в продуктовой торговой сети — как натуральная и богатая йодом пищевая[5].
Затем выпадают более растворимые сульфаты натрия и магния, хлориды натрия, калия и магния, и после них — сульфаты калия и магния. Последовательность кристаллизации солей и состав осадка может несколько варьироваться в зависимости от температуры, скорости испарения и других условий. В промышленности морскую соль получают из морской воды, в основном методом обычного выпаривания. Она отличается от каменной соли значительно большим содержанием других химических солей, минералов и различных микроэлементов, в первую очередь йода, калия, магния и марганца. Соответственно, она отличается от хлорида натрия и по вкусу — горько-солёный привкус ей придают соли магния. Она используется в медицине: при лечении кожных заболеваний, таких как псориаз. Как лечебное вещество в аптечной и обычной торговой сети, распространённым продуктом является соль с Мёртвого моря. В очищенном виде этот вид соли также предлагается в продуктовой торговой сети — как натуральная и богатая йодом пищевая[5].
Залежи
Залежи каменной соли найдены во всех геологических системах. Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах[4]. Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, о. Кулундинское, Эбейты и др. озера в Зап. Сибири.
Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах[4]. Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, о. Кулундинское, Эбейты и др. озера в Зап. Сибири.
Производство
В древности технология добычи соли заключалась в том, что соляную рапу вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённую соль выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой желобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали.
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 новгородский князь Святослав определил налог на соляные варницы[6]:
| …на мори от чрена и от салгы по пузу… |
[7]
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли. Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Мировое производство соли в 2009 году оценивается в 260 миллионов тонн. Крупнейшими мировыми производителями являются Китай (60,0 млн тонн), США (46,0 млн тонн), Германия (16,5 млн тонн), Индия (15,8 млн тонн) и Канада (14 млн тонн)[8].
Добыча соли в южной части Мертвого моря, Израиль
Кристаллы каменной соли
Плантация морской соли в Дакаре
Соляные кучи на солончаке Уюни, Боливия
Применение
В пищевой промышленности и кулинарии
Соль повареннаяВ пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывании соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывании соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах,%:
- экстра — не менее 99,5;
- высший — 98,2;
- первый — 97,5;
- второй — 97,0.
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10 −4 %, фтора (25,0 ± 5,0) × 10 −3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10 −4 %, фтора (25,0 ± 5,0) × 10 −3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15 % содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
В медицине
Изотонический раствор хлорида натрия в воде (0,9 %) применяется как дезинтоксикационное средство, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов. Гипертонические растворы (10 % р-р) используют как вспомогательный осмотический диуретик при лёгочных, желудочных и кишечных кровотечениях для обеспечения форсированного диуреза, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием[9].
Гипертонические растворы (10 % р-р) используют как вспомогательный осмотический диуретик при лёгочных, желудочных и кишечных кровотечениях для обеспечения форсированного диуреза, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием[9].
В коммунальном хозяйстве. Техническая соль
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололеда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта в виду коррозийных процессов.
Регенерация Nа-катионитовых фильтров
Nа-катионитовые фильтры широко применяются в котельных установках всех мощностей для смягчения воды при водоподготовке. Катионитовым материалом на современных водоподготовительных установках служат в основном глауконит, сульфанованные угли и синтетические смолы. Наиболее распространены сульфоугли.
Наиболее распространены сульфоугли.
Регенерацию Nа-катионитовых фильтров осуществляют 6—8%-м раствором поваренной соли, в результате действие сульфоуголя восстанавливается. Реакции идут по уравнениям:
- CaR2 + 2NаСl = 2NаR + CaСl2.
- МgR2 + 2NаСl = 2NаR + МgСl2.
Химическая промышленность
Соль, наряду с каменным углем, известняками и серой, образует «большую четвёрку» продуктов минерального сырья, которые являются важнейшими для химической промышленности[10]. Из неё получают соду, хлор, соляную кислоту, гидроксид натрия, сульфат натрия и металлический натрий. Кроме этого соль используется также для промышленного получения легкорастворимого в воде хлората натрия, который является средством для уничтожения сорняков[11]. Суммарное уравнение реакции электролиза горячего раствора хлорида натрия[12]:
- NaCl + 3 H2O → NaClO3 + 3 H2↑
Получение хлора и гидроксида натрия
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах[13][14]:
Процессы, происходящие на электродах[13][14]:
- на катоде как побочный продукт выделяется водород вследствие восстановления ионов H +, образованных в результате электролитической диссоциации воды:
- H2O ⇆ H+ + OH−
- 2 H+ + 2 e− → H2↑
- поскольку (вследствие практически полной электролитической диссоциации NaCl), хлор в растворе находится в виде хлорид-ионов, они окисляются на аноде до свободного хлора в виде газа:
- NaCl → Na+ + Cl−
- 2 Cl− − 2 e− → Cl2↑
- суммарная реакция:
- 2 NaCl + 2 H2O → 2 NaOH + Cl2↑ + H2↑
Как видно из уравнения суммарной реакции, ещё одним продуктом является гидроксид натрия. Расход электроэнергии на 1 т хлора составляет примерно 2700 кВт × час. Полученный хлор сжижается на жёлтую жидкость уже при обычной температуре[15].
Если между анодом и катодом нет диафрагмы, то растворенный в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO[14]:
- 2 NaOH + Cl2 → NaCl + NaClO + H2O
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подается в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH ничтожно мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия[14][16]:
- Na+ + e− → Na(Hg)
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
- 2 Na(Hg) + 2 H2O → 2 NaOH + H2↑
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Получение металлического натрия
Металлический натрий получают электролизом расплава хлорида натрия. Происходят следующие процессы:
- на катоде выделяется натрий:
- 2 Na+ + 2 e− → 2 Na
- на аноде выделяется хлор (как побочный продукт):
- 2 Cl− − 2 e− → Cl2
- суммарная реакция:
- 2 Na+ + 2 Cl− → 2 Na + Cl2
Ванна электролизера состоит из стального кожуха с футеровкой, графитового анода и кольцевого железного катода. Между катодом и анодом располагается сетчатая диафрагма. Для снижения температуры плавления NaCl (800 ° C), электролитом является не чистый хлорид натрия, а его смесь с хлоридом кальция CaCl 2 (40:60) с температурой плавления 580 ° C. Металлический натрий, который собирается в верхней части катодного пространства, содержит до 5 % примесь кальция, но последний со временем почти полностью отделяется, поскольку его растворимость в жидком натрии при температуре его плавления (371 ° C) составляет всего 0,01 %. С расходованием NaCl его постоянно добавляют в ванну. Затраты электроэнергии составляют примерно 15 кВт × ч на 1 кг натрия[17].
Получение соляной кислоты и сульфата натрия
Среди многих промышленных методов получения соляной кислоты, то есть водного раствора хлороводорода (HCl), применяется реакция обмена между хлоридом натрия и серной кислотой:
- NaCl + H2SO4 → NaHSO4 + HCl↑
- NaCl + NaHSO4 → Na2SO4 + HCl↑
Первая реакция происходит в значительной степени уже при обычных условиях, а при слабом нагреве идет почти до конца. Вторая происходит лишь при высоких температурах. Процесс осуществляется в специальных механизированных печах большой мощности. Хлороводород, который выделяется, обеспыливают, охлаждают и поглощают водой с образованием соляной кислоты. Как побочный продукт образуется сульфат натрия Na2SO4[18][19].
Этот метод применяется также для получения хлороводорода в лабораторных условиях.
Физические и физико-химические свойства
Температура плавления 800,8 С, кипения 1465 С.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 21 °C и 38,1 при 80 °C. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. В чистом виде хлорид натрия не гигроскопичен. Однако соль часто бывает загрязнена примесями (преимущественно ионами Ca 2 +, Mg 2 + и SO2−4), и такая соль на воздухе сыреет[20]. Кристаллогидрат NaCl · 2H 2 O можно выделить при температуре ниже +0,15 ° C[21].
Смесь измельченного льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 ° C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 ° C. Лед, имеющий температуру около 0 ° C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfH0g | −181,42 кДж/моль |
| ΔfH0l | −385,92 кДж/моль |
| ΔfH0s | −411,12 кДж/моль |
| ΔfH0aq | −407 кДж/моль |
| S0g, 1 bar | 229,79 Дж/(моль·K) |
| S0l, 1 bar | 95,06 Дж/(моль·K) |
| S0s | 72,11 Дж/(моль·K) |
Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
Лабораторное получение и химические свойства
При действии серной кислоты выделяет хлороводород. С раствором нитрата серебра образует белый осадок хлорида серебра.
Учитывая огромные природные запасы хлорида натрия, необходимости в его промышленном или лабораторном синтезе нет. Однако, его можно получить различными химическими методами как основной или побочный продукт.
- получение из простых веществ натрия и хлора является экзотермической реакцией[22]:
- Na(тв) + 1/2Cl2(г) → NaCl(тв) + 410 кДж
- нейтрализация щелочи гидроксида натрия соляной кислотой[23]:
- NaОН + НCl → NaCl + Н2О
Поскольку хлорид натрия в водном растворе почти полностью диссоциирован на ионы: NaCl → Na+ + Cl−, его химические свойства в водном растворе определяются соответствующими химическими свойствами катионов натрия и хлорид-анионов.
Структура
Кристаллическая решётка хлорида натрия.Голубой цвет = Na+
Зелёный цвет = Cl−
Хлорид натрия образует бесцветные кристаллы кубической сингонии, пространственная группа F m3m, a = 0,563874 нм, d = 2,17 г/см³. Каждый из ионов Cl− окружен шестью ионами Na+ в октаедральний конфигурации, и наоборот. Если мысленно отбросить, например, ионы Na+, то останется плотно упакованная кубическая структура с ионов Cl−, называемая гранецентрированной кубической решеткой. Ионы Na+ тоже образуют плотно упакованную кубическую решетку. Таким образом, кристалл состоит из двух подрешеток, сдвинутых друг относительно друга на полупериод. Такая же решетка характерна для многих других минералов.
В кристаллической решетке между атомами преобладает ионная химическая связь, что является следствием действия электростатического взаимодействия противоположных по заряду ионов
См. также
Примечания
- ↑ Натрия хлорид на сайте Национального института стандартов и технологии (англ. National Institute of Standards and Technology) (англ.)
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 218
- ↑ Пифагор. Золотой канон. Фигуры эзотерики. — М.: Изд-во Эксмо, 2003. — 448 с. (Антология мудрости).
- ↑ 1 2 3 4 Малая горная энциклопедия. В 3-х т. / Под ред. В. С. Белецкого . — Донецк: «Донбасс», 2004. — ISBN 966-7804-14-3
- ↑ УНИАН: Морская соль для красоты и здоровья кожи
- ↑ Российское законодательство Х-ХХ веков. Законодательство Древней Руси. т. 1. М, 1984. С. 224—225. (рус.)
- ↑ В переводе с поморской «говори» слово чрен (црен) означает четырёхугольный ящик, кованный из листового железа, а салга — котёл, в котором варили соль. Пузом в беломорских солеварнях называли мешок соли в два четверика, то есть, объёмом около 52 литров.
- ↑ Соль (PDF), Геологический обзор США на сайте Программы минеральных ресурсов (англ.)
- ↑ Энциклопедия здоровья
- ↑ Онлайн Энциклопедия кругосвет. Натрий
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 261
- ↑ Синтез хлората натрия (англ.)
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 249
- ↑ 1 2 3 М. Л. Глинка Общая химия (Учебник), изд. 2-е изд., Перераб. и доп .. — С. 608, Киев: «Высшая школа», 1982.
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 254
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 231
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 219
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 250
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 257—258
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 215—216
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 234
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 255
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 191
Ссылки
Шаблон:АТХ код A07
Плазмозамещающие и перфузионные растворы — АТХ код: B05
| B05A |
| ||
|---|---|---|---|
| B05B |
| ||
| B05C |
| ||
| B05D |
| ||
| B05X |
| ||
| B05Z |
Раствор натрия хлорида (каменной соли)
(раствор хлорида натрия)
СТО 93522978-01-2008
ХИМИЧЕСКАЯ ФОРМУЛА: NaCl
ВНЕШНИЙ ВИД:
Бесцветная жидкость с наличием взвешенных частиц, оседающих при отстое. Не допускается наличие органической фазы (нерастворителя).
СПЕЦИФИКАЦИЯ:
|
НАИМЕНОВАНИЕ ПОКАЗАТЕЛЯ |
ЗНАЧЕНИЕ НОРМЫ |
| Массовая концентрация хлорида натрия, г/дм3, не менее |
300,0 |
| Массовая концентрация ионов кальция, г/дм3, не более |
2 |
| Массовая концентрация ионов магния, г/дм3, не более |
1,2 |
| Массовая концентрация железа, мг/дм3, не более |
3 |
| Массовая концентрация сульфатов, г/дм3, не более |
7 |
Примечание: При температуре воздуха менее 0 °С допускается снижение массовой концентрации хлорида натрия в растворе каменной соли до 278 г/дм3.
ПРИМЕНЕНИЕ:
В химической промышленности для электролитического получения хлора и натра едкого диафрагменным и ртутным методами, а также в газовой, металлургической, нефтехимической и других отраслях промышленности.
ТАРА:
Железнодорожные или автомобильные цистерны с котлами из коррозионно-стойкой стали марки 12Х18Н10Т (ГОСТ 5632-72) или из черных металлов; бочки и канистры из коррозионно-стойкой стали марки 12Х18Н10Т (ГОСТ 5632-72), полиэтилена или винипласта. Не допускается заливать в тару из цветных металлов.
ТРАНСПОРТИРОВАНИЕ И ХРАНЕНИЕ:
Всеми видами транспорта в соответствии с правилами перевозки грузов, действующими на данном виде транспорта. Базы для хранения раствора каменной соли могут быть различного типа. Раствор каменной соли при отсутствии механизированных баз может храниться в цистернах. Гарантийный срок хранения — не ограничен.
ОСОБЫЕ СВОЙСТВА:
Не токсичен, пожаро-, взрывобезопасен.
ДОПОЛНИТЕЛЬНАЯ ДОКУМЕНТАЦИЯ:
Паспорт безопасности| РЕАЛИЗАЦИЯ НА РЫНОК РФ: |
| тел.: +7 (8442) 40-61-07 |
| e-mail: [email protected] |
| РЕАЛИЗАЦИЯ НА ЭКСПОРТ: |
| тел.: +7 (8442) 40-66-09, 40-66-10, 40-66-11 |
| e-mail: [email protected] |
| СЛУЖБА ПОДДЕРЖКИ КЛИЕНТОВ: |
| тел.: +7 (8442) 40-63-03 |
| e-mail: [email protected] |
Для получения информации по технологическим особенностям применения продукции Вы можете обратиться в Центр технических и технологических компетенций АО «КАУСТИК» по телефону: +7 (8442) 40-60-07
Скачать в формате PDF >>Гипохлорит натрия
Доставка до транспортных компаний БЕСПЛАТНО: Деловые линии, Энергия.
Гипохлорит натрия
| Химическая формула: NaClO Описание: Водный раствор натриевой соли хлорноватистой кислоты. |
Применение:
Гипохлорит натрия применяют как дезинфицирующее средство для обеззараживания природных и сточных вод, воды плавательных бассейнов, в хозяйственно-питьевом водоснабжении; для мытья и дезинфекции эмалированной, фарфоровой посуды, облицовочной плитки, пластика, унитазов, мусорных ведер. Гипохлорит натрия используют для отбеливания тканей, бумаги; безусадочной обработки шерстяных изделий, при хлорировании и окислении органических соединений, в мясной, молочной промышленности и др. Центром госсанэпиднадзора министерства здравоохранения РФ (г. Москва) выдано гигиеническое заключение ? 77.01.03.601.П.30795.10.1. от 10.10.01г. на использование технического гипохлорита натрия марки А для обеззараживания природных и сточных вод в хозяйственно-питьевом водоснабжении, дезинфекции воды сельскохозяйственных водоемов, дезинфекции в пищевой промышленности, получения отбеливающих средств.Технические характеристики :
Гипохлорит натрия марки А
Внешний вид
Жидкость от зеленовато-желтого до красновато-коричневого цвета
Массовая концентрация активного хлора, г/дм3, не менее
120
Массовая концентрация щелочи в пересчете на натр едкий, г/дм3, не более
40
Упаковка:
Гипохлорит натрия заливают в стальные гуммированные железнодорожные цистерны и автомобильные контейнеры, в контейнеры из полиэтилена или стеклопластика. Допускаются полиэтиленовые бочки и канистры, стеклянные бутыли.
Транспортирование:
Транспортируют гипохлорит натрия, аналогично сульфаминовой кислоте, железнодорожным и автомобильным транспортом.
Хранение:
Гипохлорит натрия хранят в стальных гуммированных или покрытых коррозионно-стойкими материалами емкостях в не отапливаемых помещениях, защищенных от солнечного света.
Техника безопасности:
Гипохлорит натрия — едкое, негорючее, невзрывоопасное вещество. Требуется защита кожи и глаз.
Контактный номер (383)352-88-03
Хлорид натрия | Chemwatch
Что такое хлорид натрия?
Вы, наверное, знаете его лучше всего как «Соль»!Хлорид натрия, также известный как галит (химическая формула: NaCl), представляет собой химическое вещество, которое мы все чаще знаем как соль. Он выглядит как белый кристаллический порошок, полностью растворимый в воде.
Это один из самых богатых минералов на Земле, который является важным питательным веществом для людей, животных и растений.
Для чего используется хлорид натрия?
Хлорид натрия находит широкое применение как в быту, так и в коммерческих целях.
В домашних условиях его, конечно же, используют для приправы, но также и для консервирования.
С медицинской точки зрения хлорид натрия объединяется с водой для создания солевого раствора, который можно использовать различными способами, включая: капельница для облегчения обезвоживания и местное очищение ран, и это лишь некоторые из них.
Хлорид натрия также используется в качестве компонента при производстве ряда продуктов, в том числе; пластик, бумага, резина, стекло, хлор, полиэстер, отбеливатель, моющие средства и красители.
Более низкая точка замерзания рассола (соль, смешанная с водой) делает хлорид натрия идеальным средством для борьбы с обледенением дорог.Опасности хлорида натрия
Хлорид натрия обычно считается безопасным химическим веществом в обращении, но при неправильном обращении со всеми химическими веществами (даже с солью) всегда существует опасность причинения вреда.
Пути воздействия хлорида натрия включают: глаза, кожа, вдыхание и проглатывание.
Воздействие хлорида натрия на глаза может вызвать серьезное раздражение глаз и временное повреждение глаз. Повторное воздействие может вызвать воспаление и покраснение, а также временное ухудшение зрения.
Хлорид натрия может вызывать легкое раздражение кожи при контакте с кожей. При длительном воздействии на кожу она может покраснеть и опухнуть, что может привести к образованию пузырей, шелушению и утолщению кожи.
Вдыхание хлорида натрия может вызвать раздражение дыхательной системы. Пары хлорида натрия могут вызывать сонливость, головокружение, снижение внимания, потерю рефлексов / координации и головокружение. Если у человека имеется нарушение кровообращения и нервной системы или повреждение почек, важно, чтобы он прошел надлежащую проверку перед обращением, чтобы гарантировать, что его состояние не ухудшится из-за воздействия.
Очевидно, что хлорид натрия предназначен для употребления в пищу человеком, однако употребление очень больших количеств может вызвать рвоту, диарею и сильное чувство слабости.
Безопасность хлорида натрия
Если хлорид натрия попал в глаза, немедленно промойте глаза чистой проточной водой, не забывая промывать под веками. Снятие контактных линз должно производиться только квалифицированным специалистом. Если боль не проходит, обратитесь за медицинской помощью.
В случае контакта с кожей снимите всю загрязненную одежду, обувь и аксессуары и промойте пораженный участок большим количеством воды с мылом. Перед повторным ношением загрязненную одежду следует выстирать. Если симптомы не исчезнут, обратитесь за медицинской помощью.
При вдыхании переместите человека из зараженной зоны к ближайшему источнику свежего воздуха и следите за его дыханием. Если им трудно дышать, дайте им кислород. Если они не дышат, а вы квалифицированы, выполните сердечно-легочную реанимацию. Немедленно обратитесь за медицинской помощью.
Если вы проглотили большое количество хлорида натрия, не вызывайте рвоту. В случае рвоты наклоните пациента вперед или положите его на левый бок, чтобы дыхательные пути оставались открытыми, чтобы предотвратить аспирацию. Обратитесь за медицинской помощью.
Безопасное обращение с хлоридом натрия
Фонтаны для экстренной промывки глаз должны быть доступны в непосредственной близости от потенциального воздействия химического вещества, и всегда должна быть соответствующая вентиляция (при необходимости установить вытяжку).
СИЗ в том числе; При работе с хлоридом натрия рекомендуется использовать защитные очки с боковыми щитками, респираторы для защиты от пыли, химические очки, защитные перчатки, фартук из ПВХ и спецодежду.
| Показатели качества | |
| Наименование показателя | Требования ФСП |
| 1. Описание | Белый кристаллический порошок или крупинки, или бесцветные кристаллы |
| 2. Растворимость | Легко растворим в воде, мало растворим в спирте 96% |
| 3. Подлинность | Дает характерные реакции на натрий и хлориды |
| 4. Прозрачность раствора | Должен быть прозрачным |
| 5. Цветность раствора | Должен быть бесцветным |
| 6. Кислотность или щелочность | Окраска раствора должна измениться от прибавления не более 0,5 мл 0,01 М раствора натрия гидроксида или не более 0,5 мл 0,01 М раствора хлористоводородной кислоты |
| Щелочноземельные металлы и магний | Не более 0,01% в пересчете на кальций |
| 8. Барий | Мутность раствора субстанции не должна превышать мутность эталонного раствора |
| 9. Железо, %, не более | 0,0003 |
| 10. Тяжелые металлы, %, не более | 0,0005 |
| 11. Сульфаты, %, не более | 0,005 |
| 12. Калий, %, не более | 0,05 |
| 13. Соли аммония, %, не более | 0,004 |
| 14. Потеря в массе при высушивании, %, не более | 0,5 |
| 15. Мышьяк, %, не более | 0,00005 |
| 16. Фосфаты, %, не более | 0,0025 |
| 17. Бромиды, %, не более | 0,005 |
| 18. Иодиды | Раствор не должен окрашиваться в голубой цвет |
| 19. Ферроцианиды | Раствор не должен окрашиваться в голубой цвет |
| 20. Микробиологическая чистота | Категория 1.2.Б |
| 21. Количественное определение (NaCl), %, в пределах | Не менее 99,5% NaCl в пересчете на сухое вещество |
| 22. Бактериальные эндотоксины, предельное содержание не более | Не более 5 ЕЭ на 1 г субстанции |
| Упаковка | По 1 кг, 3 кг, 5 кг в полипропиленовые пакет из полиэтиленовой пленки, который термосваривают двумя швами, снабжая внутренней этикеткой. Пакеты укладывают в тканый полипропиленовый мешок с внутренним полиэтиленовым пакетом и прошивают вместе с этикеткой. По 25 кг – в тканый полипропиленовый мешок с внутренним полиэтиленовым пакетом Полиэтиленовый пакет термосваривают, полипропиленовый мешок прошивают. Каждая упаковка снабжена этикеткой. Этикетка из этикеточной бумаги, писчей, офсетной. |
| Маркировка | В соответствии с нормативной документацией |
| Хранение | В сухом месте при температуре не выше 250С |
| Срок годности | 5 лет |
Гипохлорит натрия: структура, применение и формула — стенограмма видео и урока
Использует
Гипохлорит натрия чаще всего известен как отбеливатель, который присутствует в наших бытовых чистящих средствах. Однако у него есть и другие применения. В этом разделе давайте обсудим некоторые применения гипохлорита натрия.
Бытовой отбеливатель и удаление пятен
Наиболее частым применением гипохлорита натрия является его использование в качестве активного ингредиента в отбеливателе.Большая часть производимого гипохлорита натрия используется в качестве бытового отбеливателя, который обычно содержит 5% гипохлорита натрия.
Отбеливатель используется для мытья и дезинфекции поверхностей в наших домах, таких как туалеты, полы и прилавки. Когда мы обнаруживаем пятна на одежде и простыне, отбеливатель — лучший способ удалить эти стойкие пятна.
Дезинфицирующее средство и очистка воды
Гипохлорит натрия — очень эффективное дезинфицирующее средство.В сфере общественного питания его можно использовать для дезинфекции кухонной утвари и оборудования, используемого для пищевой промышленности. В наших собственных домах использование гипохлорита натрия очень эффективно для уничтожения различных типов бактерий и вирусов.
Гипохлорит натрия также используется для очистки воды — это очень эффективное вещество, используемое для дезинфекции воды с целью уничтожения бактерий и микроорганизмов, что помогает предотвратить передачу заболеваний, передающихся через воду. Он используется в различных промышленных приложениях для предотвращения образования бактерий и слизи, а также для дезинфекции бассейнов.Иногда для уменьшения запаха в сточные воды добавляют гипохлорит натрия.
Стоматология и кожа
Вы когда-нибудь лечили корневые каналы? Растворы гипохлорита натрия с концентрацией от 0,5 до 5% используются стоматологами в качестве ирригационного средства при лечении корневых каналов. Это необходимо для предотвращения бактериальной инфекции и растворения мертвых тканей.
Растворы, содержащие 0,005% гипохлорита натрия, также могут помочь при лечении экземы, вызывающей раздражение и воспаление кожи.Раствор гипохлорита натрия также может помочь предотвратить повреждение кожи, вызванное радиацией и воздействием солнца. Это связано с тем, что раствор блокирует активность молекулы, ответственной за воспаление и старение.
Нейтрализует нервные агенты
Нервно-паралитические вещества — это вещества, которые нарушают механизм передачи нервных сигналов к органам из-за разрушения нейротрансмиттеров. Нервно-паралитические агенты могут использоваться в химическом оружии в газообразной форме.Гипохлорит натрия в концентрации 50% используется для нейтрализации следов отравляющих веществ нервно-паралитического действия на пораженных участках, а также для очистки средств индивидуальной защиты солдат после их попадания в пораженные участки.
Меры предосторожности и опасности
Хотя гипохлорит натрия очень полезен, необходимо соблюдать некоторые меры предосторожности. Мы должны убедиться, что гипохлорит натрия не смешивается с аммиаком (Nh4) из-за образования опасного газа, который вызывает затруднения дыхания и удушье.Бытовой отбеливатель должен быть недоступен для детей.
Гипохлорит натрия также является токсичным веществом, которое нельзя проглатывать. Хотя гипохлорит натрия используется для очистки оборудования для пищевой промышленности, его необходимо тщательно смывать, поскольку он токсичен.
Мы должны избегать контакта с нашими глазами, потому что это раздражитель. Мы должны следить за тем, чтобы гипохлорит натрия в высоких концентрациях не касался нашей кожи, потому что это может вызвать ожоги или раздражение.
Если наша кожа или глаза контактируют с гипохлоритом натрия, необходимо промыть пораженные участки водой и при необходимости обратиться за медицинской помощью.Если вы испытываете затрудненное дыхание из-за вдыхания гипохлорита натрия, первым делом нужно выйти на свежий воздух. Однако, если вам по-прежнему трудно дышать, вам необходимо немедленно обратиться за медицинской помощью.
Краткое содержание урока
Гипохлорит натрия — сильный окислитель, имеющий химическую формулу NaClO с ионной связью между ионом натрия (Na +) и ионом гипохлорита (ClO-). Его получают в результате реакции хлора (Cl2) с гидроксидом натрия (NaOH).Он широко известен как отбеливатель, и большая часть его продукции предназначена для бытового отбеливания. Растворы гипохлорита натрия используются в различных целях, включая удаление пятен, дезинфекцию поверхностей, обработку воды, ирригацию корневых каналов, а также предотвращение повреждения кожи.
Хотя гипохлорит натрия имеет много применений, мы должны соблюдать меры предосторожности, поскольку он токсичен в высоких концентрациях. Мы не должны смешивать гипохлорит натрия с аммиаком, потому что он производит токсичные пары. Вдыхание гипохлорита натрия может вызвать раздражение легких, поэтому в этом случае немедленно выйдите на свежий воздух и при необходимости обратитесь за медицинской помощью.В то время как низкие концентрации предотвращают повреждение кожи, высокие концентрации на нашей коже могут вызвать ожоги и раздражение. Гипохлорит натрия также раздражает глаза. При попадании гипохлорита натрия на кожу и в глаза немедленно промойте их водой и обратитесь за медицинской помощью, если это не поможет.
Формула гипохлорита натрия — применение, свойства, структура и формула гипохлорита натрия
Формула и структура: Химическая формула гипохлорита натрия — NaClO, а его молярная масса — 74.44 г / моль.
Это ионное соединение, состоящее из катиона металла натрия (Na + ), связанного с анионом гипохлорита (ClO — ).
Приготовление: Его получают промышленным способом по процессу Хукера, в котором разбавленный гидроксид натрия реагирует с газообразным хлором с образованием NaClO вместе с хлоридом натрия и водой.
2 NaOH + Cl 2 → NaClO + NaCl + H 2 O
Физические свойства: В чистом виде существует в виде нестабильного светло-зеленого твердого вещества с плотностью 1.11 г / мл, точка плавления 18 ° C и точка кипения 101 ° C. Чаще встречается в виде бледно-зеленоватого или желтого водного раствора. Водные растворы NaClO доступны в нескольких различных концентрациях или концентрации (от 1% до 25%), в зависимости от его конечного использования.
Химические свойства: Гипохлорит натрия — хороший окислитель. Он реагирует с протонными кислотами, такими как HCl, с образованием солей с выделением токсичного газообразного хлора. Он также реагирует с некоторыми кислотами с образованием хлорноватистой кислоты (HClO).В воде он разлагается на ионы натрия и хлора, а также на мощный окислитель — гидроксильный радикал (OH . ). NaClO также разлагается на хлорид натрия и кислород.
Область применения: В основном используется в качестве отбеливающего и дезинфицирующего средства как в домашних, так и в промышленных целях. Он также используется на водоочистных сооружениях, в плавательных бассейнах, в некоторых медицинских и стоматологических процедурах, в пищевой промышленности как дезинфицирующее средство, в домашних условиях как дезодорирующее и чистящее средство, а также в стиральных порошках как пятновыводитель и отбеливатель.
Воздействие на здоровье / опасность для здоровья: Гипохлорит натрия является токсичным и коррозионным веществом при более высоких концентрациях. При проглатывании может быть очень токсичным. Он также реагирует с некоторыми кислотами, а также с аммиаком, с образованием токсичных газов, таких как хлор, что может привести к серьезному раздражению глаз и респираторным проблемам. Сильные растворы отбеливателя также могут вызвать ожоги кожи.
Гипохлорит натрия — формула, структура, свойства, производство и использование
Гипохлорит натрия — это ионное химическое соединение с формулой NaOCl.В его состав входят катион натрия и анион гипохлорита. Он известен под различными другими названиями, такими как антиформин, отбеливатель и т. Д. Обычно он находится в пентагидратном состоянии. Поскольку его безводная форма нестабильна и взрывоопасно разлагается. Пентагидрат гипохлорита натрия представляет собой бледно-зеленовато-желтое твердое вещество, устойчивое и не взрывоопасное. Он широко используется в качестве чистящего средства или отбеливателя.
Формула гипохлорита натрия
S.№ | Название и формула гипохлорита натрия по ИЮПАК | |
1. | Эмпирическая формула | NaOCl |
9 2. | ||
9 2. | ||
9 2. | NaOCl или NaClO||
3. | Скелетная формула | Изображение будет загружено в ближайшее время |
4. | Название IUPAC | Гипохлорит натрия |
5. | Другие общие наименования | Антиформин, отбеливатель, хлорид натрия |
Гипохлорит натрия Гипохлорит натрия — это соль, состоящая из катиона натрия и аниона гипохлорита. Он также известен как натриевая соль хлорноватистой кислоты (HOCl). Его структура приведена ниже —
Изображение будет скоро загружено
Свойства гипохлорита натрия
Гипохлорит натрия проявляет следующие физико-химические свойства —
Его молярная масса 74.4 г.моль-1.
Пентагидрат гипохлорита натрия — зеленовато-желтое твердое вещество.
Имеет запах хлора и сладковатый запах.
Его температура плавления 18 ℃.
Его температура кипения составляет 101 ℃.
Растворим в воде.
Плотность 1,11 г / см3.
Он вызывает коррозию.
Гипохлорит натрия нестабилен и взрывоопасен, хотя пентагидрат гипохлорита натрия стабилен при более низких температурах и невзрывоопасен.
Он разлагается при высокой температуре с образованием хлората натрия и хлорида натрия. Реакция приведена ниже —
3NaOCl (водн.) → 2NaCl (водн.) + NaClO3 (водн.)
Используется при окислении крахмала.
Окисление металлов — Гипохлорит натрия реагирует с металлами и образует оксид металла, окисляя их. Реакция представлена ниже —
NaOCl + Mg 🡪 MgO + NaCl
Nh4 + NaOCl → Nh3Cl + NaOH
Nh3Cl + NaOCl → NHCl2 + NaOH
Nh3Cl + NaOCl → NCl3 + NaOH
Гипохлорид натрияПроизводство натрия
Гипохлорит натрия можно получить различными методами.Немногие из них мы обсуждаем здесь.
При хлорировании — Водный гидроксид натрия реагирует с хлором с образованием хлорида натрия, гипохлорита натрия и воды. Его дал французский химик Антуан Лабаррак. Реакция приведена ниже —
Cl2 + 2NaOH 🡪 NaCl + NaOCl + h3O
В указанной выше реакции хлор окисляется и восстанавливается одновременно. Итак, реакция — диспропорционирование.
Na2CO3 + Ca (OCl) 2 🡪 CaCO3 + NaOCl
NaCl + O3 🡪 NaOCl + O2
Использование гипохлорита натрия
Гипохлорит натрия — очень полезное соединение.Он используется во многих областях для различных целей. Некоторые из его применений перечислены ниже —
Он используется в качестве отбеливателя. Растворы бытовых отбеливателей обычно содержат 3-8% гипохлорита натрия по весу.
Используется для очистки, например, для удаления пятен плесени, зубных пятен и т. Д.
Используется как дезинфицирующее средство. Он обладает антимикробными свойствами, что делает его очень полезным в больницах в качестве дезинфицирующего средства. Он также используется в растворе Дакина.
Обладает дезодорирующим и едким действием, что делает его еще более полезным для чистки и стирки.
Применяется для очистки сточных вод.
Благодаря своей эффективности против патогенных организмов он используется в эндодонтической терапии.
Мыла, содержащие гипохлорит натрия, десятилетиями используются для лечения экземы у людей.
Гипохлорит натрия: краткое изложение в табличной форме
Гипохлорит натрия
Химическая формула
Другие названия
Антиформин, отбеливатель, хлорид соды
Молярная масса
74.4 г / моль
Точка плавления
18 ℃
Точка кипения
101 ℃
9114
9000 см Внешний вид
Зеленовато-желтое твердое вещество
Запах
Хлороподобный запах
Состояние по STP
твердое вещество Растворимость в воде
Растворим в воде (29.3 г / 100 мл)
Препарат
Хлорированием —
Cl2 + 2NaOH 🡪 NaCl + NaOCl + h3O
Гипохлоритом кальция —
Na2CO3 + Ca (OCl) 2 🡪 CaCO13
Электролизом рассола (концентрированный раствор NaCl и воды)
Озоном и натриевой солью —
NaCl + O3 🡪 NaOCl + O2
Основные свойства
Отбеливающие и дезодорирующие свойства.
Основное применение
В качестве дезинфицирующего и очищающего средства.
Недостаток
Коррозийный
Трудности при хранении
На этом мы закончим наше обсуждение темы «Гипохлорит натрия». Мы надеемся, что вам понравилось учиться и вы смогли понять концепции. Мы надеемся, что после прочтения этой статьи вы сможете решать проблемы, основанные на теме.Если вы ищете решения проблем NCERT Textbook на основе этой темы, войдите на веб-сайт Vedantu или загрузите приложение Vedantu Learning App. Таким образом вы сможете получить доступ к бесплатным PDF-файлам решений NCERT, а также к заметкам о редакции, пробным тестам и многому другому.
гидрохлорид натрия, NaOCl — формула, раствор гипохлорита натрия, жидкий отбеливатель гипохлорита натрия, гипохлорид натрия, в центре Камалалая, Калькутта, Pragati International, Калькутта
гидрохлорид натрия, NaOCl — формула, раствор гипохлорита натрия, гипохлорит натрия, гипохлорит натрия Гипохлорид натрия, हाइपोक्लोराइट в центре Камалалая, Калькутта, Pragati International, Калькутта | ID: 4645620988 Описание продукта
Наша компания владеет навыками экспорта, оптовой продажи и торговли гидрохлоридом натрия стандартного качества.Эти продукты широко используются в химической промышленности и лабораториях. Клиенты предпочитают покупать нашу продукцию, потому что мы предоставляем им продукцию непревзойденного качества по лучшим ценам на рынке. Эти продукты у нас есть оптом.
Характеристики:
- Точный состав
- Доступная цена
- Долгосрочные результаты
Заинтересовал этот товар? Получите последнюю цену у продавца
Связаться с продавцом
Изображение продукта
О компании
Год основания 1989
Юридический статус Фирмы Физическое лицо — Собственник
Характер BusinessExporter
Количество сотрудников До 10 человек
Годовой оборот Rs.1-2 крора
Участник IndiaMART с мая 2013 г.
В основном мы являемся единоличным владельцем , основанным на базе , которая была основана в 1989 в Калькутте, Западная Бенгалия, Индия. Pragati International , Kolkata входит в состав престижной компании, которая занимается экспортом, оптовой продажей и продажей керамического сырья , химикатов для очистки воды, продуктов лакокрасочной промышленности и многих других.Эти продукты изготовлены из высококачественного сырья и с использованием ультрасовременных технологий, которые делают их более эффективными и надежными. Кроме того, эти продукты проверяются профессионалами до окончательной отправки, чтобы гарантировать их качество согласно параметрам мирового класса. Клиенты высоко ценят долговечность и чистоту этих продуктов. Кроме того, мы предлагаем эти продукты клиентам по ведущим на рынке ценам, и мы также доставляем эти продукты вовремя с надлежащей упаковкой, которая является безопасной и эффективной.
Вернуться к началу 1 Есть потребность?
Получите лучшую цену
1 Есть потребность?
Получите лучшую цену
Гипохлорит: использование, взаимодействие, механизм действия
(Qiqing) Дезинфицирующее средство на основе гипохлорита натрия Гипохлорит натрия (6 г / 100 мл) Жидкость Актуальные Медицинская технология Qing., ООО Филиал Цзыбо 2020-06-21 Не применимо US 84 Дезинфицирующее средство Гипохлорит натрия (40 г / 1 л) Жидкость Экстракорпоральная Ежедневная химическая фабрика Wuxi Yong 2020 03-29 Неприменимо US 84 Дезинфицирующее средство Гипохлорит натрия (25,9 г / 518 г) Жидкий Экстракорпоральный Jiangsu Hawer A Friendly Technology Co., Ltd 2020-03-30 Неприменимо US Airocare Гипохлорит натрия (1,5 мг / 100 мл) Жидкий Актуальный Yukang Co., Ltd. 2021-01-13 Не применимо US Daily Doctor Sterilization Plus Гипохлорит натрия (0,002 г / 1 мл) Спрей Topical GFC Life Science Co., Ltd. 2020-04-29 Не применимо US Dakins Full Гипохлорит натрия (5 мг / 1 мл) Раствор Topical Century Pharmaceuticals, Inc. 1983-12-08 Не применимо US Dakins Half Гипохлорит натрия (2,5 мг / 1 мл) Раствор Для местного применения Century Pharmaceuticals, Inc. 1986 09 Не применимо US Квартал Дакинс Гипохлорит натрия (1,25 мг / 1 мл) Раствор Для местного применения Century Pharmaceuticals, Inc. -24 -24 US Di-Dak-Sol Гипохлорит натрия (0.125 мг / 1 мл) Раствор Для местного применения Century Pharmaceuticals, Inc. 2001-02-05 Неприменимо US Дезинфицирующее средство Гипохлорит натрия (5,5 кг / 100000) Жидкость Для местного применения GUANGZHOU YIQI TECHNOLOGY CO., LTD 2020-05-18 Не применимо США
Гипохлорит натрия: Чемпион общественного здравоохранения
Декабрь 2003 г.
Натрий ЧТО? Если это химическое соединение звучит совершенно незнакомо, возможно, вы узнаете его обычное название — хлорный отбеливатель.Вы можете знать это как жидкость в белом пластиковом кувшине, который часто можно увидеть возле стиральной машины. Его добавляют в белье, чтобы убить микробы и сделать белее белую одежду. Возможно, вы видели, как это использовалось и для других целей. Благодаря своим химическим свойствам, это соединение играет так много ролей в войне с микробами, что заслуживает титула чемпиона общественного здравоохранения.
Хлорный отбеливатель, гипохлорит натрия (NaOCl), является очень полезным и недорогим дезинфицирующим средством.Дезинфицирующее средство убивает микробы, от которых люди могут заболеть. Гипохлорит натрия — лишь одно из распространенных дезинфицирующих средств, содержащих хлор; газообразный хлор (Cl 2 ) и твердый гипохлорит кальция [Ca (OCl) 2 ] — два других.
Безопасная вода
Безопасная питьевая вода — основное условие хорошего здоровья. В США мы склонны воспринимать чистую питьевую воду как должное — она всегда под рукой.Но до того, как около 100 лет назад в нашу питьевую воду стали регулярно добавлять хлорные дезинфицирующие средства, такие как гипохлорит натрия, многие люди заболели и умерли от болезней, передающихся через воду (что означает «переносимые в воде»). Эти заболевания были вызваны микробами, заражающими людей простым питьем воды.
Брюшной тиф — это заболевание, передающееся через воду, которое вызывает крошечная бактерия Salmonella typhi .Это противное маленькое существо, которое можно найти в неочищенной воде, но видимое только в микроскоп, вызывает у своих жертв опасно высокую температуру и многие другие болезненные симптомы. До изобретения антибиотиков для лечения бактериальных инфекций брюшной тиф часто приводил к летальному исходу. Начиная с 1908 года, когда системы водоснабжения США начали хлорировать питьевую воду, брюшной тиф и другие серьезные заболевания, передаваемые через воду, были практически ликвидированы, что значительно повысило качество жизни американцев.
Безопасное приготовление пищи
Гипохлорит натрия используется в безопасном производстве и приготовлении пищевых продуктов. Он добавляется в воду в количествах, которые, как известно, уничтожают микробы, связанные с сырыми продуктами. Растворы гипохлорита натрия дезинфицируют поверхности для приготовления пищи, оборудование для сортировки пищевых продуктов, контейнеры и инструменты всех типов, участвующих в производстве, транспортировке и приготовлении продуктов, которые мы любим есть.
Применение в медицине
Растворы гипохлорита натрия также используются для дезинфекции многих типов поверхностей в больницах, медицинских лабораториях, кабинетах врачей и домах престарелых, чтобы предотвратить распространение инфекции среди пациентов, жителей и рабочих.Это очень важно, когда вы понимаете, что люди в больницах и домах престарелых больны или пожилые и поэтому не могут бороться с инфекциями так же хорошо, как здоровые люди.
Химия хлорирования Как гипохлорит натрия поражает микробы? Ответ находится в этой химической реакции:
HOCl, хлорноватистая кислота, образующаяся при добавлении гипохлорита натрия в воду, проникает через обычно устойчивые поверхности микроорганизмов, таких как Salmonella typhi , уничтожая их.Будет ли кислота оставаться в форме HOCl или в виде ионов H + и OCl —, зависит от кислотности или pH раствора. (Ионы определены в
Октябрьская статья «Хлорное соединение месяца».)
Дополнительные вопросы
1. Природные воды могут содержать много растворенных химических элементов из окружающей среды. Что представляют собой эти элементы и как они меняют внешний вид и вкус воды? Определите жесткую и мягкую воду.
2. Средний американец употребляет около 50 галлонов воды каждый день. Составьте список всех видов использования воды в среднем домохозяйстве. Каковы возможности экономии воды?
3. Питьевая вода берется либо из поверхностных вод (озера, водохранилища, реки), либо из грунтовых вод (в этом случае необходимы колодцы).Откуда у вас питьевая вода? Как лечится? (Подсказка: вы можете запросить годовой отчет у вашего предприятия водоснабжения.)
Идеи научных проектов
1. Закажите экскурсию на вашу местную водоочистную станцию и, используя плакатную бумагу, сделайте схему с пояснениями шагов, которым подвергается «сырая вода» во время очистки.
2. Изучите некоторые микроорганизмы, вызывающие заболевания, передающиеся через воду, в развивающихся странах, где отсутствует очистка питьевой воды.
Чтобы просмотреть список предыдущих функций «Хлорсодержащее соединение месяца», щелкните
здесь.
Гипохлорит натрия — молекула месяца Октябрь 2011 г.
Гипохлорит натрия — молекула месяца октябрь 2011 г. — версия только для HTML Что такое отбеливатель?
Бытовой отбеливатель на самом деле представляет собой смесь химикатов. Его основной составляющей является раствор ~ 3-6% гипохлорита натрия (NaOCl), который смешан с небольшими количествами гидроксида натрия, перекиси водорода и гипохлорита кальция.Его основное применение — удаление цвета, отбеливание или дезинфекция одежды или поверхностей, и он неоценим для большинства современных кухонь и ванных комнат.
Гипохлорит натрия широко используется в сельском хозяйстве и таких отраслях, как химическая промышленность, производство красок, известь, пищевая промышленность, стекло, бумага, фармацевтика, синтетика и утилизация отходов. Его часто добавляют в промышленные сточные воды для уменьшения запаха, поскольку NaOCl нейтрализует H 2 S и аммиак. Он также используется для детоксикации ванн с цианидом, используемых в процессах металлизации, и для предотвращения роста водорослей и моллюсков в градирнях.Он также используется для очистки водоснабжения и бассейнов.
Кто это придумал?
Жидкие отбеливатели на основе гипохлорита натрия были разработаны в 1785 году французом Клодом Луи Бертолле (рисунок слева). Затем он был представлен населению компанией Javel под названием liqueur de Javel . Сначала его использовали для отбеливания хлопка, но вскоре он стал популярным средством для отбеливания других материалов одежды, так как было быстро обнаружено, что гипохлорит натрия может удалять пятна с одежды при комнатной температуре.Во Франции гипохлорит натрия до сих пор известен как eau de Javel .
Как это выглядит?
Гипохлорит натрия — белый порошок, который растворяется в воде с образованием слегка желтоватого раствора с характерным запахом. Различные концентрации гипохлорита натрия обладают разным отбеливающим действием. Для домашнего использования отбеливатель обычно содержит 5% гипохлорита натрия, что придает ему pH около 11 и вызывает легкое раздражение кожи.Концентрированный отбеливатель (10-15% гипохлорита натрия) очень щелочной (pH ~ 13) и теперь настолько разъедает, что может вызвать ожог кожи при контакте.
NaOCl в виде порошка … и в виде раствора.
Как производится отбеливатель?
Первоначальный метод производства Бартолле включал пропускание Cl 2 через раствор карбоната натрия, но полученный раствор гипохлорита натрия был довольно слабым. Фактически, добавление газообразного хлора к воде дает как соляную кислоту, так и хлорноватистую кислоту:
Cl 2 + H 2 O HOCl + HCl (водн.)
Добавление соли к этой смеси позволяет образовать водный раствор гипохлорита натрия.Из равновесия вы можете видеть, что добавление кислоты к этому раствору будет сдвигать реакцию влево с выделением газообразного хлора. Следовательно, для образования стабильных гипохлоритных отбеливателей необходимо установить равновесие вправо, и это может быть достигнуто путем добавления щелочи, такой как NaOH.
Более эффективный метод производства был изобретен в 1890-х годах Э.С. Смита, который включал электролиз солевого раствора для получения NaOH и газа Cl 2 , который затем смешивали вместе с образованием NaOCl.В настоящее время единственный крупномасштабный промышленный метод производства NaOCl называется процессом Хукера и представляет собой просто улучшенную версию процесса электролиза Смита. При этом газообразный Cl2 переходит в холодный разбавленный раствор NaOH, образуя NaOCl, с NaCl в качестве основного побочного продукта. Реакция диспропорционирования (Cl 2 одновременно окисляется и восстанавливается) доводится до завершения за счет электролиза, и смесь должна поддерживаться при температуре ниже 40 ° C, чтобы предотвратить нежелательное образование хлората натрия.
Cl 2 + 2 NaOH NaCl + NaOCl + H 2 O
Как действует отбеливатель?
Гипохлорит натрия очень реакционноспособен и на самом деле нестабилен. При контакте с атмосферой газообразный хлор испаряется из раствора со значительной скоростью, а при нагревании гипохлорит натрия распадается на соль и кислород. Это также происходит при контакте с кислотами, солнечным светом, некоторыми металлами и многими газами, и это одна из причин, по которой отбеливатель может использоваться в больших количествах — после использования он разлагается на безвредные продукты (соль и вода), которые могут без проблем смывается в канализацию.
Bleach работает несколькими способами. Компонент хлорноватистой кислоты (HOCl) является очень сильным окислителем (даже более сильным, чем газ Cl 2 ) и может реагировать и разрушать многие типы молекул, включая красители. Кроме того, ион гипохлорита разлагается на хлорид и высокореактивную форму кислорода:
2ClO — 2Cl — + O 2
HOCl (и в меньшей степени Cl 2 и активный кислород) может атаковать химические связи в окрашенном соединении, либо полностью разрушая хромофор (часть молекулы, которая придает ему цвет), либо преобразовывая двойную -связи в хромофоре в одинарные связи, тем самым предотвращая поглощение видимого света молекулой.
Когда он вступает в реакцию с микробами, гипохлорит натрия атакует белки в клетках, вызывая агрегацию белков, а микробы — слипаться и погибать. Это также может вызвать разрыв клеточных мембран. Эта атака широкого спектра действия делает отбеливатель эффективным против широкого спектра бактерий.
Гипохлорит натрия является щелочным веществом, а бытовой отбеливатель также содержит NaOH, чтобы сделать раствор еще более щелочным. При растворении гипохлорита натрия в воде образуются два вещества.Это хлорноватистая кислота (HOCl) и ион гипохлорита (OCl — ), соотношение которых определяется pH воды.
Опасные побочные реакции
Отбеливатель, как правило, очень безопасен при уважительном обращении. В 2002 году Королевское общество по предотвращению несчастных случаев подсчитало, что ежегодно в британских домах происходит около 3300 несчастных случаев, требующих лечения в больницах, вызванных растворами гипохлорита натрия. Большинство из них были вызваны тем, что раствор выпили по ошибке (часто дети пили его из бутылки без этикетки), но многие также были вызваны ошибками при использовании.Гипохлорит натрия реагирует со многими реагентами, даже с солнечным светом, с образованием газообразного хлора, который в закрытых помещениях может быть серьезным раздражителем легких. Поскольку бытовой отбеливатель также содержит NaOH (каустическая сода), контакт с кожей вызовет ожоги из-за того, что NaOH разрушает жировую ткань и масла. Этот процесс известен как омыление и является методом производства мыла. Ощущение скользкости отбеливателя на коже происходит из-за омыления кожного сала и разрушения тканей!
Смешивание отбеливателя с некоторыми другими бытовыми химикатами может быть опасным из-за нежелательных побочных реакций.Добавление кислоты в отбеливатель приводит к образованию газообразного хлора, как упоминалось выше, тогда как смешивание отбеливателя с растворами аммиака (даже с мочой!) Может образовывать токсичные хлорамины: NH 3 + NaOCl NaOH + NH 2 Cl
NH 2 Cl + NaOCl NaOH + NHCl 2
NHCl 2 + NaOCl NaOH + NCl 3
При реакции отбеливателя с некоторыми бытовыми продуктами, такими как поверхностно-активные вещества и ароматизаторы, образуются хлорированные летучие органические соединения ЛОС, такие как четыреххлористый углерод (CCl 4 ) и хлороформ (CHCl 3 ), которые также могут быть вредными для здоровья.Тем не менее, польза от очистки и дезинфекции жилых помещений, вероятно, перевешивает любой потенциально вредный эффект от этих летучих органических соединений.
Отбеливатель может бурно реагировать с перекисью водорода с образованием O 2 газ:
H 2 O 2 (водн.) + NaOCl (водн.) NaCl (водн.) + H 2 O (л) + O 2 (г)
Вернуться на страницу «Молекула месяца». [DOI: 10.6084 / m9.figshare.5255599]
.
При хлорировании — Водный гидроксид натрия реагирует с хлором с образованием хлорида натрия, гипохлорита натрия и воды. Его дал французский химик Антуан Лабаррак. Реакция приведена ниже —
Он используется в качестве отбеливателя. Растворы бытовых отбеливателей обычно содержат 3-8% гипохлорита натрия по весу.
Используется для очистки, например, для удаления пятен плесени, зубных пятен и т. Д.
Используется как дезинфицирующее средство. Он обладает антимикробными свойствами, что делает его очень полезным в больницах в качестве дезинфицирующего средства. Он также используется в растворе Дакина.
Обладает дезодорирующим и едким действием, что делает его еще более полезным для чистки и стирки.
Применяется для очистки сточных вод.
Благодаря своей эффективности против патогенных организмов он используется в эндодонтической терапии.
Мыла, содержащие гипохлорит натрия, десятилетиями используются для лечения экземы у людей.
Гипохлорит натрия
Химическая формула
Другие названия
Антиформин, отбеливатель, хлорид соды
Молярная масса
74.4 г / моль
Точка плавления
18 ℃
Точка кипения
101 ℃
9114
9000 смВнешний вид
Зеленовато-желтое твердое вещество
Запах
Хлороподобный запах
Состояние по STP
Растворимость в воде
Растворим в воде (29.3 г / 100 мл)
Препарат
Хлорированием —
Cl2 + 2NaOH 🡪 NaCl + NaOCl + h3O
Гипохлоритом кальция —
Na2CO3 + Ca (OCl) 2 🡪 CaCO13
Электролизом рассола (концентрированный раствор NaCl и воды)
Озоном и натриевой солью —
NaCl + O3 🡪 NaOCl + O2
Основные свойства
Отбеливающие и дезодорирующие свойства.
Основное применение
В качестве дезинфицирующего и очищающего средства.
Недостаток
Коррозийный
Трудности при хранении
Получите лучшую цену
Получите лучшую цену
Гипохлорит: использование, взаимодействие, механизм действия
Применение в медицине
Чтобы просмотреть список предыдущих функций «Хлорсодержащее соединение месяца», щелкните здесь.
NaOCl в виде порошка … и в виде раствора.


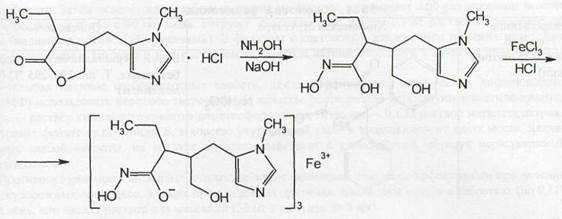

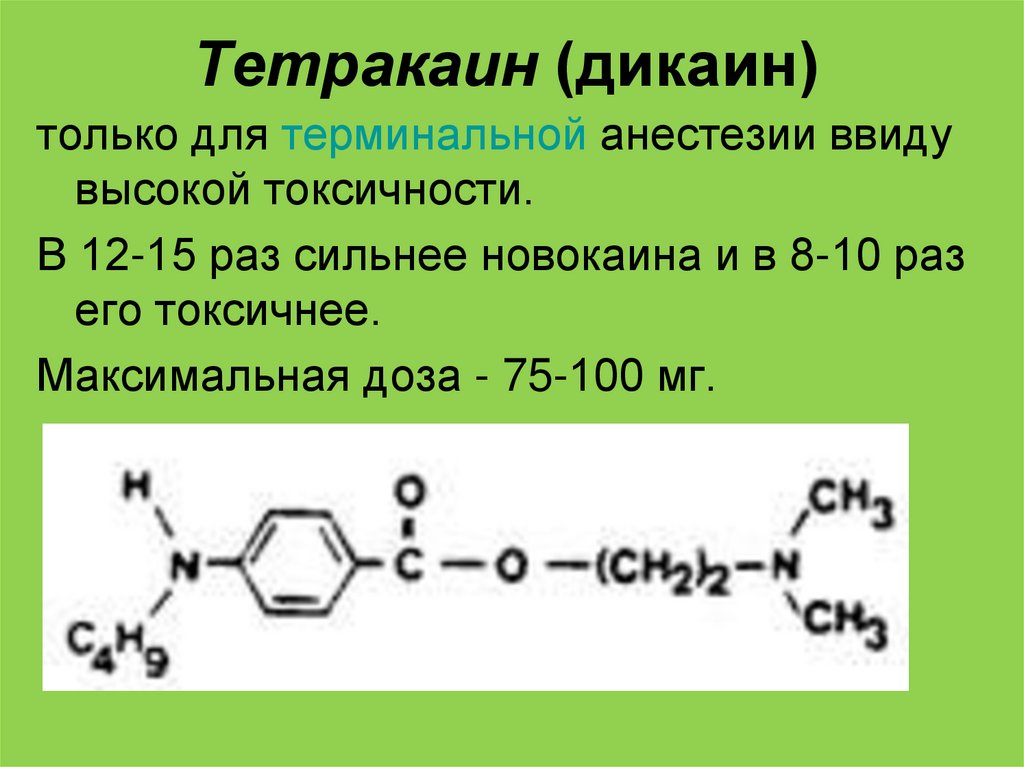
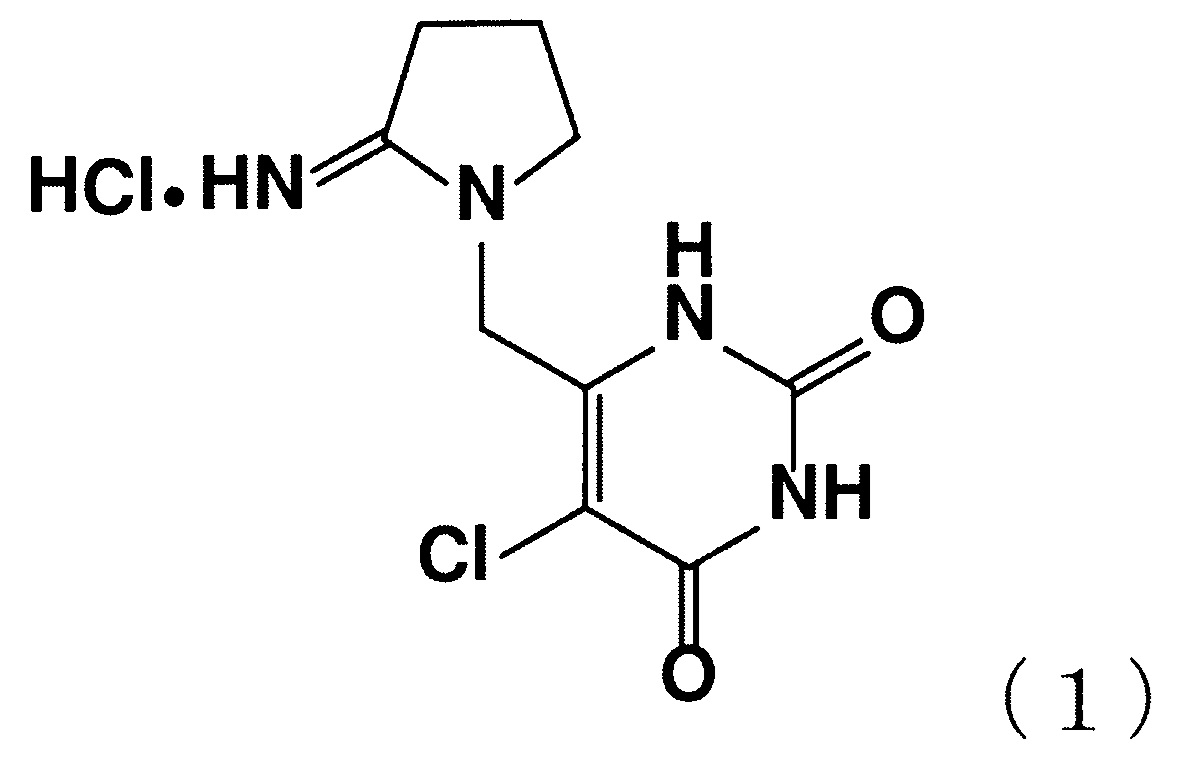 36].
36].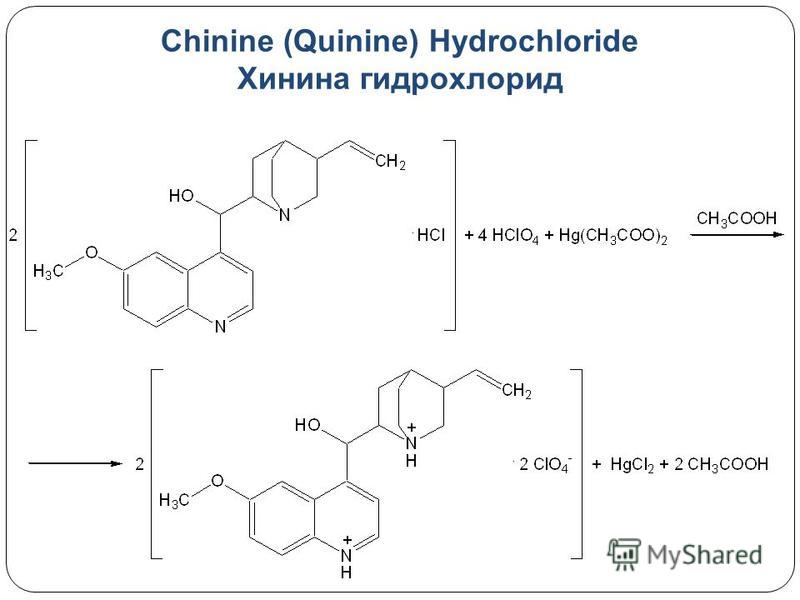 ;
;
 Разъедает многие металлы.
Разъедает многие металлы.