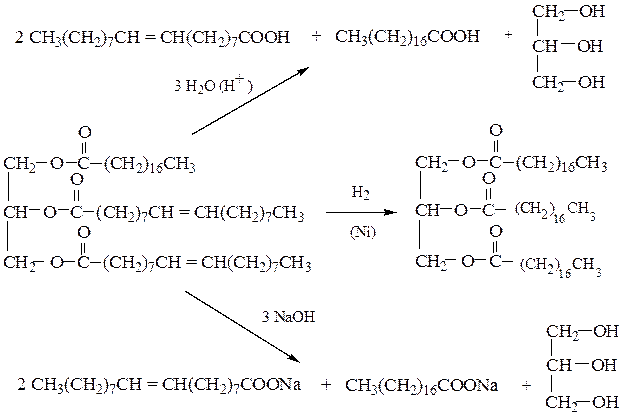химия
Причина кето-енольной таутомерии карбонильных соединений:
d. подвижность атомов водорода в α-положении
e. наличие нескольких двойных связей в радикале
Циклические ангидриды можно получить для кислот:
малеиновой
янтарной
Пропионовая кислота реагирует с:
пропионовой кислотой, водородом, этанолом
Для карбоксильной группы характерны реакции:
замещения группы -ОН , этерификации
гидратации пропеновой кислоты:
3-гидроксипропановая кислота, образуется против правила Марковникова
Глутаровая кислота при нагревании:
Дегидратируется, образует циклический ангидрид .
Реакции альдольной конденсации характерны для:
d. сложных тиоэфиров |
e. кетонов |
Реакция формальдегида с водой относится к типу:
b. диспропорционирования |
Число атомов углерода в основной цепи продукта альдольной конденсации бутаналя: шесть
Продукты гидролиза этилпропионата
a. пропионовая кислота и этиловый спирт |
Ацетали образуются в реакциях альдегидов со спиртами
c. в избытке спирта | ||
d. в кислой среде |
Ацетон можно обнаружить
a. йодоформной пробой |
Продукты реакции полного окисления формальдегида реактивом Толленса
b. углекислый газ | ||
c. вода |
Для альдегидной группы характерны реакции
: | d. восстановления | |
e. нуклеофильного присоединения |
Продукт гидратации пропеновой кислоты
a. образуется против правила Марковникова | ||
b. 3-гидроксипропановая кислота |
Этилацетат – сложный эфир
d. уксусной кислоты и этанола |
Карбонильную функциональную группу содержат молекулы
c. изопропилформиата | ||
e. бутанона |
Пропионовая кислота не реагирует с
| d. бромной водой |
e. водой |
При альдольной конденсации бутаналя образуется
b. 3 – гидрокси–2 –этилгексаналь |
Реакции альдольной конденсации характерны для
a. кетонов | ||
d. сложных тиоэфиров |
В реакциях присоединения к альдегидам
: | b. атом кислорода карбонильной группы отрицательно поляризован | |
d. карбонильный атом углерода положительно поляризован |
Для осуществления превращения CH3CHO→CH3CH2OH необходимо:
c. провести реакцию гидрирования |
Линолевая кислота проявляет свойства
: | c. одноосновных карбоновых кислот | |
e. непредельных углеводородов |
Причина кето-енольной таутомерии карбонильных соединений:
b. подвижность атомов водорода в α-положении |
Продукты гидролиза этилпропионата
b. пропионовая кислота и этиловый спирт |
Продукты гидролиза этилбутирата
b. бутановая кислота и этиловый спирт |
Продукт гидратации пропеновой кислоты
c. 3-гидроксипропановая кислота | ||
d. образуется против правила Марковникова |
Углеродная цепь этаналя удлиняется в реакции
c. альдольной конденсации |
Карбонильную функциональную группу содержат молекулы
a. бутанона | ||
c. изопропилформиата |
При альдольной конденсации бутаналя образуется
c. 3 – гидрокси–2 –этилгексаналь |
Продукты гидролиза этилпропионата
d. пропионовая кислота и этиловый спирт |
Реакции альдольной конденсации характерны для
b. сложных тиоэфиров | ||
d. кетонов |
Продукты гидролиза этилбутирата
a. бутановая кислота и этиловый спирт |
при альдольной конденсации бутаналя образуется
d. 3 – гидрокси–2 –этилгексаналь |
Для карбоксильной группы характерны реакции
d. этерификации |
Реакционную способность в реакциях присоединения возрастает в ряду
c. ацетон → метаналь → хлораль |
Ацетали образуются в реакциях альдегидов со спиртами
b. в кислой среде | ||
e. в избытке спирта |
В реакциях присоединения к альдегидам
a. атом кислорода карбонильной группы отрицательно поляризован | ||
b. карбонильный атом углерода положительно поляризован |
Причина кето-енольной таутомерии карбонильных соединений:
e. подвижность атомов водорода в α-положении |
Этилацетат – сложный эфир
e. уксусной кислоты и этанола |
Амиды кислот образуются при взаимодействии карбоновых кислот
d. с аминами |
Молекулы альдегидов и кетонов
b. не связаны межмолекулярными водородными связями | ||
d. полярные соединения |
Тиоспирты с альдегидами взаимодействуют
b. с образованием полутиоацеталей | ||
c. более активно, чем спирты |
При альдольной конденсации углерод карбонильной группы
d. присоединяется к α -углеродному атому другой молекулы |
Амиды кислот образуются при взаимодействии карбоновых кислот
c. с аминами |
Для осуществления превращения CH3CHO→CH3CH2OH необходимо:
a. провести реакцию гидрирования |
Ангидриды кислот образуются при взаимодействии карбоновых кислот
b. с фосфорной кислотой | ||
d. с карбоновыми кислотами |
studfiles.net
Реакции электрофильного характера
⇐ ПредыдущаяСтр 3 из 4Следующая ⇒
28. Напишите схему реакции гидратации пропена (пропилена).
Опишите её механизм.
Назовите продукт реакции по ЗН ИЮПАК.
Объясните отличие этой реакции от гидратации акриловой (пропеновой) кислоты, опираясь на современную трактовку правила Марковникова.
Ответ
Схема реакции гидратации пропена:
CH3CH=CH2 + H2O CH3CH(OH)CH3
Механизм реакции.
Реакция протекает в три стадии. На первой стадии, при взаимодействии с катализатором кислотного характера (Н3РО4) образуется -комплекс ( устойчивый карбокатион). На второй стадии к нему присоединяется молекула воды, на третьей происходит отщепление водородного протона.
В результате реакции получается пропанол-2.
Отличие этой реакции от гидратации акриловой (пропеновой) кислотызаключается в том, что атом водорода присоединяется к менее гидрированному атому углерода в составе двойной связи:
СН2=СН-СООН+Н2О = СН2ОН-СН2-СООН
Причиной этого является распределение электронной плотности в молекуле акриловой кислоты:
Вследствие сопряжения электронных плотностей π-связей карбоксильной группы и двойной связи и смещения общей электронной плотности в сторону более электроотрицательного атома кислорода на менее гидрированном атоме С возникает частичный отрицательный заряд, на более гидрированном – частичный положительный заряд. В соответствии с современной трактовкой правила Марковникова присоединение электрофильной частицы Н+ происходит в соответствии с распределением электронной плотности, к частице с повышенной электронной плотностью.
29. Напишите схему реакции бромирования анилина.
Опишите её механизм.
Назовите продукт бромирования по ЗН ИЮПАК.
Укажите ориентирующее действие аминогруппы.
Объясните, что легче бромируется бензол или анилин.
Решение
1. Схема реакции бромирования анилина
Механизм реакции — электрофильное замещение в ароматическом ядре. Специфической особенностью является избыточная электронная плотность в о- и п-положениях, обусловленная +М-эффектом аминогруппы. Реакция проходит в две стадии. На первой стадии (электрофильное присоединение) в о- и п-положениях образутся нестойкий δ-комплекс, лишенный ароматической структуры, с четырьмя π –электронами, делокализованными в сфере воздействия ядер пяти углеродных атомов. Шестой углеродный атом при этом переходит из состояния sp2-гибридизации в состояние sp3, приобретая таким образом тетраэдрическую симметрию. Оба заместителя Br и Н лежат в плоскости, перпендикулярной к плоскости кольца. На второй стадии лабильный δ-комплекс превращается в стабильный 2,4,6 триброманилин с потерей 3 протонов
Ориентирующее действие аминогруппы происходит в положения 2,4,6:
Бромирование анилина происходит легче, чем бромирование бензола, вследствие сопряжения неподеленной электронной пары азота с электронами ароматического ядра. Это, в свою очередь, приводит к увеличению электронной плотности в бензольном кольце, что способствует более быстрому протеканию реакции электрофильного замещения.
30. Напишите схему реакции бромирования бензойной кислоты (катализатор FеBr3).
Опишите её механизм.
Назовите продукт бромирования по ЗН ИЮПАК.
Укажите ориентирующее действие заместителя.
Объясните, что легче бромируется – бензол или бензойная кислота.
Ответ
Схема реакции бромирования бензойной кислоты (катализатор FеBr3):
Механизм реакции — электрофильное замещение в ароматическом ядре. Специфической особенностью является повышенная по сравнению с другими атомами электронная плотность в м-положении, обусловленная -М-эффектом карбоксильной группы. Реакция проходит в две стадии. На первой стадии (электрофильное присоединение) в м-положении образуется нестойкий δ-комплекс, лишенный ароматической структуры, с четырьмя π –электронами, делокализованными в сфере воздействия ядер пяти углеродных атомов. Шестой углеродный атом при этом переходит из состояния sp2-гибридизации в состояние sp3, приобретая таким образом тетраэдрическую симметрию. Оба заместителя Br и Н лежат в плоскости, перпендикулярной к плоскости кольца. На второй стадии лабильный δ-комплекс превращается в стабильную 3-бромбензойную кислоту с потерей 1 протона.Название продукта бромирования по ЗН ИЮПАК -3-бромбензойная кислотаОриентирующее действие заместителя обусловлено отрицательным мезомерным эффектом карбоксильной группы, усиливающим электронную плотность в м-положении(3 и 5- положение):
Легче бромируется бензол, так как вследствие отрицательного мезомерного эффекта карбоксильной группы происходит уменьшение электронной плотности на бензольном кольце.
31. Напишите схемы реакций алкилирования бензола третичным изобутанолом и пропеном в кислой среде.
Опишите механизм этих реакций.
Назовите продукты алкилирования по ЗН ИЮПАК.
Ответ
Схемы реакций алкилирования бензола пропеном (реакция (а) и третичным изобутанолом (реакция (b) в кислой среде:
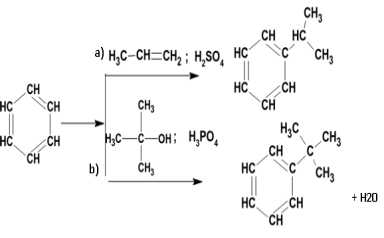
.Механизм этих реакций –электрофильное замещение, катализируемое минеральными кислотами. В качестве электрофильной частицы выступает карбкатион, который образуется либо при присоединении протона к олефину, либо при отщеплении воды от молекулы спирта под действием протона.
В обеих рассматриваемых реакциях (а и b) образуется один продукт алкилирования – изопропилбензол (кумол). В реакции b) также выделяется вода.
3. Реакции нуклеофильного характера
32. Напишите схему реакции взаимодействия 1-бромпропана с этилатом натрия.
Опишите ее механизм.
Укажите нуклеофил, субстрат, уходящую группу.
Ответ
Схема реакции взаимодействия 1-бромпропана с этилатом натрия:
Механизм реакции: замещение нуклеофильное, бимолекулярное, SN2
Реакция происходит в одну стадию. При этом атака нуклеофила и отщепление уходящей группы происходит одновременно:
C3H7Br + C2H5O— → [C2H5O—⋯ C3H7⋯ Br]− → C2H5-O-C3H7+ Br –
Нуклеофил — этилат-анион C2H5O—,
субстрат — 1-бромпропан, СН3СН2СН2Br,
уходящая
33. Напишите схему реакции гидролиза бензилхлорида (фенилхлорметана).
Опишите её механизм.
Укажите нуклеофил, субстрат, уходящую группу.
Объясните причину повышенной устойчивости бензильного катиона.
Ответ
2.Гидролиз бензилхлорида в щелочном водном растворе является реакцией нуклеофильного замещения (Sn). Механизм реакции: замещение нуклеофильное, бимолекулярное, SN2.
Реакция происходит в одну стадию. При этом атака нуклеофила и отщепление уходящей группы происходит одновременно:
C6H5СН2Cl + —OH → [OH ⋯ C6H5СН2⋯ Cl]− → C6H5СН2 OH + Cl –
3.Нуклеофил — гидроксил-анион —OH ,
субстрат — бензилхлорида, C6H5СН2Cl,
уходящая группа — Cl –
4. Причина повышенной устойчивости бензильного катиона –сопряжение электронной плотности метиленовой группировки СН2 с электронной плотностью бензольного кольца:
34. Напишите схему реакции получения полуацеталя и ацеталя из пропаналя и этанола.
Опишите механизм этой реакции.
Обоснуйте роль кислотного катализатора.
Ответ
2. Механизм реакции – ионная реакция нуклеофильного приcоединения АN
Процесс – ступенчатый. На первом этапе происходит образование нуклеофильной частицы. Затем она атакует двойную связь и образуется отрицательно заряженный комплекс. Далее происходит его нейтрализации путем протонирования. В присутствии следов минеральной кислоты процесс продолжается и приводит к образованию ацеталей
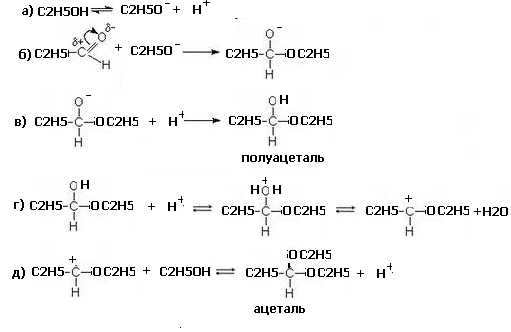
3. Роль кислотного катализатора заключается в протонировании полуацеталя на стадии г)
35. Напишите схему реакции взаимодействия этаналя с метиламином.
Опишите механизм этой реакции.
Обоснуйте роль кислотного катализатора.
Объясните возможность протекания реакции гидролиза полученного имина в кислой и щелочной среде.
Ответ
2.Механизм этой реакции –нуклеофильное присоединение с последующим отщеплением молекулы воды
3. Роль кислотного катализатора – протонирование на стадии а)
4. В присутствии разбавленных кислот имины гидролизуются водой с образованием карбонильных соединений и аминов, эта реакция обратна реакции синтеза иминов:
В присутствии щелочи гидролиз не идет
Рекомендуемые страницы:
lektsia.com
Пропеновая кислота
Пропеновая кислота
ТУ 6-09-4131-83
CH2=CHCOOH
Акриловая кислота (пропеновая кислота, этенкарбоновая кислота) СН2=СН−СООН — простейший представитель одноосновных непредельных карбоновых кислот.
Физические свойства
Акриловая кислота представляет собой бесцветную жидкость с резким запахом, растворимую в воде и органических растворителях
Синтез
Для синтеза акриловой кислоты применяют парофазное окисление пропилена кислородом воздуха на висмутовых, кобальтовыхили молибденовых катализаторах:
-
- CH2=CH−CH3 + O2 → CH2=CH−COOH
Раньше использовалась реакция взаимодействия ацетилена, оксида углерода (II) и воды:
-
- HC≡CH + CO + H2O → CH2=CH−COOH
или кетена с формальдегидом:
-
- CH2=C=O + HCHO → CH2=CH−COOH
Компанией Rohm and Haas разрабатывается технология синтеза акриловой кислоты из пропана.
Химические свойства
Обладает химическими свойствами карбоновых кислот: взаимодействует с активными металлами, основаниями, с солями более слабых кислот с образованием солей, со спиртами с образованием сложных эфиров.
Акриловая кислота образует соли, хлорангидрид, ангидриды, сложные эфиры, амиды и пр. Она вступает в реакции присоединения, характерные для этиленовых углеводородов. При действии амальгамы натрия в водном растворе и гидрировании в жидкой фазе в присутствии Ni, Pt, Pd в пропионовую кислоту. Присоединение протонных кислот, воды и NH3 происходит против правила Марковникова с образованием замещённых производных. Как диенофил акриловая кислота участвует в диеновом синтезе. Конденсируется с солями арилдиазония (реакция Меервейна):
-
- n-ClC6H4N2Cl + CH2=CH−COOH → n-ClC6H5−CH=CH−COOH + N2
При УФ-облучении или в кислых водных растворах (рН = 1), а также в присутствии инициаторов полимеризации образует полиакриловую кислоту ([−СН2−СН(СООН)−]n).
Применение
Для предотвращения полимеризации при хранении добавляют ингибитор — гидрохинон. Перед использованием перегоняют с особой осторожностью — возможна взрывоподобная полимеризация.
Акриловая кислота и её производные используются при производстве акриловых эмульсий для лакокрасочных материалов, пропитки тканей и кожи, в качестве сырья для полиакрилонитрильных волокон и акриловых каучуков, строительных смесей и клеев. Значительная часть акриловой кислоты используется также при производстве суперабсорбентов. В производстве полимеров широко применяют сложные эфирыакриловой и метакриловой кислот, главным образом метиловые эфиры: метилакрилат и метилметакрилат.
Безопасность
Акриловая кислота сильно раздражает кожные покровы. Раздражает слизистую оболочку глаз (порог раздражающего действия 0,04 мг/л). При попадании в глаза вызывает сильные ожоги роговицы глаза и может вызвать необратимые повреждения. Вдыхание паров может вызвать раздражение дыхательных путей, головную боль, при больших концентрациях или экспозиции — отёк лёгких. Хотя наличие запаха ещё не означает какой-либо угрозы здоровью, необходим мониторинг воздуха. Предельно допустимая концентрация составляет 5 мг/м³.
himmax.ru
Пропеновая кислота — это… Что такое Пропеновая кислота?
Акриловая кислота (пропеновая кислота, этенкарбоновая кислота) СН2=СН–СООН – простейший представитель одноосновных непредельных карбоновых кислот. Бесцветная жидкость с резким запахом, растворима в воде, диэтиловом эфире, этаноле, хлороформе. Легко полимеризуется с образованием полиакриловой кислоты. С другими мономерами образует сополимеры.
Синтез
Сейчас применют парофазное окисление пропилена кислородом воздуха на висмутовых, кобальтовых или молибденовых катализаторах.
СН2=СН–СН3 + O2 → СН2=СН–СООН
Раньше использовалась реакция ацетилена, оксида углерода (II) и воды:
СН≡СН + СО + Н2О → СН2=СН–СООН
или кетена с формальдегидом.
СН2=С=О + H2C=O → СН2=СН–СООН
Компанией Rohm and Haas разрабатывается технология синтеза акриловой кислоты из пропана.
Химические свойства
Акриловая кислота образует соли, хлорангидрид, ангидриды, сложные эфиры, амиды и пр. Она вступает в реакции присоединения, характерные для этиленовых углеводородов. При действии амальгамы натрия в водном растворе и гидрировании в жидкой фазе в присутвии Ni, Pt, Pd в пропионовую кислоту. Присоединение протонных кислот, воды и NH3 происходит против правила Марковникова с образованием замещенных производных. Как диенофил акриловая кислота участвует в диеновом синтезе. Конденсируется с солями арилдиазония (реакция Меервейна):
n-ClC6H4N2Cl + СН2=СНСООН n-СlС6Н4СН=СНСООН + НСl + N2.
При УФ-облучении или в кислых водных растворах (рН=1), а также присутствии инициаторов полимеризации образует полиакриловую кислоту ([—СН2—СН(СООН)—]n).
Применение
Для предотвращения полимеризации при хранении добавляют ингибитор-гидрохинон. Перед использованием перегоняют с особой осторожностью — возможна взрывоподобная полимеризация.
Акриловая кислота и ее производные используются при производстве акриловых эмульсий для лакокрасочных материалов, пропитки тканей и кожи, в качестве сырья для полиакрилонитрильных волокон и акрилатных каучуков, строительных смесей и клеев. Значительная часть акриловой кислоты используется так же при производстве суперабсорбентов. В производстве полимеров широко применяют сложные эфиры акриловой и метакриловой кислот, главным образом метиловые эфиры: метилакрилат и метилметакрилат.
Безопасность
Акриловая кислота сильно раздражает кожные покровы. Раздражает слизистую оболочку глаз (порог раздражающего действия 0,04 мг/л). При попадании в глаза вызывает сыльные ожоги роговицы глаза и может вызвать необратимые повреждения. Вдыхание паров может вызвать раздражение дыхательных путей, головную боль,при больших концентрациях или экспозиции — отёк лёгких. Хотя наличие запаха ещё не означает какой либо угрозы здоровью, необходим мониторинг воздуха. ПДК 5 мг/м3
Примечания
- Kirk-Othmer encyclopedia, 3 ed., v. I, N.Y.-[a.o.], 1978, p. 330-54. А. В. Девекки.
- Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 121
См. также
Wikimedia Foundation. 2010.
dic.academic.ru
Акриловая кислота | |
|---|---|
Общие | |
| Хим. формула | C₃H₄O₂ |
| Рац. формула | C3H4O2 |
Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 72,06 г/моль |
| Плотность | 1,051 г/см³ |
Термические свойства | |
| Т. плав. | 13 ℃ |
| Т. кип. | 141 ℃ |
| Т. всп. | 68 ℃ |
| Энтальпия образования | −384,09 кДж/моль |
| Удельная теплота испарения | 45,6 кДж/моль |
| Удельная теплота плавления | 11,16 |
Химические свойства | |
| pKa | +4.25 |
| Растворимость в воде | смешивается |
Классификация | |
| Номер CAS | 79-10-7 |
| PubChem | 6581 |
| ChemSpider | 6333 |
| Номер EINECS | 201-177-9 |
| RTECS | AS4375000 |
| ChEBI | 18308 40714 |
ru.wikipedia.org
Пропеновая кислота — Справочник химика 21
Акриловая кислота (пропеновая кислота) СН2=СН—СООН — простейший представитель ненасыщенных кислот. Акриловая кислота обладает всеми свойствами карбоновых кислот. В то же время присутствие ненасыщенной двойной связи обусловливает ее способность вступать в реакции присоединения и полимеризации. Так, акриловая кислота и ее метиловый эфир — метакрилат при полимеризации образуют различные прозрачные пластмассы СН2=СН -I- СН,=СН 4- СН2=СН…-.—СНз—СН-СНз—… [c.344]Задание 10.9. Какую гидроксикислоту следует подвергнуть дегидратации, чтобы получить акриловую (пропеновую) кислоту [c.320]
СН2 СН-С 0 Акриловая (пропеновая) кислота [c.586]
Пропеновая кислота СН.г-СНСООН [c.12]
СНг=СН—СООН акриловая кислота пропеновая кислота) [c.915]
Акриловая кислота (пропеновая кислота) [c.264]
Акриловая кислота Пропеновая кислота СН2=СНСООН Токсическое действие. Оказьшает политропное действие на нервную систему, легкие, печень, почки, на кислотно-щелочное равновесие крови. Сильно раздражает слизистые. Проникает через кожу и оказывает кожно-резорбтивное действие. Обладает способностью к функциональной кумуляции. [c.624]
Напишите структурные формулы и назовите другими способами а) этиловый эфир метакриловой кислоты б) амид 2-метилпропионовой кислоты в) нитрил пропеновой кислоты г) метиловый эфир льхлор-бензойной кислоты д) оксалат кальция е) диэтиловый эфир малоновой кислоты ж) диметиловый эфир терефталевой кислоты з) ангидрид янтарной кислоты. [c.91]
СНг=СН—СООН акриловая кислота, пропеновая кислота СНг=СН—СНа—СООН винилуксусная кислота, 3-бутеновая кислота СНз—СН=СН—СООН кротоновая кислота, 2-бутеновая кислота СНг=С—СООН а-метилакриловая кислота, метакриловая кислота, [c.206]
Пропеновая кислота см. Акриловая кислота [c.415]
Номенклатура, изомерия. В группе непредельных кислот наиболее часто используют эмпирические названия СНз=СН—СООН — акриловая (пропеновая) кислота, СНз=С(СНз)—СООН — метакриловая (2-метилпропе-новая) кислота. [c.385]
На основании теории строения органических соединений предскажите химические свойства пропеновой кислоты. Напишите уравнения соответствующих химических реакций. [c.451]
Бутановая кислота Гексадекановая кислота Октадекановая кислота Пропеновая кислота Вензолкарбоновая кислота Масляная кислота Пальмитиновая кислота Стеариновая кислота Акриловая кислота Бензойная кислота СН,-СН,-СН,-СГ он СН,-(СНО -С[c.199]
Метил-пропеновая кислота 5% Pd/ , 20 мин, 170 °С 5,63 [c.512]
Отдельные представители. Акриловая, пропеновая кислота СН.2 =СН—СООН. Бесцветная жидкость с резким запахом. Смешивается с водой во всех отношениях. Получают гидролизом акрилонитрила [c.137]
Принимая во внимание, что переходное состояние близко по структуре к карбкатионному интермедиату, понижение энергии карбкатиона приводит к стабилизации переходного состояния и повышению скорости реакции (см. разд. 14.10.3). Пропеновая кислота СН2 = СН—СО2Н, наоборот, присоединяет бром медленно. Это связано с тем, что карбоксильная группа является акцептором электронов и уменьшает стабильность карбкатиона. [c.586]
Акриловая кислота (пропеновая кислота этенкарбоновая кислота) СН2=СН—СООН представляет собой жидкость, т. пл. 12,1 °С, т. кип. 140,9 °С. Легко полимеризуется и образует стеклообразную массу. [c.489]
Пропеновую кислоту обычно называют акриловой кислотой, а 2-метилпропеновую кислоту — метакрилоеой кислотой. [c.337]
chem21.info
Гидратация непредельных кислот — Справочник химика 21
Гидратация непредельных кислот [c.213]Гидратация непредельных кислот. Присоединение воды к непредельным кислотам, имеющим сопряженную с карбоксилом двойную связь, происходит не по правилу Марковникова. Например, в акриловой кислоте гидроксил присоединяется в -положение, а не в а- [c.296]
Реакция образования этилового спирта из этилена была подробно изучена А. М. Бутлеровым. Он получил этиловый спирт гидратацией этилена в присутствии серной кислоты. В настоящее время спирты производят в промышленном масштабе гидратацией непредельных углеводородов. Так, изопропиловый спирт получают в больших количествах из пропилена. В связи с необходимостью замены пищевого сырья этиловый спирт получают из этилена газообразный этилен, получаемый из газов крекинга, пропускают в серную кислоту при нагревании до 70 °С под давлением 10 ат. [c.136]
Исследования в области гидратации непредельных соединений в основном стимулировались заманчивой экономической перспективой получения этилового спирта из непищевого сырья. Еще Бутлеров указывал, что удобное и быстрое поглощение этилена концентрированной серной кислотой при температуре около 160°С составляет факт, обещающий приобрести со временем практическое значение если бы удалось открыть дешевый способ приготовления этилена в большом количестве, то он составил бы материал для добывания спирта [1]. [c.262]
Гидратация непредельных карбоновых кислот протекает в присутствии катализаторов и в зависимости от положения двойной С = С-связи по отношению к карбоксильной группе дает возможность синтезировать -, у- и б-оксикарбоновые кислоты [c.181]
Гидратация непредельных карбоновых кислот протекает в присутствии кислых катализаторов и в зависимости от положения [c.184]
Ряд свойств непредельных кислот обусловлен свойствами карбоксильной группы образование солей, сложных эфиров и др.) и двойной связи (различные реакции присоединения). Специфическими свойствами обладают кислоты с близко расположенной от карбоксила двойной связью — а, р-непредельные кислоты. Так, присоединение галоидоводородов и гидратация идут для них против правила Марковникова по типу 1,4-присоединения (как в сопряженных системах) [c.245]
По величине биохимического показателя, концентрации загрязнений и их токсичности, методам подготовки воды для биохимической очистки промышленные сточные воды подразделяются на четыре группы I группа — имеет биохимический показатель выше 0,2 II группа — в пределах 0,1—0,02 III группа — в пределах 0,01—0,001 IV группа — ниже 0,001. К I группе относятся стоки следующих установок и производств прямой перегонки нефти, гидрогенизационной очистки и платформинга, гидратации непредельных углеводородов, окисления, изомеризации углеводородов, пиролиза производства нафтеновых кислот, синтетических жирных кислот, белково-витаминных концентратов ряд других (табл. 1.3). [c.25]
Производства смазок Производства нафтеновых кислот Газофракционирования углеводородов Окисления углеводородов Гидратации непредельных углеводородов Алкилирования углеводородов Дегидрирования углеводородов Изомеризации углеводородов Сульфирования Производства ПАВ [c.74]
Ряд свойств непредельных кислот обусловлен свойствами карбоксильной группы образование солей, сложных эфиров и др.) и двойной связи (различные реакции присоединения). Специфическими свойствами обладают кислоты с близко расположенной от карбоксила двойной связью — а,Р-непредельные кислоты. Так, присоединение галогеноводородов и гидратация идут для них против правила Марковникова по типу 1,4-присоединения. На первой стадии протон присоединяется к кислороду карбоксильной группы, нуклеофил атакует -углерод, а двойная связь переходит в поло жение 2,3. Далее промежуточный продукт изомеризуется [c.232]
Сырьем для производства спиртов служат как чистые олефины, так и парафин-олефиновые фракции, содержаш,ие 10—50% непредельных углеводородов. В этом важное преимущество сернокислотного метода перед прямой гидратацией олефинов. В соответствии с уравнением (7.2), скорость реакции линейно зависит от концентрации олефина, а для газообразных олефинов — от парциального давления. Из-за плохой растворимости олефинов в серной кислоте и хорошей в алкил- ульфатах наблюдается более сложная зависимость скорость реакции в начальный период, несмотря на высокую концентрацию олефина, минимальна. [c.222]
Решение. Классы органических соединений находятся между собой в генетической связи (связи по происхождению), а потому из веществ одних классов можно получить вещества других классов. В задаче исходным веществом является непредельный углеводород этилен, конечным — сложный эфир. Очевидно, надо этилен превратить в этиловый спирт, спирт окислить в уксусный альдегид и затем в уксусную кислоту, после чего произвести этерификацию спирта кислотой. Переход от этилена к спирту осуществляется гидратацией этилена [c.422]
Химические свойства непредельных карбоновых кислот обусловлены как свойствами карбоксильной группы, так и свойствами двойной связи. Специфическими свойствами обладают кислоты с близко расположенной от карбоксильной группы двойной связью — сх, -непредель-ные кислоты. У зтих кислот присоединение галогеноводородов и гидратация идут против правила Марковникова [c.386]
Алкилсерные кислоты образуются как промежуточные продукты при реакциях гидратации непредельных углеводородов (стр. 72) и дегидратации спиртов (стр. 77 и 110) поддействием серной кислоты. [c.109]
При циклизации непредельных кетоспиртов, содержащих кратную связь в 7,S-положении, образуется тетрагидропирон и его гомологи. В кислой среде такая циклизация протекает настолько легко, что при гидратации дивинилкетонов с помощью разбавленной серной кислоты в присутствии сернокислой ртути выделить первичный продукт гидратации—непредельный кетоспирт—в большинстве случаев не удается в условиях реакции он непосредственно превращается в тетрагидропирон [c.752]
ЧТО при гидратации дивинилкетонов с помощью разбавленной серной кислоты в присутствии сернокислой ртути выделить первичны продукт гидратации—непредельный кетоспирт—в большинстве случаев не удается в условиях реакции он непосредственно превращается в тетрагидропирон [c.650]
Алкилсеркые кислоты (см.) образуются как промежуточные продукты при реакции гидратации непредельных углеводородов и дегидратации спиртов (см. ниже) под действием серной кислоты. [c.120]
Одна из первых попыток объяснения механизма окисления непредельных соединений принадлежит Эльтекову [1]. По мнению этого автора, при данной реакции происходит присоединение по месту двойной связи или одного или двух атомов кислорода. В первом случае первоначально образуется окись, превращающаяся затем путем последующих гидратации и дегидратации в альдегид или кетон. Второе и притом главное направление реакции вызывает распад молекулы по месту двойной связи. К этому же взгляду на реакцию окисления примкнул А. М. Зайцев [2] на основании обширных исследований Казанской лаборатории над окислением непредельных кислот. [c.586]
Реакция окисления непредельных углеводородов марганцовокислым калием была подробно изучена Е, Е. Вагнером (1888 г.). Оказалось, что она является общей для всех соединений с кратными связями. Из кислот этиленового ряда получаются диоксикислоты (из коричной—фенилдиоксипронионовая), из аллнлового спирта—глицерин, из олефинов—гликоли и т. д. Позднее было открыто, что этот процесс, который называют окислительной гидратацией, можно проводить каталитически. Прекрасными -катализаторами являются Оз или ОзО , значительно ускоряющие реакции. Добавки ОзО и КСЮд или НаСЮд при окислении фумаровой или малеиновой кислот в винные кислоты в несколько раз повышают скорость реакций. [c.215]
Присоединение воды к олефннам обычно проводят при перемешивании смеси непредельного соединения с серной кислотой. Таким образом, гидратация протекает в условиях кислотного катализа и начинается с электрофильного присоединения протона по кратной связи. [c.119]
Алкины легко присоединяют воду (гидратация), образуя спирты, кислоты. Присоединение Н2О идет в присутствии катализатора — Н 804 (реакция М. Г. Ку-черова, открыта в 1881 г.), либо над гетерогенными катализаторами. Сначала образуется непредельный спирт, а затем альдегид (или кетон) [c.199]
Из нефтяных углеводородов путем последовательной химической переработки получают целый ряд различных химических соединений непредельные углеводороды, спирты, кислоты, эфиры, альдегиды—продукты, играющие огромную роль как для изготовления предметов бытового потребления, так и для развития современной техники. Так, содержащийся в газах крекинга этилен при взаимодействии с хлором образует дихлорэтан, являющийся исходным сырьем для получения поливинилхлорида. Гидратацией этилена под действием катализаторов получается синтетический этиловый спирт, являющийся важным исходным сырьем для ряда химических процессов. Эта реакция, открытая А. М. Бутлеровым и В. Горяйновым, сохранила важное техническое значение и до настоящего времени. [c.69]
При обработке ацетилгликозилбромида (I) цинком и уксусной кислотой образуется непредельное соединение (II), которое называется гликалем (соответственно глюкаль, галакталь, арабиналь и т. д.). Последний при гидратации в присутствии серной кислоты дает 2-дезокси-сахар, а при обработке спиртовым раствором хлористого водорода — гликозид соответствующего 2-дезоксисахара. Этот метод является наиболее удобным и часто применимым, но, естественно, годится только для синтеза 2-дезоксисахаров. [c.118]
В настоящее время катализ с участием кислот и основавта широко используется в многотоннажвом промышленном органическом синтезе и нефтехимии. Это, в первую очередь, относится л процессам алкилирования изопарафиновых и ароматических углеводородов олефинами, полимеризации (олигомеризации) непредельных соединений, галогенирования, сульфатирования, сульфирования и нитрования, конденсации по карбонильной группе, этерификации, гидратации и дегидратации. [c.384]
В технике многие спирты получают гидратацией соответствующих непредельных углеводоров (алкенов) серной кислотой. [c.103]
Аналогичным образом при гидратации а,р-непредельных лот в организме, которая происходит на одной из стадий про- са р-окисления жирных кислот (см. 14.1.4), образуются идроксикислоты. [c.251]
Гидратация алкинов протекает в присутствии катализаторов — серной кислоты и сульфата ртутн(П) HgSOJ. На первой стадии реакции в результате присоединения молекулы воды образуется непредельный спирт, у которого гидроксильная группа находится непосредственно у атома углерода при двойной связи. Такие спирты принято называть виниловыми. [c.100]
Требования, предъявляемые к чистоте олефинов определяются процессами, в которых эти полупродукты применяются. Например, для сернокислотной гидратации этилена и пропилена можно применять этан-этиленовую и проиан-пропиленовую фракцию с широким интервалом концентраций в них олефинов. В этом случае необходимо лишь освободиться от более тяжелых непредельных углеводородов, которые в процессе абсорбции серной кислотой полимеризуются, и тем самым осложняют процесс и ухудшают качество целевого продукта. При прямой гидратации этилена, вследствие небольшой конверсии за проход и рециркуляции основной массы этилена, необходимо максимально уменьшить содержание инертных примесей (этана и др.). Поэтому при прямой гидратации в систему свежий этилен подают с концентрацией не менее 95% и при этом часть возвратного этилена направляют на ректификацию и концентрирование. В этилене, идущем на прямую гидратацию лимитируется содержание ацетилена, который в процессе превращается в ацетальдегид. Ацеталь-дегид же образует в результате поликонденсации полимеры, снижающие активность катализаторов. [c.81]
Химия углеводородов за последние десятилетия претерпела значительную эволюцию. Два основных результата этой эволюции должны быть отмечены в первую очередь установление прямых путей перехода от углеводородов разных классов к соединениям иного химического характера и отыскание новых реакций, непосредственно связываюпщх различные группы углеводородов друг с другом. Превращения первого рода касаются главным образом непредельных и лишь отчасти предельных углеводородов к ним следует отнести такие реакции, как гидратация олефинов с образованием спиртов, получение ацет-альдегида и уксусной кислоты из ацетилена, получение хлористого аллила и глицерина из пропилена, окиси этилена из этилена, нитропарафинов прямым нитрованием парафиновых углеводородов, синтез многочисленных галоидопроизводных, простых и сложных эфиров, альдегидов, кетонов, аминов и других органических соединений на основе непредельных углеводородов. Многие из этих реакций получили в настоящее время промышленное оформление и составляют новую отрасль химической промышленности — промышленность соединений алифатического ряда. [c.3]
Аналогичное явление наблюдается при реакциях окисления непредельных углеводородов и спиртов, протекающих аномально в присутствии серной кислоты вследствие дегидратирующих и гидратирующих свойств последней. Так, например, А. М. Бутлеров показал, что при окислении триметилкарбинола двухромовокислым калием в присутствии разбавленной серной кислоты образуется некоторое количество изомасляной кислоты [33]. Для объяснения этого наблюдения Бутлеров предположил, что в условиях реакции третичный спирт за счет дегидратации, а затем гидратации частично превращается в первичный, который затем окисляется до кислоты [c.513]
Что гидратация такого типа спиртов в сильно кислой среде возможна, указывает тот факт, что при взаимодействии диме-тилциклопропилкарбинола [24] с муравьиной кислотой (1 1) и метилэтилциклопропилкарбинола [25] с муравьиной кислотой (1 2) из продуктов реакции были выделены, кроме соответствующих непредельных спиртов и их эфиров, отвечающие им гликоли. В обоих случаях реакция идет по следующей схеме [c.158]
chem21.info