Что такое кремний, и почему из него делают компьютерные чипы?

Это может показаться глупым вопросом, на который можно ответить одним предложением: кремний – 14 элемент в периодической таблице. Тем не менее, кремний чаще других упоминается на сайтах, посвященных электронике, потому что он не только главный компонент большинства строительных материалов, но и основа для современных компьютерных процессоров, и даже наиболее вероятный кандидат на роль базисного элемента «неуглеродной жизни» Что же делает кремний особенным?
Кремний как строительный материал
После кислорода кремний наиболее распространенный в земной коре элемент, но найти его не так уж и просто, ведь он почти никогда не встречается в чистом виде. Наиболее часто в природе встречается силикат SiO4 или диоксид кремния SiO2. Кремний это также основной компонент песка. Полевой шпат, гранит, кварц – все они основаны на соединении кремния и кислорода.

Соединения кремния имеют широкий спектр полезных свойств, в основном потому, что они могут очень плотно связывать другие атомы в сложных конструкциях. Различные силикаты, такие как силикат кальция, являются основным компонентом цемента, главным связующим бетона и даже штукатурки. Некоторые силикатные материалы используются в керамике, и, конечно, стекле. Кроме того, кремний добавляют в такие субстанции как чугун, чтобы сплав был более прочным.
И, да, кремний также является основным структурным компонентом синтетического материала силикона, из-за чего силикон (silicone) часто путают с кремнием (silicon). Известным примером является Силиконовая долина, которая на самом деле кремниевая.
Кремний как компьютерный чип
При выборе материала для основы компьютерных транзисторов ключевым фактором являлось сопротивление. Проводники имеют низкое сопротивление и проводят ток очень легко, в то время как изоляторы блокируют ток благодаря высокому сопротивлению. Транзистор же должен сочетать в себе оба свойства.
Кремний не единственное полупроводниковое вещество на Земле – он даже не лучший полупроводник. Тем не менее, он широко доступен. Его не сложно добывать и с ним легко работать. И самое главное, ученые нашли надежный способ выводить из него упорядоченные кристаллы. Для кремния эти кристаллы являются тем же, чем бриллиант для алмаза.

Построение идеальных кристаллов является одним из основных аспектов производства компьютерных чипов. Эти кристаллы затем нарезаются в тонкие пластины, гравируются, обрабатываются и проходят сотни обработок, прежде чем становятся коммерческими процессорами. Реально сделать более совершенные транзисторы из углерода или таких экзотических материалов как германий, но ни один из них не позволит воссоздать столь масштабное производство – по крайней мере, пока.
Кремний как внеземная жизни
Фраза «углеродная жизнь» упоминается довольно часто, но что она значит? Это означает, что основные структурные молекулы нашего тела (белки, аминокислоты, нуклеиновые кислоты, жирные кислоты и другое) строятся на основе атомов углерода. Так происходит потому, что углерод может быть четырехвалентным. Кислород может сформировать две устойчивые химические связи одновременно, азот только три, но углерод может удерживать до четырех разных атомов сразу. Это является мощной основой для построения молекул и развития жизни.
Так как периодическая таблица упорядочена так, что элементы в вертикальном столбце имеют схожие химические свойства – и прямо под углеродом находится кремний. Вот почему так много теоретиков уделяют внимание «кремниевой жизни», одним из доводов в их пользу является тот факт, что кремний также четырехвалентный.
Конечно, учитывая, что кремния на Земле гораздо больше, чем углерода, должна быть веская причина, почему органическая жизнь строится на основе углерода. И тут нужно снова обратиться к периодической таблице. Элементы, которые вертикально находятся ниже, имеют более тяжелые ядра и более крупные электронные оболочки, поэтому кремний из-за своего размера меньше подходит для таких точных задач как построение ДНК. Таким образом, в другой части Вселенной развитие организма на основе кремния теоретически возможно, но на нашей планете это вряд ли случится.
vido.com.ua
это камень, наделенный особыми свойствами. Использование кремня
Не один миллион лет длился период в истории человечества, называемый каменным веком. Все это время помогал людям выживать кремень. Это камень, обладающий уникальным свойством давать искру, чем и воспользовался человек, создав из него первые орудия по добыче огня – кресало, огниво, трут.
Описание
Окрас этого природного камня зависит от примесей, содержащихся в нем. Вариантов расцветки довольно много – от желтовато-белого до темно-коричневого и даже черного.  При этом кремень не всегда однотонный, встречаются камни полосатые, рисунчатые. В зависимости от состава, а соответственно и от того, как выглядит кремень, различают 4 группы: кварц кремнистый, кварц халцедоновый, опал халцедоновый, опаловый. Этот камень имеет очень высокие показатели прочности (до 7 единиц по шкале Мооса). Его свойство искрить при ударе кусочков друг о друга древние люди использовали с целью добычи огня. Острые осколки кремня шли на изготовление топоров, ножей и наконечников для стрел.
При этом кремень не всегда однотонный, встречаются камни полосатые, рисунчатые. В зависимости от состава, а соответственно и от того, как выглядит кремень, различают 4 группы: кварц кремнистый, кварц халцедоновый, опал халцедоновый, опаловый. Этот камень имеет очень высокие показатели прочности (до 7 единиц по шкале Мооса). Его свойство искрить при ударе кусочков друг о друга древние люди использовали с целью добычи огня. Острые осколки кремня шли на изготовление топоров, ножей и наконечников для стрел.
Месторождение кремня
Этот вид камней не относится к категории редких и встречается практически во всех уголках планеты. Самым древним месторождением считается остров Рюген неподалеку от Германии. Добывают кремень и в России – в Подмосковье, Тверской и Белгородской областях.  Известны месторождения, где находят очень необычной расцветки кремень – это в основном на юге Казахстана. Там можно встретить камни розовой, сиреневой и ярко-красной окраски.
Известны месторождения, где находят очень необычной расцветки кремень – это в основном на юге Казахстана. Там можно встретить камни розовой, сиреневой и ярко-красной окраски.
Лечебные свойства кремня
Замечено, что этот камень очень благотворно воздействует на организм человека. Особенно эффективно его применение в области психотерапии. Используют кремний и для скорейшего заживления переломов, ушибов, лечения кожных заболеваний.
Но наиболее известен в лечебной практике водный раствор кремния. Считается, что он способен излечить от многих болезней. Кремень – это камень, который способен изменять энергетическую структуру воды, передавая ей часть своей энергии, и делать ее стерильной. Такая вода обладает антисептическими и противомикробными свойствами. Ее рекомендуется пить при переломах, заболеваниях пищеварительной системы, с целью профилактики и лечения различных инфекционных болезней и в качестве кровоостанавливающего средства. Особенно этими свойствами отличается черный кремень, в котором содержится незначительное количество органических веществ.
Магические свойства
Считается, что кремень – это минерал, способный наделить человека уверенностью и силой. С его помощью даже меланхоличные и ленивые люди становятся более активными и решительными в своих действиях. Камень может повлиять на стремление человека к познанию себя и самосовершенствованию.
Имеет немаловажное значение то, на какой части тела будет находиться амулет из кремня. Кулон на шее способствует проявлению лидерских качеств, уверенности в собственных силах, и наделяет способностью вести за собой людей. Если там, где сердце, то есть на левой стороне тела располагается кремень, окружающий мир будет получать от обладателя камня любовь, заботу и внимание.
Издавна считается, что кремень покровительствует путешественникам, оберегая их в пути и защищая от напастей, трудностей и обмана. Собирая всю отрицательную энергетику и переводя ее в положительную, этот камень может выполнять функцию хранителя дома.
Украшения из кремня
Некоторые виды кремня имеют настолько удивительную окраску, что их используют в качестве украшений. Многим из них даже присвоены имена (опал, яшма, халцедон). Рисунчатые камни зачастую идут на изготовление пуговиц, подвесок и запонок.  Более крупные экземпляры применяют для вытачивания ваз, шкатулок и подсвечников. Как выглядит кремень в качестве украшения интерьера, можно увидеть в некоторых общественных зданиях, залах торжественных заседаний и на станциях метро, стены которых отделаны этим минералом. Натуральной кремневой плиткой выложен пол Благовещенского храма Московского Кремля перед алтарем.
Более крупные экземпляры применяют для вытачивания ваз, шкатулок и подсвечников. Как выглядит кремень в качестве украшения интерьера, можно увидеть в некоторых общественных зданиях, залах торжественных заседаний и на станциях метро, стены которых отделаны этим минералом. Натуральной кремневой плиткой выложен пол Благовещенского храма Московского Кремля перед алтарем.
Кремень в промышленности
Высокая прочность этого камня широко используется в строительстве и промышленности. Особенно популярен он в абразивном производстве. Шлифовальные шкурки, изготовленные с применением кремня, могут долго сохранять поверхность в рабочем состоянии, не подвергаясь засорению. И при строительстве дорог также используется этот камень. Гранит, кремень, известняк – все эти простейшие камни встречаются вокруг настолько часто, что мы уже привыкли их просто не замечать.
fb.ru
Как найти кремний в природе
КАК ПОДДЕРЖАТЬ УРОВЕНЬ И СОДЕРЖАНИЕ КРЕМНИЯ В ОРГАНИЗМЕ?
Очень хорошим подспорьем для каждого будет кремниевая вода, приготовленная просто методом обычного настаивания на природном материале.
Собрать более мелкие камни, чтобы поверхность соприкосновения кремния с водой была возможно большей.
Воду постоянно сливают и используют для клизмы. Нижний слой воды 3-4 см выбрасывают. Обычно настаивание длится 2-3 дня. Настаивать кремниевую воду можно при комнатной температуре. Лучше всего в эмалированной посуде с крышкой. Для приготовления пищи и промывной воды для клизмы настаивают воду 2 дня. Для лечения 5-7 дней.
Каждый раз после сливания воды ведро и кремний промывайте проточной водой.
Черный камень практически нерасходуемый природный материал. Он будет «работать», не требуя замены, отдыха и регенерации для вас, и ваших детей.
«Черный сланец»
Это черные листы кремня, полученные при расслоении скальной породы. Происхождение органогенное. При минералогическом исследовании установлен высокий процент содержания кремния около 50 %. При настаивании в течение суток черный сланец дает высокий процент перехода окислов кремния в воду, выше, чем любая известная минеральная вода. Кремниевую воду можно использовать для питья, приготовления пищи, умывания, компрессов, полоскания горла и т. д.
Потребление кремниевой воды зависит от потребности каждого человека.
Кремниевую воду обязательно сливайте с камешков и только тогда используйте для приготовления пищи.
Камни не кипятите. Все свои целебные для человека качества кремниевая вода сохраняет неопределенно долго. Хранить ее лучше всего при комнатной температуре в закрытой посуде. Водные растворы целебных трав и сборов на кремниевой воде значительно более эффективны, чем на обычной водопроводной.
Кремниевую воду применяют при домашнем консервировании с целью улучшения качества продуктов.
Срезанные цветы и зелень дольше сохраняют свежесть в кремниевой воде.
КАК НАЙТИ КРЕМНИЙ (SI) В ПРИРОДЕ
Чтобы не ошибиться в выборе, проверьте его, ударив стальным предметом как бы вскользь. Если искры сыплются, значит, кремень.
Из более чем семисот его разновидностей для лечения годится только опалово-халцедоновый. Если его расколоть, внутренняя сторона будет темно-серой или черной (из-за магния), матовой. Можно взять и красновато-черный камень, в котором есть железо.
Эту информацию нам прислал В.Кирсанов
Как найти кремний в природе
Отыскать кремень в природе легко. Его очень много среди морской или речной гальки. А чтобы не ошибиться в выборе, проверьте его, ударив стальным предметом как бы вскользь. Если искры сыплются, значит, кремень. Из более чем семисот его разновидностей для лечения годится только опалово–халцедоновый. Если его расколоть, внутренняя сторона будет темно–серой или черной (из–за магния), матовой. Можно взять и красновато–черный камень, в котором есть железо.
Кремневая вода сочетает в себе вкус и свежесть родниковой, чистоту и структуру талой и бактерицидные свойства серебряной воды.
Если рядом с постелью больного поставить емкость с водой, в которой лежит кремень, воздух станет чище и здоровее.
Кремний – темносерое, блестящее кристаллическое вещество, хрупкое и очень твердое, кристаллизуется в решетке алмаза. Это типичный полупроводник (проводит электричество лучше, чем изолятор типа каучука, и хуже проводника – меди). При высокой температуре кремний весьма реакционноспособен и взаимодействует с большинством элементов, образуя силициды, например силицид магния Mg2Si, и другие соединения, например SiO2 (диоксид кремния), SiF4(тетрафторид кремния) и SiC (карбид кремния, карборунд). Кремний растворяется в горячем растворе щелочи с выделением водорода: Si + NaOH ® Na4SiO4 + 2H2.
www.o8ode.ru
свойства, характеристика, формула. История открытия кремния
Многие современные технологические устройства и аппараты были созданы за счет уникальных свойств веществ, находящихся в природе. Человечество экспериментальным путем и тщательным изучением окружающих нас элементов постоянно модернизирует собственные изобретения — данный процесс называется техническим прогрессом. Он основан на элементарных, доступных каждому вещах, которые окружают нас в повседневной жизни. Например, песок: что может быть в нем удивительного и необычного? Ученые смогли выделить из него кремний – химический элемент, без которого не существовало бы компьютерной техники. Область его применения отличается разнообразием и постоянно расширяется. Это достигается за счет уникального свойства атома кремния, его структуры и возможности соединений с другими простыми веществами.

Характеристика
В периодической системе, разработанной Д. И. Менделеевым, кремний (химический элемент) обозначен символом Si. Относится к неметаллам, располагается в главной четвертой группе третьего периода, имеет атомный номер 14. Его соседство с углеродом не является случайным: во многом их свойства сопоставимы. В природе не встречается в чистом виде, так как является активным элементом и имеет достаточно прочные связи с кислородом. Основное вещество — кремнезем, который является оксидом, и силикаты (песок). При этом кремний (его природные соединения) является одним из наиболее распространенных химических элементов на Земле. По массовой доле содержания он занимает второе место после кислорода (более 28 %). Верхний слой земной коры содержит кремний в виде диоксида (это кварц), различные типы глин и песка. Вторую по распространенности группу составляют его силикаты. На глубине около 35 км от поверхности расположены слои гранита и базальтовые отложения, в состав которых входят кремневые соединения. Процент содержания в земном ядре пока не просчитан, но ближайшие к поверхности слои мантии (до 900 км) содержат силикаты. В составе морской воды концентрация кремния составляет 3 мг/л, лунный грунт на 40 % состоит из его соединений. Просторы космоса, которые человечество на сегодняшний день изучило, содержат этот химический элемент в больших количествах. Например, спектральный анализ метеоритов, которые приближались к Земле на расстояние, доступное исследователям, показал, что они состоят на 20 % из кремния. Существует вероятность формирования жизни на основе этого элемента в нашей галактике.

Исследовательский процесс
История открытия химического элемента кремния имеет несколько этапов. Многие вещества, систематизированные Менделеевым, использовались человечеством на протяжении веков. При этом элементы находились в природном виде, т .е. в соединениях, которые не подвергались химической обработке, и все их свойства не были известны людям. В процессе изучения всех особенностей вещества у него появлялись новые направления использования. Свойства кремния на сегодняшний день не изучены до конца — этот элемент при достаточно широком и разнообразном спектре применения оставляет простор для новых открытий будущим поколениям ученых. Современные технологии значительно ускорят данный процесс. В XIX веке многие знаменитые химики пытались получить кремний в чистом виде. Впервые это удалось сделать Л. Тенару и Ж. Гей-Люссаку в 1811 году, но открытие элемента принадлежит Й. Берцелиусу, который смог не только выделить вещество, но и описать его. Химик из Швеции получил кремний в 1823 году, для этого он использовал металлический калий и калиевую соль. Реакция происходила при катализаторе в виде высокой температуры. Полученное простое вещество серо-бурого цвета являло собой аморфный кремний. Кристаллический чистый элемент был получен в 1855 году Сент-Клер Девилем. Сложность выделения напрямую связана с высокой прочностью атомных связей. В обоих случаях химическая реакция направлена на процесс очищения от примесей, при этом аморфная и кристаллическая модели имеют разные свойства.

Кремний: произношение химического элемента
Первое название полученного порошка — кизель — было предложено Берцелиусом. В Великобритании и США кремний и по сей день называют не иначе, как силиций (Silicium) или силикон (Silicon). Термин происходит от латинского «кремень» (или «камень»), и в большинстве случаев его привязывают к понятию «земля» за счет широкого распространения в природе. Русское произношение данного химического вещества бывает разное, все зависит от источника. Его называли кремнеземом (Захаров применял такой термин в 1810 г.), сицилием (1824 год, Двигубский, Соловьев), кремнеземнием (1825 год, Страхов), и только в 1834 году российский химик Герман Иванович Гесс вводит наименование, которое до сегодняшнего момента используется в большинстве источников — кремний. В периодической системе Менделеева он обозначен символом Si. Как читается химический элемент кремний? Многие ученые англоязычных стран произносят его наименование как «си» или употребляют слово «силикон». Отсюда происходит известное на весь мир название долины, которая является научно-исследовательской и производственной площадкой компьютерной техники. Русскоязычное население называет элемент кремнием (от древнегреческого слова «утес, гора»).
Нахождение в природе: месторождения
Целые горные системы сложены из соединений кремния, который в чистом виде не встречается, ведь все известные минералы являются диоксидами или силикатами (алюмосиликатами). Удивительные по красоте камни используются людьми в качестве поделочного материала — это опалы, аметисты, кварцы различных типов, яшма, халцедон, агат, горный хрусталь, сердолик и многие другие. Образовались они благодаря вхождению в состав кремния различных веществ, которые определили их плотность, структуру, цвет и направление использования. Весь неорганический мир можно связать с этим химическим элементом, который в природной среде образует прочные связи с металлами и не металлами (цинк, магний, кальций, марганец, титан и т. д.). По сравнению с другими веществами, кремний достаточно легкодоступен для добычи в производственных масштабах: он содержится в большинстве видов руды и минералов. Поэтому активно разрабатываемые месторождения привязываются скорее к доступным источникам энергии, чем к территориальным скоплениям вещества. Кварциты и кварцевые пески есть во всех странах мира. Наиболее крупными производителями и поставщиками кремния являются: Китай, Норвегия, Франция, США (Западная Вирджиния, Огайо, Алабама, Нью-Йорк), Австралия, ЮАР, Канада, Бразилия. Все изготовители используют различные способы, которые зависят от вида выпускаемой продукции (технический, полупроводниковый, высокочастотный кремний). Химический элемент, дополнительно обогащенный или, наоборот, очищенный от всех видов примесей, имеет индивидуальные свойства, от которых зависит его дальнейшее использование. Это относится и к данному веществу. Строение кремния определяет сферу его применения.

История использования
Очень часто из-за схожести наименований люди путают кремний и кремень, однако понятия эти не тождественны. Внесем ясность. Как уже упоминалось, в природе кремний в чистом виде не встречается, чего нельзя сказать о его соединениях (тот же кремнезем). Основные минералы и горные породы, образуемые диоксидом рассматриваемого нами вещества — это песок (речной и кварцевый), кварц и кварциты, полевые шпаты и кремень. О последнем слышали, должно быть, все, ведь ему придается большое значение в истории развития человечества. С данным камнем связывают первые орудия труда, созданные людьми в период каменного века. Его острые грани, образующиеся при откалывании от основной породы, значительно облегчали труд древних домохозяек, а возможность заострения – охотников и рыболовов. Кремень не обладал прочностью металлических изделий, но вышедшие из строя инструменты было легко заменить новыми. Его использование в качестве огнива продолжалось многие века — вплоть до изобретения альтернативных источников.
Что касается современных реалий, свойства кремния позволяют эксплуатировать вещество для отделки помещений или создания керамической посуды, при этом, помимо прекрасного эстетичного вида, он имеет множество отличных функциональных качеств. Отдельное направление его применения связано с изобретением стекла около 3000 лет назад. Это событие дало возможность создавать зеркала, посуду, мозаичные витражи из соединений, содержащих кремний. Формула начального вещества дополнялась необходимыми составляющими, что позволяло придавать изделию требуемый цвет и влияло на прочность стекла. Удивительные по красоте и разнообразию произведения искусства были сделаны человеком из минералов и камней, содержащих кремний. Целебные свойства этого элемента были описаны учеными древности и применялись на протяжении всей истории человечества. Им выкладывали колодцы для питьевой воды, кладовые для хранения продуктов, использовали как в быту, так и в медицине. Порошок, полученный в результате измельчения, прикладывали к ранам. Особое внимание уделялось воде, которая настаивалась в посуде, сделанной из соединений, содержащих кремний. Химический элемент взаимодействовал с ее составом, что позволяло уничтожать ряд болезнетворных бактерий и микроорганизмов. И это еще далеко не все отрасли, где рассматриваемое нами вещество весьма и весьма востребовано. Строение кремния обуславливает его многофункциональность.

Свойства
Для более подробного ознакомления с особенностями вещества его необходимо рассмотреть с учетом всех возможных свойств. План характеристики химического элемента кремния включает в себя физические свойства, электрофизические показатели, изучение соединений, реакции и условия их прохождения и т. д. Кремний в кристаллической форме имеет темно-серый с металлическим отливом цвет. Решетка гранецентрированная кубическая имеет сходство с углеродной (алмаз), но за счет большей длины связей не настолько прочная. Пластичным её делает нагревание до 800 оС, в остальных случаях она остается хрупкой. Физические свойства кремния делают это вещество поистине уникальным: он является прозрачным для инфракрасного излучения. Температура плавления — 1410 0С, кипения — 2600 0С, плотность при нормальных условиях — 2330 кг/м3. Теплопроводность непостоянна, для различных образцов она принимается в приблизительном значении 25 0С. Свойства атома кремния позволяют использовать его в качестве полупроводника. Это направление применения наиболее востребовано в современном мире. На величину электропроводности оказывает влияние состав кремния и элементы, находящиеся в соединении с ним. Так, для повышенной электронной проводимости используются сурьма, мышьяк, фосфор, для дырчатой – алюминий, галлий, бор, индий. При создании приборов с кремнием в качестве проводника применяется поверхностная обработка определенным агентом, который и оказывает влияние на работу аппарата.
Свойства кремния как отличного проводника используются достаточно широко в современном приборостроении. Особенно актуально его применение при производстве сложной техники (например, современные вычислительные устройства, компьютеры).
Кремний: характеристика химического элемента
В большинстве случаев кремний четырехвалентен, также встречаются связи, в которых он может иметь значение +2. При нормальных условиях он малоактивен, имеет прочные соединения, при комнатной температуре может вступить в реакцию только со фтором, находящимся в газообразном агрегатном состоянии. Это объясняется эффектом блокирования поверхности диоксидной пленкой, который наблюдается при взаимодействии с окружающим кислородом или водой. Для стимуляции реакций необходимо применять катализатор: повышение температуры идеально подходит для такого вещества, как кремний. Химический элемент взаимодействует с кислородом при 400-500 0С, в результате диоксидная пленка увеличивается, идет процесс окисления. При повышении температуры до 50 0С наблюдается реакция с бромом, хлором, йодом, в результате чего образуются летучие тетрагалогениды. С кислотами кремний не взаимодействует, исключение составляет смесь фтористоводородной и азотной, при этом любая щелочь в нагретом состоянии является растворителем. Кремневодороды образуются только путем разложения силицидов, в реакцию с водородом он не вступает. Наибольшей прочностью и химической пассивностью отличаются соединения с бором и углеродом. Высокую стойкость по отношению к щелочам и кислотам имеет соединение с азотом, которое происходит при температуре свыше 1000 0С. Силициды получаются при реакции с металлами, и в этом случае от дополнительного элемента зависит валентность, которую показывает кремний. Формула вещества, образованного при участии переходного металла, является стойкой к воздействию кислот. Строение атома кремния напрямую влияет на его свойства и способность взаимодействовать с другими элементами. Процесс образования связей в природе и при воздействиях на вещество (в лабораторных, промышленных условиях) различается значительно. Строение кремния предполагает его химическую активность.
Строение
Схема строения атома кремния имеет свои особенности. Заряд ядра +14, что соответствует порядковому номеру в периодической системе. Количество заряженных частиц: протонов – 14; электронов – 14; нейтронов – 14. Схема строения атома кремния имеет следующий вид: Si +14) 2) 8) 4. На последнем (внешнем) уровне расположено 4 электрона, что определяет степень окисления со знаком «+» или «-». Оксид кремния имеет формулу SiO2 (валентность 4+), летучее водородное соединение — SiH4 (валентность -4). Большой объем атома кремния позволяет в некоторых соединениях иметь координационное число 6, например, при соединении со фтором. Молярная масса — 28, радиус атома — 132 пм, конфигурация электронной оболочки: 1S22S22P63S23P2.
Применение
Поверхностно или полностью легированный кремний используется в качестве полупроводника при создании многих, в том числе высокоточных, приборов (например, солнечные фотоэлементы, транзисторы, выпрямители тока и т. д.). Сверхчистый кремний применяется для создания солнечных батарей (энергетика). Монокристаллический вид используется для изготовления зеркал и газового лазера. Из соединений кремния получают стекло, керамическую плитку, посуду, фарфор, фаянс. Многообразие получаемых видов товаров описать сложно, их эксплуатация происходит на бытовом уровне, в искусстве и науке, на производстве. Получаемый цемент служит сырьем для создания строительных смесей и кирпича, отделочных материалов. Распространение масел, смазки на основе кремнийорганических соединений позволяет значительно уменьшить силу трения в подвижных частях многих механизмов. Силициды за счет уникальных свойств в области противодействия агрессивным средам (кислотам, температурам) широко применяются в промышленности. Их электрические, ядерные и химические показатели принимают во внимание специалисты на сложных производствах, не последнюю роль играет и строение атома кремния.
Мы перечислили самые наукоемкие и передовые на сегодняшний день сферы применения. Наиболее распространенный, изготавливаемый в больших объемах технический кремний используется по целому ряду направлений:
- В качестве сырья для производства более чистого вещества.
- Для легирования сплавов в металлургической промышленности: наличие кремния увеличивает тугоплавкость, повышает устойчивость к коррозии и механическую прочность (при избытке данного элемента сплав может оказаться слишком хрупким).
- В качестве раскислителя для удаления лишнего кислорода из металла.
- Сырье для производства силанов (соединений кремния с органическими веществами).
- Для производства водорода из сплава кремния с железом.
- Изготовление солнечных батарей.

Велико значение данного вещества и для нормального функционирования организма человека. Строение кремния, его свойства являются в данном случае определяющими. При этом переизбыток или недостаток его ведет к серьезным заболеваниям.
В организме человека
Медицина достаточно давно использует кремний в качестве бактерицидного и антисептического средства. Но при всей пользе наружного применения данный элемент должен постоянно возобновляться в организме человека. Нормальный уровень его содержания позволит улучшить жизнедеятельность в целом. В случае его недостатка более 70 микроэлементов и витаминов не будут усвоены организмом, что значительно понизит сопротивляемость к целому ряду заболеваний. Наибольшее процентное соотношение кремния наблюдается в костях, коже, сухожилиях. Он играет роль структурного элемента, который поддерживает прочность и придает упругость. Все скелетные твердые ткани формируются за счет его соединений. В результате последних исследований обнаружено содержание кремния в почках, поджелудочной железе и соединительных тканях. Роль данных органов в функционировании организма достаточно велика, поэтому снижение его содержания губительно отразится на многих основных показателях жизнеобеспечения. В сутки с пищей и водой организм должен получать 1 грамм кремния — это поможет избежать возможных болезней, таких как воспалительные процессы кожного покрова, размягчение костей, образование камней в печени, почках, ухудшение зрения, состояния волос и ногтей, атеросклероз. При достаточном уровне содержания данного элемента повышается иммунитет, нормализуются обменные процессы, улучшается усвоение многих элементов, необходимых для здоровья человека. Наибольшее количество кремния — в злаковых культурах, редисе, гречневой крупе. Значительную пользу принесет кремниевая вода. Для определения количества и частоты ее использования лучше проконсультироваться со специалистом.
fb.ru
Кремний — Традиция
| Кремний (Si) | |
|---|---|
Атомный номер \(~14\)
слегка блестящий порошок. | |
| Свойства атома | |
| Атомная масса (молярная масса) | 28,0855 а. е. м. (г/моль) |
| Радиус атома | 132 пм |
| Энергия ионизации (первый электрон) | 786,0(8,15) кДж/моль (эВ) |
| Электронная конфигурация | [Ne] 3s2 3p2 |
| Химические свойстваa | |
| Ковалентный радиус | 111 пм |
| Радиус иона | 42(+4e)271(-4e)[[ пм |
| Электроотрицательность (по Полингу) | 1,90 |
| Электродный потенциал | 0 |
| Степени окисления | +4, −4, +2 |
| Термодинамические свойства простого вещества | |
| Плотность | 2,33 г/см³ |
| Удельная теплоёмкость | 19,8 Дж/(K·моль) |
| Теплопроводность | 149 Вт/(м·K) |
| Температура плавления | 1688 K |
| Теплота плавления | 50,6 кДж/моль |
| Температура кипения | 2623K |
| Теплота испарения | 383 кДж/моль |
| Молярный объём | 12,1 см³/моль |
| Кристаллическая решётка | |
| Структура решётки | алмаз |
| Период решётки | 5,430 Å |
| Отношение c/a | n/a |
| Подвижность электронов | 0,15 м²/в·с. |
| Температура Дебая | 625,00 K |
Кре́мний (греч. Kremnos — «утёс, гора») — химический элемент с атомным номером \(~14\) в периодической системе, обозначается символом \(~Si\) (лат. Silicium), металл.
В чистом виде был выделен в 1811 году французскими учеными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром. В 1825 году шведский химик Йёнс Якоб Берцелиус действием металлического калия на фтористый кремний SiF4 получил чистый элементарный кремний. Новому элементу было дано название «силиций» (от лат. silex — кремень). Русское название «кремний» введено в 1834 году российским химиком Германом Ивановичем Гессом.
Нахождение в природе[править]
По распространённости в земной коре кремний среди всех элементов занимает второе место (после кислорода). Масса земной коры на 27,6—29,5 % состоит из кремния. Кремний входит в состав нескольких сотен различных природных силикатов и алюмосиликатов. Больше всего распространен кремнезём — многочисленные формы диоксида кремния (IV) SiO2 (речной песок, кварц, кремень и др.), составляющий около 12 % земной коры (по массе). В свободном виде кремний в природе не встречается, хотя одна четвертая земли состоит из кремния.
В промышленности кремний получают, восстанавливая расплав SiO2коксом при температуре около 1800 °C в дуговых печах. Чистота полученного таким образом кремния составляет около 99,9 %. Так как для практического использования нужен кремний более высокой чистоты, полученный кремний хлорируют. Образуются соединения состава SiCl4 и SiCl3H. Эти хлориды далее очищают различными способами от примесей и на заключительном этапе восстанавливают чистым водородом. Возможна также очистка кремния за счет предварительного получения силицида магния Mg2Si. Далее из силицида магния с помощью соляной или уксусной кислот получают летучий моносилан SiH4. Моносилан очищают далее ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000 °C. Содержание примесей в получаемом этими методами кремнии снижается до 10 -8-10-6% по массе.
Способ получения кремния в чистом виде разработан Николаем Николаевичем Бекетовым. Крупнейшим производителем кремния в России является ОК Русал[1] — кремний производится на заводах в г. Каменск-Уральский (Свердловская область) и г. Шелехов (Иркутская область).
Физические свойства[править]
Кристаллическая структура кремния.Кристаллическая решетка кремния кубическая гранецентрированная типа алмаза, параметр а = 0,54307 нм (при высоких давлениях получены и другие полиморфные модификации кремния), но из-за большей длины связи между атомами Si—Si по сравнению с длиной связи С—С твердость кремния значительно меньше, чем алмаза. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом. Интересно, что кремний прозрачен к инфракрасному излучению начиная с длинны волны 1.1 микрометр. Обладая самым высоким коэффициетом преломления (n = 3,4), прозрачностью, пропусканию инфракрасеых лучей он нашёл широкое применение в изготовлении оптических систем (объективов, биноклей ночного видения, в медицине — контактных линз и т.д.)
Электрофизические свойства[править]
Элементарный кремний — типичный непрямозонный полупроводник. Ширина запрещенной зоны при комнатной температуре 1,12 эВ, а при Т = 0 К составляет 1,21 эВ [2]. Концентрация носителей заряда в кремнии с собственной проводимостью при комнатной температуре 1,5·1016м-3. На электрофизические свойства кристаллического кремния большое влияние оказывают содержащиеся в нем микропримеси. Для получения монокристаллов кремния с дырочной проводимостью в кремний вводят добавки элементов III-й группы — бора, алюминия, галлия и индия, с электронной проводимостью — добавки элементов V-й группы — фосфора, мышьяка или сурьмы. Электрические свойства кремния можно варьировать, изменяя условия обработки монокристаллов, в частности, обрабатывая поверхность кремния различными химическими агентами.
Подвижность электронов 0,15 м²/в·с (или 1500 cм²/в·с ).[3]
Химические свойства[править]
Схема атома кремнияВ соединениях кремний склонен проявлять степень окисления +4 или −4, так как для атома кремния более характерно состояние sp³-гибридизации орбиталей. Поэтому во всех соединениях, кроме оксида кремния (II) SiO, кремний четырёхвалентен.
Химически кремний малоактивен. При комнатной температуре реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. При нагревании до температуры 400—500°C кремний реагирует с кислородом с образованием диоксида SiO2, с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов SiHal4.
С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой SinH2n+2 — получают косвенным путем. Моносилан SiH4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например:
Ca2Si + 4HCl → 2CaCl2 + SiH4↑.
Образующийся в этой реакции силан SiH4 содержит примесь и других силанов, в частности, дисилана Si2H6 и трисилана Si3H8, в которых имеется цепочка из атомов кремния, связанных между собой одинарными связями (—Si—Si—Si—).
С азотом кремний при температуре около 1000 °C образует нитрид Si3N4, с бором — термически и химически стойкие бориды SiB3, SiB6 и SiB12. Соединение кремния и его ближайшего аналога по таблице Менделеева — углерода — карбид кремния SiС (карборунд) характеризуется высокой твердостью и низкой химической активностью. Карборунд широко используется как абразивный материал.
При нагревании кремния с металлами возникают силициды. Силициды можно подразделить на две группы: ионно-ковалентные (силициды щелочных, щелочноземельных металлов и магния типа Ca2Si, Mg2Si и др.) и металлоподобные (силициды переходных металлов). Силициды активных металлов разлагаются под действием кислот, силициды переходных металлов химически стойки и под действием кислот не разлагаются. Металлоподобные силициды имеют высокие температуры плавления (до 2000 °C). Наиболее часто образуются металлоподобные силициды составов MeSi, Me3Si2, Me2Si3, Me5Si3 и MeSi2. Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
При восстановлении SiO2 кремнием при высоких температурах образуется оксид кремния (II) SiO.
Для кремния характерно образование кремнийорганических соединений, в которых атомы кремния соединены в длинные цепочки за счет мостиковых атомов кислорода —О—, а к каждому атому кремния, кроме двух атомов О, присоединены еще два органических радикала R1 и R2 = CH3, C2H5, C6H5, CH2CH2CF3 и др.
В настоящее время кремний — основной материал для электроники и солнечной энергетики. Монокристаллический кремний — материал для зеркал газовых лазеров. Иногда кремний (технической чистоты) и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях. Соединения металлов с кремнием — силициды, являются широкоупотребляемыми в промышленности (например электронной и атомной) материалами с широким спектром полезных химических, электрических и ядерных свойств (устойчивость к окислению, нейтронам и др.), а также силициды ряда элементов являются важными термоэлектрическими материалами. Кремний применяется в металлургии при выплавке чугуна, сталей, бронз, силумина и др. (как раскислитель и модификатор, а также как легирующий компонент). Соединения кремния служат основой для производства стекла и цемента. Производством стекла и цемента занимается силикатная промышленность. Она также выпускает силикатную керамику — кирпич, фарфор, фаянс, стеклокерамику (ситаллы) и изделия из них.
Ядерная энергетика[править]
Медицина[править]
Оптика[править]
- Линзы контактные
Линзы из органических полимеров дают возможность создавать недорогие асферические линзы с помощью литья. В области офтальмологии созданы мягкие контактные линзы. Их производство основано на применении оптическиих полимерных материалов материалов (ОПМ), имеющих бифазную природу, сочетающих фрагменты кремний-органического или кремний-фторорганического полимера силикона и гидрофильного полимера гидрогеля.
- Линзы из кремния
Линзы из кремния или рентгеновская оптика преломления — линзы, изготовленные из однородного кремния, прозрачные для инфракрасного излучения, рентгеновсого излучения, преломляющие Х-лучи.
В настоящее время нашли применение линзы из кремния. Это связано с современным уровнем технологий обработки твёрдых кристаллов и самое важное, кремний сочетает сверхнизкую! дисперсию с самым большим абсолютным значением коэффициента преломления n=3,4! в диапазоне ИК-излучения; линзы из кремния прозрачны к Х-лучам и способны их преломлять, фокусировать (мягкие и жёсткие Х-лучи), что в последнее время находят широкое применение в микроскопии, телескопии, вытесняя рентгеновскую дорогостоящую оптику с применением зеркал и оптических систем «скользящего» преломления Х-лучей. Они полностью непрозрачны в видимом диапазоне спектра. Кроме этого кремний обладает способностью создавать материалы, имеющих бифазную природу, сочетающих фрагменты кремний-органического или кремний-фторорганического полимера силикона и гидрофильного полимера гидрогеля. Что делает его самым перспективным в изготовлении мягких контактных линз. [5]
Биологическая роль[править]
Для некоторых организмов кремний является важным биогеным элементом. Он входит в состав опорных образований у растений и скелетных — у животных. В больших количествах кремний концентрируют морские организмы — диатомовые водоросли, радиолярии, губки. Большие количества кремния концентрируют хвощи и злаки, в первую очередь — подсемейства Бамбуков и Рисовидных, в том числе — рис посевной. Мышечная ткань человека содержит (1-2)·10-2% кремния, костная ткань — 17·10-4%, кровь — 3,9 мг/л. С пищей в организм человека ежедневно поступает до 1 г кремния.
Соединения кремния относительно нетоксичны. Но очень опасно вдыхание высокодисперсных частиц как силикатов, так и диоксида кремния, образующихся, например, при взрывных работах, при долблении пород в шахтах, при работе пескоструйных аппаратов и т. д. Микрочастицы SiO2, попавшие в лёгкие, кристаллизуются в них, а возникающие кристаллики разрушают лёгочную ткань и вызывают тяжёлую болезнь — силикоз. Чтобы не допустить попадания в лёгкие опасной пыли, следует использовать для защиты органов дыхания респиратор.
- ↑ Р Смит., Полупроводники: Пер. с англ. — М.: Мир, 1982. — 560 с, ил.
- ↑ Зи С., Физика полупроводниковых приборов: В 2-х книгах. Кн. 1. Пер. с англ. — М.: Мир, 1984. — 456 с, ил.
- ↑ http://www.lenta.ru/news/2008/01/22/graphene/
- ↑ В.В.Аристов, Л.Г.Шабельников Успехи физических наук, январь 2008г.,Том178, №1
- ↑ http://www.nsc.ru/HBC/hbc.phtml?15+320+1
traditio.wiki
Кремний в природе (25,8% в Земной коре)
Кремний (Si) — это неметалл, стоящий на 2 месте после кислорода по запасам и нахождению на Земле(25,8% в Земной коре). В чистом виде он практически не встречается, в основном присутствует на планете в виде соединений.
Характеристика кремния
Физические свойства

Кремний – это хрупкий светло-серый материал с металлическим оттенком или порошкообразный материал коричневого цвета. Строение кристалла кремния однотипно с алмазом, но из-за различий в длине связи между атомами твердость алмаза значительно выше.
Кремний – неметалл, доступный для электромагнитного излучения. Благодаря некоторым качествам, он находится в середине между неметаллами и металлами:
• при увеличении температуры до 800 °C становится гибким и пластичным;
• при нагревании до 1417 °С плавится;
• начинает кипеть при температуре свыше 2600 °С;
• меняет плотность при высоком давлении;
• обладает свойством намагничиваться против направления внешнего магнитного поля (диамагнит).
Кремний – полупроводник, и примеси, входящие в его сплавы определяют электрические характеристики будущих соединений.
Химические свойства

При разогревании Si вступает в реакцию с кислородом, бромом, йодом, азотом, хлором и различными металлами. При соединении с углеродом получаются твердые сплавы с термо — и химио — стойкостью.
Кремний никак не воздействует с водородом, поэтому все возможные смеси c ним получают другим путем.
При обычных условиях он слабо реагирует со всеми веществами, кроме газообразного фтора. С ним образуется тетрафторид кремния SiF4. Такая неактивность объясняется тем, что на поверхности неметалла из-за реакции с кислородом, водой, ее парами и воздухом ложится пленка диоксида кремния и окутывает его. Поэтому химическое воздействие замедленно и незначительно.
Для удаления этого слоя используют смесь фтороводородной и азотной кислот или водные растворы щелочей. Некоторые специальные жидкости для этого предусматривают добавление хромового ангидрида и иных веществ.
Нахождение кремния в природе

Содержание Si в литосфере 25,8% по массе. Концентрация в морской воде 3 мг/л. Кремний очень распространен, примерно 12% всей твердой оболочки нашей планеты состоит из кремнезема в форме кварца и его разновидностей.
Кремний для Земли столь же важен как углерод для растений и животных. Ее кора почти наполовину состоит из кислорода, а если добавить к этому кремний, получится 80% массы. Эта связь очень важна для перемещения химических элементов.
75% литосферы содержат различные соли кремневых кислот и минералов (песок, кварциты, кремень, слюды, полевые шпаты и т. д.). Во время образования магмы и разных магматических пород Si накапливается в гранитах и в ультраосновных породах (плутонических и вулканических).
В теле человека 1 г кремния. Большинство содержится в костях, сухожилиях, кожном и волосяном покрове, лимфоузлах, аорте и трахее. Он участвует в процессе роста соединительной и костной тканей, а так же поддерживает эластичность сосудов.
Норма употребления в день для взрослого — 5 – 20 мг. Избыток вызывает силикоз.
Применение кремния в промышленности
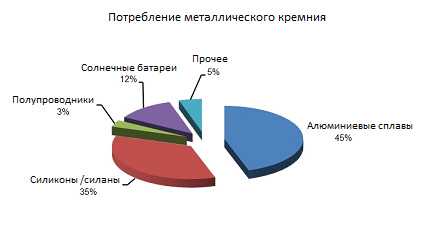
С каменного века этот неметалл известен человеку и широко используется до сих пор.
Применение:
• он хороший восстановитель, поэтому его используют в металлургии для получения металлов.
• в определенных условиях кремний способен проводить электричество, поэтому его применяют в электронике.
• оксид кремния используется в изготовлении стекол и силикатных материалов.
• специальные сплавы используется для производства полупроводниковых приборов.
xn—-8sbiecm6bhdx8i.xn--p1ai
Популярная библиотека химических элементов. Раритетные издания. Наука и техника
Кремний
| 14 | |
Si |
4 8 2 |
| КРЕМНИЙ | |
| 28,086 | |
| 3s23p2 | |
Чем знаменит кремний? Во-первых, этот элемент – второй по распространенности на Земле после кислорода. Масса земной коры более чем на четверть – 27,6% – состоит из кремния.
Во-вторых, этот элемент – ближайший аналог углерода со всеми, как говорится, вытекающими отсюда последствиями.
Очевидно, с этих двух точек зрения и стоит рассматривать кремний – достаточно обыкновенный и достаточно необыкновенный элемент.
Природные соединения
«Показывают мне, – писал в одной из своих популярных книг академик А.Е. Ферсман, – самые разнообразные предметы: прозрачный шар, сверкающий на солнце чистотой холодной ключевой воды, красивый, пестрого рисунка агат, яркой игры многоцветный опал, чистый песок на берегу моря, тонкую, как шелковинка, нитку из плавленого кварца или жароупорную посуду из него, красиво ограненные груды горного хрусталя, таинственный рисунок фантастической яшмы, окаменелое дерево, превращенное в камень, грубо обработанный наконечник стрелы древнего человека… все это одно и то же химическое соединение элементов кремния и кислорода».
Как ни разнообразен этот перечень, он, конечно, не исчерпывает многообразия природных соединений кремния. Начнем, однако, с упомянутых. «Грубо обработанный наконечник стрелы древнего человека» был сработан из кремня. А что такое кремень? Современный человек видел эти наконечники, равно, как и кремневые ружья, разве только в историческом музее. «Кремни», вставляемые в зажигалки курильщиков, ни внешне, ни по составу нимало не похожи на те кремни. Впрочем, многие из нас в детстве высекали искры, ударяя камешком о камешек, и скорее всего, тогда в наших руках были настоящие кремни.
Так что такое кремень? Химик на этот вопрос ответит буквально по Ферсману: двуокись кремния, кремнезем. Возможно, при этом добавит, что кремнезем кремня – аморфный, в отличие от кристаллического кремнезема кварцевого песка и горного хрусталя, и что часть химиков считает кремень кристаллогидратом mSiO2 · nH2O.
Геолог на тот же вопрос ответит иначе, но тоже в общем-то буднично: минеральное образование, распространенное и мало интересное, пласты и «желваки» кремня обычно залегают среди известняков и меловых отложений…
И лишь гуманитарий-историк отзовется, должен отозваться, о кремне восторженно, ибо именно кремень – невзрачный и не очень прочный камень – помог в свое время человеку стать Человеком. Каменный век – век кремневых орудий труда. Причиной тому не только и не столько распространенность и доступность кремня, сколько способность его при сколе образовывать острые режущие кромки.
Обратимся теперь к кристаллическим аналогам кремня: «красиво ограненные груды горного хрусталя», «чистый песок на берегу моря»… Разница между ними небольшая, по существу лишь в размерах и примесях. Чистый песок – чистая кристаллическая двуокись кремния. Чистой воды горный хрусталь – то же самое. И что еще очень важно, оба эти вещества – полимеры, неорганические полимеры.
Одним из первых предположение о полимерном строении двуокиси кремния высказал Дмитрий Иванович Менделеев. Именно этим обстоятельством объяснял он нелетучесть и тугоплавкость веществ состава SiO2 или, правильнее, (SiO2)n. Рентгеноструктурные исследования наших дней подтвердили правильность этой догадки. Установлено, что кристаллический кремнезем представляет собой трехмерный сетчатый полимер. Цепочка кремнекислородных тетраэдров очень прочна, связь кремния с кислородом намного прочнее, чем, например, связь между атомами углерода в цепях органических полимеров. Кремнекислородным цепям хватает и гибкости, но в мире минералов они образуют жесткие сплетения в виде пространственных решеток и сеток, которые хрупки, неподатливы при механической обработке. Чтобы кремнекислородные цепочки остались гибкими, эластичными, их нужно изолировать одну от другой, окружить другими атомами или группами атомов. Это сделали химики, синтезировавшие многочисленные ныне кремнийорганические полимеры, речь о которых ниже. Впрочем, и природа дала великолепный образец волокнистого по структуре полимерного соединения кислорода и кремния – это асбест.
Сегодня очень непросто ответить на детский вопрос, какая из разновидностей кристаллической двуокиси кремния – песок или горный хрусталь – важнее для современного человека. Если брать в расчет только природный горный хрусталь, запасы которого практически исчерпаны, то ответ однозначен: конечно, песок. Из кварцевого песка делают кварцевое стекло, а из него – превосходную лабораторную посуду, баллоны ламп специального назначения и многое другое. Горный же хрусталь – не только поделочный материал, он и пьезоэлектрик. Он нужен радиотехнике в все возрастающих количествах, и вряд ли возможно было бы быстрое развитие этой отрасли, если бы люди не научились выращивать крупнокристаллический искусственный кварц в виде монокристаллов. В 30-х годах Александр Евгеньевич Ферсман писал: «Через несколько десятков лет геологи не будут больше с опасностью для жизни взбираться на вершины Альп, Урала или Кавказа в погоне за кристаллами, не будут добывать их в безводных пустынях Южной Бразилии или в наносах Мадагаскара. Я уверен, что мы будем по телефону заказывать нужные куски кварца на государственном кварцевом заводе». Кварцевые заводы появились даже раньше, чем предсказывал ученый. Они выпускают кристаллы кварца, ничем не уступающие природному горному хрусталю, в количествах, достаточных не только для радиоэлектронной промышленности, не только для оптики, но и для украшений. Сомневающимся в этом утверждении рекомендуем обратиться в ближайший от их дома ювелирный магазин.
Кремний – элементарный
Мы умышленно ограничили рассказ о природных соединениях кремния тремя веществами и одним, по существу, соединением. Обо всем в коротком очерке все равно не расскажешь, а соединения с кислородом – самые важные. Вернемся, однако, собственно к кремнию.
Несмотря на распространенность в природе, этот элемент открыли сравнительно поздно. В 1825 г. выдающийся шведский химик и минералог Йенс Якоб Берцелиус сумел в двух реакциях выделить не очень чистый аморфный кремний в виде коричневого порошка. Для этого он восстановил металлическим калием газообразное вещество, известное ныне как тетрафторид кремния SiF4, и кроме того, провел такую реакцию: K2SiF6 + 4К → 6KF + Si.
Новый элемент был назван силицием (от латинского silex – кремень). Русское название этого элемента появилось спустя девять лет, в 1834 г., и благополучно дожило, в отличие, скажем, от «буротвора», до наших дней.
Кремний, как и углерод, образует различные аллотропические модификации. Кристаллический кремний так же мало похож на аморфный, как алмаз на графит. Это твердое вещество серо-стального цвета с металлическим блеском и гранецентрированной кристаллической решеткой того же типа, что у алмаза. Впрочем, аморфный кремний, как выяснилось, тоже не аморфный, а мелкокристаллический.
Первый промышленный способ производства кремния, изобретенный во второй половине XIX в. известным русским химиком Н.Н. Бекетовым, основан на восстановлении четыреххлористого кремния SiCl4 парообразным цинком. Технически чистый кремний (95…98% Si) сейчас получают главным образом восстановлением кремнезема в электрической дуге между графитовыми электродами. Используется до сих пор изобретенный еще в прошлом веке способ восстановления кремнезема коксом в электрических печах. Этот способ также дает технический кремний, нужный металлургии как раскислитель, связывающий и удаляющий из металла кислород, и как легирующая добавка, повышающая прочность и коррозионную стойкость сталей и многих сплавов на основе цветных металлов. Впрочем, здесь важно, «не переборщить»: избыток кремния может привести к хрупкости.
Не отошел в прошлое и бекетовский способ получения кремния (в реакции между парами цинка и тетрахлоридом кремния – летучей бесцветной жидкостью с температурой кипения всего 57,6°C). Это один из способов получения высокочистого полупроводникового кремния, о котором определенно наслышаны читатели этой книги.
Полагают, что при абсолютном нуле идеально чистый и идеально правильный монокристаллический кремний должен быть идеальным электроизолятором. Но идеальная чистота так же недостижима, как и абсолютный нуль. В нашем случае это, что называется, к добру. Не идеальный, а просто высокочистый и сверхчистый кремний стал важнейшим полупроводниковым материалом. При температуре, отличной от абсолютного нуля, в нем возникает собственная проводимость, причем носителями электрического тока являются не только свободные электроны, но и так называемые дырки – места, покинутые электронами.
Вводя в сверхчистый кремний те или иные легирующие добавки (в микроколичествах; обычно это делается с помощью ионно-лучевых установок), в нем создают проводимость того или иного типа. Добавки элементов третьей группы менделеевской таблицы ведут к созданию дырочной проводимости, а пятой – электронной. Что значат для нас сегодня полупроводники, объяснять, вероятно, излишне. Расскажем лучше вкратце о способах получения полупроводникового кремния.
Один из этих способов упомянут выше. Заметим только, что реакцию высокочистых паров цинка с очень чистым четыреххлористым кремнием проводят при температуре 950°C в трубчатом реакторе, изготовленном из плавленого кварца. Элементарный кремний образуется в виде игольчатых кристаллов, которые потом измельчают и промывают соляной кислотой, разумеется тоже весьма чистой. Затем следует еще одна ступень очистки – зонная плавка, и лишь после нее поликристаллическую кремниевую массу превращают в монокристаллы.
Есть и другие реакции, в которых получают высокочистый полупроводниковый кремний. Это восстановление водородом трихлорсилана SiHCl или четыреххлористого кремния SiCl4 и термическое разложение моносилана, гидрида кремния SiH4 или тетраиодида SiJ4. В последнем случае разложение соединения происходит на разогретой до 1000°C танталовой ленте. Дополнительная очистка зонной плавкой следует после каждой из этих реакций.
В полупроводниковом кремнии содержание примесей крайне мало – 10–5…10–6% и даже меньше.
Кремнийорганика
Первое органическое соединение, содержащее кремний, было получено еще в 1845 г. в реакции этилового спирта с четыреххлористым кремнием: SiCl4 + 4С2Н5OН → Si(OC2Н5)4 + 4HCl. Но это не был первый синтез кремнийорганического соединения в том смысле, какой вкладывает в это понятие современная химическая номенклатура. Кремнийорганическими сейчас признают лишь те соединения, в которых есть связь углерод – кремний. Так что первое кремнийорганическое соединение – тетраэтил-силиций Si(C2H5)4 – было получено лишь в 1863 г.
Конечно, в то время никто не предполагал, что спустя 100 лет кремнийорганика разовьется в самостоятельную и важную ветвь химической науки, что кремнийорганические соединения, особенно полимерные, станут первостепенно важны для многих видов промышленности, для транспорта и строительства, даже для быта.
Опытная хозяйка перед стиркой смажет руки силиконовым кремом, который предохранит их не только от воды, но и от разъедающего действия соды или стирального порошка. Сдавая в чистку платье или костюм, мы охотно доплачиваем за несминаемую складку и за «пропитку», благодаря которой платье будет меньше грязниться. И в том и в другом случае нашу одежду на фабрике химической чистки обработают Кремнийорганическими жидкостями…
Этот же раздел химической науки подарил нам самые теплостойкие и в то же время самые морозостойкие синтетические каучуки. Температурный интервал работоспособности кремнийорганических каучуков от –80 до +260°C, и эти каучуки уже давно существуют не в виде экзотических лабораторных образцов, а в виде массовой промышленной продукции.
Для современной электротехники очень важны кремнийорганические лаки, представляющие собой растворы кремнийорганических полимеров. Они обладают отличными электроизоляционными свойствами, устойчивы к атмосферным воздействиям, перепадам температур, солнечной радиации. Вот лишь один пример эффективности подобных материалов в технике. До внедрения кремнийорганических лаков изоляция электродвигателя врубовой машины в условиях шахты служила в среднем 5 месяцев. Когда в качестве изоляции стали применять кремнийорганический лак, срок службы двигателя до первого ремонта вырос до 3 лет.
Подобных примеров можно привести десятки, и число их будет множиться с каждым годом: появляются новые вещества, в состав которых наряду с кремнием и традиционными элементами органического мира входят алюминий, титан и другие металлы. Каждый привносит в молекулу что-то свое, и на каком-то этапе количество переходит в качество.
Многие известные ученые работали и продолжают работать в этой области химии. Советскую школу кремний-органиков возглавляет академик К.А. Андрианов, который еще в 1937 г. получил первые в мире кремнийорганические полимеры – полиорганосилоксаны.
Кремний и жизнь
В обзорной статье о кремнии, написанной еще лет десять назад, такой раздел был бы необязателен. Слишком мало знала наука о роли кремния в жизни высших животных и человека. Известно было, что кремний (его двуокись) составляет основу скелетов у некоторых морских организмов – радиолярий, диатомей, некоторых губок, морских звезд. Известно также, что он нужен растениям: от злаков и осоки до пальм и бамбука. Чем жестче стебель растения, тем больше в его золе находят кремния. Растения, как и морские животные, берут кремний из воды. И в пресной, и в соленой воде растворено около 3 мг/л кремния (в виде кремниевых кислот и их солей). Роль же кремния в жизни высших животных и человека долгое время оставалась неясной. Было широко распространено мнение о биологической инертности и бесполезности соединений кремния.
Но, с другой стороны, давно известно серьезное заболевание – силикоз, вызываемое длительным вдыханием пыли, содержащей свободную двуокись кремния. Некоторые кремнийорганические соединения – арилсилатроны оказались токсичными для всех теплокровных животных.
И в то же время известно, что в человеческом организме кремний есть практически повсеместно, больше всего – в костях, коже, соединительной ткани, а также в некоторых железах. При переломах костей содержание кремния в месте перелома возрастает почти в 50 раз. Минеральные воды с высоким содержанием кремния (например, известная кавказская вода «Джермук») оказывают благотворное влияние на здоровье людей, особенно пожилых.
Нельзя сказать, что роль кремния в жизни выяснена уже окончательно – скорее, наоборот: появление новой информации все больше осложняет картину. Синтезом и исследованием биологически активных соединений кремния сейчас заняты во многих лабораториях мира. Очень активно работают над комплексом проблем, который кратко можно назвать так же, как названа эта глава, т.е. кремний и жизнь, сотрудники Иркутского института органической химии во главе с членом-корреспондентом Академии наук СССР М.Г. Воронковым. В одной из своих статей он писал: «Уже имеющиеся многочисленные наблюдения позволяют прийти к заключению о необходимости широких и тщательных исследований (в том числе на молекулярном уровне) роли кремния в живых организмах и изыскания возможностей использовать соединения этого элемента для лечения и профилактики различных заболеваний и травм, а также для борьбы со старением». Пояснения здесь, наверное, требует лишь последний тезис. Дело в том, что установлены возрастные особенности кремниевого обмена в организме: с возрастом содержание этого элемента в костной ткани, артериях, коже существенно уменьшается…
Этот раздел наших знаний об элементе №14 еще не стал сводом общепринятых, устоявшихся истин. Но, очевидно, именно здесь проходит в наши дни передний край борьбы за познание кремния – ближайшего аналога углерода, жизненно важного элемента.
Коротко об изотопах
Природный кремний состоит из трех изотопов с массовыми числами 28, 29 и 30. Преобладает (92,27%) легкий изотоп – кремний-28. Известны также несколько радиоактивных изотопов кремния; долгоживущий лишь один кремний-32 с периодом полураспада около 710 лет.
Больше всего – в силикатах
Во всех природных соединениях кремний связан с кислородом. На долю кремнезема (во всех его разновидностях) приходится около 12% массы земной коры. Намного больше доля силикатов и алюмосиликатов: 75% массы земной коры составлено из этих соединений кремния, кислорода и других элементов, в первую очередь алюминия.
Ферросилиций
Сплав кремния с железом – ферросилиций широко используются в черной металлургии и для изготовления кислотоупорных изделий. Этот сплав готовят, прокаливая смесь двуокиси кремния, угля и железной руды в доменных или электрических печах. На ферросилиций с 15% Si не действуют большинство кислот; правда, он подвержен разрушению соляной кислотой. Чтобы ферросилиций был устойчив к действию и этой кислоты, нужно, чтобы в нем было не меньше 50% Si.
Карборунд – соперник алмаза
Это соединение, как и многие карбиды, отличается прочностью, твердостью, жаропрочностью и химической стойкостью. По твердости кристаллы SiC уступают лишь алмазу и боразону, но поскольку карбид кремния значительно дешевле, его широко применяют для обработки твердых материалов. Получают карборунд в реакции кварцевого песка с углем, проходящей в электрической печи при температуре около 2000°C. Чистый карборунд бесцветен, ему, как и кремнию, свойственны качества полупроводника. А еще это единственное соединение, в котором есть связь кремний – углерод и которое тем не менее не относят к кремнийорганическим соединениям. Очевидно, потому, что вообще все карбиды считаются неорганическими соединениями.
Солнечные батареи
На спутниках, луноходах, космических кораблях и станциях установлены солнечные батареи, преобразующие в электричество лучистую энергию Солнца. В них работают кристаллы полупроводниковых материалов и в первую очередь кремния. При поглощении кванта света в таком кристалле освобождаются электроны. Если такие кристаллы составят довольно внушительных размеров панели, то нетрудно соединить проводником освещенный в неосвещенный участки. По проводнику потечет ток. Кремниевые преобразователи солнечной энергии в электрическую уже работают но только в космосе, но и на земле. А в павильоне «Космос» на ВДНХ их может увидеть каждый.
Стекла, стекла, стекла…
Перефразируя И.А. Крылова, можно сказать: «Что стекла разны, всякий знает». Что без стекла современному человеку пришлось бы худо, – тоже. Что в составе подавляющего большинства стекол есть двуокись кремния, тоже, пожалуй, знают почти все. А вот соотношение различных окислов в составе различных стекол известно лишь химикам. В «нормальном» стекле 75,3% SiO2, в бутылочном – 73, оконном – 72, электроламповом – всего 69,4%. Зато в высокопрочном стекле «пирекс», отличающемся также повышенной химической стойкостью, двуокиси кремния 80,9% – больше, чем в любом другом стекле, кроме, конечно, кварцевого…
И растворимое стекло
Самый распространенный клей – силикатный, он же растворимое стекло, метасиликат натрия Na2SiО3. Это знает каждый школьник, но это не совсем верно. В растворимом стекле наряду с Na2SiO3 содержатся и более сложные силикаты натрия. Помутнение силикатного клея – результат отщепления части молекул SiO2. Этот клей плохо пристает к резине, потому его лучше держать в сосуде с резиновой, а не корковой или тем более стеклянной пробкой.
Кремнии в газах
Некоторые соединения кремния газообразны при обычных условиях. Во-первых, это его тетрафторид – бесцветный газ с резким запахом, который переходит в жидкое состояние лишь при температуре –77°C под давлением 2 атм. Газообразны и два простейших кремневодорода – моносилан SiH4, аналог метана, и дисилан SiН6, аналог этана. Оба эти газа чрезвычайно легко окисляются и обладают малоприятными запахами.
Что такое аметист
Среди веществ состава SiO2 немало поделочных и полудрагоценных камней. Знаменитый лиловый аметист – это природный, окрашенный примесью марганца горный хрусталь. При нагревании до 300…350°C аметисты необратимо обесцвечиваются или даже желтеют. А аметисты, обесцвеченные рентгеновским излучением, способны восстановить свою изначальную окраску.
• Фосфор
• Оглавление
Дата публикации:
18 марта 2002 года
n-t.ru
