Угольная кислота, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Формула Угольной кислоты структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: CH2O3
Химический состав Угольной кислоты
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12.011 | 1 | 19,4% |
| H | Водород | 1.008 | 2 | 3,3% |
| O | Кислород | 15.999 | 3 | 77,4% |
Молекулярная масса: 62,024
У́гольная кислота́ — слабая двухосновная кислота с химической формулой H2CO3, образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. В водных растворах неустойчива. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
В водных растворах неустойчива. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Угольная кислота существует в водных растворах в равновесии с диоксидом углерода, причём равновесие сильно сдвинуто в сторону разложения кислоты. Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 129 пм. Безводная угольная кислота представляет собой бесцветные кристаллы, устойчивые при низких температурах, сублимирующиеся при температуре -30 градусов Цельсия, а при дальнейшем нагревании полностью разлагающиеся. Поведение чистой угольной кислоты в газовой фазе исследовано в 2011 году австрийскими химиками.
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода. В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода. Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов). Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду. Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода. Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система. Значение pH в такой системе, соответствующей насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., равен pH=3,9.
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов). Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду. Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода. Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система. Значение pH в такой системе, соответствующей насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., равен pH=3,9.
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие смещается в сторону разложения угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью. Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно. При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты.
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты.
Угольная кислота образуется при растворении в воде диоксида углерода. Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа. Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. Газированная вода). В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот.
Некоторые представители подобных соединений перечислены в таблице:
В этом качестве она может образовывать все производные, характерные для карбоновых кислот.
Некоторые представители подобных соединений перечислены в таблице:
| Класс соединений | Пример соединения |
|---|---|
| Сложные эфиры | поликарбонаты |
| Хлорангидриды | фосген |
| Амиды | мочевина |
| Нитрилы | циановая кислота |
| Ангидриды | пироугольная кислота |
Как сделать угольную кислоту, свойства и применение
Угольная кислота Угольная кислота представляет собой химическое соединение с химической формулой H 2 CO 3 и молекулярной формулой CH 2 8 O 3
. Это неорганическая слабая кислота, которая существует только в виде раствора. Угольная кислота также известна как воздушная кислота, воздушная кислота или дигидрокарбонат. Он образует два вида солей: карбонаты и бикарбонаты. Ph угольной кислоты составляет 4,68 в 1 мМ.
Он образует два вида солей: карбонаты и бикарбонаты. Ph угольной кислоты составляет 4,68 в 1 мМ.
Угольная кислота является специфически двухпротонной кислотой, что означает, что она имеет два протона, которые могут диссоциировать от исходной молекулы. Таким образом, есть две константы диссоциации, первая для диссоциации иона бикарбоната и вторая для диссоциации иона бикарбоната в ион карбоната.
Возникновение:Углекислота присутствует в крови в организме человека. Он образуется в организме человека при растворении воды с углекислым газом. Он также присутствует в дождевой воде, кальците, ферментации, угле, грунтовых водах, метеорах, вулканах, аминокислотах, белках, океанах, растениях, эритроцитах, отложениях серы, солях и пещерах.
Свойства угольной кислоты:
Физические свойства:
Внешний вид: серовато-белое твердое вещество.
Температура плавления: 210 градусов по Цельсию, температура кипения: -78 градусов по Цельсию.

Молекулярная масса: 62,024 г/моль.
Растворимость: нерастворим.
Угольная кислота имеет значение pH менее 7.
Угольная кислота не имеет запаха и имеет щелочной вкус.
Химическая Свойства :
Углекислота — слабая и нестабильная двухосновная кислота.
Кислотность 6,3 пК.
Приготовление углекислоты:
Реагенты
Карбонат кальция
Раствор соляной кислоты
Лакмус
Вода
Носите лабораторные очки и старайтесь избегать контакта кожи с соляной кислотой. Соблюдайте общие рекомендации по безопасности.
Количество шагов:
- Налейте в стакан немного воды.

- Добавьте в химический стакан 5-6 капель лакмуса.
- Положите кусочек карбоната кальция в пробирку или в стакан.
- Налейте в пробирку/стакан небольшое количество соляной кислоты и закройте ее отверстие пробкой с выпускной трубкой.
- Опустите конец выпускной трубки в раствор лакмуса. Образовавшийся газ начнет пузыриться через раствор, и цвет раствора изменится.
- Проверить рН воды. Воды больше нет, образовалась углекислота. рН будет читать его как слабую кислоту.
Химическая реакция в виде уравнения:
CaCO 3 + HCl → CaCl 2 + CO 2 ↑+ H 2 O
CO 2 + H 2 O → H 2 CO 3
Углекислота Применение: 4Угольная кислота чаще всего используется в виде солей.
 Он также играет жизненно важную роль в протонировании многих азотистых оснований в сыворотке крови. Углекислота является основным буферным элементом в организме человека и расщепляется на углекислый газ ферментом, называемым карбоангидразой.
Он также играет жизненно важную роль в протонировании многих азотистых оснований в сыворотке крови. Углекислота является основным буферным элементом в организме человека и расщепляется на углекислый газ ферментом, называемым карбоангидразой.В напитках: Угольная кислота широко используется для приготовления шипучих, шипучих напитков.
Для лечения дерматитов: обычно используется для лечения дерматитов, таких как стригущий лишай.
Также используется для полоскания рта или вагинального душа.
При отравлении или передозировке препарата углекислота дается перорально для вызывания рвоты.
Для очистки контактных линз очень эффективна углекислота, она также используется в качестве газа для сварки, пищевой промышленности и косметики.
Для гидролиза крахмала также используется угольная кислота.
Углекислота — Энциклопедия Нового Света
Материал из Энциклопедии Нового Света
Перейти к:навигация, поиск
Предыдущий (Карбонатит)
Следующий (Углеугольный)
| Другие названия | Раствор диоксида углерода |
| Идентификаторы | |
|---|---|
| CAS-номер | [463-79-6] |
| УЛЫБКИ | С(=О)(О)О |
| Недвижимость | |
| Молекулярная формула | H 2 CO 3 |
| Молярная масса | 62,03 г/моль |
| Плотность | 1,0 г/см 3 (разбавленный раствор) |
| Растворимость в воде | существует только в растворе |
| Кислотность (p K a ) | 6,36 (см. текст) текст) 10,25 |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 °C, 100 кПа) | |
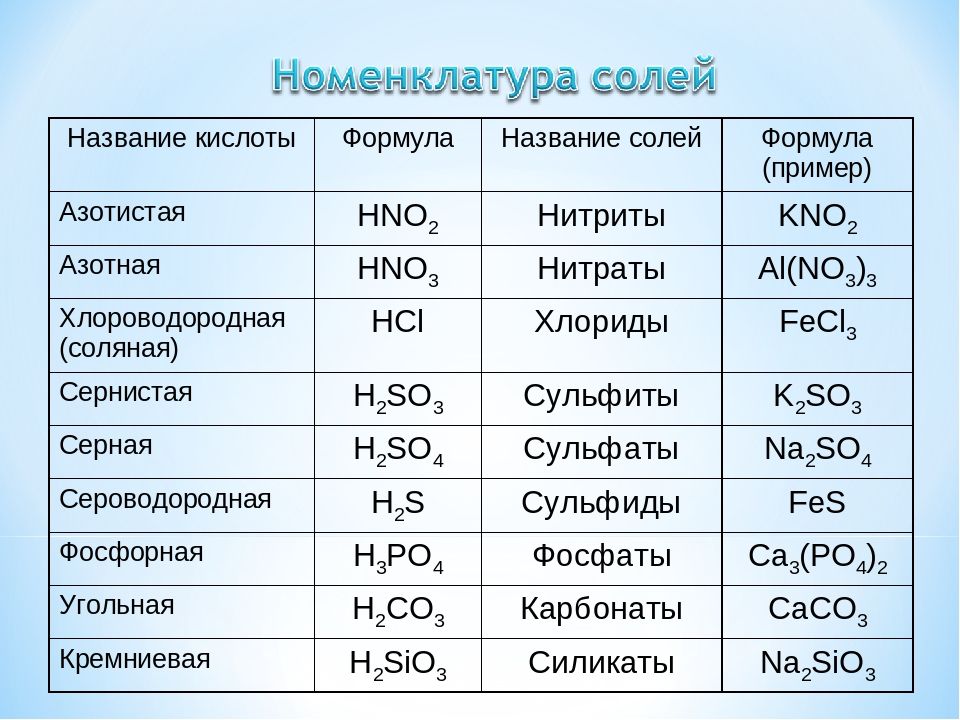
Угольная кислота (древнее название кислота воздуха или воздушная кислота ) является слабой кислотой с формулой H 2 CO 3 . Он образуется в небольших количествах при растворении углекислого газа в воде и обычно находится только в растворе. Соли угольных кислот называются бикарбонатами (или гидрокарбонатами, когда анион HCO 3 − ) и карбонаты (когда анионом является CO 3 2− ).
Содержимое
- 1 Раствор в воде
- 2 Кислотность угольной кислоты
- 3 Роль угольной кислоты в крови
- 4 Получение чистой угольной кислоты
- 5 pH и состав раствора угольной кислоты
- 6 См. также
- 7 Каталожные номера
- 8 Внешние ссылки
- 9 кредитов
Присутствие угольной кислоты в крови и других жидкостях организма помогает контролировать уровень pH (кислотность) этих жидкостей.
Раствор в воде
Диоксид углерода, растворенный в воде, находится в равновесии с угольной кислотой: Константа равновесия при ч = 1,70×10 −3 , что указывает на то, что большая часть углекислого газа не превращается в угольную кислоту и остается в виде CO 2 молекул. В отсутствие катализатора равновесие достигается довольно медленно.
Константы скорости составляют 0,039 с -1 для прямой реакции (CO 2 + H 2 O → H 2 CO 3 ) и 23 с -1 для обратной реакции (0 -1 2 CO 3 → CO 2 + H 2 O).
Кислотность угольной кислоты
Угольная кислота имеет два кислых атома водорода и, следовательно, две константы диссоциации:
- H 2 CO 3 ⇌ HCO 3 − + H +
- 9
- K 08 = 2,5×10 90 270 -4 90 271 моль/л; p K a1 = 3,60 при 25 °C.

- K 08 = 2,5×10 90 270 -4 90 271 моль/л; p K a1 = 3,60 при 25 °C.
- 9
- H 2 CO 3 ⇌ HCO 3 − + H +
- HCO 3 − ⇌ CO 3 2− 9037 +
0 + H
0- К а2 = 5,61×10 −11 моль/л ; стр К а2 = 10,25 при 25 °С.
- HCO 3 − ⇌ CO 3 2− 9037 +
Следует соблюдать осторожность при указании и использовании первой константы диссоциации угольной кислоты. Приведенное выше значение верно для молекулы H 2 CO 3 и показывает, что это более сильная кислота, чем уксусная кислота или муравьиная кислота: этого можно было ожидать из-за влияния электроотрицательного кислородного заместителя. Однако, угольная кислота существует только в растворе в равновесии с двуокисью углерода, поэтому концентрация H 2 CO 3 значительно ниже концентрации CO 2 , снижающий измеренную кислотность. Уравнение можно переписать следующим образом ( ср. сернистая кислота ):
- CO 2 + H 2 O ⇌ HCO 3 − + H + 7
- a
- K 9028 0008 = 4,30×10 -7 моль/л; р К а = 6,36.

- CO 2 + H 2 O ⇌ HCO 3 − + H + 7
Эта цифра цитируется как константа диссоциации угольной кислоты, хотя это двусмысленно: ее лучше было бы назвать константой кислотности диоксида углерода, поскольку она особенно полезна для расчета pH CO 2 растворы.
Роль угольной кислоты в крови
Углекислота играет очень важную роль в крови млекопитающих. Является промежуточным звеном при переносе углекислого газа из легких в кровь и наоборот. Превращение диоксида углерода в угольную кислоту катализируется ферментом (карбоангидраза), который увеличивает скорость реакции почти в миллиард раз. Углекислота диссоциирует в крови (как и в других растворах) с образованием в основном H + и HCO 3 — (бикарбонат) ионы. Эта диссоциация является равновесной реакцией и помогает контролировать уровень рН крови.
Получение чистой угольной кислоты
Долгое время исследователи считали невозможным получение чистого бикарбоната водорода (H 2 CO 3 ) при комнатной температуре (около 20 °C или около 70 °F). Однако в 1991 году ученым из Центра космических полетов имени Годдарда НАСА (США) удалось получить первый чистый H 2 CO 3 проб. Они сделали это, подвергнув замороженную смесь воды и углекислого газа высокоэнергетическому излучению, а затем нагрев, чтобы удалить избыток воды. Оставшуюся угольную кислоту охарактеризовали с помощью инфракрасной спектроскопии.
Однако в 1991 году ученым из Центра космических полетов имени Годдарда НАСА (США) удалось получить первый чистый H 2 CO 3 проб. Они сделали это, подвергнув замороженную смесь воды и углекислого газа высокоэнергетическому излучению, а затем нагрев, чтобы удалить избыток воды. Оставшуюся угольную кислоту охарактеризовали с помощью инфракрасной спектроскопии.
Способность производить угольную кислоту путем облучения твердой смеси H 2 O и CO 2 привела к предположению, что H 2 CO 3 можно найти в космическом пространстве, где замерзшие льды H 2 О и СО 2 распространены, как и космические лучи и ультрафиолетовый свет, чтобы помочь им реагировать.
Такой же полиморф угольной кислоты (обозначается бета-угольной кислотой) был получен криотехнологией в Университете Инсбрука: чередующиеся слои стеклообразных водных растворов бикарбоната и кислоты нагревались в вакууме, что вызывает протонирование бикарбоната, и растворитель впоследствии удалены.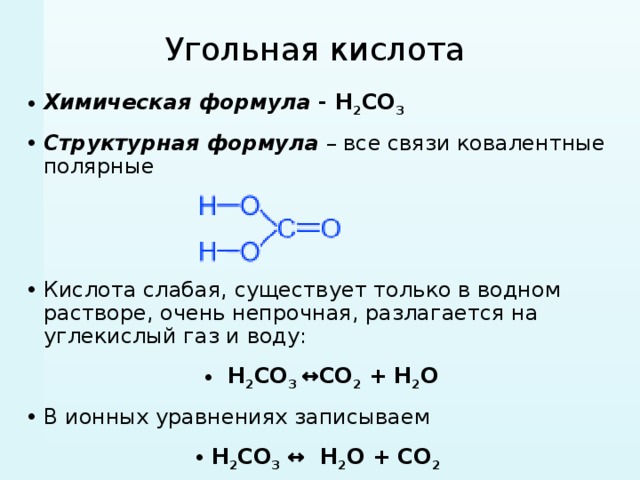 Второй полиморф (обозначенный альфа-угольной кислотой) был получен по той же методике в Университете Инсбрука с использованием в качестве растворителя метанола, а не воды.
Второй полиморф (обозначенный альфа-угольной кислотой) был получен по той же методике в Университете Инсбрука с использованием в качестве растворителя метанола, а не воды.
Исследователи из Инсбрука сообщили, что чистая, не содержащая воды угольная кислота очень стабильна в газовой фазе с рассчитанным периодом полураспада 180 000 лет. Тем не менее, согласно их расчетам, присутствие одной молекулы воды заставляет молекулу угольной кислоты быстро разлагаться на углекислый газ и воду.
pH и состав раствора угольной кислоты
При данной температуре состав чистого раствора угольной кислоты (или чистого CO 2 9раствор 0008) полностью определяется парциальным давлением двуокиси углерода над раствором pCO2{\displaystyle \scriptstyle p_{CO_{2}}}. Для расчета этого состава необходимо принять во внимание указанные выше равновесия между тремя различными карбонатными формами (H 2 CO 3 , HCO 3 − и CO 3 2− ), а также равновесие между растворенным CO 2 и H 2 CO 3 с константой Kh = [h3CO3] [CO2] {\ displaystyle \ scriptstyle K_ {h} = {\ frac {[H_ {2} CO_ {3} ]}{[CO_{2}]}}} (см. выше) и следующего равновесия между растворенным CO 9{2-}]} дают шесть уравнений для шести неизвестных [CO 2 ], [H 2 CO 3 ], [H + ], [OH − ], [HCO 3 — ] и [CO 3 2− ], показывая, что состав раствора полностью определяется pCO2 {\ displaystyle \ scriptstyle p_ {CO_ {2}}}. Уравнение, полученное для [H + ], представляет собой кубическую форму, численное решение которой дает следующие значения pH и различных концентраций частиц:
выше) и следующего равновесия между растворенным CO 9{2-}]} дают шесть уравнений для шести неизвестных [CO 2 ], [H 2 CO 3 ], [H + ], [OH − ], [HCO 3 — ] и [CO 3 2− ], показывая, что состав раствора полностью определяется pCO2 {\ displaystyle \ scriptstyle p_ {CO_ {2}}}. Уравнение, полученное для [H + ], представляет собой кубическую форму, численное решение которой дает следующие значения pH и различных концентраций частиц:
| PCO2 {\ displaystyle \ scriptstyle P_ {CO_ {2}}} (атм.) | рН | [CO 2 ] (моль/л) | [H 2 CO 3 ] (моль/л) | [HCO 3 − ] (моль/л) | [CO 3 2− ] (моль/л) |
| 10 −8 | 7,00 | 3,36 × 10 -10 | 5,71 × 10 −13 | 1,42 × 10 −9 | 7,90 × 10 −13 |
| 10 −6 | 6,81 | 3,36 × 10 −8 | 5,71 × 10 −11 | 9,16 × 10 −8 | 3,30 × 10 −11 |
| 10 −4 | 5,92 | 3,36 × 10 −6 | 5,71 × 10 −9 | 1,19 × 10 −6 | 5,57 × 10 −11 |
| 3,5 × 10 −4 | 5,65 | 1,18 × 10 −5 | 2,00 × 10 −8 | 2,23 × 10 −6 | 5,60 × 10 −11 |
| 10 −3 | 5,42 | 3,36 × 10 −5 | 5,71 × 10 −8 | 3,78 × 10 −6 | 5,61 × 10 −11 |
| 10 −2 | 4,92 | 3,36 × 10 −4 | 5,71 × 10 −7 | 1,19 × 10 −5 | 5,61 × 10 −11 |
| 10 −1 | 4,42 | 3,36 × 10 −3 | 5,71 × 10 −6 | 3,78 × 10 −5 | 5,61 × 10 −11 |
| 1 | 3,92 | 3,36 × 10 −2 | 5,71 × 10 −5 | 1,20 × 10 −4 | 5,61 × 10 −11 |
| 2,5 | 3,72 | 8,40 × 10 −2 | 1,43 × 10 −4 | 1,89 × 10 −4 | 5,61 × 10 −11 |
| 10 | 3,42 | 0,336 | 5,71 × 10 −4 | 3,78 × 10 −4 | 5. 61 × 10 −11 61 × 10 −11 |
- Мы видим, что во всем диапазоне давлений pH всегда значительно ниже pKa 2 , так что концентрация CO 3 1−7 g − по концентрации HCO 3 − . Фактически CO 3 9{-4}} атм), мы получаем слабокислый раствор (р Н = 5,7) и растворенный углерод теперь находится в основном в форме СО 2 . Начиная с этого давления, [OH — ] также становится незначительным, так что ионизированная часть раствора теперь представляет собой эквимолярную смесь H + и HCO 3 — .
- При давлении CO 2 , типичном для бутылок с газировкой (PCO2{\displaystyle \scriptstyle P_{CO_{2}}} ~ 2,5 атм), мы получаем относительно кислую среду (стр. H = 3,7) с высокой концентрацией растворенного СО 2 . Эти особенности обуславливают кисловатый и игристый вкус этих напитков.
- В диапазоне от 2,5 до 10 атм pH пересекает значение pKa 1 (3,60), что дает преобладающую концентрацию H 2 CO 3 (по отношению к HCO 3 − − − − − − −
Как отмечалось выше, [CO 3 2− ] можно пренебречь для этой конкретной задачи, что приводит к следующему очень точному аналитическому выражению для [H 9{1/2}}
См.
 также
также- Кислота
- Углерод
- Углекислый газ
- pH
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Hage, W., K.R. Liedl, A. Hallbrucker и E. Mayer. 1998. «Углекислота в газовой фазе и ее астрофизическое значение». Наука , 279:1332-1335.
- Hage, W., A. Hallbrucker, and E. Mayer. 1993. «Угольная кислота: синтез путем протонирования бикарбоната и спектроскопическая характеристика FTIR с помощью нового криогенного метода». Дж. Ам. хим. соц. 115:8427-8431.
- Hage, W., A. Hallbrucker, and E. Mayer. 1995. Полиморф угольной кислоты и его возможное астрофизическое значение. J. Chem. соц. Фарада. Транс. 91:2823-2826.
- Jolly, WL 1991. Современная неорганическая химия , 2-е изд. Нью-Йорк: MgGraw-Hill. ISBN 0-07-112651-1
- Лёртинг, Т., К. Таутерманн, Р.Т. Кремер, И. Коль, Э. Майер, А. Халльбрукер и К. Р. Лидл. 2001. «Об удивительной кинетической стабильности угольной кислоты».
 Анжю. хим. Междунар. Эд. 39:891-895.
Анжю. хим. Междунар. Эд. 39:891-895. - Мур, М. Х. и Р. Ханна. 1991. «Инфракрасные и масс-спектральные исследования льда, облученного протонами h3O+CO2: доказательства существования угольной кислоты». Spectrochimica Acta , 47A:255-262.
- Welch, M.J., J.F. Lipton, and J.A. Seck. 1969. . J. Phys. хим. 73:3351.
Внешние ссылки
Все ссылки получены 10 января 2017 г.
- Почему так долго несправедливо сомневались в существовании угольной кислоты?
Авторы
Энциклопедия Нового Света автора и редактора переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно осуществляться в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа.




 Анжю. хим. Междунар. Эд. 39:891-895.
Анжю. хим. Междунар. Эд. 39:891-895.