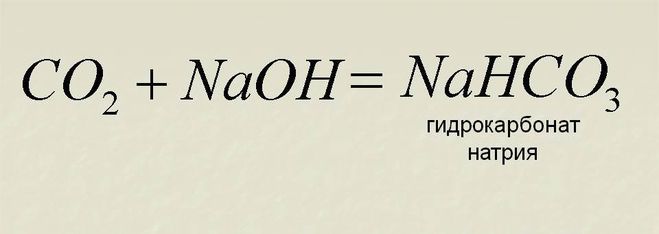Сода кальцинированная техническая | компания ГлавХим г.Москва, Тула
Сода кальцинированная техническая (натрий углекислый, карбонат натрия) ГОСТ 5100-85
Хранение
Условия хранения технической кальцинированной соды не должны допускать попадания влаги на продукт и тару, поэтому соду хранят в сухих закрытых складских помещениях любого типа при относительной влажности не более 75%. Помещение для хранения должно часто проветриваться. Кальцинированная сода в мягких контейнерах разового использования может храниться на открытых площадках. На потребительские свойства кальцинированной соды марки А действует гарантийный срок 3 месяца, марки Б — 6 месяцев, при хранении в мягких контейнерах — 5 лет со дня изготовления.
|
Наименование показателей |
Марки |
|
Техническая марка-Б (высший сорт) ГОСТ 5100-85 |
|
|
Внешний вид |
Порошок белого
цвета.
|
|
Массовая доля углекислого натрия , %,не менее |
99,4 |
|
Массовая доля потери массы при прокаливании , %, не более |
0,5 |
|
Массовая доля хлоридов в пересчете на NaCI, 0%, не более |
0.4 |
|
Массовая доля железа в пересчете на Fe2O3, %, не более |
0.003 |
|
Массовая доля углекислого натрия в пересчете на непрок, прод-т,%, не менее |
98,9 |
Физико-химические свойства:
|
Наименование показателя |
Марка Б |
||
|
Высший сорт |
Первый сорт |
Второй сорт |
|
|
Массовая доля углекислого натрия (Na2CO3), %, не менее |
99,4 |
99,0 |
99,0 |
|
Массовая доля углекислого натрия (Na2CO3) в пересчете на непрокаленный продукт, %, не менее |
98,9 |
98,2 |
97,5 |
|
Массовая доля потери при прокаливании (при 270 – 300 °С), %, не более |
0,5 |
0,8 |
1,5 |
|
Массовая доля хлоридов в пересчете на NaCI, %,не более |
0,4 |
0,5 |
0,8 |
|
Массовая доля железа в пересчете на Fe2O3, %, не более |
0,003 |
0,003 |
0,008 |
|
Массовая доля веществ, нерастворимых в воде, %, не более |
0,03 |
0,04 |
0,08 |
|
Массовая доля сульфатов в пересчете на Na2SO4, %, не более |
|
0,05 |
Не нормируется |
Кальцинированная сода марок А и Б
находит широкое применение в разнообразных отраслях промышленности. Наибольшая
доля ее использования приходится на стекольное производство и химическую
промышленность: изготовление всех видов стекла, мыла и других моющих средств,
эмалей, получение ультрамарина, натриевых, хромовых, фосфорных солей и т. д.
Кроме того, кальцинированная сода применяется в цветной и черной металлургии,
нефтехимической и нефтеперерабатывающей промышленности, мыловаренной, целлюлозно-бумажной,
текстильной, пищевой, лакокрасочной, кожевенной отраслях, а также для бытовых
нужд.
Наибольшая
доля ее использования приходится на стекольное производство и химическую
промышленность: изготовление всех видов стекла, мыла и других моющих средств,
эмалей, получение ультрамарина, натриевых, хромовых, фосфорных солей и т. д.
Кроме того, кальцинированная сода применяется в цветной и черной металлургии,
нефтехимической и нефтеперерабатывающей промышленности, мыловаренной, целлюлозно-бумажной,
текстильной, пищевой, лакокрасочной, кожевенной отраслях, а также для бытовых
нужд.
Кальцинированная сода марки А высшего сорта используется для изготовления электровакуумного стекла, а сода марки Б — для производства глицеринов, жирных кислот, синтетических моющих средств.
виды, состав, польза и вред для организма
Пищевая сода — это иное название гидрокарбоната натрия. Формула пищевой соды — NaHCO 3. Вещество представляет собой белый мелкокристаллический порошок солоноватого вкуса с широкой сферой применения. В результате реакции с кислотой формула пищевой соды распадается на карбонат натрия (соль), воду и углекислый газ.
| Пищевая ценность |
|---|
Порция 100 г |
| Количество на порцию |
Калории из жиров |
% Суточное значение * |
Всего жиров 0 г |
Холестерин 0 мг |
Натрий 27360 мг 1140 % |
Калий 0 мг |
Всего углеводов 0 г |
Пищевые волокна 0 г |
Белки 0 г |
* Расчет для суточного рациона в 2000 ккал |
Соотношение БЖУ в продукте
Источник: depositphotos.com
Как сжечь 0 ккал?
Применение пищевой соды
Применение пищевой соды целесообразно в:
- Пищевой промышленности — производстве кондитерских изделий, хлебопечении, приготовлении напитков;
- Химической промышленности — в целях производства пенопластов, красителей, товаров бытовой химии, фтористых реактивов;
- Легкой промышленности — изготовлении искусственной кожи, подошвенной резины, текстиля.

- Медицине — в качестве средства для снижения кислотности желудочного сока, а также нейтрализации ожогов кожи кислотами.
Кроме того, гидрокарбонат натрия входит в состав порошка, применяемого в сфере пожаротушения — его действие основано на оттеснении кислорода от места возгорания с помощью углекислого газа.
Сода в пищевой промышленности
Основная сфера применения пищевой соды, конечно же, кулинария. Знакомый с детства порошок используется в качестве дополнительного или основного разрыхлителя при выпечке. Незначительное количество соды (на кончике ложки), добавленное в тесто, сделает выпечку более мягкой, пышной и легкоусваиваемой. Для того чтобы продукт не приобрел характерного для соды мыльного привкуса, необходимо соблюдать правильные пропорции. При добавлении пищевой соды в воду или свежее молоко (не кислую среду) продукт принято гасить уксусом — так у теста исчезает неприятный привкус карбоната натрия. При смешивании соды со сметаной, кефиром или простоквашей пищевую соду гасить необязательно.
Пищевая сода в медицине
Применение пищевой соды кулинарией не ограничивается: широко распространено использование гидрокарбоната натрия в традиционной и нетрадиционной медицине. Лечение пищевой содой является эффективным благодаря способности вещества уничтожать микробы, а также нейтрализовать действие кислот.
Для того чтобы избавиться от мучительной изжоги или отрыжки достаточно размешать в 1 стакане воды чайную ложку соды и выпить залпом.
Пищевая сода используется при простуде и боли в горле путем полоскания содовым раствором из расчета 1 чайная ложка гидрокарбоната натрия на стакан теплой воды.
Незаменима сода при лечении ожогов. Если случился ожог, необходимо смешать 1 чайную ложку пищевой соды с растительным маслом, нанести на ватный тампон и приложить к больному месту. Спустя некоторое время боль уйдет, и рана быстро затянется.
Лечение пищевой содой фурункулов, мозолей и натоптышей осуществляется с помощью примочек крепким содовым раствором или горячих содовых ванночек для ног.
В целях отвыкания от курения практикуется полоскание полости рта густым раствором соды в малых дозах — чтобы не нарушить процесс пищеварения.
С помощью соды осуществляется также:
- Лечение алкоголизма и табакокурения;
- Растворение отложений в позвоночнике, суставах, камней в почках и печени, лечение радикулита, ревматизма, остеохондроза, подагры, мочекаменной и желчнокаменной болезни;
- Очищение организма от солей кадмия, свинца, таллия, ртути, висмута, бария и других тяжелых металлов.
Пищевая сода в косметологии
Жесткая вода, лаки и спреи часто делают наши волосы слабыми и секущимися. Одна столовая ложка соды, добавленная в средство по уходу (шампунь или кондиционер) укрепит волосы, сделает их мягкими и блестящими.
Используется пищевая сода и в качестве смягчающего скраба для кожи. Смешайте 2 столовых ложки соды с увлажняющим средством для тела. Ополосните кожу водой и с помощью мочалки распределите смесь по всему телу, уделяя внимание «проблемным» участкам: локтям, коленям, зоне бикини. Данная процедура смягчит, очистит кожу, а также снимет воспаления, полученные от бритвенных станков.
Данная процедура смягчит, очистит кожу, а также снимет воспаления, полученные от бритвенных станков.
Пищевая сода — прекрасное средство для восстановления PH-баланса кожи и избавления от прыщей. Окуните ватный тампон в раствор соды и средства для очищения лица и начните мягко массировать кожу круговыми движениями, избегая области вокруг глаз. Данная процедура позволит удалить ороговевшие частицы кожи и очистить поры лица. Регулярное проведение процедуры поможет избавиться от прыщей полностью.
Пищевая сода для похудения
Свойство пищевой соды, препятствующее всасыванию жиров в организме, позволяет применять гидрокарбонат натрия в качестве средства для похудения. Однако, осуществлять прием содового раствора необходимо только после консультации врача, со строгим соблюдением дозировки — иначе вред пищевой соды, нанесенный организму, будет неизбежен.
Более безопасный способ сбросить лишние килограммы с помощью пищевой соды — применение средства в составе ванн. Суть действия пищевой соды для похудения заключается в активизации лимфатической системы. Несколько капель эфирных масел, добавленные в содовую ванну, ускоряют выведение шлаков и токсинов из организма, а, следовательно, и процесс потери лишнего веса. Помимо оздоровительного эффекта, ванны с пищевой содой прекрасно расслабляют, способствуя снижению усталости и нервного напряжения.
Несколько капель эфирных масел, добавленные в содовую ванну, ускоряют выведение шлаков и токсинов из организма, а, следовательно, и процесс потери лишнего веса. Помимо оздоровительного эффекта, ванны с пищевой содой прекрасно расслабляют, способствуя снижению усталости и нервного напряжения.
Вред пищевой соды
Несмотря на вышеперечисленные достоинства гидрокарбоната натрия, пищевая сода, помимо пользы, может причинить нашему организму вред. Неконтролируемое употребление пищевой соды внутрь вызывает усиленное выделение углекислого газа, что сопровождается еще большим выделением кислоты и вздутием желудка — так называемым, «кислотным рикошетом».
Длительный контакт с порошком пищевой соды может вызвать раздражение кожи и ожог. Избегайте попадания пищевой соды в глаза.
Видео с YouTube по теме статьи:
Вы бродите по супермаркету, разыскивая стиральный порошок без фосфатов. Естественно, для того чтобы узнать, какое средство из целого арсенала бытовой химии вам подходит, берете в руки каждую упаковку с нужной классификацией и смотрите состав содержащегося в ней продукта. Наконец, выбрали подходящее средство, но в процессе изучения всех стиральных порошков магазина заметили странную закономерность: на каждой коробке или пачке было написано что-нибудь типа: «В состав продукта входит карбонат натрия». В каждом человеке присутствует малая толика любопытства, и вы не являетесь исключением. Захотелось узнать, что это за вещество, не так ли? Сегодняшняя статья пополнит объм ваших знаний некоторыми сведениями об этом соединении.
Наконец, выбрали подходящее средство, но в процессе изучения всех стиральных порошков магазина заметили странную закономерность: на каждой коробке или пачке было написано что-нибудь типа: «В состав продукта входит карбонат натрия». В каждом человеке присутствует малая толика любопытства, и вы не являетесь исключением. Захотелось узнать, что это за вещество, не так ли? Сегодняшняя статья пополнит объм ваших знаний некоторыми сведениями об этом соединении.
Определение
Карбонат натрия (формула Na 2 CO 3) является натриевой солью угольной кислоты. В разных источниках его могут называть по-разному: и углекислым натрием, и динатрия триоксокарбонатом, и кальцинированной содой. Кстати, о последнем названии. Обсуждаемое сейчас химическое соединение в чистом виде — это не та пищевая сода, которую добавляют в различные продукты. Ее название — гидрокарбонат натрия. Вещества с присутствием карбоната натрия (да и сам он тоже) зовутся содами. Исключение составляет каустическая сода, научное название которой — гидроксид одноименного металла. Однако гидрокарбонат натрия реагирует с этим веществом, образуя обсуждаемое сейчас соединение. Все остальные соды — сам карбонат с водой или водородом в одной формуле. Сегодня рассматриваются свойства, получение и применение только чистой натриевой соли угольной кислоты.
Однако гидрокарбонат натрия реагирует с этим веществом, образуя обсуждаемое сейчас соединение. Все остальные соды — сам карбонат с водой или водородом в одной формуле. Сегодня рассматриваются свойства, получение и применение только чистой натриевой соли угольной кислоты.
Карбонат натрия: физические свойства
Это вещество в безводном состоянии имеет вид бесцветного кристаллического порошка (фото выше). Строение его кристаллической рещетки зависит от температуры окружения: если последняя не меньше 350, но ниже 479 о С, то она является моноклинной, если температура выше — гексагональной.
Карбонат натрия: химические свойства
Если опустить его в сильную кислоту, то угольная, получившаяся в ходе реакции и являющаяся крайне нестойкой, распадется на газообразный оксид четырехвалентного углерода и воду. Второй продукт реакции — натриевая соль соответствующей кислоты (например, при бросании кристаллов обсуждаемого сейчас карбоната в серную кислоту, получатся углекислый газ, вода, и сульфат натрия). В воде данное соединение будет гидролизоваться, благодаря этому нейтральная среда становится щелочной
В воде данное соединение будет гидролизоваться, благодаря этому нейтральная среда становится щелочной
Получение
Его можно получить несколькими способами, все они разные, но в этой статье будет рассказано лишь об одном. Необходимо смешать мел и древесный уголь с сульфатом натрия, а потом запечь эту смесь при температуре около 1000 о С. Уголь будет восстанавливать последний до сульфида, который при реакции с карбонатом кальция образует расплав сернистого кальция и искомого вещества. Его необходимо обработать водой, затем отфильтровать ненужный сульфид и упарить получившийся раствор. Образовавшийся сырой карбонат натрия очищается посредством перекристаллизации, а затем обезвоживается с помощью кальцинирования. Данный метод называется способом Леблана.
Применение
Отрасли, производящие стекло, стиральные порошки, мыло и эмали не обходятся без карбоната натрия, где его используют, чтобы получить ультрамарин. Также с помощью него устраняют жесткость воды, обезжиривают металлы и проводят десульфатизацию, объектом которой является доменный чугун. Карбонат натрия является хорошим окислителем и регулятором кислотности, его содержат моющие посуду средства, сигареты и пестициды. Также он известен как пищевая добавка E500, не дающая ингредиентам комковаться и слёживаться. Обсуждаемое сейчас вещество необходимо и для того, чтобы приготовить проявитель фотографий.
Карбонат натрия является хорошим окислителем и регулятором кислотности, его содержат моющие посуду средства, сигареты и пестициды. Также он известен как пищевая добавка E500, не дающая ингредиентам комковаться и слёживаться. Обсуждаемое сейчас вещество необходимо и для того, чтобы приготовить проявитель фотографий.
Заключение
Вот для чего полезен карбонат натрия. В чистом виде он, может быть, многим никогда и не встречался, однако его кристаллогидраты (это все соды, кроме каустической) используются человеком почти везде. Это одно из веществ, соединения которых с водой применяются в промышленности гораздо чаще, чем они сами в чистом виде.
Химическая формула
Сода кальцинированная техническая (натрий углекислый), порошок или гранулы белого цвета. Na 2 CO 3 .
Физические свойства
гигроскопичный продукт, на воздухе поглощает влагу и углекислоту с образованием кислой соли NaHCO 3 , при хранении на открытом воздухе слеживается. Водные растворы соды кальцинированной имеют сильно щелочную реакцию. Выпускают соду кальцинированную марки А (гранулированная) и марки Б (порошкообразная).
Водные растворы соды кальцинированной имеют сильно щелочную реакцию. Выпускают соду кальцинированную марки А (гранулированная) и марки Б (порошкообразная).
- Высокое качество соды кальцинированной отмечено Платиновым знаком качества в 2004 г.
- Сода кальцинированная награждена дипломом и серебрянной медалью конкурса «Лучшая продукция товаров бытовой химии, средств гигиены и косметики 2004г.»
- Лауреат республиканского конкурса «Лучшие товары Башкортостана» и конкурса «100 лучших товаров России» 2004г.
Спецификация
| Марка А | Марка Б | |||||
|---|---|---|---|---|---|---|
| Высший сорт | Первый сорт | Второй сорт | Высший сорт | Первый сорт | Второй сорт | |
| Массовая доля углекислого натрия (Na 2 CO 3), %, не менее | 99,4 | 99,0 | 98,5 | 99,4 | 99,0 | 99,0 |
| Массовая доля углекислого натрия (Na 2 CO 3) в пересчете на непрокаленный продукт, %, не менее | 98,7 | 98,2 | 97,0 | 98,9 | 98,2 | 97,5 |
| Массовая доля потери при прокаливании (при 270 – 300 °С), %, не более | 0,7 | 0,8 | 1,5 | 0,5 | 0,8 | 1,5 |
| Массовая доля хлоридов в пересчете на NaCI, %,не более | 0,2 | 0,5 | 0,8 | 0,4 | 0,5 | 0,8 |
| Массовая доля железа в пересчете на Fe 2 O 3 , %, не более | 0,003 | 0,005 | 0,008 | 0,003 | 0,003 | 0,008 |
| Массовая доля веществ, нерастворимых в воде, %, не более | 0,04 | 0,04 | 0,08 | 0,03 | 0,04 | 0,08 |
| Массовая доля сульфатов в пересчете на Na 2 SO 4 , %, не более | 0,04 | 0,05 | Не нормируется | 0,04 | 0,05 | Не нормируется |
| Насыпная плотность, г/см 3 , не менее | 1,1 | 0,9 | 0,9 | Не нормируется | ||
| Гранулометрический состав: | ||||||
| остаток на сите с сеткой № 2К по ГОСТ 6613, %, не более | Не нормируется | 5 | 5 | Не нормируется | ||
| прохождение через сито с сеткой № 1,25К по ГОСТ 6613, % | 100 | Не нормируется | Не нормируется | |||
| остаток на сите с сеткой № 1К по ГОСТ 6613, %, не более | Не нормируется | Не нормируется | ||||
| прохождение через сито с сеткой № 01К по ГОСТ 6613, %, не более | 7 | 15 | 25 | Не нормируется | ||
| Магнитные включения размером более 0,25 мм | Отсутствуют | Не нормируется | Не нормируется | |||
Область применения соды кальцинированной
Сода кальцинированная марок А и Б используется в производстве стекла всех видов, в том числе: хрусталя, оптического и медицинского стекла, стеклоблоков, пеностекла, силиката натрия растворимого, керамических плиток, компонента фритт для глазурей; черной и цветной металлургии: для производства свинца, цинка, вольфрама, стронция, хрома, для десульфуризации и дефосфации чугуна, в очистке отходящих газов, для нейтрализации сред. Для производства электровакуумного стекла используется сода кальцинированная марки А высшего сорта со строго нормированным гранулометрическим составом.Сода кальцинированная марки Б применяется в химической промышленности для производства синтетических моющих средств и жирных кислот, при очистке рассолов, в производстве фосфорных, хромовых, бариевых, натриевых солей как карбонатсодержащее сырье, в производстве глицеринов, аллилового спирта; целлюлозно-бумажной, анилино-красочной и лакокрасочной и нефтяной промышленностях.
Для производства электровакуумного стекла используется сода кальцинированная марки А высшего сорта со строго нормированным гранулометрическим составом.Сода кальцинированная марки Б применяется в химической промышленности для производства синтетических моющих средств и жирных кислот, при очистке рассолов, в производстве фосфорных, хромовых, бариевых, натриевых солей как карбонатсодержащее сырье, в производстве глицеринов, аллилового спирта; целлюлозно-бумажной, анилино-красочной и лакокрасочной и нефтяной промышленностях.
Упаковка, транспортирование, хранение
Соду кальцинированную упаковывают в бумажные мешки массой 50 кг, мягкие специализированные контейнеры разового использования массой 800 кг (марка А) и 500 кг (марка Б).Соду кальцинированную транспортируют насыпью – в содовозах и хопперах, упакованную в мягкие специализированные контейнеры перевозят по железной дороге в полувагонах и крытых вагонах.Соду кальцинированную, упакованную в мешки, перевозят любым видом транспорта, предохраняя продукт от попадания влаги. Гарантийный срок хранения соды кальцинированной марки А – 3 мес., марки Б – 6 мес., упакованной в мягкие специализированные контейнеры – 5 лет с даты изготовления.
Гарантийный срок хранения соды кальцинированной марки А – 3 мес., марки Б – 6 мес., упакованной в мягкие специализированные контейнеры – 5 лет с даты изготовления.
Сода кальцинированная – гигроскопический продукт, который при хранении на открытом воздухе слеживается, а на воздухе поглощает углекислоту и влагу. Применяется пищевой и химической промышленности.
Сода кальцинированная марок «А» применяется в производстве стекла всех видов. Марка «Б» — только в химической индустрии.
Химическая формула соды кальцинированной – Na 2 CO 3 . Безопасность продукта: сода кальцинированная, взрыво — и пожаробезопасна, по степени влияния на организм человека относится к веществам 3-го класса опасности.
Соду кальцинированную техническую марки А упаковывают в мягкую тару разового использования, в пятислойные бумажные мешки. Упакованную в мешки соду, можно транспортировать любыми видами транспорта, только в закрытых транспортных средствах. Продукт марки «Б» транспортируется в специальным транспортом насыпью или крытых вагонах. Мягкие контейнеры перевозятся только в крытых вагонах. Техническую кальцинированную соду хранят в специальных бункерах, складских помещениях, защищая от воздействия влаги. Сода кальцинированная марки «А» хранится – 3 месяца, марки «Б» – 6 месяцев, а сода которая упакованная в мягкую тару – 5 лет.
Мягкие контейнеры перевозятся только в крытых вагонах. Техническую кальцинированную соду хранят в специальных бункерах, складских помещениях, защищая от воздействия влаги. Сода кальцинированная марки «А» хранится – 3 месяца, марки «Б» – 6 месяцев, а сода которая упакованная в мягкую тару – 5 лет.
Основные меры безопасности в работе с кальцинированной содой: вдыхание пыли вызывает раздражение дыхательных путей, коньюктивит. Концентрированный раствор, который случайно попадет в глаза, может привести к неврозу, ожогу, помутнению роговицы – при долгой работе с раствором. Раствор очень едкий при влажности. Желательно пользоваться респиратором, очками, защитным костюмом при работе. Если все же раствор попадет на кожные покровы необходимо удалить вещество тампоном, промыть пораженный участок под струей проточной воды. Закапать глаза 30% раствором альбуцида, на кожные покровы нанести тетрациклинувую мазь. При попадании в организм – промыть желудок с помощью зонда.
Представленная в этой статье информация о различных аспектах пищевой соды , который является популярным бытовых ингредиент, используемый для различных целей. Пищевая сода имеет множество применений и используется в первую очередь в целях приготовления пищи. Он химически известный как бикарбонат натрия, или, точнее, его название ИЮПАК, известно как гидрокарбонат натрия. Она представлена химическая формула nahco3 по. Так что пищевая сода»? Ну, сода-это, по сути, белое кристаллическое соль натрия, и он обычно появляется в виде порошка.
Пищевая сода имеет множество применений и используется в первую очередь в целях приготовления пищи. Он химически известный как бикарбонат натрия, или, точнее, его название ИЮПАК, известно как гидрокарбонат натрия. Она представлена химическая формула nahco3 по. Так что пищевая сода»? Ну, сода-это, по сути, белое кристаллическое соль натрия, и он обычно появляется в виде порошка.
Химическая Формула
Выпечки соды или порошка выпечки и различных химических имена, как гидрокарбонат натрия (na2co3), пищевая сода, гидрокарбонат натрия (nahco 3) и т. д.. Это также называется бикарбонат натрия, или просто сода. Его основная химическая формула nahco3 и она подготовлена промышленно Сольве.
В этот процесс, химические вещества, такие как карбонат кальция (caco3), используется хлорид натрия (NaCl), аммиака (Nh4), диоксида углерода (СО2) и вода (h3O) не. Они реагируют на различные шаги, чтобы дать выход основного продукта. Реакция протекает в два этапа:
Шаг № 1: реакции водным раствором гидроксида натрия (NaOH) и углекислый газ (CO2) —
СО2 + 2 NaOH в → Na2со3 + Н2О
Шаг#2: Добавление больше углекислого газа в приведенной выше реакции —
Na2со3 + СО2 + Н2О → 2NaHCO3
Химическая реакция пищевой соды в воде
Прием nahco3 состоит из двух ионов, ионов натрия (катионы) na+ и бикарбонат ионов (анионов) НСО3-. Объяснил ниже-это путь гидрокарбоната натрия растворяются в воде, разбив на две ионов.
Объяснил ниже-это путь гидрокарбоната натрия растворяются в воде, разбив на две ионов.
Прием nahco3 → Н+(водн) + НСО3-(ая)
Термическое разложение соды
Химическая формула любое соединение дает нам широкое представление о различных химических реакций и свойств этого соединения. Понятно, что если мы раскладываем смесь, используя тепловую энергию, мы можем получить соединения, с помощью которого он подготовлен. Представленное ниже является реакция этого процесса при температуре 70° C.
2 nahco3 по → Na2со3 + Н2О + СО2
Как правило большого пальца, можно вспомнить, что большинство гидроксидов в общем, следуйте приведенным выше реакциям разложения. При нагревании дальше, около 100° С, гидроксиды распадается на соответствующие оксиды.
Na2со3 → количеством na2o (оксид натрия) + СО2
Использует
Пищевая сода находит широкое применение в промышленных и бытовых товаров. Бикарбонат натрия используется в качестве лекарства для желудка и кислотного газа, путем смешивания в соответствующих количествах в различных препаратов. В случаях, почечная и мочевая кислота, гидрокарбонат натрия используется для лечения проблем, связанных с мочой. Раствор бикарбоната натрия считается внутривенно в случаях ацидоза. Бикарбонат натрия в нужных количествах добавляется наряду с соответствующей концентрацией раствора перекиси водорода, и служит альтернативой для зубных паст.
В случаях, почечная и мочевая кислота, гидрокарбонат натрия используется для лечения проблем, связанных с мочой. Раствор бикарбоната натрия считается внутривенно в случаях ацидоза. Бикарбонат натрия в нужных количествах добавляется наряду с соответствующей концентрацией раствора перекиси водорода, и служит альтернативой для зубных паст.
Наиболее популярный способ использования пищевой соды в наших домах-для чистки и отбеливания целей. Бикарбонат натрия широко используется для выпечки целей. Он также используется в качестве химические разрыхлители, которая помогает тесту подняться при выпечке. Однако добавление слишком большого количества этого порошка в тесто приводит к горьким вкусом, и поэтому должны быть осторожны, о соответствующим количеством разрыхлителя, который должен быть использован.
Делая легкие пасту из выпечки соды и воды, а затем прикладывать их к области кожи, пострадавших от акне помогает избавиться от акне в течение 2 — 3 дней. Все, что вам нужно сделать, это постоянно применять пасту, и оставьте его подсыхать на 10 — 20 минут. Различные химические и физические свойства пищевой соды можно разобрались, к пониманию своей формуле, которая содержит элементы и металлы с различными свойствами.
Различные химические и физические свойства пищевой соды можно разобрались, к пониманию своей формуле, которая содержит элементы и металлы с различными свойствами.
Что представляет собой гидрокарбонат натрия, он же бикарбонат, натрий двууглексилый, а попросту питьевая или пищевая сода, известно многим еще со школьных уроков химии. Сода пищевая — это кислая натриевая соль угольной кислоты. В химии формула соды пищевой определяется как NaHCO 3 .
Химический состав гидрокарбоната натрия
Как и любой продукт, используемый в питании, пищевая сода имеет пищевую ценность, которая определяется количеством белков, минералов, углеводов и макроэлементов. Состав соды пищевой определяется следующими показателями на 100 г съедобной части:
- зола — 36,9 г;
- вода — 0,2 г;
- натрий — 27,4 г;
- селен — 0,2 мкг.
В состав гидрокарбоната натрия не входят белки, жиры, углеводы и пищевые волокна, а ее калорийность составляет 0 ккал. Плотность соды — 2,16 г/см 3 .
Химическая формула соды NaHCO 3 представляет собой кислую натриевую соль угольной кислоты, которая по международным атомным массам составляет 84,00 а.е.
Если провести реакцию соды с кислотами то химическая формула соды пищевой распадется на углекислый газ и воду и будет иметь вначале формулу образования соли и угольной кислоты — NaHCO 3 + HCl → NaCl + H 2 CO 3 , а затем H 2 CO 3 → H 2 O + CO 2 .
В бытовых условиях чаще используется уксусная кислота, при реакции с которой образуется ацетат натрия — NaHCO 3 + CH 3 COOH → CH 3 COONa + H 2 O + CO 2
При термических реакциях под воздействием температур от 60 градусов гидрокарбонат распадается на карбонат натрия, углекислый газ и воду. Температура кипения — 851°С, плавления — 270°С.
Щелочные свойства соды
Пищевая сода — это щелочь, такое утверждение имеет свою доказательную базу . Растворы всех химических веществ определяются значением водородного показателя (рН), характеризующим кислотность или щелочность среды.
Если раствор имеет показатель рН 6 и ниже, он представляет собой кислотную среду. Вещества, растворы которых имеют рН 8 и выше — щелочную среду.
В нейтральной среде (например, в чистой воде) рН равен 7. Раствор пищевой соды имеет рН 9, т.е. является слабой щелочью и способен нейтрализовать опасные для организма человека свойства сильных кислот.
Формула пищевой соды имеет в своем составе элементы, которые характеризуют ее как мягкую щелочь, не оказывающую агрессивного воздействия на мягкие ткани организма, поэтому очень часто отщелачивающие свойства этого продукта используют в лечебных и профилактических целях для оздоровления организма.
Представленный еще в советские времена Государственный стандарт и технические условия натрия двууглекислого предусматривают его изготовление в соответствии установленного еще в 1976 году стандарта технологического регламента. Эти требования включают установленные методы анализа, безопасности, приемки и хранения. Ранее указывался ГОСТ — сода пищевая под номером 2156-76, который использовался в фармакологической, химической, легкой, пищевой промышленности, цветной металлургии, а также народном хозяйстве. В настоящее время нормы этого ГОСТА не пересматривались.
Ранее указывался ГОСТ — сода пищевая под номером 2156-76, который использовался в фармакологической, химической, легкой, пищевой промышленности, цветной металлургии, а также народном хозяйстве. В настоящее время нормы этого ГОСТА не пересматривались.
По физико-химическим составляющим сода должна была иметь следующие показатели для 1 и П сорта:
| Внешний вид | Кристаллический порошок белого цвета, без запаха | |
|---|---|---|
| Массовая доля двууглекислого натрия (NaHCO3), %, не меньше | 99,5 | 99,0 |
| Массовая доля углекислого натрия (Na2CO3), %, не более | 0,4 | 0,7 |
| Массовая доля хлоридов в пересчете на NaCl, %, не более | 0,02 | 0,04 |
| Массовая доля мышьяка (As), %, не более | Выдерживает испытание | |
| Массовая доля не растворимых в воде веществ, %, не более | Выдерживает испытание | |
| Массовая доля железа (Fe2+), %, не более | 0,001 | 0,005 |
| Массовая доля кальция (Ca2+), %, не более | 0,04 | 0,05 |
| Массовая доля сульфатов в пересчете на SO42-, %, не более | 0,02 | 0,02 |
| Массовая доля влаги, %, не более | 0,1 | 0,2 |
В данном ГОСТе срок годности соды пищевой был ограничен 12 месяцами. В современном производстве сода пищевая не имеет ограничений в сроках. Основным условием является ее правильное хранение.
В современном производстве сода пищевая не имеет ограничений в сроках. Основным условием является ее правильное хранение.
Требования безопасности пищевой соды
Химический состав соды пищевой демонстрирует ее как не токсичное, но взрывоопасное и пожароопасное средство. По степени воздействия на организм человека она имеет третий класс опасности. В воздухе рабочей зоны допустимая норма двууглекислого натрия в воздухе 5мг/м 3 .
Химформула соды, а также ее состав говорят о том, что под воздействием определенных температур она может быть пожароопасна и взрывоопасна. При нагревании емкости, в которых она хранится, могут взорваться. При нагревании сода может разлагаться на токсичные газы, а при постоянном присутствии в помещении с ее пылью у человека может возникнуть раздражение дыхательных путей. Люди, которые работают на производстве, где находятся большое количество пищевой соды должны соблюдать меры предосторожности, использовать средства индивидуальной защиты.
При возникновении пожара в соответствии с ГОСТом, необходимо:
- Отвести вагон в безопасное место. Изолировать опасную зону в радиусе не менее 100 м. Откорректировать указанное расстояние по результатам химразведки. Удалить посторонних. Соблюдать меры пожарной безопасности. Не курить. Пострадавшим оказать первую помощь.
- Не прикасаться к пролитому или просыпанному веществу. Не допускать попадания вещества в водоемы, подвалы, канализацию.
- В зону аварии входить в защитной одежде и дыхательной маске. Тушить воздушно-механической пеной с дальнего расстояния.
- Засыпать песком или другим инертным материалом. Выжечь территорию (отдельные очаги) при угрозе попадания в грунтовые воды. Вызвать специалистов для нейтрализации.
- Вызвать скорую помощь. Свежий воздух, покой, тепло, чистая одежда. Глаза и слизистые промывать водой не менее 15 минут.
Как необходимо хранить и перевозить соду
Для количественных грузоперевозок пищевую соду упаковывают для безопасности в многослойные бумажные мешки до 50 кг, а также в контейнеры разового использования с полиэтиленовой прослойкой. Для розничной торговли соду упаковывают в картонные пачки или в плотные упаковки из полиэтилена массой до 1 кг. Гидрокарбонат натрия перевозят разными видами транспорта, кроме воздушного.
Для розничной торговли соду упаковывают в картонные пачки или в плотные упаковки из полиэтилена массой до 1 кг. Гидрокарбонат натрия перевозят разными видами транспорта, кроме воздушного.
Как добывают гидрокарбонат натрия
В природе пищевая сода (широкая группа содовых минералов) добывается на высохших содовых озерах или водоемах. Из-за высокой концентрации соды и солей минералы выпадают на берег в виде кристаллических сугробов. Иногда при высыхании озер они образуют целые пласты, покрытые песчаными наносами. По истечении некоторого времени такой пласт может опять оказаться над поверхностью земли, что дает возможность из него получать содовое сырье. Существует несколько видов минералов, из которых можно получать соду. Самое распространенное сырье для получения соды — минерал трон, который перед тем как получить готовый продукт проходит тщательный очистительный, нагревательный процесс, а также проходит этап дробления, чтобы избавиться от нежелательных газов.
Сырье для получения соды — это природные минеральные образования, которые содержат в своем составе углекислый натрий. Содовое сырье имеет разный химический состав, в котором имеют место как полезные, так и вредные компоненты. Известны 2 группы сырья. В первую входят:
Содовое сырье имеет разный химический состав, в котором имеют место как полезные, так и вредные компоненты. Известны 2 группы сырья. В первую входят:
- горные породы с минералам;
- карбонаты и бикарбонаты натрия — трона, натрон, нахколин,термонатрит, давсонит, гейлюссит, шоршит;
- подземные воды содового типа с повышенным содержанием карбоната натрия.
Ко второму типу относятся варианты содовых месторождений, в которых есть залежы натрона, троны, галита. Сода, которую добывают в природе из рапных и высохших озер в Кении, Танзании, Боливии, Мексике и других странах. Кроме того, минерал для получения соды получают из давсонитовых отложений, которые образовались при катагенезе песчано-глинистых пород под воздействием содовых вод.
В Советском Союзе из-за низкой рентабельности добыча природной соды путем выщелачивания была прекращена еще в 1971 году. Самым распространенным являлся открытый и шахтенный способ. В шахтах гидрокарбонат натрия растворяли выщелачивающим методом, а затем раствор выкачивали на поверхность.
Сегодня соду получают промышленным методом, используя аммиачно-хлоридный способ, при котором в концентрат хлорида натрия, насыщенный аммиаком пропускают углекислый газ. В процессе такого синтезирования начинаются реакции, в результате которых путем фильтрования гидрокарбонат натрия отделяют, а продукты переработки (аммиак) возвращают в производство.
Общепринятая пищевая сода, химическая формула которой NaHCO 3 , получается в настоящее время не при очистки соды природным путем, а химическим способом.
Кристаллы природных солей выращивают также и лабораторным путем. Очищение бикарбоната натрия осуществляется двумя способами — мокрым и сухим. Общий процесс представляет собой реакцию карбонизации — насыщение раствора углекислым газом, в результате которой происходит процесс перекристализации, а способы отличаются лишь в методе приготовления раствора.
Современные потребители двууглекислый натрий — пищевую соду могут наблюдать в продуктах как пищевую добавку Е500.
Кальцинированная сода, формула которой известна с давних времен, уже давно применяется во многих сферах. Многие хозяйки используют ее в быту. Ведь кальцинированная сода — это моющее средство, натуральное и безопасное.
Многие хозяйки используют ее в быту. Ведь кальцинированная сода — это моющее средство, натуральное и безопасное.
формула и состав
Примерно лет 20 назад в каждом доме имелась упаковка этого удивительного средства. Что же собой представляет кальцинированная сода? Формула данного вещества — Na2CO3. По сути, это натриевая Это вещество представляет собой смесь мелких и крупных кристаллов белого цвета.
Стоит отметить, что порошок из окружающей среды поглощает влагу. В результате этого кальцинированная сода быстро слеживается. Поэтому рекомендуют хранить это вещество в закрытой емкости, а также в тех помещениях, где не очень высокий уровень влажности.
В промышленности для этого вещества существует ГОСТ. Сода кальцинированная выпускается согласно документу 5100 85, который был принят еще в советское время. Однако ГОСТ действует до сих пор. Согласно данной технологии, вещество делят на несколько марок: А и Б. По массовому содержанию определенных химических элементов эти составы отличаются. Это позволяет использовать каждую марку в отдельной отрасли промышленности.
Это позволяет использовать каждую марку в отдельной отрасли промышленности.
Как получают это средство?
Производство соды кальцинированной — это сложные химические процессы. Стоит отметить, что в природе в чистом виде это вещество существует, и это открытие было сделано в начале 19 века. Изначально его получали из золы, полученной в результате сожжения прибрежных растений, а также из некоторых водорослей. Конечно, человечество эволюционировало, и вместе с ним развились новые технологии. К тому же было обнаружено крупное место залегания этого вещества.
На данный момент кальцинированная сода, формула которой указана выше, изготавливается несколькими способами, такими как:
- Получение из природного вещества.
- Аммиачный метод.
- Получение из нефелинового сырья.
- Карбонизация
Получение из природного сырья
Этот способ изготовления кальцинированной соды представляет собой новую промышленную отрасль. Она появилась относительно недавно, но стала основным конкурентом для тех, кто добывает это вещество аммиачным способом.
Стоит отметить, что метод был известен уже давно. Однако только в начале 20 века его смогли применить на практике. Началом для бурного развития данного направления стало открытие богатейших залежей соды (троны) в США.
Основан метод получения кальцинированной соды из природного сырья на переработке щелоков и рапы, которые образуются при растворении отложений соды. Стоит отметить, что помимо углекислого натрия в большинстве случаев удается выделить и другие компоненты, которые входят в состав исходных веществ.
Способ Леблана
Это еще один не менее популярный способ, позволяющий получить такое вещество, как сода кальцинированная. Состав данного вещества достаточно прост, и его легко выделить из других веществ. Этот способ основан на сплавлении смеси угля и во вращающихся печах. Температура в них может достигать 1000°С. В результате этого процесса образуется содовый сплав — это сырая сода. После этого вещество подвергается выщелачиванию водой. Это требуется для извлечения из содового раствора соды.
Полученный раствор должен хорошо отстояться. Затем щелок очищают, выпаривают из него влагу, кальцинируют — прокаливают, а после измельчают в порошок. Как правило, для изготовления соды используют известняк, мел и соль.
Полезные свойства
Гост «Сода кальцинированная» 5100 85 не менялся на протяжении многих десятилетий. Благодаря разработанной технологии производства данное вещество обладает уникальными свойствами. Кальцинированная сода применяется не только в промышленности, но и в быту. Среди всех полезных качеств этого состава стоит выделить:
- Способность хорошо удалять старую грязь, краску, жирные пятна.
- Хорошо очищает раковины, кафель, фарфор, эмаль и керамику.
- Справляется практически с любыми засорами в трубах.
- Смягчает воду.
- Отстирывает даже застаревшие пятна с одежды.
- Позволяет побороть садовых вредителей.
- Хорошо дезинфицирует.
Вред соды
Сода кальцинированная, техническая обладает не только достоинствами. Это вещество имеет и некоторые недостатки. Конечно, нельзя сказать, что состав способен вызвать какой-либо вред. Это будет неправильно. Скорее неправильное применение кальцинированной соды может привести к возникновению каких-либо побочных эффектов . В результате появляются негативные отзывы о средстве.
Это вещество имеет и некоторые недостатки. Конечно, нельзя сказать, что состав способен вызвать какой-либо вред. Это будет неправильно. Скорее неправильное применение кальцинированной соды может привести к возникновению каких-либо побочных эффектов . В результате появляются негативные отзывы о средстве.
Чаще всего отмечается несоблюдение мер предосторожности, а также дозировок. Раствор кальцинированной соды — это агрессивное вещество. Ошибки в дозировках, а также нарушения процесса использования могут нанести здоровью человека вред. Поэтому при работе с веществом следует помнить о правилах безопасности. К тому же не стоит забывать о том, что кальцинированная сода подходит далеко не для всех материалов.
Меры предосторожности
Какими свойствами обладает сода кальцинированная? Состав вещества указывает на его безопасность. Поэтому кальцинированную соду часто используют в быту. Это вещество отличается белым цветом и кристаллической структурой. Раствор соды обладает сильно выраженным щелочным эффектом. Однако само по себе вещество считается взрыво- и пожаробезопасным. Но из-за деятельности человека его относят к третьему классу.
Однако само по себе вещество считается взрыво- и пожаробезопасным. Но из-за деятельности человека его относят к третьему классу.
Сода кальцинированная, техническая — это химически активный состав. При работе с этим веществом следует соблюдать правила безопасности. Если сода попала на слизистую, то это может вызвать сильнейшее раздражение тканей. В некоторых случаях возникают даже ожоги. Если вещество попало на кожу или же в глаза, то рекомендуется промыть хорошо чистой водой пораженный участок.
Не стоит забывать, что кальцинированная сода поглощает влагу. В результате ее соединения с водой образуется агрессивный раствор. Поэтому не рекомендуется использовать кальцинированную соду в помещениях, где отмечен высокий показатель влажности воздуха.
Применение в промышленности
В промышленности часто используется сода кальцинированная. Характеристика и свойства этого вещества позволяют применять его во многих отраслях. Некоторые производственные процессы очень сложно представить без участия данного компонента. К основным областям применения кальцинированной соды в промышленности стоит отнести:
К основным областям применения кальцинированной соды в промышленности стоит отнести:
Это вещество просто незаменимо. Кальцинированная сода применяется даже при производстве медикаментов. Его используют здесь в качестве средства для очистки, элемента для синтеза прочих химических компонентов и так далее.
Можно ли использовать в быту?
Кальцинированная сода используется многими хозяйками и в домашних условиях. Как было указано выше, это вещество представляет собой прекрасное чистящее и моющее средство. Кальцинированная сода способна очистить практически любые поверхности от жира. И все благодаря своим уникальным свойствам. К тому же это относительно дешевый аналог многих современных брендов бытовой химии. Эффективность кальцинированной соды проверена годами. Помимо этого вещество является безопасным и натуральным.
Этот состав часто используют для стирки, для удаления накипи и жира. Кальцинированная сода просто незаменима в быту. К тому же ее можно добавлять при стирки в стиральные порошок. Это позволит уберечь технику от накипи.
Это позволит уберечь технику от накипи.
Борьба с вредителями
Используется кальцинированная сода в быту еще и для борьбы с садовыми вредителями. Для этого готовят простой раствор. На ведро чистой воды требуется не более 6 чайных ложечек кальцинированной соды. Готовым составом можно обработать виноградные лозы. Это средство защищает растения от серой гнили. Стоит отметить, что такой раствор подходит для обработки фруктовых растений. Вреда средство не наносит, но позволяет защитить растения от гусениц и прочих вредителей.
Помимо этого, раствор можно использовать для обработки огурцов, кабачков, дынь и капусты. Однако увлекаться кальцинированной содой не стоит. Чрезмерное ее количество вредит почве. Что, в свою очередь, может сильно повлиять на будущий урожай.
В завершение
Кальцинированная сода представляет уникальное химическое соединение, которое используется человечеством на протяжении многих лет не только во многих отраслях промышленности, но и в быту. Если соблюдать все правила безопасности, то применение этого вещества не несет вреда здоровью. Кальцинированная сода не опаснее уксуса. А ведь он тоже при неправильном использовании способен навредить нашему организму.
Если соблюдать все правила безопасности, то применение этого вещества не несет вреда здоровью. Кальцинированная сода не опаснее уксуса. А ведь он тоже при неправильном использовании способен навредить нашему организму.
Вряд ли кто-то задумывался над тем, что в производстве многих вещей, которые нас окружают, применяется кальцинированная сода. К тому же изготавливает ее из природного сырья. Многие чистящие и моющие средства , стиральные порошки и прочая дорогая бытовая химия , которая продается по высоким ценам, — это раствор кальцинированной соды, который был вида изменен и разбавлен определенными добавками.
Двууглекислый натрий, натрия гидрокарбонат, натрия бикарбонат, питьевая сода — это названия одного и того же химического соединения, известного каждому человеку как «пищевая сода». Она является хорошим разрыхлителем для теста. Содовым раствором можно снять зубную боль. Но это далеко не весь спектр применения этого «чудо»-вещества. На самом деле, без гидрокарбоната натрия трудно обойтись и в быту, и в кулинарии, и в медицине, и во многих других сферах деятельности.
История создания
Пищевую соду в хлебопечении использовали с древности. Она была найдена археологами при раскопках пещер І-ІІ веков до н.э. Тогда ее добывали из морских или находили в виде минерала. Это химическое соединение активно использовали в древнем Египте.
Впервые химическая формула соединения — NaHCO3- была установлена ученым-французом Анри де Монсо. Благодаря этому открытию, пищевую соду стали получать синтетическим путем, что значительно удешевило ее стоимость и расширило спектр использования. С момента открытия формулы способы его синтеза постоянно менялись, совершенствовались, становились экономически выгоднее.
Способы получения
Первый способ промышленного получения карбоната натрия заключался в растворении каменной в , смешивании раствора с известняком и древесным углем и последующим нагреванием в печи. Однако, как оказалось, на выходе получали не пищевую, а кальцинированную соду. Кроме того, в результате такой деятельности оставалось очень много токсичных отходов (сульфида кальция и хлороводорода), поэтому от него быстро отказались.
Сегодня пищевую соду производят двумя способами — «сухим» и «мокрым», в основе каждого из которых лежит реакция карбонизации (обогащения раствора углекислотой).
Виды соды
С химической точки зрения и области применения различают несколько разновидностей соды: пищевую (питьевую), кальцинированную (бельевую) и каустическую (гидроксид натрия).
Химические свойства
Гидрокарбонат натрия — это слабая кислая соль угольной кислоты. Представляет собой мелкие бесцветные кристаллы, которые при повышении температуры до 50-60°С начинают «отдавать» молекулу углекислого газа, постепенно разлагаясь до карбоната натрия (кальцинированной соды).
Реагирует с кислотами с образованием солей (хлорида, ацетата, сульфата натрия) и угольной кислоты, которая моментально расщепляется до воды и углекислоты. В воде порошок растворяется плохо и легко отделяется фильтрованием.
Полезные свойства
Польза гидрокарбоната натрия обусловлена его щелочной рН. Именно способность реагировать с кислотами и ощелачивать среду лежит в основе таких полезных свойств пищевой соды как:
- кислотонейтрализующее;
- антисептическое;
- противовоспалительное;
- противозудное;
- подсушивающее;
- противогрибковое;
- разжижающее мокроту;
- смягчающее и отбеливающее кожу.

Такое множество полезных свойств позволяет использовать это соединение в народной и традиционной медицине для лечения многих заболеваний и нормализации самочувствия человека при различных патологических и физиологических состояниях.
Возможный вред
Пищевую соду следует употреблять внутрь в ограниченных количествах и по строгим показаниям. Кристаллы бикарбоната в большом количестве токсичны для слизистой органов пищеварения и могут вызвать сильное раздражение и ответные аллергические реакции.
При регулярном вдыхании паров углекислого газа или кристаллов гидрокарбоната, например, на производстве соды, может возникать раздражение слизистой органов дыхания.
Частое употребление содового раствора грозит стойкими органическими нарушениями работы пищеварительной системы. Происходит ощелачивание желудочного сока, а также сдвиг в сильно щелочную сторону содержимого кишечника.
Медицинское применение
Гидрокарбонат натрия широко применяют в медицине. При этом соду используют в разных ее областях: дерматологии, гастроэнтерологии, кардиологии, пульмонологии, стоматологии, токсикологии, при ЛОР-патологиях. Помогает двууглекислый натрий от изжоги, тошноты, укачивания.
При этом соду используют в разных ее областях: дерматологии, гастроэнтерологии, кардиологии, пульмонологии, стоматологии, токсикологии, при ЛОР-патологиях. Помогает двууглекислый натрий от изжоги, тошноты, укачивания.
Это вещество применяют внутрь в виде содового напитка и наружно в сухом виде, в виде пасты или водного раствора для обтираний, примочек, ванночек.
В стоматологии
Полоскание раствором гидрокарбоната натрия ротовой полости снимает местное воспаление, облегчает зубную боль, укрепляет десны, устраняет неприятный запах. Соду можно использовать в качестве заменителя зубной пасты для отбеливания зубов.
В гастроэнтерологии
При тошноте делают крепкий содовый раствор (1 ст.ложка на стакан воды) и медленно выпивают его. При сильной изжоге рекомендуется чайную ложку соды растворить в стакане воды и выпить. Таким образом, на некоторое время состояние больных улучшается. Однако, необходимо отметить, что при частых изжогах следует обратиться к врачу, а не лечиться содой дома. Привычное поступление щелочного раствора вызывает реакцию нейтрализации между соляной кислотой и содой, в результате чего выделяется много углекислого газа, который вызывает вздутие. Образовашаяся углекислота раздражает химиорецепторы желудка, стимулируя тем самым рефлекторное усиление образования желудочного сока.
Привычное поступление щелочного раствора вызывает реакцию нейтрализации между соляной кислотой и содой, в результате чего выделяется много углекислого газа, который вызывает вздутие. Образовашаяся углекислота раздражает химиорецепторы желудка, стимулируя тем самым рефлекторное усиление образования желудочного сока.
В кардиологии
Гидрокарбонатные ванны способствуют нормализации артериального давления и сердцебиения, что полезно при перебоях в работе сердца и сосудов. Сода способствует усилению мочеотделения, чем уменьшает общий объем циркулирующей крови. Как результат уменьшается давление кровяного столба на стенки сосудов и немного падает артериальное давление.
Прием раствора гидрокарбоната натрия внутрь при резком повышении кровяного давления является средством первой помощи при гипертоническом кризе в домашних условиях. Если выпить содовый напиток вместе с гипотензивными лекарствами, это потенциирует их эффект.
В дерматологии
Мыльно-содовые ванночки и аппликации помогают избавиться от грибкового поражения ногтей, а также от мозолей и натоптышей. Пастой из пищевой соды и воды нужно обрабатывать места ожогов кожи при воздействии на нее кислот, а также участки кожи с солнечными ожогами. Смачивать водой с растворенной в ней содой нужно места укусов комаров и других насекомых на коже. При сильном зуде можно посыпать кожу сухим порошком.
Пастой из пищевой соды и воды нужно обрабатывать места ожогов кожи при воздействии на нее кислот, а также участки кожи с солнечными ожогами. Смачивать водой с растворенной в ней содой нужно места укусов комаров и других насекомых на коже. При сильном зуде можно посыпать кожу сухим порошком.
При проблемах с запахом пота, содовым раствором следует обработать подмышки. Бактерии и грибки, которые размножаются в поте, продуцируют кислоты, которые и вызывают неприятный запах. Гидрокарбонат натрия нейтрализует эти кислоты и проявляет умеренный антисептический эффект.
Ванночки для ног на основе гидрокарбоната делают при грибковых заболеваниях ступней и ногтей. Они также помогают смягчить загрубевшую кожу пяток перед педикюром. Горячие ванночки из крепкого раствора пищевой соды помогают при панариции (гнойном воспалении под ногтем).
При ЛОР-патологиях
Гидрокарбонат натрия при попадании в вязкую мокроту, реагирует с кислотами, содержащимися в ней. Образовавшиеся пузырьки углекислого газа и вода разжижают мокроту, увеличивают ее количество и облегчают откашливание.
Для приготовления отхаркивающего средства при трахеитах, ларингитах, бронхитах, а также при сильном кашле чайную ложку пищевой соды разводят в 200 мл теплого . Этот эликсир пьют перед сном. Вместо такого напитка можно делать паровые ингаляции с содой. Столовую ложку порошка разводят в литре горячей воды и дышат над ней. Для усиления эффекта в раствор можно добавить несколько капель эфирных масел эвкалипта, сосны или . Полосканиями горла раствором из соли и соды снимают воспаление гланд при ангине.
Внутривенное введение стерильного водного раствора натрия гидрокарбоната часто применяют в реанимации, инфекционных отделения и токсикологии при отравлениях, интоксикациях. метаболическом ацидозе.
Использование в кулинарии
Многогранно применение гидрокарбоната натрия и в кулинарии. Способность соды при гашении уксусом выделять углекислый газ позволяет использовать ее в качестве разрыхлителя. Гашеная сода придает пышность омлету, тесту. Гасить соду можно уксусом или вносить порошок в сметанное или кефирное тесто. Во втором случае молочная кислота будет играть роль уксуса.
Во втором случае молочная кислота будет играть роль уксуса.
Добавление ее в блюда из бобовых позволяет сократить время их приготовления. Если использовать соду в маринаде для мяса, можно смягчить жесткие мышечные волокна. Ягодные и фруктовые муссы при добавлении в них щепотки соды становятся слаще, а и — более прозрачными и ароматными.
Для того чтобы избавиться от нитратов в овощах, их нужно замочить в содовом растворе. Потемневший можно осветлить этим же способом.
Применение в хозяйстве
Незаменимо вещество и в быту. Оно является отличным чистящим средством. Хромированные изделия и столовое серебро для возвращения им блеска натирают сухой содой, промывают мыльной водой, а затем протирают насухо мягкой ветошью.
Порошок гидрокарбоната натрия, нанесенный на увлажненную губку, устраняет царапины и потертости на половых покрытиях из винила. Кафельную плитку, кухонную плиту, мойку и сантехнику можно очистить от загрязнений, обработав густой смесью соды и воды. Эта же смесь помогает избавиться от специфического кошачьего запаха в местах, где были «метки».
Эта же смесь помогает избавиться от специфического кошачьего запаха в местах, где были «метки».
Для удаления запахов
Хорошая гигроскопичность двууглекислого натрия является причиной того, что он быстро впитывает ароматы, поэтому его можно использовать для устранения различных запахов. Чтобы избавиться от неприятных запахов в холодильнике, нужно насыпать сухой порошок в стакан и поставить его в дверцу холодильника. Меняя содержимое стакана по мере необходимости (раз в 1-2 месяца), можно навсегда избавиться от специфического «холодильного» запаха.
При устойчивом запахе кислого молока «пахнущие» емкости нужно почистить сухим порошком. Аналогично поступают с посудой, имеющей запах рыбы.
Если засыпать несколько столовых ложек порошка в сливное отверстие, а через несколько минут включить теплую воду, можно устранить неприятный запах из сифона под раковиной.
Питьевая сода поможет справиться также с неприятным запахом от ковра. Для этого ковер посыпают порошком, оставляют на 20-30 минут, а затем тщательно пылесосят. Однако такой способ подходит только для нелиняющих ковров.
Однако такой способ подходит только для нелиняющих ковров.
С помощью пищевой соды можно также предупредить появление неприятных запахов, например, из стиральной или посудомоечной машины при их длительном простое. Уезжая на длительное время из дома, следует натереть сухим гидрокарбонатом внутреннюю поверхность машинок и оставить их дверцы приоткрытыми, а после возвращения — запустить их в режиме ополаскивания.
Для ухода за одеждой
Во время машинной стирки хорошо будет добавить в стиральный порошок соду. Это поможет избавиться от неприятного запаха в стиральной машинке, улучшит качество стирки и аромат выстиранного белья. Неприятно пахнущую одежду можно выстирать в машинке, обильно посыпав ее содой.
Мокрый купальник не заплесневеет и не будет неприятно пахнуть, если после купания в бассейне или в природном водоеме его сложить в пакет с содой, а дома хорошенько выполоскать и высушить.
Использование в косметологии
Сода — отличное косметическое средство. Хороший очищающий и отбеливающий эффект имеет скраб, приготовленный из измельченных овсяных хлопьев и сухого гидрокарбоната натрия. Кожа после такого скраба становится мягкой, а регулярное его применение избавляет от прыщей. Для придания блеска волосам после мытья головы их нужно обработать раствором соды и .
Хороший очищающий и отбеливающий эффект имеет скраб, приготовленный из измельченных овсяных хлопьев и сухого гидрокарбоната натрия. Кожа после такого скраба становится мягкой, а регулярное его применение избавляет от прыщей. Для придания блеска волосам после мытья головы их нужно обработать раствором соды и .
Для похудения
Гидрокарбонат натрия применяют также для похудения. Чтобы потерять до 2 кг за одну процедуру, можно наполнить ванну теплой водой и растворить в ней 0,5 кг и 0,3 кг обычной питьевой соды. Худеющему нужно погрузиться в такую ванну на 20 минут. При этом температура воды должна быть около 40°С. Содово-солевой раствор расслабляет мышцы, снимает усталость и нервное напряжение, очищает лимфатические сосуды, уменьшает отечность тканей. После ванной обтираться не следует: достаточно надеть теплый халат. Делать такие водные процедуры лучше перед сном.
Другие способы использования
Незаменима сода в походах. Ею можно:
- мыть посуду, не нанося вреда окружающей среде;
- заменить зубную пасту;
- затушить костер;
- смазать кожу в местах укуса насекомых.

Избавиться от неприятного запаха от обуви можно, если ее изнутри натереть сухой содой или смачивать содовым раствором. Смесь бикарбоната натрия и сахара устребляет тараканов.
Использование в промышленности
Питьевую соду в качестве пищевой добавки Е500 использует пищевая промышленность в изготовлении хлебобулочных, мучных, кондитерских, колбасных изделий, газированных напитков, а также для очистки промышленного оборудования.
Химическая промышленность использует гидрокарбонат натрия в производстве красителей, реактивов, средств бытовой химии, пенопластов. Бикарбонатом наполняют порошковые огнетушители.
В легкой промышленности соду применяют в кожевенном производстве, для изготовления искусственной кожи, шелковых и хлопковых тканей.
Как выбрать и хранить
Натрия гидрокарбонат должен храниться в закрытых пачках, чтобы не накапливать посторонних запахов. Перед покупкой необходимо встряхнуть пачку с содой. Если из нее посыплется мелкая пыль, это признак залежалости продукта и частичного распада соединения внутри пачки. Дома следует сразу же пересыпать порошок в герметичную емкость.
Дома следует сразу же пересыпать порошок в герметичную емкость.
Храниться сода должна в сухих вентилируемых помещениях, вдали от сильнопахнущих продуктов. Температура хранения не ограничивается, однако нужно помнить, что чем она выше, тем быстрее продукт теряет свои свойства. Гарантийным сроком хранения является 12 месяцев, но если сода хранилась правильно и не утратила своей реактивности, срок ее годности не ограничен.
Проверить реактивность гидрокарбоната можно простым способом: при гашении щепотки соды уксусом будет образовываться пена из пузырьков газа.
Расширив спектр применения соды в домашнем хозяйстве, каждая хозяйка может сэкономить свой бюджет и открыть для себя много экологически чистых и гипоаллергенных средств для уборки, стирки и многого другого.
В интернете есть масса видео, как использовать соду, и мало информации, как ее сделать в домашних условиях. Причина проста: такой продукт проще и дешевле приобрести готовым, чем утруждать себя его изготовлением. Впрочем, есть еще и познавательный аспект вопроса. Давайте разберемся, как сделать соду дома и использовать ее в быту.
Впрочем, есть еще и познавательный аспект вопроса. Давайте разберемся, как сделать соду дома и использовать ее в быту.
Как сделать соду в домашних условиях?
Как сделать соду в домашних условиях
Прежде чем приступать к химическим экспериментам, решите, какую именно соду вы хотели бы получить в итоге. Существует несколько видов вещества:
- сода пищевая (питьевая), или гидрокарбонат натрия, является белым нетоксичным порошком с солоноватым вкусом. Активно используется в кулинарии и медицине;
- сода кальцинированная, или карбонат натрия, является сильной щелочью, поэтому подходит для бытовых нужд: для смягчения воды, мытья полов, чистки посуды и сантехники;
- сода каустическая, или гидроксид натрия, – едкая щелочь, относящаяся к категории опасных веществ. Применяется при производстве бумаги, мыла, шампуня, средств для прочистки канализационных засоров.
В природе сода встречается в составе воды некоторых озер, поэтому древнейшим способом получения вещества было выпаривание. Помимо рассола сырьем для ее добычи служила зола сожженных водорослей. Сейчас в общем производстве соды большую долю составляет искусственный продукт, получаемый аммиачным методом.
Помимо рассола сырьем для ее добычи служила зола сожженных водорослей. Сейчас в общем производстве соды большую долю составляет искусственный продукт, получаемый аммиачным методом.
Как получить кальцинированную соду? Для этого нужно в металлическую кружку насыпать обычную соду. Далее ее, постоянно помешивая, нагревают на сильном огне. Спустя 5−8 минут у вас вместо гидрокарбоната будет карбонат.
Полученную кальцинированную соду можно использовать для создания каустика
Вначале 20 г карбоната натрия растворяют в 150 мл воды. Затем раствор подогревают до полного исчезновения кристалликов соды. Далее добавляют 14 г гашеной извести. Раствор отфильтровывают от осадка (мела). Каустик готов. Важно: все манипуляции выполняйте в перчатках, так как гидроксид, попадая на кожу, вызывает сильные химические ожоги.
Как применять домашнюю соду
На основе кальцинированной соды можно приготовить раствор для чистки кафеля, раковин, унитаза и ванной. Для этого в литре воды надо развести 2−3 столовые ложки порошка. Карбонатом натрия выводят даже застарелые пятна с льняных и хлопковых тканей.
Карбонатом натрия выводят даже застарелые пятна с льняных и хлопковых тканей.
Введение.
(натрон, бикарбонат натрия, гидрокарбонат натрия) — нейтрализующая кислоту натриевая соль. Питьевая сода — это гидрокарбонат натрия NaHCO 3 , двууглекислый натрий.В общем случае «сода» представляет собой техническое название натриевых солей угольной кислоты H 2 CO 3 . В зависимости от химического состава соединения различается питьевая сода (пищевая сода, бикарбонат натрия, двууглекислый натрий, гидрокарбонат натрия) — NaHCO 3 , кальцинированная сода (карбонат натрия, безводный углекислый натрий) — Na 2 CO 3 и кристаллическая сода — Na 2 CO 3 .10H 2 O, Na 2 CO 3 .7H 2 O, Na 2 CO 3 .H 2 O.Искусственная пищевая сода (NaHCO3) — белый кристаллический порошок.
Современные содовые озера известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Серлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США).
В США природная сода удовлетворяет более 40% потребности страны в этом полезном ископаемом. В России из-за отсутствия крупных месторождений сода из минералов не добывается.
Сода была известна человеку примерно за полторы-две тысячи лет до нашей эры, а может быть, и раньше. Ее добывали из содовых озер и извлекали из немногочисленных месторождений в виде минералов. Первые сведения о получении соды путем упаривания воды содовых озер относятся к 64 году нашей эры. Алхимикам всех стран вплоть до 18 века представлялась неким веществом, которое шипело с выделением какого-то газа при действии известных к тому времени кислот — уксусной и серной. Во времена римского врача Диоскорида Педания о составе соды никто не имел понятия. В 1736 году французский химик, врач и ботаник Анри Луи Дюамель де Монсо впервые смог получить из воды содовых озер очень чистую соду. Ему удалось установить, что сода содержит химический элемент «Натр». В России еще во времена Петра Первого соду называли «зодой» или «зудой» и вплоть до 1860 года ее ввозили из-за границы. В 1864 году в России появился первый содовый завод по технологии француза Леблана. Именно благодаря появлению своих заводов сода стала более доступной и начала свой победный путь в качестве химического, кулинарного и даже лекарственного средства.
В 1864 году в России появился первый содовый завод по технологии француза Леблана. Именно благодаря появлению своих заводов сода стала более доступной и начала свой победный путь в качестве химического, кулинарного и даже лекарственного средства.
Что такое пищевая сода.
В промышленности, торговле и в быту под названием сода встречаются несколько продуктов: кальцинированная сода — безводный углекислый натрий Na 2 СO 3 , двууглекислая сода — бикарбонат натрия NaНСO 3 , часто называемая также питьевой содой, кристаллическая сода Na 2 СO 3 .10Н 2 O и Nа 2 СO 3 .Н 2 O и каустическая сода, или едкий натр, NаОН. Обыкновенная сода, в зависимости от способа приготовления, бывает леблановская и аммиачная. Последняя представляет собой более чистый продукт. Кроме того сода бывает либо в виде кальцинированной (безводной, прокаленной), либо кристаллической. Эта сода содержит 10 частей воды.
Современная пищевая сода — типичный промышленный продукт. Однако она была известна человечеству задолго до нашей эры в естественном состоянии и уже применялась в кулинарии Древнего Египта, на территории которого существовали содовые озера, выделявшие на жгучем солнце пустыни осадочную соду.
В природе сода встречается в твердом виде в небольших залежах в составе минерала трона Na 2 CO 3 NaHCO 3 .2H 2 O, в виде раствора — в воде некоторых содовых озер и щелочных минеральных источников и в золе некоторых растений. До начала XIX в. использовалась почти исключительно природная сода, но с ростом потребления соды возникла необходимость производства соды в больших масштабах искусственным путем. В настоящее время добыча природной соды крайне мала. Имеются содовые озера (в Кулундинской степи), однако природная сода составляет небольшой процент в общем ее производстве. Промышленное производство очищенного продукта тесно связано с содовым производством, поскольку в качестве сырья для получения очищенной пищевой соды применяется карбонат (или сырой гидрокарбонат) натрия, а также диоксид углерода известковых печей.
В настоящее время в мире производится несколько миллионов тонн соды в год для промышленного производства, пищевой и медицинской промышленности.
Искусственно сода была получена лишь в конце XVIII века во Франции химиком Лебланом (1791 год). Секрет получения, как тогда водилось, долго держался в тайне, вследствие чего сода стала впервые активно применяться именно во французской кулинарии, особенно во французском кондитерском производстве, и в первую очередь при изготовлении бисквитов и других французских печений, в то время как кондитерское производство в других странах — например, в Австрии, в России — развивалось в ином направлении, с использованием других, преимущественно дрожжевых тестоподъемных средств. Вот почему во Франции, кроме бисквитов, доминировали сухие и слоеные печенья, а в Германии и Польше, где работали французские учителя-повара, получило развитие песочное содовое тесто, в то время как Вена вплоть до XX века оставалась центром пышных кондитерских изделий и знаменита превосходным дрожжевым «венским тестом» — верхом искусного применения дрожжей в кондитерском деле. Лишь в 1861 году бельгийский химик Э. Сольве разработал современный способ получения соды, на который во второй половине XIX — начале XX века перешли все европейские страны и США.
Секрет получения, как тогда водилось, долго держался в тайне, вследствие чего сода стала впервые активно применяться именно во французской кулинарии, особенно во французском кондитерском производстве, и в первую очередь при изготовлении бисквитов и других французских печений, в то время как кондитерское производство в других странах — например, в Австрии, в России — развивалось в ином направлении, с использованием других, преимущественно дрожжевых тестоподъемных средств. Вот почему во Франции, кроме бисквитов, доминировали сухие и слоеные печенья, а в Германии и Польше, где работали французские учителя-повара, получило развитие песочное содовое тесто, в то время как Вена вплоть до XX века оставалась центром пышных кондитерских изделий и знаменита превосходным дрожжевым «венским тестом» — верхом искусного применения дрожжей в кондитерском деле. Лишь в 1861 году бельгийский химик Э. Сольве разработал современный способ получения соды, на который во второй половине XIX — начале XX века перешли все европейские страны и США.
Лишь после Первой мировой войны и революции 1917 г. содовые кондитерские изделия получили развитие в СССР, в 20-30-х годах, в основном через сеть общественного питания, ибо содовое тесто дает возможность достигать стереотипности, стандарта выпечных изделий (одинаковости в их весе, виде, форме). А после Второй мировой войны содовые кондитерские изделия заняли в России основное место в домашнем приготовлении за счет утраты навыков новых поколений к созданию традиционных национальных русских сладостей, а также в связи с редким появлением в продаже дрожжей и разнообразных пряностей, применяемых ранее в русском кондитерском деле (бадьян, калган, корица, имбирь, черный перец, померанцевая цедра).
Характеристики пищевой соды.
Химические свойства.
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты.Молекулярная масса (по международным атомным массам 1971 г.) — 84,00.
Реакция с кислотами.
Гидрокарбонат натрия реагирует с кислотами, с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду:
NaHCO 3 + HCl → NaCl + H 2 CO 3
H 2 CO 3 → H 2 O + CO 2
в кулинарии чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
NaHCO 3 + CH 3 COOH → CH 3 COONa + H 2 O + CO 2
Сода хорошо растворяется в воде. Водный раствор питьевой соды имеет слабощелочную реакцию. Шипение соды — результат выделения углекислого газа CO 2 в результате химических реакций.
Водный раствор питьевой соды имеет слабощелочную реакцию. Шипение соды — результат выделения углекислого газа CO 2 в результате химических реакций.
Термическое разложение.
При температуре 60° C гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200° C):
2NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2
При дальнейшем нагревании до 1000° C (например при тушении пожара порошковыми системами) полученный карбонат натрия распадается на углекислый газ и оксид натрия:
Na 2 CO 3 → Na 2 O + CO 2 .
Физико-химические показатели.
Бикарбонат натрия представляет собой кристаллический порошок белого цвета со средним размером кристал лов 0,05 — 0,20 мм. Молекулярная масса соединения равна 84,01, плотность составляет 2200 кг/м³, насыпная плотность — 0,9 г/см³. Теплота растворения бикарбоната натрия исчисляется 205 кДж (48,8 ккал) на 1 кг NaHCO 3 , теплоемкость достигает 1,05 кДж/кг.К(0,249 ккал/кг.°С).
Гидракарбонат натрия термически малоустойчив и при нагревании разлагается с образованием твердого карбоната натрия и выделением диоксида углерода, а также воды в газовую фазу:
2NaHCO 3 (тв. ) ↔ Na 2 CO 3 (тв.) + CO 2 (г.) + H 2 O (пар) — 126 кДж (- 30 ккал)Аналогично разлагаются и водные растворы бикарбоната натрия:
) ↔ Na 2 CO 3 (тв.) + CO 2 (г.) + H 2 O (пар) — 126 кДж (- 30 ккал)Аналогично разлагаются и водные растворы бикарбоната натрия:
2NaHCO 3 (р.) ↔ Na 2 CO 3 (р.) + CO 2 (г.) + H 2 O (пар) — 20,6 кДж (- 4,9 ккал) Водный раствор бикарбоната натрия имеет слабо выраженный щелочной характер, в связи с чем на животные и растительные ткани он не действует. Растворимость гидрокарбоната натрия в воде невелика и с повышением температуры она несколько повышается: с 6,87 г на 100 г воды при 0° С до 19,17 г на 100 г воды при 80° С.
Вследствие небольшой растворимости плотность насыщенных водных растворов бикарбоната натрия сравнительно мало отличается от плотности чистой воды.
Температура кипения (разлагается): 851° C;
Температура плавления: 270° C;
Плотность: 2,159 г/см³;
Растворимость в воде, г/100 мл при 20° C: 9.
Применение.
Двууглекислый натрий (бикарбонат), применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Зарегистрирован в качестве пищевой добавки E500.
Широко примененяется в:
- химической промышленности — для производства красителей, пенопластов и других органических продуктов, фтористых реактивов, товаров бытовой химии, наполнителей в огнетушителях, для отделения двуокиси углерода, сероводорода из газовых смесей (газ поглощается в растворе гидрокарбоната при повышенном давлении и пониженной температуре, раствор восстанавливается при подогреве и пониженном давлении).
- легкой промышленности — в производстве подошвенных резин и искусственных кож, кожевенном производстве (дубление и нейтрализация кож).
- текстильной промышленности (отделка шелковых и хлопчатобумажных тканей). Применение бикарбоната натрия в производстве резиновых изделий также обусловлено выделением CO 2 при нагревании, способствующем приданию резине необходимой пористой структуры.
- пищевой промышленности — хлебопечении, производстве кондитерских изделий, приготовлении напитков.
- медицинской промышленности — для приготовления инъекционных растворов, противотуберкулезных препаратов и антибиотиков.

- металлургии — при осаждении редкоземельных металлов и флотации руд.
Кулинария.
Основное применение питьевой соды — кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), изготовлении кондитерских изделий, производстве газированных напитков и искусственных минеральных вод, самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, в смеси с карбонатом аммония), например, в бисквитном и песочном тесте. Это связано с легкостью ее разложения при 50-100° С.
Пищевая сода, применяемая преимущественно при изготовлении мелкого печенья, кондитерских крошек, листов для тортов и слоеных пирожков. В последнюю четверть XIX в. началось ее применение в кондитерском деле, вначале только во Франции и Германии и лишь в самом конце XIX века и в начале XX столетия — также в России.
Применение соды открыло путь к фабричному производству современного печенья — штамповочного. Вместе с тем многие старые виды печенья — бисквитные, слоеные, битые, пряничные, вздувные, меренги — отошли в область прошлого, исчезли не только из общественного, но и из домашнего обихода.
Вместе с тем многие старые виды печенья — бисквитные, слоеные, битые, пряничные, вздувные, меренги — отошли в область прошлого, исчезли не только из общественного, но и из домашнего обихода.
Сода — необходимый повседневный помощник на кухне для мытья посуды, тары для косервирования, некоторых плодов и ягод перед сушкой. Она обладает свойством нейтрализовать и убивать запахи.
Ошибочно думать, что сода — специя только для кондитерского дела. Помимо кондитерского производства, сода применяется также для приготовления английских мармеладов, в мясные фарши для блюд молдавской, румынской и узбекской кухни (калийная сода) и при приготовлении напитков. Количества соды, вносимые во все перечисленные изделия, крайне малы — от «на кончике ножа» до щепотки и четверти чайной ложки. В напитках с содой доля ее гораздо выше — по половине и полной чайной ложке на литр жидкости. Для кондитерских и других целей соду кладут по предписанию рецептов, обычно это очень малые дозы. Хранят ее в герметичной таре, берут сухим предметом.
Получение соды промышленным способом дало широкие возможности в приготовлении многих видов современной кондитерской продукции в европейских странах. Россия долгое время шла традиционным путем, предпочитая дрожжевое и другие виды теста.
В России совершенно не применяли до второй половины XIX века соду в хлебопечении и кондитерском деле. Да и в самом конце XIX века изделия такого рода производились более всего на Украине и в Польше, а также в Прибалтике. У русского населения, привыкшего испокон веков к натуральным видам теста — либо дрожжевого, заквасочного, либо медово-яичного, где в качестве подъемного средства не применялись искусственные химические вещества, а использовались естественно возникавшие при печении газы, в результате взаимодействия таких продуктов, как мед (сахар), яйца, сметана, алкоголь (водка) или винный уксус, — содовое печенье имело крайне низкую популярность и невысокий спрос.
Кондитерские изделия на соде считались «немецкими» и игнорировались как из чисто кулинарно-вкусовых, так и из «патриотических» соображений.
Кроме того, русские национальные кондитерские изделия — медовые пряники и коврижки, глазированные жемки и вареные в меду орешки — имели столь неповторимо превосходный вкус, что успешно конкурировали с западно-европейскими, более утонченными по форме, но «хлипкими» с точки зрения сытости, добротности и вкуса французскими бисквитами, где привлекательность достигалась вовсе не особым характером теста, а применением экзотических пряностей, в основном ванили.
Кроме кондитерских изделий, сода в русской кухне никогда не применялась и не применяется фактически до сих пор. Между тем в Прибалтике, Молдове, Румынии, на Балканах соду применяют как разрыхляющее средство в ряде блюд, приготавливаемых путем жарения. Так, соду вносят в разнообразные полутестяные жареные блюда: оладьи из картофеля, куда входит и пшеничная мука; разнообразные блинчики, сметанные лепешки и пышки, сырники, приготовленные из сочетания творога и муки, а также в мясные фарши, если они состоят только из мяса и лука, без добавления мучных компонентов (муки, белого хлеба, панировочных сухарей). Такой сырой мясной фарш (говяжий, свиной) оставляют с содовой добавкой на выстойку в холодильнике на несколько часов, а затем легко формуют из этого фарша «сосиски», которые быстро (за 10-15 минут) гриллируют в духовом шкафу любой домашней плиты (газовой, дровяной или электрической).
Такой сырой мясной фарш (говяжий, свиной) оставляют с содовой добавкой на выстойку в холодильнике на несколько часов, а затем легко формуют из этого фарша «сосиски», которые быстро (за 10-15 минут) гриллируют в духовом шкафу любой домашней плиты (газовой, дровяной или электрической).
Аналогичное использование соды в мясные фарши известно и в армянской кухне, с той только разницей, что в таких случаях фарш не выстаивается, а подвергается сразу же интенсивному взбиванию с добавлением нескольких капель (5-8) коньяка, и превращается фактически в мясное суфле, используемое для приготовления различных национальных блюд (в основном калолаков).
В англоязычных странах Европы и Америки (Англии, Шотландии, на Восточном побережье США и в Канаде) соду применяют как непременную добавку в варенье из цитрусовых (апельсинов, пампельмозов, лимонов, грейпфрутов), а также для приготовления цукатов. В результате достигается особая развариваемость цитрусов, их жестких корок, превращение такого варенья в подобие густого мармелада, и одновременно снижается (но не исчезает совсем!) степень неприятной горечи, всегда присутствующей в кожуре цитрусовых плодов.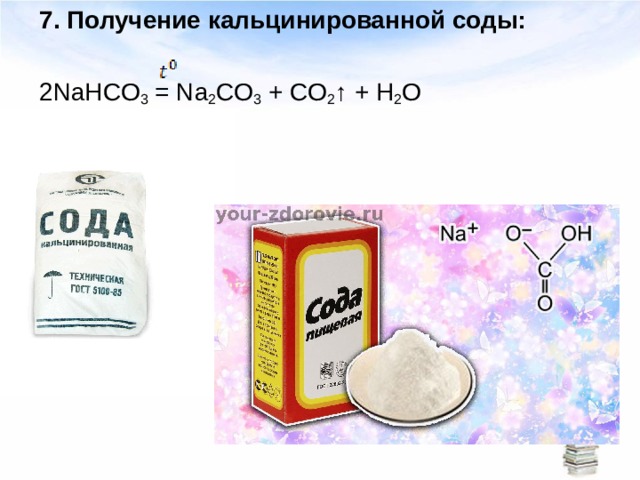 Корки апельсинов, составляющих у нас своего рода балласт, отходы при употреблении этих фруктов, с помощью соды становятся ценным сырьем для получения ароматного, высокопитательного мармелада.
Корки апельсинов, составляющих у нас своего рода балласт, отходы при употреблении этих фруктов, с помощью соды становятся ценным сырьем для получения ароматного, высокопитательного мармелада.
В среднеазиатских кухнях сода применяется при приготовлении некондитерских видов простого теста с целью придать ему особую эластичность и превратить в вытяжное тесто без применения для этого растительного масла, как это принято в южноевропейских, средиземноморских и балканских кухнях. В Средней Азии кусочки простого пресного теста после обычной получасовой выстойки смачивают небольшим количеством воды, в котором растворены 0,5 чайной ложки соли и 0,5 чайной ложки соды, а затем растягивают их руками в тончайшую лапшу (т. н. дунганская лапша), которая обладает нежным, приятным вкусом и идет на приготовление национальных блюд (лагмана, монпара, шимы и др.).
Соду в качестве мизерных добавок к любой пище в процессе приготовления, и именно во время тепловой обработки, добавляют во многих национальных кухнях, учитывая, что это дает в ряде случаев не только неожиданный вкусовой эффект, но и обычно очищает пищевое сырье и все блюдо от различных случайных побочных запахов и привкусов.
Вообще роль соды на кухне, даже помимо кулинарного процесса, — весьма значительна. Ведь без соды практически невозможна идеальная чистка столовой и кухонной эмалированной, фарфоровой, стеклянной и фаянсовой посуды, а также кухонного инструментария и оборудования от посторонних запахов и различных налетов и патины. Особенно незаменима и необходима сода при чистке чайной посуды — заварочных чайников и чашек от образующегося на их стенках чайного налета, пленки.
Столь же необходимо применение соды при мытье посуды, в которой приготавливалась рыба, чтобы отбить рыбный запах. Обычно поступают следующим образом: стойкий рыбный запах отбивают тем, что протирают посуду луком, а затем уничтожают (смывают) луковый запах, чистя эту посуду содой.
Словом, сода — непременный компонент кухонного производства, и на хорошей кухне без нее нельзя обойтись. Более того, ее отсутствие в арсенале повара или хозяйки немедленно становится заметным, ибо оно связывает того, кто работает у плиты или за разделочным столом, во многих его действиях.
Современные экологические обстоятельства вызвали еще одно новое применение соды на кухне как средства, повышающего качество овощного сырья. Можно, например, рекомендовать обмывать все обработанные, но еще не нарезанные овощи — перед их закладкой в котел или на сковородку — в растворе соды в воде. Или засыпать одной-двумя чайными ложками соды уже очищенный картофель, залитый холодной водой и предназначенный для отваривания или приготовления пюре. Это не только очистит картофель от химикатов, которые использовались при его выращивании, но и сделает сам продукт светлее, чище, красивее, снимет все побочные запахи, приобретенные при транспортировке или неправильном хранении, а также порче. Сам картофель станет после готовности рассыпчатым, вкусным. Таким образом, применение соды до приготовления, при холодной обработке (затем продукт тщательно промывается холодной водой), способно повысить качество овощного пищевого сырья, в частности у крахмалосодержащих овощей, у корнеплодов и листовых культур (капусты, салатов, шпината, петрушки и т. д.).
д.).
Сода столь прочно заняла место щелочного агента, что до сих пор ничем не удалось сдвинуть ее с этой позиции. Пищевая сода как разрыхлитель может действовать двояко. Во-первых, она разлагается при нагревании по реакции:
2NaHCO 3 (сода) → Na 2 CO 3 (соль) + H 2 O (вода) + CO 2 (углекислый газ).
И в этом случае, если добавить в песочное тесто излишнее количество соды, за небольшое время выпечки она может не успеть термически разложиться без остатка и печенье или кекс получат неприятный «содовый» привкус.
Точно так же, как и поташ, сода реагирует с кислотами, содержащимися в тесте или добавленными туда искусственно:
NaHCO 3 (сода) + R-COOH (кислота) → R-COONa (соль) + H 2 O (вода) + CO 2 (углекислый газ)
Множество различных фирменных пакетиков и их доступность не отменяют развлечения для юных химиков — самостоятельно изготовить порошок для выпечки.
пропорциональный состав такого традиционного порошка:
2 части кислой виннокаменной соли,
1 часть пищевой соды,
1 часть крахмала или муки.
Медицина.
Как выглядит сода, прекрасно знают все — это белый порошок, который впитывает воду и отлично в ней растворяется. Но мало кто знает об удивительных целебных свойствах этого «простого» вещества. Между тем, сода — гидрокарбонат натрия — один из главных ингредиентов нашей крови. Результаты исследования влияния соды на организм человека превзошли все ожидания. Оказалось, что сода способна выравнивать кислотно-щелочное равновесие в организме, восстанавливать обмен веществ в клетках, улучшать усвоение кислорода тканями, а также препятствовать потере жизненно необходимого калия. Помогает сода при изжоге, при морской болезни, при простудах, при сердечных заболеваниях и головных болях, при кожных заболеваниях. Как видите, сода — лекарство первой помощи.
Раствор питьевой соды используется в качестве слабого антисептика для полосканий, а также как традиционное кислотонейтрализующее средство от изжоги и болей в желудке (современная медицина не рекомендует применять из-за побочных эффектов, в том числе, из-за «кислотного рикошета») или для устранения ацидоза и т. п.
п.
Пищевая сода применяется для лечения заболеваний, связанных с повышенной кислотностью; раствор питьевой соды применяется для полоскания горла, для промывания кожи при попадании кислот.
Бикарбонат натрия (пищевая сода) может замедлять развитие хронического заболевания почек. К такому выводу пришли ученые из Королевской клиники Лондона (Royal London Hospital), Великобритания. Они исследовали 134 человека с запущенным хроническим заболеванием почек и метаболическим ацидозом.
Одна группа испытуемых проходила обычное лечение, а вторая помимо традиционного лечения ежедневно получала небольшое количество пищевой соды в виде таблеток. У тех больных, кто пил бикарбонат натрия, функции почек ухудшались на 2/3 медленнее, чем у прочих.
Быстрое прогрессирование заболевания почек наблюдалось только у 9% подопытных из «содовой группы» против 45% испытуемых, лечившихся традиционно. Кроме того, у принимавших соду реже развивалась терминальная стадия почечной недостаточности, которая требует диализа. Примечательно, что повышение содержания бикарбоната натрия в организме не вызывало у больных повышения кровяного давления.
Примечательно, что повышение содержания бикарбоната натрия в организме не вызывало у больных повышения кровяного давления.
Cода является недорогим и эффективным средством лечения хронического заболевания почек. Однако исследователи предостерегают: прием соды должен проходить под наблюдением врача, который должен правильно рассчитать дозировку для больного.
Лечебные свойства пищевой соды.
Раньше гидрокарбонат натрия применялся очень широко (как и другие щелочи) в качестве антацидного средства при повышенной кислотности желудочного сока, язвенной болезни желудка и 12-типерстной кишки. При приеме внутрь пищевая сода быстро нейтрализует соляную кислоту желудочного сока и оказывает выраженный антацидный эффект. Однако применение соды заключается не только в блестяще отмытой посуде и избавлении от изжоги. Пищевая сода занимает достойное место в домашней аптечке.
Как и древние египтяне, получавшие природную соду из озерных вод методом выпаривания, люди использовали и другие свойства соды.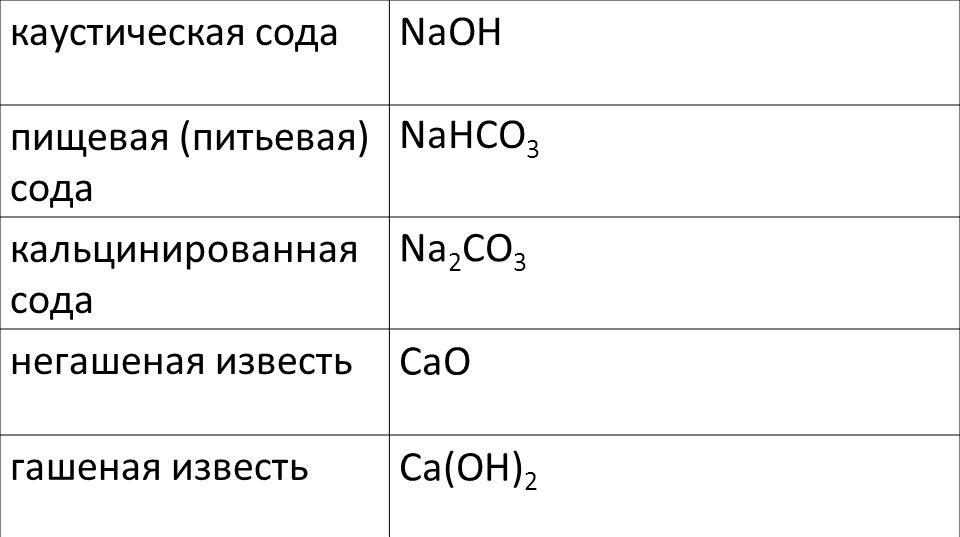 Она обладает нейтрализующими качествами, используется в медицинской практике для лечения гастритов с повышенной кислотностью. Способна убивать микробов, используется как дезинфицирующее средство: соду применяют для ингаляций, полосканий, очищения кожи.
Она обладает нейтрализующими качествами, используется в медицинской практике для лечения гастритов с повышенной кислотностью. Способна убивать микробов, используется как дезинфицирующее средство: соду применяют для ингаляций, полосканий, очищения кожи.
Широкое применение сода имеет и в здравохранении.
Профилактика кариеса.
Кислоты, образующиеся во рту в результате жизнедеятельности бактерий, разрушают эмаль зубов. Эти кислоты можно нейтрализовать, несколько раз в день полоща рот раствором пищевой соды. Можно поступить иначе: смочите зубную щетку водой, опустите ее в соду и почистите зубы. Сода, кроме того, оказывает легкое абразивное действие: она отполирует зубы, не повреждая эмали.
От неприятного запаха ног.
Добавленная в воду для ножной ванны сода нейтрализует выделяемые бактериями кислоты, которые и придают ногам неприятный запах. Сода поможет также устранить резкий запах пота под мышками.
При укусах насекомых.
Не расчесывайте до крови укусы комаров и прочих кровососов. Лучше приготовьте кашеобразную смесь из воды и соды и нанесите на место укуса. Содовая кашица облегчит также зуд, вызванный ветряной оспой или контактом кожи с борщевиком, крапивой.
Лучше приготовьте кашеобразную смесь из воды и соды и нанесите на место укуса. Содовая кашица облегчит также зуд, вызванный ветряной оспой или контактом кожи с борщевиком, крапивой.
При опрелостях.
Содовые примочки значительно улучшают состояние малышей с опрелостями. Они уменьшают зуд и ускоряют заживление кожи.
При цистите.
Болезнетворные бактерии живут в мочевом пузыре в слегка кислой среде. Если ваш мочевой пузырь пал жертвой инфекции, идеальный послеобеденный напиток для вас — шипучий коктейль из пищевой соды с водой.
При солнечных ожогах.
Добавьте в теплую ванну немного пищевой соды: она смягчит воду, превратив ее в успокаивающую примочку для раздраженной кожи.
От боли в горле.
Размешайте 0,5 чайн. ложки соды в стакане воды и каждые 4 часа полощите горло приготовленным раствором: он нейтрализует кислоты, вызывающие боль. Полоскание таким раствором рта поможет снять и воспаление слизистой ротовой полости.
От неприятного запаха изо рта.
В сочетании с перекисью водорода пищевая сода дает мощный окислительный эффект и разрушает бактерии, порождающие неприятный запах во рту. Добавьте 1 стол. ложку соды в стакан раствора перекиси водорода (2-3%) и прополощите рот.
При простуде.
Полезно делать ингаляцию. Для этого можно взять небольшой чайник, вскипятить в нем 1 стакан воды с 1 чайн. ложкой соды. Сделать из твердой бумаги трубочку, надеть ее на носик чайника и вдыхать пар в течение 10-15 минут. Данная ингаляция очень помогает для отделения мокроты.
Для отхаркивания вязкой мокроты 2 раза в день выпивать натощак по 1/2 стакана теплой воды, в которой растворены 0,5 чайн. ложки соды и щепотка соли.
При частых мигренях.
Каждый день принимать раствор кипяченой воды с пищевой содой. В 1-й день за 30 минут до обеда выпивать 1 стакан раствора (0,5 чайн.ложки соды + вода), 2-й день — 2 стакана и т.д., доведя до 7 стаканов. После уменьшать дозу в обратном порядке.
Прочее.
При ринитах, стоматитах, ларингитах, конъюнктивитах применяют 0,5-2% раствор соды.
Для обеззараживания слизистой оболочки рта полезно полоскать рот некрепким раствором (сода — 85 г, соль — 85 г, мочевина — 2,5 г) после еды.
Средство от курения: полоскать рот раствором пищевой соды (1 столовая ложка на 200 мл воды).
При сухости кожи, сухих дерматитах, ихтиозе и псориазе полезны лечебные ванны (сода — 35 г, карбонат магнезии — 20 г, перборат магния — 15 г). Температура воды должна быть не выше 38-39° С, сначала нужно садиться просто в теплую ванну, потом постепенно увеличивать температуру. Длительность ванны 15 минут.
Пожаротушение.
Гидрокарбонат натрия входит в состав порошка, применяемого в порошковых системах пожаротушения, утилизируя тепло и оттесняя кислород от очага горения выделяемым углекислым газом.
Очистка оборудования. Технология абразиво-струйной очистки (АСО).
Производится очистка оборудования и поверхностей от различных покрытий и загрязнений с применением технологии абразиво-струйной очистки (АСО) оборудования. В качестве абразива используется бикарбонат натрия (пищевая сода, двууглекислый натрий, гидрокарбонат натрия, NaHCO 3 , кислый углекислый натрий).
Технология АСО с применением бикарбоната натрия — это новый эффективный способ очистки оборудования с помощью «мягкого» абразива. Абразив приведен в движение сжатым воздухом, производимым компрессором. Этот способ получил коммерческое признание и широко используется в Европе и США уже в течение 25 лет благодаря своей универсальности и экономической целесообразности.
Обработка поверхности оборудования подобна обычной пескоструйной очистке. Различие заключается в том, что частицы соды являются «мягким» абразивным материалом, то есть не повреждают саму поверхность.
Принцип:
Хрупкая частица кислого углекислого натрия при соприкосновении с очищаемой поверхностью взрывается.
Энергия, выпущенная этой вспышкой, и удаляет загрязнение от очищаемой поверхности. Абразивные частицы соды полностью разбиваются в тонкую пыль, которая легко разлетается в разные стороны перпендикулярно падению, увеличивая очистительный эффект. В целях пылеподавления содо-струйная очистка оборудования обычно выполняется с применением увлажнения, то есть гидро-абразиво-струйной очистки (ГАСО) оборудования. Углекислый натрий растворяется в воде. Поэтому использованный абразив будет растворен или может смываться после окончания чистки.
Углекислый натрий растворяется в воде. Поэтому использованный абразив будет растворен или может смываться после окончания чистки.
Это отличие от кварцевого песка, который срезает покрытие. Кварцевый песок также еще стирает часть очищаемой поверхности, которую сода оставляет фактически невредимой. Существует еще много различий между этими видами очистки оборудования, но они являются уже следствием свойств абразивов.
Растворимые абразивы на основе бикарбоната натрия специально разработаны для абразиво-струйной очистки оборудования. Сыпучие качества абразивов уменьшают плотность потока, связанную с плохой текучестью обычного углекислого натрия.
Технологии производства соды.
Сода впервые была получена в 1793 г. Лебланком, однако пищевая, очищенная сода была изготовлена в 1861 г. Сольвэ.
В конце XVIII и начале XIX в. для получения искусственной соды стали применять способ Леблана, сущность которого заключается в следующем: из поваренной соли действием на нее серной кислотой вначале получали сульфат натрия, затем сульфат натрия сплавляли при высокой температуре с углекислым кальцием и углем. Из полученного сплава соду выщелачивали водой. Раствор затем выпаривали.
Из полученного сплава соду выщелачивали водой. Раствор затем выпаривали.
Изобретение бельгийским ученым Э. Сольвэ в середине XIX столетия аммиачного способа получения соды способствовало интенсивному ее внедрению в первую очередь в кондитерское дело. Основной способ искусственного получения соды в настоящее время во всех странах — аммиачный способ производства кальцинированной соды, являющейся материалом для получения остальных содовых продуктов. Сначала Франция и Германия использовали соду как технологическую добавку для разрыхления теста с целью увеличения его объема, улучшения качества. Сода делает тесто мягким, пышным, легко усвояемым. С конца XIX-начала XX века соду стали применять другие страны, в том числе Россия.
Добывают соду сейчас промышленным аммиачным способом (способ Сольве).
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH 4 HCO 3:
NH 3 + CO 2 + H 2 O + NaCl → NaHCO 3 + NH 4 Cl.
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20° C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140 — 160° C, при этом он переходит в карбонат натрия:
2NaHCO 3 →(t) Na 2 CO 3 + CO 2 + H 2 O
Образовавшийся диоксид углерода и аммиак, выделенный из маточного раствора на первой стадии процесса по реакции:
2NH 4 Cl + Ca(OH) 2 → CaCl 2 + 2NH 3 + 2H 2 O возвращают в производственный цикл.
Аммонизация раствора необходима для введения в него углекислого газа, малорастворимого в насыщенном растворе. Выпавший в виде кристаллов бикарбонат натрия отфильтровывают от раствора, содержащего хлористый аммоний и непрореагировавший NaCl, и прокаливают (кальцинируют). При этом происходит образование кальцинированной соды.
Выделяющиеся при кальцинации газы, содержащие углекислоту СO 2 , используют для карбонизации. Таким образом, часть затраченной углекислоты регенерируется.
Необходимую для процесса углекислоту получают обжигом известняка или мела. Обожженную известь СаО гасят водой.
Обожженную известь СаО гасят водой.
Гашеная известь Са(ОН) 2 замешивается с водой. Образовавшееся известковое молоко используют для регенерации аммиака из раствора (фильтровой жидкости), полученного после отделения бикарбоната и содержащего хлористый аммоний.
Для производства соды используют раствор поваренной соли (рассол) концентрации около 310 г/л, полученный в естественных условиях подземным выщелачиванием залежей поваренной соли. В естественном рассоле, помимо NaCl, обычно содержатся соли кальция и магния. При аммонизации и карбонизации рассола в результате взаимодействия этих примесей с NH 3 и СО 2 будут выпадать осадки, что приведет к загрязнению аппаратов, нарушению теплообмена и нормального хода процесса. Поэтому рассол предварительно очищают от примесей: осаждают их, добавив к рассолу строго определенное количество реактивов — суспензии соды в очищенном рассоле и известкового молока. Этот способ очистки называется содово-известковым. Выпавшие при этом осадки гидрата магния и карбоната кальция отделяют в отстойниках.
Очищенный и осветленный рассол поваренной соли направляют в барботажную абсорбционную колонну. Верхняя часть колонны служит для промывки рассолом газа, отсасываемого вакуум-насосом из вакуум-фильтров, и газа из карбонизационных колонн. В этих газах содержится небольшое количество аммиака и углекислоты, которые целесообразно отмыть свежим рассолом и, таким образом, более полно использовать их в производстве. Нижняя часть колонны служит для насыщения рассола аммиаком, поступающим из дистилляционной колонны. Полученный аммиачно-соляной рассол далее направляют в барботажную карбонизационную колонну, где происходит основная реакция превращения исходного сырья в бикарбонат натрия. Необходимая для этой цели углекислота СO 2 поступает из шахтной известково-обжигательной печи и печи кальцинации бикарбоната натрия и нагнетается снизу в колонну.
Карбонизация аммиачно-соляного рассола является важнейшей стадией производства соды. Образование бикарбоната натрия при карбонизации происходит в результате протекания в карбонизационной колонне сложных химических процессов. В верхней части колонны идет образование углекислого аммония из аммиака, содержащегося в рассоле, и углекислоты, подаваемой в колонну.
В верхней части колонны идет образование углекислого аммония из аммиака, содержащегося в рассоле, и углекислоты, подаваемой в колонну.
По мере прохождения рассола в колонне сверху вниз углекислый аммоний, реагируя с избытком углекислоты, поступающей снизу колонны, переходит в двууглекислый аммоний (бикарбонат аммония).
Примерно в середине верхней неохлаждаемой части колонны начинается реакция обменного разложения, сопровождающаяся выпадением кристаллов бикарбоната натрия и образованием в растворе хлористого аммония.В средней части колонны, где идет образование кристаллов бикарбоната натрия за счет экзотермичности реакции, температура рассола несколько повышается (до 60 — 65° C), однако охлаждать его не надо, так как такая температура способствует формированию более крупных хорошо фильтрующихся кристаллов бикарбоната натрия. Внизу колонны охлаждение необходимо для уменьшения растворимости бикарбоната натрия и увеличения его выхода.В зависимости от температуры, содержания NaCl в рассоле, степени насыщения его аммиаком и углекислотой и других факторов выход бикарбоната составляет 65-75%. Практически невозможно полное превращение поваренной соли в осадок бикарбоната натрия. В этом заключается один из существенных недостатков производства соды аммиачным методом.
Практически невозможно полное превращение поваренной соли в осадок бикарбоната натрия. В этом заключается один из существенных недостатков производства соды аммиачным методом.
Способы производства бикарбоната натрия.
Бикарбонат натрия выступает промежуточным продуктом промышленного получения кальцинированной соды по методу Сольве, предусматривающему пропускание через насыщенный раствор хлорида натрия эквимолярных (т.е. содержащих равные количества молей) количеств газообразных аммиака и диоксида углерода, что имитирует ввод в систему гидрокарбоната аммония NH 4 HCO 3:
NH 3 + H 2 O + CO 2 + NaCl / NH 4 HCO 3 → NaHCO 3 + NH 4 Cl.
В образующемся растворе наименее растворимой солью является бикарбонат натрия, который выпадает в виде кристаллического осадка. При этом важно отметить, что товарным видом данной продукции выступает очищенный двууглекислый натрий.
Наиболее широко распространенным способом очистки солей от примесей в общем случае выступает их перекристаллизация из растворов, причем в качестве растворителя наиболее часто используется вода. В основе данного способа лежит свойство большинства солей увеличивать растворимость при повышении температуры.
В основе данного способа лежит свойство большинства солей увеличивать растворимость при повышении температуры.
Согласно методу перекристаллизации, очищаемая соль растворяется в воде при высокой температуре, после чего раствор доводится до насыщенияч, а затем охлаждается, причем началу последнего из перечисленных процессов предшествует удаление нерастворенных примесей посредством фильтрации. В ходе же охлаждения раствора растворимость соли уменьшается, она выпадает в осадок и отфильтровывается. Вследствие предпринимаемых мер чистота соли повышается, поскольку все примеси, входящие в ее состав до осуществления процесса, растворяются в воде и переходят в фильтрат, представляющий собой маточную жидкость, возвращаемую на начальную стадию. По мере циркуляции маточной жидкости в ней накапливаются примеси, что в конечном счете негативно отражается на чистоте получаемой продукции и обуславливает необходимость периодического вывода из цикла части фильтрата.
Однако в том случае, если соль, подобно бикарбонату натрия, плохо растворима в воде, очищать ее методом перекристаллизации представляется экономически невыгодным, так как в системе для получения единицы массы чистого продукта должно циркулировать большое количество маточной жидкости, требующей попеременного нагревания и охлаждения. В связи с этим обстоятельством в промышленных масштабах очищенную пищевую соду получают не методом перекристаллизации, но карбонизацией содового раствора путем пропускания диоксида углерода под давление в насыщенном растворе карбоната натрия при температуре около 75° С согласно реакции:
В связи с этим обстоятельством в промышленных масштабах очищенную пищевую соду получают не методом перекристаллизации, но карбонизацией содового раствора путем пропускания диоксида углерода под давление в насыщенном растворе карбоната натрия при температуре около 75° С согласно реакции:
Na 2 CO 3 (р.) + CO 2 (г.) + H 2 O (ж.) ↔ 2NaHCO 3 (тв.) + 52,4 кДж (+ 12,5 ккал).
Практическое применение метода карбонизации позволяет значительно сократить объем жидкости, необходимой для получения единицы бикарбоната натрия, поскольку растворимость кальцинированной соды в несколько раз превышает соответствующий показатель гидрокарбоната натрия.
Содовый раствор для карбонизации получается путем растворения в воде твердой технической соды, образующейся при кальцинации сырого бикарбоната (этот процесс носит название «сухого» способа) или же разложением двууглекислого натрия в водной среде при нагревании («мокрый» способ), которое называется декарбонизацией, согласно реакции:
2NaHCO 3 (р. ) ↔ Na 2 CO 3 (р.) + CO 2 (г.) + H 2 O (пар) — 20,6 кДж (- 4,9 ккал).
) ↔ Na 2 CO 3 (р.) + CO 2 (г.) + H 2 O (пар) — 20,6 кДж (- 4,9 ккал).
Выпадающая при насыщении содового раствора диоксидом углерода чистая пищевая сода отделяется, а маточная жидкость, содержащая смесь карбоната и бикарбоната натрия, а также растворенных примесей (например, NaCl), возвращается в начало процесса для получения исходного раствора. Вследствие многократной циркуляции маточной жидкости в ней накапливаются примеси, способные засорить очищенный продукт. В результате этого часть маточной жидкости выводится из цикла и направляется в общем случае на рассолоочистку с целью разбавления крепкого содового раствора.
Натрий углекислый [Карбонат натрия] [Техническая кальцинированная сода]
Технологии
Технология очистки воды
К химическим способам обеззараживания питьевой воды относят ее обработку окислителями: хлором, озоном и т. п., а также ионами тяжелых металлов.
Подробнее
Прогноз погоды
| Астана | |
| Костанай | +2.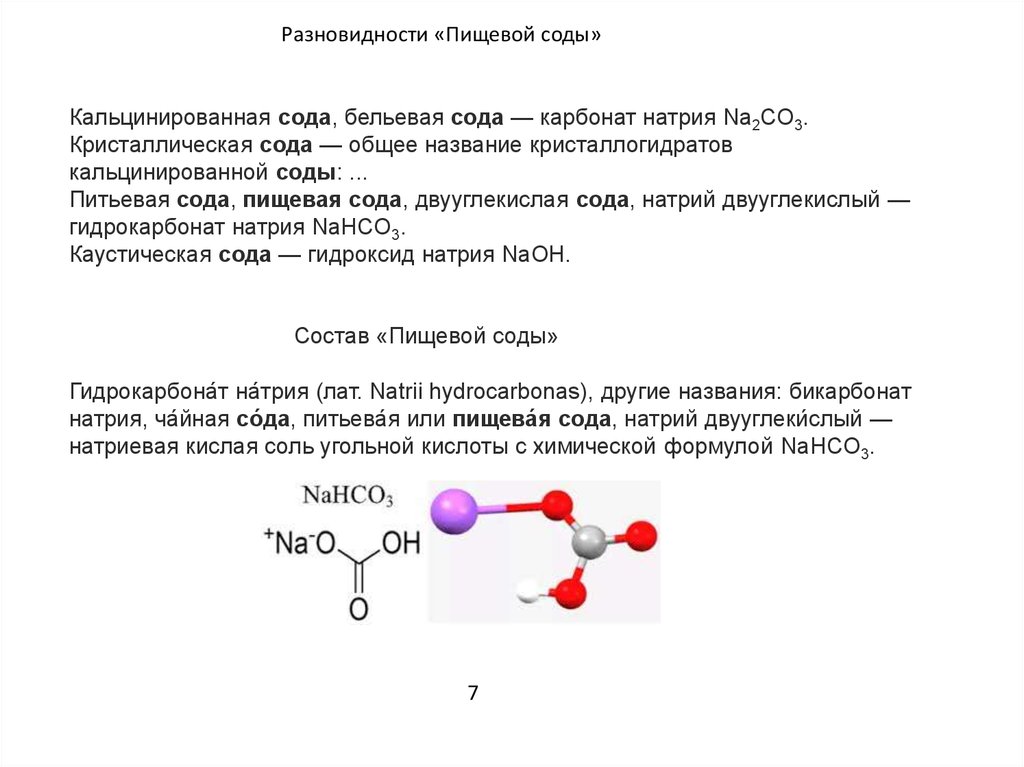 .+4 .+4 |
| Караганда |
Курсы валют
| USD | 332.6 |
| EU | 388.8 |
| RU | 5.5 |
Формула: Na2CO3
ГОСТ 5100-85
Техническая кальцинированная сода:
А — Гранулы белого цвета, Б — Порошок белого цвета.
Область применения:
Техническая кальцинированная сода (натрий углекислый, карбонат натрия) предназначается для химической, стекольной, электронной, целлюлозно-бумажной и других отраслей промышленности и поставки на экспорт. В зависимости от назначения технический натрий углекислый должен изготовляться марок А и Б. Продукт марки А используется для производства электровакуумного стекла и других целей, марки Б – в химической, стекольной и других отраслях промышленности.
Техническая характеристика:
| № | Наименование показателя | Норма для марки и сорта | |||||
|---|---|---|---|---|---|---|---|
| А | Б | ||||||
| Выс- ший | Первый | Второй | Высший | Первый | Второй | ||
| 1 | Массовая доля углекислого натрия, %, не менее | 99,4 | 99,0 | 98,5 | 99,4 | 99,0 | 99,0 |
| 2 | Массовая доля углекислого натрия в пересчете на непрокаленный продукт, %, не менее | 98,7 | 98,2 | 97,0 | 98,9 | 98,2 | 97,5 |
| 3 | Массовая доля потери при прокали-вании при 270-300°С, %, не более | 0,7 | 0,8 | 1,5 | 0,5 | 0,8 | 1,5 |
| 4 | Массовая доля хлоридов в пересчете на NaCl, %, не более | 0,2 | 0,5 | 0,8 | 0,4 | 0,5 | 0,8 |
| 5 | Массовая доля железа в пересчете на Fe2O3, %, не более | 0,003 | 0,005 | 0,008 | 0,003 | 0,003 | 0,008 |
| 6 | Массовая доля не растворимых в воде веществ, %, не более | 0,04 | 0,04 | 0,08 | 0,03 | 0,04 | 0,08 |
| 7 | Массовая доля сульфатов в пересчете на Na2SO4, %, не более | 0,04 | 0,05 | — | 0,04 | 0,05 | — |
| 8 | Насыпная плотность, г/см, не менее | 1,1 | 0,9 | 0,9 | — | — | — |
| Гранулометрический состав: | |||||||
| остаток на сите с сеткой № 2К по ГОСТ 6613-86, %, не более | — | 5 | 5 | — | — | — | |
| прохождение через сито с сеткой № 1, 25К по ГОСТ 6613-86, %, не более | 100 | — | — | — | — | — | |
| остаток на сите с сеткой № 1К по ГОСТ 6613-86, %, не более | 3 | — | — | — | — | — | |
| прохождение через сито с сеткой № 01К, 25К по ГОСТ 6613-86, %, неболее | 7 | 15 | 25 | — | — | — | |
| Магнитные включения размером более 0,25 мм | Отсут | — | — | — | — | — | |
Примечание
| |||||||
Упаковка
Натрий углекислый марки А упаковывают в мягкие специализированные контейнеры разового использования, в четырех-, пятислойные бумажные мешки
Транспортирование:
Натрий углекислый, упакованнный в мешки, транспортируют всеми видами транспорта в крытых транспортных средствах. Транспортирование упакованного продукта по железной дороге осуществляется повагонными отправками. По согласованию с потребителем продукт марки А транспортируют в специальных вагонах (содовозах, сажевозах, цементовозах). Продукт марки Б насыпью транспортируют в специальных вагонах и автомобилях (содовозах, сажевозах, цементовозах), а также в крытых вагонах. Мягкие специализированные контейнеры по железной дороге транспортируют в полувагонах и крытых вагонах.
Хранение:
Натрий углекислый хранят в закрытых складских помещениях, силосах, бункерах, предохраняя продукт от попадания влаги.
Гарантийный срок хранения продукта продукта марки А – 3 месяца, марки Б – 6 месяцев со дня изготовления, продукта, упакованного в мягкие специализированные контейнеры – 5 лет со дня изготовления.
Требования безопасности:
Натрий углекислый пожаро- и взрывобезопасен, по степени воздействия на организм относится к веществам 3-го класса опасности.
продукция
Хлорная известь
Хлор жидкий в контейнерах
Каустическая сода
Гипохлорит кальция
Оксихлорид алюминия
Пищевая сода | Encyclopedia.com
Фон
Пищевая сода представляет собой белый кристаллический порошок (NaHCO 3 ), более известный химикам как бикарбонат натрия, бикарбонат соды, гидрокарбонат натрия или кислый карбонат натрия. Он классифицируется как кислая соль, образованная соединением кислоты (угольной) и основания (гидроксида натрия), и реагирует с другими химическими веществами как мягкая щелочь. При температуре выше 300 градусов по Фаренгейту (149 градусов по Цельсию) пищевая сода разлагается на карбонат натрия (более стабильное вещество), воду и углекислый газ.
При температуре выше 300 градусов по Фаренгейту (149 градусов по Цельсию) пищевая сода разлагается на карбонат натрия (более стабильное вещество), воду и углекислый газ.
Природные химические и физические свойства пищевой соды объясняют ее широкий спектр применения, включая очистку, дезодорирование, буферизацию и пожаротушение. Пищевая сода химически нейтрализует запахи, а не маскирует или поглощает их. Следовательно, он используется в солях для ванн и дезодорантах для тела. Пищевая сода имеет тенденцию поддерживать pH 8,1 (7 — нейтральное значение), даже когда к раствору добавляют кислоты, которые снижают pH, или основания, которые повышают pH. Его способность к таблетированию делает его хорошим шипучим ингредиентом в антацидах и средствах для чистки зубных протезов. Бикарбонат натрия также содержится в некоторых средствах для полоскания рта против зубного налета и зубной пасте. Когда пищевая сода используется в качестве чистящего средства в виде пасты или высушивается на влажной губке, ее кристаллическая структура обеспечивает мягкое истирание, которое помогает удалить грязь, не царапая чувствительные поверхности. Его мягкая щелочность превращает жирные кислоты, содержащиеся в грязи и жире, в форму мыла, которое можно растворить в воде и легко смыть. Пищевая сода также используется в качестве разрыхлителя при приготовлении выпечки, такой как хлеб или блины. При сочетании с кислотным средством (например, лимонным соком) выделяется углекислый газ, который поглощается клетками продукта. Когда газ расширяется во время выпекания, стенки ячеек также расширяются, создавая дрожжевой продукт.
Его мягкая щелочность превращает жирные кислоты, содержащиеся в грязи и жире, в форму мыла, которое можно растворить в воде и легко смыть. Пищевая сода также используется в качестве разрыхлителя при приготовлении выпечки, такой как хлеб или блины. При сочетании с кислотным средством (например, лимонным соком) выделяется углекислый газ, который поглощается клетками продукта. Когда газ расширяется во время выпекания, стенки ячеек также расширяются, создавая дрожжевой продукт.
В дополнение к многочисленным бытовым применениям, пищевая сода также имеет множество промышленных применений. Например, пищевая сода при нагревании выделяет углекислый газ. Поскольку углекислый газ тяжелее воздуха, он может подавлять пламя, не пропуская кислород, что делает бикарбонат натрия полезным агентом в огнетушителях . Другие области применения включают контроль загрязнения воздуха (поскольку он поглощает выбросы диоксида серы и других кислых газов), абразивно-струйную очистку для удаления поверхностных покрытий, химическое производство, дубление кожи, растворы для бурения нефтяных скважин (поскольку он осаждает кальций и действует как смазка), производство резины и пластика, производство бумаги, обработка текстиля и очистка воды (поскольку это снижает уровень свинца и других тяжелых металлов).
Импортированная из Англии пищевая сода впервые использовалась в Америке в колониальные времена, но не производилась в Соединенных Штатах до 1839 года. В 1846 году Остин Черч, врач из Коннектикута, и Джон Дуайт, фермер из Массачусетса, основали завод в Нью-Йорке по производству пищевой соды. Сын доктора Черча, Джон, владел мельницей под названием Vulcan Spice Mills. Вулкан, римский бог кузни и огня, был представлен рукой и молотом, и новая компания по производству пищевой соды приняла логотип руки и молота как свой собственный. Сегодня торговая марка пищевой соды Arm & Hammer является одной из самых широко известных торговых марок.
Названный в честь Николя Леблана, французского химика, который изобрел его, процесс Леблана был самым ранним способом производства соды.
зола (Na 2 CO 3 ), из которой получают бикарбонат натрия. Хлорид натрия (поваренную соль) нагревали с серной кислотой, получая сульфат натрия и соляную кислоту. Затем сульфат натрия нагревали с углем и известняком с образованием карбоната натрия или кальцинированной соды.
В конце 1800-х годов Эрнест Сольве, бельгийский инженер-химик, разработал еще один метод производства кальцинированной соды. Метод Сольвея вскоре был адаптирован в Соединенных Штатах, где он заменил метод Леблана. В процессе Сольве углекислый газ и аммиак переходят в концентрированный раствор хлорида натрия. Неочищенный бикарбонат натрия выпадает в осадок и нагревается с образованием кальцинированной соды, которую затем дополнительно обрабатывают и очищают с образованием бикарбоната натрия 9.0023 Фарнакопей США (USP) чистоты.
Хотя этот метод производства кальцинированной пищевой соды широко используется, он также проблематичен, поскольку химические вещества, используемые в процессе, являются загрязняющими веществами и вызывают проблемы с утилизацией. Альтернативой является переработка кальцинированной соды из троновой руды, природного месторождения.
Сырье
Пищевая сода, или бикарбонат натрия, производится из кальцинированной соды, полученной либо с помощью процесса Solvay, либо из троновой руды, твердого кристаллического материала. История Троны насчитывает 50 миллионов лет, когда земля, окружающая Грин-Ривер, штат Вайоминг, была покрыта озером площадью 600 квадратных миль (1554 квадратных километра). Со временем это озеро испарилось, и между слоями песчаника и сланца осталось 200 миллиардов тонн чистой троны. Месторождений в бассейне Грин-Ривер достаточно велико, чтобы удовлетворить мировые потребности в кальцинированной соде и бикарбонате натрия на тысячи лет.
История Троны насчитывает 50 миллионов лет, когда земля, окружающая Грин-Ривер, штат Вайоминг, была покрыта озером площадью 600 квадратных миль (1554 квадратных километра). Со временем это озеро испарилось, и между слоями песчаника и сланца осталось 200 миллиардов тонн чистой троны. Месторождений в бассейне Грин-Ривер достаточно велико, чтобы удовлетворить мировые потребности в кальцинированной соде и бикарбонате натрия на тысячи лет.
Поскольку синтетический процесс, используемый в методе Solvay, создавал некоторые проблемы с загрязнением окружающей среды, компания Church & Dwight Co. Inc. все больше и больше основывает свое производство на добыче троны. Другой крупный производитель кальцинированной соды, FMC Corporation, также использует трону для производства кальцинированной соды и бикарбоната натрия. Трона добывается на глубине 1500 футов (457,2 метра) под поверхностью. Шахтные стволы FMC содержат почти 2500 миль (4022,5 км) туннелей и покрывают 24 квадратных мили (62 квадратных километра). Пятнадцать футов (4,57 метра) в ширину и девять футов (2,74 метра) в высоту, эти туннели позволяют проходить через них необходимому оборудованию и транспортным средствам.
Пятнадцать футов (4,57 метра) в ширину и девять футов (2,74 метра) в высоту, эти туннели позволяют проходить через них необходимому оборудованию и транспортным средствам.
Производственный процесс
Производство кальцинированной соды
- 1 Кальцинированную соду можно производить химическим путем с использованием процесса Solvay или из троновой руды. Если используется трона руда, ее необходимо сначала добыть. После подъема на поверхность трона руда транспортируется на различные перерабатывающие заводы. Там руда перерабатывается в суспензию сесквикарбоната натрия, промежуточного продукта кальцинированной соды, который фактически содержит как кальцинированную соду (карбонат натрия), так и пищевую соду (бикарбонат натрия).
Приготовление пищевой соды
- 2 Затем промежуточный раствор кальцинированной соды помещают в центрифугу, которая отделяет жидкость от кристаллов. Затем кристаллы растворяют в растворе бикарбоната (раствор кальцинированной соды, изготовленный производителем) во вращающемся диссольвере, в результате чего раствор становится насыщенным.
 Этот раствор фильтруется для удаления любых нерастворимых материалов, а затем перекачивается через питающий резервуар наверх колонны сатурации.
Этот раствор фильтруется для удаления любых нерастворимых материалов, а затем перекачивается через питающий резервуар наверх колонны сатурации. - 3 Очищенный диоксид углерода вводят в нижнюю часть колонны и выдерживают под давлением. Когда насыщенный раствор натрия проходит через колонну, он охлаждается и вступает в реакцию с углекислым газом с образованием кристаллов бикарбоната натрия. Эти кристаллы собирают на дне башни и переносят в другую центрифугу, где отфильтровывают избыток раствора (фильтрата). Затем кристаллы промывают в растворе бикарбоната, образуя лепешеобразное вещество, готовое к сушке. Фильтрат, удаленный из центрифуги, возвращается в роторный диссольвер, где он используется для насыщения большего количества промежуточных кристаллов кальцинированной соды.
- 4 Промытый фильтрационный осадок затем сушат либо на непрерывном ленточном конвейере, либо в вертикальной трубчатой сушилке, называемой мгновенной сушилкой . Теоретический выход процесса, по данным компании Church & Dwight, составляет от 90 до 95 процентов, а производимая пищевая сода имеет чистоту более 99 процентов.

Сортировка и хранение
различных сортов
- 5 Далее высушенные кристаллы бикарбоната натрия разделяют на различные сорта по размеру частиц. Стандартные сорта бикарбоната натрия и специальные сорта производятся в соответствии с конкретными требованиями клиентов, и размер частиц является основным фактором, определяющим сорта. Порошкообразный № 1 и мелкозернистый № 2 широко используются в пищевой, химической и фармацевтической промышленности. Гранулированные сорта № 4 и № 5 встречаются в пищевых продуктах и пончиках, чистящих средствах, фармацевтических препаратах и многих других продуктах. Бикарбонат натрия промышленного качества используется в различных областях, включая растворы для бурения нефтяных скважин, материалы для пожаротушения и водоподготовки.
- 6 Каждый сорт поступает в бункер для выдержки, в котором контролируются атмосфера, углекислый газ и содержание влаги для «отверждения» продукта. После отверждения марки готовы к упаковке и отправке.

Контроль качества
Качество бикарбоната натрия контролируется на каждом этапе производственного процесса. Материалы, оборудование и сам процесс выбираются таким образом, чтобы получать бикарбонат натрия максимально возможного качества. Согласно источникам FMC, когда компания строила заводы, она выбирала материалы и оборудование, которые соответствовали бы строгим требованиям к качеству производства бикарбоната натрия фармацевтического качества. FMC также использует Статистическое управление технологическим процессом (SPC) для поддержания неизменного ежедневного качества, а ключевые рабочие параметры отображаются в виде графиков для поддержания управления технологическим процессом. Параметры качества продукции записываются по номеру партии, и образцы хранятся в течение двух-трех лет.
Все USP марки соответствуют спецификациям Фармакопеи США и Кодекса пищевых химикатов для использования в фармацевтической и пищевой промышленности. Кроме того, пищевой бикарбонат натрия соответствует требованиям, установленным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, как вещество, которое Общепризнанный безопасный (GRAS).
Будущее
На рубеже двадцатого века ежегодно продавалось 53 000 тонн (48 071 метрическая тонна) пищевой соды. В то время как население резко увеличилось, продажи к 1990 году упали примерно до 32 000 тонн (29 024 метрических тонны) в год. Самоподнимающаяся мука и смеси для тортов и печенья снизили спрос на пищевую соду как на важный ингредиент для выпечки. Тем не менее, спрос на продукт по-прежнему значителен. Коммерческие пекари (особенно производители печенья) являются одними из основных пользователей этого продукта. Одним из наиболее важных свойств бикарбоната натрия является то, что при воздействии тепла он выделяет углекислый газ (CO 2 ), который заставляет хлебобулочные изделия подниматься. Бикарбонат натрия также используется в фармацевтической и медицинской промышленности, а также имеет другие промышленные применения. Поэтому он продолжает оставаться важным продуктом для сегодняшнего дня и для будущего.
Где узнать больше
Книги
Койл Л. Патрик-младший Всемирная энциклопедия продуктов питания. Facts on File, 1982.
Патрик-младший Всемирная энциклопедия продуктов питания. Facts on File, 1982.
Рут, Уэверли и Ричард де Рошмон. Еда в Америке: история. William Morrow & Co., Inc., 1976.
Периодические издания и брошюры
Grosswirth, Marvin. «Чудеса NaHCO 3 », Science Digest. Март 1976 г.
История торговой марки Arm & Hammer. Church & Dwight Co., Inc.
Бикарбонат натрия. Корпорация FMC.
Бикарбонат натрия — Химические свойства, производство. Черч энд Дуайт Ко., Инк.
— Ева Сайдман
Пищевая сода и разрыхлитель: в чем разница?
Пищевая сода и разрыхлитель являются разрыхлителями, т.е. веществами, которые помогают подняться хлебобулочным изделиям.
Опытные пекари и любители часто путают их из-за схожих названий и внешнего вида.
В этой статье рассказывается о различиях между пищевой содой и разрыхлителем и о том, как замена одного на другой может повлиять на вашу выпечку.
Пищевая сода — это разрыхлитель, используемый в выпечке, такой как торты, кексы и печенье.
Формально известный как бикарбонат натрия , это белый кристаллический порошок, который по своей природе является щелочным или щелочным (1).
Пищевая сода активируется, когда она смешивается как с кислотным ингредиентом, так и с жидкостью. При активации вырабатывается углекислый газ, благодаря которому выпечка поднимается и становится легкой и пушистой (1).
Вот почему в рецептах, включающих пищевую соду, также указываются кислые ингредиенты, такие как лимонный сок или пахта (2, 3).
РезюмеПищевая сода, известная в химическом отношении как бикарбонат натрия , представляет собой ингредиент для выпечки, который активируется жидкостью и кислотой, помогая разрыхлить или поднять.
В отличие от пищевой соды, разрыхлитель является полноценным разрыхлителем, то есть содержит как основание ( бикарбонат натрия ), так и кислоту, необходимые для подъема продукта.
Кукурузный крахмал также обычно входит в состав разрыхлителя. Он добавляется в качестве буфера для предотвращения активации кислоты и основания во время хранения.
Подобно тому, как пищевая сода реагирует с водой и кислотным ингредиентом, кислота в разрыхлителе реагирует с бикарбонатом натрия и выделяет углекислый газ при смешивании с жидкостью (4).
Доступны разрыхлители одностороннего и двойного действия, хотя разновидности одностороннего действия обычно используются только производителями продуктов питания и обычно недоступны для домашнего использования (5).
Когда в рецепте требуется разрыхлитель, скорее всего, речь идет о разрыхлителе двойного действия.
Это означает, что порошок вызывает две отдельные реакции: сначала при смешивании с жидкостью при комнатной температуре, а затем при нагревании смеси.
Для многих рецептов предпочтительна продолжительная реакция, поэтому заквашивание или подъем не происходит сразу.
РезюмеРазрыхлитель является полноценным разрыхлителем, то есть содержит как бикарбонат натрия , так и кислотный ингредиент.
Он доступен в виде агента одинарного или двойного действия, хотя более широко используются порошки двойного действия.
Пищевая сода используется в рецептах, которые также включают кислые ингредиенты, такие как винный камень, пахта или цитрусовый сок.
И наоборот, разрыхлитель обычно используется, когда в рецепте нет кислого ингредиента, поскольку порошок уже содержит кислоту, необходимую для производства углекислого газа.
Смеси для хлебобулочных изделий могут сильно различаться по уровню кислотности. Чтобы произвести желаемую выпечку, вам нужно найти правильный баланс между кислотой и основанием.
В некоторых рецептах может потребоваться и пищевая сода, и разрыхлитель.
Обычно это происходит потому, что рецепт содержит кислоту, которую необходимо компенсировать пищевой содой, но ее может быть недостаточно для полного заквашивания продукта.
РезюмеПищевая сода используется, когда рецепт включает кислые ингредиенты, тогда как разрыхлитель можно использовать без дополнительных кислых ингредиентов.
Хотя пищевую соду и разрыхлитель можно поменять местами в рецептах, это не так просто, как просто заменить один на другой.
Замена пищевой соды разрыхлителем
Хотя замена пищевой соды разрыхлителем не рекомендуется, вы можете заставить ее работать в крайнем случае.
Замена разрыхлителя на пищевую соду не требует дополнительных ингредиентов.
Однако пищевая сода намного сильнее, чем разрыхлитель. Таким образом, вам, вероятно, потребуется примерно в 3 раза больше порошка, чем соды, чтобы создать такую же способность к подъему.
Кроме того, эта замена может привести к тому, что конечный продукт будет иметь химический или горький вкус.
В качестве альтернативы вы можете попробовать один из нескольких заменителей пищевой соды.
Замена разрыхлителя пищевой содой
Если в вашем рецепте требуется разрыхлитель, а под рукой есть только пищевая сода, вы можете заменить ее, но вам потребуются дополнительные ингредиенты.
Поскольку в пищевой соде отсутствует кислота, которую обычно добавляет в рецепт разрыхлитель, вы должны обязательно добавить кислый ингредиент, например, винный камень, чтобы активировать пищевую соду.
Более того, пищевая сода обладает гораздо более сильным разрыхлителем, чем разрыхлитель.
Как правило, около 1 чайной ложки разрыхлителя эквивалентно 1/4 чайной ложки пищевой соды.
РезюмеХотя замена разрыхлителя и пищевой соды в рецептах не так проста, как замена 1:1, она может работать с некоторыми изменениями в вашем рецепте.
Многие рецепты хорошей выпечки включают пищевую соду или разрыхлитель в качестве разрыхлителя. Некоторые могут даже включать оба.
Хотя оба продукта кажутся похожими, они определенно не одинаковы.
Пищевая сода представляет собой бикарбонат натрия , для активации которого требуется кислота и жидкость, помогающие хлебобулочным изделиям подняться.
И наоборот, разрыхлитель включает бикарбонат натрия , а также кислоту. Для активации ему нужна только жидкость.
Для активации ему нужна только жидкость.
Замена одного на другой возможна при тщательной настройке.
видов, состав, польза и вред для организма
Пищевая сода — это другое название бикарбоната натрия. Формула пищевой соды – NaHCO 3. Вещество представляет собой белый мелкокристаллический порошок с солоноватым вкусом с широким спектром применения. В результате реакции с кислотой формула пищевой соды распадается на карбонат натрия (соль), воду и углекислый газ.
| Пищевая ценность |
|---|
Порция 100 г |
| Количество на порцию |
калорий из жира |
% Дневная стоимость * |
Общий жир 0 г |
Холестерин 0 мг |
Натрий 27360 мг 1140 % |
Калий 0 мг |
Всего углеводов 0 г |
Пищевые волокна 0 г |
Белки 0 г |
* Расчет на дневной рацион 2000 ккал |
Соотношение БЖУ в продукте
Источник: depositphotos. com
com
Как сжечь 0 ккал?
Применение пищевой соды
Применение пищевой соды целесообразно в:
- Пищевая промышленность — производство кондитерских изделий, хлебобулочных изделий, приготовление напитков;
- Химическая промышленность — для производства пенопласта, красителей, бытовой химии, фторреактивов;
- Легкая промышленность — производство искусственной кожи, подошвы из резины, текстиля.
- Лекарство — как средство для снижения кислотности желудочного сока, а также нейтрализации ожогов кожи кислотами.
Кроме того, бикарбонат натрия входит в состав порохов, используемых в сфере пожаротушения — его действие основано на вытеснении кислорода из места возгорания с помощью углекислого газа.
Сода в пищевой промышленности
Основная область применения пищевой соды, безусловно, кулинария. Знакомый с детства порошок используют как дополнительный или основной разрыхлитель в выпечке. Небольшое количество соды (на кончике ложки), добавленное в тесто, сделает выпечку мягче, пышнее и легче усваивается. Чтобы продукт не приобрел характерный для газировки мыльный вкус, необходимо соблюдать правильные пропорции. При добавлении пищевой соды в воду или парное молоко (не кислое) принято гасить продукт уксусом – так из теста исчезает неприятный привкус карбоната натрия. При смешивании соды со сметаной, кефиром или простоквашей гасить пищевую соду не нужно.
Чтобы продукт не приобрел характерный для газировки мыльный вкус, необходимо соблюдать правильные пропорции. При добавлении пищевой соды в воду или парное молоко (не кислое) принято гасить продукт уксусом – так из теста исчезает неприятный привкус карбоната натрия. При смешивании соды со сметаной, кефиром или простоквашей гасить пищевую соду не нужно.
Пищевая сода в медицине
Применение пищевой соды не ограничивается приготовлением пищи: широко распространено применение гидрокарбоната натрия в традиционной и нетрадиционной медицине. Лечение пищевой содой эффективно благодаря способности вещества уничтожать микробы, а также нейтрализовывать действие кислот.
Чтобы избавиться от мучительной изжоги или отрыжки, достаточно размешать чайную ложку соды в 1 стакане воды и выпить залпом.
Пищевая сода применяется при простуде и ангине путем полоскания горла раствором пищевой соды из расчета 1 чайная ложка гидрокарбоната натрия на стакан теплой воды.
Сода незаменима при лечении ожогов. При возникновении ожога смешайте 1 чайную ложку пищевой соды с растительным маслом, нанесите на ватный тампон и приложите к больному месту. Через некоторое время боль уйдет, а рана быстро заживет.
При возникновении ожога смешайте 1 чайную ложку пищевой соды с растительным маслом, нанесите на ватный тампон и приложите к больному месту. Через некоторое время боль уйдет, а рана быстро заживет.
Лечение фурункулов, мозолей и натоптышей пищевой содой проводят с помощью примочек с крепким раствором соды или горячих содовых ножных ванночек.
С целью отказа от курения практикуется полоскание рта густым раствором соды малыми дозами, чтобы не нарушать процесс пищеварения.
С помощью соды также проводится:
- Лечение алкоголизма и курения;
- Растворение отложений в позвоночнике, суставах, камней в почках и печени, лечение радикулита, ревматизма, остеохондроза, подагры, мочекаменной и желчнокаменной болезни;
- Очищение организма от солей кадмия, свинца, таллия, ртути, висмута, бария и других тяжелых металлов.
Пищевая сода в косметике
Жесткая вода, лаки и спреи для волос часто делают наши волосы слабыми и секущимися кончиками. Одна столовая ложка пищевой соды, добавленная в средство по уходу за волосами (шампунь или кондиционер), укрепит волосы, сделает их мягкими и блестящими.
Одна столовая ложка пищевой соды, добавленная в средство по уходу за волосами (шампунь или кондиционер), укрепит волосы, сделает их мягкими и блестящими.
Пищевая сода также используется в качестве смягчающего скраба для кожи. Смешайте 2 столовые ложки пищевой соды с увлажняющим кремом для тела. Ополосните кожу водой и с помощью мочалки распределите смесь по всему телу, уделяя внимание «проблемным» зонам: локти, колени, зона бикини. Эта процедура смягчит, очистит кожу, а также снимет воспаление, вызванное бритвой.
Пищевая сода – отличное средство для восстановления PH-баланса кожи и избавления от прыщей. Окуните ватный тампон в раствор пищевой соды и очищающего средства для лица и начните мягко массировать кожу круговыми движениями, избегая области вокруг глаз. Эта процедура удалит омертвевшие частички кожи и очистит поры лица. Регулярное проведение процедуры поможет полностью избавиться от прыщей.
Пищевая сода для похудения
Свойство пищевой соды препятствовать всасыванию жиров в организме, позволяет использовать гидрокарбонат натрия в качестве средства для похудения. Однако принимать содовый раствор нужно только после консультации с врачом, при строгом соблюдении дозировки – иначе вред пищевой соды для организма будет неизбежен.
Однако принимать содовый раствор нужно только после консультации с врачом, при строгом соблюдении дозировки – иначе вред пищевой соды для организма будет неизбежен.
Более безопасный способ сбросить лишние килограммы с помощью пищевой соды — использовать ее как часть ванны. Суть действия пищевой соды для похудения заключается в активизации лимфатической системы. Несколько капель эфирных масел, добавленных в содовую ванну, ускоряют вывод токсинов из организма, а, следовательно, и процесс похудения. Помимо лечебного эффекта, ванны с пищевой содой прекрасно расслабляют, помогая снизить усталость и нервное напряжение.
Вред пищевой соды
Несмотря на вышеперечисленные преимущества гидрокарбоната натрия, пищевая сода, помимо пользы, может нанести вред нашему организму. Неконтролируемый прием пищевой соды вызывает повышенное выделение углекислого газа, что сопровождается усилением выработки кислоты и вздутием живота — так называемый «кислотный рикошет».
Длительный контакт с порошком пищевой соды может вызвать раздражение кожи и ожоги. Избегайте попадания пищевой соды в глаза.
Избегайте попадания пищевой соды в глаза.
Видео с YouTube по теме статьи:
Вы бродите по супермаркету в поисках бесфосфатного стирального порошка. Естественно, чтобы узнать, какой продукт из всего арсенала бытовой химии вам подходит, возьмите в руки каждую упаковку с нужной классификацией и посмотрите на состав содержащегося в ней продукта. Наконец, они выбрали нужный продукт, но в процессе изучения всех стиральных порошков в магазине заметили странную закономерность: на каждой коробке или пачке было написано что-то вроде: «Продукт содержит карбонат натрия». В каждом человеке есть немного любопытства, и вы не исключение. Я хотел знать, что это за вещество, верно? Сегодняшняя статья добавит некоторую информацию об этом соединении к вашим знаниям.
Определение
Карбонат натрия (формула Na 2 CO 3 ) представляет собой натриевую соль угольной кислоты. В разных источниках он может называться по-разному: и карбонат натрия, и триоксокарбонат динатрия, и кальцинированная сода. Кстати, о фамилии. Обсуждаемое сейчас химическое соединение в чистом виде — это не пищевая сода, которую добавляют в различные продукты. Его название – бикарбонат натрия. Вещества с наличием карбоната натрия (и он тоже) называются содой. Исключение составляет едкий натр, научное название которого – гидроксид одноименного металла. Однако бикарбонат натрия реагирует с этим веществом, образуя обсуждаемое сейчас соединение. Все остальные газированные напитки представляют собой карбонаты с водой или водородом в одной формуле. Сегодня рассматриваются свойства, получение и применение только чистой натриевой соли угольной кислоты.
Кстати, о фамилии. Обсуждаемое сейчас химическое соединение в чистом виде — это не пищевая сода, которую добавляют в различные продукты. Его название – бикарбонат натрия. Вещества с наличием карбоната натрия (и он тоже) называются содой. Исключение составляет едкий натр, научное название которого – гидроксид одноименного металла. Однако бикарбонат натрия реагирует с этим веществом, образуя обсуждаемое сейчас соединение. Все остальные газированные напитки представляют собой карбонаты с водой или водородом в одной формуле. Сегодня рассматриваются свойства, получение и применение только чистой натриевой соли угольной кислоты.
Карбонат натрия: физические свойства
Это вещество в безводном состоянии имеет вид бесцветного кристаллического порошка (фото вверху). Структура его кристаллической решетки зависит от температуры окружающей среды: если последняя не ниже 350, но ниже 479°С, то она моноклинная, если температура выше — гексагональная.
Карбонат натрия: химические свойства
Если его опустить в сильную кислоту, то угольная кислота, полученная в ходе реакции и крайне нестойкая, разложится на газообразный четырехвалентный оксид углерода и воду. Вторым продуктом реакции является натриевая соль соответствующей кислоты (например, бросание кристаллов обсуждаемого сейчас карбоната в серную кислоту приведет к образованию углекислого газа, воды и сульфата натрия). В воде это соединение гидролизуется, из-за чего нейтральная среда становится щелочной.
Вторым продуктом реакции является натриевая соль соответствующей кислоты (например, бросание кристаллов обсуждаемого сейчас карбоната в серную кислоту приведет к образованию углекислого газа, воды и сульфата натрия). В воде это соединение гидролизуется, из-за чего нейтральная среда становится щелочной.
Квитанция
Можно получить несколькими способами, все они разные, но в этой статье речь пойдет только об одном. Необходимо смешать мел и древесный уголь с сульфатом натрия, а затем прокалить эту смесь при температуре около 1000 °С. Уголь восстановит последний до сульфида, который при реакции с карбонатом кальция образует расплав сульфида кальция и желаемое вещество. Его необходимо обработать водой, затем отфильтровать нежелательный сульфид и упарить полученный раствор. Образовавшийся сырой карбонат натрия очищают перекристаллизацией, а затем обезвоживают прокаливанием. Этот метод называется методом Леблана.
Заявка
Производства стекла, стиральных порошков, мыла и эмалей не обходятся без карбоната натрия, где из него делают ультрамарин. Также с помощью него устраняют жесткость воды, обезжиривают металлы и проводят десульфатацию, объектом которой является доменный чугун. Карбонат натрия является хорошим окислителем и регулятором кислотности, он содержится в средствах для мытья посуды, сигаретах и пестицидах. Он также известен как пищевая добавка Е500, которая предотвращает комкование и комкование ингредиентов. Обсуждаемое сейчас вещество также необходимо для приготовления фотопроявителя.
Также с помощью него устраняют жесткость воды, обезжиривают металлы и проводят десульфатацию, объектом которой является доменный чугун. Карбонат натрия является хорошим окислителем и регулятором кислотности, он содержится в средствах для мытья посуды, сигаретах и пестицидах. Он также известен как пищевая добавка Е500, которая предотвращает комкование и комкование ингредиентов. Обсуждаемое сейчас вещество также необходимо для приготовления фотопроявителя.
Заключение
Вот для чего полезен карбонат натрия. В чистом виде он, пожалуй, многими никогда не встречался, однако его кристаллогидраты (это все сода, кроме едкого натра) используются человеком почти повсеместно. Это одно из веществ, соединения которых с водой используются в промышленности гораздо чаще, чем в чистом виде.
Химическая формула
Сода кальцинированная техническая (карбонат натрия), белый порошок или гранулы. Na2CO3.
Физические свойства
гигроскопичный продукт, поглощает влагу и углекислый газ на воздухе с образованием кислой соли NaHCO 3 , при хранении на открытом воздухе слеживается. Водные растворы кальцинированной соды имеют сильнощелочную реакцию. Выпускают соду кальцинированную марки А (гранулированную) и марки Б (порошковую).
Водные растворы кальцинированной соды имеют сильнощелочную реакцию. Выпускают соду кальцинированную марки А (гранулированную) и марки Б (порошковую).
- Высокое качество кальцинированной соды было удостоено Платинового знака качества в 2004 году.
- Сода кальцинированная награждена дипломом и серебряной медалью конкурса «Лучшие товары бытовой химии, средств гигиены и косметики 2004 года».
- Лауреат республиканского конкурса «Лучшие товары Башкортостана» и конкурса «100 лучших товаров России» 2004 года.
Спецификация
| Марка A | Марка B | |||||
|---|---|---|---|---|---|---|
| Высший сорт | Первый сорт | Второй сорт | Высший сорт | Первый сорт | Второй сорт | |
| Массовая доля карбоната натрия (Na 2 CO 3 ), %, не менее | 99,4 | 99,0 | 98,5 | 99,4 | 99,0 | 99,0 |
| Массовая доля карбоната натрия (Na 2 CO 3 ) в пересчете на непрокаленный продукт, %, не менее | 98,7 | 98,2 | 97,0 | 98,9 | 98,2 | 97,5 |
| Массовая доля потерь при прокаливании (при 270 — 300 °С), %, не более | 0,7 | 0,8 | 1,5 | 0,5 | 0,8 | 1,5 |
| Массовая доля хлоридов в пересчете на NaCl, %, не более | 0,2 | 0,5 | 0,8 | 0,4 | 0,5 | 0,8 |
| Массовая доля железа в пересчете на Fe 2 O 3 , %, не более | 0,003 | 0,005 | 0,008 | 0,003 | 0,003 | 0,008 |
| Массовая доля веществ, нерастворимых в воде, %, не более | 0,04 | 0,04 | 0,08 | 0,03 | 0,04 | 0,08 |
| Массовая доля сульфатов в пересчете на Na 2 SO 4 , %, не более | 0,04 | 0,05 | Не стандартизирован | 0,04 | 0,05 | Не стандартизирован |
| Насыпная плотность, г/см 3 , не менее | 1,1 | 0,9 | 0,9 | Не нормируется | ||
| Оценка: | ||||||
| остаток на сите с сеткой № 2К по ГОСТ 6613, %, не более | Не стандартизирован | 5 | 5 | Не стандартизирован | ||
| прохождение через сито с сеткой № 1,25К по ГОСТ 6613, % | 100 | Не стандартизирован | Не стандартизирован | |||
| остаток на сите с сеткой № 1К по ГОСТ 6613, %, не более | Не стандартизирован | Не стандартизирован | ||||
| прохождение через сито с сеткой № 01К по ГОСТ 6613, %, не более | 7 | 15 | 25 | Не стандартизирован | ||
| Магнитные включения размером более 0,25 мм | Отсутствует | Не стандартизирован | Не стандартизирован | |||
Область применения кальцинированной соды
Сода кальцинированная марок А и Б применяется в производстве всех видов стекла, в том числе: хрустального, оптического и медицинского стекла, стеклоблоков, пеностекла, растворимого силиката натрия, керамической плитки, фриттового компонента для глазурей; черная и цветная металлургия: для производства свинца, цинка, вольфрама, стронция, хрома, для сероочистки и дефосфатации чугуна, в очистке отходящих газов, для нейтрализации сред. Для производства электровакуумного стекла используется кальцинированная сода марки А высшего сорта со строго нормированным гранулометрическим составом. Сода кальцинированная марки Б применяется в химической промышленности для производства синтетических моющих средств и жирных кислот, при очистке рассолов, в производстве солей фосфора, хрома, бария, натрия в качестве карбонатсодержащего сырья, в производстве глицерины, аллиловый спирт; целлюлозно-бумажной, анилиновой и лакокрасочной и нефтяной промышленности.
Для производства электровакуумного стекла используется кальцинированная сода марки А высшего сорта со строго нормированным гранулометрическим составом. Сода кальцинированная марки Б применяется в химической промышленности для производства синтетических моющих средств и жирных кислот, при очистке рассолов, в производстве солей фосфора, хрома, бария, натрия в качестве карбонатсодержащего сырья, в производстве глицерины, аллиловый спирт; целлюлозно-бумажной, анилиновой и лакокрасочной и нефтяной промышленности.
Упаковка, транспортировка, хранение
Сода кальцинированная упаковывается в бумажные мешки массой 50 кг, мягкие специализированные одноразовые контейнеры массой 800 кг (марка А) и 500 кг (марка Б). полувагоны и крытые вагоны. Соду кальцинированную, упакованную в мешки, транспортируют любым видом транспорта, защищая продукт от влаги. Гарантийный срок хранения соды кальцинированной марки А – 3 месяца, марки Б – 6 месяцев, упакованной в мягкую специализированную тару – 5 лет со дня изготовления.
Сода кальцинированная — гигроскопичный продукт, который при хранении на открытом воздухе слеживается, поглощает углекислый газ и влагу воздуха. Используется в пищевой и химической промышленности.
Сода кальцинированная марки «А» применяется в производстве всех видов стекла. Марка «Б» — только в химической промышленности.
Химическая формула сода кальцинированная — Na 2 CO 3. Безопасность продукта: сода кальцинированная, взрывопожаробезопасная, по степени воздействия на организм человека относится к веществам 3 класса опасности.
Сода кальцинированная техническая марки А упаковывают в мягкую одноразовую тару, в бумажные пятислойные мешки. Соду, расфасованную в мешки, можно транспортировать любым видом транспорта, только в крытых транспортных средствах. Товар марки «Б» транспортируют в специальном насыпном транспорте или крытых вагонах. Мягкие контейнеры перевозят только в крытых вагонах. Соду кальцинированную техническую хранят в специальных бункерах, складах, защищенных от влаги. Сода кальцинированная марки «А» хранится — 3 месяца, марки «Б» — 6 месяцев, а сода, расфасованная в мягкую тару — 5 лет.
Сода кальцинированная марки «А» хранится — 3 месяца, марки «Б» — 6 месяцев, а сода, расфасованная в мягкую тару — 5 лет.
Основные меры безопасности при работе с кальцинированной содой: вдыхание пыли вызывает раздражение дыхательных путей, конъюнктивит. Концентрированный раствор, случайно попавший в глаза, может привести к неврозам, ожогам, помутнению роговицы – если работать с раствором длительное время. Раствор очень едкий во влажном состоянии. При работе желательно использовать респиратор, очки, защитный костюм. Если все же раствор попал на кожу, необходимо удалить вещество тампоном, пораженный участок промыть под проточной водой. Закапывать глаза 30% раствором альбуцида, на кожу наносить тетрациклиновую мазь. При попадании внутрь промыть желудок через зонд.
Информация, представленная в этой статье, касается различных аспектов пищевой соды, которая является популярным бытовым ингредиентом, используемым для различных целей. Пищевая сода имеет множество применений и в основном используется для приготовления пищи. Химически он известен как бикарбонат натрия, или, точнее, его название IUPAC известно как бикарбонат натрия. Он представлен химической формулой nahco3. Так что же такое пищевая сода? Что ж, сода — это, по сути, белая кристаллическая натриевая соль, и она обычно бывает в виде порошка.
Химически он известен как бикарбонат натрия, или, точнее, его название IUPAC известно как бикарбонат натрия. Он представлен химической формулой nahco3. Так что же такое пищевая сода? Что ж, сода — это, по сути, белая кристаллическая натриевая соль, и она обычно бывает в виде порошка.
Химическая формула
Пищевая сода или разрыхлитель и различные химические названия, такие как бикарбонат натрия (na2co3), пищевая сода, бикарбонат натрия (nahco 3) и т. д. Его также называют бикарбонатом натрия или просто содой. Его основная химическая формула — nahco3, и он производится Solvay в промышленных масштабах.
В этом процессе не используются такие химические вещества, как карбонат кальция (caco3), хлорид натрия (NaCl), аммиак (Nh4), диоксид углерода (CO2) и вода (h3O). Они реагируют на разные шаги, чтобы дать основной продукт. Реакция протекает в две стадии:
Стадия 1: Реакция с водным раствором гидроксида натрия (NaOH) и диоксидом углерода (CO2) —
CO2 + 2 NaOH в → Na2co3 + h3O
Стадия 2: Добавление большего количества диоксида углерода в вышеуказанную реакцию —
Na2co3 + CO2 + h3O → 2NaHCO3
Химическая реакция пищевой соды с водой
Поступление nahco3 состоит из двух ионов, ионов натрия (катионы) na+ и ионов бикарбоната (анионов) HCO3-. Ниже объясняется, как бикарбонат натрия растворяется в воде, распадаясь на два иона.
Ниже объясняется, как бикарбонат натрия растворяется в воде, распадаясь на два иона.
Получение nahco3 → H+(водн.)+HCO3-(th)
Термическое разложение соды
Химическая формула любого соединения дает нам широкое представление о различных химических реакциях и свойствах этого соединения. Понятно, что если разложить смесь с помощью тепловой энергии, то можно получить соединение, из которого она приготовлена. Ниже представлена реакция этого процесса при 70°С.
2 nahco3 to → Na2co3 + h3O + CO2
Как правило, вы можете помнить, что большинство гидроксидов обычно следуют вышеуказанным реакциям разложения. При дальнейшем нагревании, примерно до 100°С, гидроксиды разлагаются на соответствующие оксиды.
Na2co3 → количество na2o (оксид натрия) + CO2
Использование
Пищевая сода находит широкое применение в промышленных и бытовых продуктах. Бикарбонат натрия используется как лекарство от желудочных и кислых газов путем смешивания в соответствующих количествах с различными препаратами. В случаях почек и мочевой кислоты бикарбонат натрия используется для лечения проблем с мочеиспусканием. Раствор бикарбоната натрия считается внутривенным при ацидозе. Бикарбонат натрия в нужных количествах добавляется вместе с раствором перекиси водорода соответствующей концентрации и служит альтернативой зубным пастам.
В случаях почек и мочевой кислоты бикарбонат натрия используется для лечения проблем с мочеиспусканием. Раствор бикарбоната натрия считается внутривенным при ацидозе. Бикарбонат натрия в нужных количествах добавляется вместе с раствором перекиси водорода соответствующей концентрации и служит альтернативой зубным пастам.
Самый популярный способ использования пищевой соды в наших домах — для чистки и отбеливания. Гидрокарбонат натрия широко используется в хлебопекарных целях. Он также используется в качестве химического разрыхлителя, который помогает тесту подниматься при выпечке. Однако добавление слишком большого количества этого порошка в тесто приводит к горькому вкусу, и поэтому необходимо соблюдать осторожность при использовании соответствующего количества разрыхлителя.
Приготовление легкой пасты из пищевой соды и воды и последующее нанесение ее на участок кожи, пораженный акне, помогает избавиться от акне в течение 2-3 дней. Все, что вам нужно сделать, это постоянно наносить пасту и дать ей высохнуть в течение 10-20 минут. Различные химические и физические свойства пищевой соды можно разобрать, чтобы понять ее формулу, которая содержит элементы и металлы с разными свойствами.
Различные химические и физические свойства пищевой соды можно разобрать, чтобы понять ее формулу, которая содержит элементы и металлы с разными свойствами.
Что такое двууглекислый натрий, он же двууглекислый, двууглекислый натрий, а просто питьевая или пищевая сода, многим известно еще со школьных уроков химии. Пищевая сода представляет собой кислую натриевую соль угольной кислоты. В химии формула пищевой соды определяется как NaHCO 3 .
Химический состав гидрокарбоната натрия
Как и любой продукт, используемый в питании, сода пищевая имеет пищевую ценность, которая определяется количеством белков, минеральных веществ, углеводов и макроэлементов. Состав пищевой соды определяется следующими показателями на 100 г съедобной части:
- зола — 36,9 г;
- вода — 0,2 г;
- натрия — 27,4 г;
- селен — 0,2 мкг.
В состав гидрокарбоната натрия не входят белки, жиры, углеводы и пищевые волокна, а его калорийность составляет 0 ккал. Плотность соды 2,16 г/см 3 .
Плотность соды 2,16 г/см 3 .
Химическая формула соды NaHCO 3 — кислая натриевая соль угольной кислоты, которая по международным атомным массам составляет 84,00 а.е.
Если соду взаимодействовать с кислотами, то химическая формула пищевой соды разложится на углекислый газ и воду и сначала будет иметь формулу образования соли и угольной кислоты — NaHCO 3 + HCl → NaCl + H 2 CO 3, а затем H 2 CO 3 → H 2 O + CO2.
В домашних условиях чаще применяют уксусную кислоту, при реакции с которой образуется ацетат натрия — NaHCO 3 + CH 3 COOH → CH 3 COONa + H 2 O + CO 2
При термических реакциях, под действием температур от 60 градусов бикарбонат разлагается на карбонат натрия, углекислый газ и воду. Температура кипения — 851°С, температура плавления — 270°С.
Щелочные свойства соды
Пищевая сода является щелочью, такое утверждение имеет свою доказательную базу. Растворы всех химических веществ определяются по величине водородного показателя (рН), характеризующего кислотность или щелочность среды.
Если раствор имеет значение pH 6 или меньше, это кислая среда. Вещества, растворы которых имеют рН 8 и выше, относятся к щелочным.
В нейтральной среде (например, в чистой воде) рН равен 7. Раствор пищевой соды имеет рН 9, т.е. является слабой щелочью и способен нейтрализовать опасные для организма человека свойства сильных кислот .
Формула пищевой соды содержит элементы, характеризующие ее как слабую щелочь, не оказывающую агрессивного действия на мягкие ткани организма, поэтому ощелачивающие свойства этого продукта часто используют в лечебно-профилактических целях для оздоровления организма.
Введенные еще в советское время ГОСТ и технические условия на гидрокарбонат натрия предусматривают его производство в соответствии с установленным еще в 1976 году стандартом технологического регламента. К этим требованиям относятся установленные методы анализа, безопасности, приемки и хранения. Раньше указывался ГОСТ — сода пищевая под номером 2156-76, которая применялась в фармакологической, химической, легкой, пищевой промышленности, цветной металлургии, а также в народном хозяйстве. В настоящее время нормы этого ГОСТа не пересматривались.
В настоящее время нормы этого ГОСТа не пересматривались.
По физико-химическим компонентам сода должна иметь следующие показатели для 1 и П сортов:
| Внешний вид | Белый кристаллический порошок без запаха | |
|---|---|---|
| Массовая доля бикарбоната натрия (NaHCO3), %, не менее | 99,5 | 99,0 |
| Массовая доля карбоната натрия (Na2CO3), %, не более | 0,4 | 0,7 |
| Массовая доля хлоридов в пересчете на NaCl, %, не более | 0,02 | 0,04 |
| Массовая доля мышьяка (As), %, не более | Выдерживает испытание | |
| Массовая доля веществ, нерастворимых в воде, %, не более | Выдерживает испытание | |
| Массовая доля железа (Fe2+), %, не более | 0,001 | 0,005 |
| Массовая доля кальция (Са2+), %, не более | 0,04 | 0,05 |
| Массовая доля сульфатов в пересчете на SO42-, %, не более | 0,02 | 0,02 |
| Массовая доля влаги, %, не более | 0,1 | 0,2 |
В этом ГОСТе срок годности пищевой соды был ограничен 12 месяцами. В современном производстве пищевая сода не имеет ограничений по времени. Главное условие – правильное его хранение.
В современном производстве пищевая сода не имеет ограничений по времени. Главное условие – правильное его хранение.
Требования безопасности к пищевой соде
По химическому составу пищевая сода нетоксична, но взрывоопасна и легко воспламеняется. По степени воздействия на организм человека имеет третий класс опасности. В воздухе рабочей зоны допустимая норма двууглекислого натрия в воздухе 5 мг/м 3 .
Химическая формула соды, а также ее состав указывают на то, что под воздействием определенных температур она может быть горючей и взрывоопасной. При нагревании емкости, в которых он хранится, могут взорваться. При нагревании сода может разлагаться на ядовитые газы, а если она постоянно присутствует в помещении со своей пылью, у человека может возникнуть раздражение дыхательных путей. Людям, работающим на предприятиях, где имеется большое количество пищевой соды, следует соблюдать меры предосторожности и использовать средства индивидуальной защиты.
При возникновении пожара по ГОСТ необходимо:
- Отвести автомобиль в безопасное место.
 Изолировать опасную зону в радиусе не менее 100 м. Откорректировать указанную дистанцию по результатам химической разведки. Удалите незнакомцев. Соблюдайте меры пожарной безопасности. Не курю. Оказать первую помощь пострадавшему.
Изолировать опасную зону в радиусе не менее 100 м. Откорректировать указанную дистанцию по результатам химической разведки. Удалите незнакомцев. Соблюдайте меры пожарной безопасности. Не курю. Оказать первую помощь пострадавшему. - Не прикасайтесь к пролитому или пролитому материалу. Не допускать попадания вещества в водоемы, подвалы, канализацию.
- Входить в зону аварии в защитной одежде и респираторе. Тушить воздушно-механической пеной с большого расстояния.
- Покрыть песком или другим инертным материалом. Сжечь территорию (отдельные очаги) при угрозе попадания в грунтовые воды. Вызвать специалистов для обезвреживания.
- Вызовите скорую помощь. Свежий воздух, покой, тепло, чистая одежда. Промывать глаза и слизистые оболочки водой не менее 15 минут.
Как хранить и транспортировать соду
Для количественной транспортировки сода пищевая расфасована для сохранности в многослойные бумажные мешки массой до 50 кг, а также в одноразовую тару с полиэтиленовым слоем. Для розничной торговли газировку упаковывают в картонные пачки или в герметичные полиэтиленовые пакеты массой до 1 кг. Гидрокарбонат натрия транспортируют различными видами транспорта, кроме воздушного.
Для розничной торговли газировку упаковывают в картонные пачки или в герметичные полиэтиленовые пакеты массой до 1 кг. Гидрокарбонат натрия транспортируют различными видами транспорта, кроме воздушного.
Как добывают бикарбонат натрия
В природе пищевая сода (широкая группа содовых минералов) добывается из высохших содовых озер или резервуаров. Из-за высокой концентрации соды и солей минералы выпадают на берег в виде кристаллических сугробов. Иногда, когда озера пересыхают, они образуют целые пласты, покрытые песчаными отложениями. Через некоторое время такой слой может вновь оказаться над земной поверхностью, что позволяет получать из него содовое сырье. Существует несколько видов минералов, из которых можно получить соду. Наиболее распространенным сырьем для производства соды является минерал трон, который перед получением готового продукта проходит тщательную очистку, процесс нагревания, а также проходит стадию дробления для избавления от нежелательных газов.
Сырьем для производства соды являются природные минеральные образования, содержащие в своем составе карбонат натрия. Содовое сырье имеет различный химический состав, в котором есть как полезные, так и вредные компоненты. Есть 2 группы сырья. В первую входят:
- горные породы с полезными ископаемыми;
- карбонаты и бикарбонаты натрия — трона, натрона, наколина, термонатрита, давсонита, гейлюссита, шоршита;
- подземные воды содового типа с повышенным содержанием карбоната натрия.
Ко второму типу относятся варианты содовых месторождений, в которых имеются месторождения натрона, тронов, галита. Сода, которую добывают в природе из солевых и высохших озер Кении, Танзании, Боливии, Мексики и других стран. Кроме того, минерал для содового производства получают из месторождений давсонита, образовавшихся при катагенезе песчано-глинистых пород под влиянием содовых вод.
В Советском Союзе из-за низкой рентабельности добыча натуральной соды выщелачиванием была прекращена еще в 1971. Наиболее распространенным был открыто-шахтный способ. В шахтах гидрокарбонат натрия растворяли методом выщелачивания, а затем раствор откачивали на поверхность.
Наиболее распространенным был открыто-шахтный способ. В шахтах гидрокарбонат натрия растворяли методом выщелачивания, а затем раствор откачивали на поверхность.
В настоящее время сода производится в промышленных масштабах аммиачно-хлоридным способом, при котором углекислый газ пропускают в насыщенный аммиаком концентрат хлорида натрия. В процессе такого синтеза начинаются реакции, в результате которых гидрокарбонат натрия отделяется фильтрованием, а продукты переработки (аммиак) возвращаются в производство.
Обыкновенная пищевая сода, химическая формула которой NaHCO 3 , в настоящее время получают не путем очистки соды естественным путем, а химическим способом.
Кристаллы природных солей также выращивают в лаборатории. Очистку бикарбоната натрия проводят двумя способами — мокрым и сухим. Общий процесс представляет собой реакцию карбонизации — насыщения раствора углекислым газом, в результате чего происходит процесс перекристаллизации, а способы различаются только способом приготовления раствора.
Современные потребители гидрокарбоната натрия — пищевую соду можно наблюдать в продуктах как пищевую добавку Е500.
Кальцинированная сода, формула которой известна с древних времен, уже давно используется во многих областях. Многие хозяйки используют его в быту. Ведь кальцинированная сода – моющее средство, натуральное и безопасное.
формула и состав
Около 20 лет назад в каждом доме была упаковка этого удивительного продукта. Что такое кальцинированная сода? Формула этого вещества – Na2CO3. На самом деле это натрий. Это вещество представляет собой смесь мелких и крупных белых кристаллов.
Стоит отметить, что порошок из окружающей среды впитывает влагу. В результате кальцинированная сода быстро слеживается. Поэтому хранить данное вещество рекомендуется в закрытой таре, а также в тех помещениях, где уровень влажности не очень высок.
В промышленности на это вещество существует ГОСТ. Кальцинированная сода производится в соответствии с документом 5100 85, который был принят еще в советское время. Однако ГОСТ остается в силе. По этой технологии вещество делят на несколько марок: А и Б. Эти составы отличаются массовым содержанием тех или иных химических элементов. Это позволяет использовать каждый бренд в отдельной отрасли.
Однако ГОСТ остается в силе. По этой технологии вещество делят на несколько марок: А и Б. Эти составы отличаются массовым содержанием тех или иных химических элементов. Это позволяет использовать каждый бренд в отдельной отрасли.
Как получить это лекарство?
Производство кальцинированной соды представляет собой сложный химический процесс. Стоит отметить, что это вещество существует в природе в чистом виде, и это открытие было сделано в начале 19 века. Первоначально его получали из золы, получаемой при сжигании прибрежных растений, а также из некоторых водорослей. Конечно, человечество развивалось, и вместе с ним развивались новые технологии. Кроме того, было обнаружено большое место залегания этого вещества.
На данный момент кальцинированную соду, формула которой указана выше, производят несколькими способами, такими как:
- Получение из природного вещества.
- аммиачный метод.
- Получение из нефелинового сырья.
- Карбонизация
Получение из природного сырья
Этот способ получения кальцинированной соды является новой отраслью. Он появился относительно недавно, но уже стал основным конкурентом для тех, кто добывает это вещество аммиачным методом.
Он появился относительно недавно, но уже стал основным конкурентом для тех, кто добывает это вещество аммиачным методом.
Стоит отметить, что метод известен давно. Однако на практике он был реализован только в начале 20 века. Началом для бурного развития этого направления стало открытие богатейших месторождений соды (трона) в США.
Способ получения кальцинированной соды из природного сырья основан на переработке щелока и рассола, образующихся при растворении содовых отложений. Следует отметить, что помимо карбоната натрия в большинстве случаев удается выделить и другие компоненты, входящие в состав исходных материалов.
Метод Леблана
Это еще один не менее популярный метод, позволяющий получить такое вещество, как кальцинированная сода. Состав этого вещества достаточно прост, и его легко выделить из других веществ. Этот метод основан на плавлении угольной смеси и во вращающихся печах. Температура в них может достигать 1000°С. В результате этого процесса образуется содовый сплав — это сода-сырец. После этого вещество подвергают выщелачиванию водой. Это требуется для извлечения соды из содового раствора.
После этого вещество подвергают выщелачиванию водой. Это требуется для извлечения соды из содового раствора.
Полученный раствор должен хорошо отстояться. Затем щелочь очищают, из нее выпаривают влагу, прокаливают – прокаливают, а затем измельчают в порошок. Как правило, для приготовления соды используют известняк, мел и соль.
Полезные свойства
ГОСТ «Сода кальцинированная» 5100 85 не менялся многие десятилетия. Благодаря разработанной технологии производства это вещество обладает уникальными свойствами. Кальцинированная сода используется не только в промышленности, но и в быту. Среди всех полезных качеств этого состава стоит выделить:
- Способность хорошо удалять застарелую грязь, краску, жирные пятна.
- Хорошо очищает раковины, плитку, фарфор, эмаль и керамику.
- Справляется практически с любыми засорами в трубах.
- Смягчает воду.
- Удаляет даже стойкие пятна с одежды.
- Позволяет бороться с садовыми вредителями.

- Хорошо дезинфицирует.
Вред соды
Сода кальцинированная техническая имеет не только преимущества. Есть у этого вещества и некоторые недостатки. Конечно, нельзя сказать, что состав способен причинить какой-либо вред. Это будет неправильно. Скорее, неправильное использование кальцинированной соды может привести к каким-либо побочным эффектам. В результате появляются негативные отзывы о средстве.
Чаще всего отмечают несоблюдение мер предосторожности, а также дозировок. Раствор кальцинированной соды является агрессивным веществом. Ошибки в дозировках, а также нарушения процесса употребления могут нанести вред здоровью человека. Поэтому при работе с веществом следует помнить о правилах безопасности. Кроме того, не забывайте, что кальцинированная сода подходит не для всех материалов.
Меры предосторожности
Каковы свойства кальцинированной соды? Состав вещества указывает на его безопасность. Поэтому кальцинированную соду часто используют в быту. Это вещество белого цвета и имеет кристаллическую структуру. Раствор соды обладает сильно выраженным щелочным действием. Однако само вещество считается взрывоопасным и пожаробезопасным. Но из-за деятельности человека он отнесен к третьему классу.
Это вещество белого цвета и имеет кристаллическую структуру. Раствор соды обладает сильно выраженным щелочным действием. Однако само вещество считается взрывоопасным и пожаробезопасным. Но из-за деятельности человека он отнесен к третьему классу.
Сода кальцинированная техническая — химически активный состав. При работе с этим веществом необходимо соблюдать правила безопасности. Если сода попадет на слизистую оболочку, она может вызвать сильное раздражение тканей. В некоторых случаях даже возникают ожоги. При попадании вещества на кожу или в глаза рекомендуется промыть пораженный участок чистой водой.
Не забывайте, что кальцинированная сода впитывает влагу. В результате его соединения с водой образуется агрессивный раствор. Поэтому не рекомендуется использовать кальцинированную соду в помещениях, где отмечается высокий показатель влажности воздуха.
Применение в промышленности
В промышленности часто используется кальцинированная сода. Характеристики и свойства этого вещества позволяют использовать его во многих отраслях промышленности. Некоторые производственные процессы очень сложно представить без участия этого компонента. К основным областям применения кальцинированной соды в промышленности относятся:
Некоторые производственные процессы очень сложно представить без участия этого компонента. К основным областям применения кальцинированной соды в промышленности относятся:
Этот материал просто незаменим. Кальцинированная сода используется даже в производстве лекарств. Он используется здесь как чистящее средство, элемент для синтеза других химических компонентов и так далее.
Можно ли использовать дома?
Кальцинированная сода используется многими хозяйками и в быту. Как было сказано выше, это вещество является отличным чистящим и моющим средством. Кальцинированная сода способна очистить практически любую поверхность от жира. А все благодаря его уникальным свойствам. Кроме того, это относительно дешевый аналог многих современных марок бытовой химии. Эффективность кальцинированной соды доказана годами. Кроме того, вещество является безопасным и натуральным.
Этот состав часто используется для мытья, для удаления накипи и жира. Кальцинированная сода просто незаменима в быту. Кроме того, его можно добавлять в стиральный порошок при стирке. Это защитит оборудование от накипи.
Кроме того, его можно добавлять в стиральный порошок при стирке. Это защитит оборудование от накипи.
Борьба с вредителями
Кальцинированная сода также используется в повседневной жизни для борьбы с садовыми вредителями. Для этого приготовьте простой раствор. На ведро чистой воды требуется не более 6 чайных ложек кальцинированной соды. Готовым составом можно обрабатывать лианы. Это средство защищает растения от серой гнили. Следует отметить, что такой раствор подходит для обработки плодовых растений. Вреда средство не наносит, но позволяет защитить растения от гусениц и других вредителей.
Кроме того, раствором можно обрабатывать огурцы, кабачки, бахчевые и капусту. Однако увлекаться кальцинированной содой не стоит. Слишком много вредит почве. Что, в свою очередь, может сильно повлиять на будущий урожай.
В заключение
Кальцинированная сода – уникальное химическое соединение, которое уже много лет используется человечеством не только во многих отраслях промышленности, но и в быту. Если соблюдать все правила безопасности, то употребление этого вещества не наносит вреда здоровью. Кальцинированная сода не более опасна, чем уксус. Но и он при неправильном употреблении может навредить нашему организму.
Если соблюдать все правила безопасности, то употребление этого вещества не наносит вреда здоровью. Кальцинированная сода не более опасна, чем уксус. Но и он при неправильном употреблении может навредить нашему организму.
Вряд ли кто-то задумывался над тем, что кальцинированная сода используется в производстве многих вещей, которые нас окружают. Кроме того, он изготовлен из натурального сырья. Многие чистящие и моющие средства, стиральные порошки и другая дорогая бытовая химия, которая продается по высоким ценам, представляют собой раствор кальцинированной соды, который был как бы модифицирован и разбавлен определенными добавками.
Бикарбонат натрия, гидрокарбонат натрия, гидрокарбонат натрия, пищевая сода — это названия одного и того же химического соединения, известного всем как «пищевая сода». Это хороший разрыхлитель для теста. Раствор соды может облегчить зубную боль. Но это далеко не весь спектр применения этого «чудодейственного» вещества. На самом деле без двууглекислого натрия сложно обойтись в быту, в кулинарии, в медицине и во многих других сферах деятельности.
История создания
Пищевая сода использовалась в выпечке с древних времен. Его нашли археологи при раскопках пещер I-II веков до н.э. Затем его добывали из моря или находили в виде минерала. Это химическое соединение активно использовалось еще в Древнем Египте.
Впервые химическая формула соединения — NaHCO3 — была установлена французским ученым Анри де Монсо. Благодаря этому открытию пищевую соду стали получать синтетическим путем, что значительно удешевило ее стоимость и расширило спектр применения. С момента открытия формулы методы ее синтеза постоянно менялись, совершенствовались и становились более рентабельными.
Как получить
Первый способ промышленного производства карбоната натрия заключался в растворении породы, смешивании раствора с известняком и древесным углем и последующем нагревании в печи. Однако, как оказалось, на выходе были не продукты питания, а кальцинированная сода. Кроме того, в результате такой деятельности осталось много токсичных отходов (сульфид кальция и хлористый водород), поэтому от него быстро отказались.
Сегодня пищевую соду производят двумя способами – «сухим» и «мокрым», каждый из которых основан на реакции карбонизации (обогащении раствора углекислым газом).
Виды соды
С химической точки зрения и сферы применения различают несколько видов соды: пищевая (питьевая), кальцинированная (льняная) и едкая (гидроксид натрия).
Химические свойства
Бикарбонат натрия представляет собой слабокислотную соль угольной кислоты. Представляет собой мелкие бесцветные кристаллы, которые при повышении температуры до 50-60°С начинают «отдавать» молекулу углекислого газа, постепенно разлагаясь до карбоната натрия (кальцинированной соды).
Реагирует с кислотами с образованием солей (хлорида, ацетата, сульфата натрия) и угольной кислоты, которая мгновенно распадается на воду и углекислый газ. Порошок плохо растворяется в воде и легко отделяется фильтрованием.
Преимущества
Преимущества бикарбоната натрия обусловлены его щелочным рН. Именно способность реагировать с кислотами и ощелачивать среду лежит в основе таких полезных свойств пищевой соды, как:
- кислотонейтрализующая; антисептик
- ;
- противовоспалительное;
- противозудное;
- сушка;
- противогрибковый;
- разжижение мокроты;
- смягчает и отбеливает кожу.

Такое разнообразие полезных свойств позволяет использовать это соединение в народной и традиционной медицине для лечения многих заболеваний и нормализации самочувствия человека при различных патологических и физиологических состояниях.
Возможный вред
Пищевая сода должна употребляться внутрь в ограниченных количествах и по строгим показаниям. Кристаллы бикарбоната в больших количествах токсичны для слизистой оболочки пищеварительного тракта и могут вызывать сильное раздражение и аллергические реакции.
При регулярном вдыхании паров углекислого газа или кристаллов бикарбоната, например, при производстве соды, может возникнуть раздражение слизистой оболочки дыхательных путей.
Частое употребление содового раствора грозит стойкими органическими расстройствами пищеварительной системы. Происходит ощелачивание желудочного сока, а также сдвиг в сильнощелочную сторону кишечного содержимого.
Медицинское применение
Гидрокарбонат натрия широко используется в медицине. При этом сода применяется в различных ее областях: дерматологии, гастроэнтерологии, кардиологии, пульмонологии, стоматологии, токсикологии, ЛОР-патологиях. Помогает бикарбонат натрия от изжоги, тошноты, укачивания.
При этом сода применяется в различных ее областях: дерматологии, гастроэнтерологии, кардиологии, пульмонологии, стоматологии, токсикологии, ЛОР-патологиях. Помогает бикарбонат натрия от изжоги, тошноты, укачивания.
Вещество применяют внутрь в виде содового напитка и наружно в сухом виде, в виде пасты или водного раствора для обтираний, примочек, ванн.
В стоматологии
Полоскание раствором гидрокарбоната натрия полости рта снимает местное воспаление, снимает зубную боль, укрепляет десны, устраняет неприятные запахи. Пищевая сода может использоваться вместо зубной пасты для отбеливания зубов.
В гастроэнтерологии
При тошноте приготовить крепкий раствор соды (1 столовая ложка на стакан воды) и пить медленно. При сильной изжоге рекомендуется растворить чайную ложку соды в стакане воды и выпить. Таким образом, на некоторое время состояние больных улучшается. Однако следует отметить, что при частой изжоге следует обращаться к врачу, а не лечиться содой в домашних условиях. Привычный прием щелочного раствора вызывает реакцию нейтрализации между соляной кислотой и содой, в результате чего выделяется много углекислого газа, вызывающего вздутие живота. Образующийся углекислый газ раздражает хеморецепторы желудка, тем самым стимулируя рефлекторное усиление образования желудочного сока.
Привычный прием щелочного раствора вызывает реакцию нейтрализации между соляной кислотой и содой, в результате чего выделяется много углекислого газа, вызывающего вздутие живота. Образующийся углекислый газ раздражает хеморецепторы желудка, тем самым стимулируя рефлекторное усиление образования желудочного сока.
В кардиологии
Углеводородные ванны способствуют нормализации артериального давления и сердцебиения, что полезно при перебоях в работе сердца и сосудов. Сода усиливает мочеиспускание, что снижает общий объем циркулирующей крови. В результате снижается давление столба крови на стенки сосудов и несколько падает артериальное давление.
Прием раствора гидрокарбоната натрия внутрь при резком повышении АД является первой помощью при гипертоническом кризе в домашних условиях. Если пить газированный напиток вместе с антигипертензивными препаратами, это потенцирует их действие.
В дерматологии
Мыльно-содовые ванночки и аппликации помогают избавиться от грибковых поражений ногтей, а также натоптышей и натоптышей. Пастой из пищевой соды и воды следует использовать для лечения ожогов кожи при воздействии кислот, а также участков кожи с солнечными ожогами. Смочить водой с растворенной в ней содой нужно место укусов комаров и других насекомых на коже. При сильном зуде можно присыпать кожу сухим порошком.
Пастой из пищевой соды и воды следует использовать для лечения ожогов кожи при воздействии кислот, а также участков кожи с солнечными ожогами. Смочить водой с растворенной в ней содой нужно место укусов комаров и других насекомых на коже. При сильном зуде можно присыпать кожу сухим порошком.
При проблемах с запахом пота подмышки обработать содовым раствором. Бактерии и грибки, которые растут в поте, производят кислоты, вызывающие неприятный запах изо рта. Гидрокарбонат натрия нейтрализует эти кислоты и проявляет умеренное антисептическое действие.
Ванночки для ног на бикарбонатной основе предназначены для лечения грибковых заболеваний стоп и ногтей. Они также помогают смягчить огрубевшую кожу пяток перед педикюром. Горячие ванночки из крепкого раствора пищевой соды помогают при панариции (гнойном воспалении под ногтем).
При ЛОР-патологиях
Бикарбонат натрия при попадании в вязкую мокроту вступает в реакцию с содержащимися в ней кислотами. Образующиеся пузырьки углекислого газа и воды разжижают мокроту, увеличивают ее количество и облегчают откашливание.
Для приготовления отхаркивающего средства при трахеитах, ларингитах, бронхитах, а также при сильном кашле чайную ложку пищевой соды разводят в 200 мл теплой. Этот эликсир пьют перед сном. Вместо такого напитка можно делать паровые ингаляции с содой. Столовую ложку порошка разводят в литре горячей воды и дышат над ней. Для усиления эффекта в раствор можно добавить несколько капель эвкалиптового, соснового или эфирного масел. Полоскания горла раствором соли и соды снимают воспаление миндалин при ангине.
Внутривенное введение стерильного водного раствора натрия бикарбоната часто применяют в реанимации, инфекционных болезнях и токсикологии при отравлениях, интоксикациях. Метаболический ацидоз.
Использование в кулинарии
Использование бикарбоната натрия в кулинарии также многогранно. Способность соды выделять углекислый газ при гашении уксусом позволяет использовать ее в качестве разрыхлителя. Пышность омлету, тесту придает гашеная сода. Можно погасить соду уксусом или добавить порошок в сметанное или кефирное тесто. Во втором случае роль уксуса будет играть молочная кислота.
Во втором случае роль уксуса будет играть молочная кислота.
Добавление в блюда из фасоли может сократить время приготовления. Использование пищевой соды в мясном маринаде может смягчить жесткие мышечные волокна. Ягодно-фруктовые муссы при добавлении в них щепотки соды становятся слаще, а также более прозрачными и ароматными.
Чтобы избавиться от нитратов в овощах, их нужно замочить в растворе соды. Таким же образом можно осветлить затемненное.
Применение в хозяйстве
Вещество незаменимо в быту. Это отличное очищающее средство. Для восстановления блеска хромированные изделия и изделия из серебра натирают сухой содой, промывают мыльным раствором, а затем насухо вытирают мягкой тканью.
Порошок бикарбоната натрия, нанесенный на смоченную губку, удаляет царапины и потертости с виниловых полов. Кафель, плиту, раковину и сантехнику можно очистить от грязи, обработав густой смесью соды и воды. Эта же смесь помогает избавиться от специфического кошачьего запаха в местах, где были «следы».
Для удаления запахов
Благодаря хорошей гигроскопичности бикарбоната натрия он быстро впитывает запахи, поэтому его можно использовать для устранения различных запахов. Чтобы избавиться от неприятных запахов в холодильнике, нужно насыпать сухой порошок в стакан и поставить его в дверцу холодильника. Меняя содержимое стакана по мере необходимости (каждые 1-2 месяца), можно навсегда избавиться от специфического «холодильного» запаха.
При стойком запахе кислого молока «пахнущую» тару очистить сухим порошком. То же самое проделайте с посудой, имеющей запах рыбы.
Если насыпать в сливное отверстие несколько столовых ложек порошка, а через несколько минут включить теплую воду, можно устранить неприятный запах из сифона под раковиной.
Пищевая сода также поможет справиться с неприятным запахом с ковра. Для этого ковер посыпают порошком, оставляют на 20-30 минут, а затем тщательно пылесосят. Однако этот метод подходит только для нелиняющих ковров.
Пищевая сода также может предотвратить неприятные запахи, например, из стиральной или посудомоечной машины, когда они не используются в течение длительного времени. Уходя из дома на длительное время, следует протирать внутреннюю поверхность машин сухим гидрокарбонатом и оставлять их дверцы приоткрытыми, а по возвращении запускать их в режиме ополаскивания.
Уходя из дома на длительное время, следует протирать внутреннюю поверхность машин сухим гидрокарбонатом и оставлять их дверцы приоткрытыми, а по возвращении запускать их в режиме ополаскивания.
Для ухода за одеждой
При машинной стирке в стиральный порошок рекомендуется добавлять пищевую соду. Это поможет избавиться от неприятного запаха в стиральной машине, улучшить качество стирки и аромат выстиранного белья. Неприятно пахнущую одежду можно постирать в стиральной машине, обильно посыпав пищевой содой.
Промокший купальник не заплесневеет и не будет неприятно пахнуть, если после купания в бассейне или природном водоеме его сложить в пакет с содой, а дома прополоскать и тщательно высушить.
Применение в косметологии
Сода — прекрасное косметическое средство. Хорошим очищающим и отбеливающим эффектом обладает скраб из измельченных овсяных хлопьев и сухого гидрокарбоната натрия. Кожа после такого скраба становится мягкой, а его регулярное применение избавляет от прыщей. Для придания блеска волосам после мытья головы их необходимо обработать раствором соды и .
Для придания блеска волосам после мытья головы их необходимо обработать раствором соды и .
Для похудения
Бикарбонат натрия также используется для похудения. Чтобы сбросить до 2 кг за одну процедуру, можно наполнить ванну теплой водой и растворить в ней 0,5 кг и 0,3 кг обычной пищевой соды. Худеющим нужно погрузиться в такую ванну на 20 минут. При этом температура воды должна быть около 40°С. Содово-солевой раствор расслабляет мышцы, снимает усталость и нервное напряжение, очищает лимфатические сосуды, уменьшает отек тканей. После ванны не следует вытираться: достаточно надеть теплый халат. Делать такие водные процедуры лучше перед сном.
Другое применение
Незаменимая газировка в кампаниях. Она умеет:
- мыть посуду без вреда для окружающей среды;
- заменить зубную пасту;
- потушить пожар;
- смазывать кожу в местах укусов насекомых.
Избавиться от неприятного запаха от обуви можно, если протереть ее изнутри сухой содой или смочить содовым раствором. Смесь бикарбоната натрия и сахара убивает тараканов.
Смесь бикарбоната натрия и сахара убивает тараканов.
Промышленное использование
Сода пищевая как пищевая добавка Е500 применяется пищевой промышленностью при производстве хлебобулочных, мучных, кондитерских изделий, колбасных изделий, газированных напитков, а также для очистки промышленного оборудования.
Химическая промышленность использует двууглекислый натрий в производстве красителей, реактивов, бытовой химии, пенопласта. Порошковые огнетушители заправлены бикарбонатом.
В легкой промышленности сода применяется в кожевенном производстве, для изготовления искусственной кожи, шелковых и хлопчатобумажных тканей.
Как выбирать и хранить
Бикарбонат натрия следует хранить в закрытых упаковках, чтобы не накапливались запахи. Перед покупкой необходимо встряхнуть пачку газировки. Если из него выпадает мелкая пыль, это признак несвежести продукта и частичного разложения состава внутри пачки. Дома сразу пересыпьте порошок в герметичную емкость.
Сода должна храниться в сухих проветриваемых помещениях, вдали от сильно пахнущих продуктов. Температура хранения не ограничена, но нужно помнить, что чем она выше, тем быстрее продукт теряет свои свойства. Гарантийный срок хранения 12 месяцев, но если сода хранилась правильно и не потеряла своей реакционной способности, срок ее годности не ограничен.
Проверить реакционную способность бикарбоната можно простым способом: при гашении уксусом щепотки соды из пузырьков газа образуется пена.
Расширяя спектр использования соды в домашнем хозяйстве, каждая хозяйка может сэкономить свой бюджет и открыть для себя множество экологически чистых и гипоаллергенных средств для уборки, стирки и многого другого.
В Интернете много видео о том, как использовать пищевую соду, и мало информации о том, как сделать ее дома. Причина проста: такой продукт проще и дешевле приобрести в готовом виде, чем заморачиваться с его изготовлением. Однако есть и познавательный аспект проблемы. Давайте разберемся, как сделать соду в домашних условиях и использовать ее в быту.
Давайте разберемся, как сделать соду в домашних условиях и использовать ее в быту.
Как приготовить газировку дома?
Как приготовить газировку в домашних условиях
Прежде чем приступать к химическим экспериментам, решите, какую газировку вы хотите получить. Существует несколько видов вещества:
- сода пищевая (питьевая), или гидрокарбонат натрия, представляет собой белый нетоксичный порошок с соленым вкусом. Активно используется в кулинарии и медицине;
- кальцинированная сода, или карбонат натрия, является сильной щелочью, поэтому пригодна для хозяйственных нужд: для умягчения воды, мытья полов, мытья посуды и сантехники;
- едкий натр, или гидроксид натрия, представляет собой едкую щелочь, относящуюся к категории опасных веществ. Применяется в производстве бумаги, мыла, шампуней, средств для прочистки канализационных засоров.
В природе сода встречается в составе воды некоторых озер, поэтому выпаривание было древнейшим способом получения вещества. Помимо рассола, сырьем для его добычи служила зола сгоревших водорослей. Сейчас в общем объеме производства соды большую долю составляет искусственный продукт, полученный аммиачным способом.
Помимо рассола, сырьем для его добычи служила зола сгоревших водорослей. Сейчас в общем объеме производства соды большую долю составляет искусственный продукт, полученный аммиачным способом.
Как получить кальцинированную соду? Для этого в металлическую кружку насыпьте обычную соду. Затем нагревают на сильном огне, постоянно помешивая. Через 5-8 минут у вас будет карбонат вместо бикарбоната.
Полученную кальцинированную соду можно использовать для создания каустика
Сначала 20 г карбоната натрия растворяют в 150 мл воды. Затем раствор нагревают до полного исчезновения кристаллов соды. Далее добавить 14 г гашеной извести. Раствор фильтруют от осадка (мела). Каустик готов. Важно: все манипуляции выполняйте в перчатках, так как гидроксид, попадая на кожу, вызывает сильные химические ожоги.
Как использовать домашнюю соду
На основе кальцинированной соды можно приготовить раствор для чистки плитки, раковин, унитазов и ванных комнат. Для этого разведите 2-3 столовые ложки порошка в литре воды. Карбонат натрия удаляет даже застарелые пятна с льняных и хлопчатобумажных тканей.
Для этого разведите 2-3 столовые ложки порошка в литре воды. Карбонат натрия удаляет даже застарелые пятна с льняных и хлопчатобумажных тканей.
Введение.
(натрон, гидрокарбонат натрия, гидрокарбонат натрия) — кислотонейтрализующая натриевая соль. Пищевая сода представляет собой гидрокарбонат натрия NaHCO 3 , гидрокарбонат натрия. В общем, «сода» — это техническое название натриевых солей угольной кислоты H 2 CO 3 . В зависимости от химического состава соединения сода пищевая (сода пищевая, гидрокарбонат натрия, гидрокарбонат натрия, гидрокарбонат натрия) — NaHCO 3 , сода кальцинированная (карбонат натрия, безводный карбонат натрия) — Na 2 CO 3 и кристаллическая сода — Na 2 CO 3. 10H 2 O, Na 2 CO 3 .7H 2 O, Na 2 CO 3 .H 2 O. Искусственная пищевая сода (NaHCO3) представляет собой белый кристаллический порошок.
Современные содовые озера известны в Забайкалье и Западной Сибири; Озеро Натрон в Танзании и озеро Сирлз в Калифорнии очень известны. Трона, имеющая промышленное значение, была открыта в 1938 г. в составе эоценовых отложений реки Грин (Вайоминг, США).
Трона, имеющая промышленное значение, была открыта в 1938 г. в составе эоценовых отложений реки Грин (Вайоминг, США).
В США природная сода обеспечивает более 40% потребности страны в этом минерале. В России из-за отсутствия крупных месторождений соду из полезных ископаемых не добывают.
Сода была известна человеку примерно за полторы-две тысячи лет до нашей эры, а может быть, и раньше. Его добывали из содовых озер и извлекали из нескольких месторождений в виде полезных ископаемых. Первые сведения о получении соды путем выпаривания воды содовых озер относятся к 64 году нашей эры. До 18 века алхимикам всех стран представлялось некое вещество, шипящее с выделением какого-то газа под действием известных к тому времени кислот — уксусной и серной. Во времена римского врача Диоскорида Педания никто не имел представления о составе соды. В 1736 году французский химик, врач и ботаник Анри Луи Дюамель де Монсо впервые смог получить очень чистую соду из воды содовых озер. Ему удалось установить, что сода содержит химический элемент «Натрий». В России еще во времена Петра Великого сода называлась «зода» или «чесотка» и до 1860 года ее ввозили из-за границы. В 1864 году в России появился первый содовый завод по технологии француза Леблана. Именно благодаря появлению своих заводов сода стала более доступной и начала свой победный путь как химическое, кулинарное и даже лекарственное средство.
В России еще во времена Петра Великого сода называлась «зода» или «чесотка» и до 1860 года ее ввозили из-за границы. В 1864 году в России появился первый содовый завод по технологии француза Леблана. Именно благодаря появлению своих заводов сода стала более доступной и начала свой победный путь как химическое, кулинарное и даже лекарственное средство.
Что такое пищевая сода.
В промышленности, торговле и быту под названием соды называют несколько продуктов: сода кальцинированная — безводный карбонат натрия Na 2 CO 3 , сода двууглекислая — двууглекислый натрий NaHCO 3 , часто называемая также пищевой содой, кристаллическая сода Na 2 CO 3 .10H 2 O и Na 2 CO 3 .H 2 O и едкий натр, или едкий натр, NaOH. Обыкновенная сода, в зависимости от способа приготовления, бывает Леблан и аммиачная. Последний является более чистым продуктом. Кроме того, сода бывает либо в виде кальцинированной (безводной, кальцинированной), либо кристаллической. Эта сода содержит 10 частей воды.
Современная пищевая сода является типичным промышленным продуктом. Однако она была известна человечеству задолго до нашей эры в естественном состоянии и уже использовалась в кулинарии Древнего Египта, на территории которого находились содовые озера, выделявшие осадочную соду под палящим солнцем пустыни.
Однако она была известна человечеству задолго до нашей эры в естественном состоянии и уже использовалась в кулинарии Древнего Египта, на территории которого находились содовые озера, выделявшие осадочную соду под палящим солнцем пустыни.
В природе сода встречается в твердом виде в мелких месторождениях в составе тронного минерала Na 2 CO 3 NaHCO 3 .2H 2 O, в виде раствора в воде некоторых содовых озер и щелочных минеральных источников и в пепел некоторых растений. До начала XIX в. использовалась почти исключительно натуральная сода, но с ростом потребления соды возникла необходимость производить соду в больших масштабах искусственным путем. В настоящее время добыча натуральной соды крайне мала. Имеются содовые озера (в Кулундинской степи), но природная сода составляет небольшой процент от общего объема ее производства. Промышленное производство очищенного продукта тесно связано с производством соды, так как в качестве сырья для производства очищенной пищевой соды используется карбонат натрия (или гидрокарбонат-сырец), а также углекислый газ из печей для обжига извести.
В настоящее время в мире производится несколько миллионов тонн соды в год для промышленного производства, пищевой и медицинской промышленности.
Сода была искусственно получена только в конце XVIII века во Франции химиком Лебланом (1791). Секрет получения, как это было принято тогда, долгое время держался в секрете, в результате чего сода впервые стала активно использоваться во французской кулинарии, особенно во французских кондитерских изделиях, и в первую очередь при изготовлении бисквитов и другое французское печенье, тогда как кондитерское дело в других странах — например, в Австрии, в России — развивалось в другом направлении, с использованием других, преимущественно дрожжевых тесторазрыхлителей. Вот почему во Франции, помимо бисквитов, господствовала сухая и слоеная выпечка, а в Германии и Польше, где работали французские повара, было разработано песочное содовое тесто, а Вена до 20 века оставалась центром великолепных кондитерских изделий и славится его превосходное дрожжевое «венское тесто» — верх умелого использования дрожжей в кондитерских изделиях. Лишь в 1861 г. бельгийский химик Э. Сольве разработал современный способ получения соды, на который во второй половине XIX в. перешли все страны Европы и США.го и начала 20 века.
Лишь в 1861 г. бельгийский химик Э. Сольве разработал современный способ получения соды, на который во второй половине XIX в. перешли все страны Европы и США.го и начала 20 века.
Только после Первой мировой войны и революции 1917 года содовые кондитерские изделия получили развитие в СССР, в 20-30-е годы, в основном через сеть общественного питания, т. к. содовое тесто позволяет добиться стереотипности, эталона хлебобулочных изделий ( одинаковость по своему весу, форме, очертаниям). А после ВОВ основное место в России в домашней кулинарии заняли содовые кондитерские изделия в связи с утратой новыми поколениями навыков создания традиционных русских национальных сладостей, а также в связи с редким появлением в продаже дрожжей и различных пряностей. использовавшиеся ранее в русских кондитерских изделиях (бадьян, калган, корица, имбирь, черный перец, апельсиновая цедра).
Характеристики пищевой соды.
Химические свойства.
Бикарбонат натрия представляет собой кислую натриевую соль угольной кислоты. Молекулярная масса (по международным атомным массам 1971 г.) — 84,00.
Молекулярная масса (по международным атомным массам 1971 г.) — 84,00.
Реакция с кислотами.
Гидрокарбонат натрия реагирует с кислотами с образованием соли и угольной кислоты, которая немедленно разлагается на углекислый газ и воду:
NaHCO 3 + HCl → NaCl + H 2 CO 3
H 2 CO 3 → H 2 O + CO 2
в приготовление пищи, чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
NaHCO 3 + CH 3 COOH → CH 3 COONa + H 2 O + CO 2
Пищевая сода хорошо растворяется в воде. Водный раствор пищевой соды имеет слабощелочную реакцию. Шипение соды является результатом выделения углекислого газа СО 2 в результате химических реакций.
Термическое разложение.
При температуре 60°С гидрокарбонат натрия разлагается на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200°С):
2NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2
При дальнейшем нагревании до 1000 °С (например, при тушении пожара порошковыми системами) образующийся карбонат натрия разлагается на углекислый газ и оксид натрия:
Na 2 CO 3 → Na 2 O + CO 2 .
Физические и химические индикаторы.
Бикарбонат натрия представляет собой белый кристаллический порошок со средним размером кристаллов 0,05–0,20 мм. Молекулярная масса соединения 84,01, плотность 2200 кг/м³, насыпная плотность 0,9 г/см³. Теплота растворения гидрокарбоната натрия рассчитывается как 205 кДж (48,8 ккал) на 1 кг NaHCO 3 , теплоемкость достигает 1,05 кДж/кг.К (0,249ккал/кг. °С).
Гидрокарбонат натрия термически неустойчив и при нагревании разлагается с образованием твердого карбоната натрия и выделением углекислого газа, а также воды в газовую фазу:
2NaHCO 3 (тв.) ↔ Na 2 CO 3 (тв. ) + CO 2 (г.) + H 2 O (пар) — 126 кДж (- 30 ккал) Аналогично разлагаются водные растворы гидрокарбоната натрия:
2NaHCO 3 (ч.) ↔ Na 2 CO 3 (ч.) + CO 2 (г.) + H 2 O (пар) — 20,6 кДж (- 4,9 ккал) Водный раствор гидрокарбоната натрия имеет слабощелочной характер, в связи с чем не действует на ткани животных и растений. Растворимость гидрокарбоната натрия в воде низкая и с повышением температуры несколько увеличивается: от 6,87 г на 100 г воды при 0°С до 19. 17 г на 100 г воды при 80°С.
17 г на 100 г воды при 80°С.
Из-за малой растворимости плотность насыщенных водных растворов гидрокарбоната натрия относительно мало отличается от плотности чистой воды.
Температура кипения (разлагается): 851°С;
Температура плавления: 270°С;
Плотность: 2,159 г/см³;
Растворимость в воде, г/100 мл при 20°С: 9.
Применение.
Натрий двууглекислый (бикарбонат) применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Зарегистрирован как пищевая добавка E500.
Широко применяется в:
- химической промышленности — для производства красителей, пен и других органических продуктов, фторреактивов, бытовой химии, наполнителей в огнетушителях, для выделения углекислого газа, сероводорода из газовых смесей (газ поглощается в гидрокарбонатного раствора при высоком давлении и низкой температуре, раствор восстанавливается при нагревании и пониженном давлении).

- легкая промышленность — в производстве подошвенной резины и искусственной кожи, производстве кожи (дубление и обезвреживание кожи).
- Текстильная промышленность (отделка шелковых и хлопчатобумажных тканей). Использование бикарбоната натрия в производстве резинотехнических изделий также обусловлено выделением СО 2 при нагревании, что способствует приданию каучуку необходимой пористой структуры.
- пищевая промышленность — хлебобулочные, кондитерские изделия, напитки.
- медицинская промышленность — для приготовления инъекционных растворов противотуберкулезных препаратов и антибиотиков.
- металлургия — при осаждении редкоземельных металлов и флотации руд.
Кулинария.
Основное применение пищевой соды – приготовление пищи, где она используется в основном в качестве основного или дополнительного разрыхлителя в выпечке (поскольку при нагревании выделяет углекислый газ), в производстве кондитерских изделий, в производстве газированных напитков и искусственных минералов воды, отдельно или в составе сложных разрыхлителей (например, разрыхлителей, смешанных с карбонатом аммония), например, в бисквитном и песочном тесте. Это связано с легкостью его разложения при 50-100°С.
Это связано с легкостью его разложения при 50-100°С.
Сода пищевая, в основном используется при изготовлении мелкого печенья, кондитерской крошки, коржей и слоеных пирожных. В последней четверти XIX в. использование его в кондитерских изделиях началось сначала только во Франции и Германии, и только в самом конце 19 века и в начале 20 века — еще и в России.
Использование соды открыло путь к фабричному производству современного печенья — штамповки. В то же время многие старые виды печенья — бисквитное, слоеное, ломаное, пряничное, слоеное, безе — ушли в прошлое, исчезли не только из общественного, но и из бытового обихода.
Сода — необходимый повседневный помощник на кухне для мытья посуды, консервирования тары, некоторых фруктов и ягод перед сушкой. Обладает способностью нейтрализовать и убивать запахи.
Ошибочно думать, что сода — пряность только для кондитерских изделий. Помимо кондитерского производства, сода используется также для приготовления английских мармеладов, в фаршах для блюд молдавской, румынской и узбекской кухни (калийная сода) и при приготовлении напитков. Количество соды, добавляемой во все перечисленные продукты, крайне мало — от «на кончике ножа» до щепотки с четвертью чайной ложки. В напитках с газировкой ее доля намного выше – половина и полная чайная ложка на литр жидкости. Для кондитерских и других целей соду кладут по рецептам рецептов, обычно это очень малые дозы. Хранить в герметичном контейнере, брать сухим предметом.
Количество соды, добавляемой во все перечисленные продукты, крайне мало — от «на кончике ножа» до щепотки с четвертью чайной ложки. В напитках с газировкой ее доля намного выше – половина и полная чайная ложка на литр жидкости. Для кондитерских и других целей соду кладут по рецептам рецептов, обычно это очень малые дозы. Хранить в герметичном контейнере, брать сухим предметом.
Получение соды промышленным способом дало широкие возможности в приготовлении многих видов современных кондитерских изделий в европейских странах. Долгое время Россия шла по традиционному пути, предпочитая дрожжевое и другие виды теста.
В России до второй половины XIX века сода вообще не применялась в хлебобулочных и кондитерских изделиях. А в самом конце 19 века изделий такого рода больше всего производили на Украине и в Польше, а также в Прибалтике. Русское население, с незапамятных времен привыкшее к натуральным видам теста — либо дрожжевому, либо закваске, либо медово-яичному, где в качестве разрыхлителя использовались не искусственные химические вещества, а использовались газы, естественным образом возникающие при выпечке, в результате взаимодействия таких продуктов, как мед (сахар), яйца, сметана, спирт (водка) или винный уксус — содовое печенье имело крайне низкую популярность и низкий спрос.
Кондитерские изделия на основе соды считались «немецкими» и игнорировались как по чисто кулинарным и вкусовым соображениям, так и по «патриотическим».
Кроме того, русские национальные кондитерские изделия — медовые пряники и имбирные пряники, глазированные жемчуг и орехи, сваренные в меду, — обладали столь неповторимо превосходным вкусом, что успешно конкурировали с западноевропейскими, более изысканными по форме, но «хлипкими» по сытности , добротность. и вкус французских бисквитов, где привлекательность достигалась вовсе не особым характером теста, а использованием экзотических пряностей, в основном ванили.
Кроме кондитерских изделий, сода в русской кухне никогда не использовалась и фактически не используется до сих пор. Между тем в странах Балтии, Молдавии, Румынии и на Балканах сода используется в качестве разрыхлителя в ряде блюд, приготовленных путем жарки. Так, соду добавляют в разнообразные жареные полуфабрикаты: драники, в состав которых входит и пшеничная мука; разнообразные блины, сметанные и пончики, сырники из сочетания творога и муки, а также фарша, если они состоят только из мяса и лука, без добавления мучных компонентов (мука, белый хлеб, панировочные сухари) . Такой сырой фарш (говяжий, свиной) оставляют с содовой добавкой постоять в холодильнике на несколько часов, а затем из этого фарша легко формируются «колбаски», которые быстро (минут за 10-15) обжариваются в духовке. печь из любой бытовой плиты (газовой, дровяной или электрической).
Такой сырой фарш (говяжий, свиной) оставляют с содовой добавкой постоять в холодильнике на несколько часов, а затем из этого фарша легко формируются «колбаски», которые быстро (минут за 10-15) обжариваются в духовке. печь из любой бытовой плиты (газовой, дровяной или электрической).
Подобное применение соды в фарше известно и в армянской кухне, с той лишь разницей, что в таких случаях фаршу не дают отстояться, а сразу же подвергают интенсивному взбиванию с добавлением нескольких капель (5 -8) коньяка, а фактически превращается в мясное суфле, используемое для приготовления различных национальных блюд (преимущественно калолака).
В англоязычных странах Европы и Америки (Англия, Шотландия, на восточном побережье США и Канаде) сода используется как незаменимая добавка в варенье из цитрусовых (апельсины, пампельмосы, лимоны, грейпфруты), а также для приготовления цукатов. В результате достигается особая усвояемость цитрусов, их твердая кожура, превращение такого варенья в подобие густого мармелада, и в то же время снижается степень неприятной горечи, всегда присутствующей в кожуре цитрусовых. (но не исчезает полностью!) Корки апельсинов, составляющие для нас своеобразный балласт, отходы от употребления этих фруктов, с помощью соды становятся ценным сырьем для получения ароматного высокопитательного мармелада .
(но не исчезает полностью!) Корки апельсинов, составляющие для нас своеобразный балласт, отходы от употребления этих фруктов, с помощью соды становятся ценным сырьем для получения ароматного высокопитательного мармелада .
В среднеазиатских кухнях соду используют при приготовлении некондитерских видов простого теста, чтобы придать ему особую эластичность и превратить в разливное без использования для этого растительного масла, как это принято в южно-европейской, средиземноморской и Балканские кухни. В Средней Азии кусочки простого пресного теста после обычной получасовой выдержки смачивают небольшим количеством воды, в которой растворены 0,5 ч. ложки соли и 0,5 ч. тончайшая лапша (так называемая дунганская лапша), обладающая нежным, приятным вкусом и используемая для приготовления национальных блюд (лагман, монпара, шимы и др.).
Сода как скудная добавка к любой пище в процессе приготовления, а именно при термической обработке, добавляется во многих национальных кухнях, учитывая, что в ряде случаев это дает не только неожиданный вкусовой эффект, но и обычно очищает пищевое сырье и все блюдо от разных случайных побочных запахов и вкусов.
Вообще роль газировки на кухне, даже помимо кулинарного процесса, весьма значительна. Ведь без соды практически невозможно идеально очистить столовую и кухонную эмалированную, фарфоровую, стеклянную и фаянсовую посуду, а также кухонный инвентарь и оборудование от посторонних запахов и различных налетов и патин. Сода особенно незаменима и необходима при очистке чайной посуды — чайников и чашек от чайного налета и пленок, образовавшихся на их стенках.
В равной степени необходимо использовать соду при мытье посуды, в которой готовилась рыба, чтобы отбить рыбный запах. Обычно делают так: отбивают стойкий рыбный запах, протирая посуду с луком, а затем уничтожают (смывают) луковый запах, чистя эту посуду содой.
Одним словом, сода – незаменимая составляющая кухонного производства, и без нее на хорошей кухне не обойтись. Более того, ее отсутствие в арсенале повара или хозяйки становится сразу заметным, ибо она сковывает во многих своих действиях того, кто работает у плиты или за разделочным столом.
Современные экологические обстоятельства вызвали очередное новое использование соды на кухне как средства улучшения качества растительного сырья. Можно, например, порекомендовать мыть все обработанные, но еще не нарезанные овощи — перед тем, как положить их в котел или на сковороду, — в растворе соды в воде. Или добавить одну-две чайные ложки соды в уже очищенный картофель, залитый холодной водой и предназначенный для варки или пюре. Это не только очистит картофель от химикатов, которые использовались при его выращивании, но и сделает сам продукт светлее, чище, красивее, уберет все побочные запахи, приобретенные при транспортировке или неправильном хранении, а также порчу. Сама картошка после приготовления станет рассыпчатой и вкусной. Таким образом, использование соды перед варкой, при холодной обработке (затем продукт тщательно промывается холодной водой), позволяет улучшить качество растительного пищевого сырья, в частности крахмалистых овощей, корнеплодов и листовых культур (капуста, салат, шпинат, петрушка и др. ). .).
). .).
Сода настолько прочно заняла место щелочного средства, что до сих пор ничто не могло сдвинуть ее с этой позиции. Пищевая сода в качестве разрыхлителя может работать двумя способами. Сначала он разлагается при нагревании по реакции:
2NaHCO 3 (сода) → Na 2 CO 3 (соль) + H 2 O (вода) + CO 2 (углекислый газ).
И в этом случае, если добавить в песочное тесто избыточное количество соды, оно может не успеть термически разложиться без остатка за короткое время выпечки, и печенье или торт приобретет неприятный «содовый» привкус.
Так же, как и поташ, сода реагирует с кислотами, содержащимися в тесте или искусственно добавленными туда:
NaHCO 3 (сода) + R-COOH (кислота) → R-COONa (соль) + H 2 O (вода) + CO 2 (углекислый газ)
Много разных фирменных пакетиков и их доступность не отменяет развлечения для юных химиков — сделать разрыхлитель своими руками.
пропорциональный состав такого традиционного порошка:
2 части кислой винной соли
1 часть пищевой соды
1 часть крахмала или муки.
Лекарство.
Все знают, как выглядит сода – это белый порошок, который впитывает воду и прекрасно в ней растворяется. Но мало кто знает об удивительных целебных свойствах этого «простого» вещества. Между тем, сода — бикарбонат натрия — является одним из основных ингредиентов нашей крови. Результаты исследования влияния соды на организм человека превзошли все ожидания. Оказалось, что сода способна выровнять кислотно-щелочной баланс в организме, восстановить обмен веществ в клетках, улучшить усвоение кислорода тканями, а также предотвратить потерю жизненно важного калия. Сода помогает при изжоге, морской болезни, простуде, сердечных и головных болях, кожных заболеваниях. Как видите, сода – это средство первой помощи.
Раствор пищевой соды применяют как слабый антисептик для полосканий, а также как традиционное кислотонейтрализующее средство при изжоге и желудочных болях (современная медицина не рекомендует использовать из-за побочных эффектов, в том числе из-за «кислотного рикошета») или для устранения ацидоза и др.
Сода пищевая применяется для лечения заболеваний, связанных с повышенной кислотностью; раствор пищевой соды используют для полоскания горла, для промывания кожи при контакте с кислотами.
Бикарбонат натрия (пищевая сода) может замедлить прогрессирование хронического заболевания почек. К такому выводу пришли ученые из Королевской лондонской больницы (Royal London Hospital), Великобритания. Они изучили 134 человека с прогрессирующим хроническим заболеванием почек и метаболическим ацидозом.
Одна группа испытуемых получала обычное лечение, а вторая группа, в дополнение к традиционному лечению, ежедневно получала небольшое количество таблеток пищевой соды. У тех больных, которые пили бикарбонат натрия, функция почек ухудшалась на 2/3 медленнее, чем у остальных.
Быстрое прогрессирование заболевания почек наблюдалось только у 9% участников группы, принимавших содовую, по сравнению с 45% пациентов, получавших традиционное лечение. Кроме того, у тех, кто принимал газированные напитки, была меньше вероятность развития терминальной стадии почечной недостаточности, требующей диализа. Примечательно, что увеличение содержания гидрокарбоната натрия в организме не вызывало повышения АД у больных.
Примечательно, что увеличение содержания гидрокарбоната натрия в организме не вызывало повышения АД у больных.
Сода — недорогое и эффективное средство от хронической болезни почек. Однако исследователи предупреждают: принимать соду следует под наблюдением врача, который должен правильно рассчитать дозировку для пациента.
Лечебные свойства пищевой соды.
Ранее бикарбонат натрия применялся очень широко (как и другие щелочи) в качестве антацида при повышенной кислотности желудочного сока, язвенной болезни желудка и двенадцатиперстной кишки. При приеме внутрь пищевая сода быстро нейтрализует соляную кислоту желудочного сока и оказывает выраженное антацидное действие. Однако польза соды — это не только блестяще вымытая посуда и избавление от изжоги. Пищевая сода занимает достойное место в домашней аптечке.
Подобно древним египтянам, которые получали природную соду из озерных вод путем выпаривания, люди использовали и другие свойства соды. Обладает нейтрализующими свойствами, используется в медицинской практике для лечения гастритов с повышенной кислотностью. Способен убивать микробы, используется как дезинфицирующее средство: соду применяют для ингаляций, полосканий, очищения кожи.
Способен убивать микробы, используется как дезинфицирующее средство: соду применяют для ингаляций, полосканий, очищения кожи.
Сода также широко используется в здравоохранении.
Профилактика кариеса.
Кислоты, образующиеся во рту в результате жизнедеятельности бактерий, разрушают эмаль зубов. Эти кислоты можно нейтрализовать, если несколько раз в день полоскать рот раствором пищевой соды. Можно поступить иначе: смочите зубную щетку водой, обмакните ее в пищевую соду и почистите зубы. Сода, кроме того, обладает легким абразивным действием: она отполирует зубы, не повреждая эмаль.
От неприятного запаха ног.
Пищевая сода, добавленная в воду для ванночек для ног, нейтрализует кислоты, вырабатываемые бактериями, которые придают ногам неприятный запах. Пищевая сода также поможет устранить сильный запах пота под мышками.
От укусов насекомых.
Не расчесывайте места укусов комаров и других кровососов до появления крови. Лучше приготовить кашеобразную смесь воды и соды и нанести на место укуса. Содовая кашица также снимет зуд, вызванный ветряной оспой или контактом кожи с борщевиком, крапивой.
Содовая кашица также снимет зуд, вызванный ветряной оспой или контактом кожи с борщевиком, крапивой.
При опрелостях.
Содовые лосьоны значительно улучшают состояние малышей при опрелостях. Они уменьшают зуд и ускоряют заживление кожи.
При цистите.
Болезнетворные бактерии обитают в мочевом пузыре в слабокислой среде. Если ваш мочевой пузырь стал жертвой инфекции, идеальным послеобеденным напитком для вас будет шипучий коктейль из пищевой соды и воды.
От солнечных ожогов.
Добавьте немного пищевой соды в теплую ванну, чтобы смягчить воду и превратить ее в успокаивающий лосьон для раздраженной кожи.
От боли в горле.
Размешать 0,5 ч. л. ложки соды на стакан воды и каждые 4 часа полоскать горло приготовленным раствором: он нейтрализует кислоты, вызывающие боль. Полоскание этим раствором полости рта поможет снять воспаление слизистой оболочки полости рта.
От неприятного запаха изо рта.
В сочетании с перекисью водорода пищевая сода оказывает мощное окисляющее действие и уничтожает бактерии, вызывающие неприятный запах изо рта. Добавьте 1 стол. ложку соды на стакан раствора перекиси водорода (2-3%) и прополоскать рот.
Добавьте 1 стол. ложку соды на стакан раствора перекиси водорода (2-3%) и прополоскать рот.
При простуде.
Полезно делать ингаляции. Для этого можно взять небольшой чайник, вскипятить в нем 1 стакан воды с 1 чайной ложкой. ложка соды. Сделайте из плотной бумаги трубочку, наденьте ее на носик чайника и вдыхайте пар в течение 10-15 минут. Эта ингаляция очень полезна для отделения мокроты.
Для отхаркивания вязкой мокроты 2 раза в день выпивать натощак 1/2 стакана теплой воды, в которой растворяют 0,5 чайной ложки. ложки соды и щепотка соли.
При частых мигренях.
Ежедневно принимать раствор кипяченой воды с пищевой содой. В 1-й день за 30 минут до обеда выпить 1 стакан раствора (0,5 чайной ложки соды + вода), 2-й день — 2 стакана и т. д., доведя до 7 стаканов. Затем уменьшайте дозу в обратном порядке.
Прочее.
При ринитах, стоматитах, ларингитах, конъюнктивитах применяют 0,5-2% раствор соды.
Для обеззараживания слизистой оболочки полости рта полезно полоскать рот слабым раствором (сода — 85 г, соль — 85 г, мочевина — 2,5 г) после еды.
Средство от курения: прополоскать рот раствором пищевой соды (1 столовая ложка на 200 мл воды).
При сухости кожи, сухом дерматите, ихтиозе и псориазе полезны лечебные ванны (сода — 35 г, магнезия карбонат — 20 г, магния перборат — 15 г). Температура воды не должна быть выше 38-39°С, сначала нужно просто посидеть в теплой ванне, затем постепенно повышать температуру. Продолжительность ванны 15 минут.
Пожаротушение.
Бикарбонат натрия входит в состав порохов, используемых в системах порошкового пожаротушения, утилизирующих тепло и вытесняющих кислород из источника горения выделяющимся углекислым газом.
Чистка оборудования. Технология абразивоструйной очистки (АКО).
Очистка оборудования и поверхностей от различных покрытий и загрязнений производится по технологии абразивоструйной очистки (АКО) оборудования. Гидрокарбонат натрия используется в качестве абразива (пищевая сода, гидрокарбонат натрия, гидрокарбонат натрия, NaHCO 3 , гидрокарбонат натрия). Технология
Технология
ACO с использованием бикарбоната натрия — новый эффективный способ очистки оборудования с использованием «мягкого» абразива. Абразив приводится в движение сжатым воздухом, создаваемым компрессором. Этот метод получил коммерческое признание и уже 25 лет широко используется в Европе и США благодаря своей универсальности и экономической целесообразности.
Обработка поверхности оборудования аналогична обычной пескоструйной очистке. Отличие заключается в том, что частицы соды являются «мягким» абразивным материалом, то есть не повреждают саму поверхность.
Принцип:
Хрупкая частица кислого карбоната натрия взрывается при контакте с очищаемой поверхностью.
Энергия, выделяемая этой вспышкой, удаляет грязь с очищаемой поверхности. Абразивные частицы соды полностью разбиваются на мелкую пыль, которая легко разлетается в разные стороны перпендикулярно падению, усиливая очищающий эффект. В целях пылеподавления содоструйную очистку оборудования обычно проводят с помощью увлажнения, то есть гидроабразивноструйной очистки (ГАСО) оборудования. Карбонат натрия растворяется в воде. Таким образом, использованный абразив растворится или может быть смыт после завершения очистки.
Карбонат натрия растворяется в воде. Таким образом, использованный абразив растворится или может быть смыт после завершения очистки.
Это отличается от кварцевого песка, который срезает покрытие. Кварцевый песок также стирает часть очищаемой поверхности, которую сода оставляет практически невредимой. Различий между этими видами очистительного оборудования еще много, но они уже являются следствием свойств абразивов. Абразивы на основе растворимого бикарбоната натрия
специально разработаны для абразивоструйной очистки оборудования. Сыпучие свойства абразивов снижают плотность потока, связанную с плохой текучестью обычного карбоната натрия.
Технологии производства соды.
Сода была впервые получена в 1793 году компанией Leblanc, а пищевая очищенная сода была произведена в 1861 году компанией Solvay.
В конце XVIII начале XIX в. для получения искусственной соды стали применять метод Леблана, суть которого заключается в следующем: из поваренной соли сначала получали сульфат натрия действием на нее серной кислоты, затем сульфат натрия сплавляли при высокой температуре с карбонатом кальция и каменный уголь. Из полученного сплава водой выщелачивали соду. Затем раствор упаривали.
Из полученного сплава водой выщелачивали соду. Затем раствор упаривали.
Изобретение бельгийским ученым Э. Сольве в середине 19 века аммиачного способа получения соды способствовало ее интенсивному внедрению, прежде всего, в кондитерское дело. Основным способом искусственного производства соды в настоящее время во всех странах является аммиачный способ производства кальцинированной соды, являющейся сырьем для производства других содовых продуктов. Сначала Франция и Германия использовали соду как технологическую добавку для разрыхления теста с целью увеличения его объема и улучшения качества. Сода делает тесто мягким, пышным, легкоусвояемым. С конца 19-начало 20 века соду стали использовать и другие страны, в том числе и Россия.
В настоящее время сода добывается промышленным аммиачным методом (метод Сольвея).
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и углекислого газа, т. е. как если вводят бикарбонат аммония NH 4 HCO 3 :
NH 3 + CO 2 + H 2 O + NaCl → NaHCO 3 + NH 4 кл.
Выпавший осадок малорастворимого (9,6 г на 100 г воды при 20°С) бикарбоната натрия отфильтровывают и прокаливают (обезвоживают) при нагревании до 140 — 160°С, при этом он переходит в карбонат натрия:
2NaHCO 3 →(т) Na 2 CO 3 + CO 2 + H 2 O
Образовавшиеся диоксид углерода и аммиак выделяют из маточного раствора на первой стадии процесса по реакции:
2NH 4 Cl + Ca(OH ) 2 → CaCl 2 + 2NH 3 + 2H 2 O возвращается в производственный цикл.
Аммонизация раствора необходима для введения в него углекислого газа, малорастворимого в насыщенном растворе. Выпавший в виде кристаллов гидрокарбонат натрия отфильтровывают от раствора, содержащего хлорид аммония и непрореагировавший NaCl, и прокаливают (прокаливают). При этом происходит образование кальцинированной соды.
Выделяющиеся при прокаливании газы, содержащие углекислый газ СО 2 , используют для карбонизации. Таким образом, часть отработанного углекислого газа регенерируется.
Необходимый для процесса углекислый газ получают путем обжига известняка или мела. Негашеную известь СаО гасят водой.
Негашеную известь СаО гасят водой.
Гашеная известь Ca(OH) 2 смешивается с водой. Полученное известковое молоко используют для регенерации аммиака из раствора (фильтрующей жидкости), полученного после отделения бикарбоната и содержащего хлористый аммоний.
Для производства соды используется раствор поваренной соли (рапа) концентрацией около 310 г/л, получаемый в природных условиях путем подземного выщелачивания соляных месторождений. Помимо NaCl, в природной рапе обычно содержатся соли кальция и магния. При аммонизации и карбонизации рассола в результате взаимодействия этих примесей с NH 3 и СО 2 будут происходить осадки, что приведет к загрязнению аппарата, нарушению теплообмена и нормального течения процесса. Поэтому рассол предварительно очищают от примесей: их осаждают, добавляя в рассол строго определенное количество реагентов — суспензии соды в очищенном рассоле и известковом молоке. Этот способ очистки называется натронно-известковым. Образовавшиеся осадки гидрата магния и карбоната кальция разделяют в отстойниках.
Очищенный и осветленный рассол поваренной соли направляется в барботажную абсорбционную колонну. Верхняя часть колонны используется для промывки рассолом газа, отсасываемого вакуумным насосом из вакуум-фильтров, и газа из колонны карбонизации. Эти газы содержат небольшое количество аммиака и углекислого газа, которые целесообразно промывать свежим рассолом и, таким образом, более полно использовать их в производстве. Нижняя часть колонны служит для насыщения рассола аммиаком, поступающим из ректификационной колонны. Полученный аммиачно-солевой рассол затем направляют в барботажную колонну карбонизации, где происходит основная реакция превращения сырья в бикарбонат натрия. Необходимый для этой цели диоксид углерода CO 2 поступает из шахтной печи для обжига извести и кальцинатора бикарбоната натрия и впрыскивается в колонну снизу.
Карбонизация аммиачно-солевого раствора – важнейшая стадия производства соды. Образование бикарбоната натрия при карбонизации происходит в результате сложных химических процессов, протекающих в колонне карбонизации. В верхней части колонны из аммиака, содержащегося в рассоле, и углекислого газа, подаваемого в колонну, образуется карбонат аммония.
В верхней части колонны из аммиака, содержащегося в рассоле, и углекислого газа, подаваемого в колонну, образуется карбонат аммония.
По мере прохождения рассола через колонну сверху вниз карбонат аммония, реагируя с избытком углекислого газа, поступающим снизу колонны, переходит в бикарбонат аммония (бикарбонат аммония).
Примерно в середине верхней неохлаждаемой части колонны начинается реакция обменного разложения, сопровождающаяся выпадением кристаллов гидрокарбоната натрия и образованием в растворе хлорида аммония. С), однако охлаждать его не нужно, так как эта температура способствует образованию более крупных, хорошо фильтрующихся кристаллов бикарбоната натрия. В нижней части колонны необходимо охлаждение для снижения растворимости бикарбоната натрия и увеличения его выхода. В зависимости от температуры, содержания NaCl в рассоле, степени насыщения аммиаком и углекислым газом и других факторов выход бикарбоната составляет 65-75%. Полностью превратить поваренную соль в осадок бикарбоната натрия практически невозможно. Это один из существенных недостатков производства соды аммиачным способом.
Это один из существенных недостатков производства соды аммиачным способом.
Способы производства бикарбоната натрия.
Бикарбонат натрия — промежуточный продукт промышленного производства кальцинированной соды по методу Сольве, заключающемуся в пропускании эквимолярных (т.е. содержащих равное количество молей) количеств газообразных аммиака и диоксида углерода через насыщенный раствор хлорида натрия, имитирующий введение гидрокарбоната аммония NH 4 HCO 3 в систему:
NH 3 + H 2 O + CO 2 + NaCl / NH 4 HCO 3 → NaHCO 3 + NH 4 Cl.
В полученном растворе наименее растворимой солью является бикарбонат натрия, который выпадает в виде кристаллического осадка. При этом важно отметить, что очищенный бикарбонат натрия является товарным видом этого продукта.
Наиболее распространенным методом очистки солей от примесей, как правило, является их перекристаллизация из растворов, причем в качестве растворителя чаще всего используется вода. Этот метод основан на свойстве большинства солей повышать растворимость при повышении температуры.
По методу перекристаллизации очищаемую соль растворяют в воде при высокой температуре, после чего раствор доводят до насыщения и затем охлаждают, причем последнему из этих процессов предшествует удаление нерастворенных примесей фильтрованием. При охлаждении раствора растворимость соли снижается, она выпадает в осадок и отфильтровывается. В результате проведенных мероприятий повышается чистота соли, так как все примеси, входящие в ее состав, перед проведением процесса растворяются в воде и переходят в фильтрат, являющийся маточной жидкостью, который возвращается в Начальная стадия. По мере циркуляции маточной жидкости в ней накапливаются примеси, что в конечном итоге отрицательно сказывается на чистоте получаемых продуктов и вызывает необходимость периодического удаления части фильтрата из цикла.
Однако если соль, как и бикарбонат натрия, плохо растворима в воде, то очищать ее перекристаллизацией экономически невыгодно, так как для получения единицы массы чистого продукта в системе должно циркулировать большое количество маточной жидкости, что требует попеременного нагрева и охлаждения. В связи с этим обстоятельством в промышленных масштабах очищенную пищевую соду получают не перекристаллизацией, а карбонизацией содового раствора пропусканием диоксида углерода под давлением в насыщенный раствор карбоната натрия при температуре около 75°С по методике реакция:
В связи с этим обстоятельством в промышленных масштабах очищенную пищевую соду получают не перекристаллизацией, а карбонизацией содового раствора пропусканием диоксида углерода под давлением в насыщенный раствор карбоната натрия при температуре около 75°С по методике реакция:
Na 2 CO 3 (ч.) + CO 2 (г.) + H 2 O (ж.) ↔ 2NaHCO 3 (тв.) + 52,4 кДж (+ 12,5 ккал).
Практическое применение метода карбонизации позволяет значительно уменьшить объем жидкости, необходимой для получения единицы гидрокарбоната натрия, так как растворимость кальцинированной соды в несколько раз превышает соответствующий показатель гидрокарбоната натрия.
Содовый раствор для карбонизации получают растворением в воде твердой технической соды, которая образуется при прокаливании гидрокарбоната-сырца (этот процесс называется «сухим» способом) или разложением гидрокарбоната натрия в водной среде при нагревании (« «мокрый» способ), который называется обезуглероживанием, по реакциям:
2NaHCO 3 (ч.) ↔ Na 2 CO 3 (ч. ) + CO 2 (г.) + H 2 O (пар) — 20,6 кДж (- 4,9 ккал).
) + CO 2 (г.) + H 2 O (пар) — 20,6 кДж (- 4,9 ккал).
Чистую пищевую соду, выпадающую в осадок при насыщении содового раствора диоксидом углерода, отделяют, а маточный раствор, содержащий смесь карбоната и бикарбоната натрия, а также растворенные примеси (например, NaCl), возвращают в начало процесс получения начального решения. Из-за многократной циркуляции маточного раствора в нем накапливаются примеси, которые могут засорить очищенный продукт. В результате часть маточной жидкости выводится из цикла и обычно направляется на рассол для разбавления крепкого содового раствора.
Разоблачение реакции: большой холод! — Деятельность
(4 рейтинга)Нажмите здесь, чтобы оценить
Quick Look
Уровень: 10 (9-11)
Необходимое время: 2 часа 45 минут
(три сеанса по 55 минут)
Расходные материалы Стоимость/группа: 3,00 долл. США
Размер группы: 2 2 0007
Зависимость от действия: Нет
предметных областей: Химия, наука и технологии
Ожидаемые характеристики NGSS:
| HS-ETS1-3 |
| HS-PS1-6 |
Доля:
TE Информационный бюллетень
youtube.com/embed/iJm_W-_-nQI?modestbranding=1&wmode=transparent&rel=0″ frameborder=»0″ webkitallowfullscreen=»» mozallowfullscreen=»» allowfullscreen=»» title=»Youtube embedded video»>Резюме
В присутствии воды лимонная кислота и бикарбонат натрия (он же пищевая сода) реагируют с образованием цитрата натрия, воды и углекислого газа. Учащиеся исследуют эту эндотермическую реакцию. Они тестируют стехиометрическую версию реакции с последующим тестированием различных возмущений стехиометрической версии, в которой каждый реагент (лимонная кислота, бикарбонат натрия и вода) стратегически удваивается или уменьшается вдвое, чтобы создать матрицу влияния на реакцию. Анализируя данные тестовой матрицы, они определяют оптимальные количества для использования в своих производственных компаниях, чтобы минимизировать материальные затраты и максимально увеличить производство углекислого газа. Они используют свои тестовые данные, чтобы «расширить» систему от пакета с застежкой-молнией размером в кварту до реакционного резервуара, равного объему их класса. Они собирают данные о температуре реакции и производстве углекислого газа. Более продвинутым учащимся предлагается теоретически предсказать результаты, используя стехиометрию.
Они собирают данные о температуре реакции и производстве углекислого газа. Более продвинутым учащимся предлагается теоретически предсказать результаты, используя стехиометрию.Эта учебная программа по инженерному делу соответствует научным стандартам следующего поколения (NGSS).
Инженерное подключение
Основное отношение к проектированию, представленное в этом упражнении, — это демонстрация взаимосвязей между масштабом на стенде и в натуральную величину. Хотя конечной целью может быть разработка резервуара на 50 000 галлонов, лучший путь открытия — работать с меньшими масштабами. Преимущества меньшего масштаба заключаются в том, что они 1) дешевле и проще в эксплуатации и строительстве, 2) могут быть безопаснее, если произойдет что-то неожиданное, потому что окружающую среду можно контролировать. Преимущество большого масштаба заключается в том, что он напрямую отражает реальную систему, поэтому для прогнозирования поведения не требуется никаких других испытаний.
Вторая инженерная идея, иллюстрируемая этим заданием, заключается в том, что инженер несет ответственность за разработку систем, которые обеспечивают максимальный результат с наименьшими затратами, оставаясь при этом безопасными. Например, в этом случае реакция является эндотермической и приводит к образованию газа. Неправильно спроектированный и некачественный резервуар может нанести ущерб людям и имуществу, если температура упадет до точки, при которой материал не выдержит. Кроме того, если размер резервуара слишком мал для количества производимого газа, взрыв резервуара может привести к катастрофическим повреждениям.
Цели обучения
После этого задания учащиеся должны уметь:
- Следуйте процедурам для сбора данных при изменении более чем одной переменной.
- Создайте линейные графики для представления данных.
- Интерпретация данных для прогнозирования общего поведения нескольких переменных.

- Опишите, как в этой деятельности применяются принципы инженерного проектирования, включая анализ затрат.
Цели:
- Математические способности: Навыки и понимание сбора и анализа данных, используемых в реальной жизни.
- Количественная грамотность: способность следовать процедурам и давать рекомендации.
- Инженерные приложения: процесс инженерного проектирования для контроля продуктов химической реакции, соображения стоимости, соответствующие производительности.
- Культурная значимость: соблюдение процедур, совместная работа в малых группах и практическая деятельность.
Образовательные стандарты
Каждый урок или занятие TeachEngineering связано с одной или несколькими науками K-12, технологические, инженерные или математические (STEM) образовательные стандарты.
Все более 100 000 стандартов K-12 STEM, включенных в TeachEngineering , собираются, поддерживаются и упаковываются Achievement Standards Network (ASN) ,
проект D2L (www. achievementstandards.org).
achievementstandards.org).
В ASN стандарты структурированы иерархически: сначала по источнику; напр. по штатам; внутри источника по типу; напр. , естественные науки или математика; внутри типа по подтипу, затем по классам, и т.д. .
NGSS: научные стандарты следующего поколения — наука
| Ожидаемая производительность NGSS | ||
|---|---|---|
ГС-ETS1-3. Оцените решение сложной реальной проблемы на основе приоритетных критериев и компромиссов, которые учитывают ряд ограничений, включая стоимость, безопасность, надежность и эстетику, а также возможные социальные, культурные и экологические последствия. (9-12 классы) Согласны ли вы с таким раскладом? Спасибо за ваш отзыв! | ||
| Нажмите, чтобы просмотреть другую учебную программу, соответствующую этому ожидаемому результату | ||
| Это занятие сосредоточено на следующих аспектах трехмерного обучения NGSS: | ||
| Научная и инженерная практика | Основные дисциплинарные идеи | Концепции поперечной резки |
Оценка решения сложной реальной проблемы на основе научных знаний, источников данных, созданных учащимися, приоритетных критериев и соображений компромисса. Соглашение о согласовании: Спасибо за ваш отзыв! | При оценке решений важно учитывать ряд ограничений, включая стоимость, безопасность, надежность и эстетику, а также учитывать социальные, культурные и экологические последствия. Соглашение о согласовании: Спасибо за ваш отзыв! | Новые технологии могут иметь серьезные последствия для общества и окружающей среды, в том числе неожиданные. Анализ затрат и выгод является критическим аспектом решений о технологии. Соглашение о примирении: Спасибо за ваш отзыв! |
| Ожидаемая производительность NGSS | ||
|---|---|---|
ГС-ПС1-6.
Усовершенствуйте дизайн химической системы, указав изменение условий, которое приведет к увеличению количества продуктов при равновесии. Согласны ли вы с таким раскладом? Спасибо за ваш отзыв! | ||
| Нажмите, чтобы просмотреть другую учебную программу, соответствующую этому ожидаемому результату | ||
| Это занятие сосредоточено на следующих аспектах трехмерного обучения NGSS: | ||
| Научная и инженерная практика | Основные дисциплинарные идеи | Концепции поперечной резки |
Уточните решение сложной реальной проблемы, основываясь на научных знаниях, источниках данных, созданных учащимися, приоритетных критериях и соображениях компромисса. Соглашение о примирении: Спасибо за ваш отзыв! | Структура и взаимодействия материи в масштабе определяются электрическими силами внутри атомов и между ними. Соглашение о согласовании: Спасибо за ваш отзыв! Во многих ситуациях динамический и зависящий от условий баланс между реакцией и обратной реакцией определяет количество присутствующих молекул всех типов.Соглашение о согласовании: Спасибо за ваш отзыв! Возможно, потребуется разбить критерии на более простые, к которым можно подходить систематически, и могут потребоваться решения о приоритете одних критериев над другими (компромисс).Соглашение о согласовании: Спасибо за ваш отзыв! | Большая часть науки занимается построением объяснений того, как вещи меняются и как они остаются стабильными. Соглашение о согласовании: Спасибо за ваш отзыв! |
Общие базовые государственные стандарты — математика
- Рассуждайте абстрактно и количественно.
 (Оценки
К —
12) Подробнее
(Оценки
К —
12) ПодробнееПосмотреть согласованную учебную программу
Согласны ли вы с таким раскладом? Спасибо за ваш отзыв!
- Используйте единицы как способ понять проблемы и направить решение многоступенчатых проблем; последовательно выбирать и интерпретировать единицы измерения в формулах; выбирать и интерпретировать масштаб и начало координат на графиках и дисплеях данных.
 (Оценки
9 —
12) Подробнее
(Оценки
9 —
12) ПодробнееПосмотреть согласованную учебную программу
Согласны ли вы с таким раскладом? Спасибо за ваш отзыв!
- Представьте данные по двум количественным переменным на диаграмме рассеивания и опишите, как эти переменные связаны.
(Оценки
9 —
12) Подробнее
Посмотреть согласованную учебную программу
Согласны ли вы с таким раскладом? Спасибо за ваш отзыв!
- Суммировать, представлять и интерпретировать данные по одному счетчику или измеряемой переменной
(Оценки
9 —
12) Подробнее
Посмотреть согласованную учебную программу
Согласны ли вы с таким раскладом? Спасибо за ваш отзыв!
- Решайте линейные уравнения и неравенства с одной переменной, в том числе уравнения с коэффициентами, обозначенными буквами.
 (Оценки
9 —
12) Подробнее
(Оценки
9 —
12) ПодробнееПосмотреть согласованную учебную программу
Согласны ли вы с таким раскладом? Спасибо за ваш отзыв!
Международная ассоциация преподавателей технологий и инженерии – Технология
- Проводить исследования для информирования о преднамеренных изобретениях и инновациях, отвечающих конкретным потребностям и желаниям.
 (Оценки
9 —
12) Подробнее
(Оценки
9 —
12) ПодробнееПосмотреть согласованную учебную программу
Согласны ли вы с таким раскладом? Спасибо за ваш отзыв!
- Оцените способы воздействия технологий на отдельных людей, общество и окружающую среду.
(Оценки
9 —
12) Подробнее
Посмотреть согласованную учебную программу
Согласны ли вы с таким раскладом? Спасибо за ваш отзыв!
ГОСТ
Предложите выравнивание, не указанное вышеКакое альтернативное выравнивание вы предлагаете для этого контента?
Подписывайся
Подпишитесь на нашу рассылку новостей, чтобы получать внутреннюю информацию обо всем, что связано с TeachEngineering, например, о новых функциях сайта, обновлениях учебных программ, выпусках видео и многом другом!
PS: Мы никому не передаем личную информацию и электронные письма.
Список материалов
Каждой группе нужно:
- 8 г лимонной кислоты (C 6 H 8 O 7 )
- 10,4 г бикарбоната натрия (пищевая сода)
- 40 мл воды
- 2 пакета с застежкой-молнией по 400 мл
- термометр (приблизительный диапазон: 0–200 °F)
- шприц (примерный объем 4 мл, для взятия пробы газа)
- рулетка
- калькулятор
- цветная лента для герметизации шприца
- защитные очки, по паре на ученика
- Рабочий лист реакции на воздействие
Чтобы поделиться со всем классом:
- секундомер
- (опционально) использование ГХ для анализа данных CO 2 производство; производство CO 2 также можно оценить с помощью расчетов, используя стехиометрический баланс уравнения реакции
Рабочие листы и вложения
Рабочий лист реакции на воздействие (docx)
Рабочий лист реакции на воздействие (pdf)
Теоретические результаты с использованием руководства по стехиометрическому раствору (docx)
Теоретические результаты с использованием руководства по стехиометрическому раствору (pdf)
Посетите [www. teachengineering.org/activities/view/wsu_big_chill_activity1], чтобы распечатать или загрузить.
teachengineering.org/activities/view/wsu_big_chill_activity1], чтобы распечатать или загрузить.Больше учебных программ, подобных этому
Нижняя элементарная деятельность
Ограничения: Pop Rockets при ограниченном бюджете
Ваши студенты были наняты, чтобы построить поп-ракету, но с ограниченным бюджетом. Инженерный дизайн обычно имеет некоторые ограничения, и у вас не всегда будет доступ к материалам, которые, по вашему мнению, могут вам понадобиться. Но с помощью мозгового штурма, проб и ошибок вполне возможен запуск ракеты!
Ограничения: Pop Rockets с ограниченным бюджетом
Высший элементарный урок
Взрыв: Создание реактивной тяги с помощью ракетного топлива
Учащиеся узнают, как создается ракетная тяга с помощью топлива. Обсуждаются два типа топлива — жидкое и твердое — и исследуется их связь с использованием в ракетах. Студенты узнают, почему инженерам необходимо знать различные свойства топлива.
Обсуждаются два типа топлива — жидкое и твердое — и исследуется их связь с использованием в ракетах. Студенты узнают, почему инженерам необходимо знать различные свойства топлива.
Взрыв: создание ракетной тяги с помощью ракетного топлива
Предварительные знания
Студенты должны быть знакомы с:
- Математические понятия: объемы, графические данные, измерение и преобразование единиц, сохранение материи.
- Научные понятия: масса, измерение температуры.
В качестве альтернативы это упражнение можно использовать как средство введения этих понятий. Это также идеальная возможность представить предметный материал: реакции, стехиометрия, эндотермические и экзотермические реакции, превращения масс и молей и закон идеального газа.
Введение/Мотивация
В присутствии воды лимонная кислота [C 6 H 8 O 7 ] и бикарбонат натрия [NaHCO 3 ] (также известная как пищевая сода) реагируют с образованием цитрата натрия [Na 3 C
5
H 5 O 7 ], вода и диоксид углерода [CO 2 ].
Чтобы обеспечить безопасность рабочих, инженеры-химики должны контролировать температуру и давление реакции, чтобы не произошло взрывов. Чтобы компания-производитель получала прибыль, инженеры должны производить как можно больше углекислого газа [CO 2 ] с использованием минимального количества лимонной кислоты [C 6 H 8 O 7 ].
В группах по двое ваша инженерная задача состоит в том, чтобы протестировать реакцию в лаборатории, прежде чем будет запущена крупномасштабная операционная установка. Чтобы обеспечить безопасность работников завода и, таким образом, завод получил прибыль, вы должны определить:
- Изменение температуры, происходящее в ходе реакции при различных соотношениях реагентов.
- Количество CO 2 , полученное в результате реакции с использованием тех же соотношений реагентов.
Процедура
Предыстория и концепции для учителей
- Обсудите химические вещества, которые будут использоваться в реакции.
 Предложите учащимся обсудить физические характеристики каждого из них.
Предложите учащимся обсудить физические характеристики каждого из них.
- Бикарбонат натрия (он же пищевая сода). Учащиеся могут быть знакомы с пищевой содой из домашней выпечки и уборки. Пищевая сода работает как антацид, но сама по себе она имеет очень плохой вкус. Бикарбонат натрия также используется для тушения пожаров, потому что при высокой температуре он превращается в углекислый газ и может тушить огонь.
- Лимонная кислота является распространенным ингредиентом продуктов со вкусом цитрусовых. Предложите учащимся найти его в списках ингредиентов для конфет и газированных напитков.
- Реакция бикарбоната натрия и воды очень похожа на явления, наблюдаемые, когда таблетки Алка-Зельтцер помещают в стакан с водой.
- Обсудите, что такое реакция и как можно наблюдать ее протекание.
- Продемонстрируйте смешивание лимонной кислоты + бикарбонат натрия. (Идет ли реакция?)
- Продемонстрировать добавление воды в смесь? (Идет ли реакция?)
- Релевантность: кислота + основание = вода + газ + соль (продукт нейтрален).
 Примеры применения: 1) Антациды нейтрализуют желудочную кислоту. 2) Базы, используемые для рекультивации земель, используемых при добыче полезных ископаемых (вода очень кислая и требует обработки для нейтрализации). 3) Кислоты и основания, используемые для стимулирования роста растений. Нейтрализация кислой или щелочной почвы для стимулирования роста растений.
Примеры применения: 1) Антациды нейтрализуют желудочную кислоту. 2) Базы, используемые для рекультивации земель, используемых при добыче полезных ископаемых (вода очень кислая и требует обработки для нейтрализации). 3) Кислоты и основания, используемые для стимулирования роста растений. Нейтрализация кислой или щелочной почвы для стимулирования роста растений.
- Обсудите связь с инженерией.
- Аспект безопасности: чрезмерное давление или экстремальная температура могут привести к катастрофическому отказу.
- Аспект прибыли: использование меньшего количества лимонной кислоты для производства большего количества углекислого газа. (Возможно ли?)
- Обзор экспериментального плана за три дня.
Специальная процедура
- Исходная информация : рекомендуется разделить класс на четыре группы, чтобы каждая «инженерная команда» выполняла различные соотношения реагентов во второй день.
 Таким образом, вся матрица может быть протестирована без необходимости выполнения всеми учащимися пяти наборов экспериментов. . Предлагаемые тесты:
Таким образом, вся матрица может быть протестирована без необходимости выполнения всеми учащимися пяти наборов экспериментов. . Предлагаемые тесты:
В 1-й день: Всем: 2,6 г лимонной кислоты + 2,6 г бикарбоната натрия
В день 2:
- Группа A: 1 г лимонной кислоты + 2,6 г бикарбоната натрия
- Группа B: 4 г лимонной кислоты + 5,2 г бикарбоната натрия
- Группа C: 2 г лимонной кислоты + 5,2 г бикарбоната натрия
- Группа D: 6 г лимонной кислоты + 7,8 г бикарбоната натрия
- Перед занятием
- Соберите необходимые реагенты.
- Соберите оставшиеся предметы в списке материалов.
- Сделайте копии рабочего листа Exposed Reaction Worksheet, по одному на команду, который включает процедуры.
- На классной доске или проекторе подготовьте большую таблицу данных, чтобы все учащиеся могли записывать свои выводы (начиная со 2-го дня).
 Сделайте его видимым для всего класса и подходящим для использования в качестве наглядного пособия в обсуждениях в конце второго дня.
Сделайте его видимым для всего класса и подходящим для использования в качестве наглядного пособия в обсуждениях в конце второго дня.
- Со студентами
День 1: Экспериментальные методы
- Представьте вводный контент, как описано выше.
- Разделите класс на группы по два ученика в каждой.
- Ознакомьтесь с процедурами испытаний и способами использования данных материалов.
День 2: Сбор данных
- Группы учащихся проводят одну и ту же реакцию, используя разные заданные количества реагентов.
- Учащиеся собирают, маркируют и опечатывают пробы газа.
День 3: анализ данных, обсуждение и масштабирование
- Предоставить результаты газового анализа.
- Рассчитать стоимость реагентов по сравнению с прибылью от продуктов.

- Деятельность по увеличению масштаба.
Словарь/Определения
продукты: Все материалы, образующиеся в результате реакции. В общем, «то, что у нас получается».
реагент: Исходные материалы для реакции. Обычно элементарно перегруппировываются в ходе реакции.
Оценка
Просмотрите заполненные учащимися рабочие листы Exposed Reaction Worksheets, чтобы оценить их глубину понимания.
Необязательная оценка после выполнения задания: размышление учащегося в ходе обсуждения в классе или письменного задания.
Вопросы безопасности
- Напомните учащимся не пить никаких химикатов, даже тех, которые помечены как вода или газировка, потому что загрязнение всегда возможно, особенно в условиях химической лаборатории.
- Учащиеся всегда должны носить защитные очки.

Масштабирование активности
Для более продвинутых учащихся попросите их сначала рассчитать, сколько CO 2 теоретически должно образоваться в каждой реакции, используя стехиометрию, прежде чем приступать к эксперименту. В качестве бонуса задайте учащимся вопрос: есть ли способ теоретически рассчитать, сколько углекислого газа должно образоваться в каждом эксперименте? В конце эксперимента попросите учащихся сравнить свои теоретические ответы с реальными. Попросите их объяснить, почему их экспериментальные результаты, вероятно, никогда не будут такими же, как теоретические. (Возможные ответы: Возможно, не все CO 2 произведено будет собрано; возможно, не все ограничивающие реагенты будут реагировать с образованием теоретических количеств продукта.) См. Руководство по теоретическим результатам с использованием стехиометрии.
Авторские права
© 2013 Регенты Университета Колорадо; оригинал © 2009 Попечительский совет, Вашингтонский государственный университетАвторы
Кортни БонуччеллиПрограмма поддержки
Программа CREAM GK-12, Исследовательский центр инженерного образования, Инженерно-архитектурный колледж, Университет штата ВашингтонБлагодарности
Этот контент был разработан в рамках программы «Культурно значимые инженерные приложения в математике» (CREAM) Исследовательского центра инженерного образования Инженерно-архитектурного колледжа Университета штата Вашингтон в рамках гранта Национального научного фонда GK-12 №. DGE 0538652. Однако это содержание не обязательно отражает политику NSF, и вы не должны исходить из того, что оно одобрено федеральным правительством.
DGE 0538652. Однако это содержание не обязательно отражает политику NSF, и вы не должны исходить из того, что оно одобрено федеральным правительством.
Последнее изменение: 5 мая 2020 г.
Все о натриево-известковом стекле
Возможно, вы слышали о натриево-известковом стекле, но что это такое?
Согласно Thomas Net:
Что такое натриево-известковое стекло?
«Известково-натриевое стекло является наиболее часто производимым типом стекла, составляющим 90% всего производимого стекла. Производимый в течение сотен лет, он представляет собой базовую комбинацию кремнезема, соды и извести с множеством полезных свойств для применения в различных отраслях, включая производство потребительских товаров, упаковку и научный сектор. Известково-натриевое стекло часто противопоставляют его двоюродному брату, боросиликатному стеклу, которое более подробно обсуждается здесь .
«Вот какие области охватит это руководство:
- Состав
- Свойства
- Таблица свойств
- Применение
Известково-натриевое стекло Состав
состоит из трех основных компонентов известкового стекла3.
 Первый материал — кремнезем, или диоксид кремния, который составляет 70% готового продукта. Еще 15% состоит из соды или оксида натрия, который снижает температуру плавления кремнезема, а известь, также известная как оксид кальция, составляет еще 9%.% действовать как стабилизатор. Остальные 6% составляют микроэлементы.
Первый материал — кремнезем, или диоксид кремния, который составляет 70% готового продукта. Еще 15% состоит из соды или оксида натрия, который снижает температуру плавления кремнезема, а известь, также известная как оксид кальция, составляет еще 9%.% действовать как стабилизатор. Остальные 6% составляют микроэлементы.Свойства известково-натриевого стекла
«Известково-натриевое стекло обладает несколькими свойствами, которые делают его полезным в качестве стекла для общих и более специфических применений.
» Это дешево. Известково-натриевое стекло дешевле, чем другое стекло с более специфическими свойствами, например боросиликатное или оптическое стекло.
» Химически стабилен. Атомы в натриевом известковом стекле имеют прочные атомные связи и тесно связаны друг с другом, что затрудняет воздействие других веществ на его структуру и коррозию стекла. Это делает его подходящим для использования с химическими веществами, особенно если его закалить для повышения его устойчивости к тепловому удару. Однако известково-натриевое стекло не полностью невосприимчиво к химическому износу, и другие более специализированные стекла могут быть более устойчивыми.
Однако известково-натриевое стекло не полностью невосприимчиво к химическому износу, и другие более специализированные стекла могут быть более устойчивыми.
» Тяжело. Известково-натриевое стекло имеет твердость 6–7 по шкале Мооса, которая показывает, насколько материал устойчив к истиранию. Этот наивысший балл по этой шкале равен десяти и включает в себя такие материалы, как алмаз. Однако известково-натриевое стекло также можно закалить с помощью тепла или химикатов, чтобы оно стало в три раза прочнее. Химическая закалка придает ему большую механическую прочность, делая его более твердым и устойчивым к царапинам. Термоупрочнение также придает стеклу механическую прочность, а также делает его более устойчивым к резким перепадам температуры.
» Работает. Благодаря содержанию соды и извести в натриево-кальциевом стекле его можно многократно размягчать и размягчать без потери качества. Этот атрибут делает его хорошим материалом для вторичной переработки.
» Уязвим к тепловым ударам. Внезапные перепады температуры могут привести к разрушению известково-натриевого стекла. Это можно уменьшить путем термической закалки, которая придает этому материалу дополнительную прочность.
» Это электрический изолятор. Стекло плохо пропускает электричество, так как имеет высокое удельное сопротивление и низкую диэлектрическую проницаемость. Это делает его полезным для изоляции электротехнических изделий.
“ Пропускает видимый свет. Показатель преломления натриево-кальциевого стекла составляет примерно 1,5, что означает, что отражается только около 4% падающего на него света. Остальная часть проходит, что делает его отличным материалом для приложений, где важно светопропускание.
Таблица свойств известково-натриевого стекла
«В приведенной ниже таблице более подробно описаны механические, термические, оптические, химические и электрические свойства известково-натриевого стекла. Ниже описаны класс свойства, само свойство, его измерение для известково-натриевого стекла и объяснение того, что измеряет свойство. Па — это сокращение от паскалей, единицы давления, а мкОм·см — это микроомы на сантиметр.
Ниже описаны класс свойства, само свойство, его измерение для известково-натриевого стекла и объяснение того, что измеряет свойство. Па — это сокращение от паскалей, единицы давления, а мкОм·см — это микроомы на сантиметр.
Table: Properties of Soda Lime Glass
| Class of Property | Property | Measurement | Explanation | |
| Thermal/Mechanical | Specific weight | 2,483 g/ см 3 | Вес на единицу объема | |
| 0249 | Плотность | 2,44 г/см 3 | МАССА В ЕДИНЕМ ГОЛУРСА | |
| ОЧЕНЬ СЛАДИНГИ ДВЕЙСЯ | . Различные направления | |||
| Модуль эластичности | 7,2 x 1010 PA | Как жесткий материал | ||
| Модлель из строгих.0249 | Сколько сдвига. Материал может обрабатывать Материал может обрабатывать | |||
| Модуль | 4,3 x 1010 PA | Как устойчивый градусов C | Насколько изменяется объем материала при нагревании или охлаждении | |
| Температура размягчения | 726 C/1340 F | Температура, при которой материал оседает под собственным весом | ||
| Annealing Point | 546 C/1015 F | The temperature where residual stress in a material is reduced within several minutes | ||
| Strain Point | 514 C/957 F | The temperature where остаточное напряжение в материале уменьшается в течение нескольких часов | ||
| Оптический | Показатель преломления | 1,523 (если I=435) или 1,513 (если I=645) | Измерение того, сколько света проходит через материал вместо отражение | |
| Химическая | Гидролитическая стойкость | Класс 3 | Вероятность загрязнения материала химическими веществами при контакте с ним (химическая стойкость) | |
| Электрическая | Диэлектрическая постоянная | 7,75 | Степень воздействия магнитного поля на материал | |
| Удельное удельное сопротивление | 7,94 x 1017 – 7,94 x 1018 мкОм·см Насколько материал хорошо проводит электричество | a49 |
Применение натриево-известкового стекла
«Из-за своей популярности и распространенности натриево-известковое стекло можно найти в самых разных отраслях промышленности.