Аммиачная селитра — универсальное удобрение для всех типов растений и почв
Аммиачная (аммонийная) селитра — неорганическое химическое соединение, соль азотной кислоты. Формула вещества NH4NO3, оно состоит из нитритной и аммонийной группы, обе из которых содержат связанный азот. Это обстоятельство делает его самым лучшим удобрением для растений, которым для усвоения необходим связанный азот. И еще одним достоинством может похвастаться удобрение селитра аммиачная — цена. Благодаря полезным свойствам и сравнительной дешевизне, аммиачная селитра в качестве удобрения не имеет конкурентов, несмотря на высокую взрывоопасность.
Свойства аммиачной селитры
Нитрат аммония — кристаллы белого или желтоватого цвета, иногда бесцветные. Не имеет запаха, активно поглощает влагу из воздуха. Высокая гигроскопичность заставляет производителей выпускать аммиачную селитру в гранулированном виде, в этой форме площадь поглощения влаги меньше, чем в форме мелких кристаллов. Кроме этого, в процессе производства гранулы нередко покрывается специальными веществами, которые предотвращают слеживание массы.
Кроме этого, в процессе производства гранулы нередко покрывается специальными веществами, которые предотвращают слеживание массы.
Аммиачная селитра очень хорошо растворяется в воде, реакция эндотермическая. Кроме воды, соль растворяется в этиловом и метиловом спирте, аммиаке, пиридине.
При нагревании аммиачная селитра способна взрываться. Взрывоопасность вещества повышается в замкнутом пространстве, в присутствии органических добавок (опилок, соломы), примесей сахаров и углеводов, нитритных солей и азотной кислоты, горючих материалов (например, упаковки). Поэтому нитрат аммония расфасовывают в не пропускающие влагу полиэтиленовые мешки и многослойные мешки из крафт-бумаги, хранят в прохладном (что особенно актуально в жарких климатических зонах) и сухом месте, вдали от легковоспламеняющихся веществ, применяют строго по инструкции.
При нормальном давлении существует 5 устойчивых кристаллических форм нитрата аммония, каждая в своем температурном интервале. Из одной формы в другую вещество переходит, изменяя свою кристаллическую структуру, плотность и удельный объем, с выделением или поглощением тепла. Одна из таких модификаций происходит при температуре 32,3 °С. Неправильное хранение может привести к разрушению гранул, превращению вещества в порошок, слеживанию и повышению взрывоопасности.
Одна из таких модификаций происходит при температуре 32,3 °С. Неправильное хранение может привести к разрушению гранул, превращению вещества в порошок, слеживанию и повышению взрывоопасности.
Применение
Нитрат аммония является лучшим азотным удобрением. Для развития и роста, в процессе фотосинтеза растения используют азот, но обязательно — связанный азот, в виде солей аммония, нитратов, аминов. Именно такой азот, причем в большом количестве, 35% состава, присутствует в аммиачной селитре. Кроме этого, аммиачная селитра очень проста в применении, ее можно просто рассыпать по почве и полить водой.
Азотное удобрение аммиачная селитра подходит для любых типов почв. Им можно удобрять все виды растений (злаковые и овощные культуры, плодовые деревья и кустарники, цветы) перед посевом, во время развития или активного роста. Это единственное удобрение, которое можно применять при низких температурах. Оно очень быстро разлагается и тут же начинает усваиваться растениями.
Кроме того аммиачная селитра широко применяется в производстве различных многокомпонентных взрывчатых веществ (аммоналов, аммонитов), востребованных в горном деле и в промышленности.
Нужная аммиачная селитра? Купить в Москве и области ее можно, связавшись с менеджерами магазина «ПраймКемикалсГрупп». У нас отличный сервис, хорошие цены на этот и другие реактивы.
Селитра аммиачная (Азотнокислый аммоний)
Селитра аммиачная (Азотнокислый аммоний)
- ГОСТ 2-85
- Химическая формула: Nh5NO3
- Описание Селитра аммиачная (Азотнокислый аммоний): Селитра аммиачная выпускается марок А и Б. Аммиачная селитра марки Б – высокоэффективное минеральное удобрение, содержащее не менее 34,4% азота, выпускается с применением кондиционирующих добавок, содержащих кальций, магний, сульфат или сульфат в сумме с фосфатом. Допускается применять новые добавки по согласованию с потребителем. Аммиачная селитра вносится под большинство сельскохозяйственных культур во все типы почв, характеризуется высокой усвояемостью азота. Эффективно применение аммиачной селитры с калийными и фосфорными удобрениями, смешивать их только перед самым внесением в почву.
 На легких почвах аммиачную селитру целесообразнее вносить перед посевом под культивацию. Хорошо буферные, некислые почвы можно постоянно удобрять аммиачной селитрой. На кислых почвах следует добавлять известковую муку (карбонат кальция) – 1 ц на 1 ц селитры.
На легких почвах аммиачную селитру целесообразнее вносить перед посевом под культивацию. Хорошо буферные, некислые почвы можно постоянно удобрять аммиачной селитрой. На кислых почвах следует добавлять известковую муку (карбонат кальция) – 1 ц на 1 ц селитры.
Применение Селитра аммиачная (Азотнокислый аммоний): Селитра аммиачная применяется:
- в качестве удобрения в сельском хозяйстве;
- сырья для производства промышленных взрывчатых веществ;
- сырья в химической промышленности.
Купить в интернет-магазине
Упаковка Селитра аммиачная (Азотнокислый аммоний): Аммиачную селитру упаковывают в полипропиленовые мешки с полиэтиленовым вкладышем, мягкие специализированные контейнеры. Вес мешка: нетто 50 кг. Вес мягкого контейнера: 500 кг.
Транспортирование Селитра аммиачная (Азотнокислый аммоний):
Селитру аммиачную транспортируют в упакованном виде и насыпью. Упакованную селитру транспортируют всеми видами транспорта, кроме воздушного. Насыпью селитру аммиачную транспортируют ж/д транспортом в минераловозах, водным транспортом в специализированных водных судах и автомобильным транспортом в соответствии с правилами перевозок грузов, действующими на транспорте данного вида.
Упакованную селитру транспортируют всеми видами транспорта, кроме воздушного. Насыпью селитру аммиачную транспортируют ж/д транспортом в минераловозах, водным транспортом в специализированных водных судах и автомобильным транспортом в соответствии с правилами перевозок грузов, действующими на транспорте данного вида.Хранение Селитра аммиачная (Азотнокислый аммоний): Хранение и транспортирование аммиачной селитры производят отдельно от других материалов и веществ.
Безопасность Селитра аммиачная (Азотнокислый аммоний): Селитра аммиачная нетоксична, является окислителем и пожароопасна. При хранении и транспортировании аммиачную селитру следует предохранять от нагревания, воздействия пламени или попадания искр, от загрязнения посторонними примесями.
Оформление и отгрузка Селитра аммиачная (Азотнокислый аммоний) : Благодаря отлаженной работе офиса и складов, мы предоставляем быстрое оформление и отгрузку товаров.
Доставка Селитра аммиачная (Азотнокислый аммоний): Мы предлагаем доставку товаров по России:
- автотранспортом;
- железнодорожными контейнерами, вагонами;
- через транспортные компании.
Для получения подробной информации о ценах на товары и условиях поставки звоните нашим специалистам по телефонам: (383) 279-12-43, 279-17-37, 279-16-30.
Также вы можете купить Селитра аммиачная (Азотнокислый аммоний) через интернет-магазин компании ОАО Реактив:
Заказать в интернет-магазине
Формула нитрата аммония – структура, свойства, применение, примеры вопросов
В классификации кислот, оснований и солей нитраты аммония относятся к категории неорганических солей. Который образуется в результате реакции кислоты, подобной HNO 3 , и основания, подобного NH 4 OH. Он состоит из атомов азота, кислорода и водорода. Аммиачная селитра обычно используется в удобрениях, пиротехнике, гербицидах и инсектицидах; и в производстве закиси азота. Изучение нитратов аммония относится к области неорганической химии и играет жизненно важную роль в производстве многих других неорганических соединений.
Аммиачная селитра обычно используется в удобрениях, пиротехнике, гербицидах и инсектицидах; и в производстве закиси азота. Изучение нитратов аммония относится к области неорганической химии и играет жизненно важную роль в производстве многих других неорганических соединений.
Based upon the current periodic table below are some comparisons between Nitrogen, Oxygen and Hydrogen:

 На легких почвах аммиачную селитру целесообразнее вносить перед посевом под культивацию. Хорошо буферные, некислые почвы можно постоянно удобрять аммиачной селитрой. На кислых почвах следует добавлять известковую муку (карбонат кальция) – 1 ц на 1 ц селитры.
На легких почвах аммиачную селитру целесообразнее вносить перед посевом под культивацию. Хорошо буферные, некислые почвы можно постоянно удобрять аммиачной селитрой. На кислых почвах следует добавлять известковую муку (карбонат кальция) – 1 ц на 1 ц селитры. 14 K
14 K

 В процессе атмосферный азот (N2) превращается в аммиак (Nh4) посредством реакции с водородом (h3) с использованием металлического катализатора при высоких температурах и давлениях:
В процессе атмосферный азот (N2) превращается в аммиак (Nh4) посредством реакции с водородом (h3) с использованием металлического катализатора при высоких температурах и давлениях:
 использование NH 4 NO 3 (нитрат) в садах и на больших полях стимулирует рост растений и обеспечивает готовый источник азота, из которого растения могут черпать.
использование NH 4 NO 3 (нитрат) в садах и на больших полях стимулирует рост растений и обеспечивает готовый источник азота, из которого растения могут черпать. Тем не менее, это один из ингредиентов, используемых для производства взрывчатых веществ. Нитрат аммония используется в качестве окислителя и при добавлении к другим ингредиентам, таким как топливо и т. д., становится взрывоопасным. Для взрыва таких взрывчатых смесей требуются инициаторы типа детонаторов.
Тем не менее, это один из ингредиентов, используемых для производства взрывчатых веществ. Нитрат аммония используется в качестве окислителя и при добавлении к другим ингредиентам, таким как топливо и т. д., становится взрывоопасным. Для взрыва таких взрывчатых смесей требуются инициаторы типа детонаторов. Информация в CAMEO Chemicals поступает
из множества
источники данных.
Информация в CAMEO Chemicals поступает
из множества
источники данных.


 Больше информации о абсорбентах, в том числе о ситуациях, на которые следует обратить внимание…
Больше информации о абсорбентах, в том числе о ситуациях, на которые следует обратить внимание…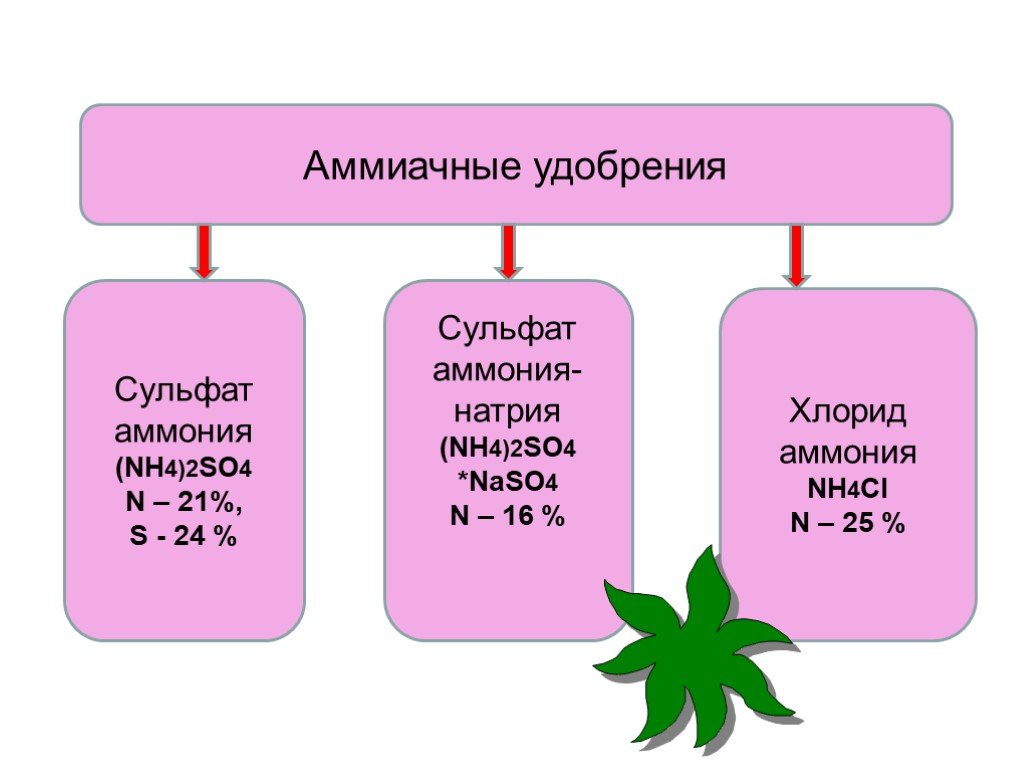


 источники данных.
источники данных.
