| Пальмитиновая кислота | |
|---|---|
| Общие | |
| Систематическое наименование | Гексадекановая кислота |
| Традиционные названия | Пальмитиновая кислота |
| Хим. формула | CH3(CH2)14COOH |
| Рац. формула | C16H32O2 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 256,43 г/моль |
| Плотность | 0,8414 г/см³ |
| Термические свойства | |
| Т. плав. | 62,9 °C |
| Т. кип. | 351—352 °C, 105 (0,01 мм рт. ст.) °С 167 (1 мм рт. ст.) °C |
| Т. всп. | 192 °C |
| Мол. теплоёмк. | 460,7 Дж/(моль·К) |
| Химические свойства | |
| Растворимость в воде | 0,0007 (20 °C) |
| Растворимость в этаноле | 2600 (7,2 °C) |
| Оптические свойства | |
| Показатель преломления | 1,4219 |
| Классификация | |
| Рег. номер CAS | |
ru.wikipedia.org
Калий пальмитат — Справочник химика 21
Калия пальмитат см. Калий пальмитиновокислый [c.264]
Мыло, образовавшееся при реакции между жиром и едким натром, со держит пальмитат натрия С15Нз1СООЫа. Натриевые мыла при комнатной температуре твердые, а калиевые — жидкие. Калиевые мыла (мягкое мыло) получают нагреванием золы растений, жира и воды (зола содержит едкое кали или карбонат калия). [c.270]
Калий ортофосфат см. Калий фосфорнокислый Калий пальмитат см. Калий пальмитиновокислый Калий пальмитиновокислый [c.246]
Чем длиннее углеводородная цепочка молекул мыл алифатического ряда, тем менее устойчив латекс при замораживании. Так, бутадиен-стирольные латексы, приготовленные на стеарате или пальмитате калия, легко коагулируют ниже —10° С. [c.31]
Формиат калия 27 Ацетат калия 42 1 Пальмитат калия 233 Стеарат калия 260 Ацетат серебра 39 Стеарат серебра 253 [c.57]
В ходе процесса окисления наблюдается изменение стабильности эмульсии. В течение первых 16—20 ч эмульсия изопропилбензола, стабилизированная пальмитатом калия, настолько устойчива, что для разделения фаз требуется продолжительное центрифугирование. Однако через некоторое время (при содержании примерно 25—30% гидроперекиси) эмульсия становится значительно менее стабильной и быстро расслаивается.
Гомогенный Эмульсионный Эмульсионный с пальмитатом калия (2 %) и соотношением фаз 1 4 [c.66]
Состав тройных смесей, содержащих наряду с пропиленгликолем и олеатом натрия спирты (этиловый, аллиловый, пропиловый и изопропиловый, бутиловый, в/пор-бутиловый, изобутиловый, трет-бу-тиловый и /пре/п-хлорбутиловый, амиловый, в/пор-амиловый и изо-амиловый, гексиловый и циклогексиловый, октиловый и изоактило-вый, лауриловый, цетиловый, бензиловый), хлорорганические соединения (этиленхлоргидрин, триметиленхлоргидрин, четыреххлористый углерод, хлороформ, хлористый метилен, дихлорэтан, хлористый бутил), а также ацетон, метилэтилкетон, этилацетат, бензол, фенол, приведены в работе [28]. Там же приведен состав тройных систем пропиленгликоль — бензол с лауратом, миристатом, пальмитатом, стеаратом натрия и пальмитатом калия, пропиленгликоль — вода с подом, этиловым эфиром, сахарозой, пропиленгликоль — бензоат натрия — хлороформ. [c.186]
Количество пошедшего пальмитата или стеарата калия эквивалентно количеству кальция и магния, а следовательно, и общей жесткости. [c.84]
При установке 0,05 н. раствора пальмитата калия уходит 0,24 мл пальмитата на вызов окраски . Поэтому, истинная величина пальмитата, пошедшего на титрование стандарта a-fMg, будет меньше на эту величину. [c.85]
Расчет нормальности. Взято 20 мл 0,05 н. стандартного раствора a+Mg, на титрование пошло 19,75 мл пальмитата калия. Нормальность пальмитата Л ц [c.85]
Метод определения общей жесткости с пальмитатом калия является наиболее точным из существующих методов. С его помощью можно определять жесткость воды без разбавления, если даже величина жесткости велика, но не превышает 100 Н° (35,6 мг-экв). Огромное большинство природных вод имеют меньшую жесткость. Иногда в местах спуска промышленных сточных вод общая жесткость может превышать указанную величину.
Рис. IV.и. Температурные зависимости параметров Зц и т радикала BIV в лиотропной жидкокристаллической системе пальмитат калия (30%) —вода (70%) [128] [c.171]
Калий пальмитат Пальмитиновой кислоты калиевая соль СНз ( HJh OOK [c.246]
Тридеканат калия Миристат калия Пальмитат калия Лаурилсульфат натрия [c.143]
Калий пальмитат 35 1,8-10- М Рефр. [4] [c.176]
Так как к этим жидкостям добавляют большое количество полиэтил енгликолей весьма высокого молекулярного веса, что обеспечивает требуемую вязкость раствора, стоимость предлагаемого заменителя турбинного масла значительно увеличивается. Поэтому в качестве загустителя испытывали также пальмитат и полиметакрилаты калия. Пальмитат калия, как установлено, растворим в гликольных жидкостях весьма ограниченно. При нагревании растворимость его увеличивается, но при охлаждении раствора загуститель вновь выделяется из него в виде мелкодисперсного осадка. Вследствие этого пальмитат калия не нашел широкого применения. В то же время установлено, что при одновременном добавлении пальмитата калия и полиэтиленгликоля вязкость смеси увеличивается значительно больше, чем от каждого загустителя в отдельности. Так, смесь из 51% гликоля, 24% воды и 20% загустителя имеет вязкость 11 мм /с при 50 °С, тогда как для смеси из 44,8% гликоля, 4,86% полигликоля, 48,6% воды и 1,6% пальмитата калия ее значение составляет 26,7 мм /с при той же температуре. Добавление же только 1,6% пальмитата калия к полигли-кольной жидкости практически не сказывается на вязкости жидкости. Весьма вероятно, что введение пальмитата калия вызывает желатинизацию раствора полиэтиленгликоля, а возникающие агломераты молекул сильно увеличивают его вязкость. Следовательно, это повышение обусловлено появлением структурной вязкости, значение которой весьма неопределенно и непостоянно и не может, конечно, служить критерием при получении масел, для которых этот показатель должен быть постоянен. Последнее препятствует использованию водосодержащих гликолей в качестве огнестойких заменителей турбинных масел, так как может нарушить нормальную работу систем смазки и регулирования турбогенераторов.
Яис. 22. Зависимость молярной солюйилизации углеводородов от концентрации П]АВ а—пальмитат калия (I), миристат алия (2). лаурат калия (3), капринат жалия (4) [c.82]
КММ некоторых ПАВ (моль/л) стеарнат калия (50°С) 0,0005 олеат калия (25° С) 0,0012 пальмитат калия (50° С) 0,0022 додецилсульфат натрня (25 С) [c.248]
Выше уже отмечались причины недостаточной популярности в России кокосовых мыл. В 1905 г., чтобы выяснить условия получения втолие нейтральных мыл даже в водных растворах , в лаборатории изучали диссоциацию кокосовых и сально-кокосовых-.мыл в водном растворе и возможность подавить ее добавлением некоторых кислот (борной, салициловой, нефтяных и др.) или солей (хлорида калия (3%), нитрата висмута, хлорида цинка, ацетата алюминия и др.). Делались и заводские опыты. Насколько этим пользовались, сведений нет, а привилегию на добавление к мылу легко гидролизующихся солей Жуков получил В 1910 г. изучали влияние поваренной соли на гидролиз мыла, а в 1911 г. уточняли метод измерения степени диссоциаций мыл в растворах. Это вызвало интерес к кислым мылам — был синтезирован и изучен ряд кислых стеаратов и пальмитатов натрия. Публикация появилась лишь в 1926 г. [c.436]
I — кумол — вода 2 — кумол — 0,1 н. раствор КааСОа 3 — кумол — 0,2%-ный раствор вальмита-та калия в 0,1 н. растворе КааСОз 4 —кумол — 1%-ный раствор пальмитата калия в 0,1 и. растворе соды. [c.42]
Позднее Шинода и Масио [34] применили метод радиоактивных индикаторов для изучения избирательной адсорбции, а именно адсорбции /г-додецилбензолсульфонатов натрия и калия, меченных 8 , и пальмитата калия, меченного на поверхности раздела раствор — воздух из растворов смесей ПАВ различного состава, содержащих одно из этих радиоактивных соединений и другое нерадиоактивное соединение в определенных молярных соотношениях.
Поглощенный кислород в начальной стадии реакции идет практически полностью на образование гидроперекиси. При накоплении гидроперекиси до 20% количество кислорода, превращаемого в гидроперекись, уменьшается примерно до 95%. Конечный и суммарный выход гидроперекиси при наличии пальмитата калия, диоктилового соль-эфира сульфо-янтарной кислоты и каприлата натрия составляет около 95% от окисляемого изопропилбензола. Образующаяся в присутствии эмульгаторов гидроперекись достаточно устойчива. Накопление карбонильных соединений в оксидате по ходу реакции, свидетельствующее о распаде гидроперекиси, почти не ускоряется по сравнению со скоростью их накопления в аналогичных услсвиях без эмульгатора. [c.64]
Начиная с 1945 г. с развитием метода титрования металлов, основанного на связывании их в комплексы (гл. 13), все прежние методы вышли из употребления. Так, если раньше для определения жесткости воды использовался классический метод Бла-кера , основанный на титровании щелочноземельных металлов пальмитатом калия, то теперь он в основном заменен методом с примепеииегл этилендиаминтетраацетата (ЭДТА). [c.120]
Получающиеся соли кальция и магния с пальмитиновой или стеариновой кислотой выходят из сферы реакции, а после полного связывания всех ионов кальция и магния избыточное количество пальмитата калия ( isHsl OOK) или стеарата калия (С17Н35СООК) гидролизуется, давая гидроксильные ионы, которые можно заметить по изменению окраски индикатора (фенолфталеин розовеет). Это и есть указание на окончание реакции по связыванию Са + и Mg2+ пальмитатом или стеаратом. [c.84]
В работах [127, 128, 162] изучены термотропные переходы в лиотропной жидкокристаллической системе ионный детергент — вода следующего состава 30 вес.% пальмитата калия Hg( h3)i4 OOK и 70 вес. о воды. При этом составе в исследованном интервале температур О—100° С система должна существовать в нескольких состояниях ниже 35° С — в состоянии геля и коагеля, в диапазоне 35—80° С — в виде гексагональной жидкокристаллической фазы, а выше должна располагаться область сосуществования гексагональной фазы и мицеллярного раствора [163].
Высокоэманирующий препарат пальмитата бария приготовляют следующим образом. ThX (или Ra) вводят в 50—60% раствор соли бария, который является нейтральным и не содержит солей аммония. В этот раствор добавляют свободный от карбонатов раствор пальмитата калия образовавшийся осадок пальмитата бария фильтруют и сушат при 80—100°. Было найдено, что в аналогичных условиях при осаждении пальмитата бария соосаждается более 90% RdTh. [c.761]
chem21.info
Пальмитат — калий — Большая Энциклопедия Нефти и Газа, статья, страница 1
Пальмитат — калий
Cтраница 1
Пальмитат калия, как и другие щелочные мыла, сильно гид-ролизуется в водном растворе. Он реагирует с солями щелочноземельных ( а также и других) металлов, образуя нерастворимые пальмитаты. [1]
Пальмитат калия Б нейтральной ередр осаждает соли ( а и Mg. Конец реакции определяется появлением ионов ОН, образующихся вследствие гидролиза избытк-а пальмитата калия. [2]
Пальмитат калия в водных растворах гидролизуется с образованием малорастворимой пальмитиновой кислоты. [4]
Титр пальмитата калия устанавливается титрованием определенного объема 100 -ного раствора хлористого или азотнокислого бария, доведенного дестиллированной водой до объема в 100 мл. [5]
Растворимость пальмитата калия невелика, а при построении изотерм необходимо было исследовать значительный интервал изменения концентрации сорбата. [6]
После растворения пальмитата калия с ьоде цстиловый спирт был выделен в чистом виде, перекристаллизацией из этанола. В дальнейшем Шеврон, выделял цстилоныи спгтрг экстракцией пегролей-гым эфиром; после отгонки эфира получался цетиловый спирт с небольшой примесью других высших жирных спиртов, содержащихся з спермацете. [7]
Определение общей жесткости пальмитатом калия может производиться в оттитрованной пробе исследуемой воды после определения карбонатной жесткости. Для удаления углекислоты, выделившейся при титровании, раствор продувают воздухом в течение 3 м через стеклянную трубочку, соединенную с резиновой грушей через хлоркалыщевую трубку, наполненную натронной известью. Избыток кислоты, введенной при титровании нейтрализуют N / 10 раствором NaOH по фенолфталеину. После этого титруют при сильном взбалтывании N / 10 раствором пальмитиновокислого калия до интенсивной устойчивой розовой окраски, не исчезающей в течение нескольких минут. [8]
Обычно предпочитают работать с пальмитатом калия. Стеарат калия менее устойчив, чем пальмитат. [9]
Метод определения общей жесткости с пальмитатом калия является наиболее точным из существующих методов. Огромное большинство природных вод имеют меньшую жесткость. Иногда в местах спуска промышленных сточных вод общая жесткость может превышать указанную величину. [10]
Подготовленный таким способом раствор титруют раствором пальмитата калия, сильно взбалтывая жидкость, пока первоначальный снежно-белый ее вид от выпавшего осадка пальмитата кальция не превратится не только в заметный розовый, но в отчетливо красный, сохраняющийся в течение нескольких минут. [11]
Мыла и мылообразующие вещества: олеаты, пальмитаты калия и натрия, сульфокислоты и их соли калия и натрия, холаты. [12]
Затем раствор титруют / 28 н спиртовым раствором пальмитата калия, в присутствии фенолфталеина, до образования устойчивой пены. Число миллилитров пальмитата калия, израсходованного на титрование, за вычетом его расхода на контрольный опыт, дает общую жесткость в градусах. [13]
В поверхностном слое образуется более плотная упаковка молекул пальмитата калия и пленка пены менее проницаема для воздуха. Подобное истолкование согласуется с выводами Брауна, Тумена и Мак-Бена [146], установившими важную роль проницаемости пленок по отношению к газу в устойчивости образующейся пены. В молекулах П-7 весовое отношение сравнительно небольшой гидрофобной группы ( изокотилфенол) к весьма длинной гидрофильной группе ( по-лиоксиэтиленовая цепь) невелико, что вызывает неупорядоченное расположение молекул этого вещества в поверхностном слое. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Пальмитат — калий — Большая Энциклопедия Нефти и Газа, статья, страница 2
Пальмитат — калий
Cтраница 2
В отличие от действия солянокислого додециламина введение лау-рината или пальмитата калия в водный раствор стирола повышает скорость полимеризации, причем в растворах с 0 0187 молярной концентрацией пальмитата или лаурината калия она увеличивается в 2 — 3 раза. [17]
Ca Mg, на титрование пошло 19 75 мл пальмитата калия. [18]
По Бляхеру, пробу, содержащую кальций, титруют раствором пальмитата калия в присутствии фенолфталеина. Когда весь кальций вступит в реакцию, избыток пальмитата калия гидролизуется с образованием свободной щелочи, окрашивающей фенолфталеин в красный цвет, что является показателем конца титрования. [19]
Наиболее благоприятные условия для оптимального извлечения ОП-7, КП и пальмитата калия из растворов находятся в пределах скоростей пропускания диспергированного воздуха, обеспечивающих ламинарный режим подъема пузырьков. [21]
Общую жесткость воды средней жесткости и очень жесткой определяют объемно-аналитическим пальмитатным методом, а при отсутствии пальмитата калия титрованием воды спиртово-мыльным раствором. Последний метод основан на переводе растворенных в воде солей жесткости посредством содержащихся в мыле стеарата, олеата и пальмитата натра в малорастворимые кальциевые и магниевые мыла. При этом конец реакции при титровании определяют по появлению устойчивой пены, образуемой избытком мыльного раствора. [22]
Общую жесткость воды средней жесткости и очень жесткой определяют объемно-аналитическим пальмитатным методом, а при отсутствии пальмитата калия титрованием воды спиртово-мыль-ным раствором. Последний метод основан на переводе растворенных в воде солей жесткости посредством содержащихся в мыле стеарата, олеата и пальмитата натра в малорастворимые кальциевые и магниевые мыла. При этом конец реакции при титрований определяют по появлению устойчивой пены, образуемой избытком мыльного раствора. [23]
Общую жесткость воды средней жесткости и очень жесткой определяют объемно-аналитическим пальмитатным методом, а при отсутствии пальмитата калия титрованием воды спиртово-мыльным раствором. Последний метод основан на переводе растворенных в воде солей жесткости посредством содержащихся в мыле стеарата, олеата и пальмитата натра в малорастворимые кальциевые и магниевые мыла. При этом конец реакции при титровании определяют по появлению устойчивой пены, образуемой избытком мыльного раствора. [24]
Глицерино-пальмитатный метод-для вод, имеющих жесткость выше 0 7 мг-экв / л, основан на титровании воды спирто-гли-цериновым раствором пальмитата калия в присутствии фенолфталеина. [25]
Там же приведен состав тройных систем пропиленгликоль — бензол с лауратом, миристатом, пальмитатом, стеаратом натрия и пальмитатом калия, пропилен-гликоль — вода с подом, этиловым эфиром, сахарозой, пропилен-гликоль — бензоат натрия — хлороформ. [26]
Глицерино-пальмитатный метод — для вод, имеющих жесткость выше 0 7 мг-экв / л, основан на титровании воды спирто-гли-цериновым раствором пальмитата калия в присутствии фенолфталеина. [27]
Предложенные им методы являются наиболее быстрыми и точными по сравнению с применявшимися до настоящего времени титрованием раствором мыла по Кларку или титрованием пальмитатом калия по Блахеру. Для титрования автор применяет как растворы комплексона III, так и трехнатриевую соль компле-ксона II и двунатриевую соль урамилдиуксусной кислоты. Наилучшие результаты были достигнуты при применении трехнатриевой соли этилендиаминтетрауксусной кислоты, и поэтому приводится только этот метод определения. [28]
Позднее Шинода и Масио [34] применили метод радиоактивных индикаторов для изучения избирательной адсорбции, а именно адсорбции тг-додецилбензолсульфонатов натрия и калия, меченных S35, и пальмитата калия, меченного С14, на поверхности раздела раствор — воздух из растворов смесей ПАВ различного состава, содержащих одно из этих радиоактивных соединений и другое нерадиоактивное соединение в определенных молярных соотношениях. [29]
Позднее Шинода и Масио [34] применили метод радиоактивных индикаторов для изучения избирательной адсорбции, а именно адсорбции и-додецилбензолсульфонатов натрия и калия, меченных S35, и пальмитата калия, меченного С14, на поверхности раздела раствор — воздух из растворов смесей ПАВ различного состава, содержащих одно из этих радиоактивных соединений и другое нерадиоактивное соединение в определенных молярных соотношениях. [30]
Страницы: 1 2 3 4
www.ngpedia.ru
Пальмитиновая кислота. Свойства, получение, применение
Пальмитиновая кислота (другое название – гексадекановая) – это насыщенная одноосновная карбоновая (жирная) кислота. Наиболее распространена в природе. Впервые это вещество нашли в пальмовом масле. Эфиры и соли данной кислоты называют пальмитатами. Многочисленные эфиры данной кислоты кристалличны и напоминают воск. Имеет следующую химическую формулу: Ch4(Ch3)14COOH. А эмпирическая ее формула такая: C16h42O2.
Нахождение пальмитиновой кислоты в природе
Данное вещество есть в составе глицеридов большинства масел растительного происхождения и животных жиров. Например, соевое масло ее содержит 6,5 %, пальмовое масло – 38-47 %, свиное сало – 30 %. Помимо того, гексадекановая кислота входит в состав некоторых восков: в спермацете кашалота содержится 90 % цетилового эфира гексадекановой кислоты, а в пчелином воске около 30 % ее миристилового эфира. В организмах животных пальмитиновая кислота является конечным продуктом синтеза жирных кислот из ацетил-КоА.
В виде глицерида гексадекановая кислота имеется в составе пальмового масла, в растительном жире североамериканских и китайских плодов Croton sebiferum и Stillinga sebifera, в семенах Rhus succedanea (в воске), в мириконовом воске из ягод Myrica cerifera, в ланолине. В свободном состоянии пальмитиновая кислота встречается в семенах паприки, в спорах Lycopodium и в трупном воске (является главной частью).
Физические свойства пальмитиновой кислоты:
1. Состояние (при стандартных условиях) — бесцветные кристаллы.
2. Молярная масса равна 256, 43 г/моль.
3. Плотность составляет 0,841 г/см³.
Термические свойства пальмитиновой кислоты:
1. Температура плавления равняется 62,9 °C.
2. Температура кипения равняется 105 °C (при 0,01 мм рт. ст.) и 167 °C (при 1 мм рт. ст.).
3. Температура вспышки равна 192 °C.
4. Молярная теплоёмкость (при нормальных условиях) равна 460 Дж/(моль·К).
Каковы химические свойства гексадекановой кислоты?
1. Растворимость в воде равна 0,0007 (при 20 °C).
2. Растворимость в этаноле составляет 2600 (при 7,2 °C).
3. Пальмитиновая кислота умеренно растворима в бензоле и ацетоне.
Оптические свойства пальмитиновой кислоты:
1. Показатель преломления равен 1,4219.
Получение пальмитиновой кислоты
Данное вещество может быть получено несколькими способами:
1. Посредством дробной кристаллизации или ретификации из смеси жирных кислот, которые были получены при помощи омыления жиров или окисления парафинов.
2. При помощи нагревания цетилового спирта с известью натровой до 270 °C (Стас и Дюма).
C16h43OH (спирт цетиловый) + О2 (кислород) = C15h41COOH + h3О (вода)
3. При плавлении элаидиновой (олеиновой) кислоты с натриевым гидроксидом:
СН3(СН2)7СН (олеиновая кислота) =СН(СН2)7СООН + Н2О (вода) + О = C15h41COOH (пальмитиновая кислота, формула) + Ch4COOH (кислота уксусная)
4. При окислении кислотой азотной 2-октодеканоном:
Ch4(Ch3)15-CO-Ch4 + 3О (кислород) = C15h41COOH (гексадекановая кислота) + Ch4COOH (кислота уксусная)
5. Также данное вещество может быть синтезировано способом цианистых соединений из йодюра пентадецилового спирта:
C15h41J + KCN (цианистое соединение) = KJ + C15h41-CN;
C15h41-CN (цианистое соединение) + 2Н2О (вода) = C15h41COOH (получаемое вещество) + Nh4
Где применяют пальмитиновую кислоту?
1. Рассматриваемое нами вещество используют в производстве напалма, стеарина (особой смеси со стеариновой кислотой), непрозрачных косметических и различных моющих средств, пластификаторов и смазочных масел. В технике эту кислоту применяют для изготовления свечей.
2. Кальция пальмитат применяют в качестве компонента составов для защиты от влаги и воды (гидрофобизации) кожи, различных тканей, дерева, непрозрачных косметических средств и декоративной косметики.
3. Также используют и пальмитат натрия в качестве компонента (загустителя) туалетных и хозяйственных мыл, эмульгатора, в составе косметических препаратов.
4. Метилпальмитат нужен для получения пальмитиновой кислоты и ее некоторых производных, гексадеканола. Также это вещество используется в качестве ароматизатора для пищевых продуктов.
5. Раньше свинцовая соль гексадекановой кислоты применялась для производства аптечных пластырей.
fb.ru
Формула Пальмитиновой кислоты структурная химическая
Структурная формула
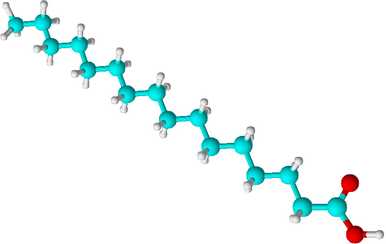 |
Истинная, эмпирическая, или брутто-формула: C16H32O2
Химический состав Пальмитиновой кислоты
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| С | Углерод | 12.011 | 16 | 74,9% |
| H | Водород | 1.008 | 32 | 12,64% |
| О | Кислород | 12.011 | 2 | 12,5% |
Молекулярная масса: 256,43
Пальмитиновая кислота (Гексадекановая кислота) CH3(CH2)14COOH — наиболее распространённая в природе одноосновная насыщенная карбоновая кислота (жирная кислота). Соли и эфиры пальмитиновой кислоты называются пальмитатами.
Нахождение в природе
Пальмитиновая кислота входит в состав глицеридов большинства животных жиров и растительных масел, например, сливочное масло содержит 25 %, свиное сало — 30 %, а также содержится в некоторых восках, например, в спермацете кашалота 90 % цетилового эфира, а в пчелином воске 30 % миристилового эфира пальмитиновой кислоты. В животных организмах пальмитиновая кислота — конечный продукт синтеза жирных кислот из ацетил-КоА.
Получение
Пальмитиновая кислота может быть получена:
- ректификацией или дробной кристаллизацией из смеси жирных кислот, получаемых омылением жиров или окислением парафинов.
- при нагревании цетилового спирта с натровой известью до 270° (Дюма и Стас)
- при плавлении с гидроксидом калия олеиновой (элаидиновой) кислоты (Варентрапп)
- при окислении азотной кислотой 2-октодеканона (Крафт)
- синтезирована методом цианистых соединений из йодюра пентадецилового спирта (Паникс)
Применение
Пальмитиновую кислоту используют в производстве стеарина (смесь со стеариновой кислотой), напалма, моющих и косметических средств, смазочных масел и пластификаторов. Пальмитат кальция используют в качестве компонента составов для гидрофобизации тканей, кожи, дерева, эмульгатора в косметических препаратах. Пальмитат натрия — в качестве эмульгатора, компонента хозяйственных и туалетных мыл, косметических препаратов; Метилпальмитат — для получения гексадеканола, пальмитиновой кислоты и её производных, а также как ароматизирующее вещество для пищевых продуктов.
formula-info.ru
Пальмитиновая кислота — это… Что такое Пальмитиновая кислота?
| Пальмитиновая кислота | |
| Общие | |
|---|---|
| Систематическое наименование | Гексадекановая кислота |
| Традиционные названия | Пальмитиновая кислота |
| Химическая формула | CH3(CH2)14COOH |
| Эмпирическая формула | C16H32O2 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветные кристаллы |
| Молярная масса | 256,43 г/моль |
| Плотность | 0,8414 г/см³ |
| Термические свойства | |
| Температура плавления | 62,9 °C |
| Температура кипения | 105 (0,01 мм рт. ст.) °С 167 (1 мм рт. ст.) °C |
| Температура вспышки | 192 °C |
| Молярная теплоёмкость (ст. усл.) | 460,7 Дж/(моль·К) |
| Химические свойства | |
| Растворимость в воде | 0,0007 (20 °C) |
| Растворимость в этаноле | 2600 (7,2 °C) |
| Оптические свойства | |
| Показатель преломления | 1,4219 |
| Классификация | |
| Рег. номер CAS | 57-10-3 |
| SMILES | CCCCCCCCCCCCCCCC(=O)O |
| Безопасность | |
| ЛД50 | 1,3 г/кг крысы (перорально), > 2,5 г/кг кролики (накожно) мг/кг |
Пальмитиновая кислота (Гексадекановая кислота) CH3(CH2)14COOH – наиболее распространенная в природе одноосновная насыщенная карбоновая кислота (жирная кислота).
Соли и эфиры пальмитиновой кислоты называются пальмитатами.
Нахождение в природе
Пальмитиновая кислота входит в состав глицеридов большинства животных жиров и растительных масел (например, пальмовое масло содержит 39—47%, коровье — 25%, соевое — 6,5%, свиное сало — 30%), а также в состав некоторых восков, например в спермацете кашалота 90% цетилового эфира, а в пчелином воске 30% миристилового эфира пальмитиновой кислоты. В животных организмах пальмитиновая кислота — конечный продукт синтеза жирных кислот из ацетил-КоА.
Получение
Пальмитиновая кислота может быть получена:
С16H33ОH + О2 = C15H31COOH + H2О
СН3(СН2)7СН=СН(СН2)7СООН + Н2О + О = C15H31COOH + СН3COОH (уксусная кислота)
CH3(CH2)15-CO-CH3 + 3О = C15H31COOH + СН3COОH (уксусная кислота)
- синтезирована методом цианистых соединений из йодюра пентадецилового спирта (Паникс)
C15H31J + KCN = KJ + C15H31-CN; C15H31-CN + 2Н2О = C15H31COOH + NН3
Применение
Пальмитиновую кислоту используют в производстве стеарина (смесь со стеариновой кислотой), напалма, моющих и косметических средств, смазочных масел и пластификаторов.
Пальмитат кальция используют в качестве компонента составов для гидрофобизации тканей, кожи, дерева, эмульгатора в косметических препаратах.
Пальмитат натрия — в качестве эмульгатора, компонента хозяйственных и туалетных мыл, косметических препаратов;
Метилпальмитат — для получения гексадеканола, пальмитиновой кислоты и её производных, а также как ароматизирующее вещество для пищевых продуктов.
См. также
dic.academic.ru
