Сода кальцинированная Карбонат натрия технический (натрий углекислый)
Главная/ТЕХНИЧЕСКАЯ ХИМИЯ/СОДА КАЛЬЦИНИРОВАННАЯ Карбонат натрия технический (натрий углекислый)
Сода кальцинированная Карбонат натрия технический (натрий углекислый) ГОСТ 5100-85
Химическая формула:Na2CO3
Сода кальцинированная техническая (натрий углекислый) – порошок или гранулы белого цвета. Кальцинированная сода марок А, Б применяется в изготовлении стекла всех видов. Также кальцинированная сода применяется в чёрной и цветной металлургии: с её помощью производят свинец, цинк, вольфрам, стронций, хром. Кальцинированную соду используют для десульфуризации, дефосфации чугуна, при очистке отходящих газов, а также для полной нейтрализации сред. Перевозить кальцинированную соду можно любым видом крытого транспорта, так как кальцинированная сода пожаробезопасна и взрывобезопасна. При хранении не допускать попадании влаги.
Технические характеристики
Карбонат натрия технический (натрий углекислый) ГОСТ 5100-85 | Марка А | Марка Б | ||||
| Высший сорт | Первый сорт | Второй сорт | Высший сорт | Первый сорт | Второй сорт | |
| Массовая доля углекислого натрия (Na2CO3), %, не менее | 99,4 | 99,0 | 98,5 | 99,4 | 99,0 | 99,0 |
| Массовая доля углекислого натрия (Na2CO3) в пересчете на непрокаленный продукт, %, не менее | 98,2 | 97,0 | 98,9 | 98,2 | 97,5 | |
| Массовая доля потери при прокаливании (при 270 – 300 °С), %, не более | 0,7 | 0,8 | 1,5 | 0,5 | 0,8 | 1,5 |
| Массовая доля хлоридов в пересчете на NaCI, %,не более | 0,2 | 0,5 | 0,8 | 0,4 | 0,5 | 0,8 |
| Массовая доля железа в пересчете на Fe2O3, %, не более | 0,003 | 0,005 | 0,008 | 0,003 | 0,003 | 0,008 |
| Массовая доля веществ, нерастворимых в воде, %, не более | 0,04 | 0,04 | 0,08 | 0,03 | 0,04 | 0,08 |
| Массовая доля сульфатов в пересчете на Na2SO4, %, не более | 0,04 | 0,05 | Не нормируется | 0,04 | 0,05 | Не нормируется |
| Насыпная плотность, г/см3, не менее | 1,1 | 0,9 | 0,9 | Не нормируется | ||
| Гранулометрический состав: | ||||||
остаток на сите с сеткой № 2К по ГОСТ 6613, %, не более | Не нормируется | 5 | 5 | Не нормируется | ||
прохождение через сито с сеткой № 1,25К по ГОСТ 6613, % | 100 | Не нормируется | Не нормируется | |||
остаток на сите с сеткой № 1К по ГОСТ 6613, %, не более | 3 | Не нормируется | Не нормируется | |||
прохождение через сито с сеткой № 01К по ГОСТ 6613, %, не более | 7 | 15 | 25 | Не нормируется | ||
Магнитные включения размером более 0,25 мм | Отсутствуют | Не нормируется | Не нормируется | |||
Карбонат натрия
Карбонат натрия (кальцинированная сода) — неорганическое соединение, натриевая соль угольной кислоты с химической формулой Na2CO3. Бесцветные кристаллы или белый порошок, хорошо растворимый в воде. В промышленности в основном получают из хлорида натрия по методу Солвэ. Применяют при изготовлении стекла, для производства моющих средств, используют в процессе получения алюминия из бокситов и при очистке нефти.
Бесцветные кристаллы или белый порошок, хорошо растворимый в воде. В промышленности в основном получают из хлорида натрия по методу Солвэ. Применяют при изготовлении стекла, для производства моющих средств, используют в процессе получения алюминия из бокситов и при очистке нефти.
Содержание
- 1 Свойства
- 2 Нахождение в природе
- 3 Получение
- 3.1 Способ Леблана
- 3.2 Промышленный аммиачный способ (способ Сольве)
- 3.3 Способ Хоу
- 3.3.1 Сравнение способов
- 4 Применение
- 5 Безопасность
- 6 Тривиальные названия
Свойства
Имеет вид бесцветных кристаллов или белого порошка. Существует в нескольких разных модификациях: α-модификация с моноклинной кристаллической решеткой образуется при температуре до 350 °C, затем, при нагреве выше этой температуры и до 479 °C осуществляется переход в β-модификацию, также имеющую моноклинную кристаллическую решетку. При увеличении температуры выше 479 °C соединение переходит γ-модификацию с гексагональной решеткой. Плавится при 854 °C, при нагреве выше 1000 °C разлагается с образованием оксида натрия и диоксида углерода.
Плавится при 854 °C, при нагреве выше 1000 °C разлагается с образованием оксида натрия и диоксида углерода.
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O. В интервале 100—120 °C моногидрат теряет воду.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 854 °C | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, малорастворим в этаноле, хорошо растворим в глицерине и воде | |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
Уравнение гидролиза (в ионной форме):
- CO32− + H2O ⇄ HCO3− + OH−
Первая константа диссоциации угольной кислоты равна 4,5⋅10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
- Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
- нахколит NaHCO3
- трона Na2CO3·NaHCO3·2H2O
- натрит (сода) Na2CO3·10H2O
- термонатрит Na2CO3·Н2O.
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей, прибрежных и солончаковых растений путём перекристаллизации относительно малорастворимого NaHCO3 из щёлока.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- Na2SO4 + 2 C → Na2S + 2CO2
Сульфид натрия реагирует с карбонатом кальция:
- Na2S + CaCO3 → Na2CO3 + CaS
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают.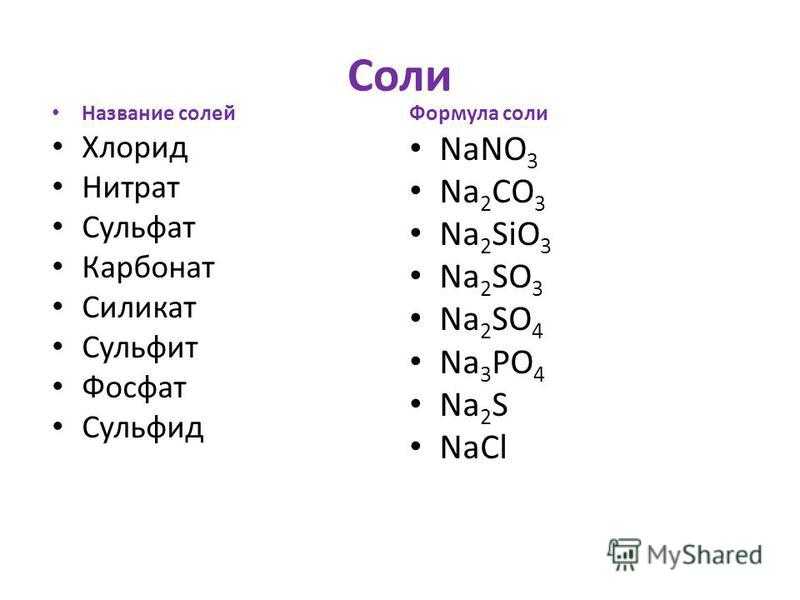 Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2 NaCl + H2SO4 → Na2SO4 + 2 HCl
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
Карбонат натрия
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.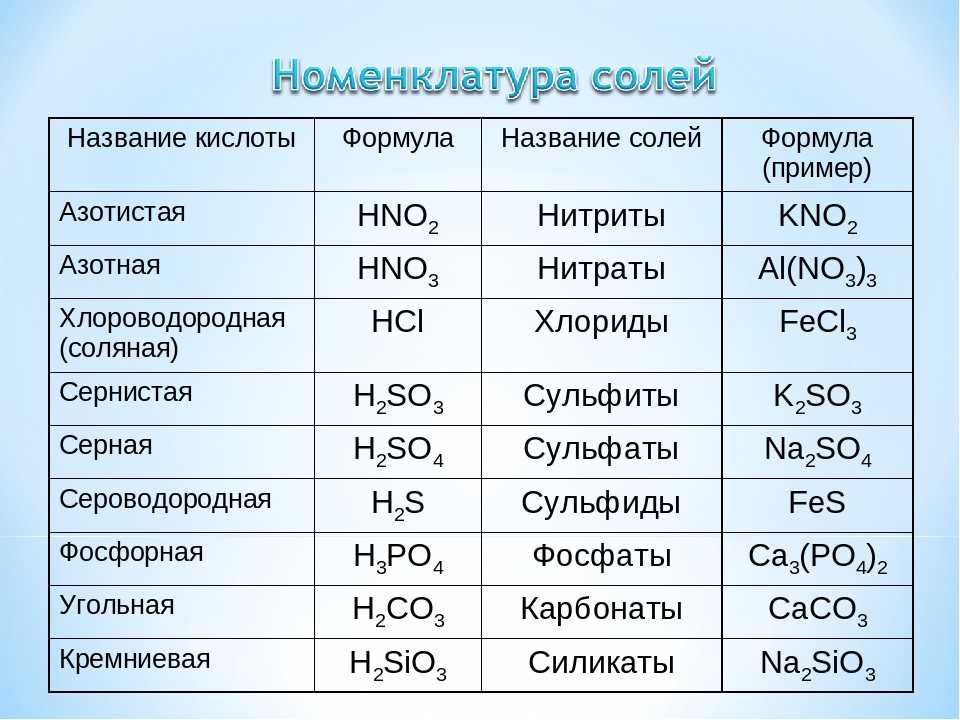
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2NaHCO3 →ot Na2CO3 + H2O + CO2↑
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год).
Применение
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах.
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью.
В фотографии используется в составе проявителей как ускоряющее средство.
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1 л масла.
Безопасность
Предельно допустимая концентрация аэрозоли кальцинированной соды в воздухе производственных помещений — 2 мг/м3. Кальцинированная сода относится к веществам 3-го класса опасности. Аэрозоль кальцинированной соды при попадании на влажную кожу и слизистые оболочки глаз и носа может вызвать раздражение, а при длительном воздействии ее — дерматит.
Тривиальные названия
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый, бикарбонат натрия
«Сода» в европейских языках происходит, вероятно, от арабского «suwwad» — общего названия различных видов солянок, растений, из золы которых её добывали в средние века; существуют и другие версии. Кальцинированная сода (карбонат натрия) называется так потому, что для получения её из бикарбоната последний «кальцинируют» (лат. calcinatio, от calx, по сходству с процессом обжига извести), то есть прокаливают.
Кальцинированная сода (карбонат натрия) называется так потому, что для получения её из бикарбоната последний «кальцинируют» (лат. calcinatio, от calx, по сходству с процессом обжига извести), то есть прокаливают.
Карбонат натрия, безводный, очищенный
- Обзор
- Характеристики
- Технические характеристики
Обзор
Свяжитесь с нами SDS Finder
Запрос бесплатных образцов
Технические характеристики
Общая информация
- Молярная масса
- 105,99 г/моль
- Номер CAS
- 497-19-8
- Линейная формула
- Na2CO3
Физические свойства
- Точка/диапазон плавления
- 854 °С
- Физическая форма
- Кристаллический порошок
- Плотность
- 2,53 г/см3 (20°С)
- Цвет
- Белый
- рН
- 11,3 при 10 г/л (20 °C)
- Давление паров
- Нет данных гектопаскаль
- Запах
- Без запаха
Информация по технике безопасности
- Термическое разложение
- Не разлагается при использовании по назначению: > 400 °C
- Химическая стабильность
- Стабилен при нормальных условиях.

- Воспламеняемость
- Продукт негорючий.
- Самовоспламенение
- Не самовоспламеняющийся
Международные перевозки
- Код Гармонизированной системы
- 28362000
Общая информация
Физические свойства
Информация по технике безопасности
Международные перевозки
- Молярная масса : 105,99 г/моль
- Номер CAS : 497-19-8
- Линейная формула : Na2CO3
- Температура плавления/диапазон : 854 °C
- Физическая форма : Кристаллический порошок
- Плотность : 2,53 г/см3 (20°С)
- Цвет : Белый
- pH : 11,3 при 10 г/л (20 °C)
- Давление пара : Данные отсутствуют гектопаскаль
- Запах : Без запаха
- Термическое разложение : Не разлагается при использовании по назначению: > 400 °C
- Химическая стабильность : Стабилен при нормальных условиях.

- Воспламеняемость : Продукт не воспламеняется.
- Самовозгорание : Не самовоспламеняющийся
- Код согласованной системы : 28362000
Свойство
Значение
проба (в расчете на сухое вещество)
Мин. 99 %
потери при сушке (130°C)
Макс. 1 %
железо (Fe)
Макс. 0,002 %
тяжелые металлы (как Pb)
Макс. 0,001 %
Макс. 0,3 %
Продажа и поставка карбоната натрия | Цена карбоната натрия
Продажа и поставка карбоната натрия
Позвоните нам, чтобы получить консультации по продажам карбоната натрия и процессам.
0 (216) 510 56 16
Тематические заголовки
Что такое карбонат натрия?
Карбонат натрия представляет собой неорганическое соединение с формулой Na2CO3 и различные гидраты. Он также известен под названиями стиральная сода, кальцинированная сода и кристаллы соды. Все формы представляют собой белые соли, растворимые в воде и дающие умеренно щелочные растворы.
Он также известен под названиями стиральная сода, кальцинированная сода и кристаллы соды. Все формы представляют собой белые соли, растворимые в воде и дающие умеренно щелочные растворы.
Его извлекали из золы растений, произраставших в богатых натрием почвах в истории. Поскольку зола этих богатых натрием растений заметно отличалась от древесной золы, карбонат натрия стал известен как «кальцинированная сода». В то время он также использовался для производства калия.
Карбонат натрия растворим в воде и может встречаться в природе в засушливых регионах, особенно в месторождениях полезных ископаемых (эвапоритах), которые образуются при испарении сезонных озер.
Карбонат натрия производится в больших количествах из хлорида натрия и известняка с помощью процесса Сольве.
Как производится карбонат натрия?
Прежде всего, карбонат натрия, встречающийся в природе, добывается в горнодобывающей промышленности. Во-вторых, его можно получить из морских водорослей и некоторых солеустойчивых видов растений.
Химически можно получить карбонат натрия с помощью процессов Леблана, Сольве и Хоу. Карбонат натрия получают путем обработки различных веществ, таких как хлорид натрия и аммиак, в начале и при прохождении определенных стадий.
Как выглядит карбонат натрия?
Твердое вещество белого цвета, гигроскопичное
Какова молекулярная формула карбоната натрия?
Молекулярная формула: Na2CO3
В каких секторах используется карбонат натрия?
- производство стекла
- умягчитель воды
- производство чистящих средств
- зубных паст
- производство бумаги
- обработка шкур животных
- кирпичная и литейная промышленность производство
- хлопок 004
- Различные химические применения, такие как бикарбонат натрия производство
- Аквариумы и плавательные бассейны
- Регулятор pH
Каковы виды использования (процессы) карбоната натрия?
- Карбонат натрия (или сода для стирки) используется в качестве чистящего средства в бытовых целях, таких как стирка одежды.
 Карбонат натрия входит в состав многих сухих мыльных порошков.
Карбонат натрия входит в состав многих сухих мыльных порошков. - Применяется для устранения временной и постоянной жесткости воды.
- Используется в производстве мыла и бумаги.
- Используется в производстве соединений натрия, таких как бура.
- Это самый важный химический компонент, который уже много лет используется для производства стекла. Карбонат натрия и песок соединяются и подвергаются сильному тепловому удару, и происходит производство стекла.
- Жесткая вода часто содержит растворенные соединения, такие как соединения кальция или магния. Карбонат натрия применяют для устранения временной и постоянной жесткости воды. Поскольку карбонат натрия растворим в воде, а карбонат магния и карбонат кальция нерастворимы, его используют для смягчения воды путем удаления Mg2+ и Ca2+.
- Карбонат натрия также используется в различных областях в качестве сильного основания. Как обычная щелочь, она предпочтительнее во многих химических процессах, поскольку она дешевле и намного безопаснее в использовании, чем NaOH.
 Его мягкость позволяет легко использовать его, особенно в бытовых целях, например, в стиральных машинах.
Его мягкость позволяет легко использовать его, особенно в бытовых целях, например, в стиральных машинах. - Может использоваться для лечения ожогов на теле человека.
- Используется в качестве регулятора pH для поддержания стабильных щелочных условий, необходимых для действия большинства фотопроявителей пленки.
- Это обычная добавка в плавательные бассейны и аквариумную воду для поддержания желаемого pH и карбонатной жесткости.
- Используется при пенной флотации для поддержания подходящего уровня pH вместе с СаО и другими слабощелочными соединениями в качестве кондиционера флотации.
- Бикарбонат натрия (NaHCO3)/пищевая сода, компонент огнетушителей, обычно производится из карбоната натрия.
- Карбонат натрия используется для производства бисульфита натрия (NaHSO3), который используется в «сульфитном» методе для отделения древесного спирта от целлюлозы. Эта реакция используется на электростанциях для удаления диоксида серы из дымовых газов.



 Карбонат натрия входит в состав многих сухих мыльных порошков.
Карбонат натрия входит в состав многих сухих мыльных порошков. Его мягкость позволяет легко использовать его, особенно в бытовых целях, например, в стиральных машинах.
Его мягкость позволяет легко использовать его, особенно в бытовых целях, например, в стиральных машинах.