Хлористый метилен — это… Что такое Хлористый метилен?
Дихлорметан (хлористый метилен, ДХМ, CH2Cl2) — прозрачная лекгоподвижная и легколетучая жидкость с характерным для галогенпроизводных сладковатым запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету. В целом наиболее безопасен среди галогеналканов.
Получение
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °С при соотношении равном 5:1
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
В результате получается смесь всех возможных хлоридов: хлорметан, дихлорметан, хлороформ и четырёххлористый углерод, которые потом разделяются дистилляцей. После чего он имеет чистоту не менее 99,7% В 1995 году годовое производство оценивалось в 500 миллионов тонн.
Свойства
Практически не растворим в воде(20 г/л), смешивается с большинством органических растворителей. Легколетуч (40 °С), образует азеотропную смесь с водой (т.кип. 38,1 °С, 98,5% М.). Метиленхлорид (дихлорметан) реагирует с хлором с образованием хлороформа и четырёххлористым углеродом. С йодом при 200 °С дает СН2l2, с бромом при 25-30 °С в присут. алюминия — бромхлорметан. При нагревании с водой гидролизуется до СН2О и НСl. При нагревании со спиртовым растворо NH3 до 100-125 °С образует гексаметилентетрамин. Реакция с водным раствором NH3 при 200 °С приводит к метиламину,муравьиной кислоте и НСl. С ароматическими соединениями в присутствии АlСl3 метиленхлорид вступает в реакцию Фриделя — Крафтса, например с бензолом образует дифенилметан. [1]
Применение
Дешевизна, высокая способность растворять многие органические вещества, легкость удаления, относительно малая токсичность привела к широкому применению его как растворитель для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворение смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов. Также используется в хроматографии. В промышленности в смеси с полимерами используют для создания формы которая быстро застывает за счёт испарения дихлорметана. Он же используется для склеивания этих пластиков: полистирол, поликарбонат, полиэтилентерефталат, АБС-пластик, но не для полиэтилена и полипропилена.
Очистка в лаборатории
- Промывают кислотой, щелочью и водой. Сушат над поташом и перегоняют. Можно использовать молекулярные сита 4А.[2]
- Кипячение с фосфорным ангидридом с последующей перегонкой. Хранится над молекулярными ситами 3А.
Специализированные применения
Используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.
Безопасность
Хотя он и является наименее ядовитым среди галогеналканов, но нужно быть осторожным при обращении, так как он очень летуч и может вызвать острое отравление. Вытяжная вентиляция необходима. В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать отравление им. Длительный покровный контакт с дихлрометаном может вызвать накопление его в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и нейропатия. На крысах показано, что он может вызывать рак лёгких, печени и поджелудочной железы. В тоже время не было отмечено какого либо влияния на развития эмбрионов у женщин имевших контакт с ДХМ.
В Евросоюзе запрещены краски с дихлорметаном, как для личного пользования так и для профессонального применения. Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые. Не вводить в контакт с щелочными металлами из-за угрозы взрыва. ПДК в рабочей зоне 50мг/м 3, в воде водоёмов не более 7.5 мг/л
КПВ 12-22%
Общая безопасность и методы устранения аварий[3]
Примечания
Wikimedia Foundation. 2010.
dic.academic.ru
Большая Энциклопедия Нефти и Газа, статья, страница 1
Метилен
Cтраница 1
Метилен считается самым неселективным реактивом органической химии. [1]
Метилен реагирует аналогичным образом с соединениями других типов, такими, как алканолы или простые эфиры. [2]
Метилен ( СН2), образующийся в первичном процессе, затем реагирует с кетеном, давая этилен и оксид углерода. [3]
Метилен может отщеплять и галоген. [4]
Метилен хлористый технический ( метиленхлорид) — бесцветная прозрачная жидкость. Поставляют по ГОСТ 9968 — 73 высшего, 1-го и 2-го сортов. [5]
Метилен присоединяется и к олефинам [84], и к избытку ли-тийалкила [79], причем эти реакции можно объяснить как взаимодействием с самим метиленом, так и промежуточным образованием металлоорганического соединения LiCh3Br ( ср. При взаимодействии пирролнатрия с йодистым метиленом образуется пиридин с выходом 0 5 % [85, 86]; эта реакция также, возможно, проходит через стадию элиминирования иода и образования метилена. [6]
Метилен: СН2 при фотолизе диазометаиа образуется в менее стабильной синглетиой форме. Синглетный метилен в результате столкновений с молекулами диазометана теряет энергию и превращается в более стабильный триплетный метилен. Фотолиз диазосоединений удобен для генерации самого метилена, но малоупотребим для генерации других карбенов вследствие малой доступности выших диазоалкаиов. [7]
Метилен, образующийся при фотолизе диазометана или кетсна, обладает избыточной энергией ( ср. [8]
Метилен, полученный фотолизом кетена, при реакции с тетра-фторэтиленом присоединяется исключительно по двойной связи. [9]
Метилен и дифенилкарбен отличаются по реакционной способности. То, что это различие, вероятно, обусловлено разницей в спиновых состояниях, хорошо демонстрируют реакции рассматриваемых карбенов с кислородом и окисью углерода. Метилен легко присоединяется к окиси углерода и с большим трудом поглощает кислород ( ср. Диарилкарбены, наоборот, легче реагируют с кислородом. [10]
Метилен СН2 в свободном виде, не существует. [11]
Метилен не образует стереоизбирательных аддуктов с олефмнами. [12]
Метилен несомненно принимает участие в реакции во втором примере, но не исключено, что здесь происходит замещение азота в недиссоциированном дифенилдиазо-метане. [13]
Метилены СНС1 [87] и СС12 [88] реагируют с трифенилфосфином с образованием непосредственно трифенилфосфоранов. [14]
Метилен йодистый применяется в минералогическом анализе для разделения минералов по удельному весу, а также для определения показателя преломления в микроскопии. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Слово МЕТИЛЕН — Что такое МЕТИЛЕН?
Слово метилен английскими буквами(транслитом) — metilen
Слово метилен состоит из 7 букв: е е и л м н т
Значения слова метилен. Что такое метилен?
Метилен
Метилен СН 2 — двузамещенный метан СН 2Х 2 или СН 2XY (где Х и Y какой-нибудь галоид или одноэквивалентный остаток кислоты, например уксусной или серной), содержит в себе СН 2 — двухатомный остаток метана, который и называют М.
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — 1890-1907
Метилен, хим., в свободном виде формулы CH₂— не известен; полимер CH₂— CH₂ представляет не что иное, как этилен или маслородный газ; хлорист. М.— бесцветная, с запахом хлороформа жидкость, предложена как анестезирующее средство.
Брокгауз и Ефрон. — 1907—1909
Метилена
МЕТИЛЕНА (Митилини) (Metelin) — город в Османской империи на о. Лесбос (ныне Греция), в кот. работало рус. почт, отделение. Использ. марки рус. почты в Османской империи. В 1909 на марках сделана надпечатка назв.
Большой филателистический словарь. — 1988
Метилене
МЕТИЛЕНЕ (Лесбосъ), одинъ изъ о-вовъ Греч. архипелага. Въ кампаню 1771 г. (см. Русско-турецкая война 1769—74 гг.¹), въ нач. окт., гр. Орловъ двинулся съ большею частью своего флота къ о-ву М. съ цѣлью уничтожить находившіеся тамъ тур.
Военная энциклопедия. — 1911—1914
Цианистый метилен
Цианистый метилен Ch3(CN)2 — полный (ср. Цианоуксусная кислота) нитрил малоновой кислоты (см.), получается действием фосфорного ангидрида на цианацетамид CN.Ch3.CO.Nh3 (амид цианоуксусной кислоты, темп. пл. 118°):CN.Ch3.CO.Nh3 Н2O = CN.Ch3.CN…
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — 1890-1907
Йодистый метилен и его гомологи
Йодистый метилен и его гомологи (хим.) — отвечают общей формуле С nН 2nJ 2. Й.-метилен CH 2J 2 получен впервые Бутлеровым из йодоформа при его нагревании с алкоголятом натрия.
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — 1890-1907
7-Метил-3-метиленокта-1.6-диен (2-Метил-6-метилен-2.7-октадиен. Мирцен)
7-Метил-3-метиленокта-1.6-диен (2-Метил-6-метилен-2.7-октадиен. Мирцен) Вещество: 7-Метил-3-метиленокта-1.6-диен (2-Метил-6-метилен-2.7-октадиен. Мирцен) Код: 531 Агр. сост.: жидкость/газ Класс опасности: 531 ПДК с/с: н/д ПДК м/р: н/д ОБУВ: 0.015 ЛОС…
www.xumuk.ru
Русский язык
Метиле́н, -а.
Орфографический словарь. — 2004
2.2-Метилендигидразид-4-пиридин-карбоновой кислоты (1.1-Метилен-бис-(изоникотиноилгидразон). Метазид)
2.2-Метилендигидразид-4-пиридин-карбоновой кислоты (1.1-Метилен-бис-(изоникотиноилгидразон). Метазид) Вещество: 2.2-Метилендигидразид-4-пиридин-карбоновой кислоты (1.1-Метилен-бис-(изоникотиноилгидразон).
www.xumuk.ru
6.12-Дидезокси-6-десметил-6-метилен-11альфа-хлор-11альфа.-12 -дигидро-12-оксо-5-гидрокситетрациклин (Хлорметациклин тозилат)
6.12-Дидезокси-6-десметил-6-метилен-11альфа-хлор-11альфа.-12 -дигидро-12-оксо-5-гидрокситетрациклин (Хлорметациклин тозилат) Вещество: 6.12-Дидезокси-6-десметил-6-метилен-11альфа-хлор-11альфа.
www.xumuk.ru
Метациклина гидрохлорид (4-Диметиламино-1.4.4а.5.5а.6. 11.12-октагидро-3.5.10.12.12а-пентагидрокси-6-метилен-1.11-д иоксинафтацен-2-карбоксамида гидрохлорид. Метациклин)
Метациклина гидрохлорид (4-Диметиламино-1.4.4а.5.5а.6. 11.12-октагидро-3.5.10.12.12а-пентагидрокси-6-метилен-1.11-д иоксинафтацен-2-карбоксамида гидрохлорид. Метациклин) Вещество…
www.xumuk.ru
- метиленблау
- метиленовый
- метиленхлорид
- метилен
- метилирование
- метилкаучук
- метилметакрилат
wordhelp.ru
Метилен хлористый
Химическая формула: СН2Сl2
Метилен хлористый – бесцветная, летучая, подвижная жидкость со сладковатым запахом, хорошо растворим в органических растворителях, плохо — в воде. Метилен хлористый используется как растворитель в различных промышленных химических процессах. Это обезжиривающий агент и компонент составов для смыва красок; для обработки фото — и кинопленки, экстрагент в пищевой промышленности (для удаления кофеина из кофе, для получения экстрактов хмеля и др. продуктов), вспенивающий агент в полиуретановых пенах, хладоагент в холодильных установках (« хладон — 30»).
Физико-химические показатели
|
Наименование показателей |
Норма по ГОСТ |
|
Внешний вид |
бесцветная прозрачная жидкость без механических примесей |
|
Плотность при 20°С, г/см2 |
1,326-1,328 |
|
Массовая доля воды, %, не более |
0,01 |
|
Массовая доля остатка после выпаривания, %, не более |
0,0005 |
|
Массовая доля железа, %, не более |
0.0001 |
|
Массовая доля кислот в пересчете на НСl, %, не более |
0,0004 |
|
Массовая доля хлорорганических примесей, %, не более |
0,23 |
|
Массовая доля хлористого метилена, %, не менее |
99,7 |
Продукт относится к веществам 4 класса опасности (вещество малоопасное) по ГОСТ 12.1.007.
Гарантийный срок хранения метилена хлористого — 3 месяца со дня изготовления.
himstroy.com
Метилен
метиленовый синий, метиленовая синькаМетиле́н — простейший карбен, бесцветный газ, формула которого СН2 сходна с формулой углеводородов ряда алкенов
Несмотря на то, что метилен был предсказан ещё в 30-х годах XX века, его существование было доказано лишь в 1959 году спектральными методами исследований
Метилен может быть получен из диазометана или кетена, разлагающихся под действием УФ-излучения на метилен, а также азот N2 или монооксид углерода, соответственно
Поскольку в молекуле метилена один атом углерода, в нём нет двойной связи как в алкенах, его относят к карбенам Обладает чрезвычайной химической активностью Может находиться в синглетной свободные электроны спарены или триплетной свободные электроны не спарены форме, которые отличаются как геометрией, так и химическими свойствами В триплетной форме является бирадикалом
В свободном виде обнаружен только в составе комет
См такжеправить
- Метил
- Карбены
- Алкилы
| Углеводородные радикалы | |
|---|---|
| Линейные насыщеные | Метил · Этил · Пропил · Изопропил · н-Бутил · Изобутил · втор-Бутил · трет-Бутил · Пентил · Гексил |
| Линейные ненасыщеные | Винил · Аллил |
| Циклические насыщеные | Циклопропил · Циклобутил · Циклопентил · Циклогексил |
| Ароматические | Фенил · Бензил · Мезил · Тритил |
метилен синий, метилендиоксибензол, метиленовая синька, метиленовая синька от, метиленово синьо, метиленовый голубой, метиленовый синий, метиленовый синий купить, метиленовый синий цена, метиленхлорид
Метилен Информацию О

Метилен Комментарии
Метилен
Метилен
Метилен Вы просматриваете субъект
Метилен что, Метилен кто, Метилен описание
There are excerpts from wikipedia on this article and video
www.turkaramamotoru.com
Хлористый метилен Википедия
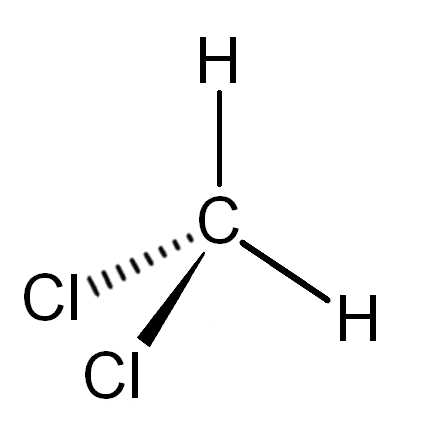
Дихлормета́н (метиленхлорид, хлористый метилен, ДХМ, CH2Cl2) — прозрачная легкоподвижная и легколетучая жидкость с характерным для галогенпроизводных запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету.
Получение
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °C при соотношении равном 5:1
- Ch5+Cl2⟶ Ch4Cl+HCl{\displaystyle {\mathsf {CH_{4}+Cl_{2}\longrightarrow \ CH_{3}Cl+HCl}}}
- Ch4Cl+Cl2⟶ Ch3Cl2+HCl{\displaystyle {\mathsf {CH_{3}Cl+Cl_{2}\longrightarrow \ CH_{2}Cl_{2}+HCl}}}
- Ch3Cl2+Cl2⟶ CHCl3+HCl{\displaystyle {\mathsf {CH_{2}Cl_{2}+Cl_{2}\longrightarrow \ CHCl_{3}+HCl}}}
- CHCl3+Cl2⟶ CCl4+HCl{\displaystyle {\mathsf {CHCl_{3}+Cl_{2}\longrightarrow \ CCl_{4}+HCl}}}
В результате получается смесь всех возможных хлоридов: хлорметан, дихлорметан, хлороформ и четырёххлористый углерод, которые потом разделяются ректификацией.
Свойства
Растворимость в воде 2 % по массе (20 г/л), смешивается с большинством органических растворителей. Легколетуч (40 °C), образует азеотропную смесь с водой (т.кип. 38,1 °C, 98,5 % дихлорметана). Метиленхлорид (дихлорметан) реагирует с хлором с образованием хлороформа и четырёххлористого углерода. С йодом при 200 °C дает СН2l2, с бромом при 25-30 °C в присутствии алюминия — бромхлорметан. При нагревании с водой гидролизуется до СН2О и НСl. При нагревании со спиртовым раствором NH3 до 100—125 °C образует гексаметилентетрамин. Реакция с водным раствором NH3 при 200 °C приводит к метиламину, муравьиной кислоте и НСl. С ароматическими соединениями в присутствии АlCl3 метиленхлорид вступает в реакцию Фриделя — Крафтса, например с бензолом образует дифенилметан.[2]
Применение
Дешевизна, высокая способность растворять многие органические вещества, лёгкость удаления, относительно малая токсичность привела к широкому применению его как растворителя для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворения смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов.
Также используется в хроматографии.
В промышленности в смеси с полимерами используют для создания формы, которая быстро застывает за счёт испарения дихлорметана. Он также используется для склеивания пластмасс: полистирола, поликарбонатов, полиэтилентерефталата, АБС-пластиков, но не для полиэтилена и полипропилена.
Очистка в лаборатории
Специализированные применения
Дихлорметан используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.
Безопасность
Контакт дихлорметана с щелочными металлами приводит к взрыву. Работы с дихлорметаном следует проводить при работающей вытяжной вентиляции.
Дихлорметан способен вызвать наркоз. Он также токсичен: воздействует на печень, почки и селезёнку, способен проникать через кожу, гематоэнцефалитический и плацентарный барьеры.
При остром отравлении при вдыхании дихлорметана наблюдаются раздражение слизистых оболочек глаз и верхних дыхательных путей, головокружение, головные боли, помрачение сознания, рвота и понос. В случае тяжёлого отравления происходит потеря сознания вследствие наркоза вплоть до остановки дыхания. При хронических отравлениях наблюдаются постоянные головные боли, головокружение, потеря аппетита, поражение внутренних органов. Длительный покровный контакт с дихлорметаном может вызвать его накопление в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и возникновение диабетической нейропатии.
В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать отравление им.[4]
На крысах показано, что он может вызывать рак лёгких, печени и поджелудочной железы.
В Евросоюзе запрещены краски с дихлорметаном как для личного пользования, так и для профессионального применения.
Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые.
ПДК в рабочей зоне 50 мг/м³, в воде водоёмов не более 7.5 мг/л. Концентрационный предел воспламенения 12-22 %. Не горюч, но поддерживает горение, от огня дает вспышку, но не горит сам, горит в смеси с другими горящими материалами внося свой вклад при пожаре, однако пролить на стол около спиртовки его не так опасно как горючие растворители, скорее как масло[источник не указан 336 дней].
Примечания
Литература
- Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы / Редкол.: Москвин А. В. и др.. — СПб.: АНО НПО «Профессионал», 2004. — 1142 с. — ISBN 5-98371-025-7.
- Ошин Л. А. Промышленные хлорорганические продукты. — М.: Химия, 1978. — 656 с. — 8400 экз.
wikiredia.ru
Метилен — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
 Метиле́н — простейший карбен, бесцветный газ, формула которого СН2 сходна с формулой углеводородов ряда алкенов.
Метиле́н — простейший карбен, бесцветный газ, формула которого СН2 сходна с формулой углеводородов ряда алкенов.
Несмотря на то, что метилен был предсказан ещё в 30-х годах XX века, его существование было доказано лишь в 1959 году спектральными методами исследований.
Метилен может быть получен из диазометана или кетена, разлагающихся под действием УФ-излучения на метилен, а также азот (N2) или монооксид углерода, соответственно.
Поскольку в молекуле метилена один атом углерода, в нём нет двойной связи как в алкенах, его относят к карбенам. Обладает чрезвычайной химической активностью. Может находиться в синглетной (свободные электроны спарены) или триплетной (свободные электроны не спарены) форме, которые отличаются как геометрией, так и химическими свойствами. В триплетной форме является бирадикалом.
В свободном виде обнаружен только в составе комет.
См. также
Напишите отзыв о статье «Метилен»
Отрывок, характеризующий Метилен
Так капитан рассказал трогательную историю своей любви к одной обворожительной тридцатипятилетней маркизе и в одно и то же время к прелестному невинному, семнадцатилетнему ребенку, дочери обворожительной маркизы. Борьба великодушия между матерью и дочерью, окончившаяся тем, что мать, жертвуя собой, предложила свою дочь в жены своему любовнику, еще и теперь, хотя уж давно прошедшее воспоминание, волновала капитана. Потом он рассказал один эпизод, в котором муж играл роль любовника, а он (любовник) роль мужа, и несколько комических эпизодов из souvenirs d’Allemagne, где asile значит Unterkunft, где les maris mangent de la choux croute и где les jeunes filles sont trop blondes. [воспоминаний о Германии, где мужья едят капустный суп и где молодые девушки слишком белокуры.]Наконец последний эпизод в Польше, еще свежий в памяти капитана, который он рассказывал с быстрыми жестами и разгоревшимся лицом, состоял в том, что он спас жизнь одному поляку (вообще в рассказах капитана эпизод спасения жизни встречался беспрестанно) и поляк этот вверил ему свою обворожительную жену (Parisienne de c?ur [парижанку сердцем]), в то время как сам поступил во французскую службу. Капитан был счастлив, обворожительная полька хотела бежать с ним; но, движимый великодушием, капитан возвратил мужу жену, при этом сказав ему: «Je vous ai sauve la vie et je sauve votre honneur!» [Я спас вашу жизнь и спасаю вашу честь!] Повторив эти слова, капитан протер глаза и встряхнулся, как бы отгоняя от себя охватившую его слабость при этом трогательном воспоминании.
wiki-org.ru
