Угольная кислота и ее соли. 9 класс
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Угольная кислота и её соли
МОУ «СОШ № 43 города Чебоксары»Угольная кислота
и её соли
36
9 класс Химия
Учитель: Трофимова Жанна Васильевна
2. Угольная кислота
Периодическая система химических элементов Д.И.МенделееваГруппы элементов
I
1
1
2
2
3
3
II
III
IV
V
1
12
4
5
5
7
8
6
9
7
10
VII
VIII
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА
0
+6
2 е,- 4 е-
2
Углерод – основа всего
живого на Земле.

3
Степень окисления в
соединениях +4, +2, — 4.
4
В природе встречается как
в свободном виде (алмаз,
графит), так и в связанном
состоянии ( углекислый
газ, карбонаты, уголь,
нефть и т.д.)
4
6
VI
Электронное строение
12
0
2p2
+6
2 s2
2
4
1 s2
5. Химическая формула Угольной кислоты
6. Вид формулы Н2СО3
7. Физические свойства Н2СО3
Угольная кислота Н2СО3 слабая, оченьнеустойчивая даже в водных
растворах. В насыщенном водном
растворе практически весь
углекислый газ содержится в виде
молекул СО2, окруженных
молекулами воды.
8. Получение Н2СО3
• Угольная кислота образуется прирастворении в воде диоксида углерода
СО2
• Содержание угольной кислоты в
растворе увеличивается при понижении
температуры раствора и увеличении
давления углекислого газа.
СО2 + Н2О = Н2СО3
9. Получение Н2СО3
• Также угольная кислота образуется привзаимодействии её солей (карбонатов и
гидрокарбонатов) с более сильной
кислотой.
 При этом бо́льшая часть
При этом бо́льшая частьобразовавшейся угольной кислоты, как
правило, разлагается на воду и диоксид
углерода
Na2CO3 + 2HCl = 2NaCl + CO2 + h3O
11. 2 ряда солей Н2СО3
Средние (Нормальные)• Карбонаты
Na2CO3
CaCO3
Кислые
• Гидрокарбонаты
NaHCO3
Ca(HCO3)2
Трехвалентные металлы (Fe, Al, Cr) карбонатов
вообще не образуют – в соответствующих клетках
таблицы растворимости стоят прочерки
12. Практическое значение солей Н2СО3
• СаСО3 карбонат кальция• Мел
• Мрамор (Плотный
кристаллический
известняк)
• Известняк
• Кальцит(известковый
шпат)
13. Применение СаСО3 карбоната кальция
Замачивание и стирка белья
Очистка нефти
Производство стекла
В текстильной промышленности
В мыловаренной промышленности
14. Практическое значение солей Н2СО3
• NaHCO3гидрокарбонат натрия
• Питьевая сода
• Пищевая сода
• Двууглекислый натрий
15. Применение NaHCO3 гидрокарбоната натрия
• В огнетушителях• В хлебопечении
• При изготовлении шипучих напитков
16.
 Практическое значение солей Н2СО3• Na2CO3 карбонат
Практическое значение солей Н2СО3• Na2CO3 карбонатнатрия
• Стиральная сода
• Кальцинированная
сода
• Нормальный
карбонат
17. Практическое значение солей Н2СО3
• Na2CO3 10h3Oкристаллогидрат
карбоната
натрия
• Кристаллическая
сода
• Натрит
18. Практическое значение солей Н2СО3
• К2СО3 карбонаткалия
• Поташ
• Углекислый
калий
• Белая «зола» от
костра
19. Сталактиты и сталагмиты
• сталактитами называют кальцитовые натёчнокапельные образования, имеющие формусосульки с внутренним питающим каналом
• сталагмиты — натечные минеральные
образования (большей частью известковые),
растущие в виде конусов, столбов со дна пещер
и других подземных карстовых полостей
навстречу сталактитам и нередко сливающиеся с
ними.
21. Механизм образования
Вода, проникающая в пещеру, растворяетизвестняк в химической реакции:
2+
CaCO3 + h3O + CO2 <=> Ca + 2 HCO3
При определённых условиях (разница в
парциальном давлении углекислого газа в
растворе и воздухе) реакция идёт в обратную
сторону, и происходит отложение карбоната
кальция — растут сталактиты.
 Происходит это
Происходит этовесьма медленно, характерное время —
десятки, сотни лет. Длина сталактитов в
отдельных случаях достигает нескольких метров.
24. Карбонаты в природе
25. Жемчуг
26. Кораллы
27. Кораллы
28. Кораллы
29. Горы из известняка
30. Горы из известняка
English Русский Правила
Название кислот и кислотных остатков и их формулы
0 Азамат #
16 сентября 2019 в 14:41
Вроде норм
Ответить
0 Гулина #
8 января 2020 в 10:02
где нитрид?
Ответить
0 Алексей #
6 сентября 2020 в 07:05
А где соляная ?
Ответить
0 Администратор#
6 сентября 2020 в 07:43
HCl Хлороводород (Соляная кислота) Cl- Хлорид
Ответить
0 we #
14 сентября 2020 в 14:50
А борная?
Ответить
0 Администратор#
14 сентября 2020 в 19:43
Добавили
Ответить
0 Лиза #
1 апреля 2021 в 15:08
а салициловая,яблочная?
Ответить
0 Администратор#
2 апреля 2021 в 10:00
Добавили
Ответить
0 Карина #
14 апреля 2021 в 16:05
а вольфрамовая кислота?
Ответить
0 Администратор#
15 апреля 2021 в 20:09
Добавили
Ответить
0 Капуста #
2 мая 2021 в 09:59
Ванадиевая кислота?
Ответить
0 Артём #
5 июля 2021 в 17:57
А где дифосфорная, тиосерная и тиоциановая
Ответить
0 Администратор#
8 июля 2021 в 17:21
Капуста:
Ванадиевая кислота?
Артём:
А где дифосфорная, тиосерная и тиоциановая
Добавили
Ответить
0 Виктор #
8 июля 2021 в 17:49
у вас нет:
марганцевистая — h3MnO4
цинковая — h3ZnO2
метафосфорная — HPO3
молибденовая — h3MoO4
ортокремнивая — h5SiO4
Ответить
0 1 #
1 августа 2021 в 11:08
А возможно ли скачать таблицу?
Ответить
0 Айдар кот #
11 марта 2022 в 18:14
Где метафосфорная кислота?
Ответить
0 Ваня Балда #
1 ноября 2022 в 05:59
А можно ли скачать таблиицу?
Ответить
Угольная кислота
Угольная кислота, также известная как h3CO3, представляет собой углеродсодержащую молекулу с химической формулой h3CO3. Незначительное количество этой молекулы можно найти в растворах диоксида углерода, включая воду. Поскольку эта молекула содержит одну углеродно-кислородную двойную связь, ее химическая формула также может быть представлена как OC(OH)2 из-за того, что она содержит одну углеродно-кислородную двойную связь.
Незначительное количество этой молекулы можно найти в растворах диоксида углерода, включая воду. Поскольку эта молекула содержит одну углеродно-кислородную двойную связь, ее химическая формула также может быть представлена как OC(OH)2 из-за того, что она содержит одну углеродно-кислородную двойную связь.
Из-за того, что это единственная кислота, которая может выделяться в газообразном состоянии легкими человека, угольную кислоту обычно называют «дыхательной кислотой». Это слабая кислота, которая образует карбонатные и бикарбонатные соли при воздействии воздуха.
h3CO3 обладает способностью растворять известняк, в результате чего образуется бикарбонат кальция ((Ca(h3CO3)2). Многие характеристики известняка, такие как сталагмиты и сталактиты, являются результатом этого процесса.
Препараты угольной кислоты-h3CO3 Угольная кислота имеет структуру, состоящую из одной двойной связи углерод-кислород и двух одинарных связей углерод-кислород. атомы углерода, участвующие в соединении.
атомы углерода, участвующие в соединении.
Во многих средах обитания с умеренным климатом углекислота, образующаяся в результате растворения и гидролиза CO2 в воде, является наиболее важным природным выщелачивающим агентом. Он одновременно слаб и нестабилен, быстро распадается на ионы водорода (H+) и ионы бикарбоната (HCO3-), которые затем выделяются в окружающую среду.
Свойства угольной кислоты-h3CO3В этом подразделе содержится список некоторых наиболее важных физических и химических свойств угольной кислоты.
1. Физические характеристики sМолекулярная масса угольной кислоты составляет 62,024 грамма на моль.
• Плотность 1,668 грамма на кубический сантиметр в стандартном состоянии состава.
6,35 – значение pKa химической молекулы h3CO3.
• Бикарбонат представляет собой сопряженное основание, соответствующее угольной кислоте в уравнении.
• Это химическое вещество чаще всего встречается в виде раствора.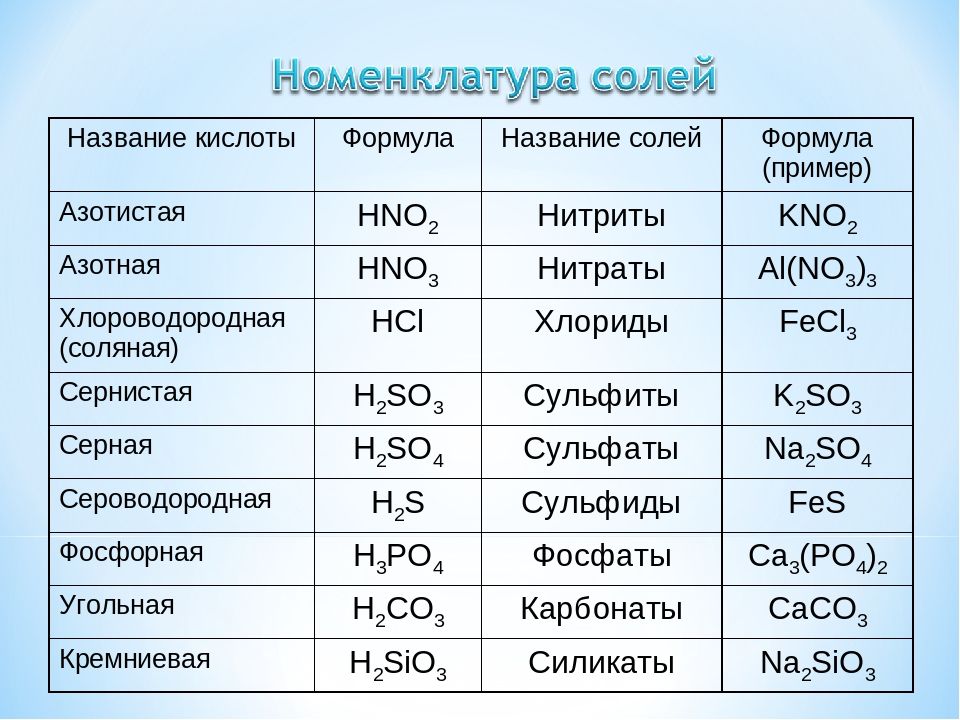 Хотя было заявлено, что ученые НАСА создали твердые образцы h3CO3, неясно, правда ли это.
Хотя было заявлено, что ученые НАСА создали твердые образцы h3CO3, неясно, правда ли это.
• h3CO3 – слабая кислота, нестабильная в естественной среде.
• В присутствии воды подвергается частичной диссоциации с образованием ионов H+ и HCO3- (бикарбонат).
h3CO3+h3OHCO3-+H+
• Углекислота является двухосновной кислотой, поэтому она может реагировать с водой с образованием двух типов солей: бикарбонатов и карбонатов.
• Добавление небольшого количества основания к h3CO3 приводит к образованию бикарбонатных солей, тогда как добавление избытка основания приводит к образованию карбонатных солей.
Наблюдателям следует помнить, что углекислота может образовываться как побочный продукт промышленных ферментационных операций или сжигания ископаемого топлива в больших масштабах в промышленности.
Применение угольной кислоты Учитывая широкий спектр применения, h3CO3 является очень важным химическим веществом, которое необходимо понимать. Некоторые из этих применений угольной кислоты перечислены в следующем разделе.
Некоторые из этих применений угольной кислоты перечислены в следующем разделе.
Газированные напитки, такие как газированная вода, игристое вино и другие газированные напитки, производятся с использованием угольной кислоты.
- При осаждении некоторых солей аммония, таких как персульфат аммония, в качестве растворителя используется h3CO3.
- Способствует удалению углекислого газа из атмосферы тела.
- Протонирование различных азотосодержащих оснований в сыворотке крови происходит в результате присутствия h3CO3
- Углекислота применяется для лечения стригущего лишая и других дерматитов путем нанесения непосредственно на больное место. • Растворы, содержащие это химическое вещество, также особенно эффективны для очистки контактных линз.
- Это лекарство можно использовать внутрь, чтобы вызвать рвоту в любое время, когда это необходимо (например, в случаях передозировки наркотиков).
Бикарбонат-ион известен как посредник в транспортировке углекислого газа из организма человека в процессе дыхательного газообмена. Известно, что в организме присутствует ион бикарбоната. Реакции гидратации, которым подвергается диоксид углерода, протекают крайне вяло, особенно при отсутствии достаточного количества катализатора для реакции. С другой стороны, присутствие семейства ферментов, известных как карбоангидразы, в эритроцитах ускоряет скорость реакции. Ферменты карбоангидразы ответственны за катализ превращения углекислого газа и воды в диссоциированные ионы угольной кислоты в присутствии воды. Это приводит к образованию анионов бикарбоната, которые растворяются в плазме крови. После вдоха в легких снова происходит катализируемая реакция, в результате которой образуется углекислый газ СО2.
Известно, что в организме присутствует ион бикарбоната. Реакции гидратации, которым подвергается диоксид углерода, протекают крайне вяло, особенно при отсутствии достаточного количества катализатора для реакции. С другой стороны, присутствие семейства ферментов, известных как карбоангидразы, в эритроцитах ускоряет скорость реакции. Ферменты карбоангидразы ответственны за катализ превращения углекислого газа и воды в диссоциированные ионы угольной кислоты в присутствии воды. Это приводит к образованию анионов бикарбоната, которые растворяются в плазме крови. После вдоха в легких снова происходит катализируемая реакция, в результате которой образуется углекислый газ СО2.
Углекислота чрезвычайно важна для океанов.
Из-за способности океана поглощать избыток углекислого газа из атмосферы (в основном из-за деятельности человека) ученые прогнозируют, что рН океанской воды снизился примерно на 0,1 единицы рН. Поглощенный углекислый газ соединяется с океанской водой, в результате чего образуется h3CO3.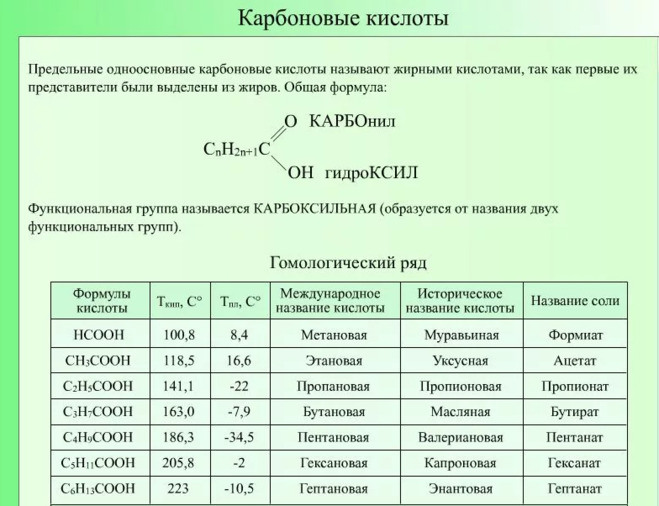 Подкисление океана — это термин, обычно используемый для описания этого процесса.
Подкисление океана — это термин, обычно используемый для описания этого процесса.
Углекислота — это химическое соединение, которое часто используется при создании безалкогольных напитков, искусственно газированных игристых вин и других игристых напитков. Бикарбонаты (также известные как карбонаты водорода) и карбонаты — это два названия солей угольной кислоты.
В чем разница между угольной кислотой и бикарбонатом
Основное различие между угольной кислотой и бикарбонатом заключается в том, что угольная кислота является нейтральным химическим соединением, тогда как бикарбонат является отрицательно заряженным химическим соединением.
Углекислота — это слабая кислота, образующаяся в растворе при растворении диоксида углерода в воде, с химической формулой h3CO3. Бикарбонат образуется комбинацией трех атомов кислорода, атома водорода и атома углерода с химической формулой HCO3-.
СОДЕРЖАНИЕ
1. Обзор и основные отличия
Обзор и основные отличия
2. Что такое угольная кислота
3. Что такое бикарбонат
4. Угольная кислота и бикарбонат в табличной форме
5. Резюме. Что такое угольная кислота и бикарбонат
3?
Угольная кислота – это h3CO3. Иногда мы даем это название растворам, содержащим углекислый газ, растворенный в воде или газированной воде. Это связано с тем, что газированная вода содержит небольшое количество h3CO3. Кроме того, угольная кислота является слабой кислотой и может образовывать два типа солей: карбонаты и бикарбонаты. Молярная масса этого соединения составляет 62,024 г/моль.
Рисунок 01: Химическая структура угольной кислоты
Когда углекислый газ растворяется в воде, он достигает равновесия между углекислым газом и угольной кислотой. Равновесие выглядит следующим образом:
CO2 + h3O ⟷ h3CO3
Если к основанию добавить избыток угольной кислоты, получится бикарбонат. Но если есть избыток основания, то угольная кислота склонна давать карбонизированные соли. Точнее, угольная кислота представляет собой соединение карбоновой кислоты, которое имеет два заместителя гидроксильной группы, присоединенные к карбонильному углероду. Более того, это полипротонная кислота, способная отдавать протоны. У него два удаляемых протона, поэтому он специфически дипротонный.
Точнее, угольная кислота представляет собой соединение карбоновой кислоты, которое имеет два заместителя гидроксильной группы, присоединенные к карбонильному углероду. Более того, это полипротонная кислота, способная отдавать протоны. У него два удаляемых протона, поэтому он специфически дипротонный.
Что такое бикарбонат?
Бикарбонат образуется при соединении трех атомов кислорода, атома водорода и атома углерода. Продуктом этой комбинации может быть ион или соединение с большим количеством электронов, чем протонов. Мы можем описать его как химический вид, имеющий химическую формулу HCO3–. Рисунок 02. Химическая структура бикарбонат-аниона . Кроме того, он служит способом контролировать пищеварительные соки после того, как желудок закончил переваривать пищу. Кроме того, углекислота в дождевой воде образует ионы бикарбоната, когда попадает на скалы. Этот поток ионов бикарбоната важен для поддержания углеродного цикла.
В чем разница между углекислотой и бикарбонатом?
Углекислота — это слабая кислота, образующаяся в растворе при растворении диоксида углерода в воде, и ее химическая формула — h3CO3. Бикарбонат образуется комбинацией трех атомов кислорода, атома водорода и атома углерода с химической формулой HCO3-. Ключевое различие между угольной кислотой и бикарбонатом заключается в том, что угольная кислота является нейтральным химическим соединением, тогда как бикарбонат представляет собой отрицательно заряженное химическое соединение. Кроме того, угольная кислота используется при приготовлении шипучих, шипучих напитков, лечении дерматитов, в средствах для полоскания рта и т. д., тогда как бикарбонат используется в пищевых продуктах, таких как выпечка (в качестве разрыхлителя), и дает способность противостоять изменениям рН.
Бикарбонат образуется комбинацией трех атомов кислорода, атома водорода и атома углерода с химической формулой HCO3-. Ключевое различие между угольной кислотой и бикарбонатом заключается в том, что угольная кислота является нейтральным химическим соединением, тогда как бикарбонат представляет собой отрицательно заряженное химическое соединение. Кроме того, угольная кислота используется при приготовлении шипучих, шипучих напитков, лечении дерматитов, в средствах для полоскания рта и т. д., тогда как бикарбонат используется в пищевых продуктах, таких как выпечка (в качестве разрыхлителя), и дает способность противостоять изменениям рН.
Следующая инфографика суммирует разницу между углекислотой и бикарбонатом в табличной форме для параллельного сравнения.
Резюме – Угольная кислота против бикарбоната
Угольная кислота – это h3CO3. Бикарбонат образуется комбинацией трех атомов кислорода, атома водорода и атома углерода с химической формулой HCO3-. Ключевое различие между угольной кислотой и бикарбонатом заключается в том, что угольная кислота является нейтральным химическим соединением, тогда как бикарбонат представляет собой отрицательно заряженное химическое соединение.
