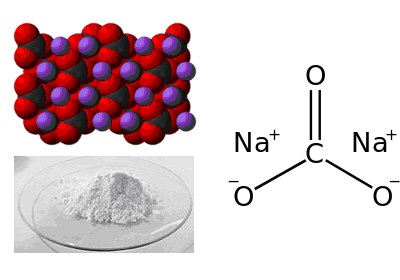
Формула Карбоната натрия структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: CNa2O3
Химический состав Карбоната натрия
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12,011 | 1 | 11,3% |
| Na | Натрий | 22,99 | 2 | 43,4% |
| O | Кислород | 15,999 | 3 | 45,3% |
Молекулярная масса: 105,988
Карбона́т на́трия Na2CO3 — химическое соединение, натриевая соль угольной кислоты.
Тривиальные названия
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый (устар.), бикарбонат натрия
Название «сода» происходит от растения солянка содоносная (лат. Salsola soda), из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры). Каустической содой называют гидроксид натрия (NaOH).
Оксиды и гидроксиды
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | H2CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде следующих минералов:
- нахколит NaHCO3
- трона Na2CO3·NaHCO3·H2O
- натрит (сода) Na2CO3·10H2O
- термонатрит Na2CO3·Н2O.
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида: Na 2SO4 + 2C → Na2S + 2CO2↑. Сульфид натрия реагирует с карбонатом кальция: Na2S + СаСО3 → Na2CO3 + CaS. Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием. Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой: 2NaCl + H2SO4 → Na2SO4 + 2HCl↑. Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты. Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году. После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день. В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углеродадиоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3: NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl. Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия: 2NaHCO 3 →(t) Na2CO3 + CO2↑ + H2O. Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2: 2Nh5Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O, и полученный NH3 также возвращают в производственный цикл. Таким образом, единственным отходом производства является хлорид кальция, не имеющий широкого промышленного применения, кроме использования в качестве противообледеняющего реагента для посыпания улиц. Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция. По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве. Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4
Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl. Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами. В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год).Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na
Свойства карбоната натрия
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 852 °C (по другим источникам, 853 °C) | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, мало растворим в этаноле хорошо растворим в глицерине, и воде (см. таблицу ниже) | растворим в воде, не растворим в этаноле |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °С | Растворимость, г Na2CO3 на 100 г H2O |
|---|---|
| 0 | 7 |
| 10 | 12,2 |
| 20 | 21,8 |
| 25 | 29,4 |
| 30 | 39,7 |
| 40 | 48,8 |
| 50 | 47,3 |
| 60 | 46,4 |
| 80 | 45,1 |
| 100 | 44,7 |
| 120 | 42,7 |
| 140 | 39,3 |
Применение
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах. В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii. Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью Также используется для приготовления проявителя фотоматериалов.
formula-info.ru
Формула соды в химии
Определение и формула соды
Содой называют несколько химических соединений:
Сода, кальцинированная сода, бельевая сода – карбонат натрия.
Химическая формула: Na2CO3, натриевая соль угольной кислоты.
Такую соду называли кальцинированной, потому что ее получали из кристаллогидратов путем прокаливания (кальцинации).
Натрит, натрон – декагидрат карбоната натрия. Формула:Na2CO3 • 10H2O
Термонатрит – моногидрат карбоната натрия. Формула: Na2CO3 • H2O
Общие химические свойства соды
Растворы всех вышеперечисленных вещества имеют щелочную реакцию среды, гидроксид натрия за счет диссоциации:
а карбонат и гидрокарбонат натрия – за счет гидролиза по аниону (угольная кислота – слабая кислота):
Реакции с кислотами:
Термическое разложение. При температуре 60–200°C гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду:
При температуре выше 100–120°C отщепляется кристаллизационная вода от кристаллогидратов:
При температуре выше 1000°C разлагается карбонат натрия:
Пищевая сода широко применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Примеры решения задач
ru.solverbook.com
Карбонат натрия: формула, свойства, получение
Образование 1 июня 2012Сода кальцинированная – это вещество, безусловно, знакомо каждому и практически все знают хотя бы несколько примеров того, где его можно применить. Официальное название вещества — карбонат натрия, формула — Na2CO3. Внешне кальцинированная сода представляет собой белый порошок, может быть представлена и в виде гранул такого же цвета. Существует еще одно название этого соединения — кальцинированная сода, но по этому поводу не должно возникать заблуждений в том отношении, что это не та, привычная нам, в быту, сода. Так ее называют еще потому, что получение вещества связано с процессом – кальцинирования – обезвоживания кристаллогидрата натрия при высокой температуре.
Углекислая сода — одно из старейших из известных веществ в истории человечества. Еще артефакты Древнего Египта содержат сведения о веществе карбонат натрия, формула которого, конечно же, была записана гораздо позднее. Папирусы нам сообщают, что в Египте это соединение получали из озер, а также из золы, получаемой в результате сжигания растений, содержащих щелочи. Надо отметить, что Египет оставался крупнейшим производителем и поставщиком соды на мировой рынок вплоть до конца XVII века, став мировой морской державой, к Египту присоединилась Испания как ведущий поставщик кальцинированной соды. Индустриализация, развитие новых отраслей промышленности требовали все большего количества этого ценного вещества, а потому в 1775 году Французская Академия по инициативе знаменитых энциклопедистов организовала проведение открытого конкурса на предмет разработки промышленного способа получения углекислой соды. Победителем этого «химического соревнования» стал знаменитый французский фармацевт и ученый-экспериментатор Николай Леблан, который впервые в 1792 году получил промышленным способом карбонат натрия, формула которого была им записана как Na2CO3. Работа Леблана представляла собой проведение реакции получения вещества из хлорида натрия с участием природных смесей мела и сульфата натрия. В результате реакции получался плав, состоящий из Na2C03 и CaS, из которого и выщелачивали водой карбонат натрия, формула вещества — Na2CO3.
Способ Леблана на долгое время стал основным для промышленности. По мнению некоторых исследователей, строительство заводов по производству соды вело к росту городских агломераций и концентрации населения в городах. Содовое производство способствовало и развитию других направлений химической отрасли, например, таких как производство серной и азотной кислот.
Развитие содового производства способствовало развитию сырьевых баз для добычи серного колчедана, поваренной соли, селитры.
Только спустя полвека у метода Леблана возник соперник – аммиачный способ содового производства. Он был шагом вперед, так требовал меньше трудозатрат, теплоэнергии, сырья, и, как следствие, обходился намного дешевле.
Именно удешевление производства способствовало появлению такого соединения, как гидрокарбонат натрия, получение которого способствовало расширению применения его уже в виде пищевого продукта, ныне известного под наименованием пищевой добавки Е-500 – пищевой соды.
Химические свойства углекислой соды следующие. Вещество гигроскопично, то есть очень хорошо впитывает влагу, в чем, наверняка, не единожды, убеждался каждый.
Кроме воды, она впитывает и диоксид углерода, который находиться в составе воздуха. Это следует учитывать при хранении вещества. Характер взаимодействия соды с жидкостями зависит, в основном, от уровня влажности и температуры.
При нагревании соединения оно распадается на углекислый газ и оксид. Сода взаимодействует с кислотами, так, например, карбонат натрия, соляная кислота в результате взаимодействия между собой образуют углекислый газ.
Натрий углекислый используется в промышленном производстве стекла, лаков и красок, мыла и моющих средств. Его свойства позволяют применять это соединение при очистке нефти, изготовлении бумаги, каустической соды и производстве натриевых солей.
Источник: fb.ruQuery failed: connection to localhost:9312 failed (errno=111, msg=Connection refused).
monateka.com
формула, состав, применение :: SYL.ru
Пищевая, или питьевая сода, — широко известное в медицине, кулинарии и бытовом потреблении соединение. Это кислая соль, молекула которой образована положительно заряженными ионами натрия и водорода, анионом кислотного остатка угольной кислоты. Химическое название соды — бикарбонат или гидрокарбонат натрия. Формула соединения по системе Хилла: CHNaO3 (брутто-формула).
Отличие кислой соли от средней
Угольная кислота образуют две группы солей — карбонаты (средние) и гидрокарбонаты (кислые). Тривиальное название карбонатов — соды — появилось еще в древности. Следует различать среднюю и кислую соли по названиям, формулам и свойствам.
Na2CO3 — карбонат натрия, динатриевая соль угольной кислоты, кальцинированная стиральная сода. Служит сырьем для получения стекла, бумаги, мыла, используется как моющее средство.

NaHCO3 — натрия гидрокарбонат. Состав подсказывает, что вещество является мононатриевой солью угольной кислоты. Это соединение отличается наличием двух разных положительных ионов — Na+ и Н+. Внешне кристаллические белые вещества похожи, их трудно отличить друг от друга.
Вещество NaHCO3 считается питьевой содой не потому, что употребляется внутрь для утоления жажды. Хотя с помощью этого вещества можно приготовить шипучий напиток. Раствор этого гидрокарбоната принимают внутрь при повышенной кислотности желудочного сока. При этом происходит нейтрализация избытка протонов Н+, которые раздражают стенки желудка, вызывают боль и жжение.
Физические свойства пищевой соды
Бикарбонат — это белые моноклинные кристаллы. В составе этого соединения присутствуют атомы натрия (Na), водорода (Н), углерода (С) и кислорода. Плотность вещества составляет 2,16 г/см3. Температура плавления — 50–60 °С. Натрия гидрокарбонат — порошок молочно-белого цвета — твердое мелкокристаллическое соединение, растворимое в воде. Питьевая сода не горит, а при нагревании свыше 70 °С разлагается на карбонат натрия, углекислый газ и воду. В производственных условиях чаще применяется гранулированный бикарбонат.

Безопасность пищевой соды для человека
Соединение не обладает запахом, его вкус — горько-соленый. Однако не рекомендуется нюхать и пробовать вещество на вкус. Вдыхание гидрокарбоната натрия может вызвать чихание и кашель. Одно из применений основано на способности пищевой соды нейтрализовать пахнущие вещества. Порошком можно обработать спортивную обувь, чтобы избавиться от неприятного запаха.
Питьевая сода (гидрокарбонат натрия) — безвредное вещество при контакте с кожей, но в твердом виде может вызвать раздражение слизистой оболочки глаз и пищевода. В низких концентрациях раствор не токсичен, его можно принимать внутрь.
Гидрокарбонат натрия: формула соединения
Брутто-формула CHNaO3 редко встречается в уравнениях химических реакций. Дело в том, что она не отображает связь между частицами, которые образуют гидрокарбонат натрия. Формула, обычно используемая для характеристики физических и химических свойств вещества, — NaHCO3. Взаимное расположение атомов отражает шаро-стержневая модель молекулы:
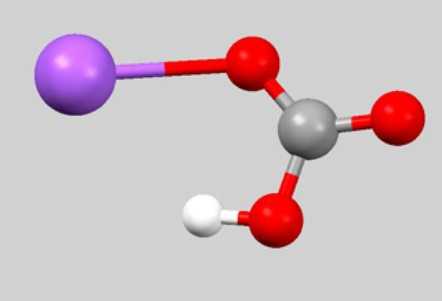
Если узнать из периодической системы значения атомных масс натрия, кислорода, углерода и водорода. то можно подсчитать молярную массу вещества гидрокарбонат натрия (формула NaHCO3):
Ar(Na) — 23;
Ar(O) — 16;
Ar(C) — 12;
Ar(H) — 1;
М (CHNaO3) = 84 г/моль.
Строение вещества
Гидрокарбонат натрия — ионное соединение. В состав кристаллической решетки входит катион натрия Na+, замещающий в угольной кислоте один атом водорода. Состав и заряд аниона — НСО3–. При растворении происходит частичная диссоциация на ионы, которые образуют гидрокарбонат натрия. Формула, отражающая структурные особенности, выглядит так:
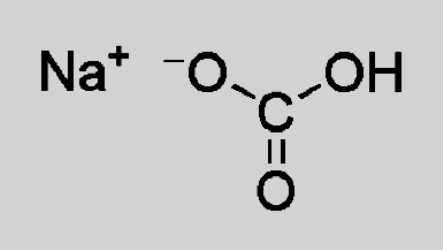
Растворимость питьевой соды в воде
В 100 г воды растворяется 7,8 г гидрокарбоната натрия. Вещество подвергается гидролизу:
NaHCO3 = Na+ + НСО3–;
Н2О ↔ Н+ + ОН–;
НСО3– + Н+ = Н2О + СО2↑.
При суммировании уравнений выясняется, что в растворе накапливают гидроксид-ионы (слабощелочная реакция). Жидкость окрашивает фенолфталеин в розовый цвет. Окраска универсальных индикаторов в виде бумажных полосок в растворе соды меняется с желто-оранжевой на серую или синюю.
Реакция обмена с другими солями
Водный раствор гидрокарбоната натрия вступает в реакции ионного обмена с другими солями при условии, что одно из вновь получившихся веществ — нерастворимое; либо образуется газ, который удаляется из сферы реакции. При взаимодействии с хлоридом кальция, как показано на схеме ниже по тексту, получается и белый осадок сарбоната кальция, и углекислый газ. В растворе остаются ионы натрия и хлора. Молекулярное уравнение реакции:
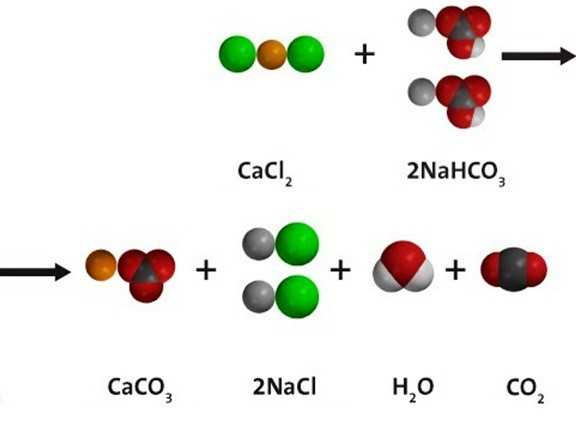
Взаимодействие питьевой соды с кислотами
Гидрокарбонат натрия взаимодействует с кислотами. Реакция ионного обмена сопровождается образованием соли и слабой угольной кислоты. В момент получения она разлагается на воду и углекислый газ (улетучивается).
Стенки желудка человека вырабатывают соляную кислоту, существующую в виде ионов
Н+ и Cl–. Если принимать внутрь натрия гидрокарбонат, реакции происходят в растворе желудочного сока с участием ионов:
NaHCO3 = Na+ + НСО3–;
HCl = Н+ + Cl–;
Н2О ↔ Н+ + ОН–;
НСО3– + Н+ = Н2О + СО2↑.
Врачи не рекомендуют постоянно использовать при повышенной кислотности желудка гидрокарбонат натрия. Инструкция к препаратам перечисляет различные побочные действия ежедневного и длительного приема питьевой соды:
- повышение давления крови;
- отрыжка, тошнота и рвота;
- тревожность, плохой сон;
- снижение аппетита;
- боли в животе.
Получение пищевой соды
В лаборатории бикарбонат натрия можно получить из кальцинированной соды. Такой же метод применялся раньше в химическом производстве. Современный промышленный способ основан на взаимодействии аммиака с углекислым газом и слабой растворимости питьевой соды в холодной воде. Через раствор хлорида натрия пропускают аммиак и диоксид углерода (углекислый газ). Образуются хлорид аммония и раствор гидрокарбоната натрия. При охлаждении растворимость питьевой соды понижается, тогда вещество легко отделяется с помощью фильтрования.
Где используется гидрокарбонат натрия? Применение пищевой соды в медицине
Многим известно, что атомы металлического натрия энергично взаимодействуют с водой, даже ее парами в воздухе. Реакция начинается активно и сопровождается выделением большого количества теплоты (горением). В отличие от атомов, ионы натрия — стабильные частицы, не наносящие вреда живому организму. Наоборот, они принимают активное участие в регуляции его функций.
Как используется неядовитое для человека и полезное во многих отношениях вещество — гидрокарбонат натрия? Применение основано на физических и химических свойствах питьевой соды. Важнейшие направления — бытовое потребление, пищевая промышленность, здравоохранение, народная медицина, получение напитков.
Среди основных свойств бикарбоната натрия — нейтрализация повышенной кислотности желудочного сока, кратковременное устранение болевого синдрома при гиперацидности желудочного сока, язвенной болезни желудка и 12-перстной кишки. Антисептическое действие раствора питьевой соды применяется при лечении боли в горле, кашля, интоксикации, морской болезни. Промывают им полости рта и носа, слизистые оболочки глаз.

Широко используются разные лекарственные формы бикарбоната натрия, например порошки, которые растворяют и применяют для инфузий. Назначают растворы для приема пациентами внутрь, промывают ожоги кислотами. Для изготовления таблеток и ректальных суппозиториев также используется гидрокарбонат натрия. Инструкция к препаратам содержит подробное описание фармакологического действия, показаний. Список противопоказаний очень короткий — индивидуальная непереносимость вещества.
Использование пищевой соды в быту
Гидрокарбонат натрия — это «скорая помощь» при изжоге и отравлении. С помощью питьевой соды в домашних условиях отбеливают зубы, уменьшают воспаление при угревой болезни, протирают кожу для удаления избытка жирного секрета. Бикарбонат натрия смягчает воду, помогает очистить загрязнения с разных поверхностей.
При ручной стирке вещей из шерстяного трикотажа можно добавить в воду питьевую соду. Это вещество освежает цвет ткани и удаляет запах пота. Нередко при глажении изделий из шелка появляются желтые подпалины от утюга. В таком случае поможет кашица из питьевой соды и воды. Вещества надо как можно быстрее смешать и нанести на пятно. Когда кашица подсохнет, ее следует почистить щеткой, а изделие прополоскать в холодной воде.
В реакции с уксусной кислотой получается ацетат натрия и бурно выделяется углекислый газ, вспенивающий всю массу: NaHCO3 + СН3СООН = Na+ + СН3СОО– + Н2О + СО2↑. Этот процесс идет всякий раз, когда при изготовлении шипучих напитков и кондитерских изделий питьевую соду «гасят» уксусом.

Вкус выпечки будет нежнее, если использовать не магазинный синтетический уксус, а сок лимона. На крайний случай можно заменить его смесью 1/2 ч. л. порошка лимонной кислоты и 1 ст. л. воды. Питьевая сода с кислотой добавляется в тесто в числе последних ингредиентов, чтобы можно было сразу ставить выпечку в духовку. Кроме бикарбоната натрия, иногда в качестве разрыхлителя используется гидрокарбонат аммония.
www.syl.ru
Цены и новости на рынке химии
Новости и события
29 октября в ЦВК «Экспоцентр» в Москве стартует VI Московский Международный Химический Форум, организованный Российским Союзом химиков при поддержке Минпромторга России на полях Международной выставки…
08 октября 2018г. в офисе Российского Союза химиков прошло заседание Оргкомитета и Технического комитета Всероссийского отраслевого конкурса Российского Союза химиков «5 звезд. Лидер химической отрасли».
…Согласно опубликованным данным «Федеральной службы государственной статистики» (Росстат), индекс производства химических веществ и химических продуктов в сентябре 2018г. по сравнению с соответствующим периодом…
вагонов-цистерн выросло в 2 раза. Объем перевозок за 3 квартал составил 91, 4 тыс. т, что на 42% выше показателя 2 квартала 2018 г., за 9 месяцев компания перевезла 205, 2 тыс. т химических грузов.
В 3 квартале НПК ОВК открыла два сервисных центра первой категории…
и сбыт химических полупродуктов, добавок, специальных химикатов и пластиков. Концерн включен в списки ведущих мировых индексов устойчивого развития: индекса устойчивости Доу-Джонса (DJSI World и Europe) и FTSE4Good.
Заявления…
установлен десятилетний тариф «инфляция минус 0, 1%», сейчас подобный механизм обсуждается для «Транснефти» и «Россетей». Как сообщал 9 октября, ОАО РЖД предложило резко изменить формулу и учитывать не потребительскую инфляцию, а…
Информация
Государственные приоритеты развития отечественной химической промышленности в задачах текущего периода: в Москве обсудят основные вопросы развития химпрома
Победители Конкурса «5 звезд. Лидеры химической отрасли»
Производство каучуков за девять месяцев увеличилось на 5%
Государственные приоритеты развития отечественной химической промышленности в задачах текущего периода: в Москве обсудят основные вопросы развития химпрома
Победители Конкурса «5 звезд. Лидеры химической отрасли»
Производство каучуков за девять месяцев увеличилось на 5%
Каталог организаций и предприятий
…
элементов (по аттестованным в ТПУ методикам) -кобальт и его соединения (нитрат, хлорид, карбонат, сульфат, гидроокись) -никель и его соединения (нитрат, хлорид, сульфат, карбонат) -молибден, молибдаты аммония, натрия, оксид молибдена -вольфрам, вольфраматы…
…
ООО «ПромСнабКомплект» предлагает свои услуги по снабжению вашего предприятия химической продукцией, по низким ценам, широко применяемой в различных производствах. Наш перечень товаров включает в себя такие наименования как: дубитель хромовый, медь…
Компания ООО «ФОРМУЛА ОЙЛ» зарегистрирована 6 июня 2008 года, юридический адрес: 450029, г. УФА, ул. ПУТЕЙСКАЯ, д. 2. Компании присвоен ОГРН: 1080277006259. Основным видом деятельности является: «Оптовая торговля прочим жидким и газообразным топливом…
Производитель коксохимической продукции. Продукция, услуги: Доменный кокс, кокс орешек, коксовая мелочь, сульфат аммония, бензол для нитрации, роданистый натрий, сера газовая и коллоидная, тиосульфат натрия, пластификаторы бетона, масло антраценовое…
Предложения на покупку и продажу продукции
ООО «Промхимпермь» Предлагает продукцию собственного производства: триэтаноламинтитант ТЭАТ-1, тетрабутоксититан, полибутоксититан (полибутилтитанат) , тетраэтоксититан (тетраэтилтитанат) , тетраизопр…
DEF Blue / AdBlue жидкость для системы SCR 20л т. +7 (915) 612-37-79, www.aksioma55.ru AUS 32 (Aqueous Urea Solution, 32.5%) — водный раствор мочевины, 32.5%. Продукт представляет собой раствор моче…
Rosneft Oleotec Grind WF-310- высокотехнологичная жидкость на основе гидрокрекингового базового масла, предназначенная для абразивной и легкой лезвийной обработки как цветных так и черных металлов. Бл…
DEF Blue / AdBlue жидкость для системы SCR 20л т. +7 (915) 612-37-79, www.aksioma55.ru AUS 32 (Aqueous Urea Solution, 32.5%) — водный раствор мочевины, 32.5%. Продукт представляет собой раствор моче…
AdBlue/DEF Blue жидкость для системы SCR 20л т. +7 (915) 612-37-79, www. aksioma55. ru AUS 32 (Aqueous Urea Solution, 32. 5%) — водный раствор мочевины, 32. 5%. Продукт представляет собой раствор…
DEF Blue / AdBlue жидкость для системы SCR 20л т. +7 (915) 612-37-79, www.aksioma55.ru AUS 32 (Aqueous Urea Solution, 32.5%) — водный раствор мочевины, 32.5%. Продукт представляет собой раствор моче…
www.himonline.ru
Карбонат натрия — это… Что такое Карбонат натрия?
Карбона́т на́трия Na2CO3 — химическое соединение, натриевая соль угольной кислоты.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — питьевая сода, натрий двууглекислый, бикарбонат натрия
Название «сода» происходит от растения Salsola Soda, из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры).
Каустической содой называют гидроксид натрия (NaOH).
Оксиды и гидроксиды
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | H2CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде следующих минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- Na2SO4 + 2C → Na2S + 2CO2↑.
Сульфид натрия реагирует с карбонатом кальция:
- Na2S + СаСО3 → Na2CO3 + CaS.
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2NaCl + H2SO4 → Na2SO4 + 2HCl↑.
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
Карбонат натрияВ 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl.
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2NaHCO3 →(t) Na2CO3 + CO2↑ + H2O.
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O,
и полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция, не имеющий широкого промышленного применения, кроме использования в качестве противообледеняющего реагента для посыпания улиц.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказал фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).[источник не указан 293 дня]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[2].
Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O.
Безводный карбонат натрия представляет собой бесцветный кристаллический порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 852 °C (по другим источникам, 853 °C) | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, мало растворим в этаноле хорошо растворим в глицерине, и воде (см. таблицу ниже) | растворим в воде, не растворим в этаноле |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
CO32− + H2O ↔ HCO3− + OH−
Первая константа диссоциации угольной кислоты равна 4,5·10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Применение
Карбонат натрия используют в стекольном производстве, мыловарении и производстве стиральных и чистящих порошков, эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще устранения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Карбонат натрия (кальцинированная сода) Название и функция вещества:
Карбонат натрия (кальцинированная сода) — регулятор кислотности; окислитель. Имеется в составе жидкости для мытья посуды, сигарет, пестицидов.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E500, регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию.
Примечания
dik.academic.ru
Карбонат натрия — это… Что такое Карбонат натрия?
Карбона́т на́трия Na2CO3 — химическое соединение, натриевая соль угольной кислоты.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — питьевая сода, натрий двууглекислый, бикарбонат натрия
Название «сода» происходит от растения Salsola Soda, из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры).
Каустической содой называют гидроксид натрия (NaOH).
Оксиды и гидроксиды
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | H2CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде следующих минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- Na2SO4 + 2C → Na2S + 2CO2↑.
Сульфид натрия реагирует с карбонатом кальция:
- Na2S + СаСО3 → Na2CO3 + CaS.
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2NaCl + H2SO4 → Na2SO4 + 2HCl↑.
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
Карбонат натрияВ 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl.
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2NaHCO3 →(t) Na2CO3 + CO2↑ + H2O.
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O,
и полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция, не имеющий широкого промышленного применения, кроме использования в качестве противообледеняющего реагента для посыпания улиц.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказал фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).[источник не указан 293 дня]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[2].
Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O.
Безводный карбонат натрия представляет собой бесцветный кристаллический порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 852 °C (по другим источникам, 853 °C) | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, мало растворим в этаноле хорошо растворим в глицерине, и воде (см. таблицу ниже) | растворим в воде, не растворим в этаноле |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
CO32− + H2O ↔ HCO3− + OH−
Первая константа диссоциации угольной кислоты равна 4,5·10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Применение
Карбонат натрия используют в стекольном производстве, мыловарении и производстве стиральных и чистящих порошков, эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще устранения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Карбонат натрия (кальцинированная сода) Название и функция вещества:
Карбонат натрия (кальцинированная сода) — регулятор кислотности; окислитель. Имеется в составе жидкости для мытья посуды, сигарет, пестицидов.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E500, регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию.
Примечания
3dic.academic.ru