Кальцинированная сода — DCS
Кальцинированная сода используется в растворах на водяной основе как источник ионов карбоната для осаждения ионов кальция, повышения pH, флокуляции растворов при забурке. Кальцинированная сода является общим названием для карбоната натрия (Na2CO3). Кальцинированная сода — слабое основание, которое растворимо в воде и при диссоциации образует ионы натрия (Na+), и ионы карбоната (CO32-) в растворе.
ОСНОВНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА
| Внешний вид | Белый порошок. | |
| Химическая формула | Na2CO3 | |
| Плотность | 2510 кг/м3 | |
| pH 1% раствора | 1 4 4 | |
| 51г/100мл пресной воды (при 30°С) |
ОБЛАСТЬ И СПОСОБ ПРИМЕНЕНИ
Кальцинированная сода используется в основном для уменьшения растворимого кальция в растворах на водной основе. Также использует для увеличения pH и флокуляции растворов при забурке. Ионы кальция присутствует в воде для приготовления раствора, они могут привести к флокуляции бурового раствора, что может привести к увеличению реологии, гелеобразования и водоотдачи. Концентрации при обработке раствора кальцинированной содой лежат в диапазоне от 0,25 до 2 фунт/баррель (от 0,7 до 5,7 кг/м3), в зависимости от концентрации онов кальция в растворе. Один фунт (0,45 кг) кальцинированной соды будет удалять 1,283 фунтов (0,58 кг), сульфата кальция (ангидрит). Обрабатывать раствор следует аккуратно, при избытке кальцинированной соды возникнет карбонатная флокуляция раствора.
Химическая реакция осаждения ионов кальция описывается следующей формулой:
Ca2+ + Na2CO3 -> CaCO3 + 2Na+ (9.7 < pH < 11.7)
Расчетная формула для уменьшения жесткости:
Кальцинированная сода (фунт / баррель) = Ca (мг/л) x 0.00093 x Fw
Где: Fw = Содержание воды при ретортном анализе (% воды/100)
ПРЕИМУЩЕСТВА
- Широкодоступный и дешевый источник ионов карбоната для осаждения ионов кальция при одновременном повышении рН
- Эффективно уменьшает концентрацию ионов кальция в растворах на водяной основе, даже при маленьких концентрациях.
- Эффективный флокулянт для забурки.
ОГРАНИЧЕНИЯ
- Увеличивает рН и не может быть использован для обработки раствора при загрязнениия цементом, или в растворах где нужен высокий рН, слабо растворим при высоком значении рН.

- Перенасыщение приводит к карбонатному загрязнению; даже незначительный избыток ионов карбоната может вызвать значительное увеличение ДНС, гелеобразования и водоотдачи.
ТОКСИЧНОСТЬ И ОБРАЩЕНИЕ
Кальцинированная сода прошла экологическую сертификацию и допущена к применению на территории РФ в качестве компонента буровых растворов..
Следует обращаться в соответствии с требованиями MSDS и общими требованиями к транспортировке, хранению и использованию промышленных химреагентов. Рекомендуется использовать средства индивидуальной защиты (очки, перчатки) и соблюдать правила личной гигиены.
Кальцинированную соду следует медленно вводить в систему. Нельзя мешать кальцинированную соду с другими хим веществами, особенно с кислотами, каустической содой или известью.
УПАКОВКА И ХРАНЕНИЕ
Кальцинированную соду упаковывают в 50- и 100 фунтов (22.7- и 45.4-кг), многослойные, бумажные мешки. Кальцинированная сода широкодоступный реагент и может поставляться в других упаковках. Хранить в сухом месте, вдали от кислот и воды.
Кальцинированная сода широкодоступный реагент и может поставляться в других упаковках. Хранить в сухом месте, вдали от кислот и воды.
Сода кальцинированная, карбонат натрия, натрий углекислый
Медународное название: Sodium Carbonate
Внешний вид: бесцветный кристаллический порошок
Химическая формула: Na2CO3
Производитель: Украина
Упаковка: мешок 25-50 кг
Хранение: до 5 лет (зависит от типа упаковки и марки продукции)
ОписаниеСода кальцинированная в безводном состоянии представляющий собой бесцветный кристаллический порошок, выпускается посредством аммиачно-содового процесса (метода Сольве), а также в ходе комплексной переработки нефелинов.
Гигроскопичный продукт, на воздухе поглощает влагу и углекислоту с образованием кислой соли NaHCO3, при хранении на открытом воздухе слеживается. Водные растворы карбоната натрия имеют сильно щелочную реакцию. Выпускают карбонат натрия технический (натрий углекислый) марки А (гранулированный) и марки Б (порошкообразный).
Водные растворы карбоната натрия имеют сильно щелочную реакцию. Выпускают карбонат натрия технический (натрий углекислый) марки А (гранулированный) и марки Б (порошкообразный).
Сода — общее название технических натриевых солей угольной кислоты. Карбонат натрия (кальцинированная сода, натрий углекислый) — химическое соединение Na2CO3, натриевая соль угольной кислоты.
Кальцинированной содой называется безводный карбонат натрия Na2CO3. Кальцинированной она называется потому, что получают ее прокаливанием (кальцинированием) гидрокарбоната натрия NaHCO3 или кристаллогидрата карбоната натрия.
Свойства
Техническая кальцинированная сода производится в виде гранул или в виде порошка. Она быстро растворяется в воде, не отличается характерным запахом. Химическая формула кальцинированной соды Na2CO3. Это вещество имеет невысокую плотность 2,54 г/см?, может закипеть только при температуре 1600°C.
Температура плавления карбоната натрия составляет: 851°C. Его плотность: 2,53 г/см?. Растворимость в воде: 22 г/100 мл при 20°C.
Кальцинированная сода считается достаточно гигроскопичным продуктом. Она способна легко впитывать в себя запахи окружающей среды, а также поглощать влагу. Во время впитывания углекислоты сода способна выделять кислые соли.
Получение
В настоящее время промышленным способом получения кальцинированной соды является так называемый способ Сольве. В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода. Выпавший остаток малорастворимого гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140-160° C, при этом он переходит в карбонат натрия. Образовавшийся диоксид углерода и аммиак, выделенный из маточного раствора на первой стадии процесса по реакции возвращают в производственный цикл.
Сегодня наиболее крупные запасы карбоната натрия расположены на территории США, Канады, Кении и ЮАР. Основными озерами, где добывают кальцинированную соду, считаются Натрон и Серлс, расположенные в Танзании и Калифорнии. Также содовые озера можно встретить на территории Забайкалья и Западной Сибири.
Основными озерами, где добывают кальцинированную соду, считаются Натрон и Серлс, расположенные в Танзании и Калифорнии. Также содовые озера можно встретить на территории Забайкалья и Западной Сибири.
Применение
Натриевая соль угольной кислоты применима:
— в производстве стекла всех видов, в том числе хрусталя, оптического, медицинского, электровакуумного стекла; стеклоблоков, пеностекла, силиката натрия растворимого, керамических плиток, компонента фритт для глазурей;
— в черной и цветной металлургии: для обезжиривания металлов и десульфатизации и дефосфации чугуна, в очистке отходящих газов, для нейтрализации сред;
— в химической промышленности для производства фосфорных, хромовых, бариевых, натриевых солей как карбонатсодержащее сырье, в производстве глицеринов, аллилового спирта;
— в целлюлозно-бумажной промышленности;
— в анилино-красочной и лакокрасочной промышленности;
— в нефтехимической и нефтеперерабатывающей промышленности;
— в мыловарении и производстве стиральных и чистящих порошков, эмалей, для получения ультрамарина;
— в пищевой промышленности зарегистрирован в качестве пищевой добавки E500, регулятора кислотности, разрыхлителя, препятствующего слёживанию.

Требования безопасности
Техническая кальцинированная сода относится к веществам 3-го класса опасности.
Аэрозоль технической кальцинированной соды при попадании на влажную кожу и слизистые оболочки глаз и носа может вызвать раздражение, а при длительном воздействии ее – дерматит.
Предельно допустимая концентрация, аэрозоли кальцинированной соды в воздухе рабочей зоны производственных помещений — 2 мг/м3..
Производственные помещения и лаборатории, в которых проводится работа с технической кальцинированной содой, должны быть оборудованы приточно-вытяжной вентиляцией, обеспечивающей состояние воздуха рабочей зоны.
Сода кальцинированная Карбонат натрия технический (натрий углекислый)
Главная \ ТЕХНИЧЕСКАЯ ХИМИЯ \ СОДА КАЛЬЦИНИРОВАННАЯ Карбонат натрия технический (натрий углекислый)Сода кальцинированная Карбонат натрия технический (натрий углекислый) ГОСТ 5100-85
Химическая формула:Na2CO3
Сода кальцинированная техническая (натрий углекислый) – порошок или гранулы белого цвета. Кальцинированная сода марок А, Б применяется в изготовлении стекла всех видов. Также кальцинированная сода применяется в чёрной и цветной металлургии: с её помощью производят свинец, цинк, вольфрам, стронций, хром. Кальцинированную соду используют для десульфуризации, дефосфации чугуна, при очистке отходящих газов, а также для полной нейтрализации сред. Перевозить кальцинированную соду можно любым видом крытого транспорта, так как кальцинированная сода пожаробезопасна и взрывобезопасна. При хранении не допускать попадании влаги.
Кальцинированная сода марок А, Б применяется в изготовлении стекла всех видов. Также кальцинированная сода применяется в чёрной и цветной металлургии: с её помощью производят свинец, цинк, вольфрам, стронций, хром. Кальцинированную соду используют для десульфуризации, дефосфации чугуна, при очистке отходящих газов, а также для полной нейтрализации сред. Перевозить кальцинированную соду можно любым видом крытого транспорта, так как кальцинированная сода пожаробезопасна и взрывобезопасна. При хранении не допускать попадании влаги.
Технические характеристики
Карбонат натрия технический (натрий углекислый) ГОСТ 5100-85 | Марка А | Марка Б | ||||
| Высший сорт | Первый сорт | Второй сорт | Высший сорт | Первый сорт | Второй сорт | |
| Массовая доля углекислого натрия (Na2CO3), %, не менее | 99,4 | 99,0 | 98,5 | 99,4 | 99,0 | 99,0 |
| Массовая доля углекислого натрия (Na2CO3) в пересчете на непрокаленный продукт, %, не менее | 98,7 | 98,2 | 97,0 | 98,9 | 98,2 | 97,5 |
| Массовая доля потери при прокаливании (при 270 – 300 °С), %, не более | 0,7 | 0,8 | 1,5 | 0,5 | 0,8 | 1,5 |
| Массовая доля хлоридов в пересчете на NaCI, %,не более | 0,2 | 0,5 | 0,8 | 0,4 | 0,5 | 0,8 |
| Массовая доля железа в пересчете на Fe2O3, %, не более | 0,003 | 0,005 | 0,008 | 0,003 | 0,003 | 0,008 |
| Массовая доля веществ, нерастворимых в воде, %, не более | 0,04 | 0,04 | 0,08 | 0,03 | 0,04 | 0,08 |
| Массовая доля сульфатов в пересчете на Na2SO4, %, не более | 0,04 | 0,05 | Не нормируется | 0,04 | 0,05 | Не нормируется |
| Насыпная плотность, г/см3, не менее | 1,1 | 0,9 | 0,9 | Не нормируется | ||
| Гранулометрический состав: | ||||||
остаток на сите с сеткой № 2К по ГОСТ 6613, %, не более | Не нормируется | 5 | 5 | Не нормируется | ||
прохождение через сито с сеткой № 1,25К по ГОСТ 6613, % | 100 | Не нормируется | Не нормируется | |||
остаток на сите с сеткой № 1К по ГОСТ 6613, %, не более | 3 | Не нормируется | Не нормируется | |||
прохождение через сито с сеткой № 01К по ГОСТ 6613, %, не более | 7 | 15 | 25 | Не нормируется | ||
Магнитные включения размером более 0,25 мм | Отсутствуют | Не нормируется | Не нормируется | |||
Сода кальцинированная — описание.
 Применение соды в промышленности и быту
Применение соды в промышленности и быту
Карбонат натрия Na2CO3 (другие названия — кальцинированная сода) — химическое соединение, натриевая соль угольной кислоты.
Не следует путать с гидрокарбонатом натрия (пищевой содой).
Не следует путать с каустической содой.
сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3(карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO310H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3(гидрокарбонат натрия) — пищевая сода, натрий двууглекислый (устар.), бикарбонат натрия
Название «сода» происходит от растения солянка содоносная (лат. Salsola soda) из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать, то есть нагревать до высокой температуры. В конце 1860-х годов два бельгийца, братья Эрнест и Альфред Сольве, осуществили аммиачный способ получения кальцинированной соды основан на реакции взаимодействия гидрокарбоната аммония с хлоридом натрия, в результате которой получаются хлорид аммония и гидрокарбонат натрия.
В конце 1860-х годов два бельгийца, братья Эрнест и Альфред Сольве, осуществили аммиачный способ получения кальцинированной соды основан на реакции взаимодействия гидрокарбоната аммония с хлоридом натрия, в результате которой получаются хлорид аммония и гидрокарбонат натрия.
Техническая кальцинированная сода производится в виде гранул или в виде порошка. Она быстро растворяется в воде, не отличается характерным запахом. Химическая формула кальцинированной соды Na2CO3. Это вещество имеет невысокую плотность 2,54 г/см³, может закипеть только при температуре 1600°C
Карбонат натрия используют в стекольном производстве;
мыловарении и производстве стиральных и чистящих порошков;
эмалей, для получения ультрамарина.
Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна.
Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах.
Может использоваться в сигаретных фильтрах.
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью
Также используется для приготовления фотографических проявителей как ускоряющее средство.
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1л масла.
В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
нахколит NaHCO3
трона Na2CO3•NaHCO3•2H2O
натрит (сода) Na2CO3•10H2O
термонатрит Na2CO3•Н2O.
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Сейчас стиральная кальцинированная сода используется не так часто, так как на смену ей пришли новые и современные фосфатные составы. Но этот вид соды способен легко удалить пятно от жира, вина, сока, или отбелить белье.
Хозяйственную кальцинированную соду современные хозяйки стали смешивать с простым мылом и водой. Каждого ингредиента необходимо взять по 100 грамм. Все ингредиенты необходимо смешать до однородной консистенции и подогреть на огне до полного растворения. Готовый гель экономные хозяйки используют в процессе стирки или мытья слишком грязной посуды.
Готовый гель экономные хозяйки используют в процессе стирки или мытья слишком грязной посуды.
Пищевую соду добавляют в составы хлебобулочных изделий, чтобы тесто лучше поднималось и имело более воздушную структуру.
Складские помещения, в которых будет храниться сода, должны иметь соответствующую вентиляционную систему, с невысокой влажностью воздуха. Перевозить данный химический продукт можно всеми видами транспорта.
Решение задачи 123
1. Na2CO3 – карбонат натрия, сода кальцинированная. Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2.
2. Пусть формула натрона Na2CO3*хН2О. Массовая доля воды в нем 0,63 (63 %). Составим уравнение 18х/(18х+106) = 0,63, решив которое получаем х = 10. Можно посчитать и по-другому. Содержание безводной соды в кристаллогидрате 100-63 = 37 %, что соответствует 106 а.е.м. Тогда 63 % соответствуют у а. е.м., откуда у = 106*63/37 »180. Отсюда х = 10. Таким образом, натрон — Na2CO3*10Н2О – декагидрат карбоната натрия, сода стиральная.
Если 63 % массы натрона отвечают 180 а.е.м. или 10 молекулам воды, то 31,5 % будет соответствовать 180*31,5/63 = 90 а.е.м. или 5 молекулам воды. То есть точный состав гидрата А — Na2CO3*5Н2О.
Для термонатрита с формулой Na2CO3*zН2О содержание натрия 37,1 %, что соответствует 2*23 = 46 а.е.м. Следовательно, молекулярная масса термонатрита (100 %) будет равна 46/0,371 »124, откуда z= 1. Можно посчитать и по уравнению 2*23/(106+18z) = 0,371. Итак, точный состав термонатрита — Na2CO3*Н2О.
3. Молярная масса безводной соды 106 г/моль, натрона – 286 г/моль. В расчете на натрон мировое потребление соды получится 33*286/106 = 89 млн. т. Основные отрасли промышленности, потребляющие соду: стекольная (48 %), химическая (24%), мыловаренная и производства чистящих средств (14%), целлюлозо-бумажная (4 %). На все остальные области применения в сумме расходуется не более 10 % соды.
На все остальные области применения в сумме расходуется не более 10 % соды.
4. В 300 г насыщенного при 25оС раствора содержится 29,5*3 = 88,5 г безводной соды. Натрон содержит такой соды 37 %, следовательно, его понадобится 88,5/0,37 = 239,2 г. Соответственно, воды надо будет взять 300-239,2 = 60,8 г.
Пусть х – масса натрона, выделяющегося при охлаждении этого раствора до 0 оС. Тогда 0,37 х – масса выделяющейся безводной соды. В растворе останется 88,5-0,37х безводной соды при массе раствора 300-х. Отношение этих величин в насыщенном при 0 оС растворе составляет 7/100. Решая уравнение (88,5-0,37х)/(300-х) = 0,07, получаем х = 225 г.
5. Итак, при охлаждении до 0 оС 300 г насыщенного при 25 оС раствора выделяется 225 г натрона. Следовательно, для получения 100 г натрона потребуется в 225/100 = 2,25 раза меньше раствора, т.е. 300/2,25 = 133,3 г. Масса безводной соды в нем составит 0,295*133,3 = 39,3 г. На 124 г термонатрита приходится 106 г безводной соды, следовательно, термонатрита нам понадобится 39,3*124/106 = 46,0 г. Воды, соответственно, надо будет взять 133,3-46,0 = 87,3 г.
Воды, соответственно, надо будет взять 133,3-46,0 = 87,3 г.
6 Сода питьевая (пищевая) – NaHCO3– гидрокарбонат натрия. Сода каустическая – NaOH– гидроксид натрия.
АО «АльфаХимПром» » Кальцинированная сода
Синонимы, торговые названия:
Натрия карбонат, натриевая соль угольной кислоты, динатрий триоксокарбонат, углекислый натрий
Нормативная документация.
ГОСТ 5100-85
Химическая формула.
Na2CO3
Внешний вид.
Гранулы или порошок белого цвета.
Спецификации.
|
Норма для марки и сорта |
||||||
|
Марка А |
Марка Б |
|||||
|
Наименование показателя |
Высший сорт |
Первый сорт |
Второй сорт |
Высший сорт |
Первый сорт |
Второй сорт |
|
1. |
Гранулы белого цвета |
Порошок белого цвета |
||||
|
2. Массовая доля углекислого натрия (Na2СОз), %, не менее |
99,4 |
99,0 |
98,5 |
99,4 |
99,0 |
99,0 |
|
3. Массовая доля углекислого натрия (Na2C03) в пересчете на непрокаленный продукт, %, не менее |
98,7 |
98,2 |
97,0 |
98,9 |
98,2 |
97,5 |
|
4. Массовая доля потери при прокаливании (при 270-300) °С, %, не более |
0,7 |
0,8 |
1,5 |
0,5 |
0,8 |
1,5 |
|
5. |
0,2 |
0,5 |
0,8 |
0,4 |
0,5 |
0,8 |
|
6. Массовая доля железа в пересчете на Fе2Oз, %, не более |
0,003 |
0,005 |
0,008 |
0,003 |
0,003 |
0,008 |
|
Массовая доля веществ, нерастворимых в воде, %, не более |
0,04 |
0,04 |
0,08 |
0,03 |
0,04 |
0,08 |
|
Массовая доля сульфатов в пересчете на Na2SO4, %, не более |
0,04 |
0,05 |
Не нормируется |
0,04 |
0,05 |
Не нормируется |
|
Насыпная плотность, г/см, не менее |
1,1 |
0,9 |
0,9 |
Не нормируется |
||
|
Гранулометрический состав: |
||||||
|
Остаток на сите с сеткой № 2К по ГОСТ 6613, %, не более |
Не нормируется |
5 |
5 |
Не нормируется |
||
|
Прохождение через сито с сеткой № 1, 25К по ГОСТ 6613, % |
100 |
Не нормируется |
Не нормируется |
|||
|
Остаток на сите с сеткой № 1К по ГОСТ 6613, %, не более |
3 |
То же |
Не нормируется |
|||
|
Прохождение через сито с сеткой № 01К по ГОСТ 6613, %, не более |
7 |
15 |
25 |
Не нормируется |
||
|
Магнитные включения размером более 0,25 мм |
Отсутствуют |
Не нормируется |
Не нормируется |
|||
Примечания:
- Нормы по показателям 2, 5-8 таблицы даны в пересчете на прокаленное вещество.

- Для производства электровакуумного стекла предназначена техническая кальцинированная сода марки А высшего сорта.
- В технической кальцинированной соде, предназначенной для производства нитрита натрия, используемого для изготовления капролактама, а также производства сульфидных солей, отбеливателей и для обезжиривания деталей в электровакуумной промышленности, массовая доля масел не должна превышать 0,01 %.
- Массовые доли углекислого натрия в непрокаленном продукте и потери при прокаливании технической кальцинированной соды марок А высшего сорта, предназначенного для производства синтетических моющих средств, 1-го и 2-го сортов и Б нормируют на момент отгрузки.
- В кальцинированной соде марки А высшего сорта, предназначенной для производства синтетических моющих средств (CMC) не нормируют массовую долю остатка на сите с сеткой № 01К по ГОСТ 6613.
- По согласованию с потребителем допускается выпуск кальцинированной соды марки Б с нормами по показателям массовая доля углекислого натрия (Na2СО3) -не менее 97 %, массовая доля углекислого натрия в непрокаленном продукте — не менее 94 %, массовая доля потери при прокаливании при 270-300 °С — не более 3, массовая доля хлоридов в пересчете на NaCl — не более 1,5 %, массовая доля железа в пересчете на Fe2О3 — не более 0,03 %.

Применение.
- Широко используется при мыловарении, производстве стиральных и чистящих порошков
- Кальцинированная сода – необходимый ингредиент в составе лако-красочных материалов, в частности эмалей
- Также он применяется для смягчения воды паровых котлов, и вообще уменьшения жёсткости воды;
- Используется для обезжиривания металлов и десульфатизации доменного чугуна;
- Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4 ,NaNO3;
- Может использоваться в сигаретных фильтрах;
- Для приготовления проявителя фотоматериалов;
- В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500.
Кальцинированная сода марки «А» используется в основном для производства электровакуумного стекла.
Кальцинированная сода марки «Б» используется в химической, стекольной и других областях промышленности.
Тара, транспортировка и хранение.
Кальцинированная сода транспортируется в мешках вместимостью 25 кг в соответствии с правилами перевозок, действующими на соответствующем виде транспорта.
Забрать продукт Вы можете самостоятельно либо заказать доставку до Вашего склада/объекта.Бикарбонат натрия
Бикарбонат натрия (сода пищевая, натрий двууглекислый, натрия гидрокарбонат) – кристаллический порошок белого цвета, без запаха. Химическая формула – NaHCO3.
Бикарбонат натрия имеет широкий спектр применения. Больше всего бикарбонат натрия используется в пищевой, химической, медицинской, фармацевтической, легкой промышленностях и при производстве комбикормов.
В пищевой промышленности – в хлебопечении, производстве кондитерских изделий, приготовлении напитков.
В химической промышленности – для производства красителей, пенопластов и других органических продуктов, фтористых реактивов, товаров бытовой химии, наполнителей в огнетушителях.
В легкой промышленности – в производстве подошвенных резин и искусственных кож, кожевенном производстве (дубление и нейтрализация кож), текстильной промышленности (отделка шелковых и хлопчатобумажных тканей).
В медицинской и фармацевтической промышленности – в производстве лекарственных средств, биологически активных добавок (БАД), гемодиализе.
При этом около 50 % бикарбоната натрия идет на бытовое потребление: в качестве разрыхлителя теста для домашней выпечки и при изготовлении кондитерских изделий, как чистящее средство, в медицинских целях (отхаркивающее средство, средство от изжоги) и во многих других целях.
Более подробную информацию о бытовых способах применения бикарбоната натрия (пищевой соды) можно узнать на сайте www.sodainfo.ru .
Бикарбонат натрия упаковывается в полиэтиленовые мешки массой 25 кг, специализированные контейнеры разового использования типа МКР (4-х стропные) с массой 1000 и 1200 кг.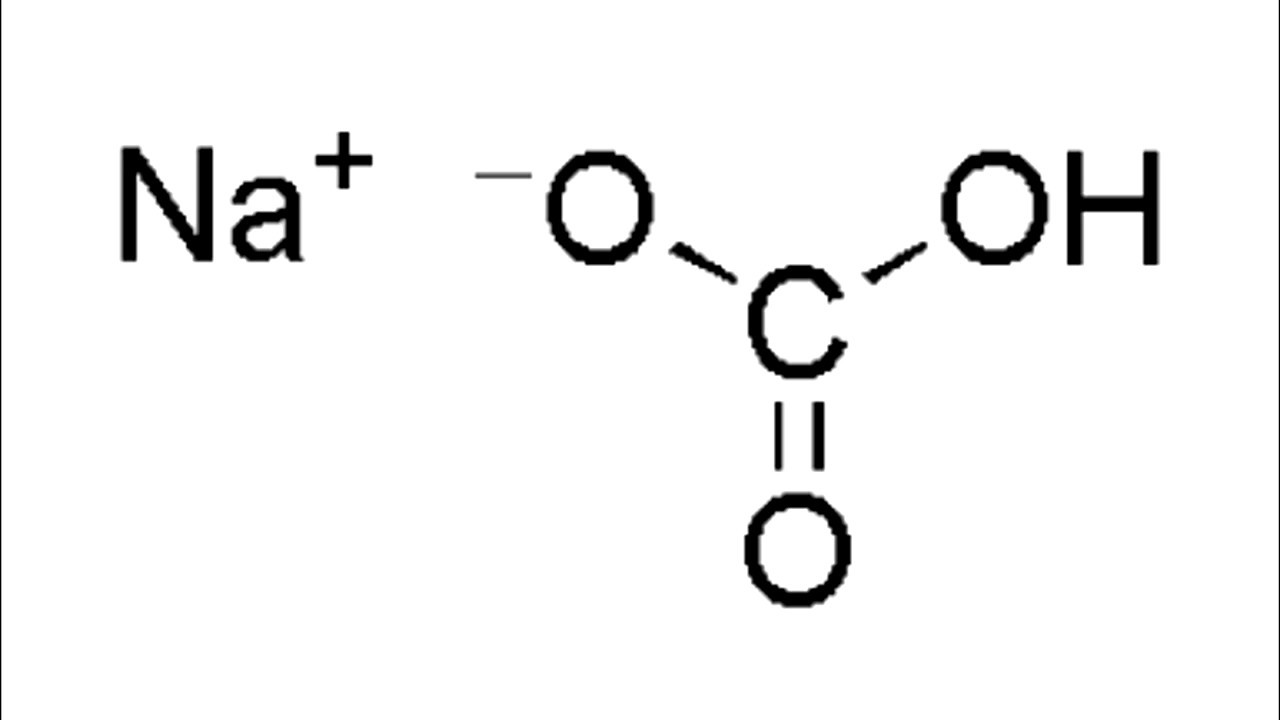 Продукт, предназначенный для розничной торговли, упаковывается в потребительскую тару – картонные пачки массой 500 г.
Продукт, предназначенный для розничной торговли, упаковывается в потребительскую тару – картонные пачки массой 500 г.
Транспортировка бикарбоната натрия осуществляется всеми видами транспорта (кроме авиации) в крытых транспортных средствах в соответствии с «Правилами перевозки грузов», действующими на транспорте данного вида.
Безопасность продукции подтверждена «Паспортом безопасности» и Свидетельством о государственной регистрации бикарбоната натрия как пищевой добавки Е-500.
Бикарбонат натрия зарегистрирован в соответствии с требованиями регламента ЕС REACH, номер регистрации 01-2119457606-32-0019.
Превратите пищевую соду в стиральную соду
Это простые инструкции по приготовлению карбоната натрия, также известного как стиральная сода или кальцинированная сода, из пищевой соды или бикарбоната натрия.
Сделайте карбонат натрия
Бикарбонат натрия — это CHNaO 3, , а карбонат натрия — Na 2 CO 3 . Просто нагрейте пищевую соду или бикарбонат натрия в духовке с температурой 200 ° F примерно в течение часа. Выделяются углекислый газ и вода, оставляя сухой карбонат натрия.Это кальцинированная сода.
Просто нагрейте пищевую соду или бикарбонат натрия в духовке с температурой 200 ° F примерно в течение часа. Выделяются углекислый газ и вода, оставляя сухой карбонат натрия.Это кальцинированная сода.
Химическая реакция процесса:
2 NaHCO 3 (с) → Na 2 CO 3 (с) + CO 2 (г) + H 2 O (г)
Соединение легко впитывает воду, образуя гидрат (возвращаясь в пищевую соду). Вы можете хранить сухой карбонат натрия в закрытом контейнере или с осушителем, чтобы он оставался сухим, или вы можете позволить ему образовать гидрат, если хотите.
Хотя карбонат натрия довольно стабилен, он медленно разлагается в сухом воздухе с образованием оксида натрия и диоксида углерода.Реакцию разложения можно ускорить, нагревая промывочную соду до 851 ° C (1124 K).
Ключевые выводы: пищевая и стиральная сода
- Бикарбонат натрия (пищевая сода) и карбонат натрия (сода для стирки) имеют похожие молекулы.
 Разница в том, сколько воды входит в молекулу.
Разница в том, сколько воды входит в молекулу. - Если выпекать пищевую соду, она разлагается с образованием стиральной соды с выделением углекислого газа и воды.
- Со временем стиральная сода разлагается с образованием оксида натрия с выделением диоксида углерода.Более теплые условия ускоряют процесс разложения.
Использование для стирки соды
Стиральная сода — хорошее универсальное чистящее средство. Его высокая щелочность помогает удалять жир, смягчать воду и дезинфицировать поверхности. Имейте в виду, что раствор карбоната натрия раздражает кожу и может вызвать химические ожоги в чистом виде. При использовании надевайте перчатки.
Карбонат натрия используется для регулирования pH в бассейне, предотвращения слеживания в продуктах, а также для лечения стригущего лишая и экземы. Он также используется в промышленных масштабах для изготовления изделий из стекла и бумаги.
Для чего используется карбонат натрия или кальцинированная сода?
Карбонат натрия, широко известный как кальцинированная сода в безводной форме, представляет собой натриевую соль угольной кислоты с химической формулой Na 2 CO 3 . Он естественным образом встречается в засушливых регионах и часто добывается из залежей троновой руды. Вайоминг является крупнейшим внутренним источником, где разрабатываются большие природные месторождения троны. Карбонат натрия может встречаться в природе в золе некоторых растений, а также может быть получен синтетическим путем из хлорида натрия и известняка с помощью хорошо известного процесса Сольвея.Карбонат натрия — это стабильный, нетоксичный белый порошок без запаха, который впитывает влагу и образует сильный щелочной водный раствор. Моногидрат карбоната натрия (Na 2 CO 3 H 2 O) имеет добавленную молекулу воды и часто используется в качестве буфера.
Две тысячи лет назад римляне использовали кальцинированную соду для изготовления хлеба, стекла и других продуктов. Сегодня и пищевая сода, и разрыхлитель производятся из кальцинированной соды, поэтому у большинства американцев на кухнях есть продукт, полученный из троны штата Вайоминг. Кальцинированная сода имеет несколько других разнообразных применений, которые ежедневно влияют на нашу жизнь. Производство стекла — это самая большая область применения, при производстве стеклянной тары, стекловолоконной изоляции и листового стекла с использованием кальцинированной соды. Производители химической продукции используют кальцинированную соду в качестве сырья при производстве пищевых подсластителей и консервантов. В фармацевтике карбонат натрия иногда используется как часть кислотно-основных химических реакций. Он также используется в качестве абразива в некоторых зубных пастах и в качестве смягчителя воды в мыле для посудомоечных машин и других бытовых моющих средствах.
Кальцинированная сода имеет несколько других разнообразных применений, которые ежедневно влияют на нашу жизнь. Производство стекла — это самая большая область применения, при производстве стеклянной тары, стекловолоконной изоляции и листового стекла с использованием кальцинированной соды. Производители химической продукции используют кальцинированную соду в качестве сырья при производстве пищевых подсластителей и консервантов. В фармацевтике карбонат натрия иногда используется как часть кислотно-основных химических реакций. Он также используется в качестве абразива в некоторых зубных пастах и в качестве смягчителя воды в мыле для посудомоечных машин и других бытовых моющих средствах.
Сода кальцинированная выпускается трех марок:
- Легкая кальцинированная сода, широко используемая в качестве буферного агента / регулятора кислотности.
- Средняя кальцинированная сода, которая широко используется в мыле и моющих средствах.
- Плотная кальцинированная сода, которая используется в промышленности и производстве.

Карбонат натрия также применяется для защиты окружающей среды. Его можно использовать для обработки и повышения щелочности озер, пострадавших от кислотных дождей.А поскольку она вступает в реакцию с диоксидом серы и соляной кислотой, кальцинированная сода может помочь очистить воздух, выходящий из химических труб и выхлопных труб электростанций, за счет образования менее вредных соединений. В сельском хозяйстве кальцинированная сода используется как натуральное удобрение.
Independent Chemical предлагает кальцинированную соду (CAS 497-19-8) и моногидрат карбоната натрия (CAS 497-19-3), а также многие другие товарные и специальные химические ингредиенты. Свяжитесь с нами, чтобы запросить ценовое предложение.
Все, что вам нужно знать о карбонате натрия
Карбонат натрия — это сильная щелочная основа, используемая в экологически чистых чистящих средствах.Часто встречается в форме порошка, он используется в самых разных отраслях промышленности, таких как чистящие средства и средства личной гигиены, а также в качестве фунгицида, микробицида, гербицида и регулятора pH.
Что такое карбонат натрия?
Карбонат натрия — химическое соединение с молекулярной формулой Na2CO3. Его обычно называют стиральной содами, и он используется в чистящих средствах, производстве стекла, в качестве пищевой добавки и т. Д.
Синонимов
Карбонат натрия может иметь следующие названия:
- Сода стиральная
- Сода кальцинированная
- Карбонат динатрия
- Сода кальцинированная
- Динатриевая соль угольной кислоты
- Сода Сольвей
- 497-19-8
Недвижимость
Карбонат натрия — это щелочь с высоким pH в концентрированных растворах.Когда его добавляют в воду, он распадается на угольную кислоту и гидроксид натрия (щелок).
Использование для очистки
Карбонат натрия используется в нескольких чистящих средствах, в том числе в экологически чистых, благодаря своим дезинфицирующим свойствам и способности рассасывать жир и смягчать воду. Вы можете найти его в средствах для стирки, средствах для мытья посуды, универсальных чистящих средствах, средствах для чистки стекла, пятновыводителях, средствах для чистки столешниц, дезинфицирующих спреях и отбеливателях.
Вы можете найти его в средствах для стирки, средствах для мытья посуды, универсальных чистящих средствах, средствах для чистки стекла, пятновыводителях, средствах для чистки столешниц, дезинфицирующих спреях и отбеливателях.
Для очистки и дезинфекции карбонатом натрия Агентство по охране окружающей среды (EPA) рекомендует использовать 2 унции на галлон воды.Этот раствор можно использовать для очистки твердых непористых поверхностей, таких как полы, стены, ванны, кафель и раствор.
Согласно EPA, карбонат натрия считается раздражителем при концентрациях ниже 15 процентов и едким веществом выше 15 процентов, поэтому помните об этом при смешивании с ним чистящих растворов. Надевайте чистящие перчатки и избегайте попадания его в глаза или рот.
Другое применение
Помимо использования в чистящих средствах, карбонат натрия используется в:
- Химическое производство
- Еда (e.г., антислеживающий агент)
- Производство стекла
- Средства личной гигиены (например, пена для ванн, зубная паста, соли для ванн и средства для замачивания, а также скрабы)
- Целлюлозно-бумажная продукция
- Обслуживание бассейна (для регулировки pH)
- Лечебные процедуры (например, для лечения дерматитов)
- Ветеринарные препараты (например, для лечения стригущего лишая, очищения кожи и лечения экземы)
Бренды продуктов, содержащие карбонат натрия
Чтобы узнать, содержат ли определенные продукты карбонат натрия, попробуйте выполнить поиск по U. S. База данных по товарам для дома Министерства здравоохранения и социальных служб, Руководство по здоровой очистке Рабочей группы по окружающей среде (EWG), Good Guide или База данных по глубокой косметике кожи EWG. Если использование общего термина «карбонат натрия» не дает особых результатов, попробуйте ввести один из его синонимов.
S. База данных по товарам для дома Министерства здравоохранения и социальных служб, Руководство по здоровой очистке Рабочей группы по окружающей среде (EWG), Good Guide или База данных по глубокой косметике кожи EWG. Если использование общего термина «карбонат натрия» не дает особых результатов, попробуйте ввести один из его синонимов.
Постановление
Когда карбонат натрия используется в продуктах личной гигиены, пищевых продуктах или лекарствах, он контролируется Управлением по контролю за продуктами и лекарствами США (FDA). Для других целей, таких как пестициды и чистящие средства, он контролируется EPA.
Здоровье и безопасность
EPA считает карбонат натрия безопасным пестицидом, а FDA считает его безопасным (GRAS). В «Решении о перерегистрации (RED) для карбоната натрия; слабые минеральные основы» от 2006 года EPA отмечает, что при использовании карбоната натрия в соответствии с руководящими принципами EPA и FDA GRAS не существует известных опасностей для здоровья человека, и что «никакой дополнительной информации не требуется. «оценить его безопасность.
«оценить его безопасность.
После того, как вы немедленно обратитесь за медицинской помощью, вот несколько рекомендаций по оказанию первой помощи на дому:
- Проглатывание: Попросите человека выпить стакан воды или молока, если иное не рекомендовано врачом.Однако не давайте им пить, если у них наблюдаются какие-либо серьезные симптомы, такие как рвота, судороги или сонливость, и им трудно глотать. Не вызывайте рвоту у человека, если об этом не сказал врач или токсикологический центр.
- Попадание в глаза или на кожу: Промыть большим количеством воды не менее 15 минут.
- Вдыхание: Вывести человека на свежий воздух.
Воздействие на окружающую среду
По данным Р.В документе E.D. EPA считает карбонат натрия естественным химическим веществом, обнаруживаемым в почве и воде, и не ожидает каких-либо неблагоприятных воздействий на дикую природу или воду при попадании небольших количеств в окружающую среду. Поэтому его можно было считать зеленым.
Поэтому его можно было считать зеленым.
Источник
Большая часть мировых запасов карбоната натрия приходится на переработку троновой руды, которая добывается на юго-западе Вайоминга.
Производство карбоната натрия
Интересно, что вы также можете сделать карбонат натрия из пищевой соды, запекая ее в духовке.
Формула карбоната натрия — использование, свойства, структура и формула карбоната натрия
Формула и структура: Химическая структура карбоната натрия — Na 2 CO 3 , а его молярная масса составляет 106,0 г / моль. Карбонат натрия представляет собой ионное соединение — натриевую соль угольной кислоты и состоит из двух катионов натрия (Na + ) и карбонатного аниона (CO 3 — ). Имеет кристаллическую структуру гептагидрата.
Происхождение: Карбонат натрия в природе встречается в минеральной форме в виде его гидратных солей (таких как трона, натрон, натрит и т. Д.)). Несколько его месторождений полезных ископаемых находятся в засушливых регионах по всему миру.
Д.)). Несколько его месторождений полезных ископаемых находятся в засушливых регионах по всему миру.
Получение: Карбонат натрия коммерчески получают двумя разными способами. Первый метод предполагает разработку месторождений карбоната натрия, который является основным методом добычи в США. Во втором методе, называемом процессом Сольвея, хлорид натрия реагирует с аммиаком с образованием бикарбоната натрия, который затем нагревают до карбоната натрия.
Физические свойства: Карбонат натрия представляет собой белый кристаллический порошок плотностью 2.54 г / мл и точка плавления 851 ° C.
Химические свойства: Карбонат натрия — стабильное, но гигроскопичное твердое вещество (поглощает воду из воздуха) и легко растворяется в воде с образованием слабокислой угольной кислоты и сильного основания, гидроксида натрия. Таким образом, водный раствор Na 2 CO 3 в целом является сильным основанием. Он бурно реагирует со многими кислотами. При нагревании до высоких температур он разлагается с выделением токсичных паров оксида динатрия (Na 2 O).
Области применения: Карбонат натрия в основном используется в качестве смягчителя воды, добавки для обработки пищевых продуктов, модификатора pH, химикатов для плавательных бассейнов и электролитов.Он также используется при производстве стекла, бумаги, мыла и моющих средств, а также многих других полезных химикатов.
Воздействие на здоровье / опасность для здоровья: Растворы карбоната натрия сильно щелочны и вызывают коррозию. При контакте с ним он может вызвать сильное раздражение кожи и глаз. Вдыхание пыли или паров карбоната натрия может вызвать раздражение слизистых оболочек и дыхательных путей, а также вызвать сильный кашель и одышку. Высокие концентрации могут повредить глаза и вызвать ожоги кожи.
Кальцинированная сода WTM
Кальцинированная сода
Кальцинированная сода
Химическое название кальцинированной соды — карбонат натрия, химическая формула Na2CO3. Он более основной, то есть менее кислый, чем бикарбонат натрия (пищевая сода), химическая формула которого — NaHCO3. Карбонат натрия предназначен для увеличения pH.
Карбонат натрия предназначен для увеличения pH.
Его используют в водоподготовке для увеличения pH кислой воды. Уловка в том, как это сделать и сколько использовать.Ниже приведены некоторые предложения и комментарии из различных источников.
Смешивание кальцинированной соды с водой и подача ее с помощью насоса для повышения pH — это процедура проб и ошибок. Лучше всего начать с небольшого количества смеси, чтобы вы могли вносить изменения по мере необходимости.
Приведенные ниже суммы являются предложением одного источника:
Смешайте 2 фунта кальцинированной соды с 5 галлонами воды. Установите помпу на 50% или 60% производительности. Дайте устройству поработать некоторое время и используйте воду, как обычно, затем проверьте pH в нескольких футах ниже по потоку от точки впрыска.Если pH не такой, какой вы хотите, внесите изменения.
Регулировку можно произвести добавлением кальцинированной соды, добавлением воды или регулировкой насоса вверх или вниз. Продолжайте регулировать, пока не получите именно тот уровень pH, который вам нужен.
Продолжайте регулировать, пока не получите именно тот уровень pH, который вам нужен.
Обязательно ведите записи и помните, что если раствор станет слишком сильным, вам, возможно, придется вылить смесь и начать все сначала.
Если вы не можете достичь желаемого уровня pH, возможно, вам придется перейти на каустическую соду.
Каустическая сода примерно на 30% сильнее, чем кальцинированная сода.Десять фунтов кальцинированной соды в 20 галлонах воды равны примерно 7,5 фунтам. каустической соды на десять галлонов воды.
Каустическая сода доступна в магазинах товаров для бассейнов. Его сложнее использовать, чем кальцинированную соду, поэтому будьте осторожны.
Вот несколько полезных фактов об инъекции кальцинированной соды:
1. 0,926 фунта. кальцинированной соды, смешанной с одним галлоном воды, получается 10% раствор кальцинированной соды.
2. 10% раствор кальцинированной соды составляет 100 000 частей на миллион кальцинированной соды.
3. Обычно вводят от 50 до 500 ppm кальцинированной соды для повышения pH колодезной воды. Количество, которое вы вводите, зависит от того, насколько вам нужно поднять pH. Это процесс, который обычно включает в себя метод проб и ошибок.
Подробнее о кальцинированной соде из разных источников:
Необходимое количество кальцинированной соды фактически определяется количеством CO2 в обрабатываемой воде, и, поскольку это редко известно, метод проб и ошибок является нормальной процедурой.
Согласно публикации WQA, «на каждую миллионную долю углекислого газа в воде необходимо 2,5 миллионной доли кальцинированной соды для нейтрализации. Если бы использовалась каустическая сода, потребовалось бы всего 0,85 ppm для нейтрализации 1,0 ppm CO2 ».
«Часто используется начальная доза раствора — четыре унции [кальцинированной соды] на галлон воды».
«[Если требуется дезинфекция], можно одновременно подавать смесь гипохлорита / кальцинированной соды для двойной обработки».
Заявление производителя кальцинированной соды о растворимости:
Кальцинированная сода легко растворяется в воде с образованием прозрачного раствора, однако она демонстрирует необычную характеристику, заключающуюся в том, что максимальная растворимость достигается при низкой температуре 97ºF.В этот момент насыщенный раствор содержит 33,2% Na2CO3 по весу. 10% -ный по весу раствор кальцинированной соды насыщен при 49ºF. Рекомендуется хранить 30% -ный раствор кальцинированной соды при температуре 120 ° F.
Определение содержания карбоната в образце кальцинированной соды
Приготовление и стандартизация 0,10 М HCl
Высушить около 2.0 г первичного стандарта, безводного Na 2 CO 3 , во взвешивающем сосуде в течение 2 часов при 105-110 ° C, затем охладите и храните в эксикаторе.
Ополосните стеклянную бутылку емкостью 1 литр дистиллированной водой. Добавьте дистиллированную воду как раз до начала плавного изгиба в верхней части, оставив немного воздуха между поверхностью воды и горлышком. Используя соответствующий мерный цилиндр, отмерьте и добавьте 17 мл 6M HCl. Затем добавьте немного воды в мерный цилиндр, аккуратно перемешайте и добавьте смесь в бутылку.Закройте бутылку пробкой и несколько раз переверните до получения однородной смеси. Одна кварта — это 946 мл, почти один литр. Семнадцать мл 6M кислоты при разбавлении 946 мл воды дают раствор, почти равный концентрации 0,1M:
\ [\ dfrac {17 \, mL} {946 \, mL + 17 \, mL} \ times 6 \, M = 0.11 \, M \]
Этот раствор должен быть стандартизирован с использованием безводного Na 2 CO 3 , поэтому нет необходимости следить за аналитической точностью в этой процедуре. Концентрация коммерческой HCl не определяется с точностью более ± 0.2 M (его обычно определяют при 36,5-38,0%, близком к 12 M), поэтому даже если 17 мл были измерены с точностью ± 0,001 мл, молярность все равно не могла быть определена с точностью, достаточной для этого эксперимента. Для достижения необходимой точности раствор должен быть стандартизирован с измеренными образцами безводного карбоната натрия.
Точно взвесьте три образца сухого безводного Na 2 CO 3 весом 0,20–0,25 г непосредственно в отдельные чистые и сухие колбы Эрленмейера на 250 мл.Добавьте 50 мл дистиллированной воды для растворения карбоната, затем накройте колбы парафильмом. Промойте чистую бюретку объемом 50 мл небольшими порциями раствора HCl, а затем наполните ее раствором кислоты. Запишите начальное показание (, а не должно быть точно 0,00 мл) с точностью до сотых долей мл. Безводный карбонат натрия поглощает воду и углекислый газ из атмосферы, поэтому ваши образцы, вероятно, будут медленно увеличиваться в весе. Нет ничего необычного в том, чтобы наблюдать увеличение на 0.0001 г каждые 5-10 секунд. Вы не должны усердно пытаться сделать массу равной 0,2000 г или 0,2500 г или какому-либо другому конкретному числу, иначе постепенное увеличение массы приведет к значительной систематической ошибке в ваших результатах. Переносите реагент до тех пор, пока наблюдаемая масса не станет между 0,2 и 0,25 г, закройте дверцы весов, снимите показания, когда масса стабилизируется до ± 0,0001 г, и закончите. Еще одно предупреждение: кристаллы безводного карбоната натрия не слипаются на вашем плоском шпателе.Они имеют тенденцию выпадать, поэтому во время переноса не пытайтесь сделать большие холмики реагента на кончике шпателя, иначе вы потеряете некоторые. Места, где вы не хотите потерять, — это вниз по стенке колбы, на краю колбы или на противне за пределами колбы. Вы хотите, чтобы все это попало в горловину колбы.
Описанное ниже титрование включает переход от синего к зеленому цвету. Некоторым людям нелегко заметить тонкость этого изменения. Сине-зеленая цветовая слепота распространена среди нашего населения, и есть много людей, которые не знают, что у них есть легкие нарушения.Чтобы быть уверенным, что вы можете определить воспроизводимую конечную точку, приготовьте 100 мл 0,05 М NaCl в колбе Эрленмейера на 250 мл, разбавив 5 мл 1,00 М NaCl до 100 мл дистиллированной водой. Добавьте 3 капли индикатора бромкрезолового зеленого и 3 капли индикатора фенолфталеина, прокипятите, охладите и титруйте до конечной точки, когда зеленый цвет просто изменится на желто-зеленый. Будьте осторожны, так как требуемый объем будет довольно небольшим, возможно, всего одна капля. Этот объем называется «коррекцией индикатора», «коррекцией холостого опыта» или «ошибкой титрования»; его следует вычесть из других объемов титрования (поскольку объем — это объем, необходимый для достижения конечной точки для образца, содержащего № Na 2 CO 3 ).
Сохраните это титрование как ориентир для воспроизводимости всех будущих титрований. Он дает вам эталонный цвет для вашей конечной точки. Приведение всех последующих титрований к этому окончательному цвету и последующее вычитание поправки индикатора из ваших окончательных объемов должно улучшить ваши результаты. В конце каждого лабораторного периода выбросьте титрование коррекции индикатора и сделайте новое в начале следующего лабораторного периода.
Добавьте 3 капли фенолфталеинового индикатора к одной пробе карбоната и титруйте ее кислотой, как описано выше в разделе обсуждения.Поместите кусок белой бумаги под колбу, которую нужно титровать, чтобы вы могли легко увидеть любые тонкие изменения цвета. В первой точке эквивалентности цвет будет блекнуть довольно медленно, поэтому не ожидайте внезапного изменения цвета с розового на бесцветный. Используйте свое здравое суждение. Фенолфталеин бесцветен в кислых растворах и ярко-розовый в щелочных растворах. Первая точка эквивалентности CO 3 2- достигается, когда раствор изменился с розового почти на бесцветный, но в нем все еще остался призрачный оттенок розового.После первой точки эквивалентности добавить 3 капли индикатора бромкрезолового зеленого; раствор станет синим. Титруйте HCl до тех пор, пока раствор не начнет менять цвет с синего на зеленый. Если он станет желтым, значит, вы зашли слишком далеко. Ваш раствор должен быть отброшен, и вы должны начать заново со вторым образцом. Новый «первый» образец можно повторно взвесить после успешного завершения двух последних. Добавьте кислоту, постоянно взбалтывая колбу. Когда синий цвет начинает переходить в зеленый, нагрейте раствор до кипения на горячей плите, чтобы удалить CO 2 , образовавшийся во время титрования.Охладите до комнатной температуры на ледяной бане. Раствор снова должен быть зеленым, возможно даже синим. Завершите титрование, добавляя по каплям кислоту до тех пор, пока цвет раствора не изменится на цвет ранее приготовленного холостого опыта. Запишите показания бюретки и рассчитайте общее количество кислоты, использованной от начала титрования до конечной точки бромкрезоловой зелени после кипячения. Скорректируйте объем использованной кислоты с помощью калибровочного графика бюретки, подготовленного ранее, и вычтите погрешность конечной точки или коррекцию холостого хода.Теперь повторите ту же процедуру с двумя другими образцами по очереди. Из объема кислоты и массы Na 2 CO 3 рассчитывают молярность раствора HCl. Среднее отклонение от средней молярности не должно превышать 0,2% от среднего.
Титрование образца кальцинированной соды
Высушите неизвестный образец в духовке в течение 1 часа при 110 ° C и охладите в эксикаторе. Используя бутыль для взвешивания, точно взвесьте 2,5 г с точностью ± 0,0001 г.Используя промывочную бутыль, добавьте небольшое количество дистиллированной воды в дозировочную бутыль, а затем перенесите растворенный материал в чистую мерную колбу на 250 мл, используя широкую воронку и промывку водой. Добавьте в мерную колбу дополнительную дистиллированную воду и доведите до калибровочной отметки. Добавляя воду, обязательно тщательно перемешайте содержимое колбы, взбалтывая ее. Однако не переворачивайте колбу на этом этапе. Только после заполнения до отметки его можно инвертировать. При заполнении до калибровочной отметки используйте пипетку, чтобы добавить последние несколько капель.Следующим шагом будет использование мерной пипетки на 25 мл. Щелкните здесь, чтобы получить полезные советы по использованию мерной пипетки. При использовании резиновой груши для втягивания жидкости в пипетку не давите грушей на конец пипетки. При необходимости обратитесь за помощью к своему инструктору. Как только вы почувствуете, что умеете пользоваться пипетками, используйте пипетку на 25 мл для переноса трех аликвот по 50 мл неизвестного раствора в три отдельные колбы Эрленмейера на 250 мл. Использовать пипетку на 25 мл для измерения этих аликвот значительно проще, чем использовать пипетку на 50 мл, с которой из-за своего размера трудно обращаться.Титрируйте каждый образец по одному, как в процедуре стандартизации кислоты.
Карбонат натрия | Encyclopedia.com
Производство карбоната натрия
Свойства карбоната натрия
Использование карбоната натрия
Ресурсы
Карбонат натрия, также известный как стиральная сода, представляет собой натриевую соль кабоновой кислоты, химическое соединение которой соответствует общая формула: Na 2 CO 3 .
Его обычно называют кальцинированной содой, потому что он был первоначально получен из золы сожженных морских водорослей.Уже более ста лет кальцинированная сода производится в основном методом, известным как процесс Сольвея (также называемый аммиачно-содовым процессом). В настоящее время это один из ведущих промышленных химикатов по объему производства в Соединенных Штатах. Он в основном используется в производстве стекла, но также используется в производстве других продуктов и является важным предшественником многих соединений натрия, используемых в промышленности.
Процесс получения карбоната натрия со временем значительно изменился.Первоначально его производили горящие водоросли, которые были богаты натрием. Когда сорняки сжигались, в золе оставался натрий в виде карбоната натрия. Хотя этот процесс был эффективным, его нельзя было использовать для производства больших объемов. Карбонат натрия использовался в различных формах с древних времен. В Древнем Египте, например, добывали натрон, который представляет собой минерал карбоната натрия и бикарбоната натрия, чтобы его можно было использовать для изготовления стекла и в качестве ингредиента для мумификации мертвых тел.
Первым процессом, который позволил производить значительные количества карбоната натрия, был синтетический процесс, известный как процесс Леблана, разработанный французским химиком Николя Лебланом (1742–1806). В этом процессе соль (хлорид натрия) реагировала с серной кислотой с образованием сульфата натрия и соляной кислоты. Сульфат натрия нагревали в присутствии известняка и угля, и полученная смесь содержала сульфат кальция и карбонат натрия, которые затем экстрагировали.
Две существенные проблемы с процессом LeBlanc, высокая стоимость и значительное загрязнение, вдохновили бельгийского инженера-химика Эрнеста Сольвея (1838–1922) на разработку более совершенного процесса создания карбоната натрия. В процессе Solvay аммиак и диоксид углерода используются для производства карбоната натрия из соли и известняка. Первоначально аммиак и диоксид углерода реагируют с водой с образованием гидроксида аммония и угольной кислоты со слабыми электролитами. Эти ионы вступают в дальнейшую реакцию и образуют бикарбонат натрия.Поскольку бикарбонат почти не растворяется в воде, он отделяется от раствора. На этом этапе бикарбонат натрия фильтруется и превращается в карбонат натрия при нагревании.
Синтетическое производство — не единственный способ получения карбоната натрия. Значительное количество добывается непосредственно из природных источников. Крупнейшие природные источники карбоната натрия в Соединенных Штатах находятся в районе Грин-Ривер, штат Вайоминг, и в высохшем озере Сирлс в пустыне Мохаве в Калифорнии.
При комнатной температуре карбонат натрия (Na 2 CO 3 ) представляет собой гигроскопичный серовато-белый порошок без запаха. Это свойство означает, что при контакте с воздухом он может самопроизвольно поглощать молекулы воды. Еще одно известное соединение, обладающее такими гигроскопичными свойствами, — это сахар. Карбонат натрия имеет точку плавления 1564 ° F (851 ° C), плотность 2,53 г / см 3 и растворим в воде. Водный раствор кальцинированной соды имеет щелочной pH и сильный щелочной вкус.Когда его помещают в слабокислый раствор, он разлагается и образует пузырьки. Этот эффект, называемый вспениванием, обнаруживается во многих коммерческих антацидных продуктах, в которых в качестве активного ингредиента используется карбонат натрия.
Безводный (без воды) карбонат натрия может абсорбировать различное количество воды и образовывать гидраты с немного разными характеристиками. Когда одна молекула воды на молекулу карбоната натрия абсорбируется, образующееся вещество, моногидрат карбоната натрия, представляется химической формулой Na 2 CO 3 • H 2 O.Этот состав имеет немного меньшую плотность, чем безводный вариант. Другой распространенный гидрат образуется в результате поглощения десяти молекул воды на молекулу карбоната натрия. Это соединение, Na 2 CO 3 • 10H 2 O, известное как декагидрат карбоната натрия, существует в виде прозрачных кристаллов, которые легко вскипают при контакте с воздухом.
Карбонат натрия используется во многих отраслях промышленности при производстве различных продуктов. Наиболее значительным пользователем является стекольная промышленность, которая использует карбонат натрия для разложения силикатов при производстве стекла.Косметическая промышленность использует его для производства мыла. В химической промышленности он используется в качестве прекурсора для множества натрийсодержащих реагентов. Это также важно в фотографии, текстильной промышленности и очистке воды. Помимо этих промышленных применений, карбонат натрия используется в медицине в качестве антацида. В доме карбонат натрия используют в качестве смягчителя воды для стирки, поэтому его иногда называют стиральной содой. Используемый для этой цели, он помогает удалить пятна от спирта, жира, масла и т. Д.
ОСНОВНЫЕ УСЛОВИЯ
Безводный —Соединение, не содержащее абсорбированной воды.
Гидрат — соединение, которое содержит определенное количество абсорбированной воды.
Гигроскопичный —Соединение, которое имеет тенденцию поглощать молекулы воды.
Процесс ЛеБлана — способ производства карбоната натрия с использованием соли, известняка и угля.
Кальцинированная сода — название карбоната натрия, которое отражает его первоначальный источник — пепел сожженных морских водорослей.
Процесс Solvay — Текущий синтетический метод производства карбоната натрия из аммиака, диоксида углерода, соли и известняка.
КНИГИ
Кэри, Фрэнсис А. Органическая химия . Dubuque, IA: McGraw-Hill, 2006.
Faith, W.L., Дональд Киз и Рональд Кларк. Промышленная химия . Нью-Йорк: John Wiley & Sons, 1966.
Hester, R.E. и Р. Харрисон, ред. Химические вещества в окружающей среде: оценка и управление рисками .Кембридж, Великобритания: Королевское химическое общество, 2006.
Хоффман, Роберт В. Органическая химия: промежуточный текст . Хобокен, Нью-Джерси: Wiley-Interscience, 2004.

 Внешний вид
Внешний вид Массовая доля хлоридов в пересчете на NaCl, %, не более
Массовая доля хлоридов в пересчете на NaCl, %, не более