физико-химические свойства и получение :: SYL.ru
Белый — лучший выбор: какие цвета заставят выглядеть наряд женщины за 50 дороже
Гусиные лапки — главный принт осени: тенденции и секреты использования в образе
Футболки с рукавами ¾: одежда, визуально уменьшающая широкую спину
Яркие пятна на чистом лице: тренд обещает стать главным в этом сезоне
Бульон поможет превратить картофельное пюре в шедевр
Положительное восприятие: почему именно принт в горох самый привлекательный
Как вписать в комфортный осенний образ балетки — хит этого сезона
Кекс с кабачком. Готовим ароматную выпечку с лаймом
Поливаем обильно. Осенняя подкормка для увеличения плодородия почвы
Осенняя подкормка для увеличения плодородия почвы
Автор Виталия Бересток
Физико-химические характеристики
Кальцинированная сода внешне представляет собой хорошо растворимый в водной среде бесцветный порошок кристаллического строения, для которого свойственен сильнощелочной тип химической реакции. Это вещество характеризуется повышенной гигроскопичностью, в воздушной среде интенсивно поглощает влагу и углекислоту, что способствует образованию кислых солей NaHCO 3. В случае хранения на открытом воздухе кальцинированная сода подвержена быстрому слеживанию. Данное химическое соединение служит основным реагентом для связывания ионов кальция. В этом качестве оно применяется, когда требуется преобразовать кальциевую глину в натриевую.
В этом качестве оно применяется, когда требуется преобразовать кальциевую глину в натриевую.
Производство кальцинированной соды
Карбонат натрия, называемый кальцинированной содой (Na2CO3), является одним из самых важных продуктов химической отрасли. Без этого вещества в наши дни не может обойтись ни одна сфера народного хозяйства. Сегодня стекольной, мыловаренной, текстильной, нефтяной, целлюлозно-бумажной и множеством других сфер промышленности потребляется в огромных количествах сода кальцинированная. Применение ее в быту тоже общеизвестно. И хотя данное вещество встречается в природе в виде минерала троны, его недостаточно для обеспечения постоянно возрастающих индустриальных нужд. Уже в восемнадцатом веке возникла острая потребность в ее дополнительном производстве. Первая промышленная методика получения кальцинированной соды была разработана и внедрена Лебланом в 1791 году. Суть данного метода заключается в прокаливании при температуре 1000 При обработке расплава горячей водой происходит гидролиз сульфида кальция с образованием сероводорода и малорастворимого гидроксида кальция, при этом кальцинированная сода оседает в растворе.
При обработке расплава горячей водой происходит гидролиз сульфида кальция с образованием сероводорода и малорастворимого гидроксида кальция, при этом кальцинированная сода оседает в растворе.
Метод Сольве
В настоящее время кальцинированная сода в промышленных масштабах производится по методу, предложенному бельгийским химиком-технологом и промышленником Эрнестом Сольве. Данный способ основан на свойствах слабой растворимости натриевого гидрокарбоната в солевых растворах высокой концентрации. Через аммиачно-водный раствор, который насыщен хлоридом натрия, пропускается углекислый газ. Образовавшийся при этом NaHCO 3, как менее растворимый в данной среде, выпадает в виде мелкодисперсного осадка. Для получения непосредственно кальцинированной соды выделенный гидрокарбонат прокаливается (кальцинируется). Данный способ прекрасно применим для синтеза Na2CO3 в промышленных масштабах, поскольку отличается высокой экономичностью и относительной простотой процесса. Сегодня мировое производство кальцинированной соды составляет около 30 млн.т. в год.
Сегодня мировое производство кальцинированной соды составляет около 30 млн.т. в год.
Экологические аспекты получения Na2CO3
Из фильтрата, оставшегося после отделения гидрокарбоната, под воздействием гашеной извести регенерируется аммиак. Единственным побочным продуктом производства кальцинированной соды выступает хлорид кальция, утилизация которого представляет собой серьезную экологическую проблему. Попытки использовать это вещество для борьбы с гололедицей приводят к засаливанию почвы и сильному угнетению растительного покрова. Сейчас для устранения обледенения в европейских странах все чаще используется экологически более чистый ацетат аммония. Интересно и то обстоятельство, что еще на заре двадцатого века во Франции был запатентован метод производства поташа (вещества, во многом сходного своим химическим строением с кальцинированной содой) по схеме Сольве, но с заменой токсичного аммиака на триметиламин.
Похожие статьи
- Сода для волос. Как пищевая сода влияет на волосы?
- Гидрокарбонат натрия: формула, состав, применение
- Как очистить микроволновку внутри содой или другими средствами
- Карбонат натрия: свойства, получение, применение
- Как пить соду для очищения организма от паразитов?
- Полезные свойства соды.

- Как делают стекло: особенности производства
Также читайте
| ⇐ ПредыдущаяСтр 14 из 17Следующая ⇒ ТЕХНОЛОГИЯ КАЛЬЦИНИРОВАННОЙ СОДЫ. ОБЩИЕ СВЕДЕНИЯ. К важнейшим видам продукции основной химической промышленности наряду с минеральными кислотами и удобрениями относятся содовые продукты — кальцинированная сода, каустическая сода и бикарбонат натрия. Кальцинированная сода широко применяется во многих отраслях промышленности, а также для бытовых нужд. Кальцинированная сода — Ка2С03 — представляет собой белый кристаллический порошок с температурой плавления 852 °С, плотностью 2533 кг/м3. Насыпная плотность кальцинированной соды составляет от 500 до 700 кг/м3. Выпускается также специальный сорт соды — так называемая «тяжелая» сода. Насыпная плотность «тяжелой» соды — от 800 до 1000 кг/м3. Кальцинированная сода — гигроскопичная соль. Она хорошо растворяется в воде с выделением тепла. При нагревании раствора выше 32,5 °С растворимость соды снижается. Качество кальцинированной технической соды из нефелинового сырья определяется требованием ГОСТ 10680—70. Методы получения соды. Кальцинированную соду получают тремя способами: аммиачным, из природной соды и комплексной переработкой нефелинов . В нашей стране аммиачный способ является основным. Процесс переработки нефелинов с получением глинозема, содовых продуктов (соды и поташа) и цемента на основе апатито-нефелинового месторождения Кольского полуострова, а также нефелиновых руд Сибири постепенно приобретает большое значение. В отдельных зарубежных странах кальцинированную соду получают из природной соды. В общем объеме производства доля синтетической соды, получаемой аммиачным способом, составляет 84%. а из нефелина—16%. Мощности по выпуску аммиачной соды используются на 95—100%, а нефелиновой соды — на 85—95%. ПРОИЗВОДСТВО СОДЫ АММИАЧНЫМ СПОСОБОМ Сырье. Основным сырьем для производства кальцинированной соды являются мел или известняк и раствор поваренной соли. Кроме того, применяют еще ряд вспомогательных материалов — аммиак, воду, пар и электроэнергию. Карбонатное сырье. Для получения оксида углерода (IV) и извести на содовых заводах применяют известняк или мел, называемые, карбонатным сырьем. От качества карбонатного сырья в значительной мере зависит нормальная работа содового завода. Применение известняка более желательно, чем применение мела. При увеличении влажности мела возрастает расход топлива на его обжиг и, следовательно, расход воздуха на сжигание топлива. С увеличением расхода воздуха снижается концентрация СО2 в печном газе. Кроме того, прочность мела ниже, чем известняка. Содержание СаС03 в известняке в соответствии с ОСТ 21-27—76 в пересчете на сухой продукт должно быть не менее 92%. Расход карбонатного сырья (100% СаСО3) на 1 т соды составляет 1,1—1,25 т. Содовые заводы обычно находятся вблизи месторождений карбонатного сырья. Поваренная соль широко распространена в природе как в твердом виде, так и в виде растворов. В производстве соды аммиачным способом применяют не твердую соль, а рассол, стоимость добычи которого путем выщелачивания соли во много раз ниже стоимости добычи твердой соли. В содовой промышленности концентрацию растворов принято выражать в так называемых нормальных делениях (н.д.). Одно нормальное деление соответствует содержанию 1/20 экв. вещества в 1 л раствора. На практике применяют рассол, содержащий 305—310 г/л NаСl, что соответствует 104,3— 106,0 н. д. Увеличение концентрации NаСl благоприятно влияет на степень его использования, что ведет к уменьшению удельного расхода рассола, к снижению расхода аммиака, известняка, пара, воды, электроэнергии на 1 т соды. На производство 1 т кальцинированной соды расходуется около 1,5 т поваренной соли. Аммиак в производстве соды находится в замкнутом цикле: после регенерации в отделении дистилляции он возвращается обратно в производство. Для восполнения неизбежных потерь в цикл вводят аммиачную воду, содержащую до 25% г Nh4. Общая схема производства. Сложный процесс производства соды можно разделить на несколько стадий (так называемые станции или отделения): 1) предварительная очистка рассола от солей кальция и магния; 2) абсорбция — насыщение рассола аммиаком и частично оксидом углерода (IV) с получением аммонизированного рассола; 3) карбонизация — насыщение аммонизированного рассола оксидом углерода (IV) с образованием бикарбоната натрия в виде суспензии; 4) фильтрование — отделение суспензии бикарбоната натрия от фильтровой жидкости; 5) дистилляция — регенерация аммиака и оксида углерода (IV) из фильтровой жидкости; 6) кальцинирование (кальцинация) — разложение бикарбоната натрия на карбонат натрия (кальцинированную соду), воду и оксид углерода (IV). Кроме основных процессов, при производстве соды протекает ряд побочных процессов, не имеющих непосредственного отношения к получению соды. Аммиак регенерируют из хлорида аммония путем обработки раствора известковым молоком: 2Nh5СL + Са(ОН)2 = 2Nh4 + 2Н20 + СаСl2 В отделении дистилляции образующийся аммиак отгоняют из раствора водяным паром и направляют в отделение абсорбции. Раствор хлорида кальция является отходом производства. Для получения известкового молока необходима известь СаО, которую на содовых заводах получают путем обжига карбонатного сырья (мела или известняка) в известково-обжигательных печах при температуре 1100—1200 °С.Образующийся при обжиге оксид углерода (IV) используют в процессе карбонизации, а известь СаО гасят избытком воды с получением известкового молока: СаО + Н20 = Са(ОН)2 Таким образом, получение соды аммиачным способом можно изобразить в виде схемы, показывающей взаимную связь между отдельными стадиями процесса: На рис. Водный раствор поваренной соли, содержащий 305—310 г/л, предварительно очищенный от солей кальция и магния, самотеком поступает в промыватель 1,где поглощает оксид углерода (IV) из газов, выходящих из карбонизационной колонны 7, и аммиак из газов, поступающих с вакуум-фильтров Рис. 1. Технологическая схема получения кальцинированной соды аммиачным способом: 1-промыватель газов; 2-абсорбер; 3-дистнлляциоиная ;4-смеситель; 5 — вакуум-фильтр; 6 — холодильник аммонизированного рассола 7 — карбонизационная колонна; 8, 12 — компрессоры; 9 — холодильник-газоочистатель; 10 -известково-обжигательная печь; 11- аппарат для гашения извести; 13 — холодильник-промыватель, 14 — содовая печь. В карбонизационной колонне 7 протекает основная реакция образования бикарбоната натрия. Сюда же подают известковое молоко, полученное гашением извести в аппарате Осадок NаНСО3 промывают на вакуум-фильтре 5и подают во вращающуюся содовую печь 14на кальцинирование, в результате чего образуется сода, пары воды и оксид углерода (IV). Кальцинированная сода из печи 14поступает на склад и далее на упаковку. ⇐ Предыдущая14Следующая ⇒ Что способствует осуществлению желаний? Стопроцентная, непоколебимая уверенность в своем… Что делать, если нет взаимности? А теперь спустимся с небес на землю. Приземлились? Продолжаем разговор… Система охраняемых территорий в США Изучение особо охраняемых природных территорий(ООПТ) США представляет особый интерес по многим причинам… ЧТО И КАК ПИСАЛИ О МОДЕ В ЖУРНАЛАХ НАЧАЛА XX ВЕКА Первый номер журнала «Аполлон» за 1909 г. начинался, по сути, с программного заявления редакции журнала… Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте: |
| Параметр | Na2CO3*10h3O | Na2CO3 |
| Т плавления, °С | 32 | 852 |
| Плотность вещества, г/см3 | 1,446 | 2,53 |
| Теплоемкость, Дж/моль*К | – | 109,2 |
| Растворимость | h3O | глицерин h3O |
Нахождение в природе
Кристаллический натрий двууглекислый – природное ископаемое, образованное из отложений морских водорослей. В природе ее можно найти в нескольких формах кристаллогидратов. Так, гидрокарбонат натрия известен как нахколит, кристаллогидрат с 2 молекулами воды (Na2CO3*NaHCO3*2h3O) – трона, с 10 молекулами воды – натрит, а с одной молекулой воды – термонатрит.
По словам геологов, основные российские запасы соды находятся в Западной Сибири и Забайкальском крае. Также известны соленые озера в Танзании (Натрон) и Калифорнии (Сирлс).
Также известны соленые озера в Танзании (Натрон) и Калифорнии (Сирлс).
Впервые упоминание троны происходит в Вайоминге, штате США. Геологоразведочная экспедиция открыла содовое месторождение в Грин-Ривере в середине XX века (1938 год).
Применение
Благодаря антисептическому действию, NaHCO3 используют в медицине при лечении заболеваний желудочно-кишечного тракта (изжога, отрыжка), ожогах (устраняет болевые ощущения).
Техническая, или кальцинированная сода, применяется в быту как пятновыводитель, а также в садоводстве для борьбы с вредителями.
Гидроксид натрия применяют на химическом и нефтехимическом производстве в качестве реагента (производство биодизеля), а также нейтрализатора кислых примесей в системе стоков. В целлюлозно-бумажной промышленности едкий натр – главное звено сульфатной варки. Актуально применение щелочи в мыловарении – свойство NaOH омывать жиры и масла используется для производства моющих средств.
Каустическая сода применяется только в быту
Очищение стойкой накипи
Помогает карбонат натрия убирать толстые наслоения жира и копоти с кастрюль и сковород (кроме тефлоновых и алюминиевых). Действия выполняют в следующей последовательности:
Действия выполняют в следующей последовательности:
- Объемную металлическую кастрюлю заполняют теплой водой на 2/3 объема, примерно 10 литров.
- Осторожно всыпают кальцинированную соду — 250 г.
- Добавляют силикатный клей — 200 мл.
- Всыпают стружку от четверти бруска хозяйственного мыла.
- Тщательно перемешивают и складывают в раствор очищаемые предметы.
- Ставят кастрюлю на плиту,
- Установив небольшой нагрев, кипятят около 30 минут. При стойких загрязнениях время увеличивают, пока поверхности полностью освободятся от накипи.
Рекомендовано для Вас:
Как смягчить воду содой в домашних условиях
Остается тщательно сполоснуть и вытереть вернувшие блеск сковороды и кастрюли.
Карбонат натрия
Википедия
Август 24, 2021
Карбона́т на́трия (кальцинированная сода) — неорганическое соединение, натриевая соль угольной кислоты с химической формулой Na2CO3. Бесцветные кристаллы или белый порошок, хорошо растворимый в воде. В промышленности в основном получают из хлорида натрия по методу Сольве. Применяют при изготовлении стекла, для производства моющих средств, используют в процессе получения алюминия из бокситов и при очистке нефти.
Бесцветные кристаллы или белый порошок, хорошо растворимый в воде. В промышленности в основном получают из хлорида натрия по методу Сольве. Применяют при изготовлении стекла, для производства моющих средств, используют в процессе получения алюминия из бокситов и при очистке нефти.
| Карбонат натрия | |||
|---|---|---|---|
| Общие | |||
| Систематическое наименование | Карбонат натрия | ||
| Традиционные названия | кальцинированная сода, углекислый натрий; декагидрат — стиральная сода | ||
| Хим. формула | Na2CO3 | ||
| Физические свойства | |||
| Молярная масса | 105,99 г/моль | ||
| Плотность | 2,53 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 854 °C | ||
| • разложения | 1000 °C | ||
| Химические свойства | |||
| Константа диссоциации кислотыpKa{\displaystyle pK_{a}} | 10,33 | ||
| Растворимость | |||
| • в воде при 20 °C | 21,8 г/100 мл | ||
| Классификация | |||
Рег. номер CAS номер CAS | |||
| PubChem | |||
| Рег. номер EINECS | 207-838-8 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E500(i) иE500 | ||
| RTECS | VZ4050000 | ||
| ChEBI | |||
| ChemSpider | |||
| Безопасность | |||
| ЛД50 | 4 г/кг (крысы, орально) | ||
| Пиктограммы СГС | |||
| NFPA 704 | 0 1 0 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Не следует путать с гидрокарбонатом натрия (пищевой содой).
Не следует путать с гидроксидом натрия (каустической содой).
- 1Свойства
- 2Нахождение в природе
- 3Получение
- 3.1Способ Леблана
- 3.2Промышленный аммиачный способ (способ Сольве)
- 3.3Способ Хоу
- 3.3.1Сравнение способов
- 4Применение
- 5Безопасность
- 6Тривиальные названия
- 7Примечания
- 8Литература
- 9Ссылки
Имеет вид бесцветных кристаллов или белого порошка. Существует в нескольких разных модификациях: α-модификация с моноклинной кристаллической решеткой образуется при температуре до 350 °C, затем, при нагреве выше этой температуры и до 479 °C осуществляется переход в β-модификацию, также имеющую моноклинную кристаллическую решетку. При увеличении температуры выше 479 °C соединение переходит γ-модификацию с гексагональной решеткой. Плавится при 854 °C, при нагреве выше 1000 °C разлагается с образованием оксида натрия и диоксида углерода.
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O. В интервале 100−120 °C моногидрат теряет воду.
В интервале 100−120 °C моногидрат теряет воду.
| параметр | безводный карбонат натрия | декагидрат Na2CO3·10H2O |
|---|---|---|
| молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| температура плавления | 854 °C | 32 °C |
| растворимость | не растворим в ацетоне и сероуглероде; малорастворим в этаноле; хорошо растворим в глицерине и воде | |
| плотностьρ{\displaystyle \rho } | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. {-}}}}
{-}}}}
Первая константа диссоциации угольной кислоты равна 4,5⋅10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
- Na2CO3+h3SO4→Na2SO4+h3O+CO2↑{\displaystyle {\mathsf {Na_{2}CO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+H_{2}O+CO_{2}\uparrow }}}
В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
- нахколит NaHCO3
- трона Na2CO3·NaHCO3·2H2O
- натрит (сода) Na2CO3·10H2O
- термонатрит Na2CO3·Н2O.
Современные минеральные содовые озёра(англ.)русск. известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии[неавторитетный источник?]. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода добывается 4 компаниями в Вайоминге и одной в Калифорнии, около половины экспортируется. Около четверти используемой в мире соды добывается из природных источников, 90% их них добывается в США.
Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода добывается 4 компаниями в Вайоминге и одной в Калифорнии, около половины экспортируется. Около четверти используемой в мире соды добывается из природных источников, 90% их них добывается в США.
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей, прибрежных и солончаковых растений путём перекристаллизации относительно малорастворимого NaHCO3 из щёлока.
Способ Леблана
В 1791 году французский химик Николя Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
Уголь восстанавливает сульфат натрия до сульфида:
- Na2SO4+2C→Na2S+2CO2{\displaystyle {\mathsf {Na_{2}SO_{4}+2C\rightarrow Na_{2}S+2CO_{2}}}}
Сульфид натрия реагирует с карбонатом кальция:
- Na2S+CaCO3→Na2CO3+CaS{\displaystyle {\mathsf {Na_{2}S+CaCO_{3}\rightarrow Na_{2}CO_{3}+CaS}}}
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2NaCl+h3SO4→Na2SO4+2HCl{\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2HCl}}}
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
Карбонат натрия
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- Nh4+CO2+h3O+NaCl→NaHCO3+Nh5Cl{\displaystyle {\mathsf {NH_{3}+CO_{2}+H_{2}O+NaCl\rightarrow NaHCO_{3}+NH_{4}Cl}}}
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2NaHCO3→otNa2CO3+h3O+CO2↑{\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow[{}]{^{o}t}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}}
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2Nh5Cl+Ca(OH)2→CaCl2+2Nh4+2h3O{\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow CaCl_{2}+2NH_{3}+2H_{2}O}}}
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год.
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год).
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах.
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью.
В фотографии используется в составе проявителей как ускоряющее средство.
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1 л масла.[источник не указан 672 дня]
Предельно допустимая концентрация аэрозоли кальцинированной соды в воздухе производственных помещений — 2 мг/м3. Кальцинированная сода относится к веществам 3-го класса опасности. Аэрозоль кальцинированной соды при попадании на влажную кожу и слизистые оболочки глаз и носа может вызвать раздражение, а при длительном воздействии — дерматит.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый, бикарбонат натрия
«Сода» в европейских языках происходит, вероятно, от арабского «suwwad» — общего названия различных видов солянок, растений, из золы которых её добывали в средние века; существуют и другие версии. Кальцинированная сода (карбонат натрия) называется так потому, что для получения её из бикарбоната последний «кальцинируют» (лат. calcinatio, от calx, по сходству с процессом обжига извести), то есть прокаливают.
Кальцинированная сода (карбонат натрия) называется так потому, что для получения её из бикарбоната последний «кальцинируют» (лат. calcinatio, от calx, по сходству с процессом обжига извести), то есть прокаливают.
- Рукк, 1992.
- Аликберова.
- — Litres 2019 isbn 5040325053
- —
- Lazenby, Henry(англ.). Mining Weekly (26 June 2014). Дата обращения: 22 августа 2020.
- , Государственный архив Пермской области, 1997
- (неопр.)(недоступная ссылка). Дата обращения: 6 октября 2013. 8 июля 2014 года.
- Гурлев, 1988, с. 298.
- Гурлев Д.С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
- Рукк Н. С.Натрия карбонат // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Большая Российская энциклопедия, 1992. — Т. 3: Меди—Полимерные.
 — С. 182. — 639 с. —48 000 экз. — ISBN 5-85270-039-8.
— С. 182. — 639 с. —48 000 экз. — ISBN 5-85270-039-8.
- Медиафайлы на Викискладе
- (неопр.). Государственный комитет СССР по стандартам. Дата обращения: 11 апреля 2019.
- Аликберова Л. Ю.(рус.). Большая Российская Энциклопедия. Министерство культуры Российской Федерации. Дата обращения: 11 апреля 2019.
Экономия на кухне и не только +Видео
Если сложить все траты на бытовую химию, сумма выйдет внушительная. Многие функции на кухне и в саду может выполнить кальцинированная сода. Вообще, мало кто интересуется, где продается кальцинированная сода и что она вообще существует.
Химическая формула пищевой соды NAHCO3( гидрокарбонат натрия), когда как кальцинированной NA2CO3(карбонат натрия или безводный углекислый натрий ), что при схожем виде делают их свойства различными. Свое бытовое название кальцинированная сода от производственного процесса, которым выпускается.
Содержание
- Важно!
- Кальцинированная сода и стирка
- Кальцинированная сода на кухне
- Кальцинированная сода в ванной
- Кальцинированная сода при ремонте
- Кальцинированная сода в садоводстве
Важно!
Не стоит путать пищевую и кальцинированную соду.
Такая ошибка может быть опасна. Кальцинированная сода является сильной щелочью, в то время как обычная более мягкая и даже применяется в пищу.
- Пищевая сода есть в каждом доме и тоже известна своими моющими свойствами, но они меркнут по сравнению с кальцинированной. Кальцинированная сода отлично удаляет любые загрязнения, особенно хорошо справляясь с жиром. Стоит заметить, что кальцинированная сода тоже используется в пищевой промышленности, как добавка Е500. использовать ее для приготовления пищи дома точно не стоит. Кальцинированная сода имеет высокий PH, по сравнению с обычной содой, поэтому если не соблюдать особых правил использования может вызвать ожоги слизистых.
- Если вам раньше не удавалось найти кальцинированную соду в магазине, посмотрите в отделе стиральных порошков, когда обычная продается с товарами для выпечки. Обычно в розницу нет проблем с ее покупкой.
- Есть множество дел, в которых кальцинированная сода может помочь: помыть посуду, вычистить раковину, ванну, унитаз, плиту на кухне, удалить накипь из стиральной машинки, мыть пол и стирать, отчистит старую краску – все это может кальцинированная сода.

- Обработка кальцинированной содой должна производиться в растворе, концентрация которого зависит от цели использования.
Кальцинированная сода и стирка
Кальцинированная сода поможет при ручной и машинной стирке, так же она практически не заменима для ухода за стиральной машинкой. При автоматической стирке нужно насыпать три ложки карбоната натрия прямо в барабан с бельем. Когда белье слишком грязное, можно увеличить дозировку на пару ложек по своему усмотрению . Температура стирки должна быть более 50 градусов, иначе сода не среагирует.
При ручной стирке можно добавить три столовых ложки соды на ведро горячей воды. Этот раствор значительно усилит действие вашего порошка для ручной стирки, но не подойдет для деликатных тканей. Соду можно использовать для замачивания вещей в теплой воде, а так же для смягчения жесткой воды при стирке. Существует раствор кальцинированной соды, который скорее можно назвать гелем, очень популярный среди домохозяек.
Если вы не доверяете магазинным средствам. Попробуйте изготовить этот ароматный гель сами. Он подойдет для стирки в машине и руками, а так же замачивания. Можно будет не только хорошо отстирать, но и отбелить белье. Это средство подойдет для стирки вещей новорожденных. В этом случае средство не только приведет к экономии в семейном бюджете, так как стрика с маленькими детьми дело ежедневное, и сделает обработку белья безопасной.
Попробуйте изготовить этот ароматный гель сами. Он подойдет для стирки в машине и руками, а так же замачивания. Можно будет не только хорошо отстирать, но и отбелить белье. Это средство подойдет для стирки вещей новорожденных. В этом случае средство не только приведет к экономии в семейном бюджете, так как стрика с маленькими детьми дело ежедневное, и сделает обработку белья безопасной.
Ингредиенты для геля : 2л воды, 1 хозяйственное мыло, 150 гр кальцинированной соды, 200 гр зеленого чая.
Натертое мыло нужно добавить в кипящую воду. После растворения мыло добавляют воду и чай. Следите, чтобы чай был натуральным и без добавок. Кипятим смесь еще пару минут. После выключения можно добавить пару капель аромомасла, по вашему вкусу и быстро перемешать. Такой гель не только постирает, но и придаст белью приятный запас, заменяя и ополаскиватель.
Для постельного белья его помешают в раствор соды и мыльной стружки. Емкость должна быть эмалированной. Затем кипятим все на медленном огне 20 минут. После кипячения можно запустить белье в обычный цикл стиральной машины. Такой метод стирки хорошо подойдет для кухонных полотенец.
После кипячения можно запустить белье в обычный цикл стиральной машины. Такой метод стирки хорошо подойдет для кухонных полотенец.
Карбонат натрия – хорошее средство для ухода за машинкой. Проблема накипи существует абсолютно во всех стиральных машинах. Источник ее появления невозможно купировать: налет будет все равно появляться в большей или меньшей степени, в зависимости от жесткости воды. Последствия накипи: запах, износ деталей, и как итог, поломка.
Этого можно избежать, очистив машинку кальцинированной содой. Работать нужно в резиновых перчатках. Манжетку и барабан нужно обработать водным раствором карбоната кальция 1:1. Дать соде среагировать в течении получаса, затем стереть остатки губкой. Теперь нужно запустить режим быстрой стирки «в холостую», так как едкая сода может повредить вещи.
Кальцинированная сода на кухне
Кальцинированная сода отлично отмоет жирную посуду. Для этого нужно развести три столовых ложки на литр воды. После такого мытья посуду нужно прополоскать в проточной воде.
Для этого нужно развести три столовых ложки на литр воды. После такого мытья посуду нужно прополоскать в проточной воде.
Кальцинированная сода борется с налетом не только в стиральной машине не и в чайнике. Достаточно пар раз прокипятить чайник, простой или электрический, с несколькими ложками соды, после чего вымыть его.
Если в пяти литрах воды развести 4 ложки кальцинированной соли, то можно помыть пол не только на кухне, но и во всем доме. Минус в том, что в отличии от магазинных средств, пол после мытья содой придется, протереть чистой водой, и насухо вытереть от разводов.
Кальцинированная сода в ванной
Сантехника тоже отлично отмывается кальцинированной собой. Для этого ее надо протереть ее губкой смоченной в растворе. Развести нужно две ложки соды на литр воды, после чего не забыть обильно смыть соду и вытереть насухо.
Кальцинированная сода при ремонте
Кальцинированная сода поможет избавиться от старой краски, причем даже в тех местах, где сложно ее удалить механически.
Удаление старой краски шпателем без предварительной подготовки очень трудоемкий процесс, использование средства на основе кальцинированной соды сильно его упрощает.
Важно! Если решите применить этот метод, обязательно используйте маску, перчатки и очки. После удаления краски. Если это было в помещении, обязательно оставьте комнату проветриваться на 12 или более часов.
Понадобится большая емкость, так как смесь сильно пенится. Одну упаковку соды (1кг) растворяем в 4,5 литра горячей воды 9 (60 С). Постепенно добавляем 900 гр гашеной извести. Полученная смесь подходит для любой окрашенной поверхности.
Кальцинированная сода в садоводстве
В саду и огороде карбонат натрия тоже приносит много пользы, при малых тратах. Она помогает победить вредителей и избавиться от таких болезней растений как мучнистая роса. Для этого растения нужно опрыскать слабым раствором соды и хозяйственного мыла. Процедуру лучше проводить рано утром или вечером, чтобы не вызвать солнечные ожоги листьев.
Для этого растения нужно опрыскать слабым раствором соды и хозяйственного мыла. Процедуру лучше проводить рано утром или вечером, чтобы не вызвать солнечные ожоги листьев.
Кальцинированная сода оказывается просто незаменимой в быту, но пользоваться ею и хранить нужно с большой осторожностью. Она не должна находиться вблизи от продуктов питания и быть доступна детям. В случае попадания соды в глаз или на слизистые поверхности, нужно срочно промыть их большим количеством воды, потом по необходимости обратиться к врачу. Работать лучше в резиновых перчатках.
Карбонат кальция отлично поглощает влагу. Поэтому его нельзя хранить в открытом виде, иначе она быстро слежится. Одно из главных правил безопасного пользования кальцинированной содой : не пренебрегать инструкцией и пропорциями приготовления, придерживаться правил ее применения, строго соблюдать пропорции, иначе можно нанести вред своему здоровью и своих близких.
youtube.com/embed/1FkNlsFSvls?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»>Карбонат натрия
| Ежемесячная техническая подсказка от Тони ХансенаSignUp | Нет отслеживания ! Нет объявлений ! Вот почему эта страница загружается быстро! |
- Материалы для керамики
1-9 | А | Б | С | Д | Е | Ф | Фриты | г | Н | я | Дж | К | л | М | Н | О | П | Вопрос | Р | С | Т | У | В | Вт | Х | Y | Z
Альтернативные названия : Кальцинированная сода, моногидрат кароната натрия, Na 2 CO 3
Описание : Наиболее распространенная форма карбоната натрия
Примечания
Кальцинированная сода, известная в керамической промышленности, представляет собой очищенный мелкозернистый белый материал. Он химически очень чистый и прокален (часто его называют плотной кальцинированной содой). Сорта (легкий, натуральный и плотный) различаются процентным содержанием кристаллизационной воды, размерами частиц и объемной плотностью (легкий сорт имеет около 40 фунтов на кубический фут, а плотный — около 70). Плотный сорт все же может потерять до 3% своего веса при прокаливании примерно до 400F.
Сорта (легкий, натуральный и плотный) различаются процентным содержанием кристаллизационной воды, размерами частиц и объемной плотностью (легкий сорт имеет около 40 фунтов на кубический фут, а плотный — около 70). Плотный сорт все же может потерять до 3% своего веса при прокаливании примерно до 400F.
Обычно кальцинированная сода используется в качестве растворимого дефлокулянта в керамических шликерах и глазури. Он хорошо работает в сочетании с силикатом натрия для получения шликеров для тела, которые не превращаются в гель слишком быстро и реология которых может быть отрегулирована в соответствии с изменениями жесткости воды (например, для тела из талька / шариковой глины требуется около 0,55% силиката натрия и 0,18% кальцинированной соды). по весу глиняного порошка, это будет 125г/40г). Более высокие пропорции кальцинированной соды (по сравнению с силикатом натрия) будут давать шликер, который дает более мягкий отлив (остается мокрым дольше). Общее количество кальцинированной соды и силиката натрия должно быть настроено таким образом, чтобы создать шликер, который в конечном итоге превратится в гель, если его оставить стоять.
Кальцинированная сода обычно не используется в качестве источника Na 2 O в глазури, поскольку она растворима. Однако он используется в качестве основного источника натрия во фриттах и стекле. Его растворимость делает его идеальным флюсом для глазури из египетской пасты. Хотя кальцинированная сода является чистым источником соды, мощного флюса в керамике, сам по себе порошок плотной версии начинает слеживаться только при 1500F.
Производство кальцинированной соды восходит к древним временам. Сегодня его перерабатывают из троновой руды в США (где находятся самые крупные месторождения). Руда прокаливается, растворяется и перекристаллизуется (в других частях мира используются другие процессы). Кальцинированная сода используется в очень широком диапазоне отраслей промышленности (самым большим потребителем является стекло), поэтому ее химические, физические и объемные свойства хорошо изучены и задокументированы (General Chemical Industrial Products публикует отличный буклет с описанием кальцинированной соды).
Моногидрат кальцинированной соды содержит 14,5% кристаллической воды. Этот материал представляет собой учебник по физике растворимости и разложения.
Отдельные кристаллы хрупкие, и оборудование для обработки должно учитывать это, чтобы сохранить качество.
Он не считается токсичным, хотя при обращении с ним могут образовываться частицы микронного размера.
При хранении может произойти слеживание, если материал поглощает воду из воздуха. Пищевая сода — это бикарбонат натрия, кальцинированная сода + углекислый газ.
Мешок 50 фунтов кальцинированной соды (или карбоната натрия).
Tap picture for full size
Кальцинированная сода растворима и поэтому непригодна для большинства керамических глазурей. Однако именно эта растворимость делает его очень полезным для контроля электролитов керамических суспензий. Это плотный сорт, не содержащий воды.
Обратная сторона пакета с карбонатом натрия (кальцинированной содой).

Нажмите на картинку, чтобы увидеть ее в полном размере
Вызывает раздражение глаз. Длительный контакт с кожей может вызвать раздражение.
Ссылки
| URL-адреса | http://minerals.usgs.gov/minerals/pubs/commodity/soda_ash/ Статика и информация |
|---|---|
| URL-адреса | http://images.dharmatrading.com/pdf/MSDS/soda-ash.pdf Образец паспорта карбоната натрия |
| URL-адреса | http://www.sodaash.com www.sodaash.com |
| URL-адреса | http://en.wikipedia.org/wiki/Натрий_карбонат Карбонат натрия в Википедии |
| Температура | Карбонат натрия разлагается (850-) |
| Температура | Дегидраты карбоната натрия (370-) |
| Материалы | Бикарбонат натрия |
| Материалы | Гидроксид натрия Дефлокулянт |
| Материалы | Силикат натрия Дефлокулянт Na2SiO3, Дефлокулянт |
| Материалы | Декагидрат карбоната натрия |
| Материалы | Нитрат натрия Источник натрия в стекольной промышленности |
| Опасности | Токсикология карбоната натрия |
| Коды типов | Общий материал Непатентованные материалы не имеют товарного знака.  Обычно они носят теоретический характер, химический состав показывает, каким был бы образец, если бы в нем не было загрязнения. Общие материалы полезны в образовательных ситуациях, когда учащимся необходимо изучать теорию материалов (позже они переходят к работе с реальными материалами). Они также полезны, когда химический состав фактического материала неизвестен. Часто точность расчетов достаточна при использовании универсальных материалов. Обычно они носят теоретический характер, химический состав показывает, каким был бы образец, если бы в нем не было загрязнения. Общие материалы полезны в образовательных ситуациях, когда учащимся необходимо изучать теорию материалов (позже они переходят к работе с реальными материалами). Они также полезны, когда химический состав фактического материала неизвестен. Часто точность расчетов достаточна при использовании универсальных материалов. |
| Типовые коды | Источник потока Материалы, содержащие Na2O, K2O, Li2O, CaO, MgO и другие флюсы, но не являющиеся полевыми шпатами или фриттами. Помните, что материалы могут быть источниками потока, а также выполнять множество других функций. Например, тальк является флюсом в высокотемпературных глазурях и матирующим веществом в низкотемпературных. Это также может быть флюс, наполнитель и усилитель расширения в телах. |
Данные
| Frit Softening Point | 851C M |
|---|---|
| Density (Specific Gravity) | 1. 44 44 |
| By Tony Hansen Follow me on |
Расскажите нам, как улучшить эту страницу
Или задайте вопрос, и мы изменим эту страницу, чтобы лучше ответить на него.
Адрес электронной почты
Имя
Субъект
Сообщение
Сообщение Введите это, чтобы доказать, что вы не робот или Обновить
Оставьте следующее пустым
https://digitalfire.com, все права защищены
Политика конфиденциальности
Карбонат натрия – применение, структура, формула и свойства
Как правило, учащиеся путают пищевую соду и соду для стирки. Это общие названия двух разных химических соединений. Один представляет собой карбонат натрия, а другой — гидрокарбонат натрия.
Что из себя представляет карбонат натрия, пищевая сода или стиральная сода? Вы можете ответить на это? Или вы тоже путаетесь между ними? Какова формула карбоната натрия? Какова формула гидрокарбоната натрия?
Этот раздел посвящен карбонату натрия, его свойствам и применению.
Что такое карбонат натрия?
Карбонат натрия является пищевой добавкой, одобренной FDA. Иногда его называют кальцинированной содой, стиральной содой, двунатриевым карбонатом или кристаллами соды. Карбонат натрия, или кальцинированная сода, является распространенным ингредиентом во многих производственных процессах.
Карбонат натрия — это природное соединение, которое также может быть получено искусственным путем. Карбонат натрия легко доступен в продуктовых магазинах, магазинах товаров для бассейнов и хозяйственных магазинах.
Карбонат натрия представляет собой неорганическое соединение, используемое в качестве умеренно сильного основания. Это ключевой компонент хозяйственного мыла и многих других товаров для дома.
Формула и структура карбоната натрия
Формула карбоната натрия Na₂CO₃ — динатриевая соль угольной кислоты. Молярная масса карбоната натрия составляет 106,0 г/моль. Это ионное соединение. Он состоит из аниона карбоната (CO₃⁻) и двух катионов натрия (Na⁺). Имеет кристаллическую декагидратную структуру.
Имеет кристаллическую декагидратную структуру.
Структура карбоната натрия представлена ниже:
Гидраты карбоната натрия
Обычно карбонат натрия существует в виде трех гидратов и безводного солевого состояния. Эти состояния
1. Натрон:
Это декагидрат карбоната натрия. Его химическая формула: Na₂CO₃·10H₂O. Он легко кристаллизуется с образованием моногидрата.
2. Термонатрит:
Это моногидрат карбоната натрия. Его химическая формула – Na₂CO₃·H₂O. Его также называют кристаллическим карбонатом.
3. Гептагидрат карбоната натрия:
Минеральная форма неизвестна. Его химическая формула: Na₂CO₃·7H₂O.
4. Натрит:
Это безводный карбонат натрия, также называемый кальцинированной содой. При нагревании образуются гидраты. Другой способ получения натрита — нагревание гидрокарбоната натрия.
Синтез карбоната натрия
Существует пять процессов синтеза карбоната натрия, т. е. горнодобывающая промышленность, процесс Барилла и водорослей, процесс Леблана, Хоу и Сольве.
Среди этих пяти способов процесс Сольвея является наиболее коммерчески используемым процессом синтеза карбоната натрия.
Процесс Сольве:
Промышленный химик Эрнест Сольве из Бельгии в 1861 году разработал метод получения карбоната натрия. Этапы процесса Solvay:
Этап 1: Производство гидрокарбоната натрия:
На этом этапе гидрокарбонат натрия и хлорид аммония производятся с использованием аммиака, хлорида натрия и воды. Происходит химическая реакция
NaCl + NH3 + CO₂ + H2O → NaHCO3 + NH4Cl
Этап 2: Производство карбоната натрия:
На этом этапе путем нагревания гидрокарбоната натрия формулы NaHCO3 из этапа 1 он превращается в карбонат натрия. На этом этапе высвобождаются вода и углекислый газ.
2NaHCO₃ → Na₂CO3 + H₂O + CO₂ ↑
Этап 3: Рециркуляция аммиака:
Хлорид аммония, полученный на этапе 1, обрабатывается известью, а оставшийся продукт двуокиси углерода используется на этапе 2. Происходит реакция.
Происходит реакция.
2NH₄Cl + CaO → 2NH3 + CaCl2 + H₂O
Полученный аммиак рециркулируется в процессе Solvay. Единственным отходом в процессе Solvay является хлорид кальция, а рассол и известняк являются единственными потребляемыми веществами. В результате процесс становится существенно более экономичным, чем другой процесс.
Физические свойства карбоната натрия
В окружающей среде имеется природный и искусственный карбонат натрия. Естественно, это происходит в засушливых районах, особенно в месторождениях полезных ископаемых, обнаруживаемых при периодическом испарении озерной воды.
Изготовлен из троны, двухсолевого раствора. Некоторые другие физические свойства карбоната натрия:
- Это белое кристаллическое твердое вещество.
- Молярная масса карбоната натрия составляет 105,99 г/моль.
- Он не имеет запаха, вкуса и хорошо растворим в воде.
- Температура кипения Na₂CO₃ составляет 1600°C, тогда как он разлагается при 851°C.

- Он является основным или щелочным, так как превращает красный лакмус в синий.
- Плотность карбоната натрия 2,54 г/см³.
- Это один из немногих водорастворимых карбонатов металлов.
- Одна из его редко встречающихся форм называется натритом.
Химические свойства карбоната натрия
Некоторые основные химические свойства карбоната натрия:
1. Воздействие тепла:
Тепловое воздействие на безводный карбонат натрия отсутствует. Плавится при 852°C, не распадаясь.
2. Эффект гидролиза:
Во время гидролиза в раствор высвобождаются ионы ОН⁻. Эти ионы делают раствор карбоната натрия слегка щелочным.
Na₂CO3 + 2H₂O → H₂CO3 + 2Na⁺ + 2OH⁻
3. Влияние двуокиси углерода:
Водный карбонат натрия поглощает двуокись углерода и производит гидрокарбонат натрия.
Na₂CO₃ + H₂O + CO₂ → 2NaHCO₃
4. Влияние растительных кислот:
Когда слабые кислоты, такие как сок лайма, реагируют с карбонатом натрия, образуется двуокись углерода.
Na₂CO3 + 2HCl → 2NaCl + H₂O + CO₂
- Обладает моющими свойствами благодаря омылению, которое делает жиры и жиры смешиваемыми с водой.
Применение карбоната натрия
1
. Умягчение воды:Карбонат натрия помогает смягчить воду, удаляя Ca²⁺, Mg²⁺ и другие ионы, которые делают ее жесткой. Когда все эти ионы обрабатывают карбонат-ионами, они образуют нерастворимые твердые осадки. Кроме того, мягкая вода имеет много преимуществ. Он снижает потери мыла, увеличивает срок службы труб и фитингов и предохраняет их от ржавчины.
2. Производство стекла:Кальцинированная сода и каустическая сода необходимы при производстве стекла. Карбонат натрия, Na₂CO3, служит флюсом кремнезема. Он снижает температуру плавления смеси без применения специальных материалов и позволяет недорого получить «натриево-известковое стекло» 9.0014
3. Пищевые добавки и кулинария: Карбонат натрия — это пищевая добавка, которая действует как антислеживатель, регулятор кислотности, стабилизатор и разрыхлитель. Он имеет множество кулинарных применений. Его также добавляют в некоторые продукты питания для улучшения их вкуса.
Он имеет множество кулинарных применений. Его также добавляют в некоторые продукты питания для улучшения их вкуса.
4. Некоторые другие применения:
Используется в кирпичной промышленности в качестве смачивающего агента для уменьшения количества воды, необходимой для экструзии глины. Многие сухие мыльные порошки содержат Na₂CO₃. Кроме того, он действует как пенообразователь и абразив в зубной пасте. Он также используется в качестве прочной основы в различных приложениях.
Резюме
Что такое карбонат натрия? Короче говоря, карбонат натрия — это динатриевая соль угольной кислоты с химической формулой Na₂CO₃. Молярная масса карбоната натрия составляет 105,99 г/моль. Существует два способа синтеза карбоната натрия.
Пригоден для различных целей как дома, так и на работе. Он используется для производства мыла, стекла и других химических веществ. Он также действует как регулятор pH.
Хотя низкая концентрация карбоната натрия не может повредить коже, водная форма карбоната натрия обладает высокой реакционной способностью и коррозионным действием. Это может вызвать значительное раздражение кожи и глаз. Таким образом, необходимо обращаться с ним осторожно и безопасно.
Это может вызвать значительное раздражение кожи и глаз. Таким образом, необходимо обращаться с ним осторожно и безопасно.
Часто задаваемые вопросы
1. Каковы симптомы отравления карбонатом натрия?A. Хотя карбонат натрия безвреден в небольших количествах, слишком большое его количество может вызвать отравление. Некоторые симптомы отравления карбонатом натрия включают:
- Проблемы с дыханием
- Рвота
- Диарея
- Низкое кровяное давление
- Раздражение глаз
Поэтому обращайтесь с ним осторожно.
2. Ядовит ли карбонат натрия?A. Обычно он безвреден при контакте с кожей. Однако растворы, приготовленные с карбонатом натрия, могут вызывать коррозию. Хотя небольшие количества не токсичны, слишком большое количество может вызвать отравление. Тем не менее, по большей части карбонат натрия имеет низкий риск токсичности.
3. Что происходит при пероральном приеме карбоната натрия? A. Прием внутрь карбоната натрия не добавит натрия в ваш организм. Даже количество потребляемого вами натрия намного ниже, чем количество натрия в пище. Когда вы принимаете карбонат натрия перорально, он смешивается с водой в вашем теле и действует как антацид. Он нейтрализует желудочную кислоту в желудке. Но обычно для этой цели его не назначают.
Прием внутрь карбоната натрия не добавит натрия в ваш организм. Даже количество потребляемого вами натрия намного ниже, чем количество натрия в пище. Когда вы принимаете карбонат натрия перорально, он смешивается с водой в вашем теле и действует как антацид. Он нейтрализует желудочную кислоту в желудке. Но обычно для этой цели его не назначают.
A. Карбонат натрия часто добавляют в воду в некотором количестве для изменения ее рН и щелочности. Обычно его добавляют в диапазоне от 1 ppm до 40 ppm в процессе борьбы с коррозией. Это количество незначительно по сравнению с естественным количеством в продуктах питания и напитках.
5. Какие этапы входят в процесс производства карбоната натрия по методу Леблана?A. Этот производственный процесс состоит из трех этапов. Это
Этап 1: Хлорид натрия обрабатывается серной кислотой.
2NaCl + H₂SO4 → Na₂SO4 + 2HCl
Этап 2: Сульфат натрия нагревают с помощью угля.
Na₂SO4 + 2C → Na₂S + 2CO₂
Этап 3: На этом последнем этапе обрабатываются сульфид натрия и карбонат кальция.
Na₂S + CaCO3 → Na₂CO3 + CaS
6. Какие материалы используются в процессе Solvay?A. Основные материалы, используемые в процессе Solvay, недороги и легко доступны. Это
- Рассол или раствор хлорида натрия:
NaCl обеспечивает ионы Na⁺ при производстве карбоната натрия. Рассол имеется в изобилии на земле. Его можно легко собрать как в океане, так и на суше.
- Известняк или карбонат кальция:
CaCO₃ обеспечивает ионы CO3⁻ при производстве Na₂CO₃. Он легко доступен в майнинге.
- Аммиак:
NH₃ производится в промышленных масштабах по процессу Габера. Это дорого, но может быть переработано в процессе Solvay.
Это дорого, но может быть переработано в процессе Solvay.
Na2CO3 – применение, формула, свойства, часто задаваемые вопросы
Что такое карбонат натрия?
Карбонат натрия — неорганический химикат с формулой Na 2 CO 3 и его многочисленные гидраты (также известные как стиральная сода, кальцинированная сода и кристаллы соды). Все формы представляют собой водорастворимые, бесцветные соли без запаха, образующие в воде умеренно щелочные растворы. Его традиционно получали из золы растений, произраставших на почвах, богатых натрием.
Молекулярная формула карбоната натрия: Na 2 CO 3 . Точно так же химическая формула кальцинированной соды: Na 2 CO 3 .10H 2 O. Поскольку зола этих богатых натрием растений заметно отличалась от золы древесины (которая первоначально использовалась для производства поташа), карбонат натрия был получивший название «кальцинированная сода». Технология Solvay производит его в огромных количествах из хлорида натрия и известняка. Карбонат натрия также известен как стиральная сода.
Технология Solvay производит его в огромных количествах из хлорида натрия и известняка. Карбонат натрия также известен как стиральная сода.
Что такое Na
2 СО 3 ?Карбонат натрия представляет собой химическое соединение, состоящее из неорганических элементов. Кальцинированная сода представляет собой карбонат натрия, иногда известный как карбонат натрия. Трона используется для удаления кальцинированной соды. Трона — двойная соль, состоящая из карбоната натрия и гидрокарбоната натрия, образующаяся в результате процессов испарения в озерах. Наиболее важным из основных тяжелых химических веществ является карбонат натрия, иногда известный как стиральная сода или кальцинированная сода. Его преимущество заключается в том, что он не вызывает коррозии и поэтому более безопасен в обращении, чем гидроксид натрия.
Also read —
- NCERT Solutions for Class 11 Chemistry
- NCERT Solutions for Class 12 Chemistry
- NCERT Solutions for All Subjects
Sodium Carbonate Formula
Sodium carbonate is a carbonic acid diazonium salt with the chemical формула Na 2 CO 3 . Кристаллы соды, кальцинированная сода и сода для стирки — некоторые другие названия. Это неорганическое соединение растворимо в воде, образуя угольную кислоту и гидроксид натрия при растворении в воде. Это белый порошок без запаха в чистом виде. Это мощная основа, которая также действует как антацид.
Кристаллы соды, кальцинированная сода и сода для стирки — некоторые другие названия. Это неорганическое соединение растворимо в воде, образуя угольную кислоту и гидроксид натрия при растворении в воде. Это белый порошок без запаха в чистом виде. Это мощная основа, которая также действует как антацид.
Существует четыре способа получения карбоната натрия: процесс Solvay, процесс Labnac, двойной процесс и электролитический процесс.
Он слабо растворим в этаноле и нерастворим в спирте, поскольку является слабой кислотой. Одним из наиболее распространенных применений Na 2 CO 3 является умягчение воды. Уровень pH составляет примерно 11.
Гидраты Na
2 CO 3Доступны три гидрата и безводная соль карбоната натрия:
Na 2 CO 3 .10H 2 O, декагидрат карбоната натрия (натрон), легко выветривается с образованием моногидрата.

Na 2 CO 3 .7H 2 O, гептагидрат карбоната натрия (в кристаллической форме неизвестно).
Na 2 CO 3 .H 2 O, моногидрат карбоната натрия (термонатрит). Кристаллический карбонат – другое его название.
Na 2 CO 3 Кальцинированная сода, также известная как безводный карбонат натрия. Для его создания гидраты нагревают. Он также может образовываться при нагревании (кальцинировании) гидрокарбоната натрия, как на заключительном этапе процесса Сольве.
Читать Подробнее:
- NCERT Notes класс 11 Химия Глава 10 Глава 10 Элементы S-блок
- NCERT Solutions для класса 11 Глава 10 Главные. Элементы S-блока
Синтез карбоната натрия:
Процесс Solvey
В настоящее время метод Solvey является единственным способом получения карбоната натрия. При этом в холодный насыщенный раствор хлорида натрия вводят углекислый газ и аммиак. Гидрокарбонат натрия, очень мало растворимый в присутствии ионов натрия, в происходящих процессах практически полностью осаждается. Его отфильтровывают и сжигают для получения карбоната натрия. Ингредиенты для этой процедуры доступны по цене и широко доступны. Рассол (NaCl), аммиак (NH 3 ) и известняк (CaCO 3 ) являются тремя основными ингредиентами. CaCl 2 является значительным побочным продуктом этой процедуры.
При этом в холодный насыщенный раствор хлорида натрия вводят углекислый газ и аммиак. Гидрокарбонат натрия, очень мало растворимый в присутствии ионов натрия, в происходящих процессах практически полностью осаждается. Его отфильтровывают и сжигают для получения карбоната натрия. Ингредиенты для этой процедуры доступны по цене и широко доступны. Рассол (NaCl), аммиак (NH 3 ) и известняк (CaCO 3 ) являются тремя основными ингредиентами. CaCl 2 является значительным побочным продуктом этой процедуры.
Для представления реакций можно использовать следующее уравнение. Для его создания гидраты нагревают. Он также может образовываться при нагревании (кальцинировании) гидрокарбоната натрия, как в процессе Solvay:
2NH 3 + H 2 O + CO 2 → (NH 4 )2CO 3 029 (НХ 4 )2CO 3 + H 2 O + CO 2 → 2NH 4 HCO 3
When common salt is added to a solution containing NH 4 + and HCO 3 – , осаждается NaHCO 3 , наименее растворимый из двух. После этого отфильтровывается.
После этого отфильтровывается.
NH 4 HCO 3 + NaCl → NH 4 Cl + NaHCO 3
После этого бикарбонат натрия нагревают для получения Na 2 СО 3 .
2NaHCO 3 → Na 2 CO 3 + CO 2 + H 2 O
Полученный газ CO 2 может быть переработан.
При растворении безводного карбоната натрия в воде он перекристаллизуется с образованием кристаллов стиральной соды, которые в процессе кристаллизации включают десять молекул воды.
Свойства Na
2 CO 3 :Physical:
Na 2 CO 3 | Sodium carbonate |
Molecular Weight/ Molar Mass | 105. |
Плотность | 2,54 г/см времена |
кипящая точка | 1,600 ° C | 851 °C |
Химический
:
Гидролиз высвобождает ионы OH – (водн.), делая водные растворы карбоната натрия умеренно щелочными.
Na 2 CO 3 (с) + 2H 2 O(ж) → H 2 CO 3 (водн.) + 2Na + (водн. ) + 2OH – (водн.)
) + 2OH – (водн.)
Водные растворы карбоната натрия поглощают углекислый газ из воздуха и создают гидрокарбонат натрия.
NA 2 CO 3 (AQ) + H 2 O + CO 2 (G) → 2NAHCO 3 (aq)
Соси, карбон. как сок лайма, с образованием диоксида углерода
Na 2 CO 3 (водн.) + 2H + (водн.) → 2Na + (водн.) + H 2 O(ж) + CO 2 9 Na
CO 3 (водн.) + 2HCl (водн.) → 2NaCl (водн.) + H 2 O(л) + CO 2 (г)
NCERT Химические примечания:
4 1 NCERT Химические примечанияСтруктура карбоната натрия:
Ниже приведена схема, иллюстрирующая структуру молекул карбоната натрия. Каждая молекула карбоната натрия состоит из двух атомов натрия, трех атомов кислорода и одного атома углерода. Каждый катион натрия имеет положительный заряд, тогда как многоатомный карбонатный анион имеет отрицательный заряд. В результате карбонат натрия представляет собой нейтрально заряженную молекулу.
Каждая молекула карбоната натрия состоит из двух атомов натрия, трех атомов кислорода и одного атома углерода. Каждый катион натрия имеет положительный заряд, тогда как многоатомный карбонатный анион имеет отрицательный заряд. В результате карбонат натрия представляет собой нейтрально заряженную молекулу.
Карбонат натрия Использование карбоната натрия:
Из него делают моющие средства, мыло и бумагу.
Жидкое стекло (силикат натрия), бура, фосфат натрия и множество других солевых соединений производятся из него.
В кирпичной промышленности используется в качестве смачивающего агента.
Используется в зубной пасте как абразив и пенообразователь.
Используется в качестве регулятора pH.
Используется как умягчитель воды — карбонаты осаждают жесткую воду, содержащую ионы магния и кальция.

В качестве реагента для стандартизации в лаборатории и в качестве аналитического реагента.
Также проверка-
- NCERT Пример класс 11th Chemistry Solutions
- NCERT Пример класса 12th Cemistry Solutions
- NCERT Exemplar Solutions для всех субъектов
- NCERT Exemplar Solutions для всех субъектов
- NCERT. DTD HTML 3.0 asWedit + расширения//RU> Проекты от пещерного человека до химика: калий
Огонь был нам весьма полезен как для производства тепла, так и для преобразования материалов из одной формы в другую (например, из глины в керамику). Даже пепел оставшиеся после пожара оказываются полезными свойствами. Древние люди обнаружили что древесная зола может быть использована для очистки. Это может показаться нелогичным нас, так как мы обычно ассоциируем пепел с грязью. Но древесная зола не просто грязь.
 Основными компонентами древесной золы являются карбонат калия (поташ).
и карбонат натрия (кальцинированная сода). С химической точки зрения эти два соединения
очень похожи. Настолько похоже, что в то время как пепел использовался на протяжении тысячелетий
разница между карбонатом натрия и калия была обнаружена только в
19век. Элементы первого столбца таблицы Перидиса, содержащие
натрий и калий, называются щелочными металлами .
Основными компонентами древесной золы являются карбонат калия (поташ).
и карбонат натрия (кальцинированная сода). С химической точки зрения эти два соединения
очень похожи. Настолько похоже, что в то время как пепел использовался на протяжении тысячелетий
разница между карбонатом натрия и калия была обнаружена только в
19век. Элементы первого столбца таблицы Перидиса, содержащие
натрий и калий, называются щелочными металлами .Калий был первой базой человека. Основание — это материал, удаляющий водород. ионы (Н + ) из водного раствора. Мы также относимся к такому материалу как щелочь . Щелочи имеют горький вкус и слегка мыльное ощущение. при растирании в пальцах. Выделение щелочи предшествует изготовление настоящего мыла.
Даже сегодня карбонат калия и натрия остаются чрезвычайно важными химическими веществами. Производство только карбоната натрия в США составило 9 миллиардов кг, что делает их 11-м самый производимый химикат в США
Вы помните из проекта метатезиса, что весь натрий и калий соединения растворимы в воде.
 Когда ионное соединение растворяется в воде, оно
диссоциирует на катионы (положительные ионы) и анионы (отрицательные ионы). За
поташ пишем:
Когда ионное соединение растворяется в воде, оно
диссоциирует на катионы (положительные ионы) и анионы (отрицательные ионы). За
поташ пишем:(I) К 2 СО 3 (т) ——> 2 К + (водн.) + СО 3 2- (водн.)
Прежде чем мы продолжим, нам нужно немного обсудить химию воды. сам. Как и ионные соединения, вода обладает способностью ионизировать, т. распадаться на ионы. В любом образце воды крошечная доля воды молекулы ионизируются по реакции:
(II) H 2 O(ж) <-----> H + (водн.) + OH — (водн.)
Двойная стрелка означает, что вода находится в равновесие с ион водорода и гидроксид-ион. В любой момент времени будет много воды, присутствует немного иона водорода и немного иона гидроксида. В чистой воде при комнатной температуре, например, 1 молекула воды из 556 миллионов будет ионизированный. Поскольку одна вода распадается на одну H + и одну OH — , концентрации H + и OH — равны в нейтральном растворе.
 Когда ионное соединение растворяется в воде, оно может поглощать или выделять водород.
или гидроксид-ионы. Если чистый эффект состоит в том, что ионов водорода больше, чем ионов гидроксида,
решение называется кислый . Если там
ионов гидроксида больше, чем ионов водорода, раствор называется основным или щелочной .
Когда ионное соединение растворяется в воде, оно может поглощать или выделять водород.
или гидроксид-ионы. Если чистый эффект состоит в том, что ионов водорода больше, чем ионов гидроксида,
решение называется кислый . Если там
ионов гидроксида больше, чем ионов водорода, раствор называется основным или щелочной .Мы уже видели нашу первую кислоту. Когда вино или медовуха «скиснет», бактерии окисляют этанол до уксусной кислоты. Уксусная кислота ионизируется с образованием ионов водорода. и ацетат-ионы:
CH 3 COOH(водн.) <-----> H + (водн.) + CH 3 COO — (водн.)
В результате образуются ионы водорода, и, следовательно, раствор становится кислым. Кислый раствор имеет кислый вкус.Когда карбонат калия растворяется в воде, он ионизируется в калий и карбонат. ионы, как мы видели. Оказавшись в растворе, ионы калия просто плавают вокруг. и очень не реагируют. Мы называем такой ион ионом наблюдателей , потому что он не участвует в дальнейших химических реакциях.
 Ион карбоната,
с другой стороны, действует как основание в водном растворе, т. е. поглощает
ионы водорода везде, где он их находит. Реакция, которую мы пишем, зависит от того,
раствор изначально был кислым или щелочным. В кислом растворе пишем:
Ион карбоната,
с другой стороны, действует как основание в водном растворе, т. е. поглощает
ионы водорода везде, где он их находит. Реакция, которую мы пишем, зависит от того,
раствор изначально был кислым или щелочным. В кислом растворе пишем:(IIIa) CO 3 2- (водн.) + H + (водн.) <-----> HCO 3 — (водн.)
а в щелочном или нейтральном растворе пишем:
(IIIb) CO 3 2- (водн.) + H 2 O(л) <-----> HCO 3 — (водн.) + OH — (водн.)
Ион карбоната будет реагировать с любым видом вокруг. Если есть много ион водорода (кислый раствор) ион водорода прилипает к иону карбоната и образует новый ион, гидрокарбонат ион, или бикарбонат ион. Если вокруг не так много ионов водорода, карбонат фактически крадет ион водорода. из воды, оставляя ион гидроксида и образуя щелочной раствор. Обратите внимание, что мы снова использовали двунаправленную стрелку для обозначения равновесия.
 а не реакция, которая идет до конца.
а не реакция, которая идет до конца.Есть еще две реакции, которые еще больше усложняют картину. Во-первых, если раствор действительно кислый, ион бикарбоната также может прилипнуть к иону водорода:
(IVa) HCO 3 — (водн.) + H + (водн.) <-----> H 2 CO 3 (водн.)
или
(IVb) HCO 3 — (водн.) + H 2 O <-----> H 2 CO 3 (водн.) + OH — (водн.)H 2 CO 3 называется угольная кислота . Угольная кислота может может разлагаться на воду и углекислый газ:
(V) H 2 CO 3 (водный) <-----> H 2 О(л) + CO 2 (г)
Вы могли заметить это явление при брожении медовухи. Дрожжи производят углекислый газ. Вы можете обнаружить производство этого газа, потому что, когда бутылка запечатана, она становится под давлением. Появляется только тонкий слой пузырьков поверх мед.
 Но если крышку открыть, медовуха превращается в пенный настой.
объединяясь с пузырьками. До того, как вы открыли крышку, углекислый газ был
растворился в медовухе. Когда крышка была открыта и давление сброшено, появился углекислый газ.
из раствора, улетучивается в виде газа.
Но если крышку открыть, медовуха превращается в пенный настой.
объединяясь с пузырьками. До того, как вы открыли крышку, углекислый газ был
растворился в медовухе. Когда крышка была открыта и давление сброшено, появился углекислый газ.
из раствора, улетучивается в виде газа.Эта последовательность равновесий также активна в газированных напитках. Когда вода под давлением углекислого газа часть газа растворяется. Некоторые из растворенный газ соединяется с водой с образованием угольной кислоты. Некоторые из углеродных кислота распадается на ион водорода и ион бикарбоната. немного бикарбоната ион далее распадается на ион водорода и ион карбоната. Все пять видов будет присутствовать, но в зависимости от кислотности раствора будет больше одного чем другой.
Полезно уметь количественно определять кислотность. Для этого ученые используют шкалу рН. pH ( pee Aych ) определяется как отрицательный десятичный логарифм концентрации ионов водорода. В математика, общий журнал используется для подсчета порядка величины числа, то есть подсчитать количество нулей.
 Например, в чистой воде H + концентрация 0,0000001 моль/л. В этом числе семь нулей, а
рН 7.
Например, в чистой воде H + концентрация 0,0000001 моль/л. В этом числе семь нулей, а
рН 7.Оборотной стороной этой спецификации является OH 9.0685 — концентрация и отрицательный обыкновенный логарифм этой концентрации называется рОН ( пи-ох айч ). Поскольку вода может ионизироваться в H + и OH — , получается что pH + pOH = 14. В кислом растворе есть много ионов H + , плавающих вокруг, но ионов ОН — не очень много, и рН низкий. В нейтральном растворе имеется равное количество ионов H + и OH — , а pH равен 7. А в щелочном растворе H 9 мало0685 + ионов, много ОН — ионов, и рН высокий. Конечно, концентрация ионов зависит от концентрации раствора. Итак, чтобы провести объективное сравнение, мы следует сравнивать растворы с одинаковой общей концентрацией. Вот pH и pOH значения для нескольких растворов с концентрацией 1% (т.е. 1 грамм соединения в 100 граммах раствора):



 До 25% кальцинированной соды применяется в химической промышленности для получения бикарбоната натрия, каустической соды и других солей натрия, стекла, в анилинокрасочном и лакокрасочном производствах. Основными потребителями кальцинированной соды являются цветная и черная металлургия, нефтяная, пищевая, целлюлознобумажная, текстильная и другие отрасли промышленности.
До 25% кальцинированной соды применяется в химической промышленности для получения бикарбоната натрия, каустической соды и других солей натрия, стекла, в анилинокрасочном и лакокрасочном производствах. Основными потребителями кальцинированной соды являются цветная и черная металлургия, нефтяная, пищевая, целлюлознобумажная, текстильная и другие отрасли промышленности.

 На содовых заводах к рассолу предъявляются следующие требования: он должен быть насыщенным или близким к насыщению. Максимальная концентрация ЫаС1 в воде при 15 °С равна 317 г/л.
На содовых заводах к рассолу предъявляются следующие требования: он должен быть насыщенным или близким к насыщению. Максимальная концентрация ЫаС1 в воде при 15 °С равна 317 г/л. Аммиачная вода, поступающая с коксохимических заводов, содержит сульфид аммония, предохраняющий стальную аппаратуру и трубопроводы от коррозии. При использовании синтетической аммиачной воды в технологический процесс производства соды вместе с аммиачной водой вводят Nа2S.
Аммиачная вода, поступающая с коксохимических заводов, содержит сульфид аммония, предохраняющий стальную аппаратуру и трубопроводы от коррозии. При использовании синтетической аммиачной воды в технологический процесс производства соды вместе с аммиачной водой вводят Nа2S.
 1 показана общая технологическая схема производства кальцинированной соды по аммиачному способу.
1 показана общая технологическая схема производства кальцинированной соды по аммиачному способу. Сюда же поступает газ, предварительно промытый и очищенный, из известково-обжигательных печей 10(37—40% С02) и смешанный газ (смесь газа известково-обжигательных печей и газа содовых печей). В смешанном газе содержится 60—80% С02 — при двух вводах газа в карбонизационную колонну — и около 50% С02 —при одном вводе. Газы подают в колонну7 с помощью компрессоров 8 и 12.
Сюда же поступает газ, предварительно промытый и очищенный, из известково-обжигательных печей 10(37—40% С02) и смешанный газ (смесь газа известково-обжигательных печей и газа содовых печей). В смешанном газе содержится 60—80% С02 — при двух вводах газа в карбонизационную колонну — и около 50% С02 —при одном вводе. Газы подают в колонну7 с помощью компрессоров 8 и 12. Суспензию кристаллического бикарбоната натрия в растворе хлорида аммония и непрореагировавшего хлорида натрия направляют в вакуум-фильтр 5для выделения бикарбоната натрия. Маточную жидкость, содержащую углеаммонийные соли и хлорид аммония (фильтрат) подают из вакуум-фильтров в дистилляционную колонну 3,где осуществляется регенерация аммиака из раствора, содержащего хлорид и карбонат аммония. При нагревании раствора до 70— 80 °С карбонат аммония разлагается; разложение хлорида аммония проводят в дистиллере-смесителе 4,куда он поступает из колонны 3.
Суспензию кристаллического бикарбоната натрия в растворе хлорида аммония и непрореагировавшего хлорида натрия направляют в вакуум-фильтр 5для выделения бикарбоната натрия. Маточную жидкость, содержащую углеаммонийные соли и хлорид аммония (фильтрат) подают из вакуум-фильтров в дистилляционную колонну 3,где осуществляется регенерация аммиака из раствора, содержащего хлорид и карбонат аммония. При нагревании раствора до 70— 80 °С карбонат аммония разлагается; разложение хлорида аммония проводят в дистиллере-смесителе 4,куда он поступает из колонны 3. Этот раствор, называемый дистиллерной жидкостью, является отходом производства.
Этот раствор, называемый дистиллерной жидкостью, является отходом производства. Переход от 32°С до 35°С вызовет необратимую деформацию структуры молекулы:
Переход от 32°С до 35°С вызовет необратимую деформацию структуры молекулы: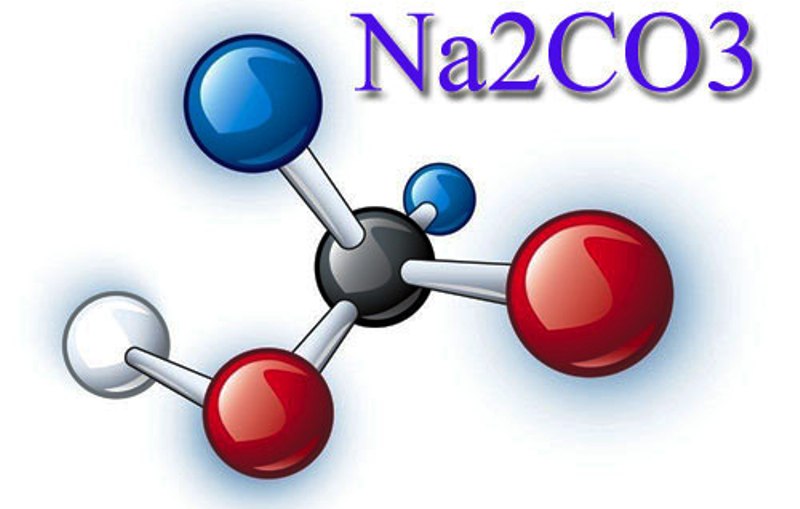 — С. 182. — 639 с. —48 000 экз. — ISBN 5-85270-039-8.
— С. 182. — 639 с. —48 000 экз. — ISBN 5-85270-039-8. Такая ошибка может быть опасна. Кальцинированная сода является сильной щелочью, в то время как обычная более мягкая и даже применяется в пищу.
Такая ошибка может быть опасна. Кальцинированная сода является сильной щелочью, в то время как обычная более мягкая и даже применяется в пищу.


 9888 g/mol
9888 g/mol
 Основными компонентами древесной золы являются карбонат калия (поташ).
и карбонат натрия (кальцинированная сода). С химической точки зрения эти два соединения
очень похожи. Настолько похоже, что в то время как пепел использовался на протяжении тысячелетий
разница между карбонатом натрия и калия была обнаружена только в
19век. Элементы первого столбца таблицы Перидиса, содержащие
натрий и калий, называются щелочными металлами .
Основными компонентами древесной золы являются карбонат калия (поташ).
и карбонат натрия (кальцинированная сода). С химической точки зрения эти два соединения
очень похожи. Настолько похоже, что в то время как пепел использовался на протяжении тысячелетий
разница между карбонатом натрия и калия была обнаружена только в
19век. Элементы первого столбца таблицы Перидиса, содержащие
натрий и калий, называются щелочными металлами . Когда ионное соединение растворяется в воде, оно
диссоциирует на катионы (положительные ионы) и анионы (отрицательные ионы). За
поташ пишем:
Когда ионное соединение растворяется в воде, оно
диссоциирует на катионы (положительные ионы) и анионы (отрицательные ионы). За
поташ пишем: Когда ионное соединение растворяется в воде, оно может поглощать или выделять водород.
или гидроксид-ионы. Если чистый эффект состоит в том, что ионов водорода больше, чем ионов гидроксида,
решение называется кислый . Если там
ионов гидроксида больше, чем ионов водорода, раствор называется основным или щелочной .
Когда ионное соединение растворяется в воде, оно может поглощать или выделять водород.
или гидроксид-ионы. Если чистый эффект состоит в том, что ионов водорода больше, чем ионов гидроксида,
решение называется кислый . Если там
ионов гидроксида больше, чем ионов водорода, раствор называется основным или щелочной . Ион карбоната,
с другой стороны, действует как основание в водном растворе, т. е. поглощает
ионы водорода везде, где он их находит. Реакция, которую мы пишем, зависит от того,
раствор изначально был кислым или щелочным. В кислом растворе пишем:
Ион карбоната,
с другой стороны, действует как основание в водном растворе, т. е. поглощает
ионы водорода везде, где он их находит. Реакция, которую мы пишем, зависит от того,
раствор изначально был кислым или щелочным. В кислом растворе пишем: а не реакция, которая идет до конца.
а не реакция, которая идет до конца. Но если крышку открыть, медовуха превращается в пенный настой.
объединяясь с пузырьками. До того, как вы открыли крышку, углекислый газ был
растворился в медовухе. Когда крышка была открыта и давление сброшено, появился углекислый газ.
из раствора, улетучивается в виде газа.
Но если крышку открыть, медовуха превращается в пенный настой.
объединяясь с пузырьками. До того, как вы открыли крышку, углекислый газ был
растворился в медовухе. Когда крышка была открыта и давление сброшено, появился углекислый газ.
из раствора, улетучивается в виде газа. Например, в чистой воде H + концентрация 0,0000001 моль/л. В этом числе семь нулей, а
рН 7.
Например, в чистой воде H + концентрация 0,0000001 моль/л. В этом числе семь нулей, а
рН 7. 0001
0001 Мы будем использовать
тестовая бумага, которая меняет цвет с синего (щелочной) на зеленый и желтый (нейтральный)
от оранжевого до красного (кислого).
Мы будем использовать
тестовая бумага, которая меняет цвет с синего (щелочной) на зеленый и желтый (нейтральный)
от оранжевого до красного (кислого). это
этот механизм, который мы постараемся использовать в этом проекте.
это
этот механизм, который мы постараемся использовать в этом проекте. В морской воде растворены
все виды вещей, растворенных в почве и камнях в районе, который стекает
в море. Некоторые из этих веществ, например хлорид натрия, обладают высокой растворимостью.
в то время как другие, такие как карбонат кальция, имеют низкую растворимость. В конце концов,
меняются геологические условия, море отрезается от океана, дренаж
модели меняются, и море начинает высыхать, возможно, в течение
из сотен тысяч лет. Мертвое море и Большое Соленое озеро
два современных примера такой ситуации. Теперь, когда море испаряется, оно становится
более концентрированным, пока не станет насыщенным наименее растворимым веществом.
содержит. Как и избыток сахара, добавленный в чай, этот наименее растворимый материал падает.
на дно и откладывается в виде слоя, возможно, карбоната кальция. Как
испарение продолжается, присутствующие вещества осаждаются в обратном порядке
их растворимости. Наконец, наиболее растворимые присутствующие вещества откладываются.
как самый верхний слой, как море отдает последнюю свою влагу.
В морской воде растворены
все виды вещей, растворенных в почве и камнях в районе, который стекает
в море. Некоторые из этих веществ, например хлорид натрия, обладают высокой растворимостью.
в то время как другие, такие как карбонат кальция, имеют низкую растворимость. В конце концов,
меняются геологические условия, море отрезается от океана, дренаж
модели меняются, и море начинает высыхать, возможно, в течение
из сотен тысяч лет. Мертвое море и Большое Соленое озеро
два современных примера такой ситуации. Теперь, когда море испаряется, оно становится
более концентрированным, пока не станет насыщенным наименее растворимым веществом.
содержит. Как и избыток сахара, добавленный в чай, этот наименее растворимый материал падает.
на дно и откладывается в виде слоя, возможно, карбоната кальция. Как
испарение продолжается, присутствующие вещества осаждаются в обратном порядке
их растворимости. Наконец, наиболее растворимые присутствующие вещества откладываются.
как самый верхний слой, как море отдает последнюю свою влагу. Осаждаемые вещества зависят от того, что присутствовало в первоначальном море, и
порядок, в котором они откладываются, зависит от их относительной растворимости.
Осаждаемые вещества зависят от того, что присутствовало в первоначальном море, и
порядок, в котором они откладываются, зависит от их относительной растворимости.
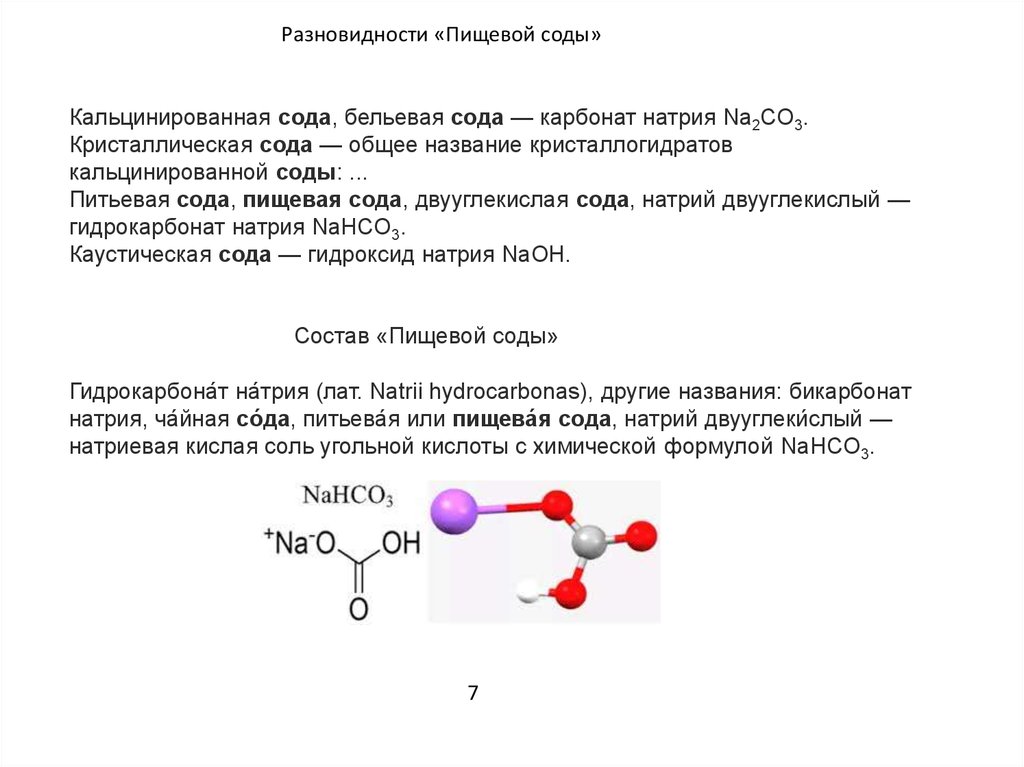 Наконец, оставшийся раствор можно слить и прокипятить до
сухости с образованием твердого карбоната калия.
Наконец, оставшийся раствор можно слить и прокипятить до
сухости с образованием твердого карбоната калия.
 Но как калий
экстрагируется, концентрируется и очищается, он становится более заслуживающим внимания.
Но как калий
экстрагируется, концентрируется и очищается, он становится более заслуживающим внимания. оставляя нерастворимые компоненты. Вам понадобится пара горстей
древесная зола, немного воды, наш старый друг, 2-литровая бутылка безалкогольного напитка и
глиняная миска, неалюминиевая кастрюля или стеклянный стакан. Первый контейнер
(бутылка 2 л) нужно только держать воду. Мы используем бутылку для безалкогольных напитков для
удобство. Второй контейнер должен быть огнестойким и водонепроницаемым. Если мы
собирались для исторической точности, мы бы использовали глиняную посуду. Но любая кастрюля
или химический стакан, который можно использовать на плите, подойдет. Не использовать
алюминиевый горшок. Алюминий реагирует с сильными основаниями и вашим проектом
будет разрушен.
оставляя нерастворимые компоненты. Вам понадобится пара горстей
древесная зола, немного воды, наш старый друг, 2-литровая бутылка безалкогольного напитка и
глиняная миска, неалюминиевая кастрюля или стеклянный стакан. Первый контейнер
(бутылка 2 л) нужно только держать воду. Мы используем бутылку для безалкогольных напитков для
удобство. Второй контейнер должен быть огнестойким и водонепроницаемым. Если мы
собирались для исторической точности, мы бы использовали глиняную посуду. Но любая кастрюля
или химический стакан, который можно использовать на плите, подойдет. Не использовать
алюминиевый горшок. Алюминий реагирует с сильными основаниями и вашим проектом
будет разрушен. Любой уголь
подарок всплывет наверх. Поместите бутылку туда, где ее никто не побеспокоит.
и оставьте на ночь.
Любой уголь
подарок всплывет наверх. Поместите бутылку туда, где ее никто не побеспокоит.
и оставьте на ночь. Это ваш продукт. Он содержит все
растворимые вещества, которые изначально присутствовали в золе. Этот
могут включать хлориды натрия и калия, сульфаты, гидроксиды,
и карбонаты. Из них только гидроксиды и карбонаты являются основными.
Я проверю ваш продукт с помощью индикаторной бумаги pH, чтобы определить, является ли он щелочным.
Это ваш продукт. Он содержит все
растворимые вещества, которые изначально присутствовали в золе. Этот
могут включать хлориды натрия и калия, сульфаты, гидроксиды,
и карбонаты. Из них только гидроксиды и карбонаты являются основными.
Я проверю ваш продукт с помощью индикаторной бумаги pH, чтобы определить, является ли он щелочным.
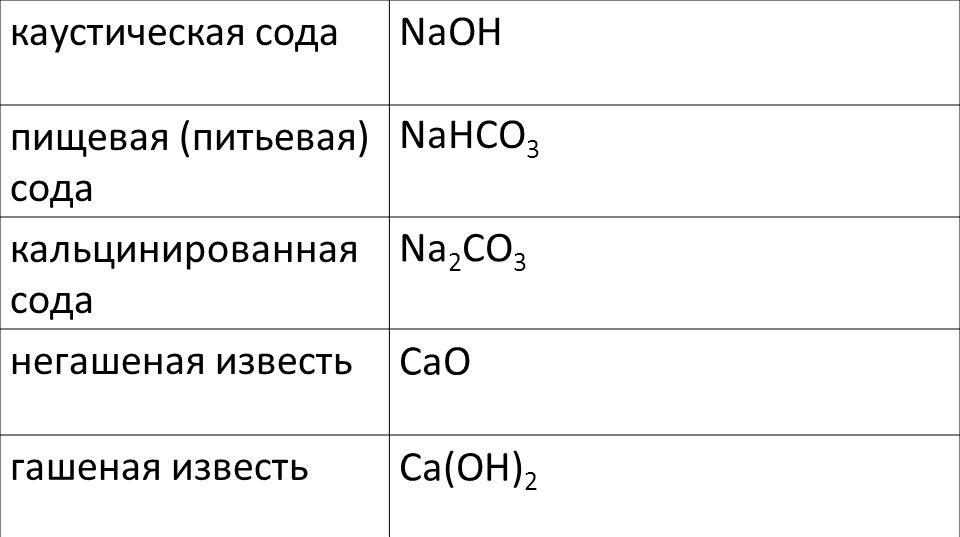 В присутствии кислот выделяет углекислый газ, из которого делают хлеб и
торт красивый и пышный. Разрыхлитель содержит пищевую соду вместе с
кислота.
В присутствии кислот выделяет углекислый газ, из которого делают хлеб и
торт красивый и пышный. Разрыхлитель содержит пищевую соду вместе с
кислота. 





