Изопропилпропионат naoh водный — NET-ALKO
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
пропилацетат X1 Ch5 X2 винилацетилен X3.
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
HBr, t∘ h3O, H+ KMnO4, h3O, t°
пропанол-1 → X1→ пропен → X2 → ацетон → X2
При написании уравнений реакций используйте структурные формулы органических веществ.
3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
4. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
h3, кат Na HCl KMnO4, h3SO4, to
Ch5 → HCHO → X1 → X2 → X1 → X3
5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Al2O3, 400o KMnO4, h3O HBr(изб.)
C2H5OH → X1 → X2 → X3 → этин → C2h5O.
6. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
h3O, Hg2+ h3, кат. KOHспиртов., to
X1 → (Сh4)2CO → X2 → (Ch4)2CHBr → X3 → X1.
7. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
h3O KMnO4 h3SO4(конц.), t∘ h4PO4(конц.)
CaC2 →X1 → K2C2O4 → X2→ HCOOK → X3
8. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Br2, свет Nh4 (изб.) HNO2 CuO, t∘ KMnO4, h3SO4
X1 → Ch4Br → X2 → X3 → h3CO → X4
9. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ch4CHCl2→Ch4CHO→h3,кат.,t∘X1→Nh4,300∘,кат.→C2H5−Nh3→CO2+h3OX2→t∘X3.
10. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
KOHспиртов., t∘ h3O, Hg2+ KMnO4, h3SO4 Cl2, свет
C2h5Br2 → X1→ X2→ Ch4COOH → X3 → h3NCh3COOH.
11. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
h3SO4(конц.), 180∘ Br2 h3O, Hg2+ h3, кат.
пропанол−1→ X1 → X2 → пропин → X3 → X4.
12. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Na 300oC, Pt KMnO4, h3SO4, t°
Циклопропан ® 1-бромпропан → X1 → X2→ толуол → X3
13. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
to, Pt KMnO4, h3O изб. HBr 2КОН (спирт.), t°
С2H5Cl → C3H8 → X1 → X2 → X3 → Х4.
14. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
NaOH(спиртов.), t° KMnO4, h3SO4, t°
Хлорбутан → X1 → пропионовая кислота → изопропилпропионат → X3
15. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
метан→1500°CX1→2Na,t° X2→бутин−2→KMnO4,h3SO4,t° →X3→хлоруксуснаякислота.
17. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C3H8→Br2,светX1→KOH+h3OX2→C3H6→Br2X3→изб.KOHспиртов.,t°X4.
18. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
ацетилен →С,t° Х1 →C2H5Cl,AlCl3 Х2 →+Cl2,свет Х3 → стирол → полистирол.
19. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ch4−CH−CH−OH→180°C h3SO4X1→HClX2→NaOH,h3OX3→ →X1→KMnO4,h3O,0∘CX4
20. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
X1→бензол→С2Н4,H+X2→KMnO4,h3SO4,t∘X3→Ch4OH,t∘,H+X4→CO2
21. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ch4C≡CAg→HClX1→HBr(изб.)X2→X1→h3O,Hg2+ацетон→h3,кат,t°X3
22. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1,3-дибромбутан →Zn Х1 → 2-бромбутан →Na Х2 →1,2-диметилбензол →KMnO4,h3SO4,t∘Х3
23. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
2-хлорбутан → бутен-2 →KMnO4,h3SO4,t∘ Х1 →Cl2(Pкр.,t∘) Х2 →→аминоуксуснаякислота→пропанол−2,H+,t∘ Х3
При написании уравнений реакций используйте структурные формулы органических веществ.
24. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
h3C=Ch3→0°KMnO4,h3OX1→2HBrX2→CH≡CH→h3O(Hg2+),t°→X3→Cu(OH)2,t°X4
25. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Этилат калия →h3O X1 → хлорэтан → X2 → этиленгликоль →Ch4COOH,H+ X3
26. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
HC≡CH→h3O(Hg2+)X1→KMnO4,h3SO4,t°Ch4COOH→NaOHX2→Ch4IX3→h3O(H+)уксуснаякислота.
27. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Na t°, Pt Ch4Cl, AlCl3 KMnO4, h3SO4 NaOH
1-бромпропан → X1 → X2 → X3 → C6H5COOH → X4
28. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
29. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
30. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
NaOH, h3O NaOH NaOH, t∘ 1500 ∘C
бромэтан → Х1 → СН3СООН → Х2 → Х3 → Х4
31. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C6h22O6 → брожение →Х1 → KMnO4,h3SO4, t∘ →СН3СООН → NaOH →Х2 −→ NaOH, t →Х3 → HNO3(р-р), t →Х4
При написании уравнений реакций используйте структурные формулы органических веществ. Для глюкозы допустимо использование молекулярной формулы.
32. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
X1 →Br 2→бромэтан → KOH, h3O, t∘ →X2 → K2Cr2O7, h3SO4 → ацетальдегид → Х2 → бутадиен-1,3
33. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
бутират натрия → NaOH, t∘ →Х1 → 2-бромпропан → спирт.KOH, t∘ →Х2 →H+h3O → Х3 → h3SO4, t∘KMnO4 →Х4
34. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
35. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
36. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Сh4−Ch3−Ch3−Ch4 → Br 2, hν →X1→ KOH(спирт.), t° X2 →Br 2 → X3→ KOH(спирт),изб., t° → Ch4C≡CCh4 → h3O,Hg2+ →X4
37. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C2h5 → этиленгликоль → изб. HBr →Х1 →изб. KOH(спирт.), t∘ →Х2 → СН3СНО → Cu(OH)2 →Х3
При написании уравнений реакций используйте структурные формулы органических веществ.
38. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ch4COONa → Ch5 → X1 → C6H6 → X2 → KOH, KMnO4, t∘ → C6H5COOK
При написании уравнений реакций используйте структурные формулы органических веществ.
studepedia.org
Синонимы названий
Следует отметить, что название этого вещества неодинаково и имеет несколько синонимов. Всего можно обозначить 6 разных вариантов:
- гидроксид натрия;
- натр едкий;
- сода каустическая;
- натриевая щелочь;
- каустик;
- едкая щелочь.
Каустической содой данное соединение называют в простонародье и промышленности. В химических синтезах более правильно говорить натриевая щелочь или едкий натр. Формула от этого не меняется. Самое обыденное название — каустик. Правильным с точки зрения систематической номенклатуры веществ является название гидроксид натрия.
Химическая формула и строение молекулы
Если рассматривать данное вещество с точки зрения химии, то оно будет состоять из двух ионов: катиона натрия (Na+) и гидроксид-аниона (ОН-). Связываясь между собой за счет электростатического притяжения разнозаряженных частиц, данные ионы формируют едкий натр. Формула эмпирического вида будет NaOH.
Гидроксогруппа образована ковалентной полярной связью между кислородом и водородом, при этом с натрием она удерживается ионной связью. В растворе щелочь полностью диссоциирует на ионы, являясь сильным электролитом.
Области применения
Существует достаточно много отраслей, в которых актуален едкий натр. Применение основано на его химических и физических свойствах, делающих данное соединение незаменимым во многих синтезах и процессах.
Можно выделить несколько основных областей, в которых гидроксид натрия — обязательный элемент.
- Химическое производство (синтез сложных эфиров, мыла, жиров, получение волокон, травление алюминия, для получения продуктов нефтепереработки, как катализатор во многих процессах; является основным веществом для нейтрализации кислот и соответствующих им оксидов; в аналитической химии применяется для титрования; также используется для получения чистых металлов, многих солей, других оснований и органических соединений).
- При производстве бумаги для обработки целлюлозы древесины (избавления от древесного вещества лигнина).
- В хозяйственной деятельности человека также незаменим едкий натр. Применение многочисленных моющих и чистящих средств на его основе очень актуально. Мыловарение, получение шампуней — все это не обходится без каустической соды.
- Необходим для синтеза биотоплива.
- Применяется в государственных масштабах для дегазации и нейтрализации отравляющих веществ, воздействующих на организмы.
- Производство лекарств и наркотических средств.
- Пищевая отрасль — кондитерские изделия, шоколад, какао, мороженое, окрашивание конфет, маслин, выпечка хлебобулочных изделий.
- В косметологии для удаления инородных образований (родинки, папилломы, бородавки).
- Используется на ликеро-водочных и табачных комбинатах.
- В текстильной промышленности.
- Производство стекла: цветного, обычного, оптического и прочего. Очевидно, что гидроксид натрия — очень важное и полезное в деятельности человека вещество. Совершенно не зря оно синтезируется в мире ежегодно в тоннах — 57 миллионов и более.
Физические свойства
Белое порошкообразное вещество, иногда бесцветное. Может быть в виде мелкокристаллического порошка либо в виде хлопьев. Чаще в форме крупных кристаллов. Температура плавления достаточно низкая — 65,1оС. Очень быстро поглощает влагу и переходит в гидратированную форму NaOH·3,5Н2О. В этом случае температура плавления еще меньше, всего 15,5оС. Практически неограниченно растворяется в спиртах, воде. На ощупь как твердое вещество, так и жидкое мылкое.
Очень опасное в концентрированном и разбавленном виде. Способно повреждать все оболочки глаза, вплоть до зрительных нервов. Попадание в глаза может закончиться слепотой. Поэтому работа с данным соединением крайне опасна и требует защитных приспособлений.
Химические свойства
Едкий натр свойства проявляет точно такие же, как и все щелочи: взаимодействует с кислотами, кислотными оксидами, амфотерными оксидами и гидроксидами, солями. Из неметаллов вступает в реакции с серой, фосфором и галогенами. Также способен реагировать с металлами. В органической химии гидроксид натрия вступает во взаимодействие с амидами, эфирами, галогензамещенными алканами.
Условия хранения
Хранение натра едкого осуществляется по определенным условиям. Это объясняется тем, что он крайне реакционноспособен, особенно, когда помещение влажное.
- Основными условиями можно назвать следующие.
- Хранение вдали от отопительных приборов.
- Герметично закрытые и запаянные упаковки, не способные пропускать влагу.
Сухой кристаллический каустик хранится в мешках специального состава (плотный полиэтилен), жидкий — в темной стеклянной таре с притертыми пробками. Если же количество его большое и требует транспортировки, то раствор натра едкого помещают в специальные стальные контейнеры и канистры.
Перевозить данное вещество можно любым известным способом с соблюдением правил техники безопасности, исключая транспортировку по воздуху.
Жидкая натриевая щелочь
Помимо кристаллического, существует еще водный раствор едкого натра. Формула его та же, что и для твердого. В химическом отношении растворы более применимы и удобны в использовании. Поэтому в такой форме каустик используется чаще.
Раствор едкого натра, формула которого — NaOH, находит применение во всех вышеперечисленных областях. Он неудобен только при транспортировании, так как перевозить лучше сухой каустик. По всем остальным свойствам нисколько не уступает кристаллам, а в некоторых и превосходит их.
waterhim.su
net-alko.site
Изопропилпропионат naoh водный — NET-ALKO
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
пропилацетат X1 Ch5 X2 винилацетилен X3.
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
HBr, t∘ h3O, H+ KMnO4, h3O, t°
пропанол-1 → X1→ пропен → X2 → ацетон → X2
При написании уравнений реакций используйте структурные формулы органических веществ.
3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
4. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
h3, кат Na HCl KMnO4, h3SO4, to
Ch5 → HCHO → X1 → X2 → X1 → X3
5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Al2O3, 400o KMnO4, h3O HBr(изб.)
C2H5OH → X1 → X2 → X3 → этин → C2h5O.
6. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
h3O, Hg2+ h3, кат. KOHспиртов., to
X1 → (Сh4)2CO → X2 → (Ch4)2CHBr → X3 → X1.
7. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
h3O KMnO4 h3SO4(конц.), t∘ h4PO4(конц.)
CaC2 →X1 → K2C2O4 → X2→ HCOOK → X3
8. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Br2, свет Nh4 (изб.) HNO2 CuO, t∘ KMnO4, h3SO4
X1 → Ch4Br → X2 → X3 → h3CO → X4
9. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ch4CHCl2→Ch4CHO→h3,кат.,t∘X1→Nh4,300∘,кат.→C2H5−Nh3→CO2+h3OX2→t∘X3.
10. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
KOHспиртов., t∘ h3O, Hg2+ KMnO4, h3SO4 Cl2, свет
C2h5Br2 → X1→ X2→ Ch4COOH → X3 → h3NCh3COOH.
11. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
h3SO4(конц.), 180∘ Br2 h3O, Hg2+ h3, кат.
пропанол−1→ X1 → X2 → пропин → X3 → X4.
12. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Na 300oC, Pt KMnO4, h3SO4, t°
Циклопропан ® 1-бромпропан → X1 → X2→ толуол → X3
13. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
to, Pt KMnO4, h3O изб. HBr 2КОН (спирт.), t°
С2H5Cl → C3H8 → X1 → X2 → X3 → Х4.
14. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
NaOH(спиртов.), t° KMnO4, h3SO4, t°
Хлорбутан → X1 → пропионовая кислота → изопропилпропионат → X3
15. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
метан→1500°CX1→2Na,t° X2→бутин−2→KMnO4,h3SO4,t° →X3→хлоруксуснаякислота.
16. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
17. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C3H8→Br2,светX1→KOH+h3OX2→C3H6→Br2X3→изб.KOHспиртов.,t°X4.
18. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
ацетилен →С,t° Х1 →C2H5Cl,AlCl3 Х2 →+Cl2,свет Х3 → стирол → полистирол.
19. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ch4−CH−CH−OH→180°C h3SO4X1→HClX2→NaOH,h3OX3→ →X1→KMnO4,h3O,0∘CX4
20. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
X1→бензол→С2Н4,H+X2→KMnO4,h3SO4,t∘X3→Ch4OH,t∘,H+X4→CO2
21. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ch4C≡CAg→HClX1→HBr(изб.)X2→X1→h3O,Hg2+ацетон→h3,кат,t°X3
22. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1,3-дибромбутан →Zn Х1 → 2-бромбутан →Na Х2 →1,2-диметилбензол →KMnO4,h3SO4,t∘Х3
23. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
2-хлорбутан → бутен-2 →KMnO4,h3SO4,t∘ Х1 →Cl2(Pкр.,t∘) Х2 →→аминоуксуснаякислота→пропанол−2,H+,t∘ Х3
При написании уравнений реакций используйте структурные формулы органических веществ.
24. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
h3C=Ch3→0°KMnO4,h3OX1→2HBrX2→CH≡CH→h3O(Hg2+),t°→X3→Cu(OH)2,t°X4
25. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Этилат калия →h3O X1 → хлорэтан → X2 → этиленгликоль →Ch4COOH,H+ X3
26. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
HC≡CH→h3O(Hg2+)X1→KMnO4,h3SO4,t°Ch4COOH→NaOHX2→Ch4IX3→h3O(H+)уксуснаякислота.
27. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Na t°, Pt Ch4Cl, AlCl3 KMnO4, h3SO4 NaOH
1-бромпропан → X1 → X2 → X3 → C6H5COOH → X4
28. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
29. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
30. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
NaOH, h3O NaOH NaOH, t∘ 1500 ∘C
бромэтан → Х1 → СН3СООН → Х2 → Х3 → Х4
31. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C6h22O6 → брожение →Х1 → KMnO4,h3SO4, t∘ →СН3СООН → NaOH →Х2 −→ NaOH, t →Х3 → HNO3(р-р), t →Х4
При написании уравнений реакций используйте структурные формулы органических веществ. Для глюкозы допустимо использование молекулярной формулы.
32. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
X1 →Br 2→бромэтан → KOH, h3O, t∘ →X2 → K2Cr2O7, h3SO4 → ацетальдегид → Х2 → бутадиен-1,3
33. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
бутират натрия → NaOH, t∘ →Х1 → 2-бромпропан → спирт.KOH, t∘ →Х2 →H+h3O → Х3 → h3SO4, t∘KMnO4 →Х4
34. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
35. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
36. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Сh4−Ch3−Ch3−Ch4 → Br 2, hν →X1→ KOH(спирт.), t° X2 →Br 2 → X3→ KOH(спирт),изб., t° → Ch4C≡CCh4 → h3O,Hg2+ →X4
37. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C2h5 → этиленгликоль → изб. HBr →Х1 →изб. KOH(спирт.), t∘ →Х2 → СН3СНО → Cu(OH)2 →Х3
При написании уравнений реакций используйте структурные формулы органических веществ.
38. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ch4COONa → Ch5 → X1 → C6H6 → X2 → KOH, KMnO4, t∘ → C6H5COOK
При написании уравнений реакций используйте структурные формулы органических веществ.
studepedia.org
Синонимы названий
Следует отметить, что название этого вещества неодинаково и имеет несколько синонимов. Всего можно обозначить 6 разных вариантов:
- гидроксид натрия;
- натр едкий;
- сода каустическая;
- натриевая щелочь;
- каустик;
- едкая щелочь.
Каустической содой данное соединение называют в простонародье и промышленности. В химических синтезах более правильно говорить натриевая щелочь или едкий натр. Формула от этого не меняется. Самое обыденное название — каустик. Правильным с точки зрения систематической номенклатуры веществ является название гидроксид натрия.
Химическая формула и строение молекулы
Если рассматривать данное вещество с точки зрения химии, то оно будет состоять из двух ионов: катиона натрия (Na+) и гидроксид-аниона (ОН-). Связываясь между собой за счет электростатического притяжения разнозаряженных частиц, данные ионы формируют едкий натр. Формула эмпирического вида будет NaOH.
Гидроксогруппа образована ковалентной полярной связью между кислородом и водородом, при этом с натрием она удерживается ионной связью. В растворе щелочь полностью диссоциирует на ионы, являясь сильным электролитом.
Области применения
Существует достаточно много отраслей, в которых актуален едкий натр. Применение основано на его химических и физических свойствах, делающих данное соединение незаменимым во многих синтезах и процессах.
Можно выделить несколько основных областей, в которых гидроксид натрия — обязательный элемент.
- Химическое производство (синтез сложных эфиров, мыла, жиров, получение волокон, травление алюминия, для получения продуктов нефтепереработки, как катализатор во многих процессах; является основным веществом для нейтрализации кислот и соответствующих им оксидов; в аналитической химии применяется для титрования; также используется для получения чистых металлов, многих солей, других оснований и органических соединений).
- При производстве бумаги для обработки целлюлозы древесины (избавления от древесного вещества лигнина).
- В хозяйственной деятельности человека также незаменим едкий натр. Применение многочисленных моющих и чистящих средств на его основе очень актуально. Мыловарение, получение шампуней — все это не обходится без каустической соды.
- Необходим для синтеза биотоплива.
- Применяется в государственных масштабах для дегазации и нейтрализации отравляющих веществ, воздействующих на организмы.
- Производство лекарств и наркотических средств.
- Пищевая отрасль — кондитерские изделия, шоколад, какао, мороженое, окрашивание конфет, маслин, выпечка хлебобулочных изделий.
- В косметологии для удаления инородных образований (родинки, папилломы, бородавки).
- Используется на ликеро-водочных и табачных комбинатах.
- В текстильной промышленности.
- Производство стекла: цветного, обычного, оптического и прочего. Очевидно, что гидроксид натрия — очень важное и полезное в деятельности человека вещество. Совершенно не зря оно синтезируется в мире ежегодно в тоннах — 57 миллионов и более.
Физические свойства
Белое порошкообразное вещество, иногда бесцветное. Может быть в виде мелкокристаллического порошка либо в виде хлопьев. Чаще в форме крупных кристаллов. Температура плавления достаточно низкая — 65,1оС. Очень быстро поглощает влагу и переходит в гидратированную форму NaOH·3,5Н2О. В этом случае температура плавления еще меньше, всего 15,5оС. Практически неограниченно растворяется в спиртах, воде. На ощупь как твердое вещество, так и жидкое мылкое.
Очень опасное в концентрированном и разбавленном виде. Способно повреждать все оболочки глаза, вплоть до зрительных нервов. Попадание в глаза может закончиться слепотой. Поэтому работа с данным соединением крайне опасна и требует защитных приспособлений.
Химические свойства
Едкий натр свойства проявляет точно такие же, как и все щелочи: взаимодействует с кислотами, кислотными оксидами, амфотерными оксидами и гидроксидами, солями. Из неметаллов вступает в реакции с серой, фосфором и галогенами. Также способен реагировать с металлами. В органической химии гидроксид натрия вступает во взаимодействие с амидами, эфирами, галогензамещенными алканами.
Условия хранения
Хранение натра едкого осуществляется по определенным условиям. Это объясняется тем, что он крайне реакционноспособен, особенно, когда помещение влажное.
- Основными условиями можно назвать следующие.
- Хранение вдали от отопительных приборов.
- Герметично закрытые и запаянные упаковки, не способные пропускать влагу.
Сухой кристаллический каустик хранится в мешках специального состава (плотный полиэтилен), жидкий — в темной стеклянной таре с притертыми пробками. Если же количество его большое и требует транспортировки, то раствор натра едкого помещают в специальные стальные контейнеры и канистры.
Перевозить данное вещество можно любым известным способом с соблюдением правил техники безопасности, исключая транспортировку по воздуху.
Жидкая натриевая щелочь
Помимо кристаллического, существует еще водный раствор едкого натра. Формула его та же, что и для твердого. В химическом отношении растворы более применимы и удобны в использовании. Поэтому в такой форме каустик используется чаще.
Раствор едкого натра, формула которого — NaOH, находит применение во всех вышеперечисленных областях. Он неудобен только при транспортировании, так как перевозить лучше сухой каустик. По всем остальным свойствам нисколько не уступает кристаллам, а в некоторых и превосходит их.
waterhim.su
net-alko.site
Формула Изопропилового спирта структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: C3H8O
Химический состав Изопропилового спирта
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12,011 | 3 | 60% |
| H | Водород | 1,008 | 8 | 13,4% |
| O | Кислород | 15,999 | 1 | 26,6% |
Молекулярная масса: 60,096
Изопропиловый спирт, пропанол-2 (2-пропанол), втор-пропанол, изопропанол, диметилкарбинол, ИПС — простейший вторичный одноатомный спирт алифатического ряда. Существует изомер изопропанола — пропанол-1.
Прозрачная, бесцветная жидкость с резким запахом и мягким горьким вкусом.
Изопропиловый спирт используется в качестве заменителя этилового спирта в косметике, парфюмерии, бытовой химии, автохимии, медицинских изделиях, в средствах для очистки стёкол, оргтехники и как растворитель в промышленности.
В развитых странах пропанол-2 широко используется в товарах личной гигиены и в медицине, благодаря низкой токсичности. 75 % Водный раствор диметилкарбинола используется как дезинфицирующее средство для рук. Вода способствует проникновению сквозь мембраны пор бактерий, таким образом обеспечивая высокую эффективность и более качественное обеззараживание. Изопропиловый спирт используется в качестве вспомогательного компонента профилактического средства от наружного отита.
Как и все спирты, огнеопасен, токсичен, требует осторожного отношения. Эффективен для лечения дерматита в качестве средства для протирания пораженных участков кожи, негативное влияние на кожу не отмечается.
Свойства
Химические свойства
Химическая формула (рациональная) изопропилового спирта: CH3CH(OH)CH3.
Изопропанол обладает свойствами вторичных спиртов жирного ряда, в том числе образует простые и сложные эфиры. Гидроксильная группа может быть вытеснена представителями ряда галогенов. С ароматическими соединениями изопропиловый спирт конденсируется с образованием производных, таких как изопропилбензол и изопропилтолуол. В изопропаноле хорошо растворяются многие эфирные масла, алкалоиды, некоторые синтетические смолы и другие химические соединения. При дегидрировании превращается в ацетон.
Реагирует с сильными окислителями. Агрессивен в отношении некоторых видов пластика и резины.
Физические свойства
Бесцветная жидкость с характерным спиртовым запахом, более резким, чем у этанола (по этому признаку их можно в некоторых случаях отличить), tплавления −89,5 °C, tкипения 82,4 °C, плотность 0,7851 г/см³ (при 20 °C), tвспышки 11,7 °C. Нижний предел взрываемости в воздухе 2,5 % по объёму (при 25 °C). Температура самовоспламенения 456 °C. Коэффициент преломления 1,3776 (в жидком состоянии, при 20 °C). Динамическая вязкость при стандартных условиях 2,43 мПа·с. Молярная теплоёмкость (ст. усл.) — 155,2 Дж/(моль·К).
Пар хорошо смешивается с воздухом, легко образует взрывчатые смеси. Давление паров — 4,4 кПа (при 20 °C). Относительная плотность пара — 2,1, относительная плотность смеси пар/воздух — 1,05 (при 20 °C).
Растворим в ацетоне, хорошо растворим в бензоле, с остальными растворителями (вода, органические вещества) смешивается в любых соотношениях. С водой образует азеотропную смесь (87,9 % изопропилового спирта, tкипения 80,2 °C).
Зависимость температуры замерзания смеси изопропилового спирта с водой от концентрации изопропилового спирта в смеси представлена в таблице:
| Концентрация спирта об % |
Концентрация спирта вес % |
Температура замерзания °C |
|---|---|---|
| 0 | 0 | 0 |
| 10 | 8 | -4 |
| 20 | 17 | -7 |
| 30 | 26 | -15 |
| 40 | 34 | -18 |
| 50 | 44 | -21 |
| 60 | 54 | -23 |
| 70 | 65 | -29 |
| 80 | 76 | -37* |
| 90 | 88 | -57* |
| 100 | 100 | -90* |
Получение
Существует два метода промышленного производства изопропанола — гидрирование ацетона и гидратация пропилена.
Основным способом получения изопропанола в Российской промышленности является сернокислотная гидратация пропилена
CH3CH=CH2 + H2SO4 → (CH3)2CHOSO3H + H2O → (CH3)2CHOH.
Сырьем может служить пропан-пропиленовая фракция с содержанием пропилена 30-90 % (фракция пиролиза и крекинга нефти). Однако наблюдается тенденция к использованию чистого пропилена, так как в этом случае процесс можно вести при невысоких давлениях, резко снижается образование побочных продуктов реакции — полимеров и ацетона. На первой стадии процесса образуется сернокислотный экстракт, содержащий равновесную смесь изопропилового спирта, изопропилсульфата (CH3)2CHOSO2OH, H2SO4 и H2O, на второй — сернокислотный экстракт нагревается с водой и удаляется образующийся изопропиловый спирт. Прямую гидратацию пропилена осуществляют в основном в присутствии твердого катализатора (в скобках указаны условия процессов): Н3РО4 на носителе (240—260°С; 2,5-6,5 МПа) или катионообменной смолы (130—160°С; 8,0-10,0 МПа). Изопропиловый спирт получают также окислением парафинов воздухом и другими способами.
Современный способ:
{CH3COCH3 + H2 →kat CH3CH(OH)CH3
Гидрирование ацетона водородом (в фазе пара) в присутствии стационарного медно-никельхромитного катализатора.
В России изопропанол производят из пропилена на ЗАО «Завод синтетического спирта» (г. Орск) и методом гидрирования ацетона водородом — ООО «Синтез Ацетон», (г. Дзержинск)
Применение
Изопропиловый спирт используют для получения:
По причине особого государственного регулирования этанола, изопропиловый спирт часто является его заменителем во многих областях его применения. Так, изопропанол входит в состав:- косметики
- парфюмерии
- бытовой химии
- дезинфицирующих средств
- средства для автомобилей (антифриз, растворитель в зимних стеклоомывателях)
- Репеллентов
- промывок печатных плат после пайки с флюсом, продается под названием «Очиститель универсальный».
Медицина
70 % изопропиловый спирт применяется вместо этилового спирта как антисептик для пропитки медицинских салфеток.
Влияние на человека
Ингаляционное.
Предельно допустимая концентрация (ПДК) паров изопропанола в воздухе рабочей зоны составляет 10 мг/м³ (ГОСТ 9805-84), в атмосферном воздухе населенных мест 0.6 мг/м³(ГН 2.1.6.1338-03). Не накапливается в организме, то есть кумулятивными свойствами не обладает. Необходимо отметить, что изопропиловый спирт значительно менее летуч, чем, например, этанол, и для достижения больших концентраций его паров необходима значительно большая площадь разлива и испарения. Благодаря этому свойству, изопропиловый спирт заменил этиловый в парфюмерии, дезинфицирующих составах, стеклоомывателях и незамерзающих жидкостях.
Изопропанол горюч. При горении даёт яркое пышное пламя, полностью разлагается на простые составляющие — воду и углекислый газ, не вызывая раздражений и иных побочных эффектов. Горение изопропанола не выделяет вредных веществ, копоти и пр.
Испарение изопропанола из емкости с площадью менее 20 см² в помещении более 30 м³ при температуре 30 °C и ниже не вызывает негативных реакций.
Пероральное.
Отравления изопропанолом случайны и в основном происходят с детьми младше 6 лет. Летальный исход от отравления изопропанолом происходит крайне редко.
Небольшие дозы изопропанола, как правило, не вызывают значительных расстройств. Серьёзное токсическое воздействие на здорового взрослого человека при пероральном употреблении может быть достигнуто при дозах порядка 50 мл и более. Изопропанол при приеме внутрь метаболизируется в печени под действием алкогольдегидрогеназы в ацетон, что обусловливает его токсическое действие.
При приеме внутрь вызывает опьянение, сходное с алкогольным. Хотя токсичность изопропанола примерно в 3,5 раза выше, чем у этанола, его опьяняющее действие также выше, но уже в 10 раз. По этой причине смертельные отравления изопропанолом, в сравнении с отравлениями от этилового спирта, случаются реже, так как человек впадает в алкогольный транс гораздо раньше, чем сможет самостоятельно принять смертельную дозу изопропанола (если только не выпил единовременно от 500 мл).
Биологический полураспад изопропилового спирта в организме человека составляет от 2,5 до 8 часов.
Наркотические свойства
Изопропиловый спирт обладает наркотическим действием. Наркотический эффект изопропанола почти в 2 раза превышает аналогичный эффект этанола. Концентрация 1,2 %, воздействующая в течение 4 часов, оказывает опьяняющее действие.
При длительном воздействии больших концентраций паров вызывает головную боль, оказывает раздражающее воздействие на глаза и дыхательные пути. Для достижения данного эффекта потребуется находиться в течение длительного времени в непроветриваемом помещении с большой площадью разлива изопропанола. Может оказывать угнетающее действие на центральную нервную систему. Воздействие на уровне, значительно превышающем ПДК, может вызвать потерю сознания. Отравление изопропиловым спиртом возникает нечасто.
formula-info.ru
Изопропилпропионат — Справочник химика 21
| Рис. 41. Хроматограмма разделения смеси этилацетата, этил-пропионата и изопропилпропионата с использованием в качестве вытеснителя ж-ксилола при 75° С на колонне с активированным |
Диметил-1,4-диоксан ИзобуТИЛ ацетат Изопропилпропионат Метилвалерат Метилизовалерат 2-Метил-2-пентанол-4-он Метилпивалат Этилизобутират [c.105]
Диметил-1,4-диоксан Изобутилацетат Изопропилпропионат Метилвалерат Метилизовалерат [c.154]
Изопропилпропионат [156, 157]. При облучении полным светом ртутной лампы к [c.355]
Изопропилпропионат см. Изопропиловый эфир пропионовой кислоты Изопропилсалицилат см. Изопропиловый эфир салициловой кислоты Изопропилсорбат см. Изопропиловый. эфир сорбиновой кислоты [c.224]
Сложные эфиры с общей химической формулой приведены по возрастанию иисла атомов углерода в молекуле спирта, напрпмер метилизовалерат, этилизо-бутират, этилбутират, изопропилпропионат и т. д. [c.26]
Диамиловый эфнр 4-Метил-2-пентанон (метн Метилизовалерат Этилизобутират Этилбутират Изопропилпропионат Изобутилацетат Бутилацетат 4-МетиЛ -2-пентанол Дипропиламин Толуол [c.535]
Что произойдет при действии раствора этилата натрия на этилизовалерат, изопропилпропионат, этилизобутират, изомасля-ный альдегид, бензальдегид [c.111]
Этилизовалерат и изопропилпропионат подвергнутся сложноэфирной конденсации, этилизобутират останется неизмененным (см. ответ 53) изомасляный альдегид (см. ответ 50) и бензальдегид вступят в реакцию Каниццарро. [c.125]
Получение кетонов с использованием в качестве источника водорода воды и углеводородов не дало заметного эффекта с точки зрения улучшения основных показателей процесса. Зато при применении спиртов были получены достаточно интересные результаты. Так, при исследовании реакции взаимодействия этилена с окисью углерода и изопропиловым спиртом в присутствии карбонилов кобальта 1414] было показано, что реакция может быть направлена как в сторону образования изопропилпропионата (гидрокарбалкоксилирование), так и в сторону образования диэтилкетона. Селективное образование диэтилкетона наблюдалось при высоких концентрациях этилена, малых концентрациях изопропилового спирта и повышенных температурах (табл. 6.14). [c.244]
chem21.info
Изопропилпропионат — Помогите, пожалуйста, с химией. — 22 ответа
Изопропилпропионат naoh водный
В разделе Естественные науки на вопрос Помогите, пожалуйста, с химией. заданный автором Ёельдерея Сельдеревна)) лучший ответ это Нужно провести этерификацию изопропиловым спиртом (используя в качестве катализатора сильную кислоту, какую именно, значения не имеет, но удобнее всего использовать серную, так как она не приводит к образованию побочных продуктов) .
СН3-СН2-СООН + (СН3)2СН-ОН ——> СН3-СН2-СОО-СН (СН3)2 + Н2О.
Что касается замечания Котеньки, что не «пропионат», то дело вот в чем:
Издавна кислоту СН3-СН2-СООН называли «пропионовой», а ее соли и эфиры — пропионатами. По современным правилам эта кислота называется «пропановой», а ее производные — «пропаноатами». Но это современное название приживается с трудом, большинство химиков по-прежнему используют название «пропионовая», вот даже в твоем задачнике она названа «пропионовой», а не «пропановой».
Зависит от условий. При проведении реакции в водном растворе образуется комплексный ион [Cr(OH)4](-), а при очень высоких значениях рН даже [Cr(OH)6](3-) по уравнениям:
Cr(OH)3 + NaOH ——> Na[Cr(OH)4]
и Cr(OH)3 + 3 NaOH ——> Na3[Cr(OH)6.
В литературе встречаются оба варианта. Но в статье в википедии () дана картинка — схема состояния хрома в зависимости от рН и окислительно-восстановительного потенциала среды, На этой картинке область, соответствующая [Cr(OH)6](3-) даже не показана. То ли эта область лежит гораздо правее, то ли автор диаграммы считает, что [Cr(OH)6](3-) вообще не образуется.
При сплавлении в безводных условиях (или при упаривании раствора Na[Cr(OH)4] и прокаливании остатка) образуется хромит натрия:
Cr(OH)3 + NaOH ——> NaCrO2 + 2 h3O
Na[Cr(OH)4] ——> NaCrO2 + 2 h3O.
Соль NaCrO2 называется хромИт натрия. В задаче либо опечатка, и должно быть именно хромит натрия, либо забыли добавить слева окислитель, например Н2О2. Тогда получится именно хромАт натрия:
2 Cr(OH)3 + 4 NaOH + 3 Н2О2 ——> 2 Na2CrO4 + 8 Н2О.
Привет! Вот подборка тем с ответами на Ваш вопрос: Помогите, пожалуйста, с химией.
Ответ от Котенька…[гуру]
1) Сколько шагов и какие реактивы?
2)В растворе (на условия-тьфу?), и не хромат…
Ответ от 2 ответа[гуру]
Привет! Вот еще темы с нужными ответами:
Ответить на вопрос:
22oa.ru
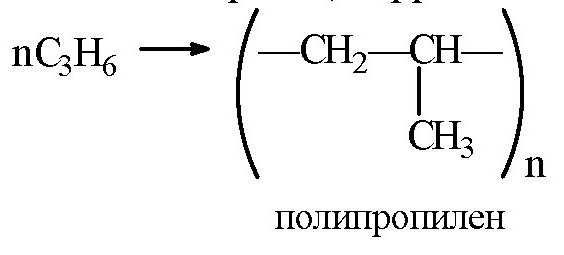
Полимеризация пропилена: схема, уравнение, формула
Что представляет собой полимеризация пропилена? Каковы особенности протекания данной химической реакции? Попробуем найти развёрнутые ответы на эти вопросы.

Характеристика соединений
Схемы реакций полимеризации этилена и пропилена демонстрируют типичные химические свойства, которыми обладают все представители класса олефинов. Такое необычное название данный класс получил от старого названия масла, используемого в химическом производстве. В 18 веке был получен хлористый этилен, который представлял собой маслянистое жидкое вещество.
Среди особенностей всех представителей класса непредельных алифатических углеводородов отметим наличие в них одной двойной связи.
Радикальная полимеризация пропилена объясняется именно присутствием в структуре вещества двойной связи.

Общая формула
У всех представителей гомологического ряда алкенов общая формула имеет вид СпН2п. Недостаточное количество водородов в структуре объясняет особенность химических свойств этих углеводородов.
Уравнение реакции полимеризации пропилена является прямым подтверждением возможности разрыва по такой связи при использовании повышенной температуры и катализатора.
Непредельный радикал называется аллилом или пропенилом-2. Зачем проводится полимеризация пропилена? Продукт этого взаимодействия применяется для синтеза синтетического каучука, который, в свою очередь, востребован в современной химической промышленности.
Физические свойства
Уравнение полимеризации пропилена подтверждает не только химические, но и физические свойства данного вещества. Пропилен является газообразным веществом с невысокими температурами кипения и плавления. Данный представитель класса алкенов имеет незначительную растворимость воде.

Химические свойства
Уравнения реакции полимеризации пропилена и изобутилена показывают, что процессы протекают по двойной связи. В качестве мономеров выступают алкены, а конечными продуктами такого взаимодействия будут полипропилен и полиизобутилен. Именно углерод-углеродная связь при подобном взаимодействии будет разрушаться, и в конечном итоге будет образовываться соответствующие структуры.
По двойной связи происходит образование новых простых связей. Как протекает полимеризация пропилена? Механизм данного процесса аналогичен процессу, протекающему у всех остальных представителей данного класса непредельных углеводородов.
Реакция полимеризации пропилена предполагает несколько вариантов протекания. В первом случае процесс осуществляется в газовой фазе. По второму варианту реакция идет в жидкой фазе.
Кроме того, полимеризация пропилена протекает и по некоторым устаревшим процессам, предполагающим применение в качестве реакционной среды насыщенного жидкого углеводорода.

Современная технология
Полимеризация пропилена в массе по технологии Spheripol представляет собой совмещение суспензионного реактора для изготовления гомополимеров. Процесс предполагает применение газофазного реактора с псевдожидкостным слоем для создания блок-сополимеров. В подобном случае реакция полимеризации пропилена предполагает добавление в устройство дополнительных совместимых катализаторов, а также проведение предварительной полимеризации.

Особенности процесса
Технология предполагает перемешивание компонентов в специальном устройстве, предназначенном для предварительного превращения. Далее эту смесь добавляют в петлевые полимеризационные реакторы, туда поступает и водород, и отработанный пропилен.
Работа реакторов осуществляется при диапазоне температур от 65 до 80 градусов по Цельсию. Давление в системе не превышает 40 бар. Реакторы, которые располагаются последовательно, применяются на заводах, рассчитанных на большие объемы изготовления полимерной продукции.
Из второго реактора удаляют полимерный раствор. Полимеризация пропилена предполагает перенос раствора в дегазатор повышенного давления. Здесь осуществляется удаление порошкового гомополимера от жидкого мономера.
Производство блоксополимеров
Уравнение полимеризации пропилена Ch3= CH — Ch4 в данной ситуации имеет стандартный механизм протекания, есть отличия только в условиях осуществления процесса. Вместе с пропиленом и этеном порошок из дегазатора идет в газофазный реактор, работающий при температуре около 70 градусов по Цельсия и давлении не больше 15 бар.
Блок сополимеры после выведения из реактора поступают в специальную систему отведения от мономера порошкообразного полимера.
Полимеризация пропилена и бутадиенов ударопрочного вида допускает использование второго газофазного реактора. Он позволяет увеличивать уровень пропилена в полимере. Кроме того, возможно добавление в готовый продукт добавок, использование гранулирования, способствует повышению качества получаемого продукта.

Специфика полимеризации алкенов
Между изготовлением полиэтилена и полипропилена есть некоторые отличия. Уравнение полимеризации пропилена позволяет понять, что предполагается применение иного температурного режима. Кроме того, некоторые различия существуют и в конечной стадии технологической цепочки, а также в областях использования конечных продуктов.
Пероксид используют для смол, которые обладают отличными реологическими свойствами. У них повышенный уровень текучести расплавов, сходные физические свойства с теми материалами, которые имеют низкий показатель текучести.
Смолы, имеющие отличные реологические свойства, применяют в процессе литьевого формования, а также в случае изготовления волокон.
Для повышения прозрачности и прочности полимерных материалов производители стараются добавлять в реакционную смесь специальные кристаллизирующие добавки. Часть полипропиленовых прозрачных материалов замещают постепенно иными материалами в области выдувного формования и создания литья.
Особенности полимеризации
Полимеризация пропилена в присутствии активированного угля протекает быстрее. В настоящее время применяется каталитический комплекс углерода с переходным металлом, основанный на адсорбционной способности углерода. В результате полимеризации получается продукт, имеющий отличные эксплуатационные характеристики.
В качестве основных параметров процесса полимеризации выступает скорость реакции, а также молекулярный вес и стереоизомерный состав полимера. Значение имеет и физическая и химическая природа катализатора, полимеризационная среда, степень чистоты составных частей реакционной системы.
Линейный полимер получается и в гомогенной, и в гетерогенной фазе, если идет речь об этилене. Причина заключается в отсутствии у данного вещества пространственных изомеров. Чтобы получить изотактический полипропилен, стараются использовать твердые хлориды титана, а также алюминийорганические соединения.
При применении комплекса, адсорбированного на кристаллическом хлориде титана (3), можно получать продукт с заданными характеристиками. Регулярность решетки носителя не является достаточным фактором для приобретения катализатором высокой стереоспецифичности. Например, в случае выбора иодида титана (3) наблюдается получение большего количества атактического полимера.
Рассмотренные каталитические компоненты имеют льюисовский характер, поэтому связаны с подбором среды. Самой выгодной средой является применение инертных углеводородов. Так как хлорид титана (5) является активным адсорбентом, в основном выбирают алифатические углеводороды. Как протекает полимеризация пропилена? Формула продукта имеет вид (-СН2-СН2-СН2-)п. Сам алгоритм реакции аналогичен протеканию реакции у остальных представителей данного гомологического ряда.
Химическое взаимодействие
Проанализируем основные варианты взаимодействия для пропилена. Учитывая, что в его структуре есть двойная связь, основные реакции протекают именно с ее разрушением.
Галогенирование протекает при обычной температуре. По месту разрыва сложной связи происходит беспрепятственное присоединение галогена. В результате данного взаимодействия образуется дигалогенпроизводное соединение. Труднее всего происходит йодирование. Бромирование и хлорирование протекает без дополнительных условий и энергетических затрат. Фторирование пропилена протекает со взрывом.
Реакция гидрирования предполагает использование дополнительного ускорителя. В качестве катализатора выступает платина, никель. В результате химического взаимодействия пропилена с водородом, образуется пропан – представитель класса предельных углеводородов.
Гидратация (присоединение воды) осуществляется по правилу В. В. Марковникова. Суть его состоит в присоединении по двойной связи атома водорода к тому углероду пропилена, который имеет его максимальное количество. При этом галоген будет прикрепляться к тому С, который имеет минимальное число водорода.
Для пропилена характерно горение в кислороде воздуха. В результате этого взаимодействия будет получаться два основных продукта: углекислого газа, водяного пара.
При действии на данное химическое вещество сильных окислителей, например, перманганата калия, наблюдается его обесцвечивание. Среди продуктов химической реакции будет двухатомный спирт (гликоль).
Получение пропилена
Все способы можно разделить на две основные группы: лабораторные, промышленные. В лабораторных условиях можно получить пропилен при отщеплении галогеноводорода от исходного галогеналкила при воздействии на них спиртового раствора гидроксида натрия.
Пропилен образуется при каталитическом гидрировании пропина. В лабораторных условиях данное вещество можно получить при дегидратации пропанола-1. В данной химической реакции применяют в качестве катализаторов фосфорную либо серную кислоту, оксид алюминия.
Как получают пропилен в больших объемах? В связи с тем, что в природе данное химическое вещество встречается редко, были разработаны промышленные варианты его получения. Самым распространенным является выделение алкена из продуктов нефтепереработки.
Например, осуществляется крекинг сырой нефти в специальном кипящем слое. Пропилен получают путем пиролиза бензиново фракции. В настоящее время выделяют алкен и из попутного газа, газообразны продуктов коксования угля.
Есть разнообразные варианты пиролиза пропилена:
- в трубчатых печах;
- в реакторе с применением кварцевого теплоносителя;
- процесс Лавровского;
- автотермический пиролиз по методу Бартломе.
Среди отработанных промышленных технологий необходимо отметить и каталитическое дегидрирование насыщенных углеводородов.
Применение
Пропилен имеет различные области применения, поэтому и производится в больших масштабах в промышленности. Своим появлением данный непредельный углеводород обязан работам Натты. В середине двадцатого века он, пользуясь каталитической системой Циглера, разработал технологию полимеризации.
Натта сумел получить стереорегулярный продукт, который был им назван изотактическим, поскольку в структуре метильные группы были расположены с одной стороны цепочки. Благодаря такому варианту «упаковки» полимерных молекул, получаемое полимерное вещество имеет отличные механические характеристики. Полипропилен используется для изготовления синтетического волокна, востребован в качестве пластической массы.
Примерно десять процентов нефтяного пропилена потребляется для производства его оксида. До середины прошлого века данное органическое вещество получали хлоргидринным методом. Реакция протекала через образование промежуточного продукта пропиленхлоргидрина. У такой технологии есть определенные недостатки, которые связаны с использованием дорогостоящего хлора и гашеной извести.
В наше время на смену этой технологии пришел халкон-процесс. Он основывается на химическом взаимодействии пропена с гидропероксидами. Применяют оксид пропилена в синтезе пропиленглиголя, идущий на изготовление пенополиуретанов. Они считаются отличными амортизирующими материалами, поэтому идут на создание упаковок, ковриков, мебели, теплоизоляционных материалов, сорбирующих жидкостей и фильтрующих материалов.
Кроме того, среди основных сфер применения пропилена необходимо упомянуть синтез ацетона и изопропилового спирта. Изопропиловый спирт, являясь отличным растворителем, считается ценным химическим продуктом. В начале двадцатого века этот органический продукт получали сернокислотным методом.
Кроме того, отработана технология прямой гидратации пропена с введением в реакционную смесь кислых катализаторов. Около половины всего производимого пропанола уходит на синтез ацетона. Данная реакция предполагает отщепление водорода, проводится при 380 градусах по Цельсия. Катализаторами в этом процессе выступают цинк и медь.
Среди важных отраслей применения пропилена особое место занимает гидроформилирование. Пропен идет на производство альдегидов. Оксисинтез в нашей стране стали использовать с середины прошлого века. В настоящее время эта реакция занимает важное место в нефтехимии. Химическое взаимодействие пропилена с синтез-газом (смесью угарного газа и водорода) при температуре 180 градусов, катализаторе оксиде кобальта и давлении в 250 атмосфер наблюдается образование двух альдегидов. Один имеет нормальное строение, у второго – изогнутая углеродная цепочка.
Сразу после открытия данного технологического процесса, именно эта реакция стала объектом исследований для многих ученых. Они искали способы смягчения условий ее протекания, старались снизить процентное содержание в получаемой смеси альдегида разветвленного строения.
Для этого были придуманы экономичные процессы, предполагающие применение иных катализаторов. Удалось снизить температуру, давление, увеличить выход альдегида линейного строения.
Эфиры акриловой кислоты, которые также связаны с полимеризацией пропилена, применяют в качестве сополимеров. Около 15 процентов нефтехимического пропена применяют в качестве исходного вещества для создания акрионитрила. Этот органический компонент необходим для изготовления ценного химического волокна – нитрона, создания пластических масс, производства каучуков.
Заключение
Полипропилен считают в настоящее время крупнейшим производством нефтехимии. Спрос на этот качественный и недорогой полимер растет, поэтому он постепенно вытесняет полиэтилен. Он незаменим при создании жесткой упаковки, пластин, пленок, автомобильных деталей, синтетической бумаги, канатов, ковровых деталей, а также для создания разнообразного бытового оборудования. В начале двадцать первого века производство полипропилена занимало второе место в полимерной промышленности. Учитывая запросы различных отраслей промышленности, можно сделать вывод: в ближайшее время сохранится тенденция масштабного производства пропилена и этилена.
fb.ru
Что такое изопропиловый спирт
Химическое соединение, имеющее молекулярную формулу Ch4CH(OH)Ch4. Другое название — пропан-2-ол, медицинский спирт. Жидкость обладает сильным запахом, огнеопасна, бесцветна. 
Изопропиловый спирт обладает рядом химических свойств. Он способен растворяться в алкоголе, эфире, хлороформе, воде. Это вещество не взаимодействует с солями. Благодаря свойству хорошо исчезать в бессолевой среде, изопропиловый спирт легко выделить в воде. Достаточно добавить сульфат натрия или обычную поваренную соль. Это его главное отличие от метанола и этанола. Неофициальное название этого метода — «соление». Проводят его для разделения изопропилового спирта на слои.
Изопропиловый спирт производят тремя способами:
- Косвенная гидратация — это реакция пропилена с серной кислотой. В результате получается смесь сложных эфиров сульфата. Их также перерабатывают и получают нужное вещество. Побочным продуктом является диизопропиловый спирт.
- Прямая гидратация проводится в жидкой или газовой фазе. Обязательно должны присутствовать кислотные катализаторы. Проводится реакция пропилена и воды. Оба процесса заключаются в отделении изопропилового спирта от Н2О.
- Гидрогенизация ацетона. Используют неочищенный ацетон. Его гидрогенезируют с помощью оксидов меди и хрома либо с применением никеля Ренея.
 Изопропиловый спирт получил широкое применение. Чаще всего его используют в фармацевтике. В промышленности его применяют в качестве растворителя. В химической промышленности его используют для получения кумола. Согласно результатам прошлого года, изопропиловый спирт часто применяют в косметических изделиях и в быту. Это продукт используют в качестве добавки в бензин.
Изопропиловый спирт получил широкое применение. Чаще всего его используют в фармацевтике. В промышленности его применяют в качестве растворителя. В химической промышленности его используют для получения кумола. Согласно результатам прошлого года, изопропиловый спирт часто применяют в косметических изделиях и в быту. Это продукт используют в качестве добавки в бензин.
Этот спирт применяется в медицине как эффективное дезинфицирующее средство. Им обрабатывают место для инъекции. Также его применяют как антисептик. Часто используется в качестве осушителя для наружного отита.
Изопропиловый спирт абсолютированный отличается от обычного степенью очистки. В нем наименьшее количество примесей. Он хорошо растворяет смолы и масла, не вредит лакокрасочному покрытию. Из-за этого он и получил широкое распространение в автомобильной промышленности. Его часто добавляют в жидкость для мытья стекол.
В лабораториях изопропиловый спирт применяется в качестве консерванта биологического происхождения. Используют его для органики. Это хорошая альтернатива синтетическим консервантам, в частности формальдегиду.
Где купить изопропиловый спирт? На оптовых складах. Продают его чаще всего в больших количествах. Несмотря на свое широкое применение, он может вызывать отравление. Поэтому нужно принимать все меры предосторожности при использовании антифризов, стеклоочистителей, лосьонов для бритья и так далее.
Особенность изопропилового спирта в том, что он не проникает в оранизм через кожу. Но зато он отлично всасывается через легкие и желудок. Он оказывает угнетающее действие на ЦНС в 2 раза сильнее, чем этанол. В печени он перерабатывается в ацетон, а затем выводится через мочевую систему. Лечение заключается в промывании желудка. Если наступает обезвоживание или шок, проводят инфузионную терапию с применением бикарбоната натрия. Хорошо показывает себя гемодиализ.
fb.ru
