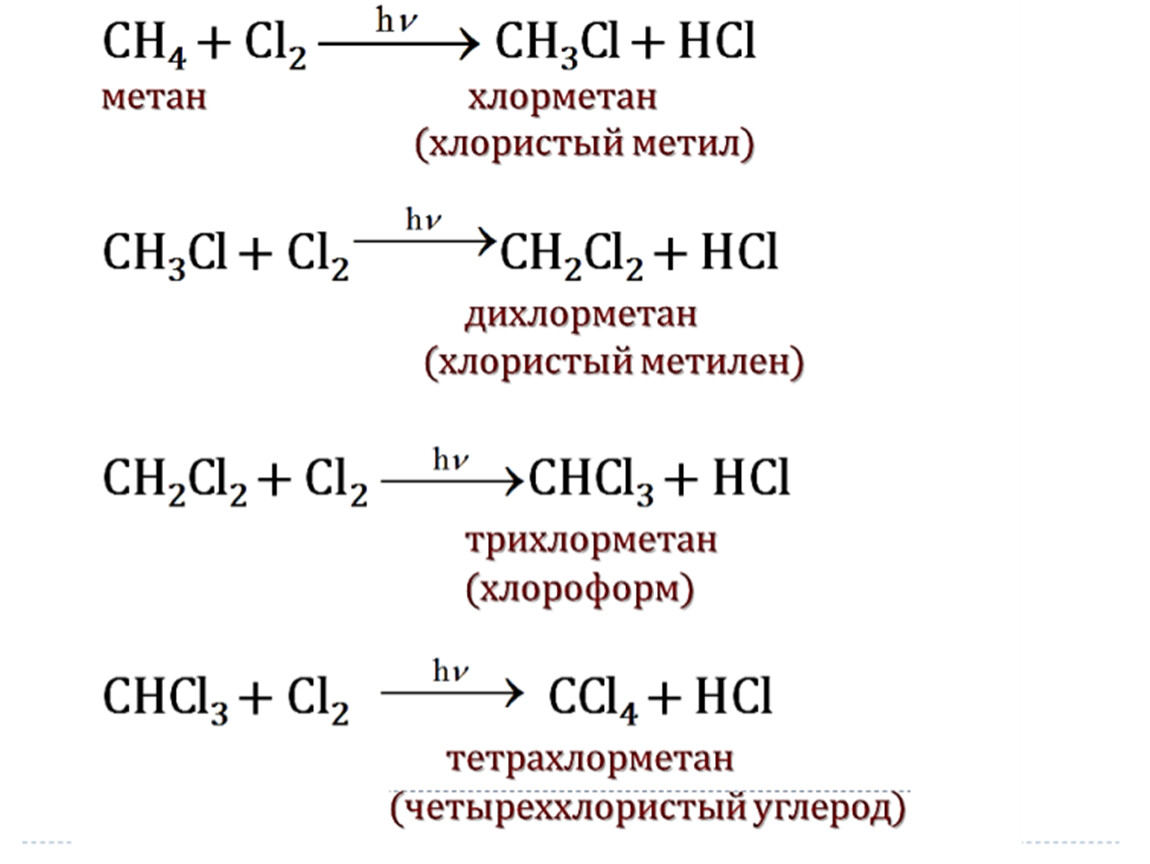
Формула Хлорметана структурная химическая
- Хлорорганическое соединение
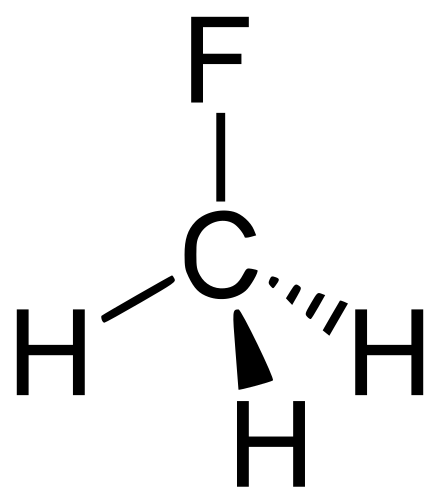
Структурная формула
Истинная, эмпирическая, или брутто-формула: CH3Cl
Химический состав Хлорметана
| Символ | Элемент | Атомный вес | Число атомов | Процент массы | C | Углерод | 12.011 | 1 | 23,8% |
|---|---|---|---|---|
| H | Водород | 1.008 | 3 | 6% |
| Cl | Хлор | 35.453 | 1 | 70,2% |
Молекулярная масса: 50,488
Хлорметан (метилхлори́д) — органическое вещество, принадлежащее к группе галогеналканов.
Производство
Большая часть хлорметана получается реакцией метанола с хлороводородом, согласно следующей химической реакции:
CH3OH + HCl → CH3Cl + H2O
Это может быть осуществлено пропусканием хлороводорода через кипящий метанол вместе с хлоридом цинка в качестве катализатора или пропусканием смеси метанола и хлороводорода через окись алюминия при 350 °C.
Меньшие количества хлорметана производят нагреванием смеси метана и хлора до 400 °C. Однако этот метод дает смесь с более хлорированными производными метана (дихлорметан, хлороформ, тетрахлорметан) и используется тогда, когда необходимы эти вещества.
Применение
Хлорметан был широкоприменяемым хладагентом. Но такое его применение прекратили из-за токсичности и пожароопасности. Хлорметан был использован для производства добавок к бензину на основе свинца (тетраметилсвинец). Наиболее важное использование хлорметана сейчас в качестве химического полупродукта в производстве силиконовых полимеров. Меньшие количества используют в качестве растворителя при производстве бутилкаучука и очистке бензина. Хлорметан используют как метилирующий или хлорирующий агент в органической химии. Он находит также множество различных применений: удаления жирных загрязнений, следов смол, как ракетное топливо, для получения пенополистирола. Как локальное обезболивающее, как промежуточный продукт при синтезе лекарств, как носитель в низкотемпературной полимеризации, как жидкость для термометрического и термостатического оборудования, в качестве гербицида.
Безопасность
Вдыхание газообразного хлорметана оказывает токсическое действие на центральную нервную систему. У пострадавшего возникает сонливость, головокружение, рассеянность, нарушение координации движений, спутанность речи, нарушение дыхания, удушье. При больших концентрациях наступают судороги, параличи и кома.
В случае проглатывания может возникнуть тошнота и рвота. Контакт сжиженного метилхлорида с кожей приводит к обморожению. Контакт с глазами может привести к ухудшению зрения.
Хроническое воздействие хлорметана вызывает тератогенный эффект.
У пострадавшего возникает сонливость, головокружение, рассеянность, нарушение координации движений, спутанность речи, нарушение дыхания, удушье. При больших концентрациях наступают судороги, параличи и кома.
В случае проглатывания может возникнуть тошнота и рвота. Контакт сжиженного метилхлорида с кожей приводит к обморожению. Контакт с глазами может привести к ухудшению зрения.
Хроническое воздействие хлорметана вызывает тератогенный эффект.
Хлорметан
Артикул: 74-87-3
по запросуПроизводитель: Не указано
Вы нашли, что искали? Если вам нужна помощь, пожалуйста, свяжитесь с нами: ru
ruОсновное описание
Идентификация
Химические и физические свойства
Риски, безопасность и условия использования
Классификация химических реактивов
Смотрите также
Форма запроса
Чтобы купить хлорметан, отправьте запрос
Контактные данные
Контактное лицо:
Телефон:
Email:
ИНН организации:
Название организации:
Информация о заказе
Упаковка:
Количество:
Фасовка:
Производство:
— — — Выберите значение — — -ОтечественныйИмпортный
Дополнительные требования:
Включите в запрос ваши требования к продукции. Обращаем внимание, что мы не продаем химические реактивы частным лицам.
Нажимая кнопку «Отправить» Вы соглашаетесь с Условиями использования и Политикой конфиденциальности
×
| Мужская | |||||||||
| 43-50 | 50-59 | 59-72 | 72-83 | 83-95 | 95-104 | 104-113 | |||
| 147-157 | 152-170 | 165-188 | 170-193 | 170-193 | 170-193 | 170-193 | |||
| 81-86 | 86-91 | 97-102 | 102-107 | 112-117 | 117-122 | 122-127 | |||
| Женская | |||||||||
| 79-84 | 84-89 | 89-94 | 94-99 | 99-104 | |||||
| 58-64 | 64-69 | 69-74 | 76-81 | 84-89 | |||||
| 84-89 | 89-94 | 94-99 | 102-107 | 109-114 | |||||
Хлорметан , также называемый Метилхлорид , или просто R-40 или HCC 40, представляет собой химическое соединение, когда-то широко использовавшееся в качестве хладагента. Метилхлорид был впервые синтезирован французскими химиками Жаном-Батистом Дюма и Эженом Пелиго в 1835 году путем кипячения смеси метанола, серной кислоты и хлорида натрия. Этот метод аналогичен тому, что используется сегодня. Дополнительные рекомендуемые знания
ПроизводствоБольшое количество хлористого метила образуется естественным образом в океанах под действием солнечного света на биомассу и хлора в морской пене. Однако весь хлористый метил, который используется в промышленности, производится синтетическим путем. Большинство хлористого метила получают реакцией метанола с хлористым водородом в соответствии с химическим уравнением
Это можно осуществить либо барботированием газообразного хлористого водорода через кипящий метанол с катализатором из хлорида цинка или без него, либо пропусканием объединенных паров метанола и хлористого водорода над катализатором из оксида алюминия при 350 °C. Меньшее количество хлористого метила получают путем нагревания смеси метана и хлора до температуры выше 400 °C. Однако этот метод также приводит к более сильно хлорированным соединениям, таким как метиленхлорид и хлороформ, и обычно используется только тогда, когда желательны и эти другие продукты. ИспользованиеРаньше хлористый метил был широко используемым хладагентом, но из-за его токсичности его использование было прекращено. Хлористый метил также когда-то использовался для производства присадок на основе свинца к бензину, но использование этилированного бензина было прекращено в большинстве промышленно развитых стран (важным исключением является бывший Советский Союз). В настоящее время метилхлорид используется в качестве промежуточного химического вещества в производстве силиконовых полимеров. Меньшие количества используются в качестве растворителя при производстве бутилкаучука и при переработке нефти. Метилхлорид также используется в качестве метилирующего и хлорирующего агента в органической химии. БезопасностьВдыхание газообразного хлористого метила оказывает действие на центральную нервную систему, подобное опьянению. Жертвы могут испытывать сонливость, головокружение или спутанность сознания, затрудненное дыхание, одышку и удушье, ходьбу или речь. При более высоких концентрациях возможны паралич, судороги и кома. При проглатывании возможны тошнота и рвота. Контакт с кожей в виде охлажденной жидкости может привести к обморожению. Попадание в глаза может привести к затуманенному зрению, широко расширенным зрачкам, которые медленно реагируют на изменение освещения. Хроническое воздействие хлористого метила связано с врожденными дефектами у мышей. У людей воздействие хлористого метила во время беременности может привести к неправильному формированию нижнего отдела позвоночника, таза и ног плода, но это окончательно не доказано. В 1997 году повторное расследование пожара в ночном клубе Cocoanut Grove в Бостоне назвало утечку хлористого метила из холодильника основной причиной этой катастрофы. См. также
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Эта статья находится под лицензией GNU Free Documentation License. Он использует материал из статьи Википедии «Хлорметан». Список авторов есть в Википедии. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
органическая химия. Всего структурных изомеров дифенилхлорметана?
спросил
Изменено 4 года, 7 месяцев назад
Просмотрено 841 раз
$\begingroup$ Максимально доступно 8 вариантов, но во время рисования я обнаружил, что их гораздо больше.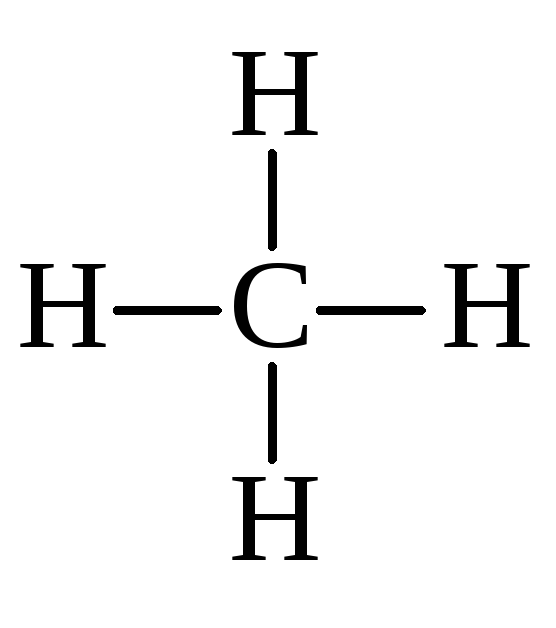 Существуют ли другие условия структурной формулы, кроме того факта, что соединения будут иметь одинаковую молекулярную формулу, но разные структурные формулы?
Существуют ли другие условия структурной формулы, кроме того факта, что соединения будут иметь одинаковую молекулярную формулу, но разные структурные формулы?
Есть ли какие-либо другие условия, которые я должен учитывать, я думаю, что упускаю момент.
- органическая химия
- структурная формула
- цис-транс-изомерия
Начиная с метана, $\ce{Ch5}$, в качестве отправной точки,
- дифенилметан (буква «d» как в Delta) имеет две фенильные группы, которые независимо друг от друга присоединены непосредственно к этому ядру (ср. .). Какая ситуация описана в анкете и рассмотрена в вашем варианте в строке А), который правильно отвечает на вопрос.
- Альтернативно, как структурный изомер, вы можете соединить одну фенильную группу со следующей (которая тогда называется бифенилом, буква «b», как в Браво), которая, в свою очередь, как одна группа связана с метильной группой.



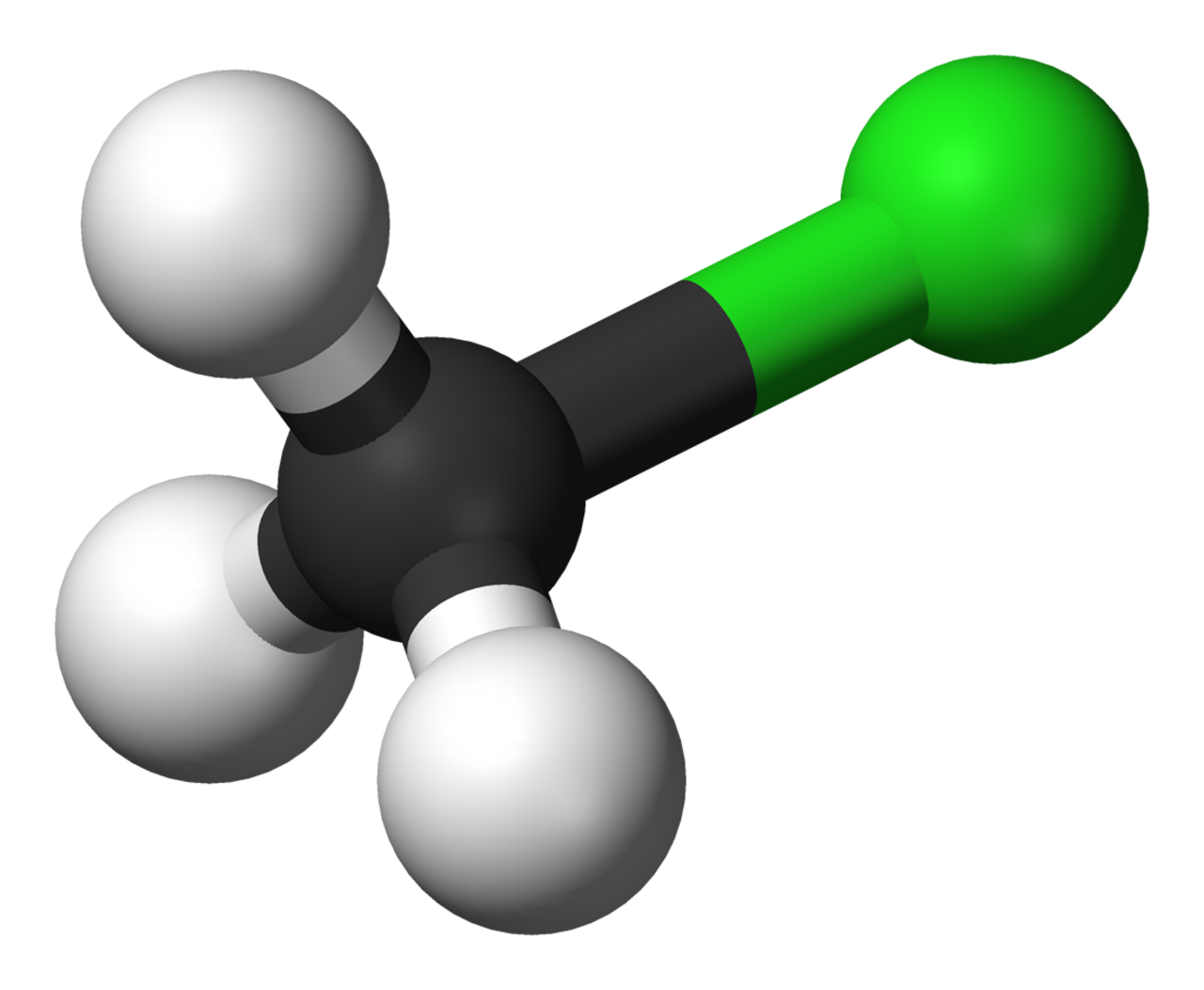 Это бесцветный легковоспламеняющийся газ со слегка сладковатым запахом, который, тем не менее, может быть токсичным. Из-за опасений по поводу его токсичности он больше не присутствует в потребительских товарах.
Это бесцветный легковоспламеняющийся газ со слегка сладковатым запахом, который, тем не менее, может быть токсичным. Из-за опасений по поводу его токсичности он больше не присутствует в потребительских товарах.
 Он также используется в ряде других областей: в качестве экстрагента для жиров, масел и смол, в качестве пропеллента и пенообразователя в производстве пенополистирола, в качестве местного анестетика, в качестве промежуточного продукта в производстве лекарств, в качестве носителя катализатора в низкомолекулярных средах. температурной полимеризации, в качестве жидкости для термометрического и термостатического оборудования и в качестве гербицида.
Он также используется в ряде других областей: в качестве экстрагента для жиров, масел и смол, в качестве пропеллента и пенообразователя в производстве пенополистирола, в качестве местного анестетика, в качестве промежуточного продукта в производстве лекарств, в качестве носителя катализатора в низкомолекулярных средах. температурной полимеризации, в качестве жидкости для термометрического и термостатического оборудования и в качестве гербицида.