Хлористый метилен | это… Что такое Хлористый метилен?
ТолкованиеПеревод
- Хлористый метилен
Дихлорметан (хлористый метилен, ДХМ, CH2Cl2) — прозрачная лекгоподвижная и легколетучая жидкость с характерным для галогенпроизводных сладковатым запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету. В целом наиболее безопасен среди галогеналканов.
Содержание
- 1 Получение
- 2 Свойства
- 3 Применение
- 3.1 Очистка в лаборатории
- 3.2 Специализированные применения
- 4 Безопасность
- 5 Примечания
Получение
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °С при соотношении равном 5:1
- CH4 + Cl2 → CH
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
В результате получается смесь всех возможных хлоридов: хлорметан, дихлорметан, хлороформ и четырёххлористый углерод, которые потом разделяются дистилляцей.
 После чего он имеет чистоту не менее 99,7% В 1995 году годовое производство оценивалось в 500 миллионов тонн.
После чего он имеет чистоту не менее 99,7% В 1995 году годовое производство оценивалось в 500 миллионов тонн.Свойства
Практически не растворим в воде(20 г/л), смешивается с большинством органических растворителей. Легколетуч (40 °С), образует азеотропную смесь с водой (т.кип. 38,1 °С, 98,5% М.). Метиленхлорид (дихлорметан) реагирует с хлором с образованием хлороформа и четырёххлористым углеродом. С йодом при 200 °С дает СН2l2, с бромом при 25-30 °С в присут. алюминия — бромхлорметан. При нагревании с водой гидролизуется до СН 2О и НСl. При нагревании со спиртовым растворо NH3 до 100-125 °С образует гексаметилентетрамин. Реакция с водным раствором NH3 при 200 °С приводит к метиламину,муравьиной кислоте и НСl. С ароматическими соединениями в присутствии АlСl3 метиленхлорид вступает в реакцию Фриделя — Крафтса, например с бензолом образует дифенилметан. [1]
Применение
Дешевизна, высокая способность растворять многие органические вещества, легкость удаления, относительно малая токсичность привела к широкому применению его как растворитель для проведения реакций, экстракций в том числе и в лабораториях.
 Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворение смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов. Также используется в хроматографии. В промышленности в смеси с полимерами используют для создания формы которая быстро застывает за счёт испарения дихлорметана. Он же используется для склеивания этих пластиков: полистирол, поликарбонат, полиэтилентерефталат, АБС-пластик, но не для полиэтилена и полипропилена.
Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворение смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов. Также используется в хроматографии. В промышленности в смеси с полимерами используют для создания формы которая быстро застывает за счёт испарения дихлорметана. Он же используется для склеивания этих пластиков: полистирол, поликарбонат, полиэтилентерефталат, АБС-пластик, но не для полиэтилена и полипропилена.Очистка в лаборатории
- Промывают кислотой, щелочью и водой. Сушат над поташом и перегоняют. Можно использовать молекулярные сита 4А.[2]
- Кипячение с фосфорным ангидридом с последующей перегонкой. Хранится над молекулярными ситами 3А.
Специализированные применения
Используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.

Безопасность
Хотя он и является наименее ядовитым среди галогеналканов, но нужно быть осторожным при обращении, так как он очень летуч и может вызвать острое отравление. Вытяжная вентиляция необходима. В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать отравление им. Длительный покровный контакт с дихлрометаном может вызвать накопление его в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и нейропатия. На крысах показано, что он может вызывать рак лёгких, печени и поджелудочной железы. В тоже время не было отмечено какого либо влияния на развития эмбрионов у женщин имевших контакт с ДХМ.
В Евросоюзе запрещены краски с дихлорметаном, как для личного пользования так и для профессонального применения. Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые. Не вводить в контакт с щелочными металлами из-за угрозы взрыва. ПДК в рабочей зоне 50мг/м3, в воде водоёмов не более 7.

КПВ 12-22%
Общая безопасность и методы устранения аварий[3]
Примечания
- ↑ Химическая энциклопедия Т3, М 1988, стр 60-61
- ↑ Органикум Т2, М 1992, стр 411
- ↑ http://www.safework.ru/ilo/ICSC/cards/view/?0058
Wikimedia Foundation. 2010.
Игры ⚽ Поможем сделать НИР
- Хлористый этил
- Хлоро-серебряный элемент
Полезное
Хлористый метилен | это… Что такое Хлористый метилен?
ТолкованиеПеревод
- Хлористый метилен
Дихлорметан (хлористый метилен, ДХМ, CH2Cl2) — прозрачная лекгоподвижная и легколетучая жидкость с характерным для галогенпроизводных сладковатым запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету.
В целом наиболее безопасен среди галогеналканов.
Содержание
- 1 Получение
- 2 Свойства
- 3 Применение
- 3.1 Очистка в лаборатории
- 3.2 Специализированные применения
- 4 Безопасность
- 5 Примечания
Получение
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °С при соотношении равном 5:1
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
В результате получается смесь всех возможных хлоридов: хлорметан,

Свойства
Практически не растворим в воде(20 г/л), смешивается с большинством органических растворителей. Легколетуч (40 °С), образует азеотропную смесь с водой (т.кип. 38,1 °С, 98,5% М.). Метиленхлорид (дихлорметан) реагирует с хлором с образованием хлороформа и четырёххлористым углеродом. С йодом при 200 °С дает СН2l2, с бромом при 25-30 °С в присут. алюминия — бромхлорметан. При нагревании с водой гидролизуется до СН2О и НСl. При нагревании со спиртовым растворо NH3 до 100-125 °С образует гексаметилентетрамин. Реакция с водным раствором NH3 при 200 °С приводит к метиламину,муравьиной кислоте и НСl. С ароматическими соединениями в присутствии АlСl 3 метиленхлорид вступает в реакцию Фриделя — Крафтса, например с бензолом образует дифенилметан. [1]
Применение
Дешевизна, высокая способность растворять многие органические вещества, легкость удаления, относительно малая токсичность привела к широкому применению его как растворитель для проведения реакций, экстракций в том числе и в лабораториях.
 Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворение смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов. Также используется в хроматографии. В промышленности в смеси с полимерами используют для создания формы которая быстро застывает за счёт испарения дихлорметана. Он же используется для склеивания этих пластиков: полистирол, поликарбонат, полиэтилентерефталат, АБС-пластик, но не для полиэтилена и полипропилена.
Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворение смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов. Также используется в хроматографии. В промышленности в смеси с полимерами используют для создания формы которая быстро застывает за счёт испарения дихлорметана. Он же используется для склеивания этих пластиков: полистирол, поликарбонат, полиэтилентерефталат, АБС-пластик, но не для полиэтилена и полипропилена.Очистка в лаборатории
- Промывают кислотой, щелочью и водой. Сушат над поташом и перегоняют. Можно использовать молекулярные сита 4А.[2]
- Кипячение с фосфорным ангидридом с последующей перегонкой. Хранится над молекулярными ситами 3А.
Специализированные применения
Используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.

Безопасность
Хотя он и является наименее ядовитым среди галогеналканов, но нужно быть осторожным при обращении, так как он очень летуч и может вызвать острое отравление. Вытяжная вентиляция необходима. В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать отравление им. Длительный покровный контакт с дихлрометаном может вызвать накопление его в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и нейропатия. На крысах показано, что он может вызывать рак лёгких, печени и поджелудочной железы. В тоже время не было отмечено какого либо влияния на развития эмбрионов у женщин имевших контакт с ДХМ.
В Евросоюзе запрещены краски с дихлорметаном, как для личного пользования так и для профессонального применения. Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые. Не вводить в контакт с щелочными металлами из-за угрозы взрыва. ПДК в рабочей зоне 50мг/м3, в воде водоёмов не более 7.
 5 мг/л
5 мг/лКПВ 12-22%
Общая безопасность и методы устранения аварий
Примечания
- ↑ Химическая энциклопедия Т3, М 1988, стр 60-61
- ↑ Органикум Т2, М 1992, стр 411
- ↑ http://www.safework.ru/ilo/ICSC/cards/view/?0058
Wikimedia Foundation. 2010.
Игры ⚽ Поможем сделать НИР
- Хлористый этил
- Хлоро-серебряный элемент
Полезное
Что такое метиленхлорид? | The Chemistry Blog
Метиленхлорид, также известный как дихлорметан или ДХМ, представляет собой хлорорганическое соединение. Это бесцветное вещество, которое можно отличить по запаху, напоминающему хлороформ. Хотя он не смешивается с водой, он может растворять многие полярные органические соединения, что делает его отличным растворителем. Из-за этого он хорошо подходит для нескольких промышленных применений, таких как фармацевтическое производство, удаление краски, производство средств для удаления краски и очистка металла.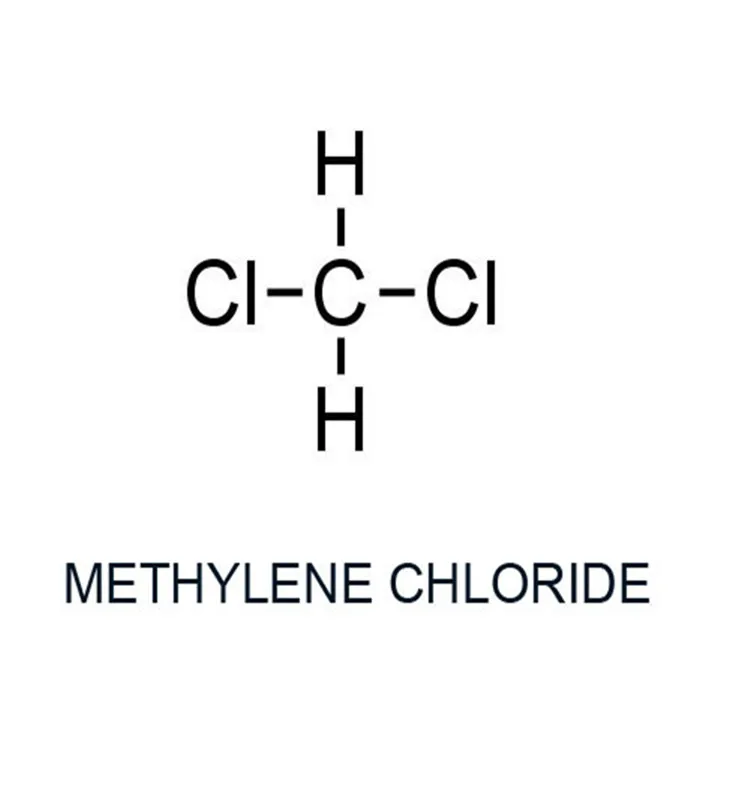
Метиленхлорид — это встречающееся в природе вещество, которое можно найти в океанах, макроводорослях, водно-болотных угодьях и вулканах. Хотя в некоторых экологических нишах он считается загрязнителем, большая часть метиленхлорида, обнаруженного в окружающей среде, возникает в результате промышленного загрязнения.
В этом посте:
Структурная формула метиленхлорида
Химическая формула метиленхлорида: CH 2 Cl 2 . Молекула этого соединения имеет тетраэдрическую структуру с атомом углерода в центре, окруженным двумя атомами водорода и двумя атомами хлора:
Источник
Как видите, существует асимметрия в размерах атомов и относительных расстояниях окружающих атомов от центра. Поэтому молекулярную структуру часто записывают упрощенно, как показано на рисунке ниже:
Метильная группа не обозначена на приведенной выше диаграмме, но вместо этого обозначена угловыми лучами, соединяющими два атома хлора. Вершина угла представляет собой метильную группу в центре молекулы. Этот способ написания структурной формулы предназначен для простоты. Это особенно полезно при работе со сложными органическими соединениями в цепочках. Этот тип диаграммы называется скелетной формулой, но также известен как сокращенная формула или линейная формула.
Этот способ написания структурной формулы предназначен для простоты. Это особенно полезно при работе со сложными органическими соединениями в цепочках. Этот тип диаграммы называется скелетной формулой, но также известен как сокращенная формула или линейная формула.
Насколько опасен метиленхлорид?
Метиленхлорид не так токсичен, как другие виды простых хлоруглеводородов. Тем не менее, это может иметь серьезные риски для здоровья, которых вы должны избегать. Например, высокая летучесть этой жидкости делает ее опасной при вдыхании, к тому же она легко всасывается через кожу.
Некоторые симптомы острого чрезмерного воздействия метиленхлорида при вдыхании включают:
- Головокружение
- Тошнота
- Головные боли
- Потеря фокуса
- Усталость
- Онемение
- Чувство слабости
- Раздражение верхних дыхательных путей
В более серьезных случаях последствия чрезмерного воздействия этого вещества включают:
- Удушье
- Потеря сознания
- Кома
- Смерть
Человеческий организм метаболизирует метиленхлорид в монооксид углерода. Поэтому чрезмерное воздействие этого вещества может привести к отравлению угарным газом. Его острое воздействие может также привести к оптической невропатии и гепатиту. Между тем длительное воздействие на кожу хлористого метилена может привести к растворению некоторых жировых тканей кожи, что приведет к химическим ожогам.
Поэтому чрезмерное воздействие этого вещества может привести к отравлению угарным газом. Его острое воздействие может также привести к оптической невропатии и гепатиту. Между тем длительное воздействие на кожу хлористого метилена может привести к растворению некоторых жировых тканей кожи, что приведет к химическим ожогам.
По данным Международного агентства по изучению рака (IARC), метиленхлорид оказывает канцерогенное воздействие на экспериментальных животных. Лабораторные эксперименты показали, что он вызывает рак легких, печени и поджелудочной железы у животных. У некоторых подопытных животных, подвергшихся воздействию химического вещества, также развился рак молочной железы и рак слюнных желез. Хотя нет доказательств того, что те же эффекты связаны с раком у людей, химическое вещество все равно классифицируется как потенциально канцерогенное.
У людей с ранее существовавшим заболеванием сердца могут наблюдаться аномальные сердечные ритмы или сердечные приступы при воздействии DCM. Те, у кого уже есть проблемы с печенью или нервной системой, могут обнаружить, что их состояние ухудшается после воздействия метиленхлорида.
Те, у кого уже есть проблемы с печенью или нервной системой, могут обнаружить, что их состояние ухудшается после воздействия метиленхлорида.
Какие области применения метиленхлорида?
Метиленхлорид обладает высокой летучестью и может растворять многие типы органических соединений. Он используется в нескольких химических процессах при массовом производстве продуктов. Например, в пищевой промышленности и производстве напитков он используется для удаления кофеина из кофе и чая, а также для приготовления экстрактов хмеля и других натуральных ароматизаторов.
Высокая летучесть соединения также делает его очень полезным в качестве пропеллента для аэрозольных распылителей. Вот почему дихлорметан обычно используется в качестве пенообразователя при производстве пенополиуретанов.
Одним из наиболее специализированных применений DCM является его использование в качестве теплового двигателя. Это связано с тем, что его низкая температура кипения позволяет ему извлекать механическую энергию из разницы температур. Одним из примеров этого является игрушка для пьющих птиц, которая работает благодаря своей чувствительности к разнице температур между водой и воздухом, в которой огромную роль играет хлористый метилен9.0003
Одним из примеров этого является игрушка для пьющих птиц, которая работает благодаря своей чувствительности к разнице температур между водой и воздухом, в которой огромную роль играет хлористый метилен9.0003
В качестве растворителя многих органических соединений дихлорметан также может сваривать некоторые виды пластмасс. Одним из практических примеров этого является герметизация корпуса электрических счетчиков. DCM также является компонентом клеев для сварки пластмасс, которые имеются в продаже и широко используются любителями, строящими модели зданий. Между тем, швейная полиграфическая промышленность использует этот состав при удалении термосклеиваемых трансферов для одежды.
Как утилизировать метиленхлорид
Высокая летучесть этого вещества затрудняет его правильную утилизацию без риска загрязнения окружающей среды или возможных связанных с этим проблем со здоровьем. Метиленхлорид относится к категории опасных отходов, но его нельзя утилизировать вместе с другими видами опасных отходов, кроме галогенированных растворителей.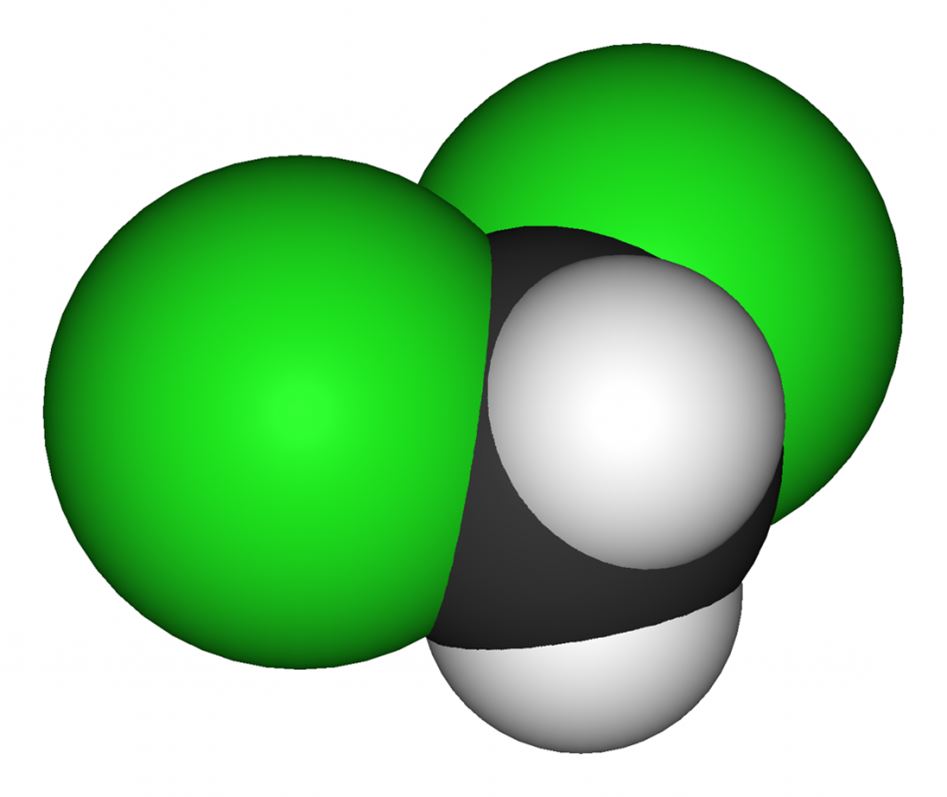
Хранение и утилизация хлористого метилена также требуют надлежащей маркировки контейнеров. Контейнеры должны быть плотно закрыты для предотвращения возможных утечек, а для хранения и утилизации требуется хорошая вентиляция.
Кроме того, обращение с этим химическим веществом, его использование, очистка и утилизация в больших количествах требует средств индивидуальной защиты (СИЗ), которые должны включать респиратор. Рабочие, которые регулярно работают с DCM и утилизируют его, должны строго соблюдать соответствующие протоколы безопасности.
Растворим ли метиленхлорид в воде?
Метиленхлорид является полярным соединением из-за расположения его атомов. Однако не смешивается с водой. Это связано с тем, что его углеводородная составляющая препятствует образованию однородной смеси с водой. Он растворим в воде только в очень ограниченном смысле, а точнее, он растворим в воде при концентрации 25,6 г/л при 15 °C.
Тем не менее, DCM смешивается со следующими растворителями:
- Этилацетат
- Спирт
- Гексаны
- Бензол
- ККл 4
- Диэтиловый эфир
- CHCl 3
При правильном обращении с хлористым метиленом сопутствующие риски для здоровья и воздействие на окружающую среду незначительны, хотя вы всегда должны следовать протоколам на рабочем месте, установленным вашей компанией, и максимально ограничивать воздействие хлористого метилена.
Заявление об отказе от ответственности
Блог на сайтеchemicals.co.uk и все, что в нем публикуется, предоставляется только в качестве информационного ресурса. Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования информации, представленной на этом веб-сайте. Мы не рекомендуем использовать какие-либо химические вещества без предварительного ознакомления с Паспортом безопасности материала, который можно получить у производителя, и следуя советам по безопасности и мерам предосторожности, указанным на этикетке продукта. Если у вас есть какие-либо сомнения по поводу вопросов охраны здоровья и безопасности, обратитесь в Управление по охране труда и технике безопасности (HSE).
CDC — Карманный справочник NIOSH по химическим опасностям
Синонимы и торговые названия
Дихлорметан, дихлорид метилена
Номер CAS
75-09-2
РТЭКС №
PA8050000
DOT ID и руководство
1593 160
Формула
CH₂Cl₂
Преобразование
1 ppm = 3,47 мг/м 3
ИДЛХ
Ca [2300 частей на миллион]
См. : 75092
: 75092
Пределы воздействия
NIOSH REL
Ca См. Приложение AOSHA PEL
[1910.1052] TWA 25 частей на миллион ST 125 частей на миллионМетоды измерения
НИОСХ 1005, 3800;
OSHA 59 , 80
См.: Методы NMAM или OSHA.
Физическое описание
Бесцветная жидкость с запахом хлороформа. [Примечание: газ выше 104°F.]
Молекулярная масса
точка кипячения
Точка замораживания
-139 ° F
Растворимость
Давление пара
350 мм рт. Ст.
Нижний предел взрываемости
Горючая жидкость
Несовместимости и реакции
сильные окислители; каустики; химически активные металлы, такие как алюминий, порошки магния, калий и натрий; концентрированная азотная кислота
Пути воздействия
вдыхание, впитывание через кожу, проглатывание, попадание на кожу и/или в глаза
Симптомы
раздражение глаз, кожи; усталость (слабость, истощение), сонливость, головокружение; онемение, покалывание в конечностях; тошнота; [потенциальный профессиональный канцероген]
Целевые органы
Глаза, кожа, сердечно-сосудистая система, центральная нервная система
Зона рака
[у животных: опухоли легких, печени, слюнных и молочных желез]
Средства индивидуальной защиты/санитарии
(См.

 После чего он имеет чистоту не менее 99,7% В 1995 году годовое производство оценивалось в 500 миллионов тонн.
После чего он имеет чистоту не менее 99,7% В 1995 году годовое производство оценивалось в 500 миллионов тонн. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворение смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов. Также используется в хроматографии. В промышленности в смеси с полимерами используют для создания формы которая быстро застывает за счёт испарения дихлорметана. Он же используется для склеивания этих пластиков: полистирол, поликарбонат, полиэтилентерефталат, АБС-пластик, но не для полиэтилена и полипропилена.
Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворение смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов. Также используется в хроматографии. В промышленности в смеси с полимерами используют для создания формы которая быстро застывает за счёт испарения дихлорметана. Он же используется для склеивания этих пластиков: полистирол, поликарбонат, полиэтилентерефталат, АБС-пластик, но не для полиэтилена и полипропилена.


 Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворение смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов. Также используется в хроматографии. В промышленности в смеси с полимерами используют для создания формы которая быстро застывает за счёт испарения дихлорметана. Он же используется для склеивания этих пластиков: полистирол, поликарбонат, полиэтилентерефталат, АБС-пластик, но не для полиэтилена и полипропилена.
Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворение смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов. Также используется в хроматографии. В промышленности в смеси с полимерами используют для создания формы которая быстро застывает за счёт испарения дихлорметана. Он же используется для склеивания этих пластиков: полистирол, поликарбонат, полиэтилентерефталат, АБС-пластик, но не для полиэтилена и полипропилена.
 5 мг/л
5 мг/л