Формула гидроксида бария в химии
Определение и формула гидроксида бария
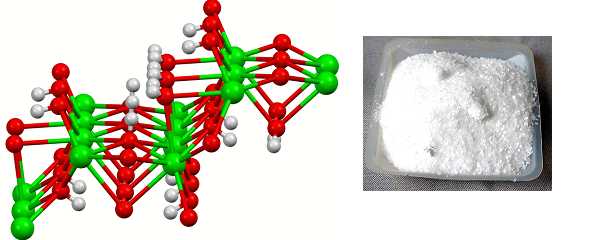
Химическая формула –
Молярная масса равна г/моль.
Физические свойства – белое порошкообразное вещество, хорошо растворимое в воде.
Плавление происходит без разложения, если дальше повышать температуру то разлагается разлагается.
Хорошо растворим в воде с образованием сильнощелочного раствора.
Химические свойства гидроксида бария
Получение
Гидроксид бария можно получить при взаимодействии бария с водой. Реакция идет уже при комнатной температуре:
Другой способ получения основывается на химической реакции оксида бария с водой:
Применение
Гидроксид бария используется в качестве реактива на сульфаты и карбонаты, для очищения растительных масел и животных жиров, как компонент различных смазок, и в неорганическом синтезе.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Гидроксид бария
Гидроксид бария — сильная основа, хотя и барий относится к щелочноземельных металлов, гидроксид бария хорошо растворим в воде. Его насыщеный раствор называют баритовых водой. Также можно встретить название — едкий Барито. Формула — Ba (OH) 2
1. Получение
Получают взаимодействием элементарного бария с водой, взаимодействием оксида бария с водой, взаимодействием солей бария с щелочами :
Ba + 2H 2 O = Ba (OH) 2 + H 2
BaO + H 2 O = Ba (OH) 2
BaSO 4 + 2 KOH = Ba (OH) 2 + K 2 SO 4 (суммарно)
2. Физические свойства
Белый порошок. В катодных лучах — желто-оранжевый цвет. Растворяется в воде, мало растворяется в ацетоне и метилацетата. Водный раствор является сильниою основой (баритовая вода). Молярная электропроводность при бесконечном открыты, при 25 ? C равна 523,8 См.см2/моль. Гигроскопичен.
3. Химические свойства
При нагревании выше 1000 ? С разлагается на оксид бария и воду :
Ba (OH) 2 = BaO + H 2 O
Взаимодействует с кислотами, кислотными оксидами, амфотерными гидроксидами :
Ba (OH) 2 + 2 HNO3 = Ba (NO 3) 2 + 2H 2 O
Ba (OH) 2 + 2 HCl = BaCl 2 + 2H 2 O
Ba (OH) 2 + SO 3 = BaSO 4 ↓ + H 2 O
Ba (OH) 2 + Zn (OH) 2 = BaZnO 2 + 2H 2 O
4. Аналитические качественные реакции
Гидроксид бария широко используют для качественного определения на наличие сульфат-ионов, карбонат-ионов:
Ba (OH) 2 + H 2 SO 4 = BaSO 4 ↓ + 2H 2 0, где BaSO 4 нерастворим, белый осадок.
Ba (OH) 2 + CO 2 = BaCO 3 ↓ + H 2 O, где BaCO 3 нерастворим осадок.
Источники
Аналитическая химия бария / Н.С. Фрумина, Н.Н. Горюнова, С.Н. Еременко, издательство Наука, 1977 г.
Растворимость кислот, оснований и солей в воде
|
nado.znate.ru
Гидроксид бария — это… Что такое Гидроксид бария?
Гидрокси́д ба́рия (е́дкий бари́т) — одно из сложных неорганических веществ. Является сильным основанием. Химическая формула — Ba(OH)2
Описание
Гидроксид бария при стандартных условиях представляет собой бесцветные кристаллы[2]. Насыщенный раствор гидроксида бария называют баритовой водой. Гигроскопичен. Не растворим в спирте, но растворим в воде. Образует кристаллогидраты с одной, двумя, семью и восемью молекулами воды. Гидроксид бария токсичен, ПДК составляет 0,5 мг/м³.
Получение
1. Взаимодействие металлического бария с водой:
2. Взаимодействие оксида бария с водой:
3. Взаимодейстивие сульфида бария с водой:
Химические свойства
1. Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
2. Взаимодействие с кислотными оксидами с образованием соли и воды:
Применение
Применяют гидроксид бария как реактив на SO42− и CO32− (сульфат- и карбонат-ионы), для очистки раститительных масел и животных жиров, как компонент смазок, для удаления SO42− (сульфат-ионов) из промышленных растворов, получения солей бария, а также гидроксидов рубидия и цезия из их сульфатов и карбонатов.
Примечания
dic.academic.ru
Гидроксид бария Википедия
Гидрокси́д ба́рия
Свойства
Гидроксид бария при стандартных условиях представляет собой бесцветные кристаллы. Гигроскопичен. Не растворим в спирте, но растворим в воде. Образует кристаллогидраты с одной, двумя, семью и восемью молекулами воды. Гидроксид бария токсичен, ПДК составляет 0,5 мг/м³.
Получение
1. Взаимодействие металлического бария с водой:
Ba+2 h3O⟶ Ba(OH)2+ h3↑{\displaystyle {\mathsf {Ba+2\ H_{2}O\longrightarrow \ Ba(OH)_{2}+\ H_{2}\uparrow }}}
2. Взаимодействие оксида бария с водой:
BaO+ h3O⟶ Ba(OH)2{\displaystyle {\mathsf {BaO+\ H_{2}O\longrightarrow \ Ba(OH)_{2}}}}
3. Взаимодействие сульфида бария с горячей водой:
BaS+2 h3O⟶ Ba(OH)2+ h3S↑{\displaystyle {\mathsf {BaS+2\ H_{2}O\longrightarrow \ Ba(OH)_{2}+\ H_{2}S\uparrow }}}
Химические свойства
1. Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
Ba(OH)2+2 HBr⟶ BaBr2+2 h3O{\displaystyle {\mathsf {Ba(OH)_{2}+2\ HBr\longrightarrow \ BaBr_{2}+2\ H_{2}O}}}
Ba(OH)2+ h3SO4⟶ BaSO4↓+2 h3O{\displaystyle {\mathsf {Ba(OH)_{2}+\ H_{2}SO_{4}\longrightarrow \ BaSO_{4}\downarrow +2\ H_{2}O}}}
2. Взаимодействие с кислотными оксидами с образованием соли и воды:
Ba(OH)2+ CO2⟶ BaCO3↓+ h3O{\displaystyle {\mathsf {Ba(OH)_{2}+\ CO_{2}\longrightarrow \ BaCO_{3}\downarrow +\ H_{2}O}}}
Ba(OH)2+ SO3⟶ BaSO4↓+ h3O{\displaystyle {\mathsf {Ba(OH)_{2}+\ SO_{3}\longrightarrow \ BaSO_{4}\downarrow +\ H_{2}O}}}
Применение
Применяют гидроксид бария в виде баритовой воды как реактив на SO42− и CO32− (сульфат- и карбонат-ионы), для очистки растительных масел и животных жиров, как компонент смазок, для удаления SO42− (сульфат
Примечания
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
wikiredia.ru
Гидроксид бария — WiKi
Свойства
Гидроксид бария при стандартных условиях представляет собой бесцветные кристаллы. Гигроскопичен. Не растворим в спирте, но растворим в воде. Образует кристаллогидраты с одной, двумя, семью и восемью молекулами воды. Гидроксид бария токсичен, ПДК составляет 0,5 мг/м³.
Получение
1. Взаимодействие металлического бария с водой:
Ba+2 h3O⟶ Ba(OH)2+ h3↑{\displaystyle {\mathsf {Ba+2\ H_{2}O\longrightarrow \ Ba(OH)_{2}+\ H_{2}\uparrow }}}
2. Взаимодействие оксида бария с водой:
BaO+ h3O⟶ Ba(OH)2{\displaystyle {\mathsf {BaO+\ H_{2}O\longrightarrow \ Ba(OH)_{2}}}}
3. Взаимодействие сульфида бария с горячей водой:
BaS+2 h3O⟶ Ba(OH)2+ h3S↑{\displaystyle {\mathsf {BaS+2\ H_{2}O\longrightarrow \ Ba(OH)_{2}+\ H_{2}S\uparrow }}}
Химические свойства
1. Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
Ba(OH)2+2 HBr⟶ BaBr2+2 h3O{\displaystyle {\mathsf {Ba(OH)_{2}+2\ HBr\longrightarrow \ BaBr_{2}+2\ H_{2}O}}}
Ba(OH)2+ h3SO4⟶ BaSO4↓+2 h3O{\displaystyle {\mathsf {Ba(OH)_{2}+\ H_{2}SO_{4}\longrightarrow \ BaSO_{4}\downarrow +2\ H_{2}O}}}
2. Взаимодействие с кислотными оксидами с образованием соли и воды:
Ba(OH)2+ CO2⟶ BaCO3↓+ h3O{\displaystyle {\mathsf {Ba(OH)_{2}+\ CO_{2}\longrightarrow \ BaCO_{3}\downarrow +\ H_{2}O}}}
Ba(OH)2+ SO3⟶ BaSO4↓+ h3O{\displaystyle {\mathsf {Ba(OH)_{2}+\ SO_{3}\longrightarrow \ BaSO_{4}\downarrow +\ H_{2}O}}}
Применение
Примечания
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
ru-wiki.org
Бария гидроксид Википедия
Гидрокси́д ба́рия (е́дкий бари́т) — неорганическое соединение, проявляющее сильные основные свойства. Химическая формула — Ba(OH)2. Насыщенный водный раствор гидроксида бария называется баритовой водой.
Свойства
Гидроксид бария при стандартных условиях представляет собой бесцветные кристаллы. Гигроскопичен. Не растворим в спирте, но растворим в воде. Образует кристаллогидраты с одной, двумя, семью и восемью молекулами воды. Гидроксид бария токсичен, ПДК составляет 0,5 мг/м³.
Получение
1. Взаимодействие металлического бария с водой:
Ba+2 h3O⟶ Ba(OH)2+ h3↑{\displaystyle {\mathsf {Ba+2\ H_{2}O\longrightarrow \ Ba(OH)_{2}+\ H_{2}\uparrow }}}
2. Взаимодействие оксида бария с водой:
BaO+ h3O⟶ Ba(OH)2{\displaystyle {\mathsf {BaO+\ H_{2}O\longrightarrow \ Ba(OH)_{2}}}}
3. Взаимодействие сульфида бария с горячей водой:
BaS+2 h3O⟶ Ba(OH)2+ h3S↑{\displaystyle {\mathsf {BaS+2\ H_{2}O\longrightarrow \ Ba(OH)_{2}+\ H_{2}S\uparrow }}}
Химические свойства
1. Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
Ba(OH)2+2 HBr⟶ BaBr2+2 h3O{\displaystyle {\mathsf {Ba(OH)_{2}+2\ HBr\longrightarrow \ BaBr_{2}+2\ H_{2}O}}}
Ba(OH)2+ h3SO4⟶ BaSO4↓+2 h3O{\displaystyle {\mathsf {Ba(OH)_{2}+\ H_{2}SO_{4}\longrightarrow \ BaSO_{4}\downarrow +2\ H_{2}O}}}
2. Взаимодействие с кислотными оксидами с образованием соли и воды:
Ba(OH)2+ CO2⟶ BaCO3↓+ h3O{\displaystyle {\mathsf {Ba(OH)_{2}+\ CO_{2}\longrightarrow \ BaCO_{3}\downarrow +\ H_{2}O}}}
Ba(OH)2+ SO3⟶ BaSO4↓+ h3O{\displaystyle {\mathsf {Ba(OH)_{2}+\ SO_{3}\longrightarrow \ BaSO_{4}\downarrow +\ H_{2}O}}}
Применение
Применяют гидроксид бария в виде баритовой воды как реактив на SO42− и CO32− (сульфат- и карбонат-ионы), для очистки растительных масел и животных жиров, как компонент смазок, для удаления SO42− (сульфат-ионов) из промышленных растворов, получения солей бария, а также гидроксидов рубидия и цезия из их сульфатов и карбонатов.
Примечания
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
wikiredia.ru
Гидроксид бария — Gpedia, Your Encyclopedia
Гидрокси́д ба́рия (е́дкий бари́т) — неорганическое соединение, проявляющее сильные основные свойства. Химическая формула — Ba(OH) 2. Насыщенный водный раствор гидроксида бария называется баритовой водой.
Свойства
Гидроксид бария при стандартных условиях представляет собой бесцветные кристаллы. Гигроскопичен. Не растворим в спирте, но растворим в воде. Образует кристаллогидраты с одной, двумя, семью и восемью молекулами воды. Гидроксид бария токсичен, ПДК составляет 0,5 мг/м³.
Получение
1. Взаимодействие металлического бария с водой:
Ba+2 h3O⟶ Ba(OH)2+ h3↑{\displaystyle {\mathsf {Ba+2\ H_{2}O\longrightarrow \ Ba(OH)_{2}+\ H_{2}\uparrow }}}
2. Взаимодействие оксида бария с водой:
BaO+ h3O⟶ Ba(OH)2{\displaystyle {\mathsf {BaO+\ H_{2}O\longrightarrow \ Ba(OH)_{2}}}}
3. Взаимодействие сульфида бария с горячей водой:
BaS+2 h3O⟶ Ba(OH)2+ h3S↑{\displaystyle {\mathsf {BaS+2\ H_{2}O\longrightarrow \ Ba(OH)_{2}+\ H_{2}S\uparrow }}}
Химические свойства
1. Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации)
Ba(OH)2+2 HBr⟶ BaBr2+2 h3O{\displaystyle {\mathsf {Ba(OH)_{2}+2\ HBr\longrightarrow \ BaBr_{2}+2\ H_{2}O}}}
Ba(OH)2+ h3SO4⟶ BaSO4↓+2 h3O{\displaystyle {\mathsf {Ba(OH)_{2}+\ H_{2}SO_{4}\longrightarrow \ BaSO_{4}\downarrow +2\ H_{2}O}}}
2. Взаимодействие с кислотными оксидами с образованием соли и воды:
Ba(OH)2+ CO2⟶ BaCO3↓+ h3O{\displaystyle {\mathsf {Ba(OH)_{2}+\ CO_{2}\longrightarrow \ BaCO_{3}\downarrow +\ H_{2}O}}}
Ba(OH)2+ SO3⟶ BaSO4↓+ h3O{\displaystyle {\mathsf {Ba(OH)_{2}+\ SO_{3}\longrightarrow \ BaSO_{4}\downarrow +\ H_{2}O}}}
Применение
Применяют гидроксид бария в виде баритовой воды как реактив на SO42− и CO32− (сульфат- и карбонат-ионы), для очистки растительных масел и животных жиров, как компонент смазок, для удаления SO42− (сульфат-ионов) из промышленных растворов, получения солей бария, а также гидроксидов рубидия и цезия из их сульфатов и карбонатов.
Примечания
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
www.gpedia.com

