Дихлорметан, структурная формула, химические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Дихлорметан
Дихлорметан – это синтетическое химическое вещество, которое создано руками человека. Оно не встречается в природе. На внешний вид представляет прозрачную жидкость. Отличительной особенностью этого вещества считается наличие сладковатого запаха, напоминающего хлороформ.
Химическая формула дихлорметана Ch3Cl2. В химической промышленности это вещество имеет несколько названий: метилен хлористый, метиленхлорид или дихлорметан. Производится согласно ГОСТу 9968-86 «Метилен хлористый технический. Технические условия».
Физико-химические особенности
Дихлорметан производится в виде органического вещества, которое способно воспламенятся и взрываться. Это химическое соединение не вступает в реакции с водной средой, но способно растворять множество других органических веществ. Плотность дихлорметана составляет 1,33 г/см³.
Класс органических соединений дихлорметана – алифатические галогеносодержащие вещества. Из-за своей жидкой консистенции он считается весьма летучим и подвижным веществом, в котором полностью отсутствуют любые механические включения или примеси. Характерная черта– это едкий приторно-сладкий запах.
Из-за своей жидкой консистенции он считается весьма летучим и подвижным веществом, в котором полностью отсутствуют любые механические включения или примеси. Характерная черта– это едкий приторно-сладкий запах.
Хлористый метилен или дихлорметан впервые был открыт в 1840 году. В то время его получили в результате выдержки смеси из хлора и метила. Современные производственные химические компании изготовляют дихлорметан путем хлорирования метана хлором. В результате этой реакции химики получают большое количество различных хлорсодержащих веществ, среди которых в чистом виде присутствует и метиленхлорид.
Существует цепочка реакций, которая наглядно демонстрирует превращение метана в хлорметан и дихлорметан.
Сh5+Cl2->Ch4Cl+HCl
Ch4Cl+Cl2->Ch3Cl2+HCl
Ch3Cl2+Cl2->CHCl3+HCl
Хлорметан считается производной дихлорметана. Это вещество представляет едкий газ, который отличается сильным токсическим действием.
В процессе гидролиза дихлорметан может образовывать формалин и соляную кислоту.
Ch3Cl2+h3O -> 2HCl + HCHO
Сферы применения
Применение дихлорметана обусловлено его способностью растворять различные органические вещества. Его также вводят в составы пинополиуретанов в качестве пенообразующего вещества. Дихлорметан в качестве растворителя используют в:
- • производстве различных полимеров,
- • строительной сфере,
- • текстильной промышленности,
- • производстве красок и лаков,
- • пищевой промышленности.
Метиленхлорид является незаменимым химическим веществом, которое помогает в процессе экстрагирования. Дихлорметан применяют в процессе изготовления чая и кофе, в пивоварении. Также это химическое соединение принимает участие в процессе производства различных ароматизаторов, которые используют для мороженого, напитков, конфет, различных фруктовых джемов и наполнителей. Дихлорметан применяют в качестве растворителя жировых соединений в процессе обработки экзотических фруктов.
Дихлорметан применяют в качестве растворителя жировых соединений в процессе обработки экзотических фруктов.
Метиленхлорид или дихлорметан используют в процессе отбора проб воды. С его помощью проводят анализ воды на наличие токсических веществ, нитритов и нитратов, кислот, тяжелых металлов и т.д.
В строительной сфере дихлорметан помогает удалить жировую пленку с бетона, керамики, битума. Он растворяет смолы и обезжиривает металлические конструкции. Также свойства дихлорметана нашли свое применение в процессе производства поролоновых материалов. Это хиическое вещество применяют в процессе вспенивания низкоплотных поролонов.
Метилен хлористый не только растворяет жиросодержащие вещества, но и способен к склеиванию различных пластиков:
- • полистирола,
- • оргстекла,
- • поликарбонатов,
- • АБС-полимеров.
Дихлорметан начали применять в фармацевтической сфере. С его помощью производят синтез аскорбиновой кислоты.
С его помощью производят синтез аскорбиновой кислоты.
Это вещество используют в процессе производства кинопленок. Дихлорметан способствует моментальному застыванию различных пластмассовых смесей. С недавнего времени это вещество стали использовать в процессе производства духов.
В сельском хозяйстве дихлорметан входит в составы некоторых пестицидов и фумигантов. Его добавляют в некоторые пленки.
Широкое применение дихлорметана обусловлено его доступной ценой и простотой производства. Его ценят в различных сферах производства за способность к растворению различных жиров и кислот, простое применение и удаление с обрабатываемых поверхностей.
Безопасность вещества
Класс опасности дихлорметана 4. Это означает, что данное вещество относится к малоопасным и безопасным химическим соединениям. Но во время работы и хранения дихлорметана нужно быть максимально осторожным, так как это соединение способно быстро улетучиваться, что может привести к взрыву.
При непосредственном контакте с этим веществом нужно надевать защитную одежду, респиратор, защитные очки и перчатки. При длительном воздействии на организм дихлорметан способен вызвать наркоз. Он пагубно влияет на состояние нервной системы, может вызывать зрительные и слуховые галлюцинации. Дихдлорметан способен влиять на работу ЖКТ, почек и печени.
Первые симптомы отравления дихлорметаном:
- • головная боль,
- • головокружение.
- • тошнота,
- • отсутствие аппетита.
Если это вещество попало на кожу человека, то на месте контакта может появиться ожог. Допустимая норма концентрации дихлорметана в воздухе составляет 50 мг/м³. Средняя цена дихлорметана в Российской Федерации составляет 50-60 рулей за 1 кг.
Технические жидкости — Метилен хлористый, Дихлорметан
Метилен хлористый, Дихлорметан
МЕТИЛЕН ХЛОРИСТЫЙ, ДИХЛОРМЕТАН, ХЛОРИСТЫЙ МЕТИЛЕН
МЕТИЛЕН ХЛОРИСТЫЙ — Прозрачная легкоподвижная и легколетучая жидкость для промывки и чистки оборудования (шлангов, жидкостной системы оборудования, проточных тэнов, распылительных пистолетов и т. д.) от свежих и полимеризовавшихся пенополиуретаноых составов – изоцианата, полиола и готовой пены. Используется для промывки оборудования при замене составов распыления. При чистке применяется путем замачивания на некоторое время деталей оборудования без уплотнительных соединений.
д.) от свежих и полимеризовавшихся пенополиуретаноых составов – изоцианата, полиола и готовой пены. Используется для промывки оборудования при замене составов распыления. При чистке применяется путем замачивания на некоторое время деталей оборудования без уплотнительных соединений.
Так же хлористый метилен – широко применяемый в различных отраслях промышленности растворитель. В силу высокой летучести, весьма опасен, не только для человека, но и окружающей среды. Способность растворять многие органические вещества, привела к широкому спектру задач, решаемых с его помощью. Используется для обезжиривания поверхностей, растворения битума, жиров, смол.
Технические характеристики
Потребительские свойства:
| Параметры | Значение | Единица измерения |
|---|---|---|
| Сорт | Высший | — |
| ГОСТ | 9968-86 | — |
| CAS | 75-09-2 | — |
| Формула | Ch3Cl2 | — |
| Плотность |
1. 3 3
|
кг/л. |
| Гарантийный срок хранения | 1 | год |
| Страна / изготовитель | Бельгия | — |
Потребительские свойства:
| Параметры | Значение | Единица измерения |
|---|---|---|
| Сорт | Высший | — |
| ГОСТ | 9968-86 | — |
| CAS | 75-09-2 | — |
| Формула | Ch3Cl2 | — |
| Плотность |
1. 3 3
|
кг/л. |
| Гарантийный срок хранения | 1 | год |
| Страна / изготовитель | Бельгия | — |
Качественные характеристики:
| Параметры | Значение | Единица измерения |
|---|---|---|
| Содержание основного вещества | > 99.95 | % |
| Четыреххлористый углерод, не более | < 12 | мгр/кг. |
| Хлороформ | < 56 |
мгр/кг.
|
| 1.2-дихлорэтан | < 100 | мгр/кг. |
| 1.1-дихлорэтилен | < 100 | мгр/кг. |
| Стабилизатор (Amylene) | 40 ~ 60 | мгр/кг. |
| Вода (h3O) | < 50 | мгр/кг. |
| Кислотность (Hcl) | < 5 | мгр/кг. |
| Хлорные соединения (Cl2) | < 1 | мгр/кг. |
| Остаток при испарении | < 10 |
мгр/кг.
|
| Тяжелые Металлы (Pb) | < 1 | мгр/кг. |
| Цвет | < 10 | АРНА |
| Показатель преломления | 1.42 ~ 1.43 | nD20 |
| Диапазон плотности | 1.32 ~ 1.33 | d20/20 |
Рекомендации по использованию:
∙ Не вдыхать пары;
∙ Работать в средствах защиты дыхания;
∙ Работать в перчатках;
∙ Не использовать пластиковую тару;
СРОК ГОДНОСТИ: 1 год.
Пластификаторы на основе дибутилфталата должны храниться в таре изготовителя или в герметично закрытой алюминиевой емкости либо из нержавеющей стали. При хранении необходимо исключить попадание влаги и прямых солнечных лучей.
При хранении необходимо исключить попадание влаги и прямых солнечных лучей.
Подробные характеристики
Необходимые документы
УТЕПЛЕНИЕ ЧАСТНОГО ДОМА
БЕСПЛАТНЫЙ звонок с сайтаРассчитать стоимость
СМОТРЕТЬ ВИДЕО ЧИТАТЬ СТАТЬИ
Дихлорметан — Американское химическое общество
- Вы здесь:
- СКУД
- Молекула недели
- Молекула недели Архив
- Архив — Д
- Дихлорметан
Молекула недели Архив
04 марта 2019 г.
Предыдущий Далее
Вы беспокоитесь, что я загрязню ваш кофе без кофеина? Не будь.
Какая я молекула?
Март — месяц растворителей MOTW! Это первая из четырех статей о ключевых растворителях — прим. ред.
Дихлорметан, обычно называемый метиленхлоридом, представляет собой растворитель, который широко используется в химических исследованиях и производстве. Это очень летучая жидкость (см. таблицу быстрых фактов), но она не воспламеняется и не взрывоопасна на воздухе.
Дихлорметан обычно получают путем хлорирования метана. В процессе также образуются три других хлоруглеводорода C 1 — хлорметан, трихлорметан (хлороформ) и тетрахлорметан (четыреххлористый углерод). Эти четыре вещества разделяют перегонкой.
Хотя дихлорметан является наименее токсичным C 1 хлоруглеводородом, он представляет опасность. Вдыхание его может вызвать симптомы, варьирующиеся от сонливости до раздражения дыхательных путей и даже смерти. Он также может быть канцерогенным, но было проведено недостаточно исследований, чтобы установить степень воздействия, вызывающего рак.
Он также может быть канцерогенным, но было проведено недостаточно исследований, чтобы установить степень воздействия, вызывающего рак.
Несмотря на опасность для здоровья, дихлорметан является одним из основных растворителей, используемых для удаления кофеина из кофейных зерен. После удаления кофеина летучесть растворителя позволяет легко удалить остаточный растворитель. Любой оставшийся дихлорметан значительно ниже концентрации в 10 частей на миллион, разрешенной Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США.
Информация об опасности дихлорметана| Классификация СГС*: раздражение кожи, категория 2 | |
| h415 — вызывает раздражение кожи | |
| Классификация СГС: серьезное раздражение глаз, категория 2A | |
| h419 — вызывает серьезное раздражение глаз | |
| Классификация СГС: специфическая токсичность для органа-мишени, однократное воздействие, наркотическое действие, категория 3 | |
| h436 — Может вызывать сонливость или головокружение | |
| Классификация СГС: канцерогенность, категория 2 | |
| h451 — Предположительно вызывает рак | |
| Классификация СГС: опасность для водной среды, острая опасность, категория 3 | |
| h502 — Вреден для водных организмов | |
*Глобально согласованная система классификации и маркировки химических веществ. Пояснения к пиктограммам.
Пояснения к пиктограммам.
| Рег. CAS. № | 75-09-2 |
| Эмпирическая формула | CH 2 Класс 2 |
| Молярная масса | 84,93 г/моль |
| Внешний вид | Бесцветная жидкость |
| Температура кипения | 40 ºC |
| Растворимость в воде | 13 г/л |
Обновление MOTW:
01 апреля 2019 г.
Дихлорметан (он же метиленхлорид) десятилетиями был полезным растворителем; но из-за его значительных опасностей его используют в меньшем количестве приложений. В середине марта Агентство по охране окружающей среды США завершило запрет на использование дихлорметана в качестве ингредиента в средствах для удаления красок и покрытий, используемых потребителями, который вступит в силу в конце 2019 года. потребительского и промышленного использования, недостаточно далеко.
потребительского и промышленного использования, недостаточно далеко.
Узнайте больше об этой молекуле из CAS, самого авторитетного и всеобъемлющего источника химической информации.
Молекула недели нуждается в ваших предложениях!
Если вашей любимой молекулы нет в нашем архиве, отправьте электронное письмо по адресу [email protected]. Молекула может быть примечательна своим текущим или историческим значением или по какой-либо причудливой причине. Благодарю вас!
Оставайтесь на шаг впереди химии
Узнайте, как ACS может помочь вам оставаться впереди в мире химии.
Подробнее
Метиленхлорид | 75-09-2
Описание
Метиленхлорид (дихлорметан (ДХМ)) представляет собой летучую бесцветную жидкость со сладким запахом, которая используется в качестве растворителя для многих применений, включая покрытие фотопленок, в аэрозольных составах и в процессах окраски, где желательна высокая летучесть, и в качестве обычного «вспенивателя» для синтетических пен. Эта летучесть может привести к высоким концентрациям в плохо проветриваемых помещениях. Метиленхлорид использовался в качестве пропеллента для лака для волос, но это использование было прекращено в 1919 г.89. Это мощный растворитель, который эффективно растворяет эфиры целлюлозы, жиры, масла, смолы и каучук.
Эта летучесть может привести к высоким концентрациям в плохо проветриваемых помещениях. Метиленхлорид использовался в качестве пропеллента для лака для волос, но это использование было прекращено в 1919 г.89. Это мощный растворитель, который эффективно растворяет эфиры целлюлозы, жиры, масла, смолы и каучук.
ДХМ является наиболее водорастворимым и одним из наименее токсичных из хлорметанов, с преобладающим токсическим эффектом угнетения ЦНС, выражающимся в виде наркоза. Сообщаемые системные эффекты после несмертельного воздействия метиленхлорида включают головную боль, головокружение, ступор, раздражительность, онемение, психомоторные расстройства и повышение уровня карбоксигемоглобина в крови. Быстрое удаление из зоны воздействия обычно приводит к полному выздоровлению. Метиленхлорид слегка раздражает кожу, а его всасывание через кожу не считается серьезной угрозой для здоровья человека. Зрительный контакт может быть болезненным, но вряд ли приведет к серьезной травме. Адаптация к парам хлористого метилена происходит при повторном контакте, что снижает способность обнаруживать воздействие.
Химические свойства
Метиленхлорид, хлорированный растворитель, представляет собой летучую бесцветную жидкость со сладким запахом. Его часто называют дихлорметаном. Метиленхлорид имеет множество промышленных применений, таких как снятие краски, очистка металла и обезжиривание.
Метиленхлорид не встречается в природе в окружающей среде. Хлористый метилен используется как промышленный растворитель и как растворитель для краски. Его также можно найти в некоторых аэрозолях и пестицидах, и он используется в производстве фотопленки.
Использование
Метиленхлорид используется в качестве растворителя, особенно там, где требуется высокая летучесть. Это хороший растворитель для масел, жиров, восков, смол, битума, каучука и ацетата целлюлозы, а также полезное средство для удаления краски и обезжиривателя. Он используется в средствах для удаления краски, в пропеллентах для аэрозольных баллончиков, в качестве растворителя пластмасс, в качестве обезжиривающего агента, в качестве экстрагирующего агента в фармацевтической промышленности и в качестве пенообразователя в пенополиуретанах.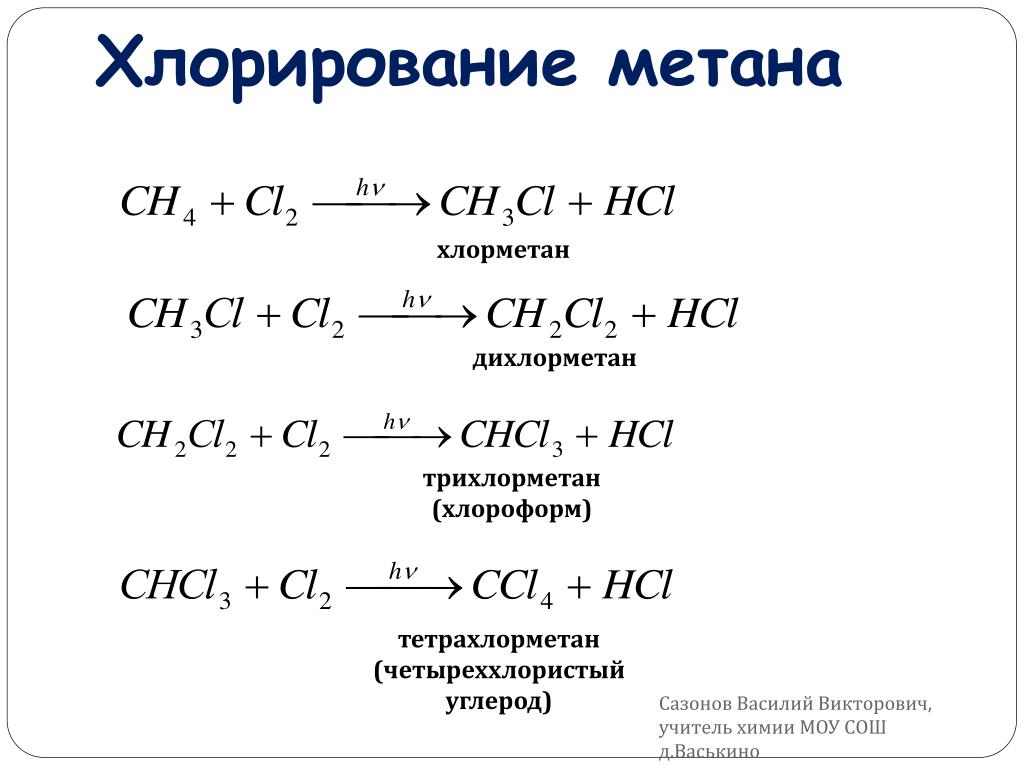 Его растворяющие свойства иногда увеличиваются путем смешивания с метанолом, нефтяным бензином или тетрахлорэтиленом.
Его растворяющие свойства иногда увеличиваются путем смешивания с метанолом, нефтяным бензином или тетрахлорэтиленом.
Метиленхлорид является активным ингредиентом многих средств для удаления краски, включая промышленные средства для удаления краски и коммерческой мебели, средства для удаления краски в домашних условиях и продукты, используемые для обслуживания самолетов. Химикат обладает уникальной способностью проникать, образовывать пузыри и снимать самые разные лакокрасочные покрытия. Составы химикатов широко используются как в проточных, так и в погружных (погружных) баках при ремонте мебели. Для технического обслуживания военных и коммерческих самолетов часто требуется продукт на основе метиленхлорида для проверки поверхности на наличие повреждений.
С середины 1990-х годов хлористый метилен заменил 1,1,1-трихлорэтан в рецептурах негорючих клеев для промышленного применения, включая изготовление обивочной пены. Он обеспечивает клейкие составы с прочными, мгновенными характеристиками склеивания и эффективностью при экстремальных температурах и влажности. При использовании пенопласта использование метиленхлорида исключает возможность образования жестких швов и обеспечивает полное соответствие требованиям к воспламеняемости мягкой мебели.
При использовании пенопласта использование метиленхлорида исключает возможность образования жестких швов и обеспечивает полное соответствие требованиям к воспламеняемости мягкой мебели.
Метиленхлорид используется в аэрозолях в качестве сильного растворителя, подавителя воспламеняемости, подавителя давления паров и понизителя вязкости. Текущие аэрозольные применения метиленхлорида включают аэрозольные краски и смазочные материалы.
Хлористый метилен является ведущим вспомогательным вспенивающим агентом, используемым в производстве плит эластичных пенополиуретанов для производства мебели и постельных принадлежностей. Метиленхлорид используется в качестве экстрагента при извлечении и очистке широкого спектра материалов, включая масла, жиры и воски. Химическое вещество используется для декофеинизации кофе и чая, экстракции живицы из различных специй и для экстракции хмеля. Как и в случае с покрытиями для таблеток, в готовом продукте практически не остается химических веществ.
Подготовка
Метиленхлорид получают в результате хлорирования метана, в ходе которого могут образовываться другие производные хлорированного метана. Оксид пропилена, циклогексан и/или 2-метил-2-бутен добавляют в качестве стабилизаторов. Чистота зависит от количества С2 и высших углеводородов в метане и степени хлорирования. Могут присутствовать небольшие количества некоторых других хлорированных соединений. Метиленхлорид обычно извлекают из процессов экстракции, и несколько сортов обычно встречаются в торговле. Метиленхлорид стабилен в сухом виде, но гидролизуется в присутствии воды.
Оксид пропилена, циклогексан и/или 2-метил-2-бутен добавляют в качестве стабилизаторов. Чистота зависит от количества С2 и высших углеводородов в метане и степени хлорирования. Могут присутствовать небольшие количества некоторых других хлорированных соединений. Метиленхлорид обычно извлекают из процессов экстракции, и несколько сортов обычно встречаются в торговле. Метиленхлорид стабилен в сухом виде, но гидролизуется в присутствии воды.
Опасность для здоровья
Когда хлористый метилен попадает в организм человека, он влияет на функцию мозга, например, неспособность концентрироваться. При достаточно высоком уровне он может перестать дышать. При более низких уровнях воздействие метиленхлорида вызывает головокружение, усталость, головные боли и тошноту. Метиленхлорид распадается на другие химические вещества в организме, такие как окись углерода. Кроме того, хлористый метилен может вытеснять кислород в рабочей среде из-за высокого давления паров. Контакт кожи с метиленхлоридом вызывает жжение и покраснение кожи.
Контакт кожи с метиленхлоридом вызывает жжение и покраснение кожи.
Несовместимости
Хлористый метилен реагирует с сильными окислителями, едкими веществами, химически активными металлами, такими как порошки алюминия и магния, калием, натрием и концентрированной азотной кислотой.
Физические свойства
Распространенным синонимом хлористого метилена является дихлорметан.
Метиленхлорид — бесцветная жидкость со сладковатым запахом.
Химическая формула хлористого метилена – Ch3Cl2, молекулярная масса – 84,93 г/моль.
Давление паров хлористого метилена составляет 349 мм рт.ст. при 20 °C, а коэффициент октанол/вода (log K ow ) равен 1,30.
Метиленхлорид имеет порог запаха 250 частей на миллион (ppm).
Хлористый метилен мало растворим в воде и негорюч.
Использование
Метиленхлорид преимущественно используется в качестве растворителя в средствах для снятия краски и смывках; в качестве технологического растворителя при производстве лекарств, фармацевтических препаратов и пленочных покрытий; в качестве растворителя для очистки и отделки металлов в производстве электроники; и в качестве агента при вдувании уретановой пены.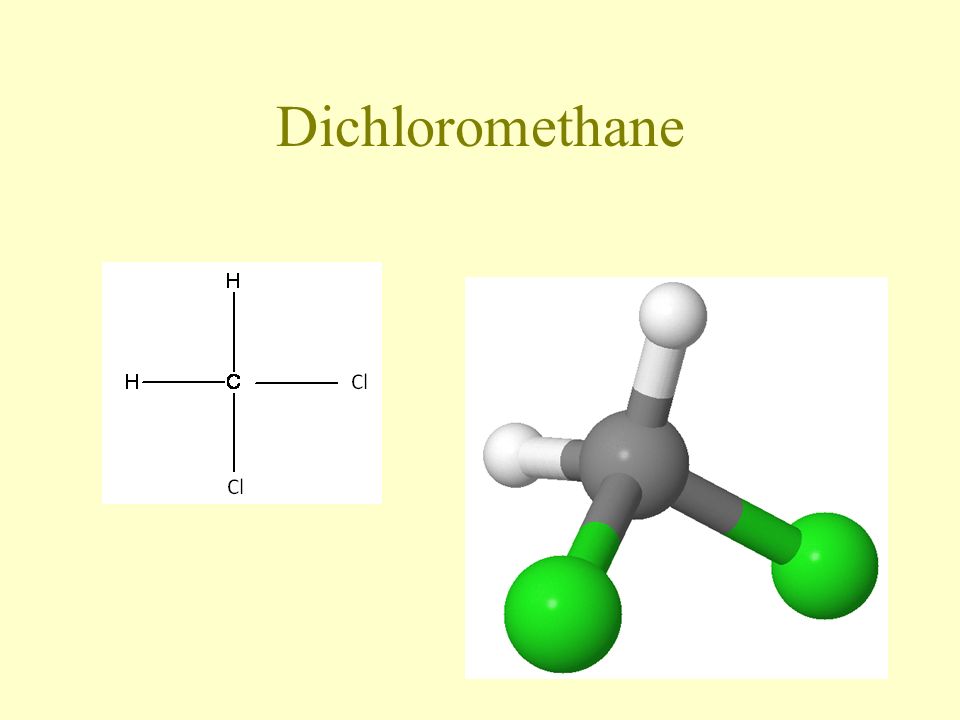
Метиленхлорид также используется в качестве пропеллента в аэрозолях для таких продуктов, как краски, автомобильные товары и спреи от насекомых.
Он используется в качестве растворителя для экстракции масляных смол специй, хмеля и для удаления кофеина из кофе. Однако из-за опасений по поводу остаточного растворителя большинство декофеинаторов больше не используют метиленхлорид.
Метиленхлорид также одобрен для использования в качестве послеуборочного фумиганта для зерна и клубники и в качестве градуирующего агента для цитрусовых.
Подготовка
Метиленхлорид был впервые получен Реньо в 1840 году путем хлорирования метиленхлорида на солнечном свете. Он стал важным промышленным химикатом во время Второй мировой войны. В настоящее время для производства метиленхлорида используются два промышленных процесса — гидрохлорирование метанола и прямое хлорирование метана (Rossberg et al., 1986; Holbrook, 1993).
Преобладающий метод производства метиленхлорида использует в качестве первой стадии реакцию хлористого водорода и метанола с получением метилхлорида. Затем избыток хлористого метила смешивают с хлором и вступают в реакцию с образованием метиленхлорида с хлороформом и четыреххлористым углеродом в качестве побочных продуктов. Эту реакцию обычно проводят в газовой фазе термически, но ее также можно проводить каталитически или фотолитически. При низкой температуре и высоком давлении жидкофазный процесс способен обеспечить высокую селективность по метиленхлориду (Rossberg et al., 19).86; Холбрук, 1993).
Более старый и в настоящее время менее используемый метод производства метиленхлорида включает прямую реакцию избытка метана с хлором при высоких температурах (400–500°C) или при несколько более низких температурах либо каталитически, либо фотолитически. Метилхлорид, хлороформ и четыреххлористый углерод также образуются как побочные продукты (Rossberg et al., 1986; Holbrook, 1993).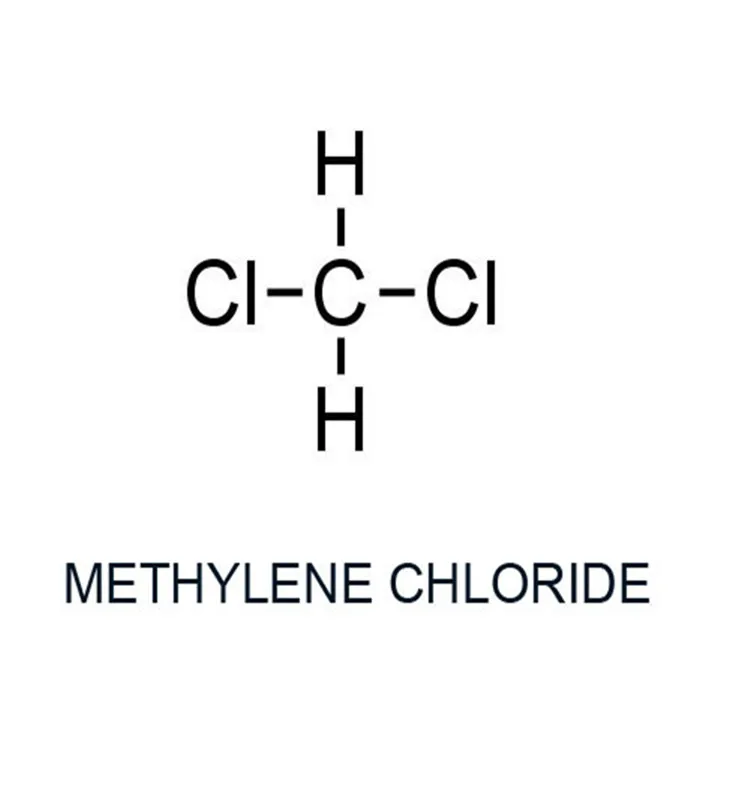
Мировое производство метиленхлорида увеличилось с 93 тысяч тонн в 1960 году до примерно 570 тысяч тонн в 1919 году.80 (Edwards et al., 1982) и, как полагают, все еще составляет несколько сотен тысяч тонн. Производство в Соединенных Штатах неуклонно снижалось с 1981 по 1993 год, о чем свидетельствуют следующие цифры (тыс. тонн): 1981 г. — 404; 1984, 275; 1987, 234; 1990, 209; 1993, 160 (анон., 1994, 1997). Общее количество, произведенное в Западной Европе, колебалось от 331 500 тонн в 1986 г. до 254 200 тонн в 1991 г. (ВОЗ, 1996).
Опасность для здоровья
Хлористый метилен преимущественно используется в качестве растворителя. Острые (краткосрочные) последствия вдыхания метиленхлорида у людей в основном связаны с воздействием на нервную систему, включая снижение зрительных, слуховых и двигательных функций, но эти эффекты обратимы после прекращения воздействия. Последствия хронического (длительного) воздействия хлористого метилена предполагают, что центральная нервная система (ЦНС) является потенциальной мишенью у людей и животных. Данные о людях неубедительны в отношении метиленхлорида и рака. Исследования на животных показали увеличение случаев рака печени и легких, а также доброкачественных опухолей молочной железы после вдыхания метиленхлорида.
Данные о людях неубедительны в отношении метиленхлорида и рака. Исследования на животных показали увеличение случаев рака печени и легких, а также доброкачественных опухолей молочной железы после вдыхания метиленхлорида.
Химическая реактивность
Интенсивно реагирует с активными металлами (литий, натрий, калий) и сильными основаниями (трет-бутоксид калия) (Sax, 1984)
Промышленное использование
Метиленхлорид был предложен и уже используется в коммерческих целях в качестве заменителя хлорфторуглеродных вспомогательных пенообразователей. Метиленхлорид очень летуч (температура кипения 39.8°С) и инертен в полиуретанообразующих смесях. Однако метиленхлорид считается канцерогеном и оказывает другие вредные воздействия на рабочих, подвергающихся его воздействию. Соответственно, концентрация хлористого метилена в воздухе внутри установки по производству пеноматериала должна поддерживаться на низком уровне. Американская конференция государственных специалистов по промышленной гигиене рекомендует, чтобы рабочие не подвергались воздействию более 50 частей на миллион этого химического вещества, в то время как допустимый предел воздействия Управления по охране труда и здоровья составляет 500 частей на миллион. Поддержание уровня метиленхлорида на заводе по производству пеноматериала ниже 50 частей на миллион может потребовать дополнительного вентиляционного оборудования, что повлечет за собой увеличение затрат. Кроме того, это химическое вещество является признанным загрязнителем окружающей среды, и как федеральное правительство, так и правительства штатов начинают ограничивать выбросы химического вещества с заводов, которые его используют. Таким образом, в ближайшем будущем установки, использующие метиленхлорид в качестве вспомогательного пенообразователя, могут столкнуться со значительными дополнительными расходами на установку скрубберов или аналогичного оборудования для удаления метиленхлорида из воздуха и/или других газов, выбрасываемых с установки.
Американская конференция государственных специалистов по промышленной гигиене рекомендует, чтобы рабочие не подвергались воздействию более 50 частей на миллион этого химического вещества, в то время как допустимый предел воздействия Управления по охране труда и здоровья составляет 500 частей на миллион. Поддержание уровня метиленхлорида на заводе по производству пеноматериала ниже 50 частей на миллион может потребовать дополнительного вентиляционного оборудования, что повлечет за собой увеличение затрат. Кроме того, это химическое вещество является признанным загрязнителем окружающей среды, и как федеральное правительство, так и правительства штатов начинают ограничивать выбросы химического вещества с заводов, которые его используют. Таким образом, в ближайшем будущем установки, использующие метиленхлорид в качестве вспомогательного пенообразователя, могут столкнуться со значительными дополнительными расходами на установку скрубберов или аналогичного оборудования для удаления метиленхлорида из воздуха и/или других газов, выбрасываемых с установки. Кроме того, Калифорния недавно предложила, чтобы выбросы метиленхлорида в этом штате облагались высоким налогом на «загрязнение», и другие штаты, вероятно, последуют аналогичному курсу.
Кроме того, Калифорния недавно предложила, чтобы выбросы метиленхлорида в этом штате облагались высоким налогом на «загрязнение», и другие штаты, вероятно, последуют аналогичному курсу.
Потенциальное воздействие
Основным путем воздействия метиленхлорида на человека является вдыхание окружающего воздуха.
Профессиональное и потребительское воздействие метиленхлорида в воздухе помещений может быть намного выше, особенно при окраске распылением или другом использовании аэрозолей. Люди, работающие в этих местах, могут вдохнуть химическое вещество или оно может попасть на кожу.
Хлористый метилен был обнаружен в пробах поверхностных и подземных вод, взятых на полигонах опасных отходов, а также в питьевой воде в очень низких концентрациях.
хранение
Перед работой с метиленхлоридом вы должны пройти обучение по правильному обращению с ним и его хранению.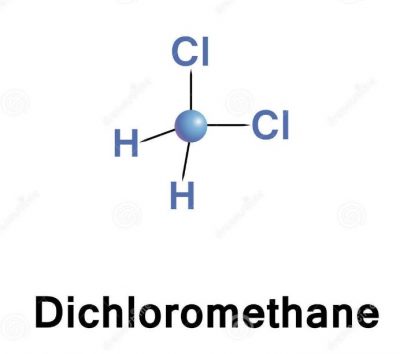
Должна быть установлена регулируемая, отмеченная зона, где метиленхлорид обрабатывается, используется или хранится в соответствии со стандартом OSHA по метиленхлориду (29 CFR 1910.1052).
Метиленхлорид бурно реагирует с ОКИСЛЯЮЩИМИ АГЕНТАМИ (такими как ПЕРХЛОРАТЫ, ПЕРОКСИДЫ, ПЕРМАНГАНАТЫ, ХЛОРАТЫ, НИТРАТЫ, ХЛОР, БРОМ и ФТОР, ХИМИЧЕСКИ АКТИВНЫМИ МЕТАЛЛАМИ (такими как КАЛИЙ, НАТРИЙ, МАГНИЙ и АЛЮМИНИЙ) и СИЛЬНЫМИ ОСНОВАНИЯМИ (такими как НАТРИЙ ГИДРОКСИД и КАЛИЙ ГИДРОКСИД).0025
Метиленхлорид не совместим с жидким кислородом, титаном и аминами.
Хранить в плотно закрытых емкостях в прохладном, хорошо проветриваемом помещении вдали от металлов и легких.
Метиленхлорид воздействует на некоторые формы РЕЗИНОВЫХ ПЛАСТИКОВ и ПОКРЫТИЙ и вызывает коррозию железа. НЕРЖАВЕЮЩАЯ СТАЛЬ, МЕДЬ и НИКЕЛЬ в присутствии ВОДЫ.
Структура Льюиса Ch3Cl2, молекулярная геометрия, полярность
Наука
- Автор: Priyanka
21 октября
Метиленхлорид, также известный как дихлорметан (ДХМ), представляет собой органическое химическое соединение. Ch3Cl2 — это химическая формула ДХМ. Это бесцветная летучая жидкость со сладким запахом. Соединение естественным образом получено из вулканов, водно-болотных угодий и других океанических источников. Он имеет множество применений, но в основном он используется в пищевой промышленности. В этой статье мы узнаем структуру, молекулярную геометрию , приложения и другие химические свойства в деталях.
Состав
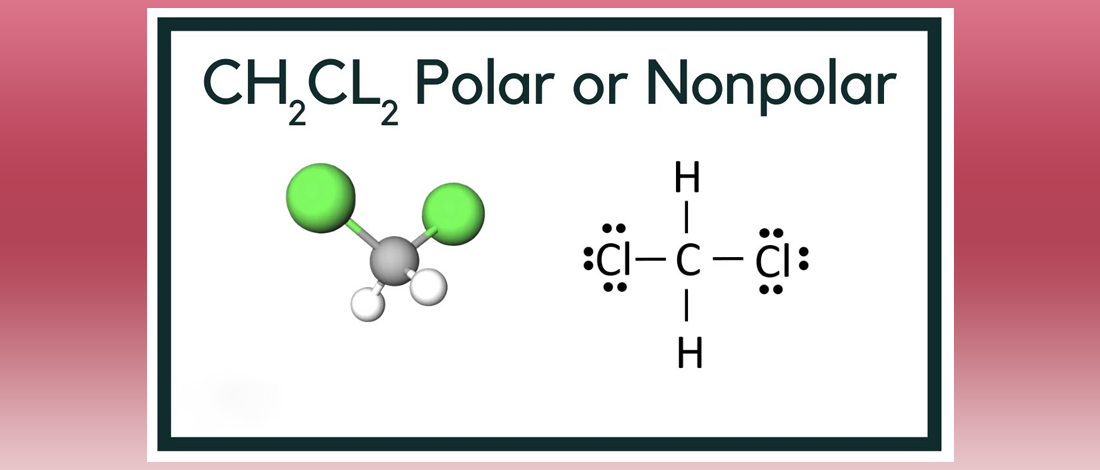
Ch3Cl2 Структура Льюиса Для понимания свойств и строения любых химических соединений, в том числе органических, чрезвычайно важна их структура Льюиса. Структура Льюиса — это теория, которая помогает понять структуру данного соединения на основе правила октетов. Согласно правилу октета, молекула должна иметь восемь электронов на внешней оболочке, чтобы стать инертной или стабильной. Для этого соединения есть одна молекула углерода, две молекулы водорода и две молекулы хлора.
Согласно правилу октета, молекула должна иметь восемь электронов на внешней оболочке, чтобы стать инертной или стабильной. Для этого соединения есть одна молекула углерода, две молекулы водорода и две молекулы хлора.
Чтобы узнать структуру Льюиса, необходимо определить количество валентных электронов в соединении. Валентные электроны — это сумма электронов, которые каждая молекула имеет на своей внешней оболочке в соединении. Эти электроны включают те, которые участвуют в образовании связи, а также те, которые не участвуют в формировании связей. Электроны, участвующие в образовании связи, называются связывающими парами электронов. Тогда как те, которые не участвуют в образовании каких-либо связей, называются неподеленными парами электронов или несвязывающими парами электронов.
В структуре Льюиса линии представляют связи, а точки представляют валентные электроны. Когда мы говорим о Ch3Cl2, углерод менее электроотрицательный, чем атома хлора . Чтобы понять структуру Льюиса, давайте сначала рассчитаем общее количество валентных электронов для дихлорметана.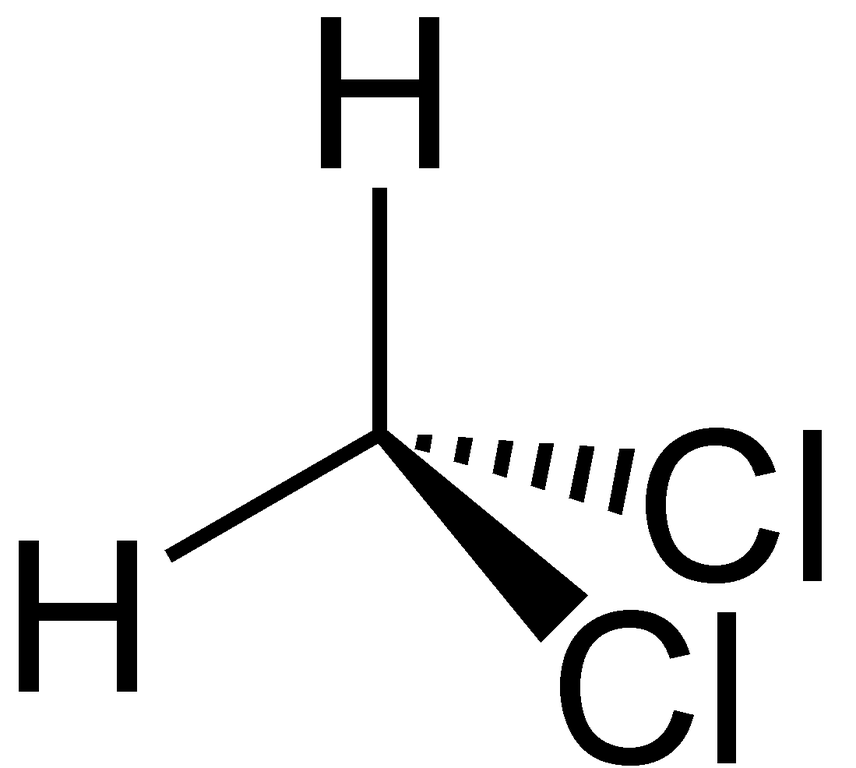
У углерода четыре валентных электрона, у водорода один валентный электрон и, как у всех галогенов, у хлора семь валентных электронов.
Общее количество валентных электронов = 4 + 2*1 + 2*7
= 4+2+14
= 20
В соединении двадцать валентных электронов, и образуются четыре связи. Центральный атом углерода образует две связи как с атомами водорода, так и с атомами хлора. Таким образом, в образовании связи участвуют по четыре валентных электрона углерода, по два электрона водорода и хлора.
Гибридизация дихлорметана Когда две молекулы участвуют в образовании связи, их орбитали перекрываются из-за совместного использования электронов. Эти перекрывающиеся орбитали называются гибридными орбиталями. Связи, образующиеся в дихлорметане, являются ковалентными. Центральный углерод гибридизуется, так как молекула образует все четыре связи в соединение . В образовании связей участвуют электрон с 22-орбитали и три других электрона с 2p-орбиталей.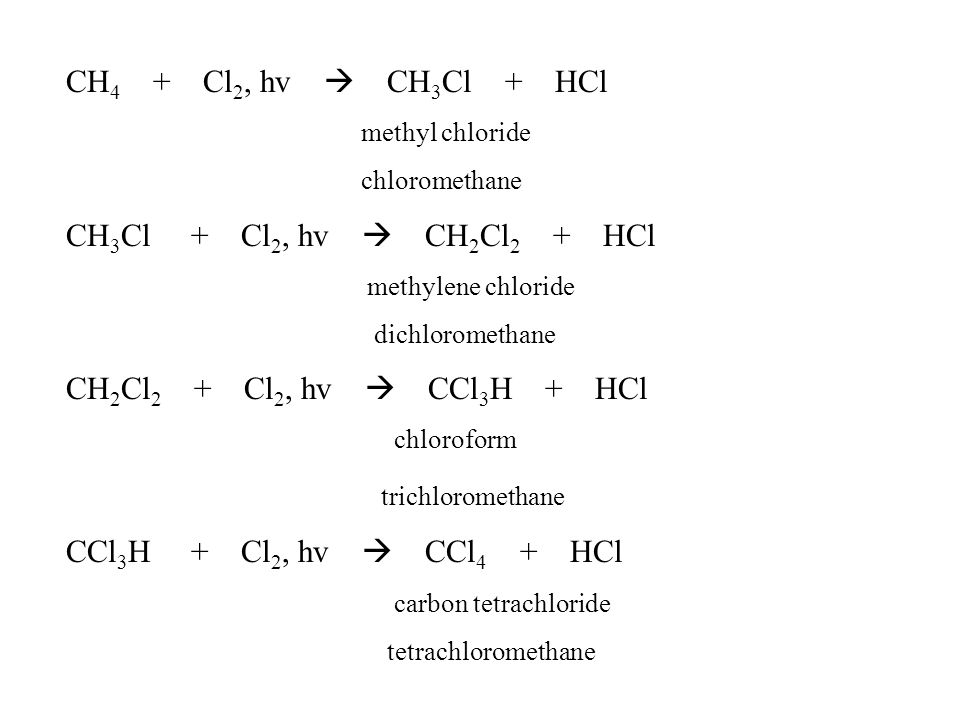 Таким образом, гибридизация атома углерода в Ch3Cl2 представляет собой sp3.
Таким образом, гибридизация атома углерода в Ch3Cl2 представляет собой sp3.
Сравнительно легко понять молекулярную геометрию соединения, зная его структуру Льюиса и гибридизацию. Расположение молекул в этом соединении таково, что атом углерода находится в центральном атоме, один атом водорода находится в самом верхнем положении, а другой — слева от центрального атома. Точно так же один атом хлора находится справа от углерода, а другой — в одном из нижних положений центрального атома. Поскольку гибридизация представляет собой sp3, молекулярная геометрия дихлорметана становится тетраэдрической. Форма соединения – тригонально-пирамидальная.
Полярность дихлорметана Полярность любого соединения зависит от неподеленных пар электронов и симметрии соединения. Это также зависит от электроотрицательности молекул, участвующих в образовании соединения. Здесь атом водорода менее электроотрицателен, чем атом хлора, и, следовательно, в соединении существует чистый дипольный момент. Кроме того, расположение связанных пар асимметрично, что делает дихлорметан полярным.
Кроме того, расположение связанных пар асимметрично, что делает дихлорметан полярным.
Физические свойства
Теперь, когда мы знаем все о химических свойствах и структуре Ch3Cl2, давайте посмотрим на его физические свойства.
| Property of the compound | Experimental values |
| Density of DCM | 1.3226 g/cm3 |
| Molecular weight of DCM | 84.93 g/mol |
| Boiling point ДКМ | 39,60C |
| Температура плавления ДХМ | -97,60C |
Использование дихлорметана
- ДХМ используется в пищевой промышленности в качестве растворителя и в качестве смывки для краски.
- Также используется в качестве обезжиривающего средства.
- Соединение также используется в производстве аэрозольных составов.
Опасности при использовании дихлорметана
- Поскольку это соединение является очень летучим по своей природе, оно может вызвать острую опасность при вдыхании.


