Барий, свойства атома, химические и физические свойства
Барий, свойства атома, химические и физические свойства.
Поделиться в:
Ba 56 Барий
137,327(7) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 6s2
Барий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 56. Расположен во 2-й группе (по старой классификации — главной подгруппе второй группы), шестом периоде периодической системы.
Атом и молекула бария. Формула бария. Строение бария
Изотопы и модификации бария
Свойства бария (таблица): температура, плотность, давление и пр.
Физические свойства бария
Химические свойства бария. Взаимодействие бария. Реакции с барием
Получение бария
Применение бария
Таблица химических элементов Д. И. Менделеева
И. Менделеева
Атом и молекула бария. Формула бария. Строение бария:
Барий (лат. Barium, от др.-греч. βαρύς – «тяжёлый») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ba и атомным номером 56. Расположен в 14-й группе (по старой классификации — главной подгруппе второй группы), шестом периоде периодической системы.
Барий – щёлочноземельный металл. Относится к группе лёгких, цветных металлов.
Барий обозначается символом Ba.
Как простое вещество барий при нормальных условиях представляет собой мягкий, ковкий щёлочноземельный металл серебристо-белого цвета.
Молекула бария одноатомна.
Химическая формула бария Ba.
Электронная конфигурация атома бария 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2. Потенциал ионизации (первый электрон) атома бария равен 502,85 кДж/моль (5,2116646(12) эВ).
Строение атома бария. Атом бария состоит из положительно заряженного ядра (+56), вокруг которого по шести атомным оболочкам движутся 56 электронов. При этом 54 электрона находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку барий расположен в шестом периоде, оболочек всего шесть. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья и пятая – внутренние оболочки представлена s-, р- и d-орбиталями. Четвертая – внутренняя оболочка представлена s-, р-, d- и f-орбиталями. Шестая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома бария – на 6s-орбитали находится два спаренных электрона. Поэтому барий проявляет валентность II и степень окисления +2. В свою очередь ядро атома бария состоит из 56 протонов и 81 нейтрон. Барий относится к элементам s-семейства.
Шестая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома бария – на 6s-орбитали находится два спаренных электрона. Поэтому барий проявляет валентность II и степень окисления +2. В свою очередь ядро атома бария состоит из 56 протонов и 81 нейтрон. Барий относится к элементам s-семейства.
Радиус атома бария (вычисленный) составляет 253 пм.
Атомная масса атома бария составляет 137,327(7) а. е. м.
Барий обладает высокой химической активностью. Ядовит.
Барий, свойства атома, химические и физические свойства
Изотопы и модификации бария:
Свойства бария (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Барий |
| 102 | Прежнее название | |
| 103 | Латинское название | Barium |
| 104 | Английское название | Barium |
| 105 | Символ | Ba |
| 106 | Атомный номер (номер в таблице) | 56 |
| 107 | Тип | Металл |
| 108 | Группа | Щёлочноземельный, лёгкий, цветной металл |
| 109 | Открыт | Карл Вильгельм Шееле и Иоганн Готлиб Ган, Швеция, 1774 г. |
| 110 | Год открытия | 1774 г. |
| 111 | Внешний вид и пр. | Мягкий, вязкий, ковкий металл серебристо-белого цвета. Ядовит |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации: – α-барий с кубической объёмно-центрированной кристаллической решёткой, – β-барий |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,034 % |
| 120 | Содержание в морях и океанах (по массе) | 3,0·10-6 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 1,0·10-6 |
| 122 | Содержание в Солнце (по массе) | 1,0·10-6 % |
| 123 | Содержание в метеоритах (по массе) | 0,00027 % |
| 124 | Содержание в организме человека (по массе) | 0,00003 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 137,327(7) а.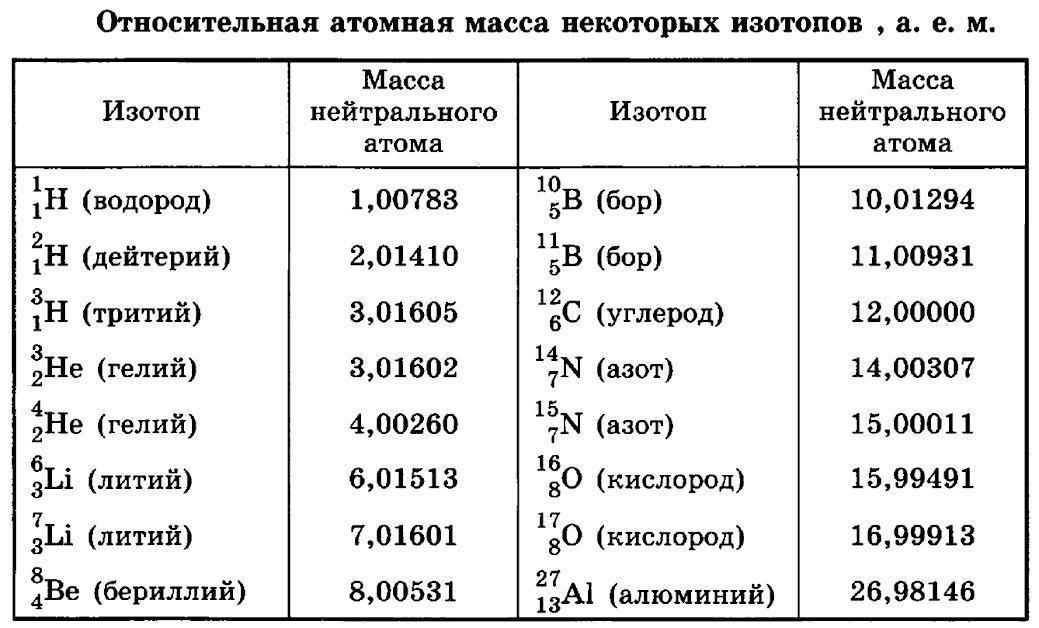 е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 6s2 |
| 203 | Электронная оболочка | K2 L8 M18 N18 O8 P2 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 253 пм |
| 205 | Эмпирический радиус атома* | 215 пм |
| 206 | Ковалентный радиус* | 215 пм |
| 207 | Радиус иона (кристаллический) | Ba2+ 149 (6) пм, 156 (8) пм, 166 (10) пм, 175 (12) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 268 пм |
| 209 | Электроны, Протоны, Нейтроны | 56 электронов, 56 протонов, 81 нейтрон |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 6 |
| 212 | Группа в периодической таблице | 2-ая группа (по старой классификации – главная подгруппа 2-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| Химические свойства | ||
| 301 | Степени окисления | 0, +1, +2 |
| 302 | Валентность | II |
| 303 | Электроотрицательность | 0,89 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 502,85 кДж/моль (5,2116646(12) эВ) |
| 305 | Электродный потенциал | Ba2+ + 2e– → Ba, Eo = -2,905 В |
| 306 | Энергия сродства атома к электрону | 13,954(6) кДж/моль (0,14462(6) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 3,51 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 3,338 г/см3 (при температуре плавления 727 °C и иных стандартных условиях , состояние вещества – жидкость) |
| 402 | Температура плавления* | 727 °C (1000 К, 1341 °F) |
| 403 | Температура кипения* | 1845 °C (2118 K, 3353 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 7,12 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 142 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,209 Дж/г·K (при 0-100 °C) |
| 410 | Молярная теплоёмкость* | 28,07 Дж/(K·моль) |
| 411 | Молярный объём | 39,1245 см³/моль |
| 412 | Теплопроводность | 18,4 Вт/(м·К) (при 18,4 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-барий |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 5,020 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-39-3 |
Примечание:
205* Эмпирический радиус бария согласно [1] и [3] составляет 222 пм.
206* Ковалентный радиус бария согласно [1] и [3] составляет 215±11 пм и 198 пм соответственно.
401* Плотность бария согласно [3] и [4] составляет 3,5 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело) и 3,76 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) соответственно.
402* Температура плавления бария согласно [3] составляет 728,85 °C (1002 K, 1343,93 °F).
403* Температура кипения бария согласно [3] и [4] составляет 1636,85 °C (1910 K, 2978,33 °F) и 1860 °C (2133,15 K, 3380 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) бария согласно [3] и [4] составляет 7,66 кДж/моль и 8,66 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) бария согласно [4] составляет 150,9 кДж/моль.
410* Молярная теплоёмкость бария согласно [3] составляет 28,1 Дж/(K·моль).
Физические свойства бария:
Химические свойства бария. Взаимодействие бария. Реакции с барием:
Получение бария:
Применение бария:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26.
 Железо
Железо - 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60.
 Неодим
Неодим - 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93.
 Нептуний
Нептуний - 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Barium
- https://de.wikipedia.
 org/wiki/Barium
org/wiki/Barium - https://ru.wikipedia.org/wiki/Барий
- http://chemister.ru/Database/properties.php?dbid=1&id=266
- https://chemicalstudy.ru/bariy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
барий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле бария барий
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 2 995
Изобутират бария, структурная формула, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Формула нитрида бария. Структура, свойства, применение, примеры вопросов
Барий — химический элемент с символом Ba и атомным номером 56. Это мягкий металл серебристого цвета, который быстро тускнеет на воздухе и вступает в реакцию с водой. Встречается в природе в виде двухвалентного катиона в сочетании с другими элементами. Он высокотоксичен при остром хроническом воздействии. Используется в металлургии. Он используется в вакуумных трубках в качестве осушителя и агента удаления кислорода.
Азот
Азот — это химический элемент с символом N. Атомный номер азота равен 7, а его электронная конфигурация — 1s 2 2s 2 2p 3 . Это неметалл и самый легкий член 15 группы периодической таблицы. Это бесцветный элемент без запаха. Это природный элемент. Это необходимо для жизни на Земле. Он необходим для роста и размножения как растений, так и животных. Он входит в состав всех белков.
Он входит в состав всех белков.
Нитрид бария
Нитрид бария представляет собой ионное соединение с формулой Ba 3 N 2 . Это оранжево-желтое твердое вещество. Он растворим в воде и нерастворим в органических растворителях. Чтобы написать формулу нитрида бария, найдем элемент этого соединения. Барий — это химическое соединение с символом Ba, а азот — это химическое соединение с символом N. Барий — это металл, а азот — неметалл. Это неметалл, а металл дает нам ионное соединение, мы пишем формулу нитрида бария как Ba 3 Н 2 .
Структура нитрида бария
Нитрид бария представляет собой ионное соединение. Он имеет три атома бария и два атома азота. Барий — это металл, а азот — неметалл, это ионное соединение. Это означает, что электроны превращаются из металла в неметалл. Барий находится во 2-й группе периодической таблицы, у него 2 валентных электрона, у азота 5 валентных электронов. Чтобы завершить октет азота, каждый барий отдает электроны азоту. Затем барий получил заряд +2, а азот получил заряд -3. Ба 2+ Н 3- .
Затем барий получил заряд +2, а азот получил заряд -3. Ба 2+ Н 3- .
Структура нитрида бария
Получение нитрида бария
- Нитрид бария получают реакцией бария с азотом.
N 2 + 3 Ba —> Ba 3 N 2
- Нитрат аммония взаимодействует с окисью бария, оксидом бария и нитридом бария.
NH 4 NO 3 + 8 Ba ——> 3 BaO +Ba 3 N 2 + 2 Ba(OH) 2
- Ammonia reacts with barium to form нитрид бария и водород.
2 NH 3 + 3 Ba ——> 3 H 2 + Ba 3 N 2
3 BA (NH 2 ) 2 — -> 4 NH 3 + BA 3 N 2
Physical Propeties of Barik nitride
.
 составляет 439,994 грамма.
составляет 439,994 грамма.Химические свойства нитрида бария
- Нитрид бария реагирует с водой с образованием гидроксида бария и аммиака.
6 H 2 O + BA 3 N 2 — -> 2 NH 3 + 3 BA (OH) 2
- 79 2
- 979 2
- 9999. аммиак и фторид бария.
6 HF + BA 3 N 2 —> 2 NH 3 + 3 BAF 2
- BARIUD NITRIDE ITRIDE.
Ba 3 N 2 ——–> N 2 + 3 Ba
- Нитрид бария реагирует с пеноксидом формадия
3 В 2 О 5 + 5 Ва 3 Н 2 —> 15 ВаО + 2 В 3 8 5
Использование нитрида бария
- Нитрид бария используется в качестве синтетического прекурсора для тройных нитридов металлов.

- Используется в качестве флюсовой среды для выращивания GaN.
- Керамика, которая находит применение в качестве легирующей примеси в оптических материалах, таких как белые светодиоды.
Часто задаваемые вопросы о формуле нитрида бария
Вопрос 1: Опасен ли нитрид бария и как с ним обращаться?
Ответ:
Да. Нитрид бария может вызвать серьезное раздражение кожи и глаз. Это может вызвать раздражение дыхательных путей. Чтобы не вдыхать его пары, тщательно мойте руки и кожу после контакта с ним. И вы не едите, не пьете при употреблении этого продукта. Наденьте защитные перчатки и очки.
Вопрос 2: Что такое нитриды?
Ответ:
Нитрид представляет собой соединение азота, в котором азот имеет формальную степень окисления -3. Ковалентные бинарные нитриды обладают широким спектром свойств в зависимости от элемента, с которым связан азот.
 Это редкое природное вещество. Он образуется, когда является ионным, интерстициальным и ковалентным.
Это редкое природное вещество. Он образуется, когда является ионным, интерстициальным и ковалентным.Вопрос 3: Как можно использовать азот?
Ответ:
Азот — химический элемент с символом N. Это бесцветный газ без запаха. Он используется для сохранения пищевых продуктов, используется в электронике, производстве нержавеющей стали и фармацевтической промышленности. Помимо его использования в удобрениях и хранилищах энергии.
Вопрос 4: Какова реакция разложения нитрида бария?
Ответ:
Химическая формула нитрида бария Ba 3 N 2 . Термическое разложение нитрида бария дает барий и азот.
Ba 3 N 2 —> 3 Ba + N 2
Вопрос 5: Каково применение бария?
Ответ:
Барий — химический элемент с символом Ba.
 Это не широко используемый элемент. Большинство из них используются в буровых растворах для нефтяных и газовых скважин. Он часто используется для электродов свечей зажигания. Его соединения используются для изготовления красок, кирпичей, стекла, плитки и резины.
Это не широко используемый элемент. Большинство из них используются в буровых растворах для нефтяных и газовых скважин. Он часто используется для электродов свечей зажигания. Его соединения используются для изготовления красок, кирпичей, стекла, плитки и резины.Формула сульфата бария – свойства, производство, применение и часто задаваемые вопросы
Сульфат бария или сульфат бария представляет собой нейтральное химическое соединение, состоящее из бария и сульфата или ионов сульфата. Как правило, химическое соединение имеет сульфат или сульфат в своем названии, когда оно состоит из сульфат-аниона, который представляет собой полианион, образованный серой и кислородом. Сульфатный полианион имеет молекулярную формулу SO42-, а электрический заряд, присутствующий на сульфатном анионе, равен -3. Следовательно, для сульфатного соединения или соли должен быть катион с положительным зарядом и тем же значением, которое равно +2, что в этом случае обеспечивается катионом бария, поскольку он имеет свойство терять два своих электрона в самой внешней валентности.
 оболочка для достижения конфигурации октетов, которая представляет собой Ba2+. Следовательно, оба они объединяются, образуя нейтральную соль, они образуют сульфат бария. Поэтому формула сульфата бария или формула сульфата бария задается как BaSO4. Как правило, и здесь молекулярная формула сульфата бария совпадает с химической формулой сульфата бария.
оболочка для достижения конфигурации октетов, которая представляет собой Ba2+. Следовательно, оба они объединяются, образуя нейтральную соль, они образуют сульфат бария. Поэтому формула сульфата бария или формула сульфата бария задается как BaSO4. Как правило, и здесь молекулярная формула сульфата бария совпадает с химической формулой сульфата бария.Свойства сульфата бария
В природе сульфат бария встречается в виде минерала, известного как барит, который также является основным коммерческим методом получения бария. Кристаллическая структура сульфата бария орторомбическая. Структурная формула компонентов, упомянутых в формуле сульфата бария, приведена ниже:
[Изображение будет загружено в ближайшее время]
Некоторые другие физические свойства, которые обычно используются для определения соединения сульфата бария, следующие:
Молекулярная масса сульфата бария, определенная по формуле сульфата бария, составляет 233,38 г/моль.

Плотность соединения, которую нельзя определить по формуле сульфата бария, составляет 4,49 г.см3.
Состав без запаха.
Растворимость соединения также варьируется. Растворимость соединения, имеющего формулу сульфата бария, нерастворима в спирте и воде, но растворима в высококонцентрированной горячей серной кислоте.
Температура плавления сульфата бария составляет 1580 ℃, и он разлагается при температуре выше 1600 ℃.
Это негорючее вещество.
Производство и использование сульфата бария
Сульфат бария коммерчески получают из минерала барита. Но минерал барит сильно загрязнен.
 Обычно его перерабатывают термохимическим восстановлением сульфата (TSR), которое широко известно как карботермическое восстановление, в основном нагреванием с коксом, в результате которого образуется сульфид бария. Реакция, описывающая формулу сульфата бария, приведена ниже:
Обычно его перерабатывают термохимическим восстановлением сульфата (TSR), которое широко известно как карботермическое восстановление, в основном нагреванием с коксом, в результате которого образуется сульфид бария. Реакция, описывающая формулу сульфата бария, приведена ниже:BaSO4 + 4C → BaS + 4CO.
Сульфид бария, в свою очередь, может быть преобразован в оксид, карбонат и галогениды. Например, при обработке сульфида бария серной кислотой или сульфатными солями образуется сульфат бария. Реакция, изображающая стехиометрический баланс в молекулярной формуле сульфата бария
BaS + h3SO4 → BaSO4 + h3S
Таким образом, это способ получения сульфата бария, который распознается в данном уравнении химической формулой сульфата бария или химическая формула сульфата бария. Обычно после реакции сульфат бария получают в виде осадка. Формула осадка сульфата бария такая же, как химическая формула сульфата бария.
Ниже приведены некоторые области применения сульфата бария:
Одним из наиболее распространенных применений сульфата бария, который производится промышленным путем из минерала, является его использование в качестве бурового раствора.
 Он широко используется в качестве жидкости для бурения нефтяных скважин, поскольку увеличивает плотность жидкости и вызывает увеличение гидростатического давления.
Он широко используется в качестве жидкости для бурения нефтяных скважин, поскольку увеличивает плотность жидкости и вызывает увеличение гидростатического давления.Он используется в виде суспензий и наиболее часто используется в качестве рентгеноконтрастного вещества для рентгенографии и других диагностических процедур.
Он используется, в частности, в методах визуализации желудочно-кишечного тракта, и эта процедура известна как «бариевая мука».
Другим распространенным и промышленным применением является его использование в качестве компонента белого пигмента для красок. Он используется в масляной краске в качестве фильтра для изменения консистенции краски.
Тонкий слой сульфата бария, известный как барит, используется в качестве покрытия на основной поверхности большинства фотобумаг для увеличения отражательной способности изображения.

- 979 2

 Железо
Железо Неодим
Неодим Нептуний
Нептуний org/wiki/Barium
org/wiki/Barium
 Это редкое природное вещество. Он образуется, когда является ионным, интерстициальным и ковалентным.
Это редкое природное вещество. Он образуется, когда является ионным, интерстициальным и ковалентным. Это не широко используемый элемент. Большинство из них используются в буровых растворах для нефтяных и газовых скважин. Он часто используется для электродов свечей зажигания. Его соединения используются для изготовления красок, кирпичей, стекла, плитки и резины.
Это не широко используемый элемент. Большинство из них используются в буровых растворах для нефтяных и газовых скважин. Он часто используется для электродов свечей зажигания. Его соединения используются для изготовления красок, кирпичей, стекла, плитки и резины. оболочка для достижения конфигурации октетов, которая представляет собой Ba2+. Следовательно, оба они объединяются, образуя нейтральную соль, они образуют сульфат бария. Поэтому формула сульфата бария или формула сульфата бария задается как BaSO4. Как правило, и здесь молекулярная формула сульфата бария совпадает с химической формулой сульфата бария.
оболочка для достижения конфигурации октетов, которая представляет собой Ba2+. Следовательно, оба они объединяются, образуя нейтральную соль, они образуют сульфат бария. Поэтому формула сульфата бария или формула сульфата бария задается как BaSO4. Как правило, и здесь молекулярная формула сульфата бария совпадает с химической формулой сульфата бария.
 Обычно его перерабатывают термохимическим восстановлением сульфата (TSR), которое широко известно как карботермическое восстановление, в основном нагреванием с коксом, в результате которого образуется сульфид бария. Реакция, описывающая формулу сульфата бария, приведена ниже:
Обычно его перерабатывают термохимическим восстановлением сульфата (TSR), которое широко известно как карботермическое восстановление, в основном нагреванием с коксом, в результате которого образуется сульфид бария. Реакция, описывающая формулу сульфата бария, приведена ниже: Он широко используется в качестве жидкости для бурения нефтяных скважин, поскольку увеличивает плотность жидкости и вызывает увеличение гидростатического давления.
Он широко используется в качестве жидкости для бурения нефтяных скважин, поскольку увеличивает плотность жидкости и вызывает увеличение гидростатического давления.