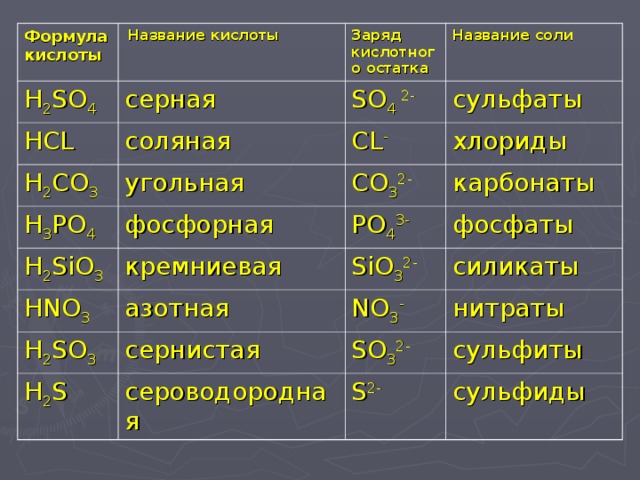
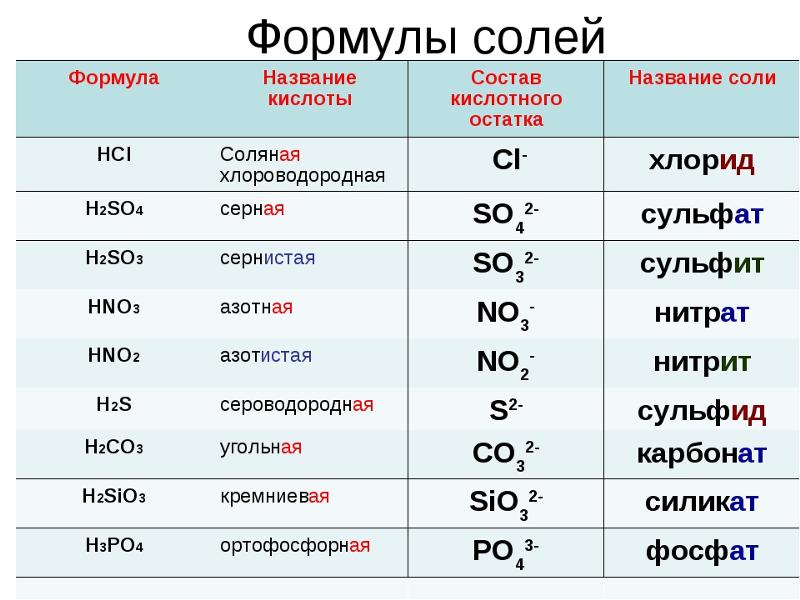
Фосфат алюминия
Фосфат алюминия (ортофосфат алюминия, алюминий фосфорнокислый) — AlPO4, неорганическое соединение, алюминиевая соль фосфорной кислоты. Твёрдое, белое кристаллическое вещество, нерастворимое в воде. Встречается в природе в виде многочисленных минералов. Образуется в виде студёнистого осадка при действии на водорастворимые соли алюминия растворимых фосфатов.
Используется в качестве флюса в производстве керамики, добавки для цемента, высокотемпературного дегидратирующего агента, для выпуска специальных сортов стекла, как катализатор в органическом синтезе. Также применяется как компонент для некоторых разрыхлителей в кондитерском деле и в медицине как антацид.
Нахождение в природе и физические свойства
Белое (в аморфном виде) или бесцветное кристаллическое вещество, существующая в четырёх модификациях, среди которых устойчивы[1]:
- α-AlPO4 — с гексагональной решёткой (пространственная группа P3121), устойчив до 580 °C;
- Плотность: 2,64 г/см³, удельная теплоёмкость: 93,2 Дж/(моль·К), стандартная энтальпия образования: −1733 кДж/моль, стандартная энергия Гиббса: −1617 кДж/моль, стандартная энтропия: 90,8 Дж/(моль·K).

- β-AlPO4 — с гексагональной (580—1047 °C) или кубической (выше 1047 °C) решёткой.
Соединение плохо растворимо в воде (ПР 9,83⋅10−10) и спирте, хорошо растворимо в соляной и азотной кислоте[2]. Хуже всего соль растворима в воде при pH 4,07—6,93[3].
При осаждении из водных растворов выпадает в виде аморфного осадка общей формулой AlPO4•xH2O. Известны кристаллогидраты, где x=2; 3,5. Безводную соль можно получить при нагревании фосфата выше 1300 °C.
Известны основные и кислые соли фосфата алюминия: Al2(PO4)(OH)3, Al(H2PO4)3, AlH3(PO4)2 и др.
Аугелит
Лазулит
В природе фосфат алюминия входит в состав следующих многочисленных минералов (список не является исчерпывающим):
- альдерманит: Mg5Al12(PO4)8(OH)22 • 32H2O
- амблигонит: (Li,Na)AlPO4(F,OH)
- ахейлит: (Fe2+,Zn)Al6(PO4)4(OH)8 • 4H2O
- аугелит: Al2(PO4)(OH)3
- берлинит: AlPO4 • xH2O
- бразилианит: NaAl3(PO4)2(OH)4
- вантасселит: Al4(PO4)3(OH)3 • 9H2O
- варисцит: AlPO4 • 2H2O
- воксит: Fe2+Al2(PO4)2(OH)2 • 6H2O
- лазулит: (Mg,Fe2+)Al2(OH,PO4)2
- скорцалит: ((Mg,Fe2+)Al2(OH,PO4)2)
- таранакит: (K,Na)3(Al,Fe3+)5(PO4)2([HPO4)6 • 18H2O
- цириловит: NaFe3+3(PO4)2(OH)4 • 2(H2O)
- чилдренит: (Fe,Mn)AlPO4(OH)2 • H2O
- эосфорит: MnAlPO4)(OH)2 • H2O
Получение и химические свойства
Фосфат алюминия довольно устойчивое соединение, разлагающееся при температуре выше 2000 °C:
- 4 AlPO4 → 2 Al2O3 + P4O10
Получают нагреванием алюмината натрия с фосфорной кислотой или обменной реакцией сульфата алюминия с водорастворимыми фосфатами:
- NaAlO2 + H3PO4 →t∘ AlPO4 + NaOH + H2O
- 2 Na3PO4 + Al2(SO4)3 → 2 AlPO4 ↓ + 3 Na2SO4
Фосфат алюминия | это.
 .. Что такое Фосфат алюминия?
.. Что такое Фосфат алюминия?Фосфат алюминия (ортофосфат алюминия, алюминий фосфорнокислый) — AlPO4, неорганическое соединение, алюминиевая соль фосфорной кислоты. Твёрдое, белое кристаллическое вещество, нерастворимое в воде. Встречается в природе в виде минерала берлинита. Образуется в виде студёнистого осадка при действии на водорастворимые соли алюминия растворимых фосфатов.
Используется в качестве флюса в производстве керамики, добавки для цемента, высокотемпературного дегидратирующего агента, для выпуска специальных сортов стекла, как катализатор в органическом синтезе. Также применяется как компонент для некоторых разрыхлителей в кондитерском деле и в медицине как антацид.
Нахождение в природе и физические свойства
Белое (в аморфном виде) или бесцветное кристаллическое вещество, существующая в четырёх модификациях, среди которых устойчивы[1]:
- α-AlPO4 — с гексагональной решёткой (пространственная группа P3121), устойчив до 580 °C;
- Плотность: 2,64 г/см³, удельная теполёмкость: 93,2 Дж/(моль·К), стандартная энтальпия образования: −1733 кДж/моль, стандартная энергия Гиббса: −1617 кДж/моль, стандартная энтропия: 90,8 Дж/(моль·K).

- β-AlPO4 — с гексагональной (580—1047 °C) или кубической (выше 1047 °C) решёткой.
Соединение плохо растворимо в воде (ПР 9,83·10−10) и спирте, хорошо растворимо в соляной и азотной кислоте[2]. Хуже всего соль растворима в воде при pH 4,07—6,93[3].
При осаждении их водных растворов выпадает в виде аморфного осадка общей формулой AlPO
Известны основные и кислые соли фосфата алюминия: Al2(PO4)(OH)3, Al(H2PO4)3, AlH3(PO4)2 и др.
Аугелит
Лазулит
В природе фосфат алюминия входит в состав следующих многочисленных минералов (список не является исчерпывающим):
- альдерманит: Mg5Al12(PO4)8(OH)22 • 32H2O
- амблигонит: (Li,Na)AlPO4(F,OH)
- ахейлит: (Fe2+,Zn)Al6(PO4)4(OH)8 • 4H2O
- аугелит: Al2(PO4)(OH)3
- берлинит: AlPO4 • xH2O
- бразилианит: NaAl 3(PO4)2(OH)4
- вантасселит: Al4(PO4)3(OH)3 • 9H2O
- варисцит: AlPO4 • 2H2O
- воксит: Fe2+Al2(PO4)2(OH)2 • 6H2O
- лазулит: (Mg,Fe2+)Al2(OH,PO4)2
- скорцалит: ((Mg,Fe2+)Al2(OH,PO4)2)
- таранакит: (K,Na)3(Al,Fe3+)5(PO4)2([HPO4)6 • 18H2O
- цириловит: NaFe3+3(PO4)2(OH)4 • 2(H2O)
- чилдренит: (Fe,Mn)AlPO4(OH)2 • H2O
- эосфорит: MnAlPO4)(OH)2 • H2O
Получение и химические свойства
Фосфат алюминия довольно устойчивое соединение, разлагающееся при температуре выше 2000 °C:
Получают нагреванием алюмината натрия с фосфорной кислотой или обменной реакцией сульфата алюминия с водорастворимыми фосфатами:
Примечания
- ↑ Алюминия фосфат // Химическая энциклопедия / Главный редактор И.
 Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 217—218.
Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 217—218. - ↑ Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — P. 13—14. — ISBN 0-07-049439-8
- ↑ Тихонов В.Н. Аналитическая химия алюминия. — Серия «Аналитическая химия элементов». — М.: «Наука», 1971. — С. 17.
Шаблон:АТХ код A02
Формула фосфата алюминия – структура, свойства, использование, примеры вопросов
Фосфат алюминия является одним из химических соединений. Он содержит 1 атом фосфора, 4 атома кислорода (3 общих с одинарной связью и 1 с двойной связью) и 1 атом алюминия. Обычно он выглядит как дигидрат, что означает фосфат алюминия вместе с 2 ионами воды, а также пентагидрат означает фосфат алюминия вместе с 5 ионов воды.
Фосфат алюминия имеет много применений в жизни, теперь давайте посмотрим, что такое фосфат алюминия, его структуру, свойства и применение фосфата алюминия.
Что такое фосфат алюминия?
Фосфат алюминия представляет собой аморфную форму гидроксифосфата алюминия, в которой некоторые гидроксильные группы гидроксида алюминия заменены фосфатными группами, и он имеет множество применений, таких как антипирены, антациды, фунгициды, катализаторы, пищевые добавки и т.
д.
- Химическая формула фосфата алюминия: AlPO 4 .
- Обычно встречается в виде безводной соли и содержит структуры дигидрата и пентагидрата.
- Dihydrate: AlPO 4 .2H 2 O
- Pentahydrate: AlPO 4 .5H 2 O
Structure of Aluminum Phosphate
Aluminum phosphate dihydrate has a group фосфат-анионов, катионов алюминия и воды. Он содержит 1 атом фосфора, 4 атома кислорода (3 общих с одинарной связью и 1 с двойной связью) и 1 атом алюминия. Обычно он выглядит как дигидрат, что означает фосфат алюминия вместе с 2 ионами воды, а также пентагидрат означает фосфат алюминия вместе с 5 ионов воды.
Структура фосфата алюминия
Свойства фосфата алюминия
Физические свойства фосфата алюминия
- Фосфат алюминия представляет собой белый кристаллический порошок (бесцветная жидкость в водной форме) с неприятным запахом).

- Плотность фосфата алюминия составляет 2,56 г.см 3 в твердом состоянии.
- Температура плавления фосфата алюминия 1800°C.
- Фосфат алюминия разлагается при температуре кипения.
- Фосфат алюминия Нерастворим в воде и очень мало растворим в HCl и HNO 3 .
- Молярная масса фосфата алюминия составляет 121,9529 г/моль в виде белого кристаллического порошка.
- Показатель преломления фосфата алюминия составляет 1,546.
Химические свойства фосфата алюминия
- Фосфат алюминия реагирует с соляной кислотой (HCL) и образует трихлорид алюминия (AlPO 4 ) и фосфорную кислоту (H 3 ЗП 4 ).
Alpo 4 + 3HCL ⇢ ALCL 3 + H 3 PO 4
- Аплодисный фосфат реагирует с магнитным хлоридом (MGCL 2
- Aluminum Phosphate с магнитом. and Magnesium phosphate (Mg 3 (PO 4 ) 2 .

- Aluminum Phosphate с магнитом. and Magnesium phosphate (Mg 3 (PO 4 ) 2 .
2AlPO 4 + 3MgCl 2 ⇢ Mg 3 (PO 4 ) 2 + 2AlCl 3
Использование фосфата алюминия
Фосфат алюминия используется в электронике и электротехнике, производстве резины и клея, сборке химиотерапевтических препаратов и иммунизации для повышения иммуногенности.
Кроме того, фосфат алюминия используется в качестве антипирена, антацида, вещества с пищевой добавкой, фунгицида, катализатора и белого красителя в течение очень долгого времени, бетона, стоматологического бетона, ингибиторов эрозии.
Примеры вопросов
Вопрос 1: Изобразите структуру фосфата алюминия.
Ответ:
Дигидрат фосфата алюминия состоит из группы тетра- и октаэдрических звеньев анионов фосфата, катионов алюминия и воды. Частицы Al 3+ являются 6-координатными, а частицы PO4 3- — 4-координатными.
Структура фосфата алюминия
Вопрос 2: Каковы физические свойства фосфата алюминия?
Ответ:
Ниже приведены физические свойства фосфата алюминия:
- Фосфат алюминия представляет собой белый кристаллический порошок (бесцветная жидкость в водной форме) с неприятным запахом).
- Плотность фосфата алюминия составляет 2,56 г.см 3 в твердом состоянии.
- Температура плавления фосфата алюминия 1800°C.
- Фосфат алюминия разлагается при температуре кипения.
- Фосфат алюминия нерастворим в воде и очень мало растворим в HCl и HNO 3 .
- Молярная масса фосфата алюминия составляет 121,9529 г/моль в виде белого кристаллического порошка.
- Показатель преломления фосфата алюминия составляет 1,546.
Вопрос 3: Каковы химические свойства фосфата алюминия?
Ответ:
- Фосфат алюминия реагирует с соляной кислотой (HCL) и образует трихлорид алюминия (AlPO 4 ) и фосфорную кислоту (H 3 PO 4 ).
Alpo 4 + 3HCL ⇢ ALCL 3 + H 3 PO 4
- Аплодисный фосфат реагирует с магнитным хлоридом (MGCL 2
- Aluminum Phosphate с магнитом. and Magnesium phosphate (Mg 3 (PO 4 ) 2 .
2AlPO 4 + 3MgCl 2 ⇢ Mg 3 (PO 4 ) 2 + 2AlCl 3
Вопрос 4. Каковы области применения фосфата алюминия?
Ответ:
Применение фосфата алюминия:
- Фосфат алюминия используется в электронике и электротехнике, производстве резины и клея, сборке химиотерапевтических препаратов и иммунизации для повышения иммуногенности.
- Кроме того, фосфат алюминия используется в качестве антипирена, антацида, вещества с пищевой добавкой, фунгицида, катализатора и белого красителя в течение очень долгого времени, бетона, стоматологического бетона, ингибиторов эрозии.
Вопрос 5: Что происходит, когда хлорид магния реагирует с фосфатом алюминия?
Ответ:
Алюминиевые фосфатные реагирование с хлоридом магния (MGCL 2 ) и алюминиевый трихлорид (ALCL 3 ) и магний фосфат MG 3 (PO 40014 40014 40015).
2AlPO 4 + 3MgCl 2 ⇢ Mg 3 (PO 4 ) 2 + 2AlCl 3
Формула фосфата алюминия. Определение и свойства, полезность, применение
Фосфат алюминия представляет собой химическое неорганическое соединение, состоящее из ионов алюминия и фосфата. Любое химическое соединение известно как фосфат, если оно состоит из аниона фосфата, который представляет собой полианион, состоящий из фосфора и кислорода. Полианион фосфата имеет молекулярную формулу PO43- с электрическим зарядом -3. Следовательно, для фосфатного соединения или соли должен быть катион с положительным зарядом и тем же значением, которое равно +3. В этом случае алюминий является катионом, поскольку он имеет свойство терять три своих электрона на самой внешней оболочке, чтобы получить конфигурацию октета, которая представляет собой Al3+. Следовательно, когда они объединяются с образованием нейтральной соли, они образуют фосфат алюминия. Поэтому химическая формула фосфата алюминия дается как AlPO4. Таким образом, нейтральная химическая формула фосфата алюминия состоит из катиона алюминия и аниона фосфата.
В этом случае алюминий является катионом, поскольку он имеет свойство терять три своих электрона на самой внешней оболочке, чтобы получить конфигурацию октета, которая представляет собой Al3+. Следовательно, когда они объединяются с образованием нейтральной соли, они образуют фосфат алюминия. Поэтому химическая формула фосфата алюминия дается как AlPO4. Таким образом, нейтральная химическая формула фосфата алюминия состоит из катиона алюминия и аниона фосфата.
Свойства фосфата алюминия
В природе фосфат алюминия встречается в виде минерала, известного как берлинит. Обычно встречается в виде белого кристаллического твердого вещества. Структурная формула соединения, представляющая расположение ионов, показанное в молекулярной формуле фосфата алюминия, показана ниже:
[Изображение будет загружено в ближайшее время]
Он также имеет множество различных синтетических форм с сетью различных типов структур. как цеолиты. Берлинит имеет структуру, подобную кварцу, и он также похож на него, чего нельзя узнать из формулы фосфата алюминия. Разница между ними заключается в том, что в кварце кремний заменен Al и P. Структуры AlO4 и PO4 представляют собой тетрагидратные альтернативы друг друга. Так же, как кварц, структура фосфата алюминия показывает хиральность. Кристаллический фосфат алюминия при нагревании обычно превращается в тридимит и образуется кристобалит.
Берлинит имеет структуру, подобную кварцу, и он также похож на него, чего нельзя узнать из формулы фосфата алюминия. Разница между ними заключается в том, что в кварце кремний заменен Al и P. Структуры AlO4 и PO4 представляют собой тетрагидратные альтернативы друг друга. Так же, как кварц, структура фосфата алюминия показывает хиральность. Кристаллический фосфат алюминия при нагревании обычно превращается в тридимит и образуется кристобалит.
Ниже приведены некоторые другие физические свойства, которые обычно используются для определения соединения фосфата алюминия:
Лучшим методом идентификации любого химического соединения является молекулярная масса. Молекулярная масса этого соединения, определенная по формуле фосфата алюминия, составляет 121,952 г/моль.
Плотность компаунда 2,56 г.см3.
Растворимость соединения также варьируется.
 Растворимость соединения, имеющего формулу фосфата алюминия, нерастворима в воде и лишь незначительно растворима в HCl и HNO3.
Растворимость соединения, имеющего формулу фосфата алюминия, нерастворима в воде и лишь незначительно растворима в HCl и HNO3.Температура кипения соединения отсутствует, так как оно разлагается при нагревании.
Он изоэлектронный с диоксидом кремния, а также известен своими пьезоэлектрическими свойствами.
Утилизация фосфата алюминия
Большая часть использования фосфата алюминия связана с его использованием в молекулярных ситах из фосфата алюминия, которые обычно известны как «AlPO». Эти структуры имеют сходство со структурами фосфата алюминия, многие из них имеют микропористые полости. Структуры этих молекулярных сит состоят из чередующихся тетраэдров фосфата алюминия и фосфата.
Фосфат алюминия в сочетании с гидроксидом алюминия используется в основном в качестве иммунологических адъювантов или усилителей эффективности вакцинации.



 Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 217—218.
Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 217—218. д.
д.

 Растворимость соединения, имеющего формулу фосфата алюминия, нерастворима в воде и лишь незначительно растворима в HCl и HNO3.
Растворимость соединения, имеющего формулу фосфата алюминия, нерастворима в воде и лишь незначительно растворима в HCl и HNO3.