Натрия карбонат | это… Что такое Натрия карбонат?
Карбона́т на́трия — химическое соединение Na2CO3, натриевая соль угольной кислоты.
Содержание
|
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5% кристаллизационной воды) — кристаллическая сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — питьевая или пищевая сода, натрий двууглекислый, бикарбонат натрия
Название «сода» происходит от растения Salsola Soda, из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры).
Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры).
Каустической содой называют гидроксид натрия (NaOH).
Оксиды и гидроксиды
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | h3CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде следующих минералов:
- нахколит NaHCO3
- трона Na2CO3·NaHCO3·2H2O
- натрон (сода) Na2CO3·10H2O
- термонатрит Na2CO3·Н2O.
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США).
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблана получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000°C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
Na2SO4 + 2C → Na2S + 2CO2↑
Сульфид натрия реагирует с карбонатом кальция:
Na2S + СаСО3 → Na2CO3 + CaS
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
2NaCl + H2SO4 → Na2SO4
+ 2HCl↑Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 90% предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20°C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160°C, при этом он переходит в карбонат натрия:
2NaHCO3 →(t) Na2CO3 + CO2↑ + H2O
Образовавшийся диоксид углерода и аммиак, выделенный из маточного раствора на первой стадии процесса по реакции:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O
возвращают в производственный цикл.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского поселка Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год.
Его производительность составляла 20 тысяч тонн соды в год.
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует карбонат кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Хоу.
Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017°С переходит в бесцветный ромбический Na2CO3·7H2

Безводный карбонат натрия представляет собой бесцветный кристаллический порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а.е.м. | 286,14 а.е.м. |
| Температура плавления | 852°C (по другим источникам, 853°C) | 32°С |
| Растворимость | Не растворим в ацетоне, и сероуглероде, мало растворим в этаноле хорошо растворим в глицерине, и воде (см. таблицу ниже) | растворим в воде, не растворим в этаноле |
| Плотность ρ | 2,53 г/см3 (при 20°C) | 1,446 г/см3 (при 17°C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды.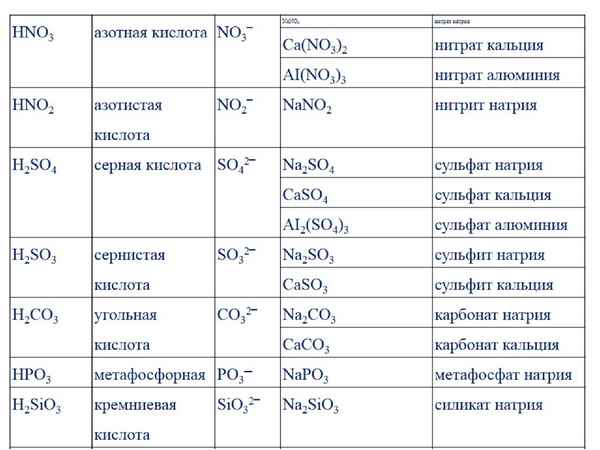 Уравнение гидролиза (в ионной форме):
Уравнение гидролиза (в ионной форме):
CO32- + H2O ↔ HCO3— + OH—
Первая константа диссоциации угольной кислоты равна 4,5·10-7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Применение
Карбонат натрия используют в стекольном производстве, мыловарении и производстве синтетических моющих средств, эмалей, для получения ультрамарина. Также он применяется для умягчения воды паровых котлов и вообще устранения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na 2B4O7, Na2HPO4.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E500, регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. [1]
[1]
Ссылки
- Sodium carbonate CAS #: 497-19-8 — Online Informational Database of Chemicals from China англ.
Пищевые добавки
Пищевые красители E1xx | Консерванты E2xx | Антиокислители и регуляторы кислотности E3xx | Стабилизаторы, загустители и эмульгаторы E4xx | Регуляторы рН и вещества против слёживания E5xx | Усилители вкуса и аромата, ароматизаторы E6xx | Разное E9xx | Пеногасители E1xxx
Разное: Воск (E900-909) • Глазурь (E910-919) • Восстановитель (E920-929) • Газ для упаковки (E930-949) • Заменители сахара (E950-969) • Вспениватель (E990-999)
Карбонат натрия — презентация онлайн
Похожие презентации:
Соли угольной кислоты
Анализ лекарственных средств неорганических соединений натрия: натрия гидрокарбонат, натрия тиосульфат, натрия нитрит
Классы неорганических веществ
IV,III группа периодической системы Д..И. Менделеева. Кислота борная, натрия гидрокарбонат
Кислота борная, натрия гидрокарбонат
Углерод. Оксиды углерода. Угольная кислота. Карбонаты. Жёсткость воды
NaOH. Гидроксид натрия
Классы неорганических веществ
Гидрокарбонат натрия NaHCO₃
Гидроксид натрия
Соли NaHCO₃- Гидрокарбонат натрия
Карбонат
натрия
Презентация Семеновой
Ангелины
9П-11
Карбонат натрия.
Карбона́т на́трия — химическое соединение
Na2CO3, натриевая соль угольной кислоты.
Карбонат натрия представляет собой
бесцветный кристаллический порошок.
Получение карбоната натрия.
Способ 1.
Способ Леблана.
Уголь восстанавливает сульфат натрия до сульфида:
Na2SO4 + 2C → Na2S + 2CO2↑.
Сульфид натрия реагирует с карбонатом кальция:
Na2S + СаСО3 → Na2CO3 + CaS.
Способ 2.
Способ Хоу.
Отличается от процесса Леблана тем, что не использует карбонат
кальция.
Способ 3.
Промышленный аммиачный способ (способ
Сольве).
Nh4 + CO2 + h3O + NaCl → NaHCO3 + Nh5Cl
2NaHCO3 →(t) Na2CO3 + CO2↑ + h3O
2Nh5Cl + Ca(OH)2 → CaCl2 + 2Nh4↑ + 2h3O
Применение.
Отрасли, производящие стекло, стиральные порошки, мыло
и эмали не обходятся без карбоната натрия, где его
используют, чтобы получить ультрамарин. Также с
помощью него устраняют жесткость воды, обезжиривают
металлы и проводят десульфатизацию, объектом которой
является доменный чугун. Карбонат натрия является
хорошим окислителем и регулятором кислотности, его
содержат моющие посуду средства, сигареты и пестициды.
Также он известен как пищевая добавка E500, не дающая
ингредиентам комковаться и слёживаться. Обсуждаемое
сейчас вещество необходимо и для того, чтобы приготовить
проявитель фотографий.
Химические и физические свойства
Карбонат натрия: химические свойства
Если опустить его в сильную кислоту, то угольная, получившаяся в
ходе реакции и являющаяся крайне нестойкой, распадется на
газообразный оксид четырехвалентного углерода и воду. Второй
продукт реакции — натриевая соль соответствующей кислоты
(например, при бросании кристаллов обсуждаемого сейчас
карбоната в серную кислоту, получатся углекислый газ, вода, и
сульфат натрия). В воде данное соединение будет
В воде данное соединение будет
гидролизоваться, благодаря этому нейтральная среда становится
щелочной
Карбонат натрия: физические свойства
Это вещество в безводном состоянии имеет вид бесцветного
кристаллического порошка (фото выше). Строение его
кристаллической рещетки зависит от температуры окружения:
если последняя не меньше 350, но ниже 479С, то она является
моноклинной, если температура выше — гексагональной.
English Русский Правила
Карбонат натрия | AMERICAN ELEMENTS®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Наименование продукта: Карбонат натрия
Номер продукта: Все применимые коды продуктов American Elements, например. НА-КБ-02 , НА-СВ-03 , НА-СВ-04 , NA-CB-05
Номер CAS: 497-19-8
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
10884 Weyburn Ave.
Los Angeles, CA
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи:
Внутренний, Северная Америка: +1 800-44 -9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси
Классификация согласно Регламенту (ЕС) № 1272/2008
GHS07
Eye Irrit. 2 ч419 Вызывает серьезное раздражение глаз.
Классификация согласно Директиве 67/548/ЕЭС или Директиве 1999/45/ЕС
Си; Раздражитель
R36: Раздражает глаза.
Информация об особых опасностях для человека и окружающей среды:
Н/Д
Опасности, не классифицированные иначе
Нет доступных данных
Элементы маркировки
Маркировка в соответствии с Регламентом (ЕС) № 1272/2008
Вещество классифицируется и маркируется в соответствии с регламентом CLP .
Пиктограммы опасности
GHS07
Сигнальное слово
Предупреждение
Формулировки опасности
h419 Вызывает серьезное раздражение глаз.
Меры предосторожности
P280 Пользоваться защитными перчатками/защитной одеждой/защитными средствами для глаз/лица.
P264 Тщательно вымыть после работы.
P305+P351+P338 ПРИ ПОПАДАНИИ В ГЛАЗА: Осторожно промывать глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскать.
P337+P313 Если раздражение глаз не проходит: обратиться к врачу.
Классификация WHMIS
D2B — Токсичный материал, вызывающий другие токсические эффекты
Система классификации
Рейтинги HMIS (шкала 0-4)
(Система идентификации опасных материалов)
Health
Fire
Реактивность
1
1
1
Здоровье (Острые эффекты) = 1
Плавелировка = 1
Физическая опасность = 1
Другие опасности
Результаты PBT и VPVB Оценка
PBT:
. N/A
vPvB:
N/A
РАЗДЕЛ 3. СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ
Вещества
Номер CAS / Название вещества:
497-19-8 Карбонат натрия
Идентификационный номер(а) EC 9024: :
207-838-8
Индексный номер:
011-005-00-2
РАЗДЕЛ 4.
 МЕРЫ ПЕРВОЙ ПОМОЩИ
МЕРЫ ПЕРВОЙ ПОМОЩИ Описание мер первой помощи
При вдыхании:
Обеспечить пострадавшего свежим воздухом. Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Немедленно обратитесь к врачу.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь к врачу.
При попадании в глаза:
Промыть открытые глаза в течение нескольких минут под проточной водой. Проконсультируйтесь с врачом.
При проглатывании:
Обратиться за медицинской помощью.
Информация для врача
Наиболее важные симптомы и эффекты, как немедленные, так и замедленные
Нет данных
Указание на необходимость немедленной медицинской помощи и специального лечения
Нет данных
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
Средства пожаротушения
Подходящие средства пожаротушения
Двуокись углерода, порошок для тушения или распыленная вода. Тушите большие пожары с помощью распыления воды или спиртостойкой пены.
Особые опасности, исходящие от вещества или смеси
Если этот продукт вовлечен в пожар, могут быть выделены следующие вещества:
Окись углерода и двуокись углерода
Оксид натрия
Рекомендации для пожарных
Защитное снаряжение:
Надеть автономный респиратор.
Носите полностью защитный непроницаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры предосторожности для персонала, защитное снаряжение и порядок действий в чрезвычайных ситуациях
Использовать средства индивидуальной защиты. Держите незащищенных людей подальше.
Обеспечьте достаточную вентиляцию.
Меры предосторожности по охране окружающей среды:
Не допускайте попадания материала в окружающую среду без официального разрешения.
Не допускайте попадания продукта в канализацию, канализационные системы или другие водотоки.
Не допускайте проникновения материала в землю или почву.
Методы и материалы для локализации и очистки:
Собрать механически.
Предотвращение вторичных опасностей:
Никаких специальных мер не требуется.
Ссылка на другие разделы
Информацию о безопасном обращении см. в разделе 7
Информацию о средствах индивидуальной защиты см. в Разделе 8.
Информацию об утилизации см. в Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в плотно закрытой таре.
Обеспечьте хорошую вентиляцию на рабочем месте.
Предотвращает образование пыли.
Информация о защите от взрывов и пожаров:
Данные отсутствуют
Условия безопасного хранения, включая любые несовместимости
Требования, которым должны соответствовать складские помещения и емкости:
Особых требований нет.
Информация о хранении в одном общем хранилище:
Не хранить вместе с окисляющими и кислотными материалами.
Хранить вдали от воды/влаги.
Дополнительная информация об условиях хранения:
Этот продукт гигроскопичен.
Хранить в сухом инертном газе.
Держите контейнер плотно закрытым.
Хранить в прохладном сухом месте в хорошо закрытых контейнерах.
Беречь от влаги и воды.
Конкретное конечное использование
Данные отсутствуют
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Дополнительная информация о конструкции технических систем:
Правильно работающий химический вытяжной шкаф, предназначенный для опасных химических веществ и имеющий среднюю скорость потока при не менее 100 футов в минуту.
Параметры управления
Компоненты с предельными значениями, требующими контроля на рабочем месте:
Нет.
Дополнительная информация:
Нет данных
Контроль экспозиции
Средства индивидуальной защиты
Соблюдайте стандартные меры защиты и гигиены при обращении с химическими веществами.
Хранить вдали от пищевых продуктов, напитков и кормов.
Немедленно снимите всю испачканную и загрязненную одежду.
Мыть руки перед перерывами и по окончании работы.
Избегать попадания в глаза.
Избегать попадания в глаза и на кожу.
Поддерживайте эргономически подходящую рабочую среду.
Дыхательное оборудование:
Используйте подходящий респиратор при наличии высоких концентраций.
Защита рук:
Непроницаемые перчатки
Осмотрите перчатки перед использованием.
Пригодность перчаток должна определяться как материалом, так и качеством, последнее из которых может варьироваться в зависимости от производителя.
Время проникновения через материал перчаток (в минутах)
Данные отсутствуют
Защита глаз:
Защитные очки
Защита тела:
Защитная рабочая одежда.
РАЗДЕЛ 9. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физико-химических свойствах
Внешний вид:
Форма: Порошок или гранулы
Цвет: Белый
Запах: Без запаха
Порог восприятия запаха: Данные отсутствуют.
pH (100 г/л) при 20 °C (68 °F): 11,5
Точка плавления/диапазон плавления: данные отсутствуют
Точка/диапазон кипения: данные отсутствуют (твердое, газообразное)
Нет данных.
Температура воспламенения: Данные отсутствуют.
Температура разложения: Данные отсутствуют.
Самовоспламенение: Данные отсутствуют.
Опасность взрыва: Данные отсутствуют.
Пределы взрываемости:
Нижний: Данные отсутствуют
Верхний: Данные отсутствуют
Давление пара: неприменимо
Плотность при 20 °C (68 °F): 2,53 г/см 3 (21,113 фунта/гал)
Относительный плотность
Нет данных.
Плотность паров
Н/Д
Скорость испарения
Н/Д
Растворимость/Смешиваемость с водой при 20 °C (68 °F): 212 г/л
Коэффициент распределения (н-октанол/вода): Данные отсутствуют.
Вязкость:
Динамика: Н/Д
Кинематика: N/A
Прочая информация
Данные отсутствуют
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность
Данные отсутствуют
Химическая стабильность
Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать:
Разложение не происходит, если используется и хранится в соответствии со спецификациями.
Возможность опасных реакций
Опасные реакции неизвестны
Условия, которых следует избегать
Нет доступных данных
Несовместимые материалы:
Вода/влага
Окислители
Опасные продукты разложения:
Окись углерода и двуокись углерода
Оксид натрия
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Информация о токсикологическом воздействии Химические вещества (RTECS) содержат данные об острой токсичности этого вещества.
Значения LD/LC50, соответствующие классификации:
Пероральная LD50 4090 мг/кг (крыса)
Раздражение или коррозия кожи:
Может вызывать раздражение
Раздражение или коррозия глаз:
Вызывает серьезное повреждение глаз.
Сенсибилизация:
Сенсибилизирующие эффекты неизвестны.
Мутагенность зародышевых клеток:
Эффекты неизвестны.
Канцерогенность:
Данные классификации канцерогенных свойств этого материала от EPA, IARC, NTP, OSHA или ACGIH отсутствуют.
Репродуктивная токсичность:
Реестр токсического воздействия химических веществ (RTECS) содержит репродуктивные данные для этого вещества.
Специфическая токсичность для системы органов-мишеней — многократное воздействие:
Неизвестно никаких эффектов.
Специфическая токсичность для системы органов-мишеней — однократное воздействие:
Эффекты неизвестны.
Опасность при вдыхании:
Эффекты неизвестны.
От подострой до хронической токсичности:
Реестр токсических эффектов химических веществ (RTECS) содержит данные о токсичности при многократном приеме для этого вещества.
Дополнительная токсикологическая информация:
Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Водная токсичность:
Нет данных
Стойкость и способность к разложению
Нет данных
Биоаккумулятивный потенциал
Нет данных
Мобильность в почве: отсутствует 909020 Дополнительная информация
допускать выброс материала в окружающую среду без официального разрешения.
Не допускайте попадания неразбавленного продукта или больших количеств в грунтовые воды, водотоки или канализационные системы.
Избегайте попадания в окружающую среду.
Смывание больших количеств в канализацию или водную среду может привести к повышению pH. Высокий уровень pH наносит вред водным организмам. При разбавлении уровня использования pH значительно снижается, так что после использования продукта водные отходы, сбрасываемые в канализацию, представляют лишь низкую водоопасность.
Результаты оценки PBT и vPvB
PBT:
Н/Д
vPvB:
Н/Д
Другие неблагоприятные эффекты
Нет доступных данных
РАЗДЕЛ 13. ИНФОРМАЦИЯ О УТИЛИЗАЦИИ
Методы обработки отходов
Рекомендация
Обратитесь к официальным правилам, чтобы обеспечить надлежащую утилизацию.
Неочищенная упаковка:
Рекомендация:
Утилизация должна производиться в соответствии с официальными правилами.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
Номер ООН
DOT, ADN, IMDG, IATA
N/A
Надлежащее отгрузочное наименование ООН
DOT, ADN, IMDG, IATA
N/A
DOT, ADR, ADN, IMDG, IATA
Class
N/A
Группа упаковки
DOT, IMDG, IATA
Н/Д
Опасности для окружающей среды:
Н/Д
Особые меры предосторожности для пользователя
Н/Д
Транспортировка навалом в соответствии с Приложением II MARPOL73/78 и Кодексом IBC
Н/Д
Транспорт/Дополнительная информация:
DOT
Загрязнитель морской среды (DOT):
№
РАЗДЕЛ 15.
 НОРМАТИВНАЯ ИНФОРМАЦИЯ
НОРМАТИВНАЯ ИНФОРМАЦИЯ Правила/законы по безопасности, охране здоровья и окружающей среды, относящиеся к веществу или смеси
Национальные правила
Все компоненты этого продукта перечислены в Перечне химических веществ Агентства по охране окружающей среды США.
Все компоненты этого продукта перечислены в Канадском перечне веществ для внутреннего потребления (DSL).
Раздел 313 SARA (списки конкретных токсичных химических веществ)
Вещество не указано в списке.
Предложение 65 штата Калифорния
Предложение 65 — Химические вещества, вызывающие рак
Вещество не указано в списке.
Prop 65 — Токсичность для развития
Вещество не указано.
Prop 65 — Токсичность для развития, женщины
Вещество не указано.
Prop 65 — Токсичность для развития, мужчины
Вещество не указано.
Информация об ограничении использования:
Только для использования технически квалифицированными лицами.
Другие правила, ограничения и запретительные положения
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (ЕС) № 1907/2006.
Вещество не указано.
Условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) в отношении производства, размещения на рынке и использования.
Вещество не указано.
Приложение XIV Регламента REACH (требуется разрешение на использование)
Вещество не указано.
REACH — Предварительно зарегистрированные вещества
Вещество указано.
Оценка химической безопасности:
Оценка химической безопасности не проводилась.
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (ДОСТИГАЕМОСТЬ). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКОЕ ПРАВО 1997-2022 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Приготовление и свойства Карбонат натрия
В течение тысяч лет люди знали и использовали карбонат натрия. Химическое вещество было получено древними египтянами из натрона, минерала, найденного на дне высохших озер. Натрон представляет собой смесь карбоната натрия и бикарбоната натрия. При мумификации умерших тел египтяне использовали карбонат натрия. Состав предохранял тела мертвых от разложения, высушивая их. Процесс был настолько успешным, что некоторые мумифицированные мумии возрастом 3000 лет до сих пор находятся в таком же хорошем состоянии, как и на момент смерти. Карбонат натрия также создавался на протяжении веков путем сжигания органических отходов, особенно морских водорослей. Общее название соединения, кальцинированная сода, происходит от этой технологии производства (зола, содержащая соединения натрия).
Информация о карбонате натрия из различных статей по химии доступна здесь. Установлено, что карбонат натрия (Na 2 CO 3 ) представляет собой химическое соединение, состоящее из неорганических элементов. Студенты, которые хотят преуспеть в химии, должны хорошо знать о карбонате натрия, чтобы получить глубокие знания о нем, чтобы хорошо сдать экзамены. Определение, подготовка, свойства и использование приведены здесь, чтобы помочь учащимся эффективно понять соответствующую тему. Продолжайте посещать наш веб-сайт для получения дополнительной помощи по химии.
Зарегистрируйтесь, чтобы получить бесплатный пробный тест и учебные материалы
+91
Подтвердите OTP-код (обязательно)
Я согласен с условиями и политикой конфиденциальности.
Обзор Карбонат натрия (SO-de-um KAR-bun-ate) представляет собой кристаллический твердый или белый порошок без запаха со щелочным вкусом. (Еще один материал со щелочным вкусом — пищевая сода. ) Он гигроскопичен, что означает, что ему нравится собирать влагу из воздуха. Он также доступен в виде моногидрата и декагидрата, оба из которых имеют немного другие физические свойства, чем безводная соль. Кальцинированная сода относится к безводной форме карбоната натрия, тогда как соляная или стиральная сода относится к декагидратной форме. Одним из наиболее важных производимых химических веществ традиционно был карбонат натрия. Его основное применение в производстве стекла и других химических веществ.
) Он гигроскопичен, что означает, что ему нравится собирать влагу из воздуха. Он также доступен в виде моногидрата и декагидрата, оба из которых имеют немного другие физические свойства, чем безводная соль. Кальцинированная сода относится к безводной форме карбоната натрия, тогда как соляная или стиральная сода относится к декагидратной форме. Одним из наиболее важных производимых химических веществ традиционно был карбонат натрия. Его основное применение в производстве стекла и других химических веществ.
Карбонат натрия (Na 2 CO 3 ) представляет собой химическое соединение, состоящее из неорганических элементов. Раньше его делали из золы растений, произраставших на богатых натрием почвах. Кальцинированную соду иногда называют карбонатом натрия. Трона используется для удаления кальцинированной соды и представляет собой двойную соль, образующуюся в озерах в результате процессов испарения. Он состоит из карбоната натрия и гидрокарбоната натрия.
Наиболее важным из основных тяжелых химикатов является карбонат натрия, иногда известный как стиральная сода или кальцинированная сода, и его преимущество заключается в том, что он не вызывает коррозии, что делает его более безопасным в обращении, чем гидроксид натрия.
Хранится на месте в силосах или загружается в меньшие бункеры по мере необходимости из мешков. Из-за поглощения воды и углекислого газа из атмосферы во время транспортировки и хранения кальцинированная сода медленно превращается в бикарбонат натрия и гидраты кальцинированной соды, которые образуют корку на открытых поверхностях. Это ограничивает доступное количество кальцинированной соды, затрудняя механический перенос и растворение в будущем. Он не вызывает коррозии и дозируется так же, как дозируется известковый порошок.
Получение и свойства Карбонат натрия Процесс Сольве в настоящее время является единственным способом получения карбоната натрия. В этом методе углекислый газ и аммиак закачиваются в охлажденный насыщенный раствор хлорида натрия. В протекающих процессах гидрокарбонат натрия, очень мало растворимый в присутствии ионов натрия, почти полностью осаждается. Фильтрация удаляет его, и он сжигается с образованием карбоната натрия.
В протекающих процессах гидрокарбонат натрия, очень мало растворимый в присутствии ионов натрия, почти полностью осаждается. Фильтрация удаляет его, и он сжигается с образованием карбоната натрия.
Ингредиенты для этой процедуры недороги и широко доступны. Рассол (NaCl), аммиак (NH 3 ), и известняк — три (CaCO 3 ). Здесь CaCl 2 является важным побочным продуктом этой процедуры.
We can write the reactions as:
2 NH 3 +H 2 O+CO 2 →NH 4 2CO 3
Nh5 2 CO 3 + H 2 O+CO 2 →2NH 4 HCO 3
отфильтровано.
NH 4 HCO 3 +NACL → NH 4 CL +NAHCO 3
Теперь бикарбонат SODIUM .
2NAHCO 3 → NA 2 CO 3 +CO 2 +H 2 O
, наконец, CO 2 O
, наконец, CO 2 ON
.
При растворении безводного карбоната натрия в воде он перекристаллизуется с образованием кристаллов стиральной соды, которые в процессе кристаллизации включают десять молекул воды.
Преимущества процесса Solvay:
- Процесс Solvay чрезвычайно рентабелен
- Сырье, необходимое для синтеза, легкодоступно и недорого
- Единственным побочным продуктом является хлорид кальция
- Он загрязняет процесс -бесплатно.
- Метод Solvay позволяет получать карбонат натрия высокой чистоты, а аммиак и двуокись углерода можно извлекать и использовать для другого цикла.
Физические свойства карбоната натрия:
Доступны бесцветные или белые кристаллические порошки карбоната натрия. Карбонат натрия в безводном состоянии гигроскопичен. Карбонат натрия имеет щелочной вкус и не имеет запаха. Карбонат натрия растворим в воде, растворим в этаноле и практически не растворим в ацетоне. При типичных давлениях и температурах карбонат натрия стабилен.
При типичных давлениях и температурах карбонат натрия стабилен.
| Na2CO3 | Карбонат натрия |
| Молекулярный вес/Молярная масса | 105,9888 g/mol |
| Density | 2.54 g/cm3 |
| Boiling Point | 1,600C |
| Melting Point | 851C |
( 1) Тепло не влияет на безводный карбонат натрия. При 8520С плавится без распада.
(2) Вследствие гидролиза, в результате которого образуются ионы OH – ((aq), водные растворы карбоната натрия являются умеренно щелочными.
Na 2 CO 3 (т)+2h3O(I)→H 2 CO 3 (водн.)+2Na+(водн.)+2OH – (водн.) 9000 (08)900 900 Водные растворы карбоната натрия поглощают углекислый газ из воздуха и создают гидрокарбонат натрия.
Na 2 CO 3 (водн. )+H 2 O+CO 2 (г)→2NaHCO 3 (водн.)
)+H 2 O+CO 2 (г)→2NaHCO 3 (водн.)
Na 2 CO 3 (водн.)+2H+(водн.)→2Na+(водн.)+H 2 O(ж)+CO 2 (г)
9
5 0 Na 3 (водн.)+2HCl(водн.)→2NaCl(водн.)+H 2 O(л)+CO 2 (г) Карбонат натрия в водеОбычно карбонат натрия динатриевая соль угольной кислоты, обладающая подщелачивающим действием. При растворении карбоната натрия в воде образуется угольная кислота и гидроксид натрия. В воде карбонат натрия чрезвычайно растворим. Он быстро диссоциирует на ионы натрия и ионы карбоната, которые в сочетании с водой образуют ионы бикарбоната.
Использование карбоната натрияНиже приведены некоторые области применения карбоната натрия –
- Это обычный ингредиент моющих средств и мыла.
- Материал, используемый в производстве стекла.

- Это материал, используемый для изготовления вискозных полимеров.
- Используется как средство против слеживания, разрыхлитель, стабилизатор и другие пищевые добавки.
- Используется в кулинарии, например, карбонат натрия придает лапше рамен неповторимый вкус.
- Материал, используемый в кирпичной промышленности.
- Используется при дублении и обработке шкур животных.
- Это пенообразователь, который содержится в зубной пасте.
- Жидкое стекло (силикат натрия), бура, фосфат натрия и множество других соединений соли производятся из него.
- Это вещество используется для изменения pH воды.
- Карбонат — это умягчитель воды, который осаждает жесткую воду, содержащую ионы магния и кальция.
- Его также можно использовать в качестве аналитического реагента и реагента для стандартизации в лаборатории.

Читайте также: Получение и свойства гидроксида натрия
Часто задаваемые вопросыКакие опасности связаны с карбонатом натрия?
При неправильном обращении или случайном контакте с карбонатом натрия карбонат натрия может нанести вред вашему здоровью и безопасности. Этот препарат может вызвать раздражение дыхательной системы, кашель, одышку и отек легких при вдыхании. Попадание в глаза может вызвать долговременное повреждение роговицы, а также ожоги. Избегайте глотания или вдыхания пыли, если вы используете карбонат натрия или кальцинированную соду в своем доме. Из-за этих опасностей следует обращаться с карбонатом натрия с осторожностью.
Где и в какой форме встречается карбонат натрия?
Карбонат натрия можно получить путем смешивания хлорида натрия (соли) и аммиака. В продовольственных магазинах, магазинах товаров для бассейнов и хозяйственных магазинах есть карбонат натрия. У серо-белого порошка нет ни запаха, ни вкуса, его часто называют твердым белым порошком.


