Химические и физические свойства алюминия. Физические свойства гидроксида алюминия :: SYL.ru
Этот легкий металл с серебристо-белым оттенком в современной жизни встречается почти повсеместно. Физические и химические свойства алюминия позволяют широко использовать его в промышленности. Самые известные месторождения – в Африке, Южной Америке, в Карибском регионе. В России места добычи бокситов имеются на Урале. Мировыми лидерами по производству алюминия являются Китай, РФ, Канада, США.
Добыча Al
В природе этот серебристый металл в силу своей высокой химической активности встречается лишь в виде соединений. Наиболее известные геологические породы, содержащие алюминий, – это бокситы, глиноземы, корунды, полевые шпаты. Промышленное значение имеют бокситы и глиноземы, именно месторождения этих руд позволяют добывать алюминий в чистом виде.
Свойства
Физические свойства алюминия позволяют легко вытягивать заготовки этого металла в проволоку и прокатывать в тонкие листы. Этот металл не является прочным, для повышения данного показателя при выплавке его легируют различными добавками: медью, кремнием, магнием, марганцем, цинком. Для промышленного назначения важно еще одно физическое свойство вещества алюминия – это его способность быстро окисляться на воздухе. Поверхность изделия из алюминия в естественных условиях обычно покрыта тонкой оксидной пленкой, которая эффективно защищает металл и препятствует его коррозии. При уничтожении этой пленки серебристый металл быстро окисляется, при этом его температура заметно повышается.
Этот металл не является прочным, для повышения данного показателя при выплавке его легируют различными добавками: медью, кремнием, магнием, марганцем, цинком. Для промышленного назначения важно еще одно физическое свойство вещества алюминия – это его способность быстро окисляться на воздухе. Поверхность изделия из алюминия в естественных условиях обычно покрыта тонкой оксидной пленкой, которая эффективно защищает металл и препятствует его коррозии. При уничтожении этой пленки серебристый металл быстро окисляется, при этом его температура заметно повышается.
Внутреннее строение алюминия
Физические и химические свойства алюминия во многом зависят от его внутреннего строения. Кристаллическая решетка этого элемента является разновидностью гранецентрированного куба.
Данный тип решетки присущ многим металлам, таким, как медь, бром, серебро, золото, кобальт и другие. Высокая теплопроводность и способность проводить электричество сделали этот металл одним из самых востребованных в мире. Остальные физические свойства алюминия, таблица которых представлена ниже, раскрывают полностью его свойства и показывают сферы их применения.
Остальные физические свойства алюминия, таблица которых представлена ниже, раскрывают полностью его свойства и показывают сферы их применения.
Легирование алюминия
Физические свойства меди и алюминия таковы, что при добавлении к алюминиевому сплаву некоторого количества меди его кристаллическая решетка искривляется, и прочность самого сплава повышается. На этом свойстве Al основано легирование легких сплавов для повышения их прочности и стойкости к воздействию агрессивной среды.
Объяснение процесса упрочнения лежит в поведении атомов меди в кристаллической решетке алюминия. Частицы Cu стремятся выпасть из кристаллической решетки Al, группируются на ее особых участках.
Там, где атомы меди образуют скопления, образуется кристаллическая решетка смешанного типа CuAl2 , в которой частицы серебристого металла одновременно входят в состав и общей кристаллической решетки алюминия, и в состав решетки смешанного типа CuAl2. Силы внутренних связей в искаженной решетке гораздо больше, чем в обычной. А значит, и прочность новообразованного вещества гораздо выше.
Силы внутренних связей в искаженной решетке гораздо больше, чем в обычной. А значит, и прочность новообразованного вещества гораздо выше.
Химические свойства
Известно взаимодействие алюминия с разбавленными серной и соляной кислотой. При нагревании этот металл в них легко растворяется. Холодная концентрированная или сильно разбавленная азотная кислота не растворяет этот элемент. Водные растворы щелочей активно воздействуют на вещество, в процессе реакции образуя алюминаты – соли, в составе которых имеются ионы алюминия. Например:
Al2O3 +3h3O+2NaOH=2Na[Al(OH)4]
Получившееся в результате реакции соединение носит название тетрагидроксоалюминат натрия.
Тонкая пленка на поверхности алюминиевых изделий защищает этот металл не только от воздуха, но и от воды. Если эту тонкую преграду убрать, элемент станет бурно взаимодействовать с водой, выделяя из нее водород.
2AL+6H2O= 2 AL (OH)3+3Н2↑
Образовавшееся вещество называется гидроксидом алюминия.
AL (OH)3 реагирует с щелочью, образуя кристаллы гидроксоалюмината:
Al(OH)2+NaOH=2Na[Al(OH)4]
Если это химическое уравнение сложить с предыдущим, получим формулу растворения элемента в щелочном растворе.
Al(OH)3+2NaOH+6H2O=2Na [Al(OH)4]+3H2↑
Горение алюминия
Физические свойства алюминия позволяют ему вступать в реакцию с кислородом. Если порошок этого металла или алюминиевую фольгу нагреть, то она вспыхивает и горит белым ослепительным пламенем. В конце реакции образуется оксид алюминия Al2O3.
Глинозем
Полученный оксид алюминия имеет геологическое название глинозем. В естественных условиях он встречается в виде корунда – твердых прозрачных кристаллов. Корунд отличается высокой твердостью, в шкале твердых веществ его показатель составляет 9. Сам корунд бесцветен, но различные примеси могут окрасить его в красный и синий цвет, так получаются драгоценные камни, которые в ювелирном деле называются рубинами и сапфирами.
Физические свойства оксида алюминия позволяют выращивать эти драгоценные камни в искусственных условиях. Технические драгоценные камни используются не только для ювелирных украшений, они применяются в точном приборостроении, для изготовления часов и прочего. Широко используются искусственные кристаллы рубина и в лазерных устройствах.
Мелкозернистая разновидность корунда с большим количеством примесей, нанесенная на специальную поверхность, известна всем как наждак. Физические свойства оксида алюминия объясняют высокие абразивные свойства корунда, а также его твердость и устойчивость к трению.
Гидроксид алюминия
Al2 (OH)3 является типичным амфотерным гидроксидом. В соединении с кислотой это вещество образует соль, содержащую положительно заряженные ионы алюминия, в щелочах образует алюминаты. Амфотерность вещества проявляется в том, что он может вести себя и как кислота, и как щелочь. Это соединение может существовать и в желеобразном, и в твердом виде.
В воде практически не растворяется, но вступает в реакцию с большинством активных кислот и щелочей. Физические свойства гидроксида алюминия используются в медицине, это популярное и безопасное средство снижения кислотности в организме, его применяют при гастритах, дуоденитах, язвах. В промышленности Al2 (OH)3 используется в качестве адсорбента, он прекрасно очищает воду и осаждает растворенные в ней вредные элементы.
Промышленное использование
Алюминий был открыт в 1825 году. Поначалу данный металл ценился выше золота и серебра. Это объяснялось сложностью его извлечения из руды. Физические свойства алюминия и его способность быстро образовывать защитную пленку на своей поверхности затрудняли исследование этого элемента. Лишь в конце 19 века был открыт удобный способ плавки чистого элемента, пригодный для использования в промышленных масштабах.
Легкость и способность сопротивляться коррозии – уникальные физические свойства алюминия. Сплавы этого серебристого металла применяются в ракетной технике, в авто-, судо-, авиа- и приборостроении, в производстве столовых приборов и посуды.
Сплавы этого серебристого металла применяются в ракетной технике, в авто-, судо-, авиа- и приборостроении, в производстве столовых приборов и посуды.
Как чистый металл Al используется при изготовлении деталей для химической аппаратуры, электропроводов и конденсаторов. Физические свойства алюминия таковы, что его электропроводность не так высока, как у меди, но этот недостаток компенсируется легкостью рассматриваемого металла, что позволяет делать провода из алюминия более толстыми. Так, при одинаковой электропроводности алюминиевый провод весит в два раза меньше медного.
Не менее важным является применение Al в процессе алитирования. Так называется реакция насыщения поверхности чугунного или стального изделия алюминием с целью защиты основного металла от коррозии при нагревании.
В настоящее время изведанные запасы алюминиевых руд вполне сопоставимы с потребностями людей в этом серебристом металле. Физические свойства алюминия могут преподнести еще немало сюрпризов его исследователям, а сферы применения этого металла гораздо шире, чем можно представить.
ГИДРОКСИД АЛЮМИНИЯ | Ataman Kimya A.Ş.
Номер КАС: 21645-51-2
Номер ЕС: 244-492-7
Химическая формула: Al(OH)3
Молярная масса: 78,00 г/моль
Гидроксид алюминия, Al(OH)3, встречается в природе в виде минерального гиббсита (также известного как гидраргиллит) и его трех гораздо более редких полиморфных модификаций: байерита, дойлеита и нордстрандита.
Гидроксид алюминия амфотерен, т. е. обладает как основными, так и кислотными свойствами.
Близкими родственниками являются гидроксид оксида алюминия AlO(OH) и оксид алюминия или оксид алюминия (Al2O3), последний из которых также является амфотерным.
Гидроксид алюминия, состав которого представляет собой Al(OH)3, встречается в природе в следующих формах: гиббсит, который является минералом, и дойлеит, нордстрандит и байерит, все из которых являются редкими полиморфными формами. Основываясь на его свойствах, мы можем сказать, что гидроксид алюминия является антацидом. Он имеет различные применения, основным из которых является медицинское применение.
Химические свойства гидроксида алюминия:
Существует множество различных форм оксида алюминия, включая как кристаллические, так и некристаллические формы.
Гидроксид алюминия является электрическим изолятором, что означает, что он не проводит электричество, а гидроксид алюминия также имеет относительно высокую теплопроводность.
Кроме того, в гидроксидах алюминия кристаллическая форма корунда, его твердость делает его пригодным в качестве абразива.
Высокая температура плавления оксида алюминия делает его хорошим огнеупорным материалом для футеровки высокотемпературных приборов, таких как печи, топки, мусоросжигательные заводы, реакторы различного типа и тигли.
Химическая формула гидроксида алюминия: Al(OH) ₃ .
Гидроксид алюминия принимают при расстройстве желудка.
Гидроксид алюминия является антацидом, что означает, что он нейтрализует избыток желудочной кислоты, связанный с расстройством желудка.
Гидроксид алюминия также помогает защитить слизистую оболочку желудка от кислотного раздражения.
Гидроксид алюминия также может уменьшить количество фосфатов, которые ваше тело поглощает из пищи, которую вы едите.
Гидроксид алюминия соединяется с фосфатом в желудке, который затем удаляется, а не всасывается.
Хотя гидроксид алюминия иногда назначают с этой целью людям с некоторыми заболеваниями почек, обычно вместо него используют другие лекарства.
Использование гидроксида алюминия:
Огнезащитный наполнитель:
Гидроксид алюминия также находит применение в качестве огнезащитного наполнителя для полимеров.
Аналогично используют гидроксид магния и смеси хунтита и гидромагнезита.
Гидроксид алюминия разлагается при температуре около 180 ° C (356 ° F), поглощая при этом значительное количество тепла и выделяя водяной пар.

В дополнение к тому, что он ведет себя как антипирен, гидроксид алюминия очень эффективен в качестве средства подавления дыма в широком диапазоне полимеров, особенно в полиэфирах, акрилах, этиленвинилацетате, эпоксидных смолах, поливинилхлориде (ПВХ) и каучуке.
Предшественники соединений Al:
Гидроксид алюминия является сырьем для производства других соединений алюминия: прокаленного оксида алюминия, сульфата алюминия, полиалюминийхлорида, хлорида алюминия, цеолитов, алюмината натрия, активированного оксида алюминия и нитрата алюминия.
Этот гель со временем кристаллизуется.
Гели гидроксида алюминия можно дегидратировать (например, с использованием смешивающихся с водой неводных растворителей, таких как этанол) с образованием порошка аморфного гидроксида алюминия, который легко растворим в кислотах.

Нагревание превращает его в активированный оксид алюминия, который используется в качестве осушителя, адсорбента при очистке газов и носителя катализатора.
Фармацевтическая:
Под общим названием «альгельдрат» гидроксид алюминия используется в качестве антацида у людей и животных (в основном кошек и собак).
Гидроксид алюминия реагирует с избытком кислоты в желудке, снижая кислотность содержимого желудка, что может облегчить симптомы язвы, изжоги или диспепсии.
Такие продукты могут вызвать запор, поскольку ионы алюминия подавляют сокращения гладкомышечных клеток желудочно-кишечного тракта, замедляя перистальтику и удлиняя время, необходимое для прохождения стула через толстую кишку.
Некоторые такие продукты разработаны таким образом, чтобы свести к минимуму такие эффекты за счет включения равных концентраций гидроксида магния или карбоната магния, которые обладают уравновешивающим слабительным действием.

Гидроксид алюминия также используется для контроля гиперфосфатемии (повышенный уровень фосфатов или фосфора в крови) у людей и животных, страдающих почечной недостаточностью.
Соль алюминия при попадании в организм связывается с фосфатом в кишечнике и снижает количество фосфора, которое может быть абсорбировано.
Осажденный гидроксид алюминия включается в качестве адъюванта в некоторые вакцины (например, вакцину против сибирской язвы).
Одним из известных брендов адъюванта гидроксида алюминия является Alhydrogel производства Brenntag Biosector.
Поскольку гидроксид алюминия хорошо поглощает белок, он также стабилизирует вакцины, предотвращая осаждение или прилипание белков вакцины к стенкам контейнера во время хранения.
Гидроксид алюминия иногда называют «квасцами», этот термин обычно используется для обозначения одного из нескольких сульфатов.
Составы вакцин, содержащие гидроксид алюминия, стимулируют иммунную систему, индуцируя высвобождение мочевой кислоты, что является сигналом иммунологической опасности.
Это сильно привлекает определенные типы моноцитов, которые дифференцируются в дендритные клетки.
Дендритные клетки захватывают антиген, переносят его в лимфатические узлы и стимулируют Т- и В-клетки.
Гидроксид алюминия, по-видимому, способствует индукции хорошего ответа Th3, поэтому он полезен для иммунизации против патогенов, которые блокируются антителами.
Однако гидроксид алюминия имеет небольшую способность стимулировать клеточный (Th2) иммунный ответ, что важно для защиты от многих патогенов, а также он бесполезен, когда антиген основан на пептидах.
Свойства гидроксида алюминия:
Очищенный гидроксид алюминия представляет собой объемистый порошок белого цвета или гранулы с плотностью около 2,42 г/мл.

Вы можете ожидать, что гидроксид алюминия будет действовать как амфотерное вещество в воде.
Если присутствует сильное основание, гидроксид алюминия будет действовать как кислота.
А если присутствует сильная кислота, гидроксид алюминия будет действовать как сильное основание.
С гидроксидом алюминия следует обращаться с осторожностью, так как его воздействие может вызвать раздражение.
Однако будут присутствовать только незначительные и остаточные повреждения.
Что касается воспламеняемости, гидроксид алюминия не воспламеняется и не горит.
Кроме того, гидроксид алюминия не реакционноспособен, поэтому устойчив как в условиях огня, так и в воде.
Использование гидроксида алюминия:
-Гидроокись алюминия используется как антацид.
-Гидроксид алюминия используется в геле гидроксида алюминия.
— Гидроксид алюминия используется для производства активированного оксида алюминия.

-Гидроксид алюминия используется в качестве наполнителя в косметике.
— Гидроксид алюминия используется в качестве промежуточного химического вещества.
-Гидроксид алюминия используется в качестве мягкого абразива для пластмасс.
-Гидроксид алюминия используется в качестве добавки к стеклу для повышения устойчивости к тепловому удару.
— Гидроксид алюминия используется в гидроизоляционных тканях.
— Гидроксид алюминия используется в производстве стекла.
Al(OH)3: гидроксид алюминия
Плотность гидроксида алюминия: 2,42 г/дм3
Температура воспламенения гидроксида алюминия: негорючий.
Температура плавления гидроксида алюминия: 300 °C.
Применение гидроксида алюминия:
Гидроксид алюминия имеет множество применений; некоторые люди считают, что это использование действительно бесконечно.
Просто чтобы проиллюстрировать широту применения, мы можем сказать, что гидроксид алюминия используется в качестве протравы в красителях, очистителя воды, ингредиента для косметики и даже в качестве элемента для процессов в фотографии.
Есть также приложения второстепенного характера в керамике и строительстве.
Но наиболее важной областью применения гидроксида алюминия является медицина.
Применение гидроксида алюминия в медицине:
Гидроксид алюминия также обладает очень полезным свойством, так как стимулирует иммунную систему человека.
Кроме того, с использованием гидроксида алюминия готовят различные вакцины, в том числе те, которые используются для лечения гепатита В, гепатита А и столбняка.
Гидроксид алюминия также может быть использован для лечения больных с заболеваниями почек, у которых наблюдается повышенный уровень фосфатов в крови из-за почечной недостаточности.
Это полезное свойство существует благодаря способности гидроксида алюминия связываться с фосфатами.
После связывания с гидроксидом алюминия фосфаты легко вымываются из организма человека.

Косметические применения гидроксида алюминия:
Существуют различные области применения гидроксида алюминия в области косметики.
Гидроксид алюминия чаще всего используется для производства губной помады, декоративной косметики и других средств по уходу за кожей.
Здесь используется гидроксид алюминия, так как он абсолютно стабилен и не токсичен для человека.
Иногда производители косметики на основе гидроксида алюминия также используют гидроксид алюминия для производства очищающих средств для кожи, средств для загара, лосьонов для тела и увлажняющих средств.
Средства личной гигиены, например, шампуни, зубные пасты, дезодоранты и многие другие, также предполагают использование гидроксида алюминия.
Гидроксид алюминия также иногда используется для защиты кожи человека.
Применение гидроксида алюминия в промышленности:
Бетон не может быть произведен без гидроксида алюминия.
На стадии производства бетона в цемент добавляют гидроксид алюминия.
Гидроксид алюминия также очень полезен, потому что цемент с добавлением гидроксида алюминия быстро высыхает, если он подвергается воздействию тепла.
Керамика и стекло как промышленного, так и бытового назначения изготавливаются с использованием гидроксида алюминия.
Самое полезное свойство гидроксида алюминия при добавлении его в стекло состоит в том, что он делает стекло термостойким.
Гидроксид алюминия возможен, поскольку, как уже упоминалось, гидроксид алюминия не воспламеняется и имеет высокую температуру плавления.
Гидроксид алюминия в сочетании с полимерами является очень хорошим антипиреном.
Использование гидроксида алюминия в текстильной области:
Не забывайте, что гидроксид алюминия не растворяется в воде.
По этой причине гидроксид алюминия можно применять в текстиле, добавляя его для производства водонепроницаемой одежды.
Кроме того, когда гидроксид алюминия необходим для связывания цветов растительных красителей с тканью, гидроксид алюминия также будет очень полезен.
В этом случае в качестве протравы используется гидроксид алюминия.
Любая морилка используется в случаях, когда ткани устойчивы к красителям.
В таких ситуациях протрава позволяет проникнуть красителю в ткань.
Другой пример использования гидроксида алюминия — это когда он используется для придания огнестойкости некоторым красителям.
Формула гидроксида алюминия Другие области применения:
Учитывая, насколько активно гидроксид алюминия используется в различных областях, мы не могли обойти вниманием и другие области его применения.
Помимо того, что мы уже упоминали выше, гидроксид алюминия, как и любое другое соединение алюминия, используется для очистки воды от частиц и разного рода примесей.
При производстве чернил гидроксид алюминия действует как наполнитель и консервант.
Гидроксид алюминия также можно использовать в качестве хроматографии в лабораториях для разделения химических веществ на различные соединения.
Реакции у людей:
В отличие от некоторых других соединений алюминия, гидроксид алюминия не вызывает побочных реакций у человека, по крайней мере, у большинства людей.
Гидроксид алюминия очень широко используется во многих сферах жизни и имеет множество применений в быту и промышленности.
Большинство людей могут не знать, что такое гидроксид алюминия или где это соединение используется, но мы уже знаем это, и полезные свойства гидроксида алюминия очевидны для всех, кто интересуется этой темой.
Медицинские меры предосторожности при приеме гидроксида алюминия:
Неудивительно, что наиболее важным применением гидроксида алюминия является его медицинское применение.
Несмотря на то, что гидроксид алюминия относительно безопасен для человека и применяется в различных сферах жизни человека, пероральное введение гидроксида алюминия следует проводить с осторожностью.
Гидроксид алюминия всегда рекомендуется проконсультировать с врачом перед началом приема гидроксида алюминия или при возникновении каких-либо проблем во время приема.
Если у вас есть какие-либо проблемы со здоровьем, связанные с почками, включая камни, запор или заболевание, вам следует обратиться к врачу или получить совет фармацевта, прежде чем принимать какие-либо лекарства, содержащие гидроксид алюминия.
Кроме того, консультация врача необходима, если вы страдаете от обезвоживания или регулярно употребляете алкоголь.
Номенклатура:
КАС №: 21645-51-2
Молекулярная формула: Al(OH)3
Молекулярный вес: 78
Синонимы: алюминиевая кислота, гидроксид алюминия, гидроксид алюминия (III), гидроксид алюминия, гидратированный оксид алюминия, ортоалюминиевая кислота.
Физическое свойство:
Физическое состояние: Белый аморфный порошок
Температура плавления: 300°C
Растворимость: в воде, растворим в кислотах, щелочах, HCl и h3SO4
Кислотность (pKa): >7
Температура вспышки: негорючий
Применение и использование гидроксида алюминия:
В основном используется в качестве активного лекарства в антацидных составах, а также используется в производстве красок для озер, чернил, носителей катализаторов и т. Д.
Д.
Гидроксид алюминия используется для лечения симптомов повышенной кислотности желудка, таких как изжога, расстройство желудка, кислый желудок или кислотное расстройство желудка.
Гидроксид алюминия также используется для снижения уровня фосфатов у людей с определенными заболеваниями почек.
Преимущества и недостатки гидроксида алюминия:
Гидроксид алюминия используется для лечения симптомов избытка желудочной кислоты, таких как расстройство желудка, изжога и кислотное расстройство желудка.
Гидроксид алюминия — это антацид, который быстро снижает кислотность желудка.
Прекратите использовать лекарство и сразу же обратитесь к врачу, если у вас есть серьезные побочные эффекты, такие как: сильная боль в желудке или запор; кровавый, черный или смолистый стул; кашель с кровью, похожей на кофейную гущу; боль при мочеиспускании; крайняя сонливость; чувство усталости, потеря аппетита и мышечная слабость
Категорически не рекомендуется принимать гидроксид алюминия более двух недель без консультации с врачом.
Кроме того, вы не должны принимать какие-либо другие лекарства при приеме гидроксида алюминия.
Если вы беременны или планируете забеременеть во время лечения гидроксидом алюминия, вам необходимо проконсультироваться с врачом.
То же самое следует сделать, если вы кормящая мать.
Воздействие гидроксида алюминия на грудного ребенка может быть вредным.
По этой причине вам следует проконсультироваться с врачом в такой ситуации.
Гидроксид алюминия (Al(OH)3 – ATH) является наиболее широко используемым неорганическим антипиреном в мире.
АТН является экономически эффективным и нетоксичным антипиреном, который может использоваться в самых разных формовочных смесях, таких как резина, полиэфирные и эпоксидные композиты, пенополиуретаны, составы на основе латекса, силикон, настенные покрытия, проволока и кабели.
Антипирены ATH относятся к категории безгалогенированных и малодымных (LSF), что важно для здоровья человека и окружающей среды.
Некоторые важные свойства гидроксида алюминия для антипиренов перечислены ниже:
-Температура разложения,
-токсичность (воздействие на здоровье человека и окружающую среду),
-Расходы,
-Удельный вес,
-Оптические свойства (цвет, показатель преломления и т.д.),
-Влияние на механические и электрические свойства конечного продукта
Что делает гидроксид алюминия?
Алюминий – это металл, встречающийся в природе.
Антацид представляет собой гидроксид алюминия.
Гидроксид алюминия используется при лечении изжоги, болей в желудке, боли в желудке или несварения желудка с кислотой.
Гидроксид алюминия также используется у людей с другими заболеваниями почек для снижения уровня фосфатов.
Безопасен ли гидроксид алюминия в косметике?
Синтетический ингредиент, который действует как замутнитель.
Основные области применения включают агент и абсорбент для окраски.
О токсичности гидроксида алюминия для кожи не известно.
Как по-другому называется гидроксид алюминия?
Гидроксид алюминия — безрецептурный антацид, используемый для лечения язвенной болезни и гиперфосфатемии.
Является ли гидроксид алюминия слабым основанием?
Гидроксид алюминия имеет молекулярную формулу Al(OH)3 как химическое соединение.
Например, в гидроксиде алюминия гидроксид (ОН) может действовать как слабое основание при реакции с сильной кислотой, соляной кислотой (HCl).
Слабое основание — это основание, которое частично диссоциирует в растворе или распадается на части.
Применение гидроксида алюминия:
-Строительство и гражданское строительство>Другое
-Повседневная жизнь>Другое
-Повседневная жизнь>Сантехнические изделия
-Повседневная жизнь>Средства общественной гигиены
-Промышленные химикаты>Другие
-Промышленные химикаты>Клеи
-Промышленная химия>Пластификаторы
-Промышленные химикаты>Резиновые химикаты
-Промышленная химия>Полимерные добавки
-Материалы по ИТ>Другое
-Материалы по ИТ>Электронные материалы
-Материалы, связанные с ИТ>Материалы для показа
-Материалы для ИТ>Материалы для обработки полупроводников
-Материалы для ИТ>Материалы для литий-ионных вторичных аккумуляторов
-Окружающая среда и энергия>Другое
-Окружающая среда и энергия>Материалы для литий-ионных аккумуляторов
СПОСОБ ПРОИЗВОДСТВА гидроксида алюминия:
Для производства используются традиционные методы производства порошков.
Порошки гидроксида алюминия (ATH) могут использоваться в качестве антипиреновой добавки для полимерных приложений и производства порошков оксида алюминия.
ХИМИЧЕСКИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА гидроксида алюминия:
Химическая чистота: > 99,5%
Белизна: > %97
Размер частиц: 20-25 мкм
ПРИМЕНЕНИЕ гидроксида алюминия:
Сырье для производства глинозема
Огнестойкие приложения
Гидроксид алюминия представляет собой белый кристаллический продукт.
Гидроксид алюминия также известен как гидратированный оксид алюминия, гидрат алюминия или тригидрат оксида алюминия (АТН).
Гидроксид алюминия обычно используется в качестве сырья для производства других химических веществ на основе оксида алюминия, таких как кальцинированный оксид алюминия, сульфат алюминия, полиалюминийхлорид (PAC), фторид алюминия и синтетический цеолит.
Химическая формула гидроксидов алюминия: Al2O3•3h3O или Al(OH)3.
Формула:
Alh4O3
h4AlO3
Чистая плата: 0
Средняя масса: 78,00356
Масса моноизотопа: 77,98976
ИнХИ: ИнХИ=1S/Al. 3h3O/h;3*1h3/q+3;;;/p-3
3h3O/h;3*1h3/q+3;;;/p-3
InChIKey: WNROFYMDJYEPJX-UHFFFAOYSA-K
СМАЙЛС: [H]O[Al](O[H])O[H]
Как принимать гидроксид алюминия?
Вы должны принимать это соединение алюминия только так, как это указано на его этикетке или как это прописывает ваш врач.
Не превышайте дозу, назначенную врачом, и не принимайте гидроксид алюминия дольше, чем было предписано.
Чтобы быть уверенным, что ваша доза точна, измерьте ее с помощью медицинской ложки или чашки вместо обычной ложки.
У вас нет специального медицинского прибора для измерения? Купите его или попросите своего врача предоставить его.
Гидроксид алюминия следует запивать полным стаканом воды.
Обычно гидроксид алюминия принимают перед сном или между приемами пищи.
Не принимайте гидроксид алюминия дольше двух месяцев, если ваш врач не посоветовал вам иначе.
Гидроксид алюминия следует хранить вдали от тепла, света и влаги.
Не волнуйтесь, если вы пропустили дозу.
Обычно гидроксид алюминия не следует принимать регулярно, но если это так, принимайте его, как только вспомните о нем.
Но если время для следующей дозы почти пришло, пропустите пропущенную дозу.
В случае передозировки гидроксидом алюминия следует обратиться в токсикологическую службу или вызвать скорую медицинскую помощь.
Симптомами передозировки гидроксидом алюминия являются потеря веса, изменения настроения, спутанность сознания, запор и мочеиспускание реже, чем обычно, или полное отсутствие мочеиспускания.
Что такое гидроксид алюминия?
Алюминий – природный минерал.
Гидроксид алюминия является антацидом.
Гидроксид алюминия используется для лечения изжоги, расстройства желудка, повышенной кислотности желудка или кислотного расстройства желудка.
Гидроксид алюминия также используется для снижения уровня фосфатов у людей с определенными заболеваниями почек.
Гидроксид алюминия также может использоваться для целей, не указанных в данном руководстве.
Структура гидроксида алюминия:
Al(OH)3 состоит из двойных слоев гидроксильных групп с ионами алюминия, занимающими две трети октаэдрических отверстий между двумя слоями.
Распознаются четыре полиморфа.
Все слои состоят из октаэдрических звеньев гидроксида алюминия с водородными связями между слоями.
Полиморфы различаются по расположению слоев.
Все формы кристаллов Al(OH)3 имеют гексагональную форму:
-гиббсит также известен как γ-Al(OH)3 или α-Al(OH)3
-байерит также известен как α-Al(OH)3 или тригидрат β-оксида алюминия.
-нордстрандит также известен как Al(OH)3
-дойлеит
Что такое гидроксид алюминия?
Гидроксид алюминия представляет собой безрецептурный пероральный антацид и фосфатсвязывающий препарат, который чаще всего используется для лечения высокого уровня фосфатов, вторичного по отношению к почечной дисфункции (аномальной или нарушенной функции почек).
Гидроксид алюминия также можно использовать для снижения выработки желудочной кислоты.
Использование гидроксидов алюминия у кошек, собак или мелких млекопитающих для лечения высокого уровня фосфатов является «неправильным» или «дополнительным».
Многие препараты обычно назначаются в ветеринарной медицине не по прямому назначению.
В этих случаях очень внимательно следуйте указаниям и предостережениям вашего ветеринара, поскольку их указания могут значительно отличаться от тех, что указаны на этикетке.
Как дается гидроксид алюминия?
Гидроксид алюминия принимают внутрь в виде жидкого геля или в виде порошка, смешанного с пищей.
Гидроксид алюминия также можно вводить в капсулы.
Гидроксид алюминия следует давать непосредственно перед едой или смешивать с пищей.
Гидроксид алюминия должен подействовать в течение 1-2 часов; однако эффекты могут быть неочевидными, поэтому для оценки эффективности этого лекарства могут потребоваться лабораторные тесты.
Гидраргиллит, который когда-то считался гидроксидом алюминия, представляет собой фосфат алюминия.
Тем не менее, и гиббсит, и гидраргиллит относятся к одному и тому же полиморфизму гидроксида алюминия, при этом гиббсит чаще всего используется в Соединенных Штатах, а гидраргиллит чаще используется в Европе.
Гидраргиллит назван в честь греческих слов, обозначающих воду (Hydra) и глину (argylles).
Что такое гидроксид алюминия?
Гидроксид алюминия — это антацид, доступный в безрецептурных (OTC) лекарствах, которые облегчают изжогу, кислотное расстройство желудка, кислый желудок и расстройство желудка.
Гидроксид алюминия можно найти в лекарствах от изжоги, которые содержат более одного антацидного активного ингредиента.
Гидроксид алюминия также можно найти в лекарствах, которые лечат другие симптомы, например газы.
Что лечит гидроксид алюминия?
-Изжога
-Изжога
— Кислый желудок
-Расстройство желудка
Что такое гидроксид алюминия?
Al(OH)3 является амфотерным по своей природе и имеет химическое название гидроксид алюминия.
Гидроксид алюминия также называют алюминиевой кислотой или гидроксидом алюминия или гидроксидом алюминия (III).
Гидроксид алюминия встречается в природе в виде минерального гиббсита и его полиморфных форм, а именно дойлеита, нордстрандита и байерита.
Гидроксид алюминия представляет собой аморфный порошок белого цвета.
Гидроксид алюминия нерастворим в воде, но растворим в щелочных и кислых растворах.
Свойства гидроксида алюминия:
Гидроксид алюминия амфотерен.
В кислоте гидроксид алюминия действует как основание Бренстеда-Лоури.
Гидроксид алюминия нейтрализует кислоту с образованием соли:
3 HCl + Al(OH)3 → AlCl3 + 3 h3O
В основаниях гидроксид алюминия действует как кислота Льюиса, связывая ионы гидроксида:
Al(OH)3 + OH- → Al(OH)4-
ГИДРОКСИД АЛЮМИНИЯ
Гидроксид алюминия или гидроксикарбонат алюминия является наиболее широко используемым активным антацидом.
Гидроксид алюминия доступен как в виде суспензии, так и в виде порошка и может использоваться отдельно или в сочетании с гидроксидом магния.
Широкое использование геля гидроксида алюминия в рецептуре антацидов основано на его превосходных фармакологических свойствах, неоднократно подтвержденных в течение многих лет применения.
Гель гидроксида алюминия является эффективным нейтрализатором и буфером желудочной соляной кислоты без известных вредных побочных эффектов.
Мы предлагаем широкий выбор марок гидроксида алюминия с различными свойствами.
ПОРОШОК ГИДРОКСИДА АЛЮМИНИЯ:
Порошки гидроксида алюминия производятся из суспензий с помощью определенных процессов сушки, в результате чего получаются порошки с различной плотностью и характеристиками размера частиц.
Порошки в основном используются при производстве антацидных таблеток, предпочтительно после предварительного гранулирования.
Предпочтительное название IUPAC:
Гидроксид алюминия
Систематическое название IUPAC:
Тригидроксидоалюминий
Номер КАС: 21645-51-2
ЧЕБИ: 33130
ЧЕМБЛ: ЧЕМБЛ1200706
ХимПаук: 8351587
Банк наркотиков: DB06723
Информационная карта ECHA: 100. 040.433
040.433
КЕГГ: D02416
Идентификационный номер PubChem: 10176082
Номер РТЭКС: BD0940000
УНИИ: 5QB0T2IUN0
Информационная панель CompTox (EPA): DTXSID2036405
Как мне взять гидроксид алюминия?
Используйте гидроксид алюминия точно так, как указано на этикетке или по назначению врача.
Гидроксид алюминия обычно принимают между приемами пищи или перед сном.
Возьмите гидроксид алюминия с полным стаканом (8 унций) воды.
Встряхните пероральную суспензию (жидкость) перед измерением дозы.
Используйте прилагаемый шприц-дозатор или прибор для измерения дозы лекарства (не кухонную ложку).
Не принимайте гидроксид алюминия дольше 2 недель без консультации с врачом.
Хранить при комнатной температуре вдали от влаги, тепла и света.
Химическая формула: Al(OH)3
Молярная масса: 78,00 г/моль
Внешний вид: белый аморфный порошок
Плотность: 2,42 г/см3, твердый
Температура плавления: 300 ° C (572 ° F, 573 K)
Растворимость в воде: 0,0001 г/100 мл
Произведение растворимости (Ksp): 3×10−34
Растворимость: растворим в кислотах и щелочах
Кислотность (pKa): >7
Изоэлектрическая точка: 7,7
Белый цвет
pH: от 8,5 до 10 (5% водная суспензия)
Линейная формула: Al(OH)3
Индекс Мерк: 15 338
Информация о растворимости: Растворимость в воде: нерастворим
Формула Вес: 78
Физическая форма: порошок
Процент чистоты: ≥63,5% (Al2O3)
Класс: Особо чистый
Потери при воспламенении: макс. 36,5 %.
36,5 %.
Упаковка: пластиковая бутылка
Водорастворимые вещества: макс. 0,2%.
Химическое название или материал: Гидроксид алюминия
Перед приемом гидроксида алюминия
Чтобы убедиться, что это правильное лечение для вас, прежде чем принимать капсулы гидроксида алюминия, важно, чтобы ваш врач или фармацевт знал:
-Если вы беременны или кормите грудью.
— Если у вас есть проблемы с работой печени или почек.
— Если вам сказали, что у вас низкий уровень фосфатов в крови.
— Если у вас когда-либо была аллергическая реакция на лекарство.
-Если вы принимаете какие-либо другие лекарства.
Сюда входят любые лекарства, которые вы принимаете и которые можно купить без рецепта, а также растительные и дополнительные лекарства.
Как принимать гидроксид алюминия
При расстройстве желудка взрослым принимать по одной капсуле четыре раза в день во время еды и одну перед сном.
Капсулы не подходят для приема детьми в качестве антацида.
Антациды лучше всего принимать, когда симптомы могут возникнуть.
Если вы принимаете гидроксид алюминия для уменьшения количества фосфатов в организме, ваш врач сообщит вам, сколько капсул нужно принимать каждый день.
Вас могут попросить принимать от 4 до 20 капсул в день.
Принимайте капсулы в течение дня во время еды.
Гидроксид алюминия может мешать другим лекарствам, принимаемым одновременно, и может препятствовать их правильному всасыванию.
Гидроксид алюминия лучше всего подходит, если между приемом гидроксида алюминия и любых других лекарств должно пройти два часа.
Другие имена:
Алюминиевая кислота
Гидроксид алюминия
Гидроксид алюминия (III)
Гидроксид алюминия
Тригидроксид алюминия
Гидратированный глинозем
Ортоалюминиевая кислота
Гидроксид алюминия считается самым важным минеральным антипиреном в мире, и, благодаря отсутствию галогенов, он безвреден для окружающей среды и характеризуется высокой эффективностью в качестве подавителя дымовых газов.
Гидроксид алюминия получают из бокситов по методу Байера.
Помимо огнезащитного свойства, превосходными характеристиками гидроксида алюминия являются его высокая степень белизны и низкая степень твердости.
Кроме того, дегидратация происходит при 200°С.
Свойства гидроксида алюминия:
-низкая степень твердости, 3
-плотность 2,4 г/см3
-высокая степень белизны (значение цвета Y > 94)
-коэффициент термического расширения 15*10-6К-1 (при темп. 20–300°С)
— огнезащитный
Что такое гидроксид алюминия?
Адъювант гидроксида алюминия включает гель гидроксида алюминия в солевом растворе.
Кроме того, гидроксид алюминия представляет собой неорганическую соль, которая используется в качестве антацида.
Кроме того, гидроксид алюминия является основным соединением, которое нейтрализует соляную кислоту в желудочном секрете.
Гидроксид алюминия имеет амфотерную природу.
Основные области применения гидроксида алюминия:
-кабели например из ПВХ
-текстильные аппликации
-композиты с твердой поверхностью из ПММА
-эпоксидные литейные смолы
-SMC/BMC и латекс
Свойства продукта:
Физическое состояние: жидкость
Форма: жидкость
Al2O3: 10% (масс. /масс.)
/масс.)
Зарядка: +1350
Цвет: от бесцветного до светло-желтого
Запах: Незначительный
pH: >= 2
Температура плавления/замерзания: < 0 °C (< 32 °F)
Температура кипения, начальная точка кипения: 100–120 °C (212–248 °F)
Плотность: 1200 – 1400 кг/м3 при 20 oC
Растворимость (вода): смешивается
Показания гидроксида алюминия:
Гидроксид алюминия часто вводят перорально для временного облегчения изжоги или гастроэзофагеального рефлюкса.
Гидроксид алюминия можно использовать местно, временно, для защиты и облегчения натертой и потертой кожи, незначительных ран и ожогов, а также раздражений кожи, возникающих в результате трения и растирания.
Пациенты также могут получать гидроксид алюминия для лечения вызванного химиотерапией орального мукозита в виде жидкости для полоскания рта.
Кроме того, гидроксид алюминия одобрен для использования в качестве адъюванта во многих вакцинах из-за его способности усиливать фагоцитоз и стимулировать иммунный ответ.
Гидроксид алюминия также одобрен для использования в широком спектре косметических продуктов в различных концентрациях.
Гидроксид алюминия также может служить фосфатсвязывающим средством у пациентов с хроническим заболеванием почек.
Однако использование гидроксидов алюминия таким образом нечасто из-за риска побочных эффектов.
Обычно пероральный гидроксид алюминия представляет собой жидкий состав гидроксида алюминия и магния.
Механизм действия:
Гидроксид алюминия [Al(OH)3] диссоциирует в желудке на Al3+ и OH-.
Освобожденные гидроксидные группы затем связываются со свободными протонами, в конечном итоге образуя в желудке воду и нерастворимые соли алюминия, в основном Al(Cl)3.
Связывание протона служит для повышения общего pH желудка, т. е. менее кислого, уменьшая симптомы несварения желудка.
Произведенная соль алюминия в основном выводится с калом, при этом менее 1% биодоступного алюминия абсорбируется в желудочно-кишечном тракте.
Алюминий существует в организме в стационарном состоянии, поэтому организм справляется с кратковременным увеличением поглощения алюминия при использовании в качестве антацида с эквивалентным увеличением экскреции с мочой немодифицированного алюминия.
Тем не менее, уставка этого равновесного состояния может повышаться при длительном повышенном потреблении алюминия, поэтому лечение гидроксидом алюминия не следует рассматривать как долгосрочное решение для пациентов, страдающих кислотным расстройством желудка.
Кроме того, пациенты с хроническим заболеванием почек могут быть не в состоянии выводить из организма повышенное количество алюминия, и поэтому их также следует тщательно обследовать.
Гидроксид алюминия для местного применения создает кислый гидрофильный слой в области раздражения; это служит защитным барьером для предотвращения инфекции и сдерживания роста бактерий в ране.
Известно, что в качестве адъюванта в вакцинах гидроксид алюминия увеличивает фагоцитоз макрофагов, возможно, за счет активации NLRP3-инфламмасомы, увеличивая поглощение желаемого антигена.
Кроме того, известно, что он способствует так называемому «репозиторному эффекту», при котором антигены агрегируют на молекуле и вокруг нее, что помогает предотвратить их деградацию в организме.
Администрация:
Гидроксид алюминия при использовании в качестве антацида следует вводить перорально.
Хорошо встряхните суспензию гидроксида алюминия перед использованием.
Гидроксид алюминия следует принимать 5–6 раз в день после еды и перед сном, но не более 3,84 г в сутки.
Пациент должен следить за дозой с потреблением воды.
Гидроксид алюминия для местного применения следует нанести на желаемую область и оставить на месте.
Алюминий для местного применения имеет минимальную абсорбцию через кожу, поэтому местное лечение гидроксидом алюминия может потребовать повторного применения по мере необходимости.
Применение гидроксида алюминия в качестве антацида не должно применяться для длительного лечения симптомов пациента.
Точно так же гидроксид алюминия не следует назначать пациентам с почечной недостаточностью.
В этих случаях повышенное содержание алюминия может вызвать более серьезные побочные эффекты или истощить запасы фосфатов в организме.
Формула гидроксида алюминия: h4AlO3
Свойства гидроксида алюминия
Молярная масса: 78,00 г/моль
Температура плавления: 300 ° C (572 ° F, 573 K)
Плотность: 2,42 г/см3, твердый
Производство гидроксида алюминия:
Практически весь гидроксид алюминия, используемый в коммерческих целях, производится по процессу Байера, который включает растворение боксита в гидроксиде натрия при температуре до 270 ° C (518 ° F).
Твердые отходы, бокситовые хвосты, удаляют, а гидроксид алюминия осаждают из оставшегося раствора алюмината натрия.
Этот гидроксид алюминия можно превратить в оксид алюминия или оксид алюминия прокаливанием.
Остаток или бокситовые хвосты, которые в основном состоят из оксида железа, очень едкие из-за остаточного гидроксида натрия.
Гидроксид алюминия исторически хранился в лагунах; это привело к аварии на глиноземном заводе Айка в 2010 году в Венгрии, где в результате прорыва дамбы девять человек утонули.
Еще 122 человека обратились за медицинской помощью в связи с химическими ожогами.
Грязь загрязнила 40 квадратных километров (15 квадратных миль) земли и достигла Дуная.
В то время как грязь считалась нетоксичной из-за низкого содержания тяжелых металлов, связанная с ней суспензия имела pH 13.
Почему назначают гидроксид алюминия?
Гидроксид алюминия, гидроксид магния — антациды, используемые вместе для облегчения изжоги, кислотного расстройства желудка и расстройства желудка.
Гидроксид алюминия можно использовать для лечения этих симптомов у пациентов с пептической язвой, гастритом, эзофагитом, грыжей пищеводного отверстия диафрагмы или повышенным содержанием кислоты в желудке (повышенная кислотность желудка).
Гидроксид алюминия соединяется с желудочной кислотой и нейтрализует ее.
Гидроксид алюминия, гидроксид магния доступны без рецепта.
Гидроксид алюминия иногда назначают для других целей; попросите вашего врача или фармацевта для получения дополнительной информации.
Что такое гидроксид алюминия?
Алюминий – природный минерал. Гидроксид алюминия является антацидом.
Гидроксид алюминия используется для лечения изжоги, расстройства желудка, повышенной кислотности желудка или кислотного расстройства желудка.
Гидроксид алюминия также используется для снижения уровня фосфатов у людей с определенными заболеваниями почек.
Гидроксид алюминия также может использоваться для целей, не указанных в данном руководстве.
Формула: Alh4O3 / Al(OH)3
Молекулярная масса: 78,0
Температура плавления: 300°С
Плотность: 2,42 г/см³
Растворимость в воде: нет
Давление пара, Па при 20°С: <10
Преимущества гидроксида алюминия:
-Высокоэффективный коагулянт на основе хлорида гидроксида алюминия
-Отличное удаление мути/взвешенных веществ
-Автоматический буферный эффект уменьшает понижение pH
-Высокая катионная плотность заряда
-Очень низкий объем шлама
-Уменьшите дозу химикатов и затраты на лечение
Как следует использовать гидроксид алюминия?
Это лекарство выпускается в виде жевательных таблеток и жидкости для приема внутрь.
Тщательно разжевывайте таблетки; не глотайте их целиком.
Выпейте полный стакан воды после приема таблеток.
Хорошо встряхните жидкость для приема внутрь перед каждым использованием, чтобы равномерно смешать лекарство.
Жидкость можно смешивать с водой или молоком.
Внимательно следуйте указаниям на этикетке на упаковке или на этикетке с рецептом и попросите своего врача или фармацевта объяснить любую часть, которую вы не понимаете.
Принимайте антациды гидроксида алюминия, гидроксида магния точно в соответствии с указаниями.
Не принимайте большее или меньшее количество гидроксида алюминия и не принимайте его чаще, чем предписано врачом.
Не принимайте антациды более 1–2 недель, если это не предписано врачом.
Какие особые меры предосторожности следует соблюдать?
Прежде чем принимать антациды гидроксида алюминия, гидроксида магния,
сообщите своему врачу и фармацевту, если у вас аллергия на антациды гидроксида алюминия, гидроксида магния или любые другие препараты.
Расскажите своему врачу и фармацевту, какие лекарства, отпускаемые по рецепту и без рецепта, вы принимаете, особенно аспирин, хиноксацин (цинобак), ципрофлоксацин (ципро), дигоксин (ланоксин), диазепам (валиум), эноксацин (пенетрекс), сульфат железа (железо), флуконазол ( Дифлюкан), индометацин, изониазид (INH), итраконазол (Sporanox), кетоконазол (Nizoral), левофлоксацин (Levaquin), ломефлоксацин (Maxaquin), налидиксовая кислота (NegGram), норфлоксацин (Noroxin), офлоксацин (Floxin), спарфлоксацин (Zagam) , тетрациклин (ахромицин, сумицин) и витамины. Если ваш врач рекомендует вам принимать антациды во время приема этих лекарств, не принимайте их в течение 2 часов после приема антацида.
Расскажите своему врачу, если у вас есть или когда-либо были заболевания почек.
Расскажите своему врачу, если вы беременны, планируете забеременеть или кормите грудью.
Если вы забеременели при приеме антацидов гидроксида алюминия, гидроксида магния, позвоните своему врачу.
Каким особым диетическим указаниям я должен следовать?
Если вы принимаете это лекарство от язвы, тщательно соблюдайте диету, назначенную врачом.
Что делать, если я забыл дозу?
Если вы принимаете запланированные дозы гидроксида алюминия, гидроксида магния, примите пропущенную дозу, как только вспомните об этом.
Однако, если гидроксид алюминия почти подходит для следующей дозы, пропустите пропущенную дозу и продолжайте свой обычный график дозирования.
Не принимайте двойную дозу, чтобы компенсировать пропущенную.
алюминий; тригидроксид
Высушенный гель гидроксида алюминия
Гель гидроксида алюминия, высушенный
тригидроксид алюминия
гидроксид алюминия
Гидроксид алюминия
Сухой гидроксид алюминия
Гидроксид алюминия, высушенный
Гель гидроксида алюминия, высушенный
КЕМБЛ1200706
DTXSID2036405
НИОСХ/БД070800
Ди-мю-гидрокситетрагидроксидиалюминий
Гидроксид алюминия технический
АФ-260
АКОС015904617
Алюминий, ди-мю-гидрокситетрагидроксиди-
DB06723
БД07080000
Q407125
J-014205
Компонент UNII-F41V936QZM WNROFYMDJYEPJX-UHFFFAOYSA-K
Гидроксид алюминия [Wiki] [REDIRECT]
14762-49-3 [РН]
21645-51-2 [РН]
244-492-7 [ЭИНЭКС]
5QB0T2IUN0
Тригидроксид алюминия [ACD/название IUPAC]
гидроксид алюминия (3+)
гидроксид алюминия (III)
Тригидроксид алюминия [немецкий] [название ACD/IUPAC]
ГИДРОКСИД АЛЮМИНИЯ [USP]
Тригидроксид алюминия
Гидроксид алюминия (III)
ГИББСАЙТ
Тригидроксиалюминий
Тригидроксид алюминия [французский] [название ACD/IUPAC]
1330-44-5 [РН]
135151-77-8 [РН]
13765-93-0 [РН]
150828-31-2 [РН]
24623-77-6 [РН]
36201-72-6 [РН]
37324-42-8 [РН]
51668-55-4 [РН]
52350-11-5 [РН]
7784-30-7 [РН]
8022-59-1 [РН]
89686-54-4 [РН]
93237-81-1 [РН]
АЛЬТЕРНАГЕЛЬ
АльтернаГель (торговое название)
АльтернаГель; алю-кап; Амфойель
Алю-Кап
Алю-Кап (торговое название)
гидроксид алюминия (III)
Гель гидроксида алюминия, высушенный
Гидроксид алюминия, высушенный
гидроксид алюминия; Гель гидроксида алюминия, высушенный; гидроксид алюминия, высушенный; Гель гидроксида алюминия, высушенный; гидроксид алюминия, высушенный; высушенный гидроксид алюминия; Высушенный гель гидроксида алюминия
Тригидроксид алюминия
тригидроксид иона алюминия (3+)
триоксиданид иона алюминия (3+)
ТРИГИДРОКСИД АЛЮМИНИЯ(3+)
гидроксид алюминия
Гидроксид алюминия (III) (реагент)
алюминий и тригидроксид
Гель гидроксида алюминия, высушенный
Гидроксид алюминия, высушенный [JAN]
Алуфос
Амфойель
ОСНОВНОЙ ГИДРОКСИД АЛЮМИНИЯ
Сухой гидроксид алюминия
Высушенный гель гидроксида алюминия
ИНЭКС 232-056-9
гидроксид алюминия
MFCD00003420
УНИИ:5QB0T2IUN0
УНИИ-5QB0T2IUN0
УНИИ-F41V936QZM
氢氧化铝[китайский]
Реакция получения гидроксида алюминия.
 Алюминий. Соединения алюминия. Амфотерный характер свойств оксида алюминия и гидроксида алюминия. Показания к применению
Алюминий. Соединения алюминия. Амфотерный характер свойств оксида алюминия и гидроксида алюминия. Показания к применениюОдним из наиболее широко используемых в промышленности веществ является гидроксид алюминия. В этой статье о нем и пойдет речь.
Что такое гидроксид?
Это химическое соединение, которое образуется при взаимодействии оксида с водой. Существует три их разновидности: кислотные, основные и амфотерные. Первые и вторые разделяются на группы в зависимости от их химической активности, свойств и формулы.
Что такое амфотерные вещества?
Амфотерными могут быть оксиды и гидроксиды. Это такие вещества, для которых характерно проявлять как кислотные, так и основные свойства, в зависимости от условий реакции, используемых реагентов и т. д. К амфотерным оксидам относятся два вида оксида железа, оксид марганца, свинца, бериллия, цинка, а также алюминия. Последний, кстати, чаще всего получают из его гидроксида. К амфотерным же гидроксидам можно отнести гидроксид бериллия, железа, а также гидроксид алюминия, который мы сегодня и рассмотрим в нашей статье.
Физические свойства гидроксида алюминия
Данное химическое соединение представляет собой твердое белое вещество. Оно не растворяется в воде.
Гидроксид алюминия — химические свойства
Как уже было сказано выше, это наиболее яркий представитель группы амфотерных гидроксидов. В зависимости от условий реакции, он может проявлять как основные, так и кислотные свойства. Данное вещество способно растворяться в кислотах, при этом образуется соль и вода.
К примеру, если смешать его с хлорной кислотой в равном количестве, то получим алюминий хлорид с водой также в одинаковых пропорциях. Также еще одно вещество, с которым реагирует гидроксид алюминия, — гидроксид натрия. Это типичный основной гидроксид. Если смешать в равных количествах рассматриваемое вещество и раствор гидроксида натрия, то получим соединение под названием тетрагидроксоалюминат натрия. В его химической структуре содержится атом натрия, атом алюминия, по четыре атома оксигена и гидрогена. Однако при сплавлении этих веществ реакция идет несколько по-другому, и образуется уже не это соединение. В результате данного процесса можно получить метаалюминат натрия (в его формулу входят по одному атому натрия и алюминия и два атома оксигена) с водой в равных пропорциях, при условии, если смешать одинаковое количество сухих гидроксидов натрия и алюминия и подействовать на них высокой температурой. Если же смешать его с гидроксидом натрия в других пропорциях, можно получить гексагидроксоалюминат натрия, который содержит три атома натрия, один атом алюминия и по шесть оксигена и гидрогена. Для того чтобы образовалось данное вещество, нужно смешать рассматриваемое вещество и раствор гидроксида натрия в пропорциях 1:3 соответственно. По описанному выше принципу можно получить соединения под названием тетрагидроксоалюминат калия и гексагидроксоалюминат калия. Также рассматриваемое вещество подвержено разложению при воздействии на него очень высоких температур. Вследствие такого рода химической реакции образуется оксид алюминия, который также обладает амфотерностью, и вода.
Однако при сплавлении этих веществ реакция идет несколько по-другому, и образуется уже не это соединение. В результате данного процесса можно получить метаалюминат натрия (в его формулу входят по одному атому натрия и алюминия и два атома оксигена) с водой в равных пропорциях, при условии, если смешать одинаковое количество сухих гидроксидов натрия и алюминия и подействовать на них высокой температурой. Если же смешать его с гидроксидом натрия в других пропорциях, можно получить гексагидроксоалюминат натрия, который содержит три атома натрия, один атом алюминия и по шесть оксигена и гидрогена. Для того чтобы образовалось данное вещество, нужно смешать рассматриваемое вещество и раствор гидроксида натрия в пропорциях 1:3 соответственно. По описанному выше принципу можно получить соединения под названием тетрагидроксоалюминат калия и гексагидроксоалюминат калия. Также рассматриваемое вещество подвержено разложению при воздействии на него очень высоких температур. Вследствие такого рода химической реакции образуется оксид алюминия, который также обладает амфотерностью, и вода. Если взять 200 г гидроксида и нагреть его, то получим 50 г оксида и 150 г воды. Кроме своеобразных химических свойств, данное вещество проявляет также и обычные для всех гидроксидов свойства. Оно вступает во взаимодействие с солями металлов, которые имеют более низкую химическую активность, нежели алюминий. Для примера можно рассмотреть реакцию между ним и хлоридом меди, для которой нужно взять их в соотношении 2:3. При этом выделится водорастворимый хлорид алюминия и осадок в виде гидроксида купрума в пропорциях 2:3. Также рассматриваемое вещество реагирует и с оксидами подобных металлов, для примера можно взять соединение той же меди. Для проведения реакции потребуется гидроксид алюминия и оксид купрума в соотношении 2:3, в результате чего получим алюминий оксид и гидроксид меди. Свойствами, которые были описаны выше, также обладают и другие амфотерные гидроксиды, такие как гидроксид железа или бериллия.
Если взять 200 г гидроксида и нагреть его, то получим 50 г оксида и 150 г воды. Кроме своеобразных химических свойств, данное вещество проявляет также и обычные для всех гидроксидов свойства. Оно вступает во взаимодействие с солями металлов, которые имеют более низкую химическую активность, нежели алюминий. Для примера можно рассмотреть реакцию между ним и хлоридом меди, для которой нужно взять их в соотношении 2:3. При этом выделится водорастворимый хлорид алюминия и осадок в виде гидроксида купрума в пропорциях 2:3. Также рассматриваемое вещество реагирует и с оксидами подобных металлов, для примера можно взять соединение той же меди. Для проведения реакции потребуется гидроксид алюминия и оксид купрума в соотношении 2:3, в результате чего получим алюминий оксид и гидроксид меди. Свойствами, которые были описаны выше, также обладают и другие амфотерные гидроксиды, такие как гидроксид железа или бериллия.
Что такое гидроксид натрия?
Как видно выше, существует много вариантов химических реакций гидроксида алюминия с гидроксидом натрия. Что же это за вещество? Это типичный основной гидроксид, то есть химически активная, растворимая в воде основа. Он обладает всеми химическими свойствами, которые характерны для основных гидроксидов.
Что же это за вещество? Это типичный основной гидроксид, то есть химически активная, растворимая в воде основа. Он обладает всеми химическими свойствами, которые характерны для основных гидроксидов.
То есть он может растворяться в кислотах, к примеру, при смешивании натрий гидроксида с хлорной кислотой в равных количествах можно получить пищевую соль (хлорид натрия) и воду в пропорции 1:1. Также данный гидроксид вступает в реакции с солями металлов, которые обладают более низкой химической активностью, нежели натрий, и их оксидами. В первом случае происходит стандартная реакция обмена. При добавлении к нему, к примеру, хлорида серебра, образуется хлорид натрия и гидроксид серебра, который выпадает в осадок (реакция обмена осуществима только в случае, если одно из веществ, полученных в ее результате, будет осадком, газом либо водой). При добавлении к натрий гидроксиду, например, оксида цинка, получаем гидроксид последнего и воду. Однако намного более специфическими являются реакции данного гидроксида AlOH, которые были описаны выше.
Получение AlOH
Когда мы уже рассмотрели основные его химические свойства, можно поговорить о том, как же его добывают. Основной способ получения данного вещества — проведение химической реакции между солью алюминия и натрий гидроксидом (может использоваться и калий гидроксид).
При такого рода реакции образуется сам AlOH, выпадающий в белый осадок, а также новая соль. Например, если взять алюминий хлорид и добавить к нему в три раза больше гидроксида калия, то полученными веществами будут рассматриваемое в статье химическое соединение и в три раза больше хлорида калия. Также существует метод получения AlOH, который предусматривает проведение химической реакции между раствором соли алюминия и карбонатом основного металла, для примера возьмем натрий. Для получения гидроксида алюминия, кухонной соли и углекислого газа в пропорциях 2:6:3 необходимо смешать хлорид алюминия, карбонат натрия (соду) и воду в соотношении 2:3:3.
Где используется алюминий гидроксид?
Гидроксид алюминия находит свое применение в медицине.
Благодаря его способности нейтрализовать кислоты, препараты с его содержанием рекомендуются при изжоге. Также его выписывают при язвах, острых и хронических воспалительных процессах кишечника. Кроме того, гидроксид алюминия используют в изготовлении эластомеров. Также он широко применяется в химической промышленности для синтеза оксида алюминия, алюминатов натрия — эти процессы были рассмотрены выше. Кроме того, его часто используют во время очистки воды от загрязнений. Также данное вещество широко применяется в изготовлении косметических средств.
Где применяются вещества, которые можно получить с его помощью?
Оксид алюминия, который может быть получен вследствие термического разложения гидроксида, используется при изготовлении керамики, применяется в качестве катализатора для проведения разнообразных химических реакций. Тетрагидроксоалюминат натрия находит свое использование в технологии окрашивания тканей.
Неорганическое вещество, щелочь алюминия, формула Al(OH) 3 . Встречается в природе, входит в состав бокситов.
Встречается в природе, входит в состав бокситов.
Свойства
Существует в четырех кристаллических модификациях и в виде коллоидного раствора, гелеобразного вещества. Реактив почти не водорастворим. Не горит, не взрывается, не ядовит.
В твердом виде — мелкокристаллический рыхлый порошок, белый или прозрачный, иногда с легким серым или розовым оттенком. Гелеобразный гидроксид тоже белый.
Химические свойства у твердой и гелеобразной модификации отличаются. Твердое вещество достаточно инертно, не вступает в реакции с кислотами, щелочами, другими элементами, но может образовывать метаалюминаты в результате сплавления с твердыми щелочами или карбонатами.
Гелеобразное вещество проявляет амфотерные свойства, то есть реагирует и с кислотами, и со щелочами. В реакции с кислотами образуются соли алюминия соответствующей кислоты, со щелочами — соли другого типа, алюминаты. Не вступает в реакции с раствором аммиака.
При нагревании гидроксид разлагается на оксид и воду.
Меры предосторожности
Реактив относится к четвертому классу опасности, считается пожаробезопасным и практически безопасным для человека и окружающей среды. Осторожность нужно проявлять только с аэрозольными частицами в воздухе: пыль оказывает раздражающее воздействие на органы дыхания, кожу, слизистые оболочки.
Поэтому на рабочих местах, где возможно образование большого количества пыли гидроксида алюминия, сотрудники должны использовать средства защиты для органов дыхания, глаз и кожи. Следует наладить контроль содержания в воздухе рабочей зоны вредных веществ по методике, утвержденной ГОСТом.
Помещение должно быть оборудовано приточно-вытяжной вентиляцией, а при необходимости — местными аспирационными отсосами.
Хранят твердую гидроокись алюминия в многослойных бумажных мешках или другой таре для сыпучих продуктов.
Применение
В промышленности реактив используется для получения чистого алюминия и производных алюминия, например, оксида алюминия, сернокислого и фтористого алюминия .
— Оксид алюминия, получаемый из гидроксида, применяется для получения искусственных рубинов для нужд лазерной техники, корундов — для сушки воздуха, очистки минеральных масел, для производства наждака.
— В медицине используется как обволакивающее средство и антацид длительного действия для нормализации кислотно-щелочного баланса ЖКТ человека, для лечения язвенной болезни желудка и двенадцатиперстной кишки, гастро-эзофагеального рефлюкса и некоторых других заболеваний.
— В фармакологии входит в состав вакцин для усиления иммунной реакции организма на воздействие введенной инфекции.
— В водоочистке — как адсорбент, помогающий удалять из воды различные загрязнения. Гидроксид активно вступает в реакции с веществами, которые нужно удалить, образуя нерастворимые соединения.
— В химпроме используется как экологичный антипирен для полимеров, силиконов, каучуков, лакокрасочных материалов — чтобы ухудшить их горючесть, способность к возгоранию, подавить выделение дыма и токсичных газов.
— В производстве зубной пасты, минеральных удобрений, бумаги, красителей, криолита.
Гидроксид алюминия — химическое вещество, которое представляет собой соединение оксида алюминия с водой. Может пребывать в жидком и твердом состояниях. Жидкий гидроксид является желеподобным прозрачным веществом, которое очень плохо растворяется в воде. Твердый гидроксид представляет собой кристаллическое вещество белого цвета, которое обладает пассивными химическими свойствами и не реагирует практически ни с одним другим элементом или соединением.
Получение гидроксида алюминия
Получение гидроксида алюминия происходит благодаря химической реакции обмена. Для этого используют водный раствор аммиака и какую-либо соль алюминия, чаще всего хлорид алюминий. Таким образом получают жидкое вещество. Если необходим твердый гидроксид, через растворенную щелочь тетрагидроксодиакваалюмината натрия пропускают диоксид углерода. Многих любителей экспериментов волнует вопрос, как получить гидроксид алюминия в домашних условиях? Для этого достаточно приобрести в специализированном магазине необходимые реагенты и химическую посуду.
Для получения твердого вещества понадобится еще и специально оборудование, так что лучше остановиться на жидком варианте. При проведении реакции необходимо использовать хорошо проветриваемое помещение, так как одним из побочных продуктов может быть газ или вещество с резким запахом, который может негативно сказаться на самочувствии и здоровье человека. Работать стоит в специальных защитных перчатках, так как большинство кислот при попадании на кожу вызывают химические ожоги. Не лишним будет позаботиться и о защите для глаз в виде специальных очков. Приступая к любому делу, в первую очередь необходимо думать об обеспечении безопасности!
Свежесинтезированный гидроксид алюминия реагирует с большинством активных кислот и щелочей. Именно поэтому для его получения используют аммиачную воду, чтобы сохранить образованное вещество в чистом виде. При использовании для получения кислоты или щелочи необходимо максимально точно рассчитать пропорцию элементов, иначе при избытке полученный гидроксид алюминия взаимодействует с остатками непоглощенной основы и полностью растворяется в ней. Это происходит из-за высокого уровня химической активности алюминия и его соединений.
Это происходит из-за высокого уровня химической активности алюминия и его соединений.
В основном, гидроксид алюминия получают из бокситовой руды с высоким содержанием оксида металла. Процедура позволяет быстро и относительно дешево отделить полезные элементы от пустой породы. Реакции гидроксида алюминия с кислотами приводят к восстановлению солей и образованию воды, а с щелочами — к получению комплексных гидрооксоалюминиевых солей. Твердый гидроксид методом сплавки соединяют с твердыми щелочами с образованием метаалюминатов.
Основные свойства вещества
Физические свойства гидроксида алюминия: плотность — 2,423 грамм на сантиметр кубический, уровень растворяемости в воде — низкий, цвет — белый либо прозрачный. Вещество может существовать в четырех полиморфных вариантах. Под воздействием низких температур образуется альфа-гидроксид, называемый байеритом. Под воздействие нагревания можно получить гамма-гидроксид или гиббсит. Оба вещества имеют кристаллическую молекулярную решетку с водородными межмолекулярными типами связи. Также встречаются еще две модификации — бета-гидроксид или нордстандрит и триклинный гибсит. Первая получается путем прокаливания байерита или гиббсита.Второй отличается от остальных видов триклинным, а не монообразным строением кристаллической решетки.
Также встречаются еще две модификации — бета-гидроксид или нордстандрит и триклинный гибсит. Первая получается путем прокаливания байерита или гиббсита.Второй отличается от остальных видов триклинным, а не монообразным строением кристаллической решетки.
Химические свойства гидроксида алюминия: молярная масса — 78 моль, в жидком состоянии хорошо растворяется в активных кислотах и щелочах, при нагревании разлагается, обладает амфотерными признаками. В промышленности в подавляющем большинстве случаев используется именно жидкий гидроксид, так как благодаря высокому уровню химической активности, он легко поддается обработки и не требует использования катализаторов или специальных условий протекания реакции.
Амфотерность гидроксида алюминия проявляется в двойственности его природы. Это означает, что в различных условиях он может проявлять кислотные либо щелочные свойства. Когда гидроксид принимает участие в реакции как щелочь, образуется соль, в которой алюминий является положительно заряженным катионом. Выступая в качестве кислоты, гидроксид алюминия на выходе также образует соль. Но в этом случае металл уже играет роль отрицательно заряженного аниона. Двойственная природа открывает широкие возможности по применению данного химического соединения. Оно используется в медицине для изготовления лекарственных препаратов, назначаемых при нарушении кислотно-щелочного баланса в организме.
Выступая в качестве кислоты, гидроксид алюминия на выходе также образует соль. Но в этом случае металл уже играет роль отрицательно заряженного аниона. Двойственная природа открывает широкие возможности по применению данного химического соединения. Оно используется в медицине для изготовления лекарственных препаратов, назначаемых при нарушении кислотно-щелочного баланса в организме.
Гидроксид алюминия входит в состав вакцин в качестве вещества, усиливающего иммунную реакцию организма на раздражитель. Нерастворимость осадка гидроксида алюминия в воде позволяет использовать вещество в водоочистных целях. Химическое соединение является очень сильным адсорбентом, который позволяет извлекать из состава воды большое количество вредных элементов.
Применение в промышленности
Применение гидроксида в промышленности связано с получением чистого алюминия. Технологический процесс начинается с обработки руды, содержащей оксид алюминия, который по завершению процесса переходит в гидроксид. Выход продукции в данной реакции достаточно высок, так что после завершения остается практически голая порода. Далее проводится операция разложения гидроксида алюминия.
Выход продукции в данной реакции достаточно высок, так что после завершения остается практически голая порода. Далее проводится операция разложения гидроксида алюминия.
Процедура не требует специальных условий, так как вещество хорошо разлагается при нагревании до температуры свыше 180 градусов по Цельсию. Этот этап позволяет выделить оксид алюминия. Это соединение является базовым или вспомогательным материалом для изготовления большого количества промышленных и бытовых изделий. При необходимости получения чистого алюминия используют процесс электролиза с добавлением в раствор криолита натрия. Катализатор забирает из оксида кислород, и чистый алюминий оседает на катоде.
Алюминий — амфотерный металл. Электронная конфигурация атома алюминия 1s 2 2s 2 2p 6 3s 2 3p 1 . Таким образом, на внешнем электронном слое у него находятся три валентных электрона: 2 — на 3s- и 1 — на 3p-подуровне. В связи с таким строением для него характерны реакции, в результате которых атом алюминия теряет три электрона с внешнего уровня и приобретает степень окисления +3. Алюминий является высокоактивным металлом и проявляет очень сильные восстановительные свойства.
Алюминий является высокоактивным металлом и проявляет очень сильные восстановительные свойства.
Взаимодействие алюминия с простыми веществами
с кислородом
При контакте абсолютно чистого алюминия с воздухом атомы алюминия, находящиеся в поверхностном слое, мгновенно взаимодействуют с кислородом воздуха и образуют тончайшую, толщиной в несколько десятков атомарных слоев, прочную оксидную пленку состава Al 2 O 3 , которая защищает алюминий от дальнейшего окисления. Невозможно и окисление крупных образцов алюминия даже при очень высоких температурах. Тем не менее, мелкодисперсный порошок алюминия довольно легко сгорает в пламени горелки:
4Аl + 3О 2 = 2Аl 2 О 3
с галогенами
Алюминий очень энергично реагирует со всеми галогенами. Так, реакция между перемешанными порошками алюминия и йода протекает уже при комнатной температуре после добавления капли воды в качестве катализатора. Уравнение взаимодействия йода с алюминием:
2Al + 3I 2 =2AlI 3
С бромом, представляющим собой тёмно-бурую жидкость, алюминий также реагирует без нагревания. Образец алюминия достаточно просто внести в жидкий бром: тут же начинается бурная реакция с выделением большого количества тепла и света:
Образец алюминия достаточно просто внести в жидкий бром: тут же начинается бурная реакция с выделением большого количества тепла и света:
2Al + 3Br 2 = 2AlBr 3
Реакция между алюминием и хлором протекает при внесении нагретой алюминиевой фольги или мелкодисперсного порошка алюминия в заполненную хлором колбу. Алюминий эффектно сгорает в хлоре в соответствии с уравнением:
2Al + 3Cl 2 = 2AlCl 3
с серой
При нагревании до 150-200 о С или после поджигания смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с выделением света:
— сульфид алюминия
с азотом
При взаимодействии алюминия с азотом при температуре около 800 o C образуется нитрид алюминия:
с углеродом
При температуре около 2000 o C алюминий взаимодействует с углеродом и образует карбид (метанид) алюминия, содержащий углерод в степени окисления -4, как в метане.
Взаимодействие алюминия со сложными веществами
с водой
Как уже было сказано выше, стойкая и прочная оксидная пленка из Al 2 O 3 не дает алюминию окисляться на воздухе. Эта же защитная оксидная пленка делает алюминий инертным и по отношению к воде. При снятии защитной оксидной пленки с поверхности такими методами, как обработка водными растворами щелочи, хлорида аммония или солей ртути (амальгирование), алюминий начинает энергично реагировать с водой с образованием гидроксида алюминия и газообразного водорода:
Эта же защитная оксидная пленка делает алюминий инертным и по отношению к воде. При снятии защитной оксидной пленки с поверхности такими методами, как обработка водными растворами щелочи, хлорида аммония или солей ртути (амальгирование), алюминий начинает энергично реагировать с водой с образованием гидроксида алюминия и газообразного водорода:
с оксидами металлов
После поджигания смеси алюминия с оксидами менее активных металлов (правее алюминия в ряду активности) начинается крайне бурная сильно-экзотермическая реакция. Так, в случае взаимодействия алюминия с оксидом железа (III) развивается температура 2500-3000 о С. В результате этой реакции образуется высокочистое расплавленное железо:
2AI + Fe 2 O 3 = 2Fe + Аl 2 О 3
Данный метод получения металлов из их оксидов путем восстановления алюминием называется алюмотермией или алюминотермией .
с кислотами-неокислителями
Взаимодействие алюминия с кислотами-неокислителями, т.е. практически всеми кислотами, кроме концентрированной серной и азотной кислот, приводит к образованию соли алюминия соответствующей кислоты и газообразного водорода:
а) 2Аl + 3Н 2 SO 4(разб. ) = Аl 2 (SO 4) 3 + 3H 2
) = Аl 2 (SO 4) 3 + 3H 2
2Аl 0 + 6Н + = 2Аl 3+ + 3H 2 0 ;
б) 2AI + 6HCl = 2AICl 3 + 3H 2
с кислотами-окислителями
-концентрированной серной кислотой
Взаимодействие алюминия с концентрированной серной кислотой в обычных условиях, а также низких температурах не происходит вследствие эффекта, называемого пассивацией. При нагревании реакция возможна и приводит к образованию сульфата алюминия, воды и сероводорода, который образуется в результате восстановления серы, входящей в состав серной кислоты:
Такое глубокое восстановление серы со степени окисления +6 (в H 2 SO 4) до степени окисления -2 (в H 2 S) происходит благодаря очень высокой восстановительной способности алюминия.
— концентрированной азотной кислотой
Концентрированная азотная кислота в обычных условиях также пассивирует алюминий, что делает возможным ее хранение в алюминиевых емкостях. Так же, как и в случае с концентрированной серной, взаимодействие алюминия с концентрированной азотной кислотой становится возможным при сильном нагревании, при этом преимущественно протекает реакция:
— разбавленной азотной кислотой
Взаимодействие алюминия с разбавленной по сравнению с концентрированной азотной кислотой приводит к продуктам более глубокого восстановления азота. Вместо NO в зависимости от степени разбавления могут образовываться N 2 O и NH 4 NO 3:
Вместо NO в зависимости от степени разбавления могут образовываться N 2 O и NH 4 NO 3:
8Al + 30HNO 3(разб.) = 8Al(NO 3) 3 +3N 2 O + 15H 2 O
8Al + 30HNO 3(оч. разб) = 8Al(NO 3) 3 + 3NH 4 NO 3 + 9H 2 O
со щелочами
Алюминий реагирует как с водными растворами щелочей:
2Al + 2NaOH + 6H 2 O = 2Na + 3H 2
так и с чистыми щелочами при сплавлении:
В обоих случаях реакция начинается с растворения защитной пленки оксида алюминия:
Аl 2 О 3 + 2NaOH + 3H 2 O = 2Na
Аl 2 О 3 + 2NaOH = 2NaAlO 2 + Н 2 О
В случае водного раствора алюминий, очищенный от защитной оксидной пленки, начинает реагировать с водой по уравнению:
2Al + 6H 2 O = 2Al(OH) 3 + 3H 2
Образующийся гидроксид алюминия, будучи амфотерным, реагирует с водным раствором гидроксида натрия с образованием растворимого тетрагидроксоалюмината натрия:
Al(OH) 3 + NaOH = Na
Алюминий — элемент 13-й (III)группы периодической таблицы химических элементов с атомным номером 13. Обозначается символом Al. Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Обозначается символом Al. Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Оксид алюминия Al2O3 — в природе распространён как глинозём, белый тугоплавкий порошок, по твердости близок к алмазу.
Оксид алюминия – природное соединение, может быть получен из бокситов или при термическом разложении гидроксидов алюминия:
2Al(OH)3 = Al2O3 + 3h3O;
Al2O3 — амфотерный оксид, химически инертен, благодаря своей прочной кристаллической решетке. Он не растворяется в воде, не взаимодействует с растворами кислот и щелочей и может реагировать лишь с расплавленной щелочью.
Около 1000°С интенсивно взаимодействует со щелочами и карбонатами щелочных металлов с образованием алюминатов:
Al2O3 + 2KOH = 2KAlO2 + h3O; Al2O3 + Na2CO3 = 2NaAlO2 + CO2.
Другие формы Al2O3 более активны, могут реагировать с растворами кислот и щелочей, α-Al2O3 взаимодействует лишь с горячими концентрированными растворами:Al2O3 + 6HCl = 2AlCl3 + 3h3O;
Амфотерные свойства оксида алюминия проявляются при взаимодействии с кислотными и основными оксидами с образованием солей:
Al2O3 + 3SO3 = Al2(SO4)3 (основные свойства),Al2O3 + Na2O = 2NaAlO2 (кислотные свойства).
Гидрокси́д алюми́ния, Al(OH)3 — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами. Получают при взаимодействии солей алюминия с водными растворами щёлочи: AlCl3+3NaOH=Al(OH)3+3NaCl
Гидроксид алюминия – типичное амфотерное соединение, свежеполученный гидроксид растворяется в кислотах и щелочах:
2Al(OH)3 + 6HCl = 2AlCl3 + 6h3O. Al(OH)3 + NaOH + 2h3O = Na.
При нагревании разлагается, процесс дегидратации довольно сложен и схематично может быть представлен следующим образом:
Al(OH)3 = AlOOH + h3O. 2AlOOH = Al2O3 + h3O.
Алюминаты — соли, образующиеся при действии щёлочи на свежеосаждённый гидроксид алюминия:Al(ОН)3 + NaOH = Na (тетрагидроксоалюминат натрия)
Алюминаты получают также при растворении металлического алюминия (или Al2O3) в щелочах:2Al + 2NaOH + 6Н2О = 2Na + ЗН2
Гидроксоалюминаты образуются при взаимодействии Al(OH)3 с избытком щелочи: Al(OH)3 + NaOH (изб) = Na
Соли алюминия. Из гидроксида алюминия можно получить практически все соли алюминия. Почти все соли алюминия хорошо растворимы в воде; плохо растворяется в воде фосфат алюминия.
Из гидроксида алюминия можно получить практически все соли алюминия. Почти все соли алюминия хорошо растворимы в воде; плохо растворяется в воде фосфат алюминия.
В растворе соли алюминия показывают кислую реакцию. Примером может служить обратимое воздействие с водой хлорида алюминия:
AlCl3+3Н2O«Аl(ОН)3+3НСl
Практическое значение имеют многие соли алюминия. Так, например, безводный хлорид алюминия АlСl3 используется в химической практике в качестве катализатора при переработке нефти
Сульфат алюминия Al2(SO4)3 18Н2O применяется как коагулянт при очистке водопроводной воды, а также в производстве бумаги.
Широко используются двойные соли алюминия — квасцы KAl(SO4)2 12h3O, NaAl(SO4)2 12h3O, Nh5Al(SO4)2 12h3O и др. — обладают сильными вяжущими свойствами и применяются при дублении кожи, а также в медицинской практике как кровоостанавливающее средство.
Применение — Благодаря комплексу свойств широко распространён в тепловом оборудовании.- Алюминий и его сплавы сохраняют прочность при сверхнизких температурах. Благодаря этому он широко используется в криогенной технике.- алюминий — идеальный материал для изготовления зеркал.- В производстве строительных материалов как газообразующий агент.- Алитированием придают коррозионную и окалиностойкость стальным и другим сплавам, — Сульфид алюминия используется для производства сероводорода.- Идут исследования по разработке пенистого алюминия как особо прочного и лёгкого материала.
Благодаря этому он широко используется в криогенной технике.- алюминий — идеальный материал для изготовления зеркал.- В производстве строительных материалов как газообразующий агент.- Алитированием придают коррозионную и окалиностойкость стальным и другим сплавам, — Сульфид алюминия используется для производства сероводорода.- Идут исследования по разработке пенистого алюминия как особо прочного и лёгкого материала.
В качестве восстановителя — Как компонент термита, смесей для алюмотермии- В пиротехнике.- Алюминий применяют для восстановления редких металлов из их оксидов или галогенидов. (Алюминотермия)
Алюминотермия. — способ получения металлов, неметаллов (а также сплавов) восстановлением их оксидов металлическим алюминием.
Aluminum hydroxide
Chemical substances
support
Aluminum hydroxide, physical and chemical properties.

Share the information:
Al(OH)3
General information
Physical properties
Crystal lattice
Security
Additional information
General information:
| 100 | General information | |
| 101 | Name | Hydroxide aluminum |
| 102 | Other names | Bayerite (α-form of hydroxide aluminum), Gibbsit (γ-form hydroxide aluminum), Hydrargillite (c’ -aluminum hydroxide form) |
| 103 | Latin name | |
| 104 | English name | Aluminium(3+) trioxidanide, Aluminic acid, Aluminic hydroxide, Aluminium(III) hydroxide, Aluminium hydroxide, Aluminum trihydroxide, Hydrated alumina, Orthoaluminic acid |
| 105 | Chemical formula | Al(OH)3 |
| 106 | Type | Inorganic substance |
| 107 | Group | Amphoteric base |
| 108 | Was discovered | |
| 109 | Date of discovery | |
| 110 | Appearance And others. | White amorphous powder or white crystals. Without smell. Non-flammable |
| 111 | Origin | Occurs naturally as bayerite minerals, gibbsit, hydrargillite, nordstrandit |
| 112 | Modifications | Known 4 crystal modifications:
and also amorphous aluminum hydroxide of variable composition Al2O3·nH2O |
| 113 | Allotropic modifications | |
| 114 | Temperature and other conditions for the transition of allotropic modifications into each other | |
| 115 | Bose-Einstein condensate | |
| 116 | 2D materials | |
| 117 | Content in the atmosphere and air (by mass) | 0 % |
| 118 | Content in the earth’s crust (by mass) | |
| 119 | Content in the seas and oceans (by mass) | |
| 120 | Content in the universe and space (by mass) | |
| 121 | Content in the Sun (by mass) | |
| 122 | Content in meteorites (by mass) | |
| 123 | Content in the human body (by mass) | |
| 124 | Molar mass | 78,004 g/mol |
Physical properties:
| 200 | Physical properties | |
| 201 | Density | 2,42 g/cm3 (at 20/25 ° C and normal conditions, state of the substance — solid) |
| 202 | Melting point | 300 °C (573 K; 572 °F) |
| 203 | Boiling point | |
| 204 | Sublimation point | |
| 205 | Decomposition temperature | 150-200 °C, > 575 °C |
| 206 | Self-ignition temperature of the gas-air mixture | |
| 207 | Molar heat of fusion (enthalpy of fusion ΔHfus) | |
| 208 | Molar heat of vaporization (enthalpy of vaporization ΔHvap) | |
| 209 | Specific heat capacity at constant pressure | |
| 210 | Molar heat capacity | |
| 211 | Molar volume | |
| 212 | Thermal conductivity | |
| 213 | Coefficient of thermal expansion | |
| 214 | Coefficient of thermal diffusivity | |
| 215 | Critical temperature | |
| 216 | Critical pressure | |
| 217 | Critical density | |
| 218 | Triple point | |
| 219 | Solubility in water and other liquids | Water: almost does not dissolve |
| 220 | Vapor pressure (mm Hg) | |
| 221 | Vapor pressure (Pa) | |
| 222 | Standard enthalpy (heat) of formation ΔfH° | -1277 kJ/mol (at 298 K, for the state of matter — solid) |
| 223 | Gibbs free energy (or Gibbs energy) ΔG | |
| 224 | Standard molar entropy S° | |
| 225 | Standard molar heat capacity Cp | |
| 226 | Enthalpy (heat) of dissociation (enthalpy of solution) ΔHdiss | |
| 227 | Absolute permittivity (permittivity) | |
| 228 | Magnetic type | |
| 229 | Curie temperature (Curie point) | |
| 230 | Neel temperature | |
| 231 | Volume magnetic susceptibility | |
| 232 | Mass magnetic susceptibility | |
| 233 | Molar magnetic susceptibility | |
| 234 | Electric type | |
| 235 | Electrical conductance in a solid | |
| 236 | Specific electrical resistance (electrical resistivity) | |
| 237 | Superconductivity at temperature | |
| 238 | Critical field of destruction of superconductivity | |
| 239 | Band gap | |
| 240 | Charge carrier density | |
| 241 | Mohs hardness | |
| 242 | Brinell hardness | |
| 243 | Vickers hardness | |
| 244 | Speed of sound | |
| 245 | Surface tension | |
| 246 | Dynamic viscosity of gases and liquids | |
| 246 | Explosive concentrations of a gas-air mixture, % of volume | |
| 247 | Explosive concentrations of a gas-oxygen mixture, % of volume | |
| 248 | Ultimate tensile strength | |
| 249 | Flow stress | |
| 250 | Elongation limit | |
| 251 | Young’s modulus | |
| 252 | Shear modulus | |
| 253 | Bulk modulus of elasticity | |
| 254 | Poisson’s ratio | |
| 255 | Refractive index |
Crystal lattice:
| 300 | Crystal lattice | |
| 311 | Crystal lattice #1 | α-form (Bayerite) |
| 312 | Lattice structure | Primitive monoclinic |
| 313 | Lattice parameters | |
| 314 | Attitude c/a | |
| 315 | Debye temperature | |
| 316 | Symmetry space group name | |
| 317 | Symmetry space group number | |
| 321 | Crystal lattice #1 | γ-form (gibbsit) |
| 322 | Lattice structure | Hexagonal |
| 323 | Lattice parameters | |
| 324 | Attitude c/a | |
| 325 | Debye temperature | |
| 326 | Symmetry space group name | |
| 327 | Symmetry space group number |
Security:
Additional information:
| 900 | Additional information | |
| 901 | CAS number | 21645-51-2 |
Note:
Sources:
- https://en.
 wikipedia.org/wiki/Aluminium_hydroxide
wikipedia.org/wiki/Aluminium_hydroxide - https://de.wikipedia.org/wiki/Aluminiumhydroxid
- https://ru.wikipedia.org/wiki/Гидроксид_алюминия
[know]
Demand coefficient 859
Химические свойства алюминия и основные реакции
Нахождение в природе
Алюминий впервые получен химическим путем немецким химиком Ф. Велером в 1827 г., а в 1856 г. французский химик Сен-Клер Девиль выделил его электрохимическим методом.
Алюминий является самым распространенным в природе металлом. Содержание его в земной коре составляет 7,45% (по массе). Важнейшие природные соединения алюминия — алюмосиликаты, боксит, корунд и криолит.
Алюмосиликаты составляют основную массу земной коры. Продукт их выветривания — глина и полевые шпаты (ортоклаз, альбит, анортит). Основной состав глин (каолин) соответствует формуле Аl2O3•2SiO2•2Н2O.
Боксит — горная порода, из которой получают алюминий. Состоит главным образом из гидратов оксида алюминия Аl2O3•nН2O.
Состоит главным образом из гидратов оксида алюминия Аl2O3•nН2O.
Физические свойства
Физические свойства алюминия хорошо изучены. Это — серебристо-белый легкий металл, плавящийся при 660°С. Он очень пластичен, легко вытягивается в проволоку и раскатывается в листы. Из алюминия можно изготовить фольгу толщиной менее 0,01мм. Алюминий обладает очень большой тепло- и электропроводностью. Сплавы алюминия с различными металлами обладают большой прочностью и легкостью.
Химические свойства
Алюминий очень активный металл. В ряду напряжений он стоит после щелочных и щелочноземельных металлов. Однако на воздухе он довольно устойчив, так как его поверхность покрывается очень плотной пленкой оксида, предохраняющей его от дальнейшего контакта с воздухом. Если с алюминиевой проволоки снять защитную оксидную пленку, то алюминий начнет энергично взаимодействовать с кислородом и водяными парами воздуха, превращаясь в рыхлую массу гидроксида алюминия. Эта реакция сопровождается выделением тепла. Очищенный от защитной оксидной пленки алюминий взаимодействует с водой с выделением водорода:
Эта реакция сопровождается выделением тепла. Очищенный от защитной оксидной пленки алюминий взаимодействует с водой с выделением водорода:
2Аl + 6Н2O = 2Аl(OН)3 + 3H2↑
Алюминий хорошо растворим в разбавленных серной и соляной кислотах:
2Al + 6НС1= 2AlС13 + 3H2↑
2AI + 3H2SO4 = Al2(SO4)3 + 3H2↑
Разбавленная азотная кислота на холоду пассивирует алюминий, но при нагревании алюминий растворяется в ней с выделением монооксида азота, гемиоксида азота, свободного азота или аммиака, например:
8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15Н2O
Концентрированная азотная кислота пассивирует алюминий.
Так как оксид и гидроксид алюминия обладают амфотерными свойствами, то алюминий легко растворяется в водных растворах всех щелочей, кроме гидроксида аммония:
2AI + 6NaOH + 6Н2O = 2Na3[A1ОН)6] + 3H2↑
Порошкообразный алюминий легко взаимодействует с галогенами, кислородом и всеми неметаллами. Для начала реакций необходимо нагревание. В дальнейшем реакции протекают очень интенсивно и сопровождаются выделением большого количества тепла:
Для начала реакций необходимо нагревание. В дальнейшем реакции протекают очень интенсивно и сопровождаются выделением большого количества тепла:
2Al + 3Вr2 — 2AlBr3 (бромид алюминия)
4Al + 3O2 = 2Al2O3 (оксид алюминия)
2Al + 3S = A12S3 (сульфид алюминия)
2Al + N2 = 2A1N (нитрид алюминия)
4Al + ЗС = Al4С3 (карбид алюминия).
Сульфид алюминия может существовать только в твердом виде. В водных растворах он подвергается полному гидролизу с образованием гидроксида алюминия и сероводорода:
A12S3 + 6H2O = 2A1(OН)3 + 3H2S.
Алюминий легко отнимает кислород и галогены у оксидов и солей других металлов. Реакция сопровождается выделением большого количества тепла:
8Al + 3Fe3O4 = 9Fe + 4Al2O3
Процесс восстановления металлов из их оксидов алюминием называется алюмотермией. Алюмотермией пользуются при получении некоторых редких металлов, которые образуют прочную связь с кислородом (ниобий, тантал, молибден, вольфрам и др.).
Алюмотермией пользуются при получении некоторых редких металлов, которые образуют прочную связь с кислородом (ниобий, тантал, молибден, вольфрам и др.).
Смесь мелкого порошка алюминия и магнитного железняка называется термитом. После поджигания термита с помощью специального запала реакция протекает самопроизвольно и температура смеси повышается до 3500°С. Железо при такой температуре находится в расплавленном состоянии. Эту реакцию используют для сваривания рельсов.
Получение
Впервые алюминий был получен восстановлением хлорида алюминия металлическим натрием:
AlС13 + 3Na = Al + 3NaCl
В настоящее время его получают электролизом расплавленных солей. В качестве электролита служит расплав, содержащий 85— 90% комплексной соли 3NaF • A1F3 (или Na3AlFe) — криолита и 10–15% оксида алюминия Al2O3 — глинозема. Такая смесь плавится при температуре около 1000°С. При растворении в расплавленном криолите глинозем ведет себя как соль алюминия и алюминиевой кислоты и диссоциирует на катионы алюминия и анионы кислотного остатка алюминиевой кислоты:
Al2O3 ⇔ Al3+ + АlO33−
Криолит диссоциирует:
Na3 [AlF6]⇔ 3Na+ + [A1F6]
При пропускании электрического тока катионы алюминия и натрия движутся к катоду — графитовому корпусу ванны, покрытому на дне слоем расплавленного алюминия, получаемого в процессе электролиза. Так как алюминий менее активен, чем натрий, то он восстанавливается в первую очередь. Восстановленный алюминий в расплавленном состоянии собирается на дне ванны, откуда его периодически выводят.
Так как алюминий менее активен, чем натрий, то он восстанавливается в первую очередь. Восстановленный алюминий в расплавленном состоянии собирается на дне ванны, откуда его периодически выводят.
Анионы AlO33− и A1F63− движутся к аноду — графитовым стержням или болванкам. На аноде в первую очередь разряжается анион AlO33−:
AlO33− — 12е = 2Al2O3 + 3O2
Оксид алюминия вновь диссоциирует, и процесс повторяется. Расход глинозема все время восполняется. Количество криолита практически не меняется. Незначительные потери криолита происходят вследствие образования на аноде тетрафторида углерода CF4 . Электролитическое производство алюминия требует больших затрат электроэнергии (на получение 1 т алюминия расходуется около 20 тыс. квт • ч электроэнергии), поэтому алюминиевые заводы строят вблизи электростанций.
Применение
Алюминий находит самое широкое применение.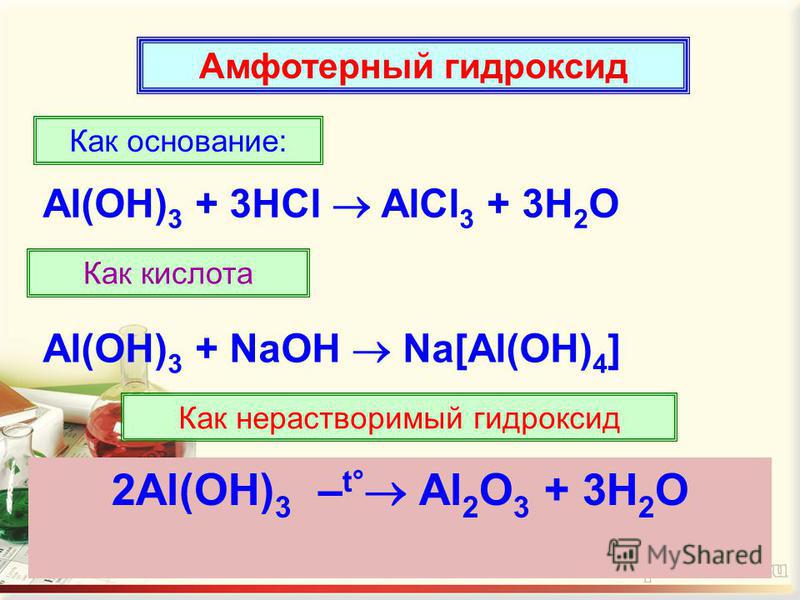 Он используется в электротехнике, его сплавы, отличаясь большой легкостью и прочностью, применяются в самолето- и машиностроении, он все больше вытесняет стали в производстве теплообменных аппаратов, из него изготовляют фольгу, применяемую в радиотехнике и для упаковки пищевых продуктов. Алюминием покрывают стальные и чугунные изделия в целях предохранения их от коррозии: изделия нагревают до 1000° С в смеси алюминиевого порошка (49%), оксида алюминия (49%) и хлорида аммония (2%). Этот процесс называется алитированием. Алитированные изделия выдерживают нагревание°С, не подвергаясь коррозии.
Он используется в электротехнике, его сплавы, отличаясь большой легкостью и прочностью, применяются в самолето- и машиностроении, он все больше вытесняет стали в производстве теплообменных аппаратов, из него изготовляют фольгу, применяемую в радиотехнике и для упаковки пищевых продуктов. Алюминием покрывают стальные и чугунные изделия в целях предохранения их от коррозии: изделия нагревают до 1000° С в смеси алюминиевого порошка (49%), оксида алюминия (49%) и хлорида аммония (2%). Этот процесс называется алитированием. Алитированные изделия выдерживают нагревание°С, не подвергаясь коррозии.
Оксид алюминия Al
2O3 Представляет собой белое вещество, обладающее высокой температурой плавления (2050°С). В природе оксид алюминия встречается в виде корунда и глинозема. Иногда встречаются прозрачные кристаллы корунда красивой формы и окраски. Корунд, окрашенный соединениями хрома в красный цвет, называют рубином, а окрашенный соединениями титана и железа в синий цвет — сапфиром. Рубин и сапфир являются драгоценными
Рубин и сапфир являются драгоценными
камнями. В настоящее время их довольно легко получают искусственно.
Оксид алюминия обладает амфотерными свойствами, но он не растворяется в воде, кислотах и щелочах. При кипячении оксида алюминия в концентрированном растворе щелочи он частично переходит в раствор. Оксид алюминия переводят в растворимое состояние сплавлением со щелочами или с пиросульфатом калия:
Al2O3 + 2NaOH = 2NaA1O2 + Н2O
Al2O3 + 3K2S2O7 = Al2(SO4)3 + 3K2SO4.
Полученные сплавы растворяются в воде. При сплавлении оксида алюминия с поташом или содой образуются алюминаты, которые легко растворяются в воде:
Al2O3 + Na2CO3 = 2NaA1O2 + CO2,
Природный корунд — очень твердое вещество. Он применяется для изготовления наждачных кругов и шлифовальных порошков. Рубин используют для изготовления втулок часовых и других точных механизмов.
Рубин используют для изготовления втулок часовых и других точных механизмов.
Глинозем используется как сырье для получения алюминия. Обезвоженный оксид алюминия применяется как адсорбент при очистке и разделении органических веществ методом хроматографии.
Гидроксид алюминия Al (ОН)
3Представляет собой белое вещество, которое при нагревании теряет воду, превращаясь оксид алюминия. Гидроксид алюминия обладает амфотерными свойствами. Свежеосажденный гидроксид легко растворяется в кислотах и щелочах (кроме гидроксида аммония):
Al(ОН)3 + ЗНС1 = AlС13 + ЗН2O
Al(ОН)3 + 3NaOH= Na3 [Al(OH)6].
Гидроксид алюминия является слабым основанием и еще более слабой кислотой, поэтому соли алюминия находятся в растворе только в присутствии избытка кислоты, а алюминаты — только в присутствии избытка щелочи. При разбавлении растворов водой эти соединения сильно гидролизуют.
Высушенный гидроксид алюминия теряет часть воды, не растворяется ни в кислотах, ни в щелочах и этим напоминает оксид алюминия.
Гидроксид алюминия обладает свойством поглощать различные вещества, поэтому его применяют при очистке воды.
Оксид алюминия, свойства, получение, химические реакции. Алюминий. Соединения алюминия. Амфотерный характер свойств оксида алюминия и гидроксида алюминия Алюминиевый оксид
Оксид алюминия – Al2O3. Физические свойства: оксид алюминия – белый аморфный порошок или очень твердые белые кристаллы. Молекулярная масса = 101,96, плотность – 3,97 г/см3, температура плавления – 2053 °C, температура кипения – 3000 °C.
Химические свойства: оксид алюминия проявляет амфотерные свойства – свойства кислотных оксидов и основных оксидов и реагирует и с кислотами, и с основаниями. Кристаллический Аl2О3 химически пассивен, аморфный – более активен. Взаимодействие с растворами кислот дает средние соли алюминия, а с растворами оснований – комплексные соли – гидроксоалюминаты металлов:
При сплавлении оксида алюминия с твердыми щелочами металлов образуются двойные соли – метаалюминаты (безводные алюминаты):
Оксид
алюминия не взаимодействует с водой и
не растворяется в ней.
Получение: оксид алюминия получают методом восстановления алюминием металлов из их оксидов: хрома, молибдена, вольфрама, ванадия и др. – металлотермия , открытый Бекетовым :
Применение: оксид алюминия применяется для производства алюминия, в виде порошка – для огнеупорных, химически стойких и аб-разивных материалов, в виде кристаллов – для изготовления лазеров и синтетических драгоценных камней (рубины, сапфиры и др.), окрашенных примесями оксидов других металлов – Сr2О3 (красный цвет), Тi2О3 и Fe2О3 (голубой цвет).
Гидроксид алюминия – А1(ОН)3 . Физические свойства: гидроксид алюминия – белый аморфный (гелеобразный) или кристаллический. Почти не растворим в воде; молекулярная масса – 78,00, плотность – 3,97 г/см3.
Химические свойства: типичный амфотерный гидроксид реагирует:
1) с кислотами, образуя средние соли: Al(ОН)3 + 3НNO3 = Al(NO3)3 + 3Н2О;
2)
с растворами щелочей, образуя комплексные
соли – гидроксоалюминаты: Al(ОН)3 + КОН +
2Н2О = К.
При сплавлении Al(ОН)3 с сухими щелочами образуются метаалюминаты: Al(ОН)3 + КОН = КAlO2 + 2Н2О.
Получение:
1) из солей алюминия под действием раствора щелочей: AlСl3 + 3NaOH = Al(ОН)3 + 3Н2О;
2) разложением нитрида алюминия водой: AlN + 3Н2О = Аl(ОН)3 + NН3?;
3) пропусканием СО2 через раствор гидроксокомплекса: [Аl(ОН)4]-+ СО2 = Аl(ОН)3 + НСО3-;
4) действием на соли Аl гидратом аммиака; при комнатной температуре образуется Аl(ОН)3.
Элементы подгруппы
хрома занимают
промежуточное положение в ряду переходных
металлов. Имеют высокие температуры
плавления и кипения, свободные места
на электронных орбиталях. Элементы хром и молибден обладают
нетипичной электронной структурой –
на внешней s-орбитали имеют один электрон
(как у Nb из подгруппы VB). У этих элементов
на внешних d– и s-орбиталях находится 6
электронов, поэтому все орбитали
заполнены наполовину, т. е. на каждой
находится по одному электрону. Имея
подобную электронную конфигурацию,
элемент обладает особенной стабильностью
и устойчивостью к окислению. Вольфрам имеет
более сильную металлическая связь,
нежели молибден .
Степень окисления у элементов подгруппы
хрома сильно варьирует. В надлежащих
условиях все элементы проявляют
положительную степень окисления от 2
до 6, максимальная степень окисления
соответствует номеру группы. Не все
степени окисления у элементов стабильны,
у хрома самая стабильная – +3.
Вольфрам имеет
более сильную металлическая связь,
нежели молибден .
Степень окисления у элементов подгруппы
хрома сильно варьирует. В надлежащих
условиях все элементы проявляют
положительную степень окисления от 2
до 6, максимальная степень окисления
соответствует номеру группы. Не все
степени окисления у элементов стабильны,
у хрома самая стабильная – +3.
Все элементы образуют оксид MVIO3, известны также оксиды с низшими степенями окисления. Все элементы данной подгруппы амфотерны – образуют комплексные соединения и кислоты.
Хром, молибден и вольфрам востребованы в металлургии и электротехнике. Все рассматриваемые металлы покрываются пассивирующей оксидной пленкой при хранении на воздухе или в среде кислоты-окислителя. Удалив пленку химическим или механическим способом, можно повысить химическую активность металлов.
Хром. Элемент получают из хромитной руды Fe(CrO2)2, восстанавливая углем: Fe(CrO2)2 + 4C = (Fe + 2Cr) + 4CO?.
Чистый
хром получают восстановлением Cr2O3 с
помощью алюминия или электролиза
раствора, содержащего ионы хрома. Выделяя
хром с помощью электролиза, можно
получить хромовое покрытие, используемое
в качестве декоративных и защитных
пленок.
Выделяя
хром с помощью электролиза, можно
получить хромовое покрытие, используемое
в качестве декоративных и защитных
пленок.
Из хрома получают феррохром, применяемый при производстве стали.
Молибден. Получают из сульфидной руды. Его соединения используют при производстве стали. Сам металл получают при восстановлении его оксида. Прокаливая оксид молибдена с железом, можно получить ферромолибден. Используют для изготовления нитей и трубок для обмотки печей и электроконтактов. Сталь с добавлением молибдена используют в автомобильном производстве.
Вольфрам. Получают из оксида, добываемого из обогащенной руды. В качестве восстановителя используют алюминий или водород. Получившийся вольфрам в идее порошка впоследствии формуют при высоком давлении и термической обработке (порошковая металлургия). В таком виде вольфрам используют для изготовления нитей накаливания, добавляют к стали.
Как правило, в качестве сырья для получения оксида алюминия служат бокситы, алуниты, а также нефелины. При содержании в них оксида алюминия более 6−7% производство ведется основным способом — методом Байера, а при меньшем содержании вещества используют метод спекания руды с известью или содой.
При содержании в них оксида алюминия более 6−7% производство ведется основным способом — методом Байера, а при меньшем содержании вещества используют метод спекания руды с известью или содой.
Метод Байера — это гидрохимический способ получения глинозема из бокситов. Он представляет собой обработку измельченной породы в шаровых мельницах, затем бокситы обрабатывают щелочными растворами при температуре 225−250°С. Полученный таким образом состав алюмината натрия разбавляют водным раствором и фильтруют.
В процессе фильтрации шлам, содержащий оксид алюминия, свойства которого соответствуют стандартным, подвергают разложению на центрифугах. Выделяется около ½ образовавшегося при этом Аl (ОН) 3 . Его отфильтровывают и прокаливают во вращающихся печах или в кипящем слое при температуре ~ 1200 °C. В результате получается глинозем, содержащий 15−60% α-Аl 2 О 3 . Применение данного метода позволяет сохранить маточный раствор для использования в последующих операциях по выщелачиванию бокситов.
Метод спекания руды с известью или содой работает следующим образом: высококремнистую измельченную руду (нефелин и др.) смешивают с содой и известняком и спекают во вращающихся печах при 1250−1300 °С. Полученную массу выщелачивают водным щелочным раствором. Раствор алюмината Na отделяют от шлама, затем освобождают от SiO 2 , осаждая его в автоклаве при давлении около 0,6 Мпа, а затем известью при атмосферном давлении и разлагают алюминат газообразным СО 2 . Полученный Аl (ОН) 3 отделяют от раствора и прокаливают при температуре около 1200 °C. При переработке нефелина, помимо глинозема, получают Na 2 CO 3 , K 2 CO 3 и цемент.
При производстве глинозема из алунитов одновременно получают H 2 SO 4 и K 2 SO 4 . Алунитовую руду обжигают при 500−580°С в восстановительной атмосфере и обрабатывают раствором NaOH по способу Байера.
Для производства высокопрочной корундовой керамики применяют порошок оксида алюминия, полученный термическим разложением некоторых солей алюминия, например, азотнокислого, алюмоаммиачных квасцов различной степени чистоты. Оксид алюминия, полученный при разложении солей, является высокодисперсным порошком γ-Al 2 O 3 (при прокаливании до 1200°С) и обладает большой химической активностью.
Оксид алюминия, полученный при разложении солей, является высокодисперсным порошком γ-Al 2 O 3 (при прокаливании до 1200°С) и обладает большой химической активностью.
Для получения ультра- и нанодисперсных порошков Аl 2 O 3 , которые используются в технологии конструкционной и инструментальной керамики, широкое распространение получил способ совместного осаждения гидроксидов (СОГ) и плазмохимического синтеза (ПХС).
Сущность метода СОГ заключается в растворении солей алюминия, например, AlCl 3 в растворе аммиака и последующем выпадении образующихся гидратов в осадок. Процесс ведут при низких температурах и больших сроках выдержки. Полученные гидроксиды сушат и прокаливают, в результате образуется порошок Аl 2 O 3 с размером частиц 10−100 нм.
В технологии ПХС водный раствор Al (NO 3) 3 подается в сопло плазмотрона. В каплях раствора возникают чрезвычайно высокие температурные градиенты, происходит очень быстрый процесс синтеза и кристаллизации Аl 2 O 3 . Частицы порошка имеют сферическую форму и размер 0,1−1 мкм.
В виде самого обычного глинозема, его химическая формула — AL2O3. На вид это кристаллы, не имеющие цвета, которые при температуре в 2044°С начинают плавиться, а при достижении отметки в 3530 °С закипают.
В природном окружении единственной устойчивой модификацией вещества является корунд, имеющий плотность 3,99 г/см3. Это очень твердый образец, принадлежащий к девятому уровню по таблице Мооса. Величина коэффициента преломления составляет: для обыкновенного луча — 1,765, и 1,759 для необыкновенного. В природном окружении оксид алюминия часто содержит в себе различные оксиды металлов, поэтому, минерал корунда может приобретать различные оттенки своей окраски. Например, таковыми являются сапфиры, рубины и другие драгоценные камни. В таком виде оксид алюминия может быть получен и лабораторно-химическим способом. Для этого используют метастабильные формы А12О3 и разлагают их термическим способом. Также в качестве источника получения алюминия оксида лабораторным методом используют
Стандартная модификация соединения представляет собой тетрагоническую кристаллическую решетку, содержащую в своем составе примерно 1-2% воды. Можно получить и аморфный по своей структуре оксид алюминия — алюмогель, для чего гелевидный раствор AL(OH) 3 обезвоживают и получают вещество в виде пористой прозрачной массы.
Можно получить и аморфный по своей структуре оксид алюминия — алюмогель, для чего гелевидный раствор AL(OH) 3 обезвоживают и получают вещество в виде пористой прозрачной массы.
Алюминия оксид совершенно нерастворим в воде, но может хорошо растворяться в криолите, разогретом до высокой температуры. Вещество амфотерно. Характерно такое свойство синтезированного алюминия оксида, как обратная зависимость температуры его образования и химической активности. Как искусственный (то есть полученный при температуре более 1200°С), так и природный корунд в обычной среде проявляют практически стопроцентную химическую инертность и полное отсутствие гигроскопичности.
Оксид начинает активно проявлять при температурах около 1000°С, когда он начинает интенсивно взаимодействовать с такими веществами, как различные щелочи, карбонаты При этом взаимодействии образуются алюминаты. Более медленно соединение вступает в реакции с SiO2 , а также различного рода шлаками кислыми. В результате этих взаимодействий получаются алюмосиликаты.
Алюмогели и оксид алюминия, которые получены путем обжига любого из гидроксидов алюминия при температуре не менее 550°С, обладают очень высокой гигроскопичностью, отлично вступают в и активно взаимодействуют с кислотными и щелочными растворами.
Как правило, в качестве сырья для получения алюминия оксида служат бокситы, алуниты, а также нефелины. При содержании в них рассматриваемого вещества более 6-7% производство ведется основным способом — методом Байера, а при меньшем содержании вещества используют метод спекания руды с известью или содой. Метод Байера представляет собой обработку измельченной породы в затем бокситы обрабатывают щелочными растворами при температуре 225-250°С. Полученный таким образом состав алюмината натрия разбавляют водным раствором и фильтруют. В процессе фильтрации шлам, содержащий оксид алюминия, свойства которого соответствуют стандартным, подвергают разложению на центрифугах. Такая технология дает возможность получать 50%-ный выход вещества. Кроме того, применение данного метода позволяет сохранить для использования в последующий операциях по выщелачиванию бокситов.
Как правило, полученный синтетическим методом алюминия оксид используют в качестве промежуточного материала для получения чистого алюминия. В промышленности он применяется в качестве сырья для изготовления огнеупорных материалов, абразивных и керамических режущих инструментов. Современные технологии активно применяют монокристаллы оксида алюминия в производстве часов, ювелирных изделий.
Электронная конфигурация внешнего уровня алюминия … 3s 2 3p 1 .
В возбужденном состоянии один из s-электронов переходит на свободную ячейку p-подуровня, такое состояние отвечает валентности III и степени окисления +3.
Во внешнем электронном слое атома алюминия существуют свободные d-подуровни. Благодаря этому его координационное число в соединениях может равняться не только 4 ([А1(ОН) 4 ] -), но и 6 – ([А1(ОН) 6 ] 3-).
Нахождение в природе
Самый распространенный в земной коре металл, общее содержание алюминия в земной коре составляет 8, 8%.
В свободном виде в природе не встречается.
Важнейшие природные соединения – алюмосиликаты:
белая глина Al 2 O 3 ∙ 2SiO 2 ∙ 2H 2 O, полевой шпат K 2 O ∙ Al 2 O 3 ∙ 6SiO 2 , слюда K 2 O ∙ Al 2 O 3 ∙ 6SiO 2 ∙ H 2 O
Из других природных форм нахождения алюминия наибольшее значение имеют бокситы А1 2 Оз ∙ nН 2 О, минералы корунд А1 2 Оз и криолит А1Fз ∙3NaF.
Получение
В настоящее время в промышленности алюминий получают электролизом оксида алюминия А1 2 О 3 в расплаве криолита.
Процесс электролиза сводится в конечном итоге к разложению А1 2 Оз электрическим током
2А1 2 Оз = 4А1 + 3О 2 (950 0 C, А1Fз ∙3NaF,эл.ток)
На катоде выделяется жидкий алюминий:
А1 3+ + 3е- = Al 0
На аноде выделяется кислород.
Физические свойства
Легкий, серебристо-белый, пластичный металл, хорошо проводит электрический ток и тепло.
На воздухе алюминий покрывается тончайшей (0,00001 мм), но очень плотной пленкой оксида, предохраняющей металл от дальнейшего окисления и придающей ему матовый вид.
Алюминий легко вытягивается в проволоку и прокатывается в тонкие листы. Алюминиевая фольга (толщиной 0,005 мм) применяется в пищевой и фармацевтической промышленности для упаковки продуктов и препаратов.
Химические свойства
Алюминий является весьма активным металлом, немного уступающим по активности элементам начала периода – натрию и магнию.
1. алюминий легко соединяется с кислородом при комнатной температуре, при этом на поверхности алюминия образуется оксидная пленка (слой А1 2 О 3). Эта пленка очень тонкая (≈ 10 -5 мм), но прочная. Она защищает алюминий от дальнейшего окисления и поэтому называется защитной пленкой
4Al + 3O 2 = 2Al 2 O 3
2. при взаимодействии с галогенами образуются галогениды:
с хлором и бромом взаимодействие происходит уже при обычной температуре, с йодом и серой — при нагревании.
2Al + 3Cl 2 = 2AlCl 3
2Al + 3S= Al 2 S 3
3. при очень высоких температурах алюминий непосредственно соединяется также с азотом и углеродом.
2Al + N 2 = 2AlN нитрид алюминия
4Al + 3С = Al 4 С 3 карбид алюминия
C водородом алюминий не взаимодействует.
4. по отношению к воде алюминий вполне устойчив. Но если механическим путем или амальгамированием снять предохраняющее действие оксидной пленки, то происходит энергичная реакция:
2Al + 6Н 2 О = 2Al(ОН) 3 + 3H 2
5. взаимодействие алюминия с кислотами
С разб. кислотами (HCl, H 2 SO 4) алюминий взаимодействует с образованием водорода.
2Al + 6HCl = 2AlCl 3 + 3H 2
На холоду алюминий не взаимодействует с концентрированными серной и азотной кислотой.
Взаимодействует с конц. серной кислотой при нагревании
8Al + 15H 2 SO 4 = 4Al 2 (SO 4) 3 + 3H 2 S + 12H 2 O
С разбавленной азотной кислотой алюминий реагирует с образованием NO
Al + 4HNO 3 = Al(NO 3) 3 + NO +2H 2 O
6. взаимодействие алюминия со щелочами
Алюминий, как и другие металлы, образующие амфотерные оксиды и гидроксиды, взаимодействуют с растворами щелочей.
Алюминий при обычных условиях, как уже было отмечено, покрыт защитной пленкой А1 2 О 3 . При действии на алюминий водных растворов щелочей слой оксида алюминия А1 2 О 3 растворяется, причем образуются алюминаты — соли, содержащие алюминий в составе аниона:
А1 2 О 3 + 2NaOH + 3Н 2 О = 2Na
Алюминий, лишенный защитной пленки, взаимодействует с водой, вытесняя из нее водород
2Al + 6Н 2 О = 2Al (ОН) 3 + 3H 2
Образующийся гидроксид алюминия, реагирует с избытком щелочи, образуя тетрагидроксоалюминат
Аl(ОН) 3 + NaOH = Na
Суммарное уравнение растворения алюминия в водном растворе щелочи:
2Al + 2NaOH + 6Н 2 О = 2Na+ 3H 2
Оксид алюминия А1 2 О 3
Белое твердое вещество, нерастворимое в воде, температура плавления 2050 0 С.
Природный А1 2 О 3 — минерал корунд. Прозрачные окрашенные кристаллы корунда — красный рубин – содержит примесь хрома — и синий сапфир — примесь титана и железа — драгоценные камни. Их получают так же искусственно и используют для технических целей, например, для изготовления деталей точных приборов, камней в часах и т. п.
п.
Химические свойства
Оксид алюминия проявляет амфотерные свойства
1. взаимодействие с кислотами
А1 2 О 3 +6HCl = 2AlCl 3 + 3H 2 O
2. взаимодействие со щелочами
А1 2 О 3 + 2NaOH – 2NaAlO 2 + H 2 O
Al 2 O 3 + 2NaOH + 5H 2 O = 2Na
3. при накаливании смеси оксида соответствующего металла с порошком алюминия происходит бурная реакция, ведущая к выделению из взятого оксида свободного металла. Метод восстановления при помощи Al (алюмотермия) часто применяют для получения ряда элементов (Cr, Мп, V, W и др.) в свободном состоянии
2А1 + WO 3 = А1 2 Оз + W
4. взаимодействие с солями, имеющими сильнощелочную среду, вследствие гидролиза
Al 2 O 3 + Na 2 CO 3 = 2 NaAlO 2 + CO 2
Гидроксид алюминия А1(ОН) 3
А1(ОН) 3 представляет собой объемистый студенистый осадок белого цвета, практически нерастворимый в воде, но легко растворяющийся в кислотах и сильных щелочах. Он имеет, следовательно, амфотерный характер.
Получают гидроксид алюминия реакцией обмена растворимых солей алюминия со щелочами
AlCl 3 + 3NaOH = Al(OH) 3 ↓ + 3NaCl
Al 3+ + 3OH — = Al(OH) 3 ↓
Данную реакцию можно использовать как качественную на ион Al 3+
Химические свойства
1. взаимодействие с кислотами
Al(OH) 3 +3HCl = 2AlCl 3 + 3H 2 O
2. при взаимодействии с сильными щелочами образуются соответствующие алюминаты:
NaOH + А1(ОН)з = Na
3. термическое разложение
2Al(OH) 3 = Al 2 О 3 + 3H 2 O
Соли алюминия подвергаются гидролизу по катиону, среда кислая (рН
Al 3+ + Н + ОН — ↔ AlОН 2+ + Н +
Al(NO 3) 3 + H 2 O↔ AlOH(NO 3) 2 + HNO 3
Растворимые соли алюминия и слабых кислот подвергаются полному (необратимому гидролизу)
Al 2 S 3 + 3H 2 O = 2Al(OH) 3 +3H 2 S
Применение в медицине и народном хозяйстве алюминия и его соединений.
Легкость алюминия и его сплавов и большая устойчивость к воздуху и воде обуславливают их применение в машиностроении, авиастроении. В виде чистого металла алюминий применяется для изготовления электрических проводов.
В виде чистого металла алюминий применяется для изготовления электрических проводов.
Алюминиевая фольга (толщиной 0,005 мм) применяется в пищевой и фармацевтической промышленности для упаковки продуктов и препаратов.
Оксид алюминия Al 2 O 3 – входит в состав некоторых антацидных средств (например, Almagel), используется при повышенной кислотности желудочного сока.
КAl(SO 4) 3 12H 2 О – алюмокалиевые квасцы применяются в медицине для лечения кожных заболеваний, как кровоостанавливающие средство. А также используют как дубильное вещество в кожевенной промышленности.
(CH 3 COO) 3 Al — Жидкость Бурова- 8% раствор ацетата алюминия оказывает вяжущее и противовоспалительное действие, в больших концентрациях обладает умеренными антисептическими свойствами. Применяется в разведенном виде для полоскания, примочек, при воспалительных заболеваниях кожи и слизистых оболочек.
AlCl 3 — применяется в качестве катализатора в органическом синтезе.
Al 2 (SO 4) 3 · 18 H 2 0 – применяется при очистки воды.
Контрольные вопросы для закрепления:
1. Назовите высшую валентность степень окисления элементов III А группы. Объясните с точки зрения строения атома.
2.Назовите важнейшие соединения бора. Что является качественной реакцией на борат-ион?
3. Какие химические свойства имеют оксид и гидроксид алюминия?
Обязательная
Пустовалова Л.М., Никанорова И.Е. Неорганическая химия. Ростов-на-Дону. Феникс. 2005. –352с. гл. 2.1 с. 283-294
Дополнительная
1. Ахметов Н.С. Общая и неорганическая химия. М.:Высшая школа, 2009.- 368с.
2. Глинка Н.Л. Общая химия. КноРус, 2009.-436 с.
3. Ерохин Ю.М. Химия. Учебник для студ. Сред проф.образ.-М.: Академия, 2006.- 384с.
Электронные ресурсы
1. Открытая химия: полный интерактивный курс химии для уч-ся школ, лицеев, гимназий, колледжей, студ. технич.вузов: версия 2.5-М.: Физикон, 2006. Электронный оптический диск CD-ROM
2. .1С: Репетитор – Химия, для абитуриентов, старшеклассников и учителей, ЗАО «1С», 1998-2005. Электронный оптический диск CD-ROM
Электронный оптический диск CD-ROM
3. Химия. Основы теоретической химии. [Электронный ресурс]. URL: http://chemistry.narod.ru/himiya/default.html
4. Электронная библиотека учебных материалов по химии [Электронный ресурс]. URL: http://www.chem.msu.su/rus/elibrary/
Формула гидроксида алюминия – структура, свойства, применение, примеры вопросов
Алюминиевая кислота, гидроксид алюминия и гидроксид алюминия (III) – все это названия гидроксида алюминия. Это химический термин для алюминия, как и для всех других карбонатов, сульфатов и гидроксидов металлов.
Встречается в природе в виде минерального гиббсита и его полиморфных форм, таких как дойлеит, нордстрандит и байерит.
Формула гидроксида алюминия
Химическая формула гидроксида алюминия: Al(OH) 3 . Гидроксид алюминия представляет собой белый аморфный порошок. Не растворяется в воде, но растворяется в щелочных и кислых растворах. Его можно использовать для лечения дискомфорта в желудке, кислотного расстройства желудка, изжоги и повышенной кислотности желудка. Его также можно использовать для снижения уровня фосфатов у людей с заболеваниями почек. Антацид также может быть полезен в немедицинских целях.
Его также можно использовать для снижения уровня фосфатов у людей с заболеваниями почек. Антацид также может быть полезен в немедицинских целях.
Структура гидроксида алюминия
Гидроксид алюминия представляет собой амфотерное химическое вещество, способное вести себя как кислота и как основание. Он встречается в кислых растворах в виде иона алюминия Al 3 + и ион гидроксида OH – . Это происходит в основных растворах, таких как ион гидроксида алюминия, Al(OH) 4 -. Ион гидроксида алюминия имеет тетраэдрическую структуру с валентным углом 116,5° между Al-O-Al. Гидроксид алюминия имеет нормальную структуру гидроксида металла с водородной связью.
Он состоит из двух слоев гидроксильных групп и двух слоев ионов алюминия, которые занимают две трети октаэдрических отверстий, образованных между двумя слоями.
Гиббсит представляет собой амфотерный минерал, который действует как основание Бренстеда-Лоури для производства соли путем поглощения ионов водорода и нейтрализации кислоты. Вот реакция:
Вот реакция:
3HCl + Al(OH) 3 → AlCl 3 + 3H 2 O
В основаниях действует как кислота Льюиса. Он восстанавливает гидроксид-ионы электронной пары. Другая реакция:
Al(OH) 3 + OH – → Al(OH) 4 –
Получение гидроксида алюминия
Процесс Байера используется для производства гидроксида алюминия, используемого в коммерческих целях. Его осуществляют растворением боксита в растворе едкого натра при температуре от 0 до 270°С. После удаления мусора раствору алюмината натрия дают выпасть в осадок. В результате образовавшийся осадок представляет собой гидроксид алюминия.
Прокаливание можно использовать для получения оксида алюминия или оксида алюминия из гидроксида алюминия.
Bayer Process Reactions
- First: Al 2 O 3 .
2H 2 O + 2 NaOH → 2 NaAlO 2 + 3 H 2 O
- Second: NAALO 2 + 2 H 2 O → AL (OH) 3 + NAOH
- Третий : 2 AL (OH) 3 → AL2O 3 + 3 H 2 O
Физические свойства гидроксида алюминия
Ниже приведены физические характеристики гидроксида алюминия.
- Гидроксид алюминия встречается в виде белого аморфного порошка.
- Гидроксид алюминия имеет температуру плавления около 573К.
- Гидроксид алюминия нерастворим в воде, но растворим в щелочах и кислотах.
- Твердый гидроксид алюминия имеет плотность около 2,42 г/см 3 .
Химические свойства гидроксида алюминия
- Гидроксид алюминия является амфотерным веществом.
- Может функционировать как кислота и как основание.
- Гидроксид алюминия в кислотах ведет себя как основание Бренстеда–Лоури.

- В результате нейтрализует кислотообразующую соль и воду, которые являются конечными результатами.
Использование гидроксида алюминия
- Гидроксид алюминия имеет ряд преимуществ, включая крупномасштабное производство, достаточное количество сырья, превосходную чистоту продукта и хорошую растворимость в кислотах. В результате гидроксид алюминия может использоваться в качестве ключевого сырья при производстве солей алюминия, таких как алюминат бария, сульфат алюминия и др.
- Благодаря наполнителю, огнестойкости, дымоудалению и нетоксичности порошок гидроксида алюминия широко известен как подходящий огнестойкий наполнитель для пластмасс, ненасыщенных полиэфиров, каучука и других органических полимеров. Механизм антипирена гидроксида алюминия заключается в следующем: при температуре выше 200°С гидроксид алюминия начинает проводить эндотермический распад с выделением трехкристаллической воды, а скорость его разложения достигает максимума при 250°С.

- Гидроксид алюминия может быть преобразован в оксид алюминия, материал с хорошей термической химической стабильностью, термической прочностью, сопротивлением ползучести, диэлектрическими характеристиками и низким коэффициентом теплового расширения. Глинозем является важным ингредиентом в производстве керамики.
Мы можем регулировать фазовое развитие композита в процессе синтеза керамики, активируя гидроксид алюминия и управляя процессом кристаллизации. - Гидроксид алюминия встречается в воде в основном в форме Al(OH) 4 – , которые могут осаждать опасные тяжелые металлы в сточных водах методом соосаждения для очистки воды после дополнительной фильтрации. Гидроксид алюминия имеет большую удельную поверхность и может адсорбировать коллоиды, взвешенные частицы, красители и органические соединения из сточных вод.
- Гидроксид алюминия обладает способностью нейтрализовать желудочную кислоту и не токсичен, поэтому он постоянно используется в качестве традиционного лекарства для лечения желудка.

Использование гидроксида алюминия в качестве адъюванта также может повысить иммуногенность вакцины. Механизм действия следующий: гидроксид алюминия адсорбирует антиген на своей поверхности, позволяя антигену медленно высвобождаться, тем самым увеличивая эффективность. - Контролируя температуру, концентрацию и рН реагентов, мы можем получить множество целевых продуктов с различной площадью поверхности, объемом пор, структурой пор и кристаллической структурой, которые можно эффективно использовать в качестве носителя катализатора для гидрирование ненасыщенных карбонильных соединений и получение фуллеренов и других подобных соединений.
- Гидроксид алюминия имеет высокую белизну, сверхмелкий размер частиц и полную кристаллическую форму, и он очень совместим с отбеливателями. Гидроксид алюминия в качестве дополнительного покрытия и смолы может значительно увеличить белизну, непрозрачность, гладкость и абсорбцию краски мелованной бумаги.
Примеры вопросов
Вопрос 1. Какова функция гидроксида алюминия?
Какова функция гидроксида алюминия?
Ответ:
Алюминий – природный металл. гидроксид алюминия является антацидом. гидроксид алюминия используется для лечения изжоги, дискомфорта в желудке, боли в желудке и кислотного расстройства желудка. гидроксид алюминия также используется для снижения уровня фосфатов у лиц с различными почечными заболеваниями.
Вопрос 2: Объясните важность геля гидроксида алюминия?
Ответ:
Гель гидроксида алюминия представляет собой суспензию аморфного гидроксида алюминия. Частично заменители углерода присутствуют в форме минерального геля. Глицерин, масло перечной мяты, сахарин, сахароза и сорбит, помимо других ингредиентов, могут присутствовать в форме геля. Различные антибактериальные компоненты также могут присутствовать в соответствующих концентрациях в геле. Он в основном используется для лечения симптомов, вызванных избытком желудочной кислоты, таких как изжога, кислотное расстройство желудка и расстройство желудка.
Это работает лучше, чем таблетки или капсулы. Осаждение этанольных растворов хлорида алюминия приводит к образованию геля, а также присутствуют первичные амины, такие как октиламин, пропиламин и додециламин.
Они действуют как акцепторы протонов во время гидролиза, позволяя происходить осаждению.
Вопрос 3: Безопасно ли использовать гидроксид алюминия в косметике?
Ответ:
Гидроксид алюминия — это искусственное вещество, которое действует как замутнитель. Агент и абсорбент для покраски — два наиболее распространенных применения. Нет никаких доказательств того, что гидроксид алюминия вреден для кожи.
Вопрос 4: Вреден ли гидроксид алюминия?
Ответ:
Побочные эффекты гидроксида алюминия включают сильную боль в желудке или запор, потерю аппетита, трудности при мочеиспускании, мышечную слабость, усталость и чрезмерную сонливость.
Вопрос 5: Является ли гидроксид щелочного металла слабым основанием?
Ответ:
Гидроксид алюминия как химическое соединение имеет молекулярную формулу Al(OH)3…. В гидроксиде алюминия, например, гидроксид (ОН) может действовать как слабое основание при взаимодействии с сильной кислотой, соляной кислотой (HCl). Слабым основанием считается такое основание, которое частично диссоциирует или отщепляется в растворе.
Вопрос 6: Почему гидроксид алюминия является кислотой?
Ответ:
Гидроксид алюминия нерастворим в воде и может растворяться только в основаниях и кислотах. Ожидается, что гидроксид алюминия будет служить амфотерным материалом в воде.
Гидроксид алюминия действует как кислота, если присутствует сильное основание.
Вопрос 7: Что вызывает дефицит фосфатов в гидроксиде алюминия?
Ответ:
Гидроксид алюминия может вызвать дефицит фосфора у людей с низким содержанием фосфора в рационе путем взаимодействия с фосфатами с образованием нерастворимого фосфата алюминия.
Формула гидроксида алюминия: значение, свойства, реакции
- Автор Riya_I
- Последнее изменение 25 июля 2022 г.
- Автор Riya_I
- Последнее изменение 25 июля 2022 г.
Формула гидроксида алюминия произносится как \(\rm{Al(OH)}_3\). Его также можно записать как гидроксид алюминия (III). Гидроксид алюминия выглядит как аморфный порошок белого цвета. В природе встречается в виде минерального гиббсита (также называемого гидраргиллит).
Молярная масса гидроксида алюминия примерно равна \(78,00\,\rm{г/моль}\). Другими полиморфами гидроксида алюминия являются айерит, дойлеит и нордстрандит. Это амфотерный оксид. В этой статье мы собираемся более подробно обсудить гидроксид алюминия. Продолжайте читать, чтобы узнать больше! 9-)\) ионов.
Гидроксид алюминия можно представить как
Молярная масса гидроксида алюминия примерно равна \(78,00\,\rm{г/моль}\).
Вывод химической формулы гидроксида алюминия Химическая формула соединения представляет собой число атомов каждого элемента, присутствующего в одной молекуле соединения. \circ \rm{C}\). В результате процесса из раствора, содержащего алюминат натрия, осаждается гидроксид алюминия, удаляются твердые отходы и бокситовые хвосты. Полученный гидроксид алюминия можно превратить в оксид алюминия (оксид алюминия) в процессе прокаливания.
\circ \rm{C}\). В результате процесса из раствора, содержащего алюминат натрия, осаждается гидроксид алюминия, удаляются твердые отходы и бокситовые хвосты. Полученный гидроксид алюминия можно превратить в оксид алюминия (оксид алюминия) в процессе прокаливания.
Обсудим физико-химические свойства гидроксида алюминия \([\rm{Al(OH)}_3]\).
Физические свойства гидроксида алюминияФизические свойства гидроксида алюминия следующие:
- Гидроксид алюминия выглядит как белый аморфный порошок.
- Температура плавления гидроксида алюминия приблизительно равна \(573\,\rm{K}\). 93\).
Физические свойства гидроксида алюминия следующие:
Гидроксид алюминия является амфотерным по своей природе. Он может выступать как в роли кислоты, так и в качестве основания. В кислотах гидроксид алюминия действует как основание Бренстеда-Лоури. В результате он нейтрализует кислотообразующую соль и воду как продукты.
В кислотах гидроксид алюминия действует как основание Бренстеда-Лоури. В результате он нейтрализует кислотообразующую соль и воду как продукты.
Например, гидроксид алюминия реагирует с соляной кислотой с образованием хлорида алюминия и воды. Химическое уравнение реакции можно представить в виде 9-\)
Реакции Гидроксид алюминияРазличные реакции гидроксида алюминия объясняются ниже:
Реакция гидроксида алюминия с серной кислотойГидроксид алюминия реагирует с серной кислотой с образованием сульфата алюминия и воды в качестве продуктов. Химическое уравнение реакции можно представить в виде
.\(2\rm{Al(OH)}_3 + 3\rm{H}_2 \rm{SO}_4 → \rm{Al}_2 (\rm{SO}_4)_3 + 6\rm{H} _2 \rm{O}\)
Реакция гидроксида алюминия с азотной кислотойГидроксид алюминия реагирует с азотной кислотой с образованием нитрата алюминия и воды. Химическое уравнение реакции можно представить в виде
.
\(3 \rm{HNO}_3 + \rm{Al(OH)}_3 → \rm{Al(NO}_3)_3 + 3\rm{H}_2 \rm{O}\)
Реакция гидроксида алюминия с угольной кислотойКарбонат алюминия и вода образуются при взаимодействии гидроксида алюминия с угольной кислотой. Химическое уравнение реакции можно представить в виде
\(\rm{Al(OH)}_3 + \rm{H}_2 \rm{CO}_3 → \rm{H}_2 \rm{O} + \rm{Al}_2 (\rm{CO} _3)_3\)
Вышеуказанные реакции являются примерами реакций нейтрализации.
Разложение гидроксида алюминияПри более высоких температурах гидроксид алюминия разлагается с образованием оксида алюминия и воды. То есть
\({\text{2Al}}{\left({{\text{OH}}} \right)_{{\text{3}}}} \xrightarrow{{{\text{Heat}}}} {\text{A}}{{\text{l}}_{\text{2}}}{{\text{O}}_{\text{3}}}{\text{+ 3}}{ {\text{H}}_{\text{2}}}{\text{O}}\) 9\ circ {\ rm {C}}. \)
Применение Гидроксид алюминия Гидроксид алюминия имеет несколько применений. В том числе:
В том числе:
- В полимерах гидроксид алюминия используется в качестве огнезащитного наполнителя из-за его недорогого бесцветного внешнего вида и хороших огнезащитных свойств.
- В полиэфирах, акрилах, ПВХ, эпоксидных смолах и каучуке он также используется в качестве средства подавления дыма.
- У людей и животных гидроксид алюминия используется в качестве антацида под названием «альгельдрат». Он помогает нейтрализовать желудочную кислоту и, следовательно, снижает кислотность желудка.
- Гидроксид алюминия также используется для контроля повышенного уровня фосфатов или фосфора в крови (гиперфосфатемия).
- В вакцинах в качестве адъюванта используется осажденный гидроксид алюминия. Составы вакцин, содержащие гидроксид алюминия, укрепляют иммунную систему.
- Используется в качестве добавки для стекла и бумаги.
- Используется как протрава при крашении.
- Используется для изготовления гончарных изделий, огнеупорной глины и типографских красок.

Гидроксид алюминия представляет собой неорганическое соединение с химической формулой \(\rm{Al(OH)}_3\). В природе встречается как минерал гиббсит, также известный как гидраргиллит. Он производится в промышленных масштабах с использованием процесса Байера. Гидроксид алюминия имеет амфотерную природу. То есть в кислотах он ведет себя как основание Бренстеда–Лоури, а в основаниях — как кислота Льюиса. Гидроксид алюминия также имеет множество применений. Используется как добавка для стекла и бумаги. Гидроксид алюминия также используется в качестве протравы при окрашивании. 9-)\) радикалы. Валентность алюминиевого радикала равна трем, а гидроксильного радикала — единице. Путем пересечения этих чисел валентности химическая формула гидроксида алюминия может быть записана как \(\rm{Al(OH)}_3.\)
Q.2. Как производится \(\rm{Al(OH)}_3\) ?
Ответ: Гидроксид алюминия \([\rm{Al(OH)}_3]\) промышленно производится по процессу Байера. \circ {\rm{C}}.\). В результате процесса из раствора, содержащего натрий, осаждается гидроксид алюминия. алюминат.
\circ {\rm{C}}.\). В результате процесса из раствора, содержащего натрий, осаждается гидроксид алюминия. алюминат.
Q.3. Для чего используется гидроксид алюминия?
Ответ: Гидроксид алюминия имеет множество применений. К ним относятся:
1. В полимерах гидроксид алюминия используется в качестве огнезащитного наполнителя.
2. В полимерах используется как средство подавления дыма.
3. У людей и животных гидроксид алюминия используется в качестве антацида под названием «альгельдрат».
4. Используется для изготовления гончарных изделий, огнеупорной глины и типографских красок.
Q.4. Гидроксид алюминия вреден?
Ответ: Гидроксид алюминия одобрен FDA как безопасный. Поэтому в разрешенных количествах употреблять неплохо. Однако в больших количествах он может вызывать токсические эффекты, такие как остеомаляция, проблемы с почками, повреждение головного мозга и т. д.
д.
Q.5. Полезен ли гидроксид алюминия?
Ответ: Гидроксид алюминия одобрен FDA как безопасный и эффективный. Поэтому в разрешенных количествах его полезно употреблять.
Practice Aluminium Hydroxide Questions with Hints & Solutions
T3DB: Aluminium hydroxide
| Record Information | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Version | 2.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Creation Date | 2009-06-19 21:58:52 UTC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дата обновления | 24-12-2014 20:24:02 UTC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Регистрационный номер | T3D1504 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификация0505 Общее название | Гидроксид алюминия | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Класс | Низкая молекула | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Описание | Гидроксид алюминия — наиболее стабильная форма алюминия. Он встречается в природе в виде минерала гиббсита (также известного как гидраргиллит) и трех его гораздо более редких полиморфных модификаций: байерита, дойлеита и нордстрандита. Гидроксид алюминия используется в качестве антацида и включается в качестве адъюванта в некоторые вакцины. Алюминий является наиболее распространенным металлом в земной коре и всегда встречается в сочетании с другими элементами, такими как кислород, кремний и фтор. (7, 8, 9) Гидроксид алюминия используется в качестве антацида и включается в качестве адъюванта в некоторые вакцины. Алюминий является наиболее распространенным металлом в земной коре и всегда встречается в сочетании с другими элементами, такими как кислород, кремний и фтор. (7, 8, 9) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тип компаунда |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemical Structure | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonyms |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemical Formula | AlH 6 O 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Средняя молекулярная масса | 81,027 г/моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Масса моноизотопа | 81. 013 g/mol 013 g/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Registry Number | 21645-51-2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IUPAC Name | alumane trihydrate | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Traditional Name | alumane trihydrate | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMILES | O.O.O.[Al] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор дюйм | дюйм = 1s/al.3h3o/h; 3*1H3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дюйм.0502 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Описание | принадлежит к классу неорганических соединений, известных как постпереходные оксиды металлов. Это неорганические соединения, содержащие атом кислорода со степенью окисления -2, в которых самый тяжелый атом, связанный с кислородом, представляет собой постпереходный металл. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Королевство | Неорганические соединения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Суперкласс | Смешанные соединения металлов и неметаллов | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Класс | Металлорганиды | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sub Class | Post-transition metal oxides | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Direct Parent | Post-transition metal oxides | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Alternative Parents |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Substituents |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молекулярный каркас | Нет в наличии | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| External Descriptors | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Biological Properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Status | Detected and Not Quantified | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Origin | Exogenous | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cellular Locations |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Биофлюиды | Недоступно | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тканевые локации | Недоступно | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Пути | Недоступно | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Применение |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Biological Roles |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemical Roles | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical Properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| State | Solid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | White пудра. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Experimental Properties |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Прогнозируемые свойства |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spectra | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 Spectra | Нет в наличии | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Профиль токсичности | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Путь воздействия | Пероральный (7) ; вдыхание (7) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Механизм токсичности | Основными органами-мишенями алюминия являются центральная нервная система и кости. Алюминий связывается с пищевым фосфором и ухудшает всасывание фосфора в желудочно-кишечном тракте. Снижение содержания фосфатов в организме приводит к остеомаляции (размягчению костей из-за нарушения минерализации костей) и рахиту. Считается, что нейротоксичность алюминия связана с несколькими механизмами. Одной из причин считается изменение функций белков цитоскелета в результате измененного фосфорилирования, протеолиза, транспорта и синтеза. Алюминий может вызывать нейроповеденческие эффекты, влияя на проницаемость гематоэнцефалического барьера, холинергическую активность, пути передачи сигналов, перекисное окисление липидов и нарушая нейрональный путь глутамата оксида азота-циклического ГМФ, а также вмешиваться в метаболизм основных микроэлементов из-за аналогичной координации. химии и последующих конкурентных взаимодействий. Было высказано предположение, что взаимодействие алюминия с рецепторами эстрогена увеличивает экспрессию генов, связанных с эстрогеном, и тем самым способствует прогрессированию рака молочной железы (1), но исследования не смогли установить четкую связь между алюминием и повышенным риском рака молочной железы. Алюминий связывается с пищевым фосфором и ухудшает всасывание фосфора в желудочно-кишечном тракте. Снижение содержания фосфатов в организме приводит к остеомаляции (размягчению костей из-за нарушения минерализации костей) и рахиту. Считается, что нейротоксичность алюминия связана с несколькими механизмами. Одной из причин считается изменение функций белков цитоскелета в результате измененного фосфорилирования, протеолиза, транспорта и синтеза. Алюминий может вызывать нейроповеденческие эффекты, влияя на проницаемость гематоэнцефалического барьера, холинергическую активность, пути передачи сигналов, перекисное окисление липидов и нарушая нейрональный путь глутамата оксида азота-циклического ГМФ, а также вмешиваться в метаболизм основных микроэлементов из-за аналогичной координации. химии и последующих конкурентных взаимодействий. Было высказано предположение, что взаимодействие алюминия с рецепторами эстрогена увеличивает экспрессию генов, связанных с эстрогеном, и тем самым способствует прогрессированию рака молочной железы (1), но исследования не смогли установить четкую связь между алюминием и повышенным риском рака молочной железы. (4). Некоторые соли алюминия вызывают иммунный ответ, активируя инфламмасомы. (7, 1, 2) (4). Некоторые соли алюминия вызывают иммунный ответ, активируя инфламмасомы. (7, 1, 2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Метаболизм | Алюминий плохо всасывается при пероральном или ингаляционном воздействии и практически не всасывается через кожу. Биодоступность алюминия сильно зависит от соединения алюминия и присутствия пищевых компонентов, которые могут образовывать комплексы с алюминием и усиливать или подавлять его абсорбцию. Алюминий связывается с различными лигандами в крови и распределяется по всем органам, причем самые высокие концентрации обнаруживаются в тканях костей и легких. Считается, что в живых организмах алюминий существует в четырех различных формах: в виде свободных ионов, в виде низкомолекулярных комплексов, в виде физически связанных макромолекулярных комплексов и в виде ковалентно связанных макромолекулярных комплексов. Абсорбированный алюминий выводится в основном с мочой и, в меньшей степени, с желчью, тогда как неабсорбированный алюминий выводится с фекалиями. (7) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Значения токсичности | LD50: 1100 мг/кг (внутрибрюшинно, крыса) (10) LD50: >5000 мг/кг (перорально, крыса) (3) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Смертельная доза | Недоступно | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Канцерогенность (Классификация IARC) | Не указано IARC. IARC классифицировал производство алюминия как канцерогенное для человека (группа 1), но не причислял сам алюминий к канцерогенам для человека. (11) Была предложена связь между использованием алюминийсодержащих антиперспирантов и повышенным риском рака молочной железы (1), но исследования не смогли установить четкую связь (4). IARC классифицировал производство алюминия как канцерогенное для человека (группа 1), но не причислял сам алюминий к канцерогенам для человека. (11) Была предложена связь между использованием алюминийсодержащих антиперспирантов и повышенным риском рака молочной железы (1), но исследования не смогли установить четкую связь (4). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Использование/Источники | Гидроксид алюминия используется в качестве антацида и включается в качестве адъюванта в некоторые вакцины. (9) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Минимальный уровень риска | Средний Пероральный: 1,0 мг/кг/день (6) Хроническая пероральная доза: 1,0 мг/кг/день (6) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Воздействие на здоровье | Алюминий воздействует на нервную систему и вызывает снижение работоспособности нервной системы и связан с изменением функции гематоэнцефалического барьера. Накопление алюминия в организме может вызвать заболевания костей или головного мозга. Высокий уровень алюминия связывают с болезнью Альцгеймера. Небольшой процент людей имеет аллергию на алюминий и испытывает контактный дерматит, расстройства пищеварения, рвоту или другие симптомы при контакте или проглатывании продуктов, содержащих алюминий. (7, 8) Небольшой процент людей имеет аллергию на алюминий и испытывает контактный дерматит, расстройства пищеварения, рвоту или другие симптомы при контакте или проглатывании продуктов, содержащих алюминий. (7, 8) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Симптомы | Вдыхание алюминиевой пыли вызывает кашель и патологические рентгенограммы грудной клетки. Небольшой процент людей имеет аллергию на алюминий и испытывает контактный дерматит, расстройства пищеварения, рвоту или другие симптомы при контакте или проглатывании продуктов, содержащих алюминий. (7, 8) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лечение | ГЛАЗА: промывать открытые глаза в течение нескольких минут под проточной водой. ПРОГЛАТЫВАНИЕ: не вызывать рвоту. Прополоскать рот водой (никогда ничего не давать в рот человеку, находящемуся без сознания). Немедленно обратитесь за медицинской помощью. КОЖА: следует немедленно обработать путем промывания пораженных участков холодной проточной водой в течение не менее 15 минут с последующим тщательным мытьем водой с мылом. При необходимости человек должен принять душ и сменить загрязненную одежду и обувь, а затем обратиться за медицинской помощью. ВДЫХАНИЕ: приток свежего воздуха. При необходимости обеспечить искусственное дыхание. При необходимости человек должен принять душ и сменить загрязненную одежду и обувь, а затем обратиться за медицинской помощью. ВДЫХАНИЕ: приток свежего воздуха. При необходимости обеспечить искусственное дыхание. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normal Concentrations | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Abnormal Concentrations | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| External Links | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DrugBank ID | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| HMDB ID | Недоступно | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор PubChem Compound | 6328211 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CheMBL ID | Недоступно | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChemSpider ID | 4886529 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| KEGG ID | C13391 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| UniProt ID | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| OMIM ID | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI ID | 33130 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BioCyc ID | Недоступно | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CTD ID | D000536 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор стежка | Гидроксид алюминия | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PDB ID | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ACToR ID | 15540 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikipedia Link | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| References | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synthesis Reference | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MSDS | T3D1504. pdf pdf | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| General References |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Генная регуляция | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Гены с повышенной регуляцией | Недоступно | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Гены с понижающей регуляцией | Недоступно | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ICSC 0373 — ГИДРОКСИД АЛЮМИНИЯ
ICSC 0373 — ГИДРОКСИД АЛЮМИНИЯ| ГИДРОКСИД АЛЮМИНИЯ | ICSC: 0373 (март 1998 г.) |
| Глинозем гидрат Оксид алюминия тригидрат Тригидроксиалюминий | |
| Номер CAS: 21645-51-2 |
| Номер ЕС: 244-492-7 |
| ОСТРЫЕ ОПАСНОСТИ | ПРЕДУПРЕЖДЕНИЕ | ПОЖАРОТУШЕНИЕ | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючий. | В случае возгорания поблизости используйте соответствующие средства пожаротушения. |
| ПРЕДОТВРАТИТЬ РАССЕЯНИЕ ПЫЛИ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРЕДУПРЕЖДЕНИЕ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Используйте местную вытяжку. | Свежий воздух, отдых. | |
| Кожа | Защитные перчатки. | Промойте кожу большим количеством воды или под душем. | |
| Глаза | Носите защитные очки. | Сначала промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно), затем обратиться за медицинской помощью. | |
| Проглатывание | Прополоскать рот. Отдыхать. Отдыхать. | ||
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Смести просыпанное вещество в закрытые контейнеры. Смойте остатки большим количеством воды. | В соответствии с критериями СГС ООН Транспорт |
| ХРАНЕНИЕ | |
| УПАКОВКА | |
| ГИДРОКСИД АЛЮМИНИЯ | КМГС: 0373 |
| ФИЗИЧЕСКАЯ И ХИМИЧЕСКАЯ ИНФОРМАЦИЯ | |
|---|---|
Физическое состояние; Внешний вид Физические опасности Химическая опасность | Формула: AlH 3 O 3 / Al(OH) 3 |
| ВОЗДЕЙСТВИЕ И ВЛИЯНИЕ НА ЗДОРОВЬЕ | |
|---|---|
Пути воздействия Последствия кратковременного воздействия | Опасность при вдыхании Последствия длительного или многократного воздействия |
| ПРЕДЕЛЫ ВОЗДЕЙСТВИЯ НА РАБОЧЕМ МЕСТЕ |
|---|
TLV: (вдыхаемая фракция): 1 мг/м 3 , как TWA; A4 (не классифицируется как канцероген для человека). МАК: (вдыхаемая фракция): 4 мг/м 3 ; (вдыхаемая фракция): 1,5 мг/м 3 ; группа риска по беременности: D |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| Указана кажущаяся температура плавления, вызванная потерей кристаллической воды. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
| Классификация ЕС |
Все права защищены. Опубликованный материал распространяется без каких-либо явных или подразумеваемых гарантий.
Ни МОТ, ни ВОЗ, ни Европейская комиссия не несут ответственности за интерпретацию и использование информации, содержащейся в этом материале. | |
Смотрите также:
Токсикологические сокращения
Гидроксид алюминия (Al(OH)3) – структура, свойства, применение
Большинство людей знают, что хотя оксид алюминия является антацидом, сам алюминий является природным минералом. Он лечит дискомфорт в желудке, кислотное расстройство желудка, изжогу и кислый желудок. Кроме того, вы можете использовать его для снижения уровня фосфатов у пациентов с почечной недостаточностью. Возможны и другие немедицинские применения антацида.
Что такое гидроксид алюминия?Для тех, кто не знает, что такое гидроксид алюминия, он также известен как гидроксид алюминия, гидроксид алюминия (III) или алюминиевая кислота. Это то же самое, что и все существующие другие карбонаты, сульфаты и гидроксиды металлов, и это химический термин для алюминия. Он встречается в природе как минерал и его полиморф, известный как байерит.
Формула гидроксида алюминия Al(OH) 3 – формула гидроксида алюминия. Аморфный белый порошок представляет собой гидроксид алюминия. Он нерастворим в воде. Однако он растворим в щелочных и кислых растворах. Это полезно для лечения болей в желудке, изжоги, кислотного расстройства желудка и кислого желудка. Кроме того, он может помочь людям с проблемами почек снизить уровень фосфатов. Антацид также может быть полезен не только в медицине. Гидроксид алюминия присутствует в минеральных рудах гиббсита, байертута, дойлеита и страндита, как и карбонаты, гидроксиды и сульфаты других металлов.
Аморфный белый порошок представляет собой гидроксид алюминия. Он нерастворим в воде. Однако он растворим в щелочных и кислых растворах. Это полезно для лечения болей в желудке, изжоги, кислотного расстройства желудка и кислого желудка. Кроме того, он может помочь людям с проблемами почек снизить уровень фосфатов. Антацид также может быть полезен не только в медицине. Гидроксид алюминия присутствует в минеральных рудах гиббсита, байертута, дойлеита и страндита, как и карбонаты, гидроксиды и сульфаты других металлов.
Он может действовать как кислота и основание, в зависимости от соединения, с которым он реагирует. Он проявляется в виде иона гидроксида ОН- и иона алюминия Al 3 + в кислых растворах. базовые решения. Тетраэдрическая структура иона гидроксида алюминия имеет валентный угол 116,5°, который образуется между атомами алюминия и кислорода. Типичная структура гидроксида алюминия включает водородные связи. Он состоит из двух слоев ионов алюминия и двух слоев гидроксильных групп, которые занимают две трети октаэдрических образований между двумя слоями.
Он состоит из двух слоев ионов алюминия и двух слоев гидроксильных групп, которые занимают две трети октаэдрических образований между двумя слоями.
Амфотерный минерал гиббсит действует как основание Бренстеда-Лоури, собирая ионы водорода и нейтрализуя кислоту с образованием соли.
3HCl (водн.) + Al(OH) 3 -> AlCl 3 (водн.) + 3H 2 O (ж)
В щелочах ведет себя как кислота Льюиса. Он ослабляет ионы гидроксида электронной пары. Еще одна реакция:
Al(OH) 3 + OH – -> Al(OH) 4 –
Получение гидроксида алюминияДля производства гидроксида алюминия для использования в промышленности требуется процесс Байера. Для этого боксит растворяют в растворе гидроксида натрия при температуре от 0 до 270 °C. После устранения мусора раствору алюмината натрия дают выпасть в осадок. Благодаря этому гидроксид алюминия выпадает в осадок.
Гидроксид алюминия можно прокалить с получением оксида алюминия или оксида алюминия.
Реакции процесса Байера
Al 2 O 3 .2H 2 O + 2NAOH -> 2NAALO 2 + 3H 2 O
NAALO 2 + 2H 2 O -> Al (OH) 3 + NAOH
2AL 2 (OH) 3 -> Al 2 O 3 + 3H 2 O
Меры предосторожности при производстве геля гидроксида алюминия- Подготовка должна очистить коническую колбу, чтобы удалить любую грязь или бактерии.
- Разложение восстановленного геля вызывает реакцию с образованием побочного продукта — соляной кислоты. Таким образом, для его устранения требуется процедура диализа.
- Растворы хлорида алюминия должны включать нисходящую спираль.
- Минимум 2% необходимо приготовить раствор хлорида алюминия (добавляя 2 г хлорида алюминия на 100 мл воды).

- В конической колбе должно находиться не менее 100 мл дистиллированной воды.
- Чтобы вскипятить воду, используйте проволочную марлю.
- Добавьте 10 мл 2% раствора хлорида алюминия, приготовленного выше. Используя пипетку-бюретку, добавьте этот раствор. Композиты имеют агрессивную природу по своей природе, как и алюминий.
- Добавьте к раствору хлорид алюминия и регулярно встряхивайте.
- При нагревании раствора цвет раствора гидроксида алюминия меняется на белый.
- Держите смесь при комнатной температуре, пока она не остынет. Гель гидроксида алюминия
- представляет собой охлаждающий раствор.
Ниже приведены физические характеристики гидроксида алюминия. Аморфный белый порошок представляет собой гидроксид алюминия.
- Температура плавления гидроксида алюминия составляет около 573 К.

- Щелочи и кислоты делают гидроксид алюминия растворимым, но не в воде.
- Плотность твердого гидроксида алюминия составляет ок. 2,42 г/см3.
- Аморфный материал представляет собой гидроксид алюминия.
- Может действовать как основание, так и как кислота.
- В кислотах гидроксид алюминия проявляет поведение основания Бренстеда-Лоури.
- В результате он уравновешивает конечные продукты, которые представляют собой кислотообразующую соль и воду.
Гидроксид алюминия обладает многочисленными преимуществами, включая массовое производство, достаточное количество сырья, превосходное качество продукции и превосходную растворимость в кислотах.
- Гидроксид алюминия является важнейшим сырьем для производства солей алюминия, таких как алюминат бария, сульфат алюминия и других.
 Порошок гидроксида алюминия
Порошок гидроксида алюминия - хорошо известен как хороший огнезащитный наполнитель для пластмасс, резины, ненасыщенного полиэстера и многочисленных органических полимеров благодаря его наполняющим, огнестойким, дымоустраняющим и нетоксичным качествам. Механизм действия гидроксида алюминия как антипирена следующий: при температуре свыше 200 °С гидроксид алюминия начинает проводить эндотермический распад и отделяет три кристалла воды. При 250°С скорость разложения достигает максимума.
- Глинозем, вещество с высоким сопротивлением ползучести, термической прочностью, термохимической стабильностью, диэлектрическими свойствами и низким коэффициентом теплового расширения, может быть получено из гидроксида алюминия. Важным компонентом в создании керамики является глинозем.
- Активируя гидроксид алюминия и контролируя процесс кристаллизации, мы можем контролировать фазу развития композита в процессе синтеза керамики.
- Al(OH)4-, основная форма гидроксида алюминия в воде, может осаждать опасные тяжелые металлы в сточных водах с помощью метода соосаждения для очистки воды после дальнейшей фильтрации.
 Гидроксид алюминия может адсорбировать коллоиды, взвешенные частицы, пигменты и органические вещества из сточных вод благодаря своей высокой удельной поверхности.
Гидроксид алюминия может адсорбировать коллоиды, взвешенные частицы, пигменты и органические вещества из сточных вод благодаря своей высокой удельной поверхности. - Гидроксид алюминия часто используется в качестве народной медицины для лечения желудка из-за его нетоксичности и способности нейтрализовать желудочную кислоту.
- Гидроксид алюминия в качестве адъюванта потенциально может повышать иммуногенность вакцины. Механизм действия следующий: гидроксид алюминия абсорбирует антиген на своей поверхности, позволяя антигену постепенно высвобождаться и увеличивая эффективность.
- Для получения ряда целевых продуктов с различной площадью поверхности, объемом пор, структурой пор и кристаллической структурой, которые могут использоваться в качестве носителей катализаторов для гидрирования ненасыщенных карбонильных соединений и получения фуллеренов и других родственных соединений, необходимо управлять температурой, концентрацией и рН реагентов.
 Гидроксид алюминия
Гидроксид алюминия - совместим с отбеливателями благодаря своей превосходной белизне, полной кристаллической структуре и ультрамелкому размеру частиц. Второе покрытие и смола из гидроксида алюминия могут значительно улучшить белизну мелованной бумаги, ее гладкую текстуру, непрозрачность и впитываемость чернил.
Алюминий — это металл, встречающийся в природе. Антигистаминный препарат – гидроксид алюминия. Кислотное расстройство желудка, боль в желудке, изжога и дискомфорт в желудке лечатся гидроксидом алюминия. Гидроксид алюминия снижает уровень фосфатов у больных с различными почечными заболеваниями.
Эффекты гидроксида алюминия Пользователи гидроксида алюминия должны знать о нескольких серьезных побочных эффектах. Большое количество вреда для здоровья может быть вызвано большим количеством одного и того же вещества. Это может вызвать повреждение легких, крапивницу, затрудненное дыхание и аллергические реакции, такие как отек языка, губ, горла и лица. Дополнительный негативный эффект от использования гидроксида алюминия:
Дополнительный негативный эффект от использования гидроксида алюминия:
- Проблемы с мочеиспусканием.
- Сильная боль в животе или запор.
- Голодная потеря.
- Усталость и ослабление мышц.
- Кровавый или липкий стул.
- Срыгивает кровью.
- Кашель.
- Крайняя умственная затуманенность.
Немедленно обратитесь за неотложной помощью, если заметите любой из этих побочных эффектов. Еще лучше получить совет от врача, прежде чем принимать какие-либо продукты, содержащие значительное количество минерала.
Заключение Гидроксид алюминия реагирует как с основаниями, так и с кислотами. TiO 2 наночастицы имеют покрытие из гидроксида алюминия. У пациентов с особыми заболеваниями почек оксид алюминия снижает уровень фосфатов. Использование оксида алюминия препятствует усвоению организмом других веществ. Для будущего использования в этом отношении необходимы двухчасовые интервалы до и после приема гидроксида алюминия.
Для будущего использования в этом отношении необходимы двухчасовые интервалы до и после приема гидроксида алюминия.
A :Al(OH) 3 — химическая формула оксида алюминия. Катион алюминия Al 3 + и три аниона гидроксила
CO 3 -2 используются для изготовления молекулы. Поскольку ионы, как правило, имеют разные конфигурации, структура оксида алюминия зависит от извлечения из материала. Орторомбические или шестиугольные решетки составляют основную массу минеральных структур. Бокситы смешивают и растворяют в растворе гидроксида при температуре до 270 градусов Цельсия, чтобы получить химическую формулу оксида алюминия. В близком родстве с гидроксидом оксида алюминия гидроксид алюминия обладает как основными, так и кислотными характеристиками.
2. Что такое гель оксида алюминия?
Что такое гель оксида алюминия? A: Суспензия аморфного гидроксида алюминия известна как гель гидроксида алюминия. Гелевая форма минерала частично заменяет углерод. Наряду с некоторыми другими вкусами гель может также включать масло перечной мяты, глицерин, сорбит, сахарозу и сахарин. Кроме того, гель может иметь нужные пропорции нескольких антибактериальных веществ. Изжога, кислотное расстройство желудка и дискомфорт в желудке входят в число наиболее часто лечащихся заболеваний. По сравнению с таблетками или капсулами работает лучше. Гель создается путем осаждения этанольных растворов хлорида алюминия. Дополнительно включены первичные амины, такие как додециламин, пропиламин и октиламин. Они действуют как акцепторы протонов, позволяя происходить осаждению во время гидролиза.
3. Являются ли основания из гидроксида щелочного металла слабыми? A: Гидроксид алюминия представляет собой химическое соединение с молекулярной формулой Al(OH) 3 . Когда гидроксид (ОН) в гидроксиде алюминия взаимодействует с соляной кислотой, сильной кислотой, он может служить слабым основанием (HCl). Слабым основанием называют такое основание, которое распадается в растворе или частично диссоциирует.
Когда гидроксид (ОН) в гидроксиде алюминия взаимодействует с соляной кислотой, сильной кислотой, он может служить слабым основанием (HCl). Слабым основанием называют такое основание, которое распадается в растворе или частично диссоциирует.
Что такое гидроксид алюминия | Что это такое, особенности…
Темы
admin6 августа 2021Последнее обновление: 6 августа 2021
0 124 5 минут чтения
Гидроксид алюминия
Чтобы понять определение гидроксида алюминия, необходимо знать, что такое алюминий . Это тип металлического элемента , найденного в периодической таблице и представленного словом «Al». Это один из наиболее распространенных элементов, который можно найти в природе и в различных соединениях. Алюминий можно найти в виде гидроксида , который в то же время представляет собой наиболее стабильную форму, в которой этот металл можно найти при нормальных условиях.
Что такое гидроксид алюминия?
Гидроксид алюминия является одной из форм более стабильной , в которой можно найти алюминий . В природе его можно найти под названием минерала гиббсита , и он является основной частью боксита .
- Характеристики гидроксида алюминия
- Структура
- Формула
- Номенклатура
- Физические свойства гидроксида алюминия
- Химические свойства
- Получение
- Что это для
- Как это принимается
- Гидроксид .
- Гидроксид алюминия характеризуется тем, что полиморфен , и по этой причине его можно найти в четырех различных формах: гиббсит , нордстрандит , байерит и дойлеит .
- Гидроксид алюминия представляет собой неорганическое соединение , основным компонентом которого является алюминий.

- Это тип неорганической соли, которая используется в качестве антацида .
- Общеизвестно как магнезиальное молоко .
- Он широко используется у людей, страдающих изжогой , поскольку обладает способностью нейтрализовать кислоты.
- В качестве лекарства его можно найти в форме таблетки , жидкости, и жевательные таблетки .
Структура
Молекула алюминия образуется с помощью алюминиевой катион AL + 3 и Три Гидроксил Анионы CO3-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-2-113. Структура каркаса гидроксида алюминия всегда зависит от минерала, из которого он извлечен, поскольку ионы имеют различное расположение. Большая часть сети, которая является частью его структуры, относится к шестиугольный или орторомбический тип. Это гидроксид, который также имеет в своей структуре 1 атом алюминия , 3 атома кислорода атома и 3 атома водорода .
Это гидроксид, который также имеет в своей структуре 1 атом алюминия , 3 атома кислорода атома и 3 атома водорода .
Формула
Химическая формула гидроксида алюминия Al(OH) 3.
Номенклатура
Номенклатура гидроксида алюминия установлена следующим образом:0012 тригидроксид алюминия .
Физические свойства гидроксида алюминия
Среди его наиболее важных физических свойств следующие: плотность составляет 2,42 г/мл.

Chemical properties
Its Наиболее важными свойствами являются:
- Гидроксид алюминия представляет собой амфотерное соединение , это означает, что вещество имеет ряд основных или кислотных характеристик, и по этой причине гидроксид алюминия растворим в двух растворах: кислот или щелочей .
- Это электрический изолятор , то есть он не способен проводить электричество, а также обладает относительно высокой теплопроводностью.

- Когда он находится в своей кристаллической форме, он имеет большую твердость , что делает его пригодным в качестве абразива .
- Не растворяется в воде, но может растворяться в основаниях и кислоты .
- При длительном контакте с водой может образовываться гель и поглощать кислоты и углекислый газ в то же время.
Получение
Гидроксид алюминия можно, во-первых, свободно найти в природе в виде минерала гиббсита . Основным методом получения гидроксида алюминия является экстракция минерала боксита , для которого используется процесс, известный как 9.0012 Bayer , основной задачей которого является достижение разделения гидроксидов алюминия от бокситов , кремнезема , которые становятся нечистыми, и оксидов железа . Далее следует следующий процесс:
Далее следует следующий процесс:
- Добыча бокситов и обращение с ними
- Осаждение или разделение твердых веществ
- Создание раствора
- Охлаждение
- Извлечение NaOH
- Осаждение Al (OH) 3
- Калинация
- Производство AL 2 O 3
Что это для
Одним из основных использования алюминия. антациды , которые облегчают изжогу, расстройство желудка и расстройство желудка. Он очень полезен для пациентов, страдающих пептической язвой , эзофагитом , грыжей пищеводного отверстия диафрагмы и другими проблемами с желудком, потому что оказывает эффект, который нейтрализует кислоты , образующиеся в желудке.
Он также используется в качестве хелатора фосфатов в для контроля гиперфосфатемии (очень высокий уровень фосфатов в крови) как у людей, так и у животных. Осажденный , он включен в качестве адъюванта в вакцины , потому что ему удается правильно поглощать белки, предотвращая их осаждения или прилипания к стенкам флакона во время хранения.
Осажденный , он включен в качестве адъюванта в вакцины , потому что ему удается правильно поглощать белки, предотвращая их осаждения или прилипания к стенкам флакона во время хранения.
Его также можно использовать в качестве средства пожаротушения , поскольку он обладает способностью поглощать большое количество тепла и в то же время выделять водяной пар. Его огнестойкость делает его эффективным в качестве средства подавления дыма типа , в основном на полиэстере, этилене, акриле, эпоксидной смоле, резине и ПВХ.
Как принимать
Дозу для приема гидроксида алюминия в качестве лекарственного средства должен установить врач в зависимости от возраста, веса и состояния здоровья. Важно хорошо встряхните товар, если он находится в форме суспензии , и все указания на лекарство должны быть соблюдены в точности. So overall , not indicated in children who are under five and adults , the usual dose is one to two tablets three times a day, especially 20 minutes or a час после того, как было съедено продуктов . дополнительная доза также может быть показан в случае болевого кризиса . Если вы принимаете жевательные таблетки , хорошо разжевывайте их перед тем, как проглотить, а затем выпейте полный стакан воды.
So overall , not indicated in children who are under five and adults , the usual dose is one to two tablets three times a day, especially 20 minutes or a час после того, как было съедено продуктов . дополнительная доза также может быть показан в случае болевого кризиса . Если вы принимаете жевательные таблетки , хорошо разжевывайте их перед тем, как проглотить, а затем выпейте полный стакан воды.
Преимущества гидроксида алюминия
Преимущества, которые можно получить с помощью гидроксида алюминия, перечислены ниже:
- Это превосходный продукт, который регулирует желудочные кислоты , которые вызывают боль, дискомфорт и расстройство желудка.

- Хотя они регулируют выработку соляной кислоты в желудке, они не уменьшают ее и не влияют на нее.
- В некоторых случаях его также можно использовать в качестве слабительного .
Значение при беременности
На этапе беременности гидроксид алюминия может иметь большое значение для лечения женщин с серьезными проблемами изжогой и желудочно-пищеводным рефлюксом и изменением образа жизни беременной женщины не решают проблему. Примечательно, что, несмотря на то, что это важное лекарство, не рекомендуется его чрезмерное использование длительное .
Риски
Среди основных рисков, которые могут быть вызваны проглатыванием гидроксида алюминия, являются следующие:
- Это может быть достигнуто в настоящее время токсичность из алюминия у пациентов, страдающих почечной недостаточностью.

- Они могут вызывать низкий уровень фосфатов в крови (гипофосфатемия).
- Пациенты с сердечная недостаточность , цирроз , отек или почечная недостаточность следует соблюдать особую осторожность при использовании гидроксида алюминия.
- Пожилые люди Взрослые могут быть предрасположены к фекальной закупорке при использовании этого препарата.
- Может вызвать раздражение глаз при контакте с ними.
Читать Далее
Темы
24 сентября 2022 г.
Темы
27 сентября 2021
24 сентября 2022
Что такое лабораторный шпатель?
27 сентября 2021 г.
Молярная доля: как рассчитывается, примеры, упражнения
7 августа 2021 г.
Что такое неодим? Использование, характеристики, свойства и история
7 августа 2021 г.

 wikipedia.org/wiki/Aluminium_hydroxide
wikipedia.org/wiki/Aluminium_hydroxide