Бериллий. Магний.Щелочноземельные металлы | АЛХИМИК
Автор Jeremiah На чтение 13 мин Просмотров 645 Опубликовано
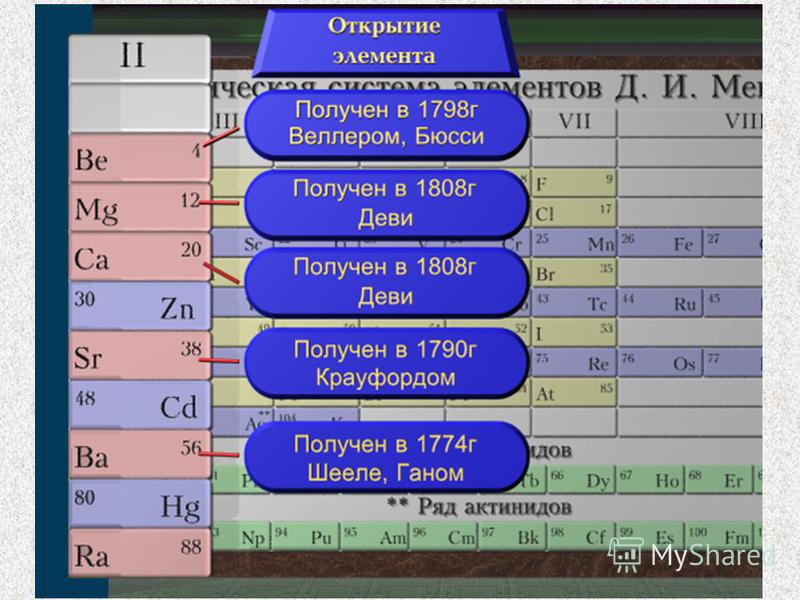
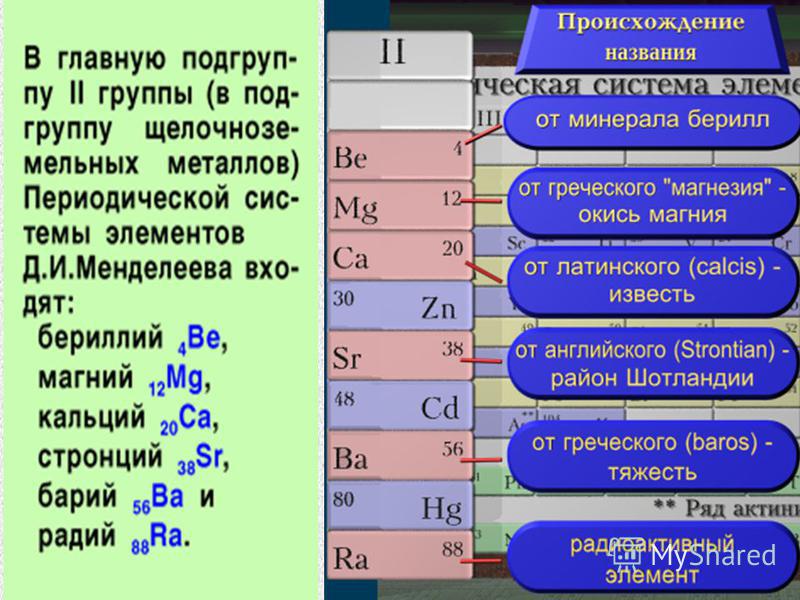
В главную подгруппу второй группы периодической системы элементов наряду с семейcтвом щёлочноземельных металлов (оно включает близкие по свойствам кальций, стронций, барий и радий) входят два типических элемента – бериллий и магний.
Если магний по свойствам во многом тяготеет к щёлочноземельным элементам, то бериллий стоит как бы особняком. Кажется, что он попал в эту группу, лишь подчиняясь правилу валентности, поскольку, как и другие элементы группы, в своих соединениях двухвалентен. По свойствам же бериллий гораздо ближе к алюминию, расположенному по диагонали от него в третьей группе. Химики так и говорят: диагональное сходство двух элементов. Причём сходство настолько сильное, что и встречаются эти элементы часто вместе, в одном соединении.
Содержание
Бериллий (Beryllium)БериллийМногие минералы бериллия – берилл 3BeO∙Al2O3∙6SiO2, хризоберилл BeAl2O4 и их разновидности (изумруд, аквамарин, александрит) – известны очень давно; эти драгоценные камни упоминаются в произведениях античных авторов. На Руси берилл называли вируллионом, под таким именем он встречается в Изборнике Святослава (1073 г.). Ученые заинтересовались бериллом лишь в конце XVIII в. Французский химик Луи Никола Воклен установил, что в состав этого минерала входит новая «земля» (так в старину называли некоторые оксиды металлов), отличная от алюмины – оксида алюминия. Он же впервые получил ее соли – соли бериллия. Они оказались сладкими на вкус, поэтому новой земле Воклен дал имя глицина (от греч. «гликис» — «сладкий»), а элементу – глициний. Это название употреблялось во Франции вплоть до XIX в., пока немецкий химик Мартин Генрих Клапрот не добился переименования его в бериллий (Berillium) – в честь минерала берилла.
В виде простого вещества бериллий получили в 1828 г. немецкий ученый Фридрих Вёлер и французский химик Антуан Бюсси. Они действовали калием на безводный хлорид бериллия: BeCl2 + 2K = Be + 2KCl. В настоящее время бериллий получают, восстанавливая его фторид магнием: BeF2 + Mg = Be + MgF2, либо электролизом расплава смеси хлоридов бериллия и натрия. Исходные соли бериллия выделяют при переработке бериллиевой руды.
БериллБериллий — тугоплавкий металл(tпл= 1287 ̊ С) светло-серого цвета, покрытый тончайшей пленкой оксида, которая защищает его от коррозии. Для него характерно уникальное в мире металлов сочетание легкости с высокой твердостью. Чистый бериллий пластичен, однако даже незначительные примеси делают его хрупким.
Обладая высокой химической активностью, бериллий легко вступает в реакции с галогенами, серой и азотом. Вода на него не действует, зато он легко растворяется как в разбавленных кислотах: Be + 2HCl = BeCl2 + H2↑, так и в растворах щелочей: Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2↑ Образующийся тетрагидроксобериллат натрия долгое время рассматривали как соль бериллиевой кислоты H2BeO2. На самом деле это комплексное соединение. Бериллаты более простого состава образуются при сплавлении оксида бериллия со щелочью или содой: Na2CO3 + BeO = Na2BeO2 + CO2↑. Здесь также проявляется сходство с алюминием.
На самом деле это комплексное соединение. Бериллаты более простого состава образуются при сплавлении оксида бериллия со щелочью или содой: Na2CO3 + BeO = Na2BeO2 + CO2↑. Здесь также проявляется сходство с алюминием.
Бериллий и его растворимые в воде соли ядовиты. Даже ничтожно малая их примесь в воздухе приводит к тяжелым заболеваниям. Несмотря на это, бериллий находит широкое применение в технике. Ещё в XIX в. обнаружили, что добавка Ве к меди сильно повышает ее твердость, прочность, химическую стойкость, делает ее похожей на сталь. Сплавы на основе меди, содержащие от 0,005 до 3% бериллия, получили название бериллиевых бронз. Из них изготовляют пружины, рессоры, подшипники, наиболее ответственные узлы машин и механизмов. В качестве легирующей добавки, значительно усиливающей прочность, бериллий вводят в состав сталей и некоторых других сплавов.
Основной потребитель бериллия – атомная энергетика, поскольку он обладает способностью отражать и замедлять нейтроны, образующиеся в ядерном реакторе. Отражатели нейтронов из бериллия отличаются высокой прочностью, химической стойкостью и легкостью. Потребность в этом металле и его добыча возрастает с каджым годом.
Отражатели нейтронов из бериллия отличаются высокой прочностью, химической стойкостью и легкостью. Потребность в этом металле и его добыча возрастает с каджым годом.
Магний весьма распространен в природе. В больших количествах он встречается в виде карбоната магния, образуя минералы магнезит MgCO3 и доломит MgCO3∙CaCO3. Сульфат и хлорид магния входят в состав калийных минералов – каинита KCl∙MgSO4∙3H2O и карналлита KCl∙MgCl2∙6H2O. Ион Mg2+ содержится в морской воде, придавая ей горький вкус. Общее количество магния в земной коре составляет около 2%.
Магний был открыт при анализе воды, взятой из минерального источника вблизи города Эпсом в Англии. Горькая на вкус, она привлекла внимание исследователей в конце XVII в. При упаривании такой воды на стенках сосуда образовалась белая корка вещества, которое назвали горькой, или эпсомской, солью MgSO4∙7H2O. Её использовали в качестве слабительного. Примерно в то же время учёные заинтересовались и белой магнезией – карбонатом магния MgCO3. При его нагревании образуется жженая магнезия – оксид MgO. Это вещество А.Л.Лавуазье ошибочно причислил к простым телам, которые уже не могут быть далее разложены.
Её использовали в качестве слабительного. Примерно в то же время учёные заинтересовались и белой магнезией – карбонатом магния MgCO3. При его нагревании образуется жженая магнезия – оксид MgO. Это вещество А.Л.Лавуазье ошибочно причислил к простым телам, которые уже не могут быть далее разложены.
Впервые магний был получен в 1808 г. Г.Дэви при электролизе влажной жжёной магнезии. По его предложению, элемент вначале назвали Magnium – чтобы подчеркнуть связь с магнезией и в то же время отличать его от марганца, который тогда называли Manganesium. Позже магний переименовали в Magnesium, а марганец — в Manganum. Однако в русском языке сохранилось первоначальное название элемента.
КаинитВ некотором смысле магний – противоположность бериллию. Он достаточно мягкий и пластичный, плавится при более низкой температуре (650̊ С). Но, как и бериллий, он обладает заметной химической активностью. На воздухе стружка магния сгорает с ослепительной вспышкой с образованием белого порошка – смеси оксида и нитрида:2Mg + O2 = 2MgO; 3Mg + N2 = Mg3N2. Недаром магниевую ленту фотографы использовали как фотовспышку.
Недаром магниевую ленту фотографы использовали как фотовспышку.
При комнатной температуре магний, покрытый тончайшей пленкой оксида, достаточно инертен и не взаимодействует с водой. Лишь при кипячении он медленно восстанавливает воду с образованием белой взвеси гидроксида магния и выделением водорода: Mg + 2H2O = Mg(OH)2↓ + H2↑.
Магний легко взаимодействует не только с разбавленными кислотами, но и с раствором хлорида аммония, в котором из-за гидролиза этой соли присутствуют ионы Н+: Mg + 2NH4Cl = MgCl2 + 2NH3 + H2. В отличие от бериллия, со щелочами он не реагирует.
Магний — сильный восстановитель. Смеси его со многими окислителями, например пероксидом бария ВаО2, используют в пиротехнике. При поджигании такая смесь сгорает ярким зеленоватым пламенем:BaO2 + Mg = MgO + BaO. Магний присутствует в животных и растительных организмах. В теле человека его в среднем 19 г. Особенно он необходим растениям, так как является составной частью хлорофилла.
Особенно он необходим растениям, так как является составной частью хлорофилла.
В технике магний применяется главным образом в виде сплавов с алюминием – магналия и электрона. Магналий содержит от 5 до 30% магния, а электрон помимо алюминия включает также, цинк, марганец, медь. Эти сплавы очень прочные и намного тверже чистых алюминия и магния, легко обрабатываются и полируются. Их используют в автомобильной промышленности, авиационной и ракетной технике. Некоторые соединения магния нашли применение в медицине: оксид магния служит средством понижения кислотности желудка, а кристаллогидрат сульфата магния – слабительным.
Щелочноземельные элементыКальцийК семейству щелочноземельных элементов относятся кальций, стронций, барий и радий. Д.И.Менделеев включал в это семейство и магний. Щелочноземельными они называются потому, что их гидроксиды, подобно гидроксидам щелочных металлов, растворимы в воде, т.е. являются щелочами.
Название «кальций» происходит от латинского calx – «известь». Так алхимики называли продукты обжига различных веществ. Древние римляне использовали известь для приготовления строительных растворов. Для этого мрамор или известняк подвергали обжигу, получая негашеную известь (оксид кальция). Производство этого вещества описал еще Плиний Старший в «Естественной истории».
Так алхимики называли продукты обжига различных веществ. Древние римляне использовали известь для приготовления строительных растворов. Для этого мрамор или известняк подвергали обжигу, получая негашеную известь (оксид кальция). Производство этого вещества описал еще Плиний Старший в «Естественной истории».
По распространенности в земной коре кальций занимает пятое место (4,1% по массе), уступая лишь кислороду, кремнию, алюминию и железу. В природе он встречается в виде гипса CaSO4∙2H2O, флюорита CaF2, апатита Ca5(PO4)3(OH) и кальцита CaCO3(карбоната кальция, образующего залежи мела, мрамора и известняка). Кальцит сформировался из панцирей древних простейших и моллюсков (кораллов), поэтому неудивительно, что иногда в известняках находят ракушки или отпечатки животных.
ГипсВ организме человека содержится в среднем около 1 кг кальция, который в форме ортофосфата входит в состав костной ткани. Почти 80% потребности в этом элементе удовлетворяется за счёт молочных продуктов. В них кальций присутствует в виде солей фосфорной и лимонной кислот. В литре молока или кефира как раз и содержится средняя суточная норма – 1,2 г кальция. При его недостатке в организме врачи назначают его препараты, например глюконат кальция.
В них кальций присутствует в виде солей фосфорной и лимонной кислот. В литре молока или кефира как раз и содержится средняя суточная норма – 1,2 г кальция. При его недостатке в организме врачи назначают его препараты, например глюконат кальция.
Металлический кальций был впервые получен Г.Дэви в 1808 г. при электролизе смеси влажной гашенной извести Са(ОН)2 с оксидом ртути HgO.
Стронций и барий распространены в природе значительно меньше, чем кальций. Стронций встречается в виде минерала целестина (от лат. caelestis – «небесный») – сульфата стронция SrSO4, образующего красивые розово-красные или бледно-голубые кристаллы, а барий – в виде барита (тяжелого шпата) BaSO4.
Стронций получил название от шотландской деревни Стронциан, близ которой в конце XVIII в. был найден редкий минерал стронцианит SrCO3.
СтронцийГодом открытия бария можно считать 1774 г., когда шведский химик Карл Вильгельм Шееле и его ученик Юхан Готлиб Ган установили, что в тяжелом шпате содержится новая земля. Она получила название «барит» (от греч. «барис» — «тяжелый»), а образующий ее элемент – «барий». В виде простых веществ барий и стронций были выделены Г.Дэви в 1808 г.
Она получила название «барит» (от греч. «барис» — «тяжелый»), а образующий ее элемент – «барий». В виде простых веществ барий и стронций были выделены Г.Дэви в 1808 г.
С пищей и питьевой водой человек ежедневно получает около 15-20 мг стронция. В большом количестве соединения этого элемента вредны для здоровья. Ионы стронция способны замещать в костях ионы кальция, что приводит к болезням.
Растворимые соединения бария еще более токсичны. Симптомы отравления ими появляются при приёме внутрь примерно 0,2 г растворимой соли. А доза 0,8-0,9 г уже смертельна. В случае отравления надо принимать 10-процентный раствор сульфата натрия или магния. При этом в организме образуется сульфат бария – нерастворимый и потому безопасный.
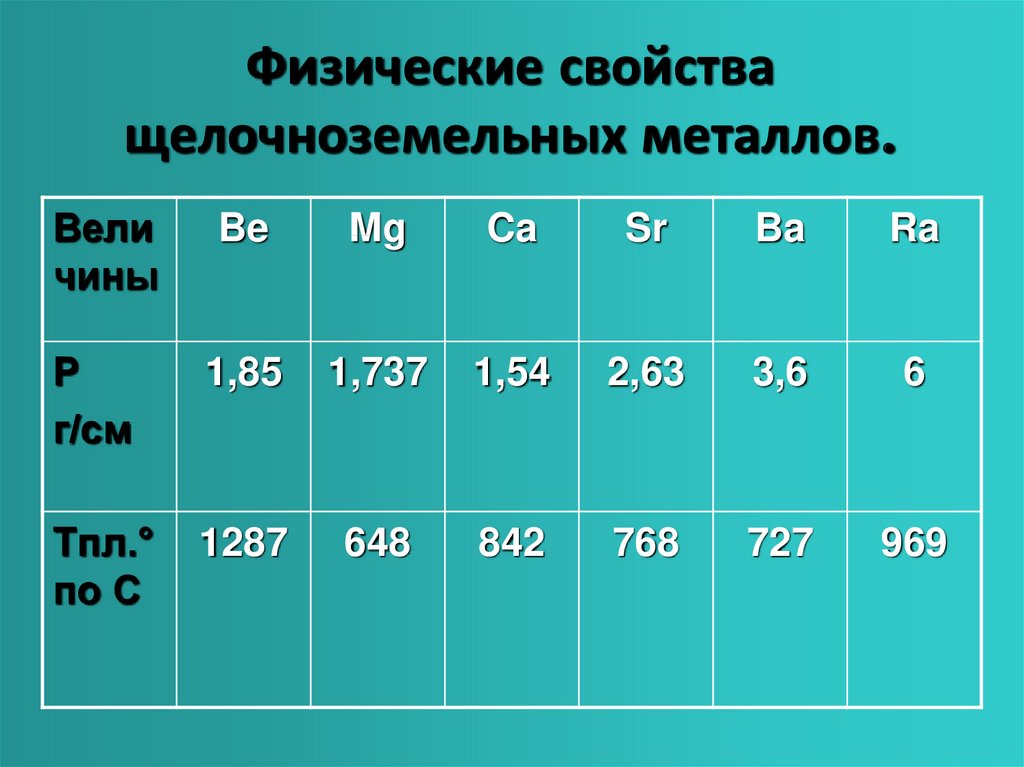
Кальций (tпл = 839̊ С), стронций (tпл = 768 ̊С) и барий (tпл = 727 ̊С) – пластичные металлы серебристо – белого цвета. Из-за недостаточной твёрдости их невозможно резать ножом, как натрий и калий.
Минерал целестинЩёлочноземельные металлы по химической активности уступают лишь щелочным.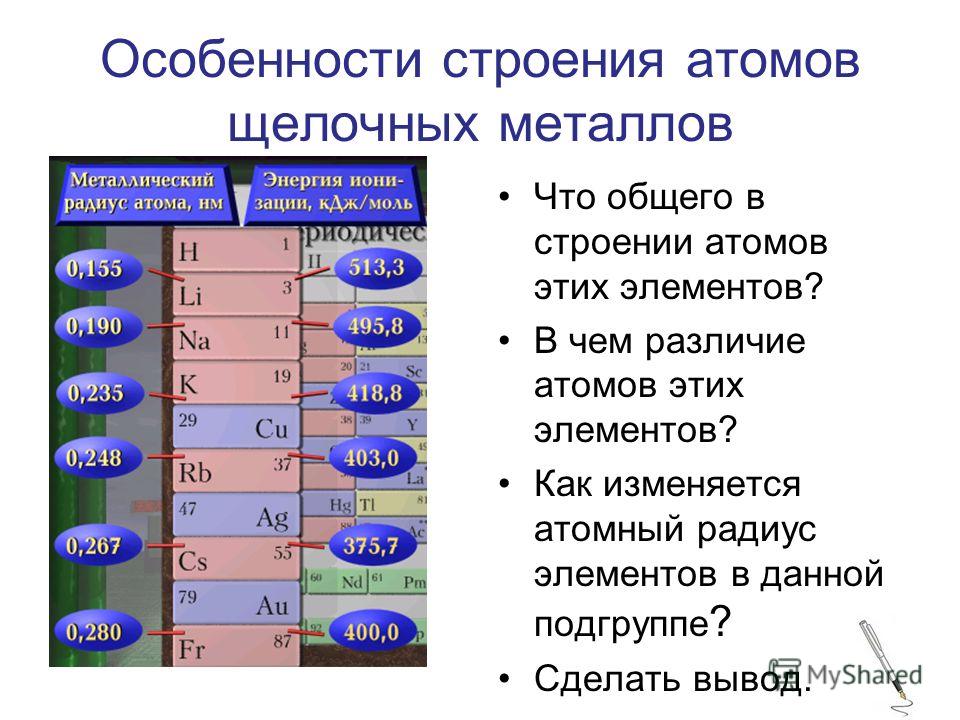 Они взаимодействуют с водой и растворами кислот с выделением водорода.
Они взаимодействуют с водой и растворами кислот с выделением водорода.
Если оксид бария выдерживать в атмосфере кислорода или на воздухе при температуре 500 ̊С то реакция будет протекать дальше:2Ва + О2 = 2ВаО2
Образовавшийся пероксид бария при 700 ̊С отщепляет избыточный кислород, вновь переходя в оксид. Щёлочноземельные металлы выделяют либо алюмотермией: 4CaO + 2Al = CaAl2O4 + 3Ca, либо электролизом расплавов хлоридов. Практическое значение из них имеет в основном кальций – он используется в металлургии в качестве раскислителя. Соединения кальция, стронция и бария применяются в разных отраслях промышленности, в строительстве.
Соединения стронция используются в производстве осветительных ракет, химического и термически устойчивого стекла. Оксид стронция входит в состав эмалей для защиты металлических предметов, а также служит катализатором при переработке нефти.
БарийОчень полезным веществом оказался сульфат бария. В конце XIX в. им разбавляли дорогие свинцовые белила, а ныне на основе BaSO4 разработана белая краска литопон, обладающая высокой кроющей способностью, что снижает ее расход. Сульфат бария также добавляют в бумагу дорогих сортов (для денежных знаков, документов).
им разбавляли дорогие свинцовые белила, а ныне на основе BaSO4 разработана белая краска литопон, обладающая высокой кроющей способностью, что снижает ее расход. Сульфат бария также добавляют в бумагу дорогих сортов (для денежных знаков, документов).
Как и другие элементы с высоким порядковым номером, барий способен поглощать рентгеновское излучение. Поэтому BaSO4 используется при изготовлении защитных материалов для рентгеновских установок и при диагностике заболеваний желудочно-кишечного тракта.
РадийПоследним из щёлочноземельных металлов был открыт радий, для которого ещё Д.И.Менделеев выделил клетку в периодической системе. Радий обнаружили в 1898 г. в урановой смоляной руде. Исследовавшие минерал супруги Пьер и Мария Кюри установили: некоторые образцы руды имеют большую радиоактивность, чем следовало ожидать, судя по количеству содержащегося в них урана. Учёные сделали вывод, что в состав урановой руды входит новый элемент, по радиоактивности превосходящий уран.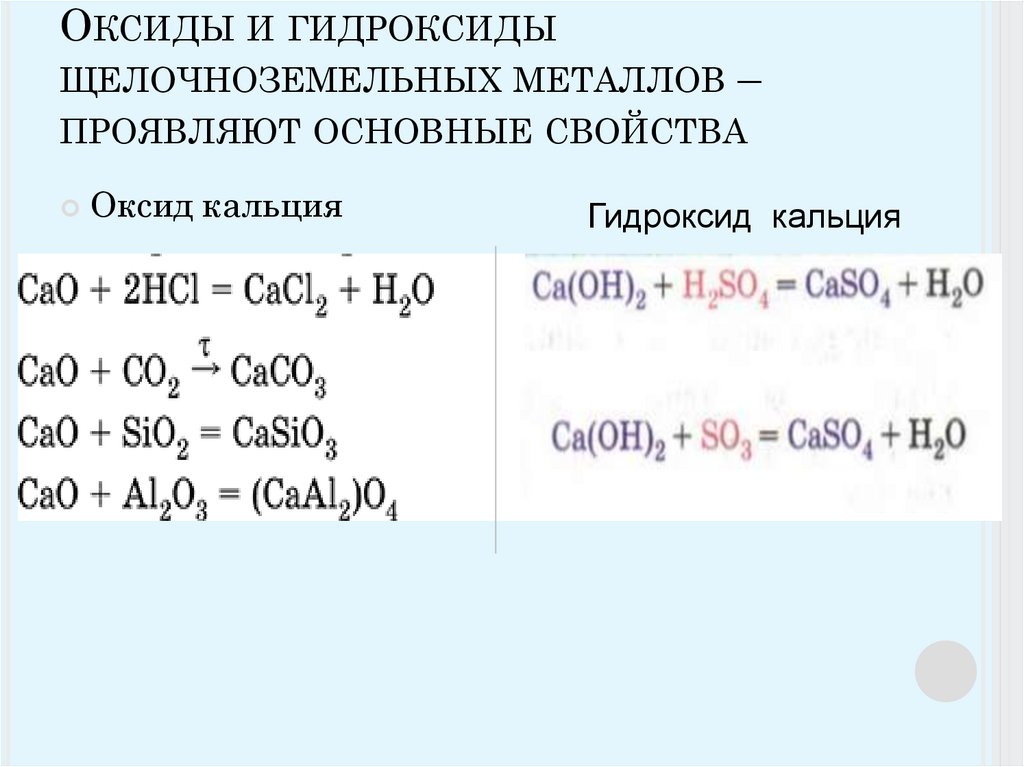 Вскоре удалось выделить его соединение. Элемент назвали радием, чтобы подчеркнуть его способность к радиоактивному распаду. Переработав почти тонну урановой руды, супруги Кюри выделили около 0,1 г соли радия, а металлический радий был получен в 1910 г. при электролизе раствора хлорида радия с ртутным катодом. Радий представляет собой тяжелый и тугоплавкий металл серебристо-белого цвета. В свободном виде он, как и другие щелочноземельные металлы, обладает высокой химической активностью, энергично реагирует с водой с выделением водорода: Ra + 2H2O = Ra(OH)2 + H2↑.Образующийся при этом гидроксид радия – сильное основание, хорошо растворимое в воде. При действии на него раствором сульфата натрия выпадает белый осадок сульфата радия, нерастворимый в кислотах.
Вскоре удалось выделить его соединение. Элемент назвали радием, чтобы подчеркнуть его способность к радиоактивному распаду. Переработав почти тонну урановой руды, супруги Кюри выделили около 0,1 г соли радия, а металлический радий был получен в 1910 г. при электролизе раствора хлорида радия с ртутным катодом. Радий представляет собой тяжелый и тугоплавкий металл серебристо-белого цвета. В свободном виде он, как и другие щелочноземельные металлы, обладает высокой химической активностью, энергично реагирует с водой с выделением водорода: Ra + 2H2O = Ra(OH)2 + H2↑.Образующийся при этом гидроксид радия – сильное основание, хорошо растворимое в воде. При действии на него раствором сульфата натрия выпадает белый осадок сульфата радия, нерастворимый в кислотах.
По химическим свойствам щелочноземельные металлы очень похожи на щелочные металлы, а магний имеет существенные отличия.
Во всех реакция магний и щелочноземельные металлы играют роль восстановителей и окисляются с образованием различных ионных соединений, содержащих ионы этих металлов с зарядом +2.
Щелочноземельные металлы уже при обычных условиях окисляются кислородом воздуха, а магний сгорает на воздухе при нагревании до 600 ̊ С; в результате образуются оксиды:
2Ca + O2 = 2CaO; 2Mg + O2 = 2MgO
Все рассматриваемые металлы при определенных условиях взаимодействуют с галогенами, серой, азотом, водородом:
Ca + Cl2 = CaCl2 Mg + Cl2 = MgCl2
Ca + S = CaS Mg + S = MgS
3Ca + N2 = Ca3N2 3Mg + N2 = Mg3N2
Ca + H2 = CaH2 Mg + H2 = MgH2
Щелочноземельные металлы активно реагируют с водой, а магний реагирует только с кипящей водой:
Реакция кальция с водойCa + 2H2O = Ca(OH)2 + H2↑
Mg + 2H2O = Mg(OH)2 + H2↑
Щелочноземельные металлы и магний энергично вытесняют водород из кислот:
Ca + 2HCl = CaCl2 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Тема 14.
 Бериллий, магний и щёлочноземельные металлы.
Бериллий, магний и щёлочноземельные металлы.Часть I
1. Заполните таблицу «Изменение свойств щёлочноземельных металлов».
2. Схема химической связи для металлов IIA группы (М):
3. Общие химические свойства (для щёлочноземельных металлов — М).
Рассмотрим ОВР.
4. BeO и Be(OH)2 относят к амфотерным соединениям. Запишите уравнения реакций, подтверждающих это, в молекулярной, полной и сокращённой ионной формах.
5. Подобно щелочным, щёлочноземельные металлы образуют гидриды с общей формулой МН2:
— это соединение с ионной кристаллической решёткой;
— образованы за счёт ионной химической связи, схема которой:
— по физическим свойствам эти вещества твёрдые, белые, растворимые в воде.
— взаимодействуют с водой (рассмотрите ОВР).
Часть II
1. Заполните таблицу «Применение кальция и магния».
Заполните таблицу «Применение кальция и магния».
2. Дополните цепочку переходов. Составьте уравнения реакций, с помощью которых можно осуществить превращения по схеме:
Первую и пятую реакции рассмотрите с позиций окисления-восстановления, остальные – в свете ТЭД. Для перехода Ca→Ca(NO3)2 предложите два варианта.
3. Проанализируйте рисунок «Взаимодействие щёлочноземельных металлов с водой». Подпишите химические формулы металлов. Объясните причину различной скорости реакций.
Скорость реакции увеличивается с активностью металла.
4. Укажите, в какой из пробирок отображено взаимодействие лития с водой, а в какой – кальция с водой.
Ответ поясните: Литий легче воды, всплывает и окисляется на поверхности.
5. Какой объём водорода образуется при взаимодействии с 0,5 л воды 20 г кальция, содержащего 5% примесей? Рассчитайте массовую долю щёлочи в полученном растворе.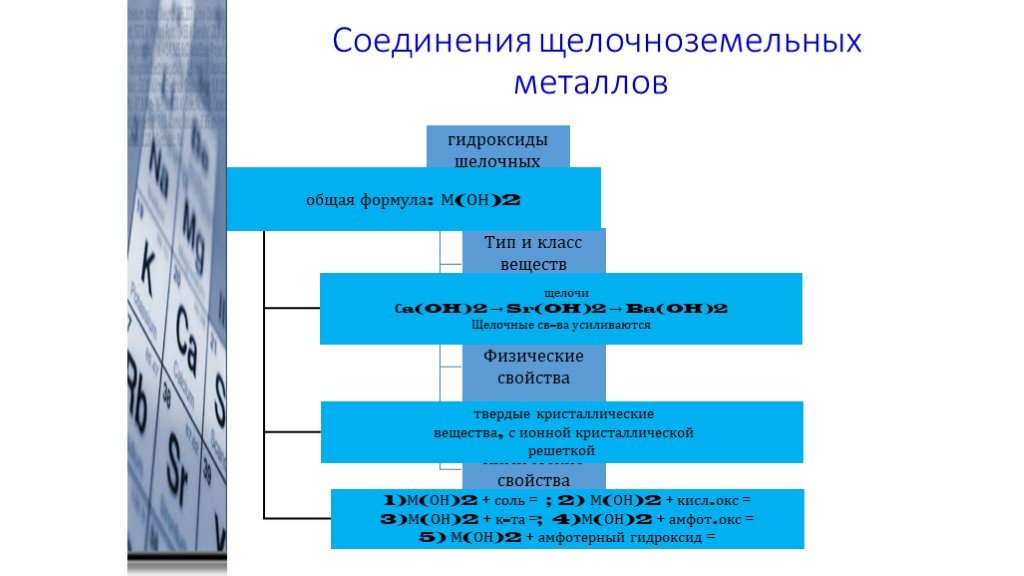
6. Придумайте и решите задачу, аналогичную предыдущей, чтобы в условии фигурировал гидрид кальция.
Гидрид кальция массой 42 г вступил в реакцию с водой, массой 200 г. Найти w%(Ca(OH)2) и V(h3), если w%(прим. в Ca h3)=10%.
7. Подготовьте небольшое сообщение об одном из щёлочноземельных металлов, используя Интернет и другие источники информации.
Составьте план или запишите тезисы сообщения в особой тетради.Бериллий.
Открыт в 1798 г. французским химиком Луи Никола Вокленом, который назвал его глицинием. Современное название элемент получил по предложению химиков немца Клапрота и шведа Экеберга. В свободном виде бериллий был выделен в 1828 году французским химиком Бюсси и независимо от него немецким химиком Велером.
Известно более 30 собственно бериллиевых минералов, но промышленное значение имеет в основном берилл.
Разновидности берилла считаются драгоценными камнями: аквамарин, изумруд, гелиодор. Известны другие разновидности берилла, различающиеся окраской (темно-синие, розовые, красные, бледно-голубые, зеленые, бесцветные и др.). Цвет бериллу придают примеси.
Известны другие разновидности берилла, различающиеся окраской (темно-синие, розовые, красные, бледно-голубые, зеленые, бесцветные и др.). Цвет бериллу придают примеси.
Бериллий — относительно твердый, но хрупкий металл серебристо-белого цвета. Один из самых твердых металлов в чистом виде (уступает только осмию, вольфраму и урану). На воздухе покрывается стойкой оксидной пленкой. В бериллии очень хорошо распространяются звуковые волны — 12600 м/с.
Применяется в различных отраслях промышленности и народного хозяйства:
• Рентгенотехника
• Ядерная энергетика
• Лазерные материалы
• Аэрокосмическая техника
• Ракетное топливо
• Огнеупорные материалы
Бериллий ядовит: летучие (и растворимые) соединения бериллия, в том числе и пыль, содержащая соединения бериллия, высокотоксичные. Бериллий обладает ярко выраженным аллергическим и канцерогенным действием. Вдыхание атмосферного воздуха, содержащего бериллий, приводит к тяжелому заболеванию органов дыхания — бериллиозу.
Элементы группы 2: щелочноземельные металлы
Бериллий, магний, кальций, барий, стронций и радий являются щелочноземельными металлами группы 2, которые представляют собой мягкие серебряные металлы с меньшим металлическим качеством, чем щелочные металлы группы 1. Хотя более тяжелые металлы, такие как Ca, Sr, Ba и Ra, имеют много общих черт с щелочными металлами группы 1, они практически так же реакционноспособны. Валентные оболочки всех элементов группы 2 имеют два электрона, что дает им степень окисления +2.
Элементы группы 2: щелочноземельные металлы
Щелочноземельные металлы представляют собой набор из шести химических элементов 2-й группы периодической таблицы. Бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra) являются вовлеченными элементами (Ra). При стандартной температуре и давлении элементы имеют очень похожие свойства: все они блестящие, серебристо-белые и умеренно реактивные металлы. Все известные щелочноземельные металлы встречаются в природе, хотя радий встречается только как побочный продукт распада урана и тория, а не как первичный элемент.
Поскольку валентные оболочки щелочноземельных металлов имеют полностью заполненную s-орбиталь, они быстро теряют два электрона, образуя катионы с зарядом +2. В результате наиболее распространенная степень окисления щелочноземельных металлов +2. Они также известны как металлы второй группы, так как они находятся во втором столбце периодической таблицы.
Общая электронная конфигурация этих элементов нс 2 .
Физические свойства щелочноземельных металлов
- Атомный и ионный радиусы
Как ионный, так и атомный радиусы уменьшаются вниз по столбцу таблицы Менделеева из-за заряда и добавления электрона на тот же энергетический уровень, что делает их меньше, чем щелочные металлы, и больше, чем другие атомы тот же период. В щелочноземельных элементах оба s-электрона могут быть потеряны, что делает их дважды положительными катионами. Радиус катионного атома меньше, чем у нейтрального атома. Ионные радиусы продолжают расти по мере продвижения вниз по колонке.
Ионные радиусы продолжают расти по мере продвижения вниз по колонке.
BE +2 ˂ MG +2 ˂ CA +2 ˂ SR +2 ˂ BA +2
- ПЛОТА 9003
- ПЛОТА 9 9003
- . , объем атомов также меньше. Кроме того, атомы имеют более прочную металлическую связь из-за наличия двух валентных электронов. Таким образом, щелочноземельные металлы плотнее и жестче, чем щелочные металлы. Плотность щелочноземельных металлов обычно увеличивается от магния к радию, при этом кальций имеет наименьшую плотность.
- Энергия ионизации
Щелочноземельные элементы могут передавать оба своих валентных электрона, образуя октетную конфигурацию благородного газа. В результате они имеют две энергии ионизации:
Первая энергия ионизации щелочноземельных металлов – это энергия, необходимая для отрыва первого электрона от нейтрального атома.
 Он больше, чем атом щелочного металла, из-за меньших радиусов и того, что электроны прочно удерживаются более высоким ядерным зарядом, а также из-за того, что электроны удаляются из полностью заполненной и поэтому стабильной подоболочки.
Он больше, чем атом щелочного металла, из-за меньших радиусов и того, что электроны прочно удерживаются более высоким ядерным зарядом, а также из-за того, что электроны удаляются из полностью заполненной и поэтому стабильной подоболочки.Вторая энергия ионизации, необходимая для второго электрона от катиона в щелочноземельных металлах, будет выше, чем первая энергия ионизации атома, но ниже, чем вторая энергия ионизации любого щелочного металла. Несмотря на большую энергию ионизации, оба электрона могут быть удалены, потому что атом принимает конфигурацию благородного газа, а меньший размер и более высокий заряд помогают преодолеть более высокую энергию ионизации за счет создания более высокой энергии решетки из-за плотной упаковки атомов или ионов в твердых телах. Кроме того, из-за большей сольватации жидкости имеют более высокую энергию гидратации.
- Растворимость
Ион бериллия является наиболее водорастворимым ионом щелочноземельного металла, и его растворимость уменьшается с увеличением размера, что делает ион бария наименее растворимым в воде.
 На растворимость вещества в воде влияют его ионный состав и размер. Меньшие ионы имеют более высокую плотность заряда и могут быть растворены большим количеством молекул воды. Это увеличивает энтальпию гидратации и делает гидратированные ионы более стабильными.
На растворимость вещества в воде влияют его ионный состав и размер. Меньшие ионы имеют более высокую плотность заряда и могут быть растворены большим количеством молекул воды. Это увеличивает энтальпию гидратации и делает гидратированные ионы более стабильными.Растворимость Be +2 > Растворимость MG +2 > Растворимость CA +2 > Растворимость SR +2 > Растворимость BA +2
- Реактивность
- ENERGIVELICAITION
- ION ENERCEITIONSIRISIASION
- . пропорциональна восстановительной способности. Прогнозируется, что от бериллия к барию восстановительная характеристика будет расти по мере снижения энергии ионизации вдоль столба. От бериллия к барию восстановительный потенциал падает, что указывает на увеличение восстановительной способности. Щелочноземельные металлы являются более слабыми восстановителями, чем щелочные металлы, из-за их более высокой энергии ионизации.

- Температуры плавления и кипения
Температуры плавления и кипения щелочноземельных металлов выше, чем у щелочных металлов из-за их меньшего размера и сильной металлической связи в плотно упакованной структуре. За исключением магния, температуры плавления и кипения щелочноземельных металлов падают в порядке от бериллия к барию.
Химические свойства щелочноземельных металлов
- Гидриды
Бериллий не реагирует сразу с водородом. Восстановление хлорида бериллия алюмогидридом лития дает гидрид бериллия. Бериллий и магний образуют ковалентные гидриды, в которых два атома металла связаны с каждым водородом. Банановая связь является примером молекулы с тремя центрами, имеющими всего два электрона.
- Реакция с водой
Даже при более высоких температурах бериллий не реагирует с водой. Магний образует гидроксиды и выделяет водород только при взаимодействии с горячей водой.
 Магний получает защитную оболочку из своего оксида, которая защищает его от дальнейшего воздействия молекул воды. Другие щелочноземельные металлы выделяют водород при взаимодействии даже с холодной водой.
Магний получает защитную оболочку из своего оксида, которая защищает его от дальнейшего воздействия молекул воды. Другие щелочноземельные металлы выделяют водород при взаимодействии даже с холодной водой.- Сульфаты
В отличие от сульфатов щелочных металлов сульфат бериллия растворим в воде. Энергия гидратации сульфата бериллия увеличивается по мере уменьшения его размера и плотности заряда, что приводит к увеличению растворимости. Растворимость других сульфатов падает от BeSO 4 в BaSO 4 , когда энергия решетки увеличивается, а энергия гидратации уменьшается (из-за увеличения размера).
Аномальное поведение бериллия
Из-за своего небольшого размера, наивысшей энергии ионизации, высокой электроположительной природы и наибольшей поляризующей природы бериллий имеет более сильный ковалентный характер. Характеристики бериллия отличают его от других щелочноземельных металлов.

- Среди щелочноземельных металлов это самый твердый.
- Даже при очень высоких температурах не вступает в реакцию с водой.
- Бериллий имеет самые высокие температуры плавления и кипения.
- Не образует гидридов при контакте с водородом.
- Из-за более высокого электродного потенциала он не выделяет водород из кислоты, как другие щелочноземельные металлы. Концентрированная азотная кислота образует оксидный слой, который делает ее неактивной.
- Оксид и гидроксид амфотерного бериллия Образует соли при растворении в кислотах и бериллат при растворении в основаниях.
- Бериллий образует карбид с определенной формулой, когда он реагирует с водой, давая метан, а не ацетилен, как другие металлы.
- Нитрид бериллия является горючим материалом.
- Не реагирует с азотом и кислородом воздуха.
Примеры вопросовДиагональное соотношение бериллия с алюминием
- Оба не подвержены влиянию кислорода и азота окружающей среды.

- Даже при высоких температурах ни один из них не вступает в реакцию с водой.
- Не выпускают водород из кислоты. Они становятся пассивными после обработки сильной азотной кислотой.
- Оба производят поливалентные гидриды с ковалентными мостиками.
- Оба имеют поливалентные мостиковые галогениды с низкой температурой плавления. Кислоты Льюиса являются галогенидами.
- Оба нитрида гидролизуются водой с выделением аммиака.
- Оксиды и гидроксиды Be и Al являются амфотерными. В результате они реагируют как с кислотой, так и с основанием.
- Оба производят карбид, который гидролизуется с образованием метана.
- Карбонаты алюминия и бериллия нестабильны.
Вопрос 1: Назовите элементы, которые называются щелочноземельными металлами?
Ответ:
Бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra) являются щелочноземельными металлами (Ra).

Вопрос 2. Почему щелочноземельные металлы тверже щелочных металлов?
Ответ:
Поскольку радиус атомов меньше, объем атомов также меньше. Кроме того, атомы имеют более прочную металлическую связь из-за наличия двух валентных электронов. В результате щелочноземельные металлы плотнее и жестче, чем щелочные металлы.
Вопрос 3. Почему температура плавления и кипения щелочноземельных металлов выше, чем у щелочных металлов?
Ответ:
Температуры плавления и кипения щелочноземельных металлов выше, чем щелочных, из-за их меньшего размера и сильной металлической связи в плотноупакованной структуре.
Вопрос 4. Как щелочноземельные металлы реагируют с водой?
Ответ:
Даже при более высоких температурах бериллий не вступает в реакцию с водой.
 Магний реагирует только с горячей водой, образуя гидроксиды и выделяя водород. Магний получает защитный слой оксида, который предотвращает дальнейшее воздействие молекул воды. Другие щелочноземельные металлы выделяют водород при взаимодействии даже с холодной водой.
Магний реагирует только с горячей водой, образуя гидроксиды и выделяя водород. Магний получает защитный слой оксида, который предотвращает дальнейшее воздействие молекул воды. Другие щелочноземельные металлы выделяют водород при взаимодействии даже с холодной водой.Вопрос 5. Что такое банановая облигация?
Ответ:
Бериллий и магний образуют ковалентные гидриды, в которых каждый водород связан с двумя атомами металла. Это известно как банановая связь.
Группа 2: элементы, периодическая таблица, свойства
В 2020 году космический телескоп Спитцер был выведен из эксплуатации НАСА после 17 лет службы. Он наблюдал за инфракрасной активностью Вселенной, что дало нам уникальную возможность заглянуть в ранее скрытые области космоса. В нем были инструменты, которые могли обнаруживать длины волн от 3,6 мкм до 160 мкм в длину, и использовалось зеркало диаметром почти 1 метр для фокусировки и отражения света.
 Это зеркало было охлаждено до холодных 5,5 К — это -268 °С!
Это зеркало было охлаждено до холодных 5,5 К — это -268 °С!Но это не причина нашего интереса. Нет, нас больше волнует, из чего он построен. Зеркало было изготовлено из бериллия , примера элемента группы 2 .
- Эта статья о группе 2 в неорганической химии.
- Мы начнем с обзора элементов группы 2 .
- Затем мы рассмотрим свойств элементов группы 2 , включая их атомный радиус, первая энергия ионизации, растворимость и реакционная способность .
- После этого мы рассмотрим применений группы 2 .
- Наконец, мы рассмотрим, как тестировать для элементов группы 2 .
Металлические элементы группы 2
Взгляните на периодическую таблицу ниже. Столбец розового цвета показывает одну конкретную группу, group 2 .
Рис.
 1 — Группа 2 в периодической таблице
1 — Группа 2 в периодической таблицеГруппа 2 группа металлов в периодической таблице. Они также известны как щелочноземельные металлы .
Group 2 contains six elements:
- Beryllium (Be)
- Magnesium (Mg)
- Calcium (Ca)
- Strontium (Sr)
- Barium (Ba)
- Radium (Ra)
R адий чрезвычайно радиоактивен и встречается только в цепочках распада более тяжелых элементов, таких как торий и уран. Почти весь природный радий в окружающей среде представляет собой 226 Ra, изотоп с периодом полураспада 1600 лет. Однако это не очень распространено. В одном килограмме земной коры содержится всего 900 пикограмм радия — это 9 х 10 -10 грамм!
Единственным коммерческим применением радия в настоящее время является его использование в ядерной медицине, где его можно использовать для лечения определенных видов рака. Однако в начале двадцатого века он прославился как источник радиации для радиоактивных шарлатанов .
 Это лженаука , которая неправильно продвигает радиацию как лекарство от многих болезней. По сей день вы все еще можете найти курорты, которые с гордостью рекламируют свои содержащие радий воды как средство от всевозможных болезней и недомоганий.
Это лженаука , которая неправильно продвигает радиацию как лекарство от многих болезней. По сей день вы все еще можете найти курорты, которые с гордостью рекламируют свои содержащие радий воды как средство от всевозможных болезней и недомоганий.Напротив, металл группы 2 кальций является пятым наиболее распространенным элементом в земной коре. Он имеет множество применений, например, в производстве мыла и цемента. Тем не менее, его самая важная функция, возможно, в организме. Кальций является важным элементом для многих организмов. Например, ионы кальция помогают регулировать сокращение мышц и нервную функцию у животных. Наши кости действуют как хранилища этих ионов. Дефицит кальция может привести к остеопорозу. Ионы кальция также играют структурную роль в растениях, помогая формировать клеточную стенку, клеточную мембрану и среднюю пластинку.
Вы можете узнать больше о влиянии ионов кальция в Теория скользящих нитей .

Свойства группы 2
Элементы группы 2 очень похожи. Физически все они мягкие, блестящие, серебристо-белые металлы , с относительно низкими температурами плавления и кипения и плотностью.
Давайте рассмотрим некоторые другие их свойства более подробно.Структура и связь группы 2
Все элементы группы 2 имеют два электрона на внешней оболочке . Эти электроны находятся на внешней s-орбитали .
Не знаете, о чем мы говорим? Ознакомьтесь с Электронная конфигурация , чтобы узнать больше о различных электронных орбиталях.
Рис. 2. Электронная конфигурация магния
При взаимодействии элементы группы 2 теряют два своих внешних электрона с образованием катионов с зарядом 2+ и степенью окисления +2. Это означает, что элементы группы 2 образуют ионных соединений .
Есть одно исключение из правил — бериллий. Этот элемент на самом деле образует ковалентные молекулы, а не ионные соединения.
 Мы рассмотрим, почему это так, когда перейдем к тенденции электроотрицательности группы 2.
Мы рассмотрим, почему это так, когда перейдем к тенденции электроотрицательности группы 2.Атомный радиус группы 2
Если вы читали Периодические тенденции , вы сможете предсказать, как изменяется атомный радиус элементов группы 2 по мере продвижения вниз по группе. Как вы можете видеть на графике ниже, атомный радиус увеличивается на при движении вниз по группе. Это потому, что каждый последующий элемент имеет больше электронов с большим количеством электронных оболочек.
Рис. 3 – Атомный радиус элементов группы 2
Мы уже видели электронную структуру магния: он имеет 12 электронов, находящихся в трех электронных оболочках. Следующий элемент в группе, кальций, имеет 20 электронов в четырех электронных оболочках. Следовательно, он имеет больший атомный радиус.
Рис. 4 – Электронная структура и атомный радиус магния и кальция
Точки плавления группы 2
В целом температуры плавления элементов группы 2 уменьшайте по мере продвижения вниз по группе.
 В твердом состоянии металлы образуют металлических решеток , состоящих из положительных катионов металлов , окруженных морем отрицательных делокализованных электронов , как показано ниже.
В твердом состоянии металлы образуют металлических решеток , состоящих из положительных катионов металлов , окруженных морем отрицательных делокализованных электронов , как показано ниже.Рис. 5 — Металлическая решетка кальция
Эта решетка поддерживается сильным электростатическим притяжением между отрицательными электронами и ядрами положительных катионов. Помните, что атомный радиус увеличивается по мере продвижения вниз по группе. Это означает, что ядра находятся дальше от делокализованных электронов. Следовательно, электростатическое притяжение слабее. А значит, для его преодоления и расплавления твердого тела требуется меньше энергии.
Рис. 6 – Температура плавления элементов группы 2
Вы заметите, что температура плавления магния не соответствует общей тенденции. К сожалению, этому нет простого объяснения. Точно так же температуры кипения металлов группы 2 также не имеют четкой тенденции.
 Еще раз, нет простого объяснения. Да, мы знаем — глубоко раздражает!
Еще раз, нет простого объяснения. Да, мы знаем — глубоко раздражает!Нужна дополнительная информация о металлических решетках? Metallic Bonding поможет вам!
Группа 2 первая энергия ионизации
Теперь мы перейдем к рассмотрению первых энергий ионизации элементов группы 2.
Энергия первой ионизации — это энергия, необходимая для удаления одного моля наиболее слабо удерживаемых электронов из одного моля атомов газа. Каждый атом образует катион с зарядом +1.
Можете ли вы угадать тенденцию?
Первая энергия ионизации уменьшается по мере того, как вы спускаетесь по группе 2. Опять же, это происходит из-за увеличения атомного радиуса. По мере продвижения вниз по группе самый внешний электрон оказывается дальше от ядра. Это означает, что притяжение между ядром и электроном слабее, поэтому его легче преодолеть.
Рис. 7 – Первая энергия ионизации элементов группы 2
Эта тема более подробно раскрыта в Тенденции в Энергия ионизации .

Группа 2 электроотрицательность
Теперь давайте посмотрим на электроотрицательность .
Электроотрицательность — это способность атома притягивать связывающую пару электронов.
Еще раз, в Полярность гораздо больше подробностей. Но основные принципы электроотрицательности применимы и здесь. Электроотрицательность уменьшается на по мере того, как вы спускаетесь по группе в периодической таблице. Как известно, атомный радиус увеличивается по мере продвижения вниз по группе. Это означает, что любые связанные электроны находятся дальше от ядра, поэтому притяжение между ними слабее.
Возможно, вы помните из Полярность , что на электроотрицательность влияет заряд ядра — количество протонов в ядре атома. По мере того, как вы спускаетесь вниз по группе, заряд ядра увеличивается, поэтому вы можете подумать, что электроотрицательность также будет увеличиваться.
Чтобы объяснить это, вернемся к структуре магния и кальция.
 Магний с атомным номером 12 имеет в ядре 12 протонов. У кальция, с другой стороны, их 20. Однако у магния есть 10 электронов внутренней оболочки, которые экранируют заряд 10 из этих протонов. Напротив, кальций имеет 18 электронов внутренней оболочки, которые экранируют заряд его протонов. Таким образом, в обоих элементах любая связывающая пара будет чувствовать притяжение только двух оставшихся неэкранированных протонов. Эффективный заряд ядра одинаков. Но поскольку кальций имеет больший атомный радиус, он имеет более низкую электроотрицательность.
Магний с атомным номером 12 имеет в ядре 12 протонов. У кальция, с другой стороны, их 20. Однако у магния есть 10 электронов внутренней оболочки, которые экранируют заряд 10 из этих протонов. Напротив, кальций имеет 18 электронов внутренней оболочки, которые экранируют заряд его протонов. Таким образом, в обоих элементах любая связывающая пара будет чувствовать притяжение только двух оставшихся неэкранированных протонов. Эффективный заряд ядра одинаков. Но поскольку кальций имеет больший атомный радиус, он имеет более низкую электроотрицательность.Помните, мы упоминали, что бериллий ведет себя немного странно? Он образует ковалентных молекул вместо ионных соединений . Это потому, что это такой маленький атом; таким образом, он имеет более высокую электроотрицательность, чем все остальные члены группы.
Например, хлорид бериллия и хлорид магния. Хлор гораздо более электроотрицательный, чем магний, и большая разница в электроотрицательности вызывает ионную связь .
 Атомы хлора так сильно притягивают электроны магния, что магний полностью их отдает. Оба элемента образуют ионы.
Атомы хлора так сильно притягивают электроны магния, что магний полностью их отдает. Оба элемента образуют ионы.Рис. 8 — Хлорид магния — ионное соединение
С другой стороны, электроотрицательность бериллия достаточно высока, чтобы он не хотел терять свои электроны. Вместо этого он цепляется за них и делит их с хлором посредством ковалентной связи . Вот почему бериллий образует ковалентные молекулы вместо ионных соединений.
Рис. 9 – Хлорид бериллия – ковалентная молекула
Растворимость группы 2
Как и все металлы, элементы группы 2 нерастворимы в воде. Однако их соединения имеют различную растворимость. Вы можете узнать больше в Соединения группы 2 , но вот обзор:
Рис. 10 – Растворимость соединений группы 2
Hy d оксиды становятся более растворимыми по мере использования
9 0 d d
группа, в то время как s u лфаты со временем становятся более растворимыми u p группа.
Реактивность группы 2
Последнее свойство, которое мы рассмотрим, это реактивность . Как и большинство металлов, элементы группы 2 довольно реакционноспособны. Их реактивность увеличивается на по мере продвижения вниз по группе. Как мы выяснили ранее, элементы группы 2 (кроме бериллия) всегда реагируют с образованием ионов с зарядом 2+. Для этого необходимо удалить два электрона внешней оболочки, иначе говоря, процессы первой и второй ионизации. Энергия ионизации уменьшается по мере продвижения вниз по группе, поэтому эти электроны легче удалить. Поэтому реактивность возрастает.
Мы исследуем некоторые характерные реакции металлов группы 2 в разделе «Реакции группы 2».
Тестирование группы 2
В самом начале статьи мы упомянули, что все элементы группы 2 очень похожи внешне. Это все серебристые металлы. Это может затруднить их различение. Однако одним из способов различения металлов группы 2 является использование испытаний пламенем .
 Различные металлы горят, образуя разноцветное пламя в захватывающем световом шоу.
Различные металлы горят, образуя разноцветное пламя в захватывающем световом шоу.Возьмите чистую металлическую петлю и окуните ее в кислоту. Держите петлю в пламени горелки Бунзена, пока не перестанет изменяться цвет. Это очищает цикл. Затем окуните петлю в твердый образец вашего металла и снова держите ее в горелке Бунзена. Обратите внимание на цвет образовавшегося пламени. Если повезет, вы получите следующие результаты:
8 СтронцийМеталл Цвет Кальций Оранжево-красный Красный Барий Зеленый Обратите внимание, что бериллий и магний не дают цветного пламени. Вам придется полагаться на другие химические тесты, чтобы отличить их друг от друга.
Использование элементов группы 2
Наконец, давайте сосредоточимся на некоторых из применений группы 2 .
- Кальций является пятым по распространенности элементом в организме человека и играет важную роль в здоровье костей, сокращении мышц и нейротрансмиссии.

- Соединения кальция используются в сельском хозяйстве для повышения pH почвы. Их также можно использовать для удаления серы из дымовых газов.
- Соединения бария используются в рентгеновских лучах, а сплавы бериллия используются в механических деталях.
- Магний является третьим наиболее часто используемым конструкционным металлом, в основном используемым в легких сплавах.
Ознакомьтесь с Группа 2 Соединения для большего количества применений группы 2.
Группа 2 — Ключевые выводы
- Группа 2 , также известный как щелочноземельных металлов , представляет собой группу металлов в периодической таблице.
- Группа 2 содержит элементы бериллий , магний , кальций , стронций , барий и радий .
- Каждый элемент группы 2 имеет два электрона на внешней оболочке .

- . пропорциональна восстановительной способности. Прогнозируется, что от бериллия к барию восстановительная характеристика будет расти по мере снижения энергии ионизации вдоль столба. От бериллия к барию восстановительный потенциал падает, что указывает на увеличение восстановительной способности. Щелочноземельные металлы являются более слабыми восстановителями, чем щелочные металлы, из-за их более высокой энергии ионизации.
- ION ENERCEITIONSIRISIASION
- . , объем атомов также меньше. Кроме того, атомы имеют более прочную металлическую связь из-за наличия двух валентных электронов. Таким образом, щелочноземельные металлы плотнее и жестче, чем щелочные металлы. Плотность щелочноземельных металлов обычно увеличивается от магния к радию, при этом кальций имеет наименьшую плотность.
- ПЛОТА 9 9003

 Он больше, чем атом щелочного металла, из-за меньших радиусов и того, что электроны прочно удерживаются более высоким ядерным зарядом, а также из-за того, что электроны удаляются из полностью заполненной и поэтому стабильной подоболочки.
Он больше, чем атом щелочного металла, из-за меньших радиусов и того, что электроны прочно удерживаются более высоким ядерным зарядом, а также из-за того, что электроны удаляются из полностью заполненной и поэтому стабильной подоболочки. На растворимость вещества в воде влияют его ионный состав и размер. Меньшие ионы имеют более высокую плотность заряда и могут быть растворены большим количеством молекул воды. Это увеличивает энтальпию гидратации и делает гидратированные ионы более стабильными.
На растворимость вещества в воде влияют его ионный состав и размер. Меньшие ионы имеют более высокую плотность заряда и могут быть растворены большим количеством молекул воды. Это увеличивает энтальпию гидратации и делает гидратированные ионы более стабильными.
 Магний получает защитную оболочку из своего оксида, которая защищает его от дальнейшего воздействия молекул воды. Другие щелочноземельные металлы выделяют водород при взаимодействии даже с холодной водой.
Магний получает защитную оболочку из своего оксида, которая защищает его от дальнейшего воздействия молекул воды. Другие щелочноземельные металлы выделяют водород при взаимодействии даже с холодной водой.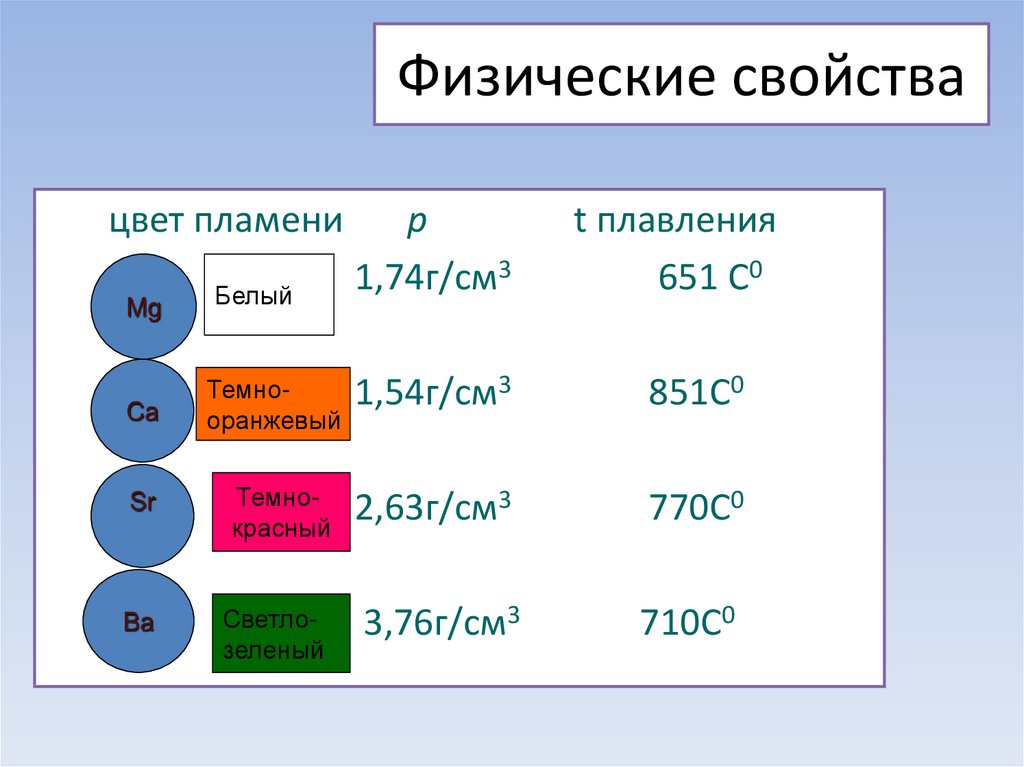


 Магний реагирует только с горячей водой, образуя гидроксиды и выделяя водород. Магний получает защитный слой оксида, который предотвращает дальнейшее воздействие молекул воды. Другие щелочноземельные металлы выделяют водород при взаимодействии даже с холодной водой.
Магний реагирует только с горячей водой, образуя гидроксиды и выделяя водород. Магний получает защитный слой оксида, который предотвращает дальнейшее воздействие молекул воды. Другие щелочноземельные металлы выделяют водород при взаимодействии даже с холодной водой. Это зеркало было охлаждено до холодных 5,5 К — это -268 °С!
Это зеркало было охлаждено до холодных 5,5 К — это -268 °С! 1 — Группа 2 в периодической таблице
1 — Группа 2 в периодической таблице Это лженаука , которая неправильно продвигает радиацию как лекарство от многих болезней. По сей день вы все еще можете найти курорты, которые с гордостью рекламируют свои содержащие радий воды как средство от всевозможных болезней и недомоганий.
Это лженаука , которая неправильно продвигает радиацию как лекарство от многих болезней. По сей день вы все еще можете найти курорты, которые с гордостью рекламируют свои содержащие радий воды как средство от всевозможных болезней и недомоганий.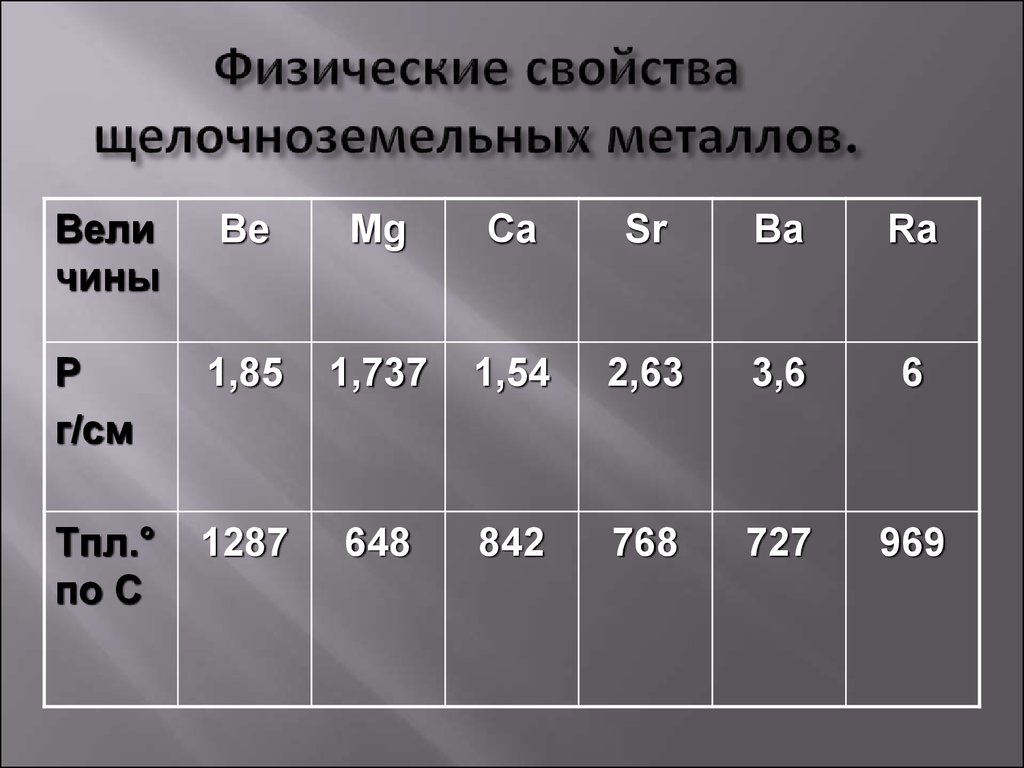
 Мы рассмотрим, почему это так, когда перейдем к тенденции электроотрицательности группы 2.
Мы рассмотрим, почему это так, когда перейдем к тенденции электроотрицательности группы 2. В твердом состоянии металлы образуют металлических решеток , состоящих из положительных катионов металлов , окруженных морем отрицательных делокализованных электронов , как показано ниже.
В твердом состоянии металлы образуют металлических решеток , состоящих из положительных катионов металлов , окруженных морем отрицательных делокализованных электронов , как показано ниже. Еще раз, нет простого объяснения. Да, мы знаем — глубоко раздражает!
Еще раз, нет простого объяснения. Да, мы знаем — глубоко раздражает!
 Магний с атомным номером 12 имеет в ядре 12 протонов. У кальция, с другой стороны, их 20. Однако у магния есть 10 электронов внутренней оболочки, которые экранируют заряд 10 из этих протонов. Напротив, кальций имеет 18 электронов внутренней оболочки, которые экранируют заряд его протонов. Таким образом, в обоих элементах любая связывающая пара будет чувствовать притяжение только двух оставшихся неэкранированных протонов. Эффективный заряд ядра одинаков. Но поскольку кальций имеет больший атомный радиус, он имеет более низкую электроотрицательность.
Магний с атомным номером 12 имеет в ядре 12 протонов. У кальция, с другой стороны, их 20. Однако у магния есть 10 электронов внутренней оболочки, которые экранируют заряд 10 из этих протонов. Напротив, кальций имеет 18 электронов внутренней оболочки, которые экранируют заряд его протонов. Таким образом, в обоих элементах любая связывающая пара будет чувствовать притяжение только двух оставшихся неэкранированных протонов. Эффективный заряд ядра одинаков. Но поскольку кальций имеет больший атомный радиус, он имеет более низкую электроотрицательность. Атомы хлора так сильно притягивают электроны магния, что магний полностью их отдает. Оба элемента образуют ионы.
Атомы хлора так сильно притягивают электроны магния, что магний полностью их отдает. Оба элемента образуют ионы.
 Различные металлы горят, образуя разноцветное пламя в захватывающем световом шоу.
Различные металлы горят, образуя разноцветное пламя в захватывающем световом шоу.
