Алюминий: свойства химические и физические
Одними из самых удобных в обработке материалов являются металлы. Среди них также есть свои лидеры. Так, например, основные свойства алюминия известны людям уже давно. Они настолько подходят для применения в быту, что данный металл стал очень популярным. Каковы же свойства алюминия как простого вещества и как атома, рассмотрим в данной статье.

История открытия алюминия
Издавна человеку было известно соединение рассматриваемого металла — алюмокалиевые квасцы. Оно использовалось как средство, способное набухать и связывать между собой компоненты смеси, это было необходимо и при выделке кожаных изделий. О существовании в чистом виде оксида алюминия стало известно в XVIII веке, во второй его половине. Однако при этом чистое вещество получено не было.
Сумел же выделить металл из его хлорида впервые ученый Х. К. Эрстед. Именно он обработал амальгамой калия соль и выделил из смеси серый порошок, который и был алюминием в чистом виде.
Тогда же стало понятно, что химические свойства алюминия проявляются в его высокой активности, сильной восстановительной способности. Поэтому долгое время с ним никто больше не работал.

Однако в 1854 году француз Девиль смог получить слитки металла методом электролиза расплава. Этот способ актуален и по сей день. Особенно массовое производство ценного материала началось в XX веке, когда были решены проблемы получения большого количества электроэнергии на предприятиях.
На сегодняшний день данный металл — один из самых популярных и применяемых в строительстве и бытовой промышленности.
Общая характеристика атома алюминия
Если характеризовать рассматриваемый элемент по положению в периодической системе, то можно выделить несколько пунктов.
- Порядковый номер — 13.
- Располагается в третьем малом периоде, третьей группе, главной подгруппе.
- Атомная масса — 26,98.
- Количество валентных электронов — 3.
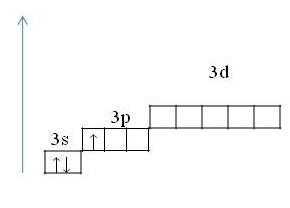
- Конфигурация внешнего слоя выражается формулой 3s23p1.
- Название элемента — алюминий.
- Металлические свойства выражены сильно.
- Изотопов в природе не имеет, существует только в одном виде, с массовым числом 27.
- Химический символ — AL, в формулах читается как «алюминий».
- Степень окисления одна, равна +3.
Химические свойства алюминия полностью подтверждаются электронным строением его атома, ведь имея большой атомный радиус и малое сродство к электрону, он способен выступать в роли сильного восстановителя, как и все активные металлы.
Алюминий как простое вещество: физические свойства
Если говорить об алюминии, как о простом веществе, то он представляет собой серебристо-белый блестящий металл. На воздухе быстро окисляется и покрывается плотной оксидной пленкой. Тоже самое происходит и при действии концентрированных кислот.

Наличие подобной особенности делает изделия из этого металла устойчивыми к коррозии, что, естественно, очень удобно для людей. Поэтому и находит такое широкое применение в строительстве именно алюминий. Свойства вещества также еще интересны тем, что данный металл очень легкий, при этом прочный и мягкий. Сочетание таких характеристик доступно далеко не каждому веществу.
Можно выделить несколько основных физических свойств, которые характерны для алюминия.
- Высокая степень ковкости и пластичности. Из данного металла изготовляют легкую, прочную и очень тонкую фольгу, его же прокатывают в проволоку.
- Температура плавления — 660 0С.
- Температура кипения — 2450 0С.
- Плотность — 2,7 г/см3.
- Кристаллическая решетка объемная гранецентрированная, металлическая.
- Тип связи — металлическая.
Физические и химические свойства алюминия определяют области его применения и использования. Если говорить о бытовых сторонах, то большую роль играют именно уже рассмотренные нами выше характеристики. Как легкий, прочный и антикоррозионный металл, алюминий применяется в самолето- и кораблестроении. Поэтому эти свойства очень важно знать.
Химические свойства алюминия
С точки зрения химии, рассматриваемый металл — сильный восстановитель, который способен проявлять высокую химическую активность, будучи чистым веществом. Главное — это устранить оксидную пленку. В этом случае активность резко возрастает.
Химические свойства алюминия как простого вещества определяются его способностью вступать в реакции с:
- кислотами;
- щелочами;
- галогенами;
- серой.
С водой он не взаимодействует при обычных условиях. При этом из галогенов без нагревания реагирует только с йодом. Для остальных реакций нужна температура.

Можно привести примеры, иллюстрирующие химические свойства алюминия. Уравнения реакций взаимодействия с:
- кислотами — AL + HCL = AlCL3 + H2;
- щелочами — 2Al + 6H2O + 2NaOH = Na[Al(OH)4] + 3Н2;
- галогенами — AL + Hal = ALHal3;
- серой — 2AL + 3S = AL2S3.
В целом, самое главное свойство рассматриваемого вещества — это высокая способность к восстановлению других элементов из их соединений.
Восстановительная способность
Восстановительные свойства алюминия хорошо прослеживаются на реакциях взаимодействия с оксидами других металлов. Он легко извлекает их из состава вещества и позволяет существовать в простом виде. Например: Cr2O3 + AL = AL2O3 + Cr.
В металлургии существует целая методика получения веществ, основанная на подобных реакциях. Она получила название алюминотермии. Поэтому в химической отрасли данный элемент используется именно для получения других металлов.
Распространение в природе
По распространенности среди других элементов-металлов алюминий занимает первое место. Его в земной коре содержится 8,8 %. Если же сравнивать с неметаллами, то место его будет третьим, после кислорода и кремния.
Вследствие высокой химической активности он не встречается в чистом виде, а лишь в составе различных соединений. Так, например, известно множество руд, минералов, горных пород, в состав которых входит алюминий. Однако добывается он только из бокситов, содержание которых в природе не слишком велико.

Самые распространенные вещества, содержащие рассматриваемый металл:
- полевые шпаты;
- бокситы;
- граниты;
- кремнезем;
- алюмосиликаты;
- базальты и прочие.
В небольшом количестве алюминий обязательно входит в состав клеток живых организмов. Некоторые виды плаунов и морских обитателей способны накапливать этот элемент внутри своего организма в течение жизни.
Получение
Физические и химические свойства алюминия позволяют получать его только одним способом: электролизом расплава соответствующего оксида. Однако процесс этот технологически сложен. Температура плавления AL2O3 превышает 2000 0С. Из-за этого подвергать электролизу непосредственно его не получается. Поэтому поступают следующим образом.
- Добывают бокситы.
- Очищают их от примесей, оставляя лишь оксид алюминия.
- Затем плавят криолит.
- Добавляют туда оксид.
- Данную смесь элекролизуют и получают чистый алюминий и углекислый газ.

Выход продукта составляет 99,7 %. Однако возможно получение и еще более чистого металла, который используется в технических целях.
Применение
Механические свойства алюминия не столь хороши, чтобы применять его в чистом виде. Поэтому чаще всего используются сплавы на основе данного вещества. Таких много, можно назвать самые основные.
- Дюралюминий.
- Алюминиево-марганцевые.
- Алюминиево-магниевые.
- Алюминиево-медные.
- Силумины.
- Авиаль.
Основное их отличие — это, естественно, сторонние добавки. Во всех основу составляет именно алюминий. Другие же металлы делают материал более прочным, стойким к коррозии, износоустойчивым и податливым в обработке.
Можно назвать несколько основных областей применения алюминия как в чистом виде, так и в виде его соединений (сплавов).
- Для изготовления проволоки и фольги, используемой в быту.
- Изготовление посуды.
- Самолетостроение.
- Кораблестроение.
- Строительство и архитектура.
- Космическая промышленность.
- Создание реакторов.

Вместе с железом и его сплавами алюминий — самый важный металл. Именно эти два представителя периодической системы нашли самое обширное промышленное применение в руках человека.
Свойства гидроксида алюминия
Гидроксид — самое распространенное соединение, которое образует алюминий. Свойства химические его такие же, как и у самого металла, — он амфотерный. Это значит, что он способен проявлять двойственную природу, вступая в реакции как с кислотами, так и со щелочами.
Сам по себе гидроксид алюминия — это белый студенистый осадок. Получить его легко при взаимодействии соли алюминия с щелочью или гидроксидом аммония. При взаимодействии с кислотами данный гидроксид дает обычную соответствующую соль и воду. Если же реакция идет с щелочью, то формируются гидроксокомплексы алюминия, в которых его координационное число равно 4. Пример: Na[Al(OH)4] — тетрагидроксоалюминат натрия.
4u-pro.ru
физические и химические свойства. Применение алюминия. 9-й класс
Разделы: Химия, Конкурс «Презентация к уроку»
Презентация к уроку
Загрузить презентацию (292,7 МБ)
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цель урока
- продолжить формирование ключевых компетенций: учебно-познавательных, информационных, ценностно-смысловых, общекультурных, коммуникативных и личностного самосовершенствования учащихся.
Задачи урока:
- сформировать знания о физико-механических и химических свойствах алюминия на основе его положения в ПСХЭ, строения атома и кристалла;
- установить причинно-следственную связь между строением и свойствами металлов 1-3 групп главных подгрупп;
- продолжить развитие умений наблюдать, делать выводы, выполнять эксперимент и объяснять его ход;
- продолжить формирования навыков составления уравнений химических реакций;
- показать практическое значение химических знаний.
Оборудование и реактивы: карточки с текстами, презентация к уроку, видеоматериал, компьютер, экран, проектор, гранулы алюминия, р-р гидроксида натрия.
Наборы реактивов на столах учащихся: алюминиевая проволока, фольга, гранулы алюминия, растворы соляной кислоты и сульфата меди (2), спички, спиртовка, держатель, смайлики.
Раздаточный материал: карточки с текстом теста (2 варианта), с дифференцированным домашним заданием (д/з).
Ход урока
1. Организационный момент.
2. Изучение нового материала.
— Мы продолжаем изучать металлы, а какой металл мы будем изучать сегодня, предстоит определить вам. Итак, эпиграф к нашему уроку:
Я металл, серебристый и лёгкий
И зовусь “самолётный металл”,
И покрыт я оксидною плёнкой,
Чтоб меня кислород не достал… (слайд 2).
— Что же за металл мы сегодня будем изучать?
— Совершенно верно алюминий. И тема нашего урока “Алюминий: физические и химические свойства.. Применение алюминия” (слайд 3). Запишем тему урока в тетрадях.
— Давайте, вместе с вами, определим задачи урока (коллективное обсуждение)
— Итак, задачи нашего урока (слайд 4).
Изучение нового материала с актуализацией опорных знаний.
Характеристика алюминия как химического элемента.
Самостоятельная работа (слайд 5).
Проверка самостоятельной работы у доски.
Примерный ответ: Al №13. заряд ядра+13, протонов 13, нейтронов 14, электронов 13.
(слайд 6)
— Как изменяется химическая активность у этих химических элементов? (Выводы делают учащиеся).
Тип и класс: Al p – элемент, переходный элемент, соединения которого обладают амфотерными свойствами.
Тип химической связи — металлическая.
Тип кристаллической решетки — металлическая (вспоминаем физические свойства веществ с металлической химической связью).
— Сейчас я вам расскажу об истории открытия алюминия (рассказ).
Нахождение алюминия в природе (слайд 7).
— Основные месторождения алюминиевого сырья: Урал, Казахстан, Сибирь, Башкирстан.
Вопрос. Почему алюминия нет в природе в свободном виде?
— На основании справочных данных, учебника, эпиграфа к уроку и образцов алюминия на ваших столах охарактеризуйте физические свойства алюминия.
Ответы учащихся. (слайд 8 и образцы в лотках).
— На физико-механических свойствах основано его применение. (обсуждение)
Задание. Посмотрите слайды (9-15) и назовите области применения алюминия и свойства, на которых основано их применение (обсуждение).
Почему, очень часто, изделия изготавливаются из сплавов алюминия?
— Алюминий — активный металл, в чём же причина его пассивности? На этот вопрос мы ответим, посмотрев видео (видео 1).
Обсуждение результатов просмотра.
Ответ – на поверхности алюминия образуется пассивная оксидная плёнка.
Подвергаются ли коррозии изделия из алюминия? Почему?
Вывод: оксидная плёнка защищает алюминий от коррозии.
Влияние алюминия и изделий из него на здоровье человека (рассказ).
— При мытье алюминиевой посуды (внутри) можно использовать абразивные материалы? Ответ поясните.
С помощью лабораторных опытов изучим некоторые химические свойства алюминия
Видео 2 размещено в архиве вместе с презентацией.
— Алюминий взаимодействует с неметаллами.
— Запишите уравнения химических реакций алюминия с кислородом, серой и хлором. Укажите восстановитель и окислитель. К одному из уравнений напишите электронный баланс (по желанию). Ребята работают в тетрадях, проверяем у доски.
— Согласно ряду активности металлов алюминий должен реагировать с кислотами. Ставим проблему и решаем её с помощью лабораторных опытов.
Выполнение учащимися лабораторного опыта взаимодействие алюминия с соляной кислотой. Учащиеся записывают уравнение химической реакции на доске и в тетрадях.
Запомните — алюминий не реагирует с концентрированной азотной кислотой!
При взаимодействии с концентрированной серной кислотой водород не выделяется, а оксид серы (4) в основном.
Взаимодействие с гидроксидом натрия (демонстрация, запись уравнения химической реакции).
Вывод: алюминий проявляет амфотерные свойства.
— А почему?
— Так как реагирует и с кислотами и с основаниями. (Записать в тетради)
(слайд 16).
— Алюминий реагирует с некоторыми солями (выполнение учащимися лабораторного опыта взаимодействия алюминия с раствором сульфата меди (2)).
— ? Почему восстанавливается чистая медь из её соли?( уравнение д/з).
— Вывод делают учащиеся: согласно ряду напряжения металлов алюминий вытесняет менее активные металлы из их солей.
— Алюминий может восстанавливать некоторые металлы из их оксидов (например,из Fe2O3) (просмотр видео 3. Видео 3 размещено в архиве вместе с презентацией).
— Уравнение химической реакции запишите в д/з.
3. Закрепление изученного материала.
Выполнение теста.
Тест
1 вариант
1. Количество протонов в атоме алюминия:
А) 12,
В) 13,
С) 10,
D) 14.
2.Электронная формула иона алюминия — А1+3:
А) 1s22s22p6.
B) 1s22s22p63s2.
C) 1s22s22p63s1.
D) 1s22s22p63s2p1.
3. Алюминий менее активен, чем:
А) углерод,
B) натрий,
С) кремний,
D) фосфор.
4. Тип кристаллической решетки у алюминия:
А) ионная,
В) металлическая,
С) атомная,
D) молекулярная.
5. На каком физическом свойстве алюминия основано применение сплавов алюминия в самолетостроении:
А) хорошая электропроводность,
В) пластичность,
С) легкость и прочность в сплавах,
D) неядовитость.
2 вариант
1.Количество нейтронов в атоме алюминия:
А) 12,
В) 13,
С) 10,
D) 14.
2.Электронная формула атома алюминия:
А) 1s22s22p6.
B) 1s22s22p63s2.
C) 1s22s22p63s1.
D) 1s22s22p63s2p1.
3. Алюминий более активен, чем:
А) сера,
B) натрий,
С) калий,
D) кальций.
4. Вид химической связи у алюминия:
А) ионная,
В) металлическая,
С) ковалентная,
D) водородная.
5. На каком физическом свойстве алюминия основано применение алюминия в электротехнике:
А) хорошая электропроводность,
В) пластичность,
С) легкость и прочность в сплавах,
D) неядовитость.
Проверка теста (слайд 17).
4. К началу урока: эпиграфу, что изучили на уроке, что узнали нового.
— Итак, вернемся к началу урока и проверим, выполнили мы с вами поставленные задачи (обсуждение, выводы).
5. Задание на дом (слайд 18).
Раздать карточки с д/з. Инструктаж выполнения домашнего задания (дифференцированного).
6. Подведение итогов, оценка работы учащихся на уроке.
— Попробуем самостоятельно оценить свою работу на уроке.
— Для этого у вас в лотках есть смайлики, но вы заметили, что на них нет эмоций. Добавим их на смайлики: улыбку, если получили прочные знания, усвоили весь материал; сомнение, если усвоили материал частично; грусть, если мало что поняли, необходимо еще поработать. В конце урока положите их мне на стол.
Оценка работы учащихся на уроке, выставление отметок учащимся.
Поблагодарить учащихся за работу на уроке (последний слайд). (слайд 19).
xn--i1abbnckbmcl9fb.xn--p1ai
Алюминий: свойства химические и физические
Образование 17 июня 2015Одними из самых удобных в обработке материалов являются металлы. Среди них также есть свои лидеры. Так, например, основные свойства алюминия известны людям уже давно. Они настолько подходят для применения в быту, что данный металл стал очень популярным. Каковы же свойства алюминия как простого вещества и как атома, рассмотрим в данной статье.

История открытия алюминия
Издавна человеку было известно соединение рассматриваемого металла — алюмокалиевые квасцы. Оно использовалось как средство, способное набухать и связывать между собой компоненты смеси, это было необходимо и при выделке кожаных изделий. О существовании в чистом виде оксида алюминия стало известно в XVIII веке, во второй его половине. Однако при этом чистое вещество получено не было.
Сумел же выделить металл из его хлорида впервые ученый Х. К. Эрстед. Именно он обработал амальгамой калия соль и выделил из смеси серый порошок, который и был алюминием в чистом виде.
Тогда же стало понятно, что химические свойства алюминия проявляются в его высокой активности, сильной восстановительной способности. Поэтому долгое время с ним никто больше не работал.

Однако в 1854 году француз Девиль смог получить слитки металла методом электролиза расплава. Этот способ актуален и по сей день. Особенно массовое производство ценного материала началось в XX веке, когда были решены проблемы получения большого количества электроэнергии на предприятиях.
На сегодняшний день данный металл — один из самых популярных и применяемых в строительстве и бытовой промышленности.
Общая характеристика атома алюминия
Если характеризовать рассматриваемый элемент по положению в периодической системе, то можно выделить несколько пунктов.
- Порядковый номер — 13.
- Располагается в третьем малом периоде, третьей группе, главной подгруппе.
- Атомная масса — 26,98.
- Количество валентных электронов — 3.
- Конфигурация внешнего слоя выражается формулой 3s23p1.
- Название элемента — алюминий.
- Металлические свойства выражены сильно.
- Изотопов в природе не имеет, существует только в одном виде, с массовым числом 27.
- Химический символ — AL, в формулах читается как «алюминий».
- Степень окисления одна, равна +3.
Химические свойства алюминия полностью подтверждаются электронным строением его атома, ведь имея большой атомный радиус и малое сродство к электрону, он способен выступать в роли сильного восстановителя, как и все активные металлы.
Видео по теме
Алюминий как простое вещество: физические свойства
Если говорить об алюминии, как о простом веществе, то он представляет собой серебристо-белый блестящий металл. На воздухе быстро окисляется и покрывается плотной оксидной пленкой. Тоже самое происходит и при действии концентрированных кислот.

Наличие подобной особенности делает изделия из этого металла устойчивыми к коррозии, что, естественно, очень удобно для людей. Поэтому и находит такое широкое применение в строительстве именно алюминий. Свойства вещества также еще интересны тем, что данный металл очень легкий, при этом прочный и мягкий. Сочетание таких характеристик доступно далеко не каждому веществу.
Можно выделить несколько основных физических свойств, которые характерны для алюминия.
- Высокая степень ковкости и пластичности. Из данного металла изготовляют легкую, прочную и очень тонкую фольгу, его же прокатывают в проволоку.
- Температура плавления — 660 0С.
- Температура кипения — 2450 0С.
- Плотность — 2,7 г/см3.
- Кристаллическая решетка объемная гранецентрированная, металлическая.
- Тип связи — металлическая.
Физические и химические свойства алюминия определяют области его применения и использования. Если говорить о бытовых сторонах, то большую роль играют именно уже рассмотренные нами выше характеристики. Как легкий, прочный и антикоррозионный металл, алюминий применяется в самолето- и кораблестроении. Поэтому эти свойства очень важно знать.
Химические свойства алюминия
С точки зрения химии, рассматриваемый металл — сильный восстановитель, который способен проявлять высокую химическую активность, будучи чистым веществом. Главное — это устранить оксидную пленку. В этом случае активность резко возрастает.
Химические свойства алюминия как простого вещества определяются его способностью вступать в реакции с:
- кислотами;
- щелочами;
- галогенами;
- серой.
С водой он не взаимодействует при обычных условиях. При этом из галогенов без нагревания реагирует только с йодом. Для остальных реакций нужна температура.

Можно привести примеры, иллюстрирующие химические свойства алюминия. Уравнения реакций взаимодействия с:
- кислотами — AL + HCL = AlCL3 + H2;
- щелочами — 2Al + 6H2O + 2NaOH = Na[Al(OH)4] + 3Н2;
- галогенами — AL + Hal = ALHal3;
- серой — 2AL + 3S = AL2S3.
В целом, самое главное свойство рассматриваемого вещества — это высокая способность к восстановлению других элементов из их соединений.
Восстановительная способность
Восстановительные свойства алюминия хорошо прослеживаются на реакциях взаимодействия с оксидами других металлов. Он легко извлекает их из состава вещества и позволяет существовать в простом виде. Например: Cr2O3 + AL = AL2O3 + Cr.
В металлургии существует целая методика получения веществ, основанная на подобных реакциях. Она получила название алюминотермии. Поэтому в химической отрасли данный элемент используется именно для получения других металлов.
Распространение в природе
По распространенности среди других элементов-металлов алюминий занимает первое место. Его в земной коре содержится 8,8 %. Если же сравнивать с неметаллами, то место его будет третьим, после кислорода и кремния.
Вследствие высокой химической активности он не встречается в чистом виде, а лишь в составе различных соединений. Так, например, известно множество руд, минералов, горных пород, в состав которых входит алюминий. Однако добывается он только из бокситов, содержание которых в природе не слишком велико.

Самые распространенные вещества, содержащие рассматриваемый металл:
- полевые шпаты;
- бокситы;
- граниты;
- кремнезем;
- алюмосиликаты;
- базальты и прочие.
В небольшом количестве алюминий обязательно входит в состав клеток живых организмов. Некоторые виды плаунов и морских обитателей способны накапливать этот элемент внутри своего организма в течение жизни.
Получение
Физические и химические свойства алюминия позволяют получать его только одним способом: электролизом расплава соответствующего оксида. Однако процесс этот технологически сложен. Температура плавления AL2O3 превышает 2000 0С. Из-за этого подвергать электролизу непосредственно его не получается. Поэтому поступают следующим образом.
- Добывают бокситы.
- Очищают их от примесей, оставляя лишь оксид алюминия.
- Затем плавят криолит.
- Добавляют туда оксид.
- Данную смесь элекролизуют и получают чистый алюминий и углекислый газ.

Выход продукта составляет 99,7 %. Однако возможно получение и еще более чистого металла, который используется в технических целях.
Применение
Механические свойства алюминия не столь хороши, чтобы применять его в чистом виде. Поэтому чаще всего используются сплавы на основе данного вещества. Таких много, можно назвать самые основные.
- Дюралюминий.
- Алюминиево-марганцевые.
- Алюминиево-магниевые.
- Алюминиево-медные.
- Силумины.
- Авиаль.
Основное их отличие — это, естественно, сторонние добавки. Во всех основу составляет именно алюминий. Другие же металлы делают материал более прочным, стойким к коррозии, износоустойчивым и податливым в обработке.
Можно назвать несколько основных областей применения алюминия как в чистом виде, так и в виде его соединений (сплавов).
- Для изготовления проволоки и фольги, используемой в быту.
- Изготовление посуды.
- Самолетостроение.
- Кораблестроение.
- Строительство и архитектура.
- Космическая промышленность.
- Создание реакторов.

Вместе с железом и его сплавами алюминий — самый важный металл. Именно эти два представителя периодической системы нашли самое обширное промышленное применение в руках человека.
Свойства гидроксида алюминия
Гидроксид — самое распространенное соединение, которое образует алюминий. Свойства химические его такие же, как и у самого металла, — он амфотерный. Это значит, что он способен проявлять двойственную природу, вступая в реакции как с кислотами, так и со щелочами.
Сам по себе гидроксид алюминия — это белый студенистый осадок. Получить его легко при взаимодействии соли алюминия с щелочью или гидроксидом аммония. При взаимодействии с кислотами данный гидроксид дает обычную соответствующую соль и воду. Если же реакция идет с щелочью, то формируются гидроксокомплексы алюминия, в которых его координационное число равно 4. Пример: Na[Al(OH)4] — тетрагидроксоалюминат натрия.
Источник: fb.ru ОбразованиеЦиклоалканы — это… Циклоалканы: получение, формула, химические и физические свойства
Циклоалканы — это углеводороды, которые в своем составе имеют замкнутые структуры. Рассмотрим особенности данных соединений, их области применения.
ОбразованиеЧто такое неон? Химические и физические свойства неона, применение
Среди всех элементов химической таблицы Менделеева интересными свойствами обладает такая группа, как инертные газы. К ним относится аргон, неон, гелий и некоторые другие вещества. Что такое неон, и где в современном м…
ОбразованиеЧто такое глюкоза? Определение, химические и физические свойства
Что такое глюкоза? Все ее употребляют, но определение дать смогут немногие. Это вещество, которое необходимо организму человека. От своевременного поступления глюкозы зависит здоровье людей.Поставлять энергию о…
ОбразованиеХлор: характеристика химических и физических свойств
В природе хлор встречается в газообразном состоянии и только в виде соединений с другими газами. В условиях, приближенных к нормальным, это ядовитый едкий газ зеленоватого цвета. Имеет больший вес, чем воздух. Обладае…
ОбразованиеХимические и физические свойства мела
Мел представляет собой осадочную породу белого цвета. Он нерастворим в воде, имеет органическое происхождение. Из статьи узнаем, где используется мел, физические и химические свойства этой породы.
ОбразованиеВодород — это что за вещество? Химические и физические свойства водорода
Каждый химический элемент в периодической системе имеет свое определенное место положения, которое отражает проявляемые им свойства и говорит о его электронном строении. Однако есть среди всех один особый атом, которы…
ОбразованиеКремний: применение, химические и физические свойства
Один из самых распространенных в природе элементов — это silicium, или кремний. Такое широкое расселение говорит о важности и значимости данного вещества. Это быстро поняли и усвоили люди, которые научились правильно …
ОбразованиеХимическое и физические свойства железа
Железо — всем известный химический элемент. Он относится к средним по химической активности металлам. Свойства и применение железа мы рассмотрим в этой статье.Распространенность в природеСуществу…
ОбразованиеАзотистая кислота. Химические и физические свойства
Азотистая кислота — это одноосновная слабая кислота, которая может существовать только в разбавленных водных растворах голубого цвета и в газовой форме. Соли данной кислоты называют азотистокислым или нитритами. Они т…
ОбразованиеХромат калия. Получение, химические и физические свойства. Применение
Хромат калия или хромоволокнистый калий (международные названия: Kalium chromicum, Kaliumchromat, Potassium chromate) — это неорганическое соединение, кристаллы желтого цвета ромбической системы, растворимые в воде. О…
monateka.com
Лекция по химии на тему «Алюминий его физические и химические свойства»
1.Общая характеристика алюминия.
Главную подгруппу III группы периодической системы составляют бор (В),алюминий (Аl), галлий (Ga), индий (In) и таллий (Тl).
Как видно из приведенных данных, все эти элементы были открыты в XIXстолетии.
Открытие металлов главной подгруппы III группы
В | Al | Ga | In | Tl |
1806 г. | 1825 г. | 1875 г. | 1863 г. | 1861 г. |
Г.Люссак, | Г.Х.Эрстед | Л. де Буабодран | Ф.Рейх, | У.Крукс |
Л. Тенар | (Дания) | (Франция) | И.Рихтер | (Англия) |
(Франция) | (Германия) |
Бор представляет собой неметалл. Алюминий — переходный металл, а галлий, индий и таллий — полноценные металлы. Таким образом, с ростом радиусов атомов элементов каждой группы периодической системы металлические свойства простых веществ усиливаются.
В данной лекции мы подробнее рассмотрим свойства алюминия.
2. Положение алюминия в таблице Д. И. Менделеева. Строение атома, проявляемые степени окисления.
Элемент алюминий расположен в III группе, главной «А» подгруппе, 3 периоде периодической системы, порядковый номер №13, относительная атомная массаAr(Al) → 27. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными.
Al +13 )2)8)3, p –элемент,
Основное состояние 1s22s22p63s23p1 |
|
Возбуждённое состояние 1s22s22p63s13p2 | |
Алюминий проявляет в соединениях степень окисления +3:
Al0– 3e—→Al+3
3. Физические свойства, нахождение в природе
Алюминий в свободном виде — серебристо-белый металл, обладающий высокой тепло- и электропроводностью.Температура плавления 650 оС. Алюминий имеет невысокую плотность (2,7 г/см3) — примерно втрое меньше, чем у железа или меди, и одновременно — это прочный металл.
По распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14% от массы земной коры.
В природе алюминий встречается только в соединениях(минералах).
Некоторые из них:
·Бокситы — Al2O3• H2O (с примесями SiO2, Fe2O3, CaCO3)
·Нефелины — KNa3[AlSiO4]4
·Алуниты — KAl(SO4)2• 2Al(OH)3
·Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
·Корунд — Al2O3
·Полевой шпат (ортоклаз) — K2O•Al2O3•6SiO2
·Каолинит — Al2O3•2SiO2• 2H2O
·Алунит — (Na,K)2SO4•Al2(SO4)3•4Al(OH)3
·Берилл — 3ВеО • Al2О3• 6SiO2
Боксит | |
Al2O3 | Корунд |
Рубин | |
Сапфир |
4.Химические свойства алюминия и его соединений
Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый вид). |
ДЕМОНСТРАЦИЯ ОКСИДНОЙ ПЛЁНКИ
Её толщина 0,00001 мм, но благодаря ней алюминий не коррозирует. Для изучения химических свойств алюминия оксидную пленку удаляют. (При помощи наждачной бумаги, или химически: сначала опуская в раствор щелочи для удаления оксидной пленки, а затем в раствор солей ртути для образования сплава алюминия со ртутью – амальгамы).
I. Взаимодействие с простыми веществами
Алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды. При нагревании он взаимодействует с серой (200 °С), азотом (800 °С), фосфором (500 °С) и углеродом (2000 °С), с йодом в присутствии катализатора — воды:
2Аl + 3S→ Аl2S3 (сульфид алюминия),
2Аl + N2→2АlN (нитрид алюминия),
Аl + Р → АlР (фосфид алюминия),
4Аl + 3С → Аl4С3 (карбид алюминия).
2 Аl + 3I2→2 AlI3 (йодид алюминия) ОПЫТ
Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S
Al4C3 + 12H2O → 4Al(OH)3+ 3CH4
В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты:
4Аl+ 3O2→ 2Аl2О3+ 1676 кДж.
ГОРЕНИЕ АЛЮМИНИЯ НА ВОЗДУХЕ
ОПЫТ
II. Взаимодействие со сложными веществами
Взаимодействие с водой:
2 Al + 6 H2O→2 Al (OH)3+3 H2
без оксидной пленки
ОПЫТ
Взаимодействие с оксидами металлов:
Алюминий – хороший восстановитель, так как является одним из активных металлов. Стоит в ряду активности сразу после щелочно-земельных металлов. Поэтому восстанавливает металлы из их оксидов. Такая реакция – алюмотермия – используется для получения чистых редких металлов, например таких, как вольфрам, ваннадий и др
3 Fe3O4+8 Al →4 Al2O3+ Fe +Q
Термитная смесь Fe3O4 и Al (порошок) – используется ещё и в термитной сварке.
Сr2О3 + 2Аl → 2Сr + Аl2О3
Взаимодействие с кислотами:
С раствором серной кислоты: 2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2
С холодными концентрированными серной и азотной не реагирует (пассивирует). Поэтому азотную кислоту перевозят в алюминиевых цистернах. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода:
2Аl + 6Н2SО4(конц) → Аl2(SО4)3 + 3SО2 + 6Н2О,
Аl + 6НNO3(конц) → Аl(NO3)3 + 3NO2 + 3Н2О.
Взаимодействие со щелочами.
2 Al + 2 NaOH + 6 H2O →2 Na[Al(OH)4] + 3 H2
ОПЫТ
Na[Аl(ОН)4] – тетрагидроксоалюминат натрия
По предложению химика Горбова, в русско-японскую войну эту реакцию использовали для получения водорода для аэростатов.
С растворами солей:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Если поверхность алюминия потереть солью ртути, то происходит реакция:
2Al + 3HgCl2 → 2AlCl3 + 3Hg
Выделившаяся ртуть растворяет алюминий, образуя амальгаму.
Обнаружение ионов алюминия в растворах: ОПЫТ
5. Применение алюминия и его соединений
Приложение 1
РИСУНОК 1
Приложение 2
РИСУНОК 2
Физические и химические свойства алюминия обусловили его широкое применение в технике. Крупным потребителем алюминия является авиационная промышленность: самолет на 2/3 состоит из алюминия и его сплавов. Самолет из стали оказался бы слишком тяжелым и смог бы нести гораздо меньше пассажиров. Поэтому алюминий называют крылатым металлом. Из алюминия изготовляют кабели и провода: при одинаковой электрической проводимости их масса в 2 раза меньше, чем соответствующих изделий из меди.
Учитывая коррозионную устойчивость алюминия, из него изготовляют детали аппаратов и тару для азотной кислоты. Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии, а также для отражения тепловых лучей такой краской покрывают нефтехранилища, костюмы пожарных.
Оксид алюминия используется для получения алюминия, а также как огнеупорный материал.
Гидроксид алюминия – основной компонент всем известных лекарств маалокса, альмагеля, которые понижают кислотность желудочного сок.
Соли алюминия сильно гидролизуются. Данное свойство применяют в процессе очистки воды. В очищаемую воду вводят сульфат алюминия и небольшое количество гашеной извести для нейтрализации образующейся кислоты. В результате выделяется объемный осадок гидроксида алюминия, который, оседая, уносит с собой взвешенные частицы мути и бактерии.
Таким образом, сульфат алюминия является коагулянтом.
6. Получение алюминия
1) Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит Na3AlF6растворяет Al2O3,как вода растворяет сахар. Электролиз “раствора” оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия — электролитом.
2Al2O3эл.ток→4Al + 3O2
В английской “Энциклопедии для мальчиков и девочек” статья об алюминии начинается следующими словами: “23 февраля 1886 года в истории цивилизации начался новый металлический век — век алюминия. В этот день Чарльз Холл, 22-летний химик, явился в лабораторию своего первого учителя с дюжиной маленьких шариков серебристо-белого алюминия в руке и с новостью, что он нашел способ изготовлять этот металл дешево и в больших количествах”. Так Холл сделался основоположником американской алюминиевой промышленности и англосаксонским национальным героем, как человек, сделавшим из науки великолепный бизнес.
2) 2Al2O3 + 3 C →4 Al + 3 CO2
7. Вопросы для самоконтроля
Ответьте на вопросы:
а) Чем отличается алюминий по химическим свойствам от других типичных металлов, ответ подтвердите уравнениями реакций.
б) Почему, алюминиевые изделия, используемые в быту, не вступают в химические реакции с кислотами, щелочами, не окисляются?
8. Задания для закрепления
№1. Для получения алюминия из хлорида алюминия в качестве восстановителя можно использовать металлический кальций. Составьте уравнение данной химической реакции, охарактеризуйте этот процесс при помощи электронного баланса.
Подумайте! Почему эту реакцию нельзя проводить в водном растворе?
№2. Закончите уравнения химических реакций:
Al + H2SO4 (раствор) →
Al + CuCl2→
Al + HNO3(конц) —t→
Al + NaOH + H2O →
№3. Осуществите превращения:
Al →AlCl3 →Al → Al2S3→ Al(OH)3t→Al2O3→Al
№4. Решите задачу:
На сплав алюминия и меди подействовали избытком концентрированного раствора гидроксида натрия при нагревании. Выделилось 2,24 л газа (н.у.). Вычислите процентный состав сплава, если его общая масса была 10 г?
Список литературы
Программы для общеобразовательных учреждений, ХИМИЯ, 8 – 11 класс, Москва, Дрофа, 2001г.
Р.П.Суровцева и др., ХИМИЯ, методическое пособие 10 – 11 класс, Москва, Дрофа, 2000г.
Л.С.Гузей, Р.П.Суровцева, ХИМИЯ – учебники 9, 10 класс, Москва, Дрофа, 1998г.
Энциклопедический словарь юного химика, Москва, Педагогика, 1990г.
Школьная энциклопедия ХИМИЯ, Москва, Дрофа, 2000г.
Э.Т.Оганесян, Важнейшие понятия и термины в химии, Москва, Высшая школа, 1993г.
Э.Т.Оганесян, Руководство по химии поступающим в вузы, Москва, Высшая школа, 1991г.
С.И.Венецкий,Ю Рассказы о металлах, Москва, Металлургия, 1975г.
Приложение1
ЭТО ИНТЕРЕСНО:
Металлический алюминий первым выделил в 1825 году датский физик Ханс Кристиан Эрстед. Пропустив газообразный хлор через слой раскаленного оксида алюминия, смешанного с углем, Эрстед выделил хлорид алюминия без малейших следов влаги. Чтобы восстановить металлический алюминий, Эрстеду понадобилось обработать хлорид алюминия амальгамой калия. Через 2 года немецкий химик Фридрих Вёллер. Усовершенствовал метод, заменив амальгаму калия чистым калием.
В 18-19 веках алюминий был главным ювелирным металлом. В 1889 году Д.И.Менделеев в Лондоне за заслуги в развитии химии был награжден ценным подарком – весами, сделанными из золота и алюминия.
К 1855 году французский ученый Сен- Клер Девиль разработал способ получения металлического алюминия в технических масштабах. Но способ был очень дорогостоящий. Девиль пользовался особым покровительством Наполеона III, императора Франции. В знак своей преданности и благодарности Девиль изготовил для сына Наполеона, новорожденного принца, изящно гравированную погремушку – первое «изделие ширпотреба» из алюминия. Наполеон намеревался даже снарядить своих гвардейцев алюминиевыми кирасами, но цена оказалась непомерно высокой. В то время 1 кг алюминия стоил 1000 марок, т.е. в 5 раз дороже серебра. Только после изобретения электролитического процесса алюминий по своей стоимости сравнялся с обычными металлами.
А знаете ли вы, что алюминий, поступая в организм человека, вызывает расстройство нервной системы. При его избытке нарушается обмен веществ. А защитными средствами является витамин С, соединения кальция, цинка.
При сгорании алюминия в кислороде и фторе выделяется много тепла. Поэтому его используют как присадку к ракетному топливу. Ракета «Сатурн» сжигает за время полёта 36 тонн алюминиевого порошка. Идея использования металлов в качестве компонента ракетного топлива впервые высказал Ф. А. Цандер.
videouroki.net
Алюминий в соединениях проявляет степень окисления +3, т.к. имеет на внешней электронной оболочке 3 электрона. Алюминий впервые был открыт в 1825 г X. Эрстедом и выделен в чистом виде в 1827г. немецким химиком Ф.Вёлером. Основные природные соединения алюминия: Получение: Физические свойства: |
all-met.narod.ru
Алюминий. Характеристика элемента. Нахождение в природе. Физические и химические свойства алюминия.
Сценарий урока
Алюминий. Характеристика элемента. Нахождение в природе.
Физические и химические свойства алюминия.
Цель: Расширить знания учащихся об алюминии, изучить физические и химические свойства алюминия, экспериментально доказать его амфотерность, ознакомить учащихся с нахождением алюминия в природе, показать его практическое значение в нашей жизни.
Развивать логическое мышление, умение экспериментальной работы во время проведения лабораторных опытов, применять теоретические знания при решении упражнений.
Формировать у учащихся чувство ответственности за соблюдение правил безопасности жизнедеятельности при проведении химического эксперимента. Формировать научное мировоззрение у учащихся.
Оборудование и материалы: Периодическая система химических элементов Д.И.Менделеева, электрохимический ряд напряжений металлов, таблица растворимости кислот, оснований и солей, алюминий, растворы соляной кислоты, гидроксида натрия, хлорида меди (II).
Базовые понятия и термины: металлы, металлическая кристаллическая решётка, электронная оболочка, амфотерность.
Тип урока: усвоение нового материала
I Организационный этап
II Актуализация опорных знаний
Учащиеся выполняют задания по вариантам, взаимно проверяют работы и выставляют оценки.
Задание: Закончить возможные уравнения химических реакций:
Вариант I
Na + H2O
Fe + Cl2
CаO + CO2
Ca(OH)2 + HBr
K2O + MgO
Mg + H2SO4
Вариант II
CaO + H2SO4
Fe + HCl
K + S
NaOH + SO3
KCl + Ca(OH)2
Na + Br2
III Мотивация учебной деятельности
На предыдущих уроках были рассмотрены строение и свойства типичных металлов. На данном уроке рассмотрим строение и свойства ещё одного металла, без которого не мыслима современная жизнь.
Два тысячелетия тому римскому императору Тиберию неизвестный подарил очень лёгкую вазу, изготовленную из металла, похожего на серебро. Мастер рассказал, что этот металл он получил из глинистой земли. Тиберий испугался, что новый металл обесценит серебро и золото, и приказал отрубить мастеру голову, а его лабораторию уничтожить, чтобы никто не узнал о способе получения нового металла.
Наполеон III, когда устраивал приёмы для важных гостей, пользовался посудой из этого металла.
В начале XX столетия один монарх имел праздничную одежду с пуговицами из этого металла.
О каком металле пойдёт речь?
IV Изучение нового материала
Фронтальная беседа
Какие элементы расположены в III группе главной подгруппы?
Что общего в строении атомов этих элементов? Изобразите строение атомов бора, алюминия, галлия по рядам.
Какие изменения в свойствах элементов, радиусов и электроотрицательностей их атомов наблюдаются в III А группе? Поясните эти изменения.
Составьте формулы высших оксидов, гидроксидов. Определите валентности, степени окисления.
В чём состоит особенность строения атома алюминия?
Выскажите предположение по поводу свойств этого элемента.
Сравните свойства алюминия и магния.
Дайте характеристику металлической связи.
Определите модель кристаллической решётки алюминия.
Нахождение в природе
Проблемный вопрос: Существует ли в природе самородный алюминий? Для ответа используйте ряд напряжений металлов.
В природе алюминий встречается в виде соединений:
каолин Al2O3.2SiO2.2H2O
бокситы Al2O3.3H2O
нефелин NaAlSiO4
криолит Na3AlF6
Немного истории.
В Китае есть гробница известного полководца Чжоу Чжу, который умер в начале III столетия. В XX веке был сделан спектральный анализ орнамента гробницы и определён его состав: сплав содержал 85% алюминия.
Д.И.Менделееву подарили дорогие весы, значительная часть деталей в которых была сделана из алюминия. Алюминиевые вещи были дорогими, потому что был неизвестен выгодный промыщленный способ получения алюминия. Его открыли лишь в XX веке.
В настоящее время алюминий получают из глинозёма в расплаве криолита путём электролиза.
Физические свойства алюминия
Демонстрация: Поверхность алюминиевого изделия царапаем лезвием ножа: свежий срез ярко блестит.
Работа с учебником и дополнительной литературой по физическим свойствам алюминия.
Алюминий серебристо-белый металл, ковкий, легко вытягивается в проволоку, tпл = 650 °C, tкип = 2520 °C. При комнатной температуре алюминий не изменяется, потому что его поверхность покрыта тонкой оксидной плёнкой, которая оказывает сильное защитное действие.
Ответьте на вопрос: почему ложки, вилки, кастрюли, вазы изготавливают из алюминия?
Демонстрация механической прочности оксидной плёнки.
Нагреваем алюминиевую проволоку и отмечаем, что алюминий плавиться, но не течёт.
Химические свойства алюминия
Проблемный вопрос: Можно ли хранить раствор соды в алюминиевой посуде? Можно ли ставить скисать молоко в алюминиевой посуде?
Фронтальная беседа
Какие общие химические свойства характерны для металлов?
Будут ли перечисленные свойства проявлять алюминий?
Кроме перечисленных свойств, какие ещё свойства будут характерны для алюминия?
Учащиеся записывают уравнения реакций, характеризующих взаимодействие алюминия с неметаллами
Лабораторный опыт: Учащиеся проводят химические реакции и записывают уравнения реакций, подтверждающих взаимодействие алюминия с растворами кислот.
Фронтальная беседа
Вспомните, что происходит, если алюминиевую кастрюлю с водой нагревать, мыть алюминиевую столовую посуду в тёплой воде. Почему?
Проблемный вопрос: Почему алюминий, находящийся в электрохимическом ряду напряжений металлов до водорода, после магния, должен характеризоваться значительной активностью, но не взаимодействует с водой при нагревании и пассивен?
Лабораторный опыт: Учащиеся изучают взаимодействие алюминия с раствором щёлочи.
Проблемный вопрос: Почему во время долгого путешествия еду заворачивают в алюминиевую фольгу?
Рассматриваем взаимодействие алюминия с оксидами металлов.
Применение алюминия
Алюминий и его сплавы широко применяются в народном хозяйстве благодаря лёгкости и устойчивости к воздействию воздуха и воды. В виде разных сплавов алюминий применяется в авиации (дюралюминий), в судостроении (магналин), в машиностроении (силумин), в строительстве, в приборостроении. Его применяют для получения металлов и неметаллов.
V Закрепление изученного материала
1. Осуществите цепочку превращения:
Al Al2(SO4)3 AlCl3
2. Объясните наличие хорошей электропроводности алюминия.
3. 24г смеси алюминия с медью обработали соляной кислотой и собрали 14,8л водорода (н.у.). Определите процентный состав смеси.
4.Напишите уравнения реакций, согласно которым протекают нижеприведенные превращения:
а/ Al3+ Al0
б/ Al0 Al2S3
в/ Al3+ Al(OH)3
VI Подведение итогов
VII Домашнее задание: изучить конспект,
Решить задачу:
Сколько потребуется алюминия для получения железа из 1кг железной руды, содержащей 80 % оксида железа (III)
Выполнить упражнение:
Осуществить цепочку превращения:
Al AlCl3 Al(OH)3 Al2(SO4)3
Приложение
ОПОРНЫЙ КОНСПЕКТ
Физические свойства алюминия
Металлический блеск, серебристо-белый цвет, легкоплавкий (tпл = 660°C), лёгкий (ρ = 2,7 г/см3), высокая пластичность, высокая электропроводность и теплопроводность.
Химические свойства алюминия
Взаимодействие с неметаллами
4Al + 3O2 = 2Al2O3
2Al + 3I2 = 2AlI3
2Al + 3S = Al2S3
Взаимодействие с водой
2Al + 6H2O = 2Al(OH)3 + 3H2
Взаимодействие с кислотами
2Al + 6HCl = 2AlCl3 + 3H2
4. Взаимодействие со щелочами
Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2
или
Al + 2NaOH +6H2O = 2Na[Al(OH)4] + 3H2
Так как алюминий взаимодействует и с кислотами и со щелочами, значит, он обладает амфотерными свойствами.
5. Взаимодействие с солями
2Al + 3CuCl2 = 2AlCl3 + 3Cu
6. Взаимодействие с оксидами металлов
8Al + 3Fe3O4 = 4Al2O3 +9Fe
Этот метод получения металлов называется алюмотермией.
infourok.ru
Алюминий: физические и химические свойства
Тема: «Алюминий: физические и химические свойства»
Учитель химии: Леоненко Н.В.
Урок изучения нового материала с мультимедийным сопровождением.
Цели:
сформировать знания о физико-механических и химических свойствах алюминия на основе его положения в периодической системе, строения атома и кристалла;
установить причинно-следственную связь между строением и свойствами при сравнении металлов I, II, III групп главных подгрупп;
продолжить развитие умений наблюдать, делать выводы, объяснять ход эксперимента;
формировать навыки составления уравнений химических реакций с участием простых веществ;
показать практическое значение химических знаний.
Оборудование: схема-кластер; видеоматериалы с демонстрационными опытами; презентация, компьютер, экран, проектор, наборы реактивов на столах (алюминиевая проволока, фольга, растворы соляной кислоты, гидроксида натрия).
Ход урока
Учитель: Из глины я обыкновенной,
Но я на редкость современный,
Я не боюсь электротока,
Бесстрашно в воздухе лечу;
Служу на кухне я без срока-
Мне все задачи по плечу.
Горжусь своим я именем:
Зовусь я…………..(алюминием).
Сообщение темы и целей урока (запись темы в тетради)
Учитель: «Однажды к древнеримскому императору Тиберию пришел ремесленник и принес чашу невиданной красоты, изготовленную из серебристого и на удивление легкого металла. На вопрос императора о названии чудесного металла ремесленник ответил, что металл получен им из … глины и пока не имеет названия. Император, испугавшись, что новый металл, который можно получать из обыкновенной глины, обесценит серебро и подорвет могущество Рима, повелел чашу уничтожить, ремесленника обезглавить, его мастерскую сравнять с землей!». Теперь, по прошествии тысячелетий, мы не можем сказать, сколько правды лежит в основе этой легенды, рассказанной римским историком Плинием Старшим в своей «Естественной истории», но значительная доля правды в ней кроется. Действительно, алюминий-серебристо-белый, но в отличие от серебра, на удивление легкий металл, который в принципе можно получить даже из глины. Не случайно у нас в России в XIX столетии алюминий называли «глиний».
Сегодня нам предстоит знакомство с алюминием как химическим элементом, так и простым веществом.
Обратите внимание: на ваших столах находятся схемы-кластеры. Именно по ним мы будем поэтапно изучать самый распространенный металл на земле.
Каждому ряду предлагается самостоятельная работа.
Самостоятельная работа.
1 ряд.
Дать характеристику элементу №13 по положению в периодической таблице.
2 ряд.
Указать состав ядра алюминия и строение электронной оболочки.
3 ряд.
Сопоставить строение атомов натрия, магния, алюминия и сделать вывод о химической активности этих металлов.
Ответы учащихся:
Алюминий-металл, находится в 3 группе главной подгруппе, третьем малом периоде; порядковый номер-13, Аr(Аl)=27.
Строение атома: Z(Аl)=13, е(Аl)=13, N(Аl)= Аr-Z= 27-13=14
Аl 1s2,2s2,2р6,3s2,3р1
Аl 1s2,2s2,2р6,3s1,3р2
Выводы: Степень окисления: +3, следовательно, алюминий в реакциях будет восстановитель.
Тип химической связи: металлическая.
Тип кристаллической решетки: металлическая.
Металлические свойства ярче выражены у кальция и еще сильнее у натрия по сравнению с алюминием, так как в ряду Na—Са—Аl число электронов на внешнем энергетическом уровне увеличивается, сила притяжения между ядром и электронами внешнего энергетического уровня увеличивается, атомный радиус уменьшается, энергия ионизации увеличивается, электроотрицательность увеличивается. Следовательно, химическая активность в ряду уменьшается.
Учитель: Но в электрохимическом ряду напряжения металлов алюминий расположен сразу после щелочноземельных металлов. Следовательно, можно предположить о его достаточной химической активности. Поэтому в природе алюминий в свободном виде не встречается. В природе алюминий встречается в виде:
— бокситов,
— каолина,
— нефелина и т. д. (Слайд- )
Месторождения алюминиевого сырья имеются на Урале, в Казахстане, Башкирии.
Учитель: Рассмотрев особенности химического элемента алюминия, перейдем к изучению простого вещества.
Лабораторная работа по теме:
«Физические свойства алюминия»
Инструктивная карта.
1. Рассмотрите алюминиевую проволоку и фольгу.
2. Определите агрегатное состояние вещества алюминия.
3. Какого цвета образцы металла?
4. Определите, имеет ли блеск металл?
5. Опустите кусочек проволоки в воду. Наблюдается ли растворение алюминия в воде?
6. Кратко запишите свои наблюдения согласно плану:
— агрегатное состояние,
— цвет,
— блеск,
— пластичность,
— растворимость в воде.
Дополнение учителя:
— легкий металл; плотность=2,7г/см3
— легкоплавкий металл: tпл.=660оС
— электропроводен (3-е место по электропроводности),
— алюминий в воде не растворяется, т.к. на его поверхности образуется оксидная пленка.
(Слайд-физические свойства алюминия).
Учитель: Мы с вами выяснили, что в химических реакциях алюминий будет проявлять восстановительные свойства. С какими же веществами он должен взаимодействовать?
Учащиеся: Как с простыми, так и со сложными веществами.
Учитель: Записываем: Химические свойства алюминия.
I. Алюминий взаимодействует с простыми веществами- неметаллами.
Опыт: Сгорание порошка алюминия.
Горение бенгальской свечи.
Учитель: Пока горит бенгальская свеча, записываем уравнение химической реакции и разбираем его, как ОВР. 4Аl+3О2=2Аl2О3
Опыт: Взаимодействие алюминия с йодом: смешиваем порошок алюминия с йодом в соотношении 1:15, в середину смеси капаем две капли воды. Врезультате реакции образуется иодит алюминия и фиолетовые пары йода.
Учитель: Записываем уравнение реакции и разбираем его как ОВР.
2Аl+3I2=2АlI3
Видео: — взаимодействие алюминия с бромом;
— взаимодействие алюминия с серой.
Учитель: Записываем уравнения реакций и разбираем как ОВР.
2Аl+3Вr2=2АlВr3
2Аl+3S=Аl2S3
Учитель: Уравнения реакций взаимодействия алюминия с азотом, углеродом и фосфором записываем в молекулярном виде, а дома разбираем как ОВР.
2Аl+N2=2АlN(t800оС)
4Аl+3С=Аl4С3(t2000оС)
Аl+Р=АlР(t500оС)
II. Алюминий взаимодействует со сложными веществами.
Лабораторная работа по теме:
«Взаимодействие алюминия с кислотами и щелочами».
Инструктивная карта.
1. Возьмите две пробирки. В каждую положите по кусочку алюминия. Прилейте в одну из них 1-2 мл. раствора соляной кислоты, а в другую столько же раствора щелочи (NаОН). Что наблюдаете? Пробирки слегка нагрейте.
2. Запишите уравнения соответствующих реакций.
3. Сделайте выводы.
Учащиеся записывают уравнения реакций на доске и разбирают их в свете ОВР.
2Аl+6HCl=2AlCl3+3h3
2Al+2NaOH+2h3O=2NaAlO2+3h3
Вывод: Алюминий проявляет амфотерные свойства, так как взаимодействует как с растворами кислот, так и с растворами щелочей.
Учитель: Для алюминия характерными являются реакции взаимодействия с солями, в состав которых входит менее активный металл: (Cлайд )
2АL+3СиSO4=Al2(SO4)3+3Cu,
а также алюминотермия- взаимодействие более активного металла с оксидом менее активного металла: 8Аl+ 3Fe3O4=9Fe+4Al2O3
Учитель: Алюминий взаимодействует с водой (без оксидной пленки):
2 Аl+6h3O=2Al(OH)3+3h3
Записанные уравнения реакций дома разобрать как окислительно-восстановительные.
Алюминий не реагирует с коцентрированными азотной и серной кислотами на холоде.
Учитель: Получение алюминия:
Из минералов в промышленности алюминий может быть получен в основном электролизом расплава:
2Аl2О3——4Аl+3О2
При получении алюминия используют также металлический натрий:
АlCl3+3Na=Al+3NaCl (метод датского ученого Г.Эрстеда, впервые получившего алюминий).
Опираясь на физические и химические свойства, а также получение, рассмотрим применение алюминия.
Учащий ся.
Применение алюминия и его сплавов во всех видах транспорта, а в особенности воздушного, привело к уменьшению собственной массы транспортных средств и к резкому увеличению эффективности их использования.
Авиаконструкции, моторы, блоки, головки цилиндров, картеры, коробки передач, насосы и многие другие детали также изготавливают из алюминия и его сплавов.
Алюминий и его сплавы применяют также при отделки железнодорожных вагонов, изготовлении корпусов и дымовых труб, спасательных лодок, радарных матч, трапов.Активно используют алюминий и его сплавы в электротехнической промышленности для изготовления кабелей, шинопроводов, конденсаторов, выпрямителей переменного тока. В приборостроении алюминий и его сплавы используют в производстве кино- и фотоаппаратуры, радиотелефонной аппаратуры. Алюминий применяется в строительстве и ядерной энергетике. Нет ни одной отрасли народного хозяйства, где бы не находил применение алюминий.
Закрепление.
Тест.
1 ряд.
1.Какова электронная конфигурация атома алюминия?
А) 1s22s22p1 Б)1s22s22p3
B) 1s22s22p63s23p1 Г) 1s22s22p63s23p63d14s2
2. С какими из указанных веществ реагирует алюминий?
А) СаО Б) HCl
B) Cl2 Г) NaOH
2 ряд.
1. Какие из указанных металлов являются более активными, чем алюминий?
А) Na Б) Cu
B) Ca Г) Fe
2. Наиболее характерная степень окисления алюминия:
А) +1 Б) +2
В) +3 Г) +4
3 ряд.
1. Алюминий в химических реакциях проявляет свойства:
А) окислителя Б) инертного соединения
В) восстановителя Г) окислителя и восстановителя
2. В промышленности алюминий получают:
А) используя в качестве восстановителя металлический натрий
Б) электролизом расплава оксида алюминия
В) используя в качестве восстановителя оксид углерода (П)
Г) электролизом раствора солей алюминия
1. Алюминий- самый распространенный химический элемент- метал в земной коре.
2. В химических реакциях алюминий является восстановителем, его степень окисления равна +3.
3. Алюминий- активный металл, взаимодействует как с простыми, так и со сложными веществами.
4. Алюминий- амфотерный металл, так как реагирует и с кислотами и со щелочами.
5. В промышленности алюминий получают электролизом расплава оксида алюминия.
Это интересно!!!
Металлический алюминий первым выделил в 1825 году датский химик Ханс Кристиан Эрстед. Пропустив газообразный хлор через слой раскаленного оксида алюминия, смешанного с углем, Эрстед выделил хлорид алюминия без малейших следов влаги. Чтобы восстановить металлический алюминий, Эрстеду понадобилось обработать хлорид алюминия амальгамой калия. Через 2 года Фридрих Велер усовершенствовал метод, заменив амальгаму калия чистым калием.
Домашнее задание: параграф 13, упр.2-5.
Типы химических реакций.
Фрагмент урока: Проведение лабораторной работы по теме «Типы химических реакций».
Цели:
сформировать знания об основных типах химических реакций, выполнив лабораторную работу и, закрепив имеющиеся знания на примере демонстрационного эксперимента;
установить причинно-следственную связь между строением и свойствами веществ при определении типов химических реакций и составлении уравнений реакций;
продолжить развитие умений наблюдать, делать выводы, объяснять ход эксперимента;
формировать навыки составления уравнений химических реакций с участием простых и сложных веществ;
показать практическое значение химических знаний.
Оборудование: схема-кластер; видеоматериалы с демонстрационными опытами; презентация, компьютер, экран, проектор, наборы реактивов на столах (пероксид водорода, оксид марганца (IV), лучинка, спички, цинк, раствор соляной кислоты, магниевая лента).
Методы: обучения— 1. эвристический,
диалогический,
программированный;
преподавания- 1. побуждающий,
стимулирующий,
инструктивный,
объяснительный;
учения- 1. частично-поисковый,
практический,
репродуктивный.
Ход урока.
Актуализация знаний.
Дать определения реакциям соединения, замещения, разложения.
Предполагаемый ответ. Реакции соединения— это реакции, в результате которых из нескольких простых или сложных веществ
образуется одно более сложное вещество.
Реакции разложения— это реакции, в результате которых из одного сложного вещества образуется несколько простых или сложных веществ.
Реакции замещения— это реакции между простым и сложным веществами, в результате которых атомы простого вещества замещают атомы в сложном веществе.
Лабораторная работа по теме «Типы химических реакций».
Задание 1.
В химический стакан налить пероксид водорода, далее добавить оксид марганца (IV) и внести в верхнюю часть стакана тлеющую лучинку. Что наблюдаете? Какой газ выделился? Написать уравнение реакции разложения пероксида водорода. Слить воду из стакана в пустую емкость, добавив к твердому остатку перосид водорода и внести тлеющую лучинку. Что наблюдаете? Сделайте вывод.
Задание 2.
В пробирку поместите таблетки цинка и прилейте раствор соляной или хлороводородной кислоты. Что наблюдаете? Запишите уравнение реакции. Сделайте вывод.
Задание 3.
Сожгите магниевую ленту. Что наблюдаете? Напишите уравнение реакции. Сделайте вывод.
Проверь свои знания по теме «Типы химических реакций».
Опыт 1. В один цилиндр помещаем раствор аммиака, а в другой цилиндр немного концентрированной соляной кислоты. Соединяем отверстия цилиндров и наблюдаем появление «дыма»- хлорида аммония. Написать уравнение реакции. Вывод?
Опыт 2. Взаимодействие натрия с водой. Что наблюдаете? Написать уравнение реакции. Вывод?
Опыт 3. Разложение перманганата калия. Что наблюдаете? Напишите уравнение реакции. Вывод?
Написать уравнения реакций.
Задания на экране.
Распределить предложенные уравнения реакций по типам:
соединения;
замещения;
разложения.
Выводы:
1. Химическая реакция- это процесс превращения исходных веществ в продукты реакции.
2. Уравнение реакции- это условная запись химической реакции.
3. Реакции классифицируются по исходным веществам и продуктам реакции на р. соединения, р. замещения и р. разложения; по тепловому эффекту: на экзотермические и эндотермические.
4. Все химические реакции находят большое применение в народном хозяйстве.
Домашнее задание: Параграф 29,30,31.
infourok.ru