Основные физико-химические свойства сероводорода (h3S) и важнейшие соединения серы
- Основные физико-химические свойства сероводорода:
- Молекулярная масса: 34,076
- Температура плавления (при 760 мм рт. ст.), °С: -82,9
- Температура кипения (при 760 мм рт. ст.), °C: -60,33
- Температура воспламенения, °С: 260
- Предельная объемная концентрация воспламенения, %: 4,3
- Плотность при 760 мм рт. ст. и 0 °С, кг/м3: 1,5392
- Плотность жидкого газа при 760 мм рт. ст., кг/м3: 950
- Теплоёмкость газа при 760 мм рт. ст. и 0 °С, ккал/(кг•°С):
- при постоянном давлении: 0,254
- при постоянном объеме: 0,192
- Теплота сгорания при 760 мм рт. ст. и 15 °С, ккал/кг: 4156
Важнейшие соединения серы
Соединения серы со степенью окисления -2
Сероводород H2S.
Сероводород H2S встречается в природе в водах некоторых минеральных источников, в вулканических газах, в попутных газах месторождения нефти. Бесцветный газ с неприятным запахом тухлых яиц, tпл = -86 °С, tкип = -60 °С. Ядовит. В твердом состоянии существует в трех различных модификациях. Мало растворим в воде, водный раствор H2S — это слабая кислота. К1 = 0,87•10-7, К2= 10-14. Сильный восстановитель. Получают в промышленности как побочный продукт при очистке нефти, природного и коксового газа. В лаборатории часто получают в аппарате Киппа при взаимодействии FeS c HCl. Применяют в производстве H2SO4, S; для получения сульфидов, сераорганических соединений; в аналитической химии для осаждения сульфидов; для приготовления лечебных, сероводородных ванн. Раздражает слизистые оболочки и дыхательные органы.
Бесцветный газ с неприятным запахом тухлых яиц, tпл = -86 °С, tкип = -60 °С. Ядовит. В твердом состоянии существует в трех различных модификациях. Мало растворим в воде, водный раствор H2S — это слабая кислота. К1 = 0,87•10-7, К2= 10-14. Сильный восстановитель. Получают в промышленности как побочный продукт при очистке нефти, природного и коксового газа. В лаборатории часто получают в аппарате Киппа при взаимодействии FeS c HCl. Применяют в производстве H2SO4, S; для получения сульфидов, сераорганических соединений; в аналитической химии для осаждения сульфидов; для приготовления лечебных, сероводородных ванн. Раздражает слизистые оболочки и дыхательные органы.
Соединения серы со степенью окисления +1
Оксид серы (I) S2O.
Оксид серы (I) S2O это желтый газ, который может несколько часов сохраняться при комнатной температуре (в чистом и сухом сосуде) лишь под давлением не выше 40 мм. рт. ст. Молекула SO2 полярна. Сильное охлаждение переводит закись серы в оранжево-красное твердое вещество. Молекулярным кислородом при обычной температуре не окисляется, а водой легко разлагается. Более или менее легко реагирует с большинством металлов. Получают при взаимодействии SO2 с серой.
рт. ст. Молекула SO2 полярна. Сильное охлаждение переводит закись серы в оранжево-красное твердое вещество. Молекулярным кислородом при обычной температуре не окисляется, а водой легко разлагается. Более или менее легко реагирует с большинством металлов. Получают при взаимодействии SO2 с серой.
Хлористая сера S2Cl2.
Хлористая сера S2Cl2 это бесцветная жидкость, tпл = -77 °С, tкип = 138 °С. Получают в больших количествах прямым действием сухого хлора на избыток серы. Применяют для получения двухлористой серы.
Соединения серы со степенью окисления +2
Серноватистая (тиосерная) кислота H2S2O3.
Сильная кислота (по силе близка к серной кислоте). При комнатной температуре неустойчива и разлагается на H2O, SO2 и S. Молярная электропроводность при бесконечном разведении при 25 °С равна 874,4 Cм•см2/моль.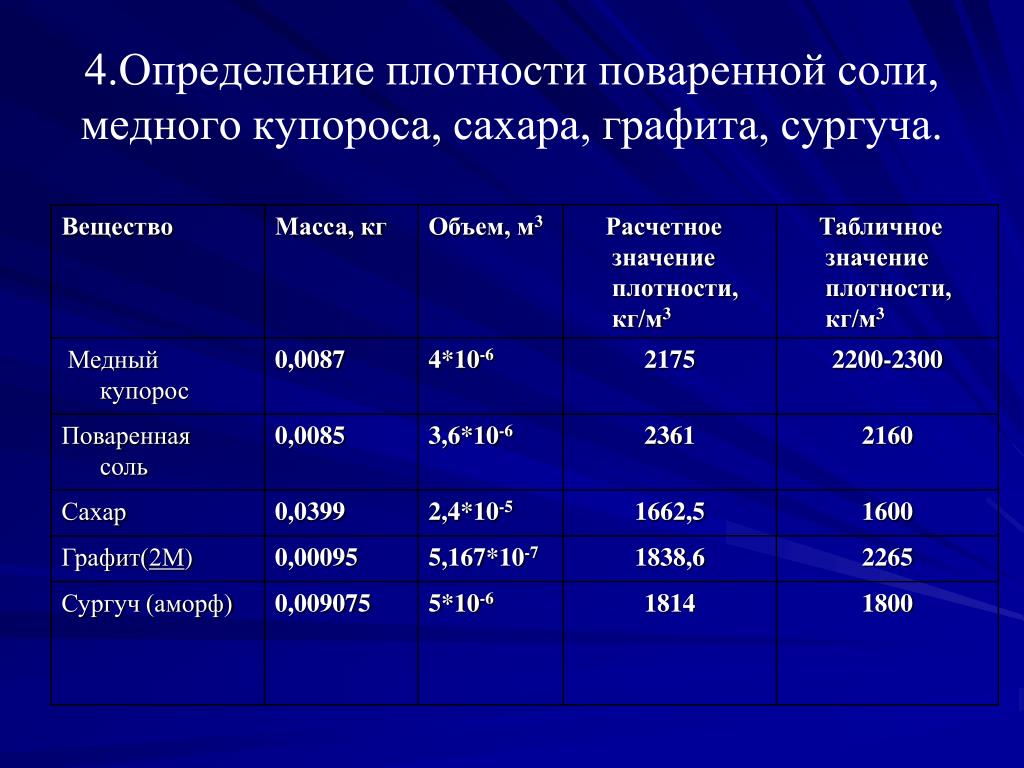
Двухлористая сера SCl2.
Жидкость красного цвета, tпл = -78 °С, tкип = 60 °С. Молекула SCl2 имеет форму равнобедренного треугольника. Получается при взаимодействии хлористой серы с хлором. В обычных условиях медленно разлагается на хлористую серу и хлор.
Соединения серы со степенью окисления +3
Дитионистая кислота H2S2O4.
Неустойчива и в свободном состоянии не получена.
Соединения серы со степенью окисления +4
Оксид серы (IV) SO2.
Бесцветный газ с удушливым запахом, легко превращаемый в жидкость, tпл = -75 °С, tкип = -10 °С. Ядовит. Хорошо растворим в воде. При растворении образуется полигидрат SO2•nH2O кислотного характера. Получают сжиганием элементной серы или обжигом руды — пирита FeS2. Образуется также в ряде металлургических процессов и при сжигании каменных углей, всегда содержащих некоторое количество серы. Особенно много SO2 выделяют работающие на каменном угле электростанции. Небольшие количества SO2 удобно получать в лаборатории из сульфитов. Применяют для производства серной кислоты, в текстильной промышленности, в качестве обесцвечивающего вещества в сахарном производстве, пищевой промышленности, для дезинфекции помещений и уничтожения паразитов на теле животных.
Особенно много SO2 выделяют работающие на каменном угле электростанции. Небольшие количества SO2 удобно получать в лаборатории из сульфитов. Применяют для производства серной кислоты, в текстильной промышленности, в качестве обесцвечивающего вещества в сахарном производстве, пищевой промышленности, для дезинфекции помещений и уничтожения паразитов на теле животных.
Сернистая кислота H2SO3.
Двухосновная кислота средней силы. Неустойчива. В свободном состоянии не выделена. Молярная электропроводность при бесконечном разведении при 25 °С равна 843,6 Cм•см2/моль.
Хлористый тионил SOCl2.
Бесцветная жидкость с резким запахом, tпл = -100 °С, tкип = 76 °С. Является плохим растворителем типичных солей, но хорошим для многих менее полярных веществ. Взаимодействует с водой. Применяется для изготовления красителей, фармацевтических препаратов. Им удобно пользоваться для получения безводных хлоридов металлов из их кристаллогидратов.
Им удобно пользоваться для получения безводных хлоридов металлов из их кристаллогидратов.
Соединения серы со степенью окисления +6
Оксид серы (VI) SO3.
Известен в трех модификациях: a, b, g. При конденсации паров SO3 образуется бесцветные, прозрачные как лед кристаллы ( tпл = 62 °С), это g-форма, которая при хранении переходит в b-форму, похожую на асбест ( tпл= 32 °С). a-форма ( tпл = 17 °С, tкип = 44,8 °С) образуется при особых условиях. Из этих трех форм наиболее высоким давлением пара обладает g-форма. Полученный серный ангидрид может быть твердым или частично жидким. Жадно соединяясь с водой, дымит на воздухе. В воде он растворяется с образованием серной кислоты. Образует соединения с водой, аммиаком или его органическими производными. Получают окислением сернистого газа.
Серная кислота H2SO4.
Безводная серная кислота — бесцветная маслянистая жидкость, без запаха, tпл = 10 °С, tкип = 296 °С. Концентрированная серная кислота вызывает ожоги кожи. Серная кислота может быть различной чистоты и концентрации. Плотность увеличивается с концентрацией и достигает максимального значения при концентрации 98,3%, при дальнейшем повышении концентрации плотность кислоты снижается. Растворение в воде сопровождается выделением большого количества тепла и уменьшением объема. При давлении 760 мм рт. ст. все водные растворы кипят при температуре выше 100 °С, точка кипения повышается с увеличением концентрации. Мало летуча. Концентрированная серная кислота действует почти на все металлы без выделения водорода. Молярная электропроводность при бесконечном разведении при 25 °С равна 859,6 Cм•см2/моль. Для промышленного получения применяются два способа: нитрозный и контактный. Основным исходным продуктом в обоих случаях является сернистый газ. Является важнейшим химическим продуктом. Применяется почти во всех отраслях химической промышленности и в целом ряде других отраслей народного хозяйства.
Концентрированная серная кислота вызывает ожоги кожи. Серная кислота может быть различной чистоты и концентрации. Плотность увеличивается с концентрацией и достигает максимального значения при концентрации 98,3%, при дальнейшем повышении концентрации плотность кислоты снижается. Растворение в воде сопровождается выделением большого количества тепла и уменьшением объема. При давлении 760 мм рт. ст. все водные растворы кипят при температуре выше 100 °С, точка кипения повышается с увеличением концентрации. Мало летуча. Концентрированная серная кислота действует почти на все металлы без выделения водорода. Молярная электропроводность при бесконечном разведении при 25 °С равна 859,6 Cм•см2/моль. Для промышленного получения применяются два способа: нитрозный и контактный. Основным исходным продуктом в обоих случаях является сернистый газ. Является важнейшим химическим продуктом. Применяется почти во всех отраслях химической промышленности и в целом ряде других отраслей народного хозяйства.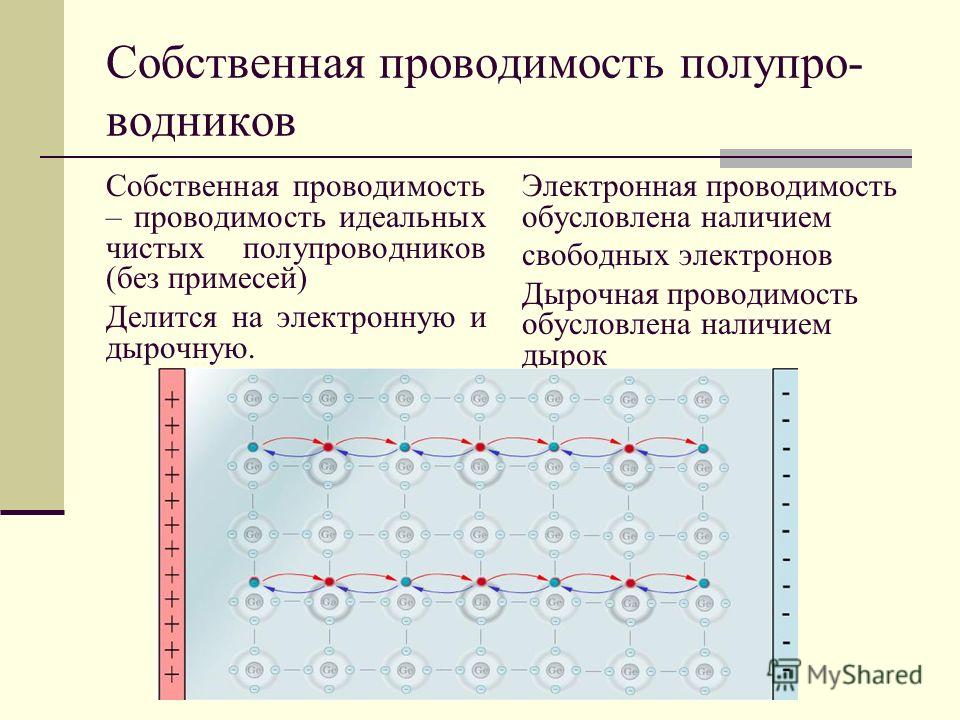
Хлористый сульфурил SO2Cl2.
Представляет собой бесцветную жидкость с резким запахом, tпл = -54 °С, tкип = 69 °С. Холодная вода действует на него медленно, но горячей он быстро разлагается с образованием серной и соляной кислот.
Для получения технико-коммерческого предложения на строительство надежной, инновационной станции подготовки попутного газа Вам необходимо заполнить опросный лист.
Для получения технико-коммерческого предложения на поставку модуля сероочистки попутного газа Вам надо заполнить опросный лист.
Доклад-сообщение Сера 4, 9 класс по химии
- Энциклопедия
- Разное
- Сера
Физические свойства
В периодической таблице Менделеева сера находится в VIA группе (шестая группа, подгруппа А), в третьем периоде. Она относится к немногочисленной группе неметаллов: Периодическая система насчитывает их всего 22, в том числе инертные газы. Как неметалл сера проявляет такие физические свойства: хрупкость, плохая тепло- и электропроводность, в отличие от металлов не обладает ковкостью и тягучестью. В естественных условиях она находится в твердом состоянии.
Как неметалл сера проявляет такие физические свойства: хрупкость, плохая тепло- и электропроводность, в отличие от металлов не обладает ковкостью и тягучестью. В естественных условиях она находится в твердом состоянии.
Аллотропия
Говоря о физическом состоянии серы, надо упомянуть о ее аллотропии, то есть о существовании нескольких форм в одном физическом состоянии. У серы есть 5 таких форм или аллотропов. Это связано со способностью серы создавать устойчивые ряды из ее атомов. Такие молекулы S8 имеют форму короны и образуют аллотропы: ромбическую и моноклинную серу — кристаллическую хрупкую желтую. Молекулы S6 и S4 – пластическую серу — вязкую, коричневую, получаемую при нагревании кристаллической серы до температуры выше 120 градусов.
Химические свойства
Сера обладает окислительными свойствами. С щелочными металлами она вступает в реакцию при обычной температуре. С остальными, кроме золота и платины, при повышении температуры.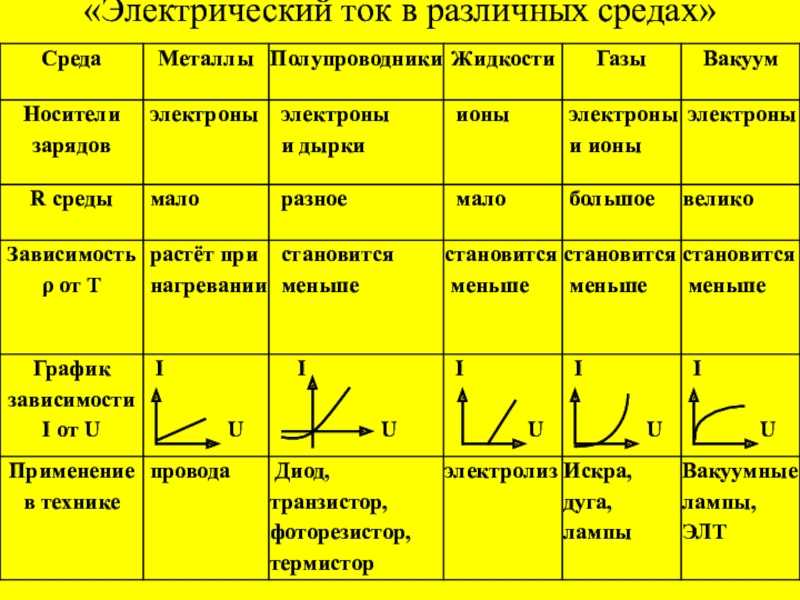 С неметаллами, такими как водород, углерод, фосфор, у серы также получаются бинарные соединения (это соединения, образующиеся в результате связывания двух элементов). Эти бинарные соединения называются сульфидами. Сероводород — h3S – является слабой сероводородной кислотой. Сульфиды металлов являются ее солями.
С неметаллами, такими как водород, углерод, фосфор, у серы также получаются бинарные соединения (это соединения, образующиеся в результате связывания двух элементов). Эти бинарные соединения называются сульфидами. Сероводород — h3S – является слабой сероводородной кислотой. Сульфиды металлов являются ее солями.
Когда сера встречает более сильный окислитель, чем она сама, то проявляет восстановительные свойства, например, с кислородом, хлором (и другими галогенами, кроме йода), сильными кислотами.
Сера выступает в качестве окислителя и восстановителя одновременно в реакции диспропорционирования. При этой реакции образуются соединения, содержащие разные степени окисления одного и того же элемента.
История применения серы человеком
Серой не одну тысячу лет пользовались первобытные «химики». Сера в самородном виде распространена в странах древних цивилизаций. Она использовалась для религиозных церемоний и ритуалов, ею отбеливали ткани, боролись с насекомыми, из нее готовили косметику и лекарства. После изобретения пороха добыча серы сильно возросла, так как сера необходимый его компонент.
После изобретения пороха добыча серы сильно возросла, так как сера необходимый его компонент.
Сегодня половина добываемой серы идет на производство серной кислоты, крайне необходимой в химической промышленности. Сера и соединения серы применяются в производстве резины, бумаги, лекарств, тканей, пластмасс, краски, удобрений, ядохимикатов и многих других вещей.
Где содержится сера в природе
В чистом виде сера добывается в местах с вулканической активностью, но не только. На планете есть также месторождения сульфидов: железный и медный колчедан, киноварь, и сульфатных соединений: гипс, ангидрит, сульфат магния, сульфат натрия и другие. Соединения серы могут содержаться в нефти и природном газе. Сера встроена в состав белка.
4, 9 класс по химии
Сера
Популярные темы сообщений
- Мухомор
Мухомор — микориз образующий пластинчатый гриб. Он принадлежит к семейству аманитовых.
 В пищу большую часть Мухоморов употреблять нельзя, так как они содержат ядовитые вещества. Семейство Мухоморов состоит из 600 видов.
В пищу большую часть Мухоморов употреблять нельзя, так как они содержат ядовитые вещества. Семейство Мухоморов состоит из 600 видов. - Организмы в океане Благодаря многим изучениям, а позже и снимкам с космоса, можно с уверенностью сказать, что большую часть земной поверхности занимают океаны. Все океаны Земли объединены в один — Мировой океан. Хоть все океаны и разделены материками все же,
- Тимофеевич Ермак
Велика и необъятна Русская земля. Начавшись с мелких феодальных княжеств, русское государство в итоге разрослось до 1/6 части суши. На протяжении многих веков постепенно присоединялись все новые и новые земли, и, пожалуй,
- Гидросфера
Гидросфера – это оболочка Земли, которая состоит из воды, не зависимо от ее состояния (твердого, жидкого, газообразного), и находится между литосферой и атмосферой. Она состоит из воды Мирового океана (96,5%) и воды суши (3,5%), а именно:
- Химия (история возникновения)
Химия – это наука о веществах и их свойствах, о превращениях веществ и способах управления этими превращениями.

Физические свойства серы
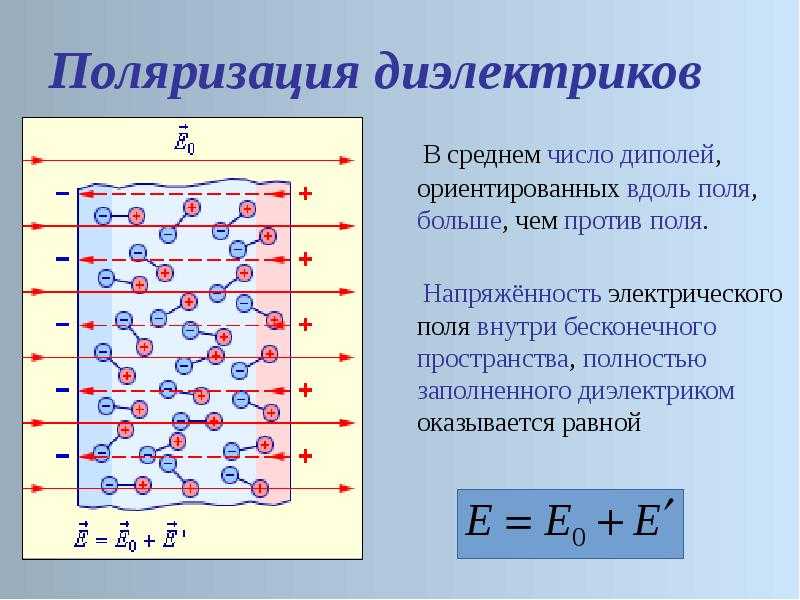
Физические свойства серы в твердом состоянии не проводят заметного электричества и поэтому образуют удобный изолирующий материал для некоторых целей, хотя чаще ее используют только в качестве ингредиента изолирующих составов или смесей. При трении сера заряжается отрицательно, а под действием излучения радия заряжается положительно. Расплавленная сера в значительной степени проводит электричество, хотя примеси могут частично способствовать этому характерному поведению.5 Электропроводность жидкости увеличивается до максимума примерно при 160°С, падает до минимума примерно при 185°С, а затем увеличивается. Удельное сопротивление при 163°С составляет примерно 7,5×10 10 Ом. Диэлектрическая проницаемость твердой серы составляет примерно 2,7, хотя возможны отклонения в зависимости от оси, вдоль которой производится измерение.
Из-за своей низкой теплопроводности твердая сера легко разрушается при нагревании, причем неравномерного расширения, вызванного теплом руки, достаточно, чтобы вызвать слышимый звук треска. Были получены следующие значения теплопроводности серы в диапазоне температур от 20° до 210°С:
| Форма. | Температура, °С | Теплопроводность. |
| Rhombic | 20 | 0.00065 |
| Rhombic | 40 | 0.00061 |
| Rhombic | 60 | 0.00058 |
| Rhombic | 80 | 0.00055 |
| Rhombic | 95 точка перехода | 0,00054 |
| Моноклиника | 100 | 0.00037 to 0.00040 |
| Plastic | 20 | 0.0002 |
| Liquid | 115 (m. pt.) pt.) | 0.00031 |
| Liquid | 120 | 0.00031 |
| Liquid | 140 | 0,00032 |
| Жидкость | 160 — область точки перехода | 0,00033 |
| Жидкая | 165 — область переходной точки | 0.00033 |
| Liquid | 170 — Transition point region | 0.00034 |
| Liquid | 190 | 0.00036 |
| Liquid | 210 | 0.00037 |
The latent heat of fusion of твердая сера изменяется в зависимости от различных аллотропных форм и температуры; она самая низкая для октаэдрической серы; на него также влияет доля нерастворимой серы (γ- или μ-) в исходном твердом веществе и в образовавшейся жидкости. При электрическом нагреве до температуры плавления найдена скрытая теплота плавления моноклинной серы, равная 8,85 г-кал. за грамм.
Скрытая теплота испарения серы (с точностью до 2 процентов) равна 79. скорость охлаждения и температура начала кристаллизации. Иногда кристаллизация происходит ритмично, что приводит к появлению кольцеобразного вида в структуре твердой массы. Утверждается, что кристаллизация переохлажденной расплавленной серы ускоряется под действием излучения радия, вероятно, β-лучей.
скорость охлаждения и температура начала кристаллизации. Иногда кристаллизация происходит ритмично, что приводит к появлению кольцеобразного вида в структуре твердой массы. Утверждается, что кристаллизация переохлажденной расплавленной серы ускоряется под действием излучения радия, вероятно, β-лучей.
В расплавленном состоянии плотность серы зависит только от температуры при условии, что достигнуто состояние равновесия между λ-серой и μ-серой; при 113°С плотность составляет 1,811, затем это значение несколько возрастает примерно до 160°С, а затем неуклонно падает до 1,480 при 446°С. Несколько исследователей измеряли коэффициент расширения, но из-за сложностей вносимые постепенной перестройкой равновесия при новых температурах, результаты не совсем согласуются между собой, хотя и дают подтверждающие доказательства существования равновесия. Средняя удельная теплоемкость подвижной серы 0,220, вязкой серы 0,29.0.
О замечательных изменениях вязкости расплавленной серы уже упоминалось.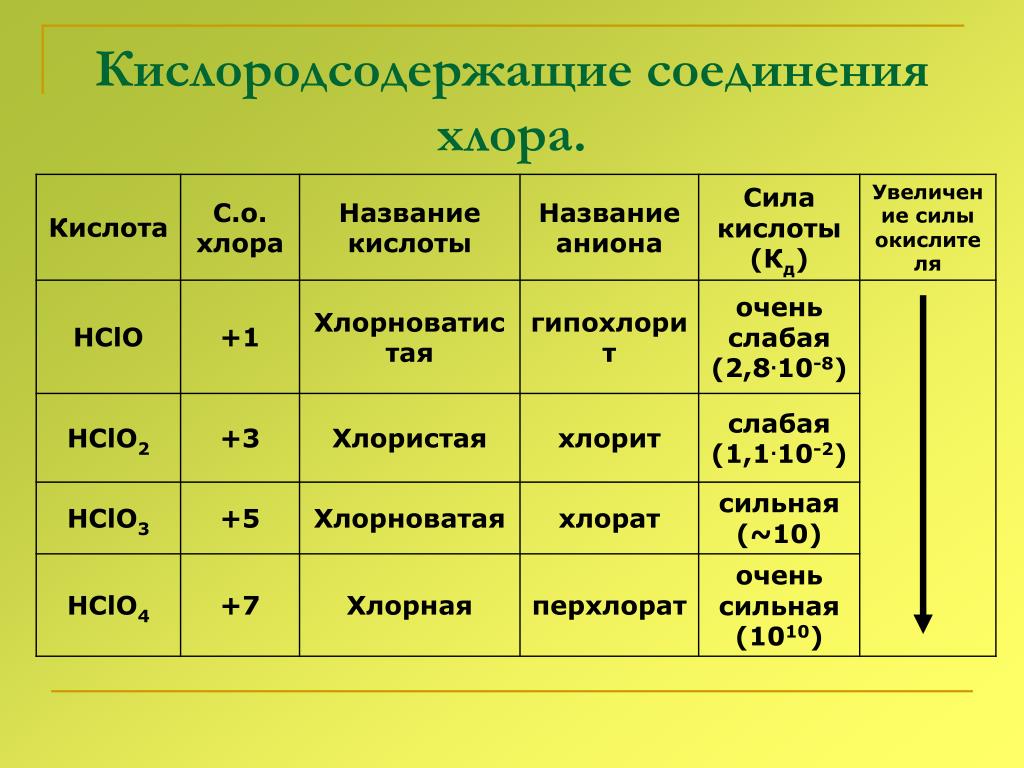 Определенные измерения были сделаны при ряде температур методом вращающихся цилиндров, и было обнаружено, что воздействие воздуха на жидкость, особенно при температуре ниже 160°С, оказывает заметное влияние на вязкость при температуре от 160°С и выше. . Вязкость очищенной (дважды перегнанной, но не дегазированной) серы имеет значение при 123°С 0,1094 сг.с. единицы измерения; это падает до минимума 0,0709при 150°С постепенно повышается примерно до 159°С, затем быстро возрастает выше этой температуры; однако точная точка перехода не наблюдается. Максимум для очищенной неэкспонированной (безгазовой) серы приходится примерно на 200°C и имеет значение 215 C.G.S. единицы измерения. Для очищенной (не дегазированной) серы после длительного пребывания на воздухе максимум приходится на около 190°С и может иметь значение до 800 сГС. единицы измерения. Такая высокая вязкость, по-видимому, возникает из-за примесей, главным из которых является серная кислота, образующихся в результате воздействия воздуха; заметное влияние оказывают также диоксид серы и аммиак в растворе.
Определенные измерения были сделаны при ряде температур методом вращающихся цилиндров, и было обнаружено, что воздействие воздуха на жидкость, особенно при температуре ниже 160°С, оказывает заметное влияние на вязкость при температуре от 160°С и выше. . Вязкость очищенной (дважды перегнанной, но не дегазированной) серы имеет значение при 123°С 0,1094 сг.с. единицы измерения; это падает до минимума 0,0709при 150°С постепенно повышается примерно до 159°С, затем быстро возрастает выше этой температуры; однако точная точка перехода не наблюдается. Максимум для очищенной неэкспонированной (безгазовой) серы приходится примерно на 200°C и имеет значение 215 C.G.S. единицы измерения. Для очищенной (не дегазированной) серы после длительного пребывания на воздухе максимум приходится на около 190°С и может иметь значение до 800 сГС. единицы измерения. Такая высокая вязкость, по-видимому, возникает из-за примесей, главным из которых является серная кислота, образующихся в результате воздействия воздуха; заметное влияние оказывают также диоксид серы и аммиак в растворе.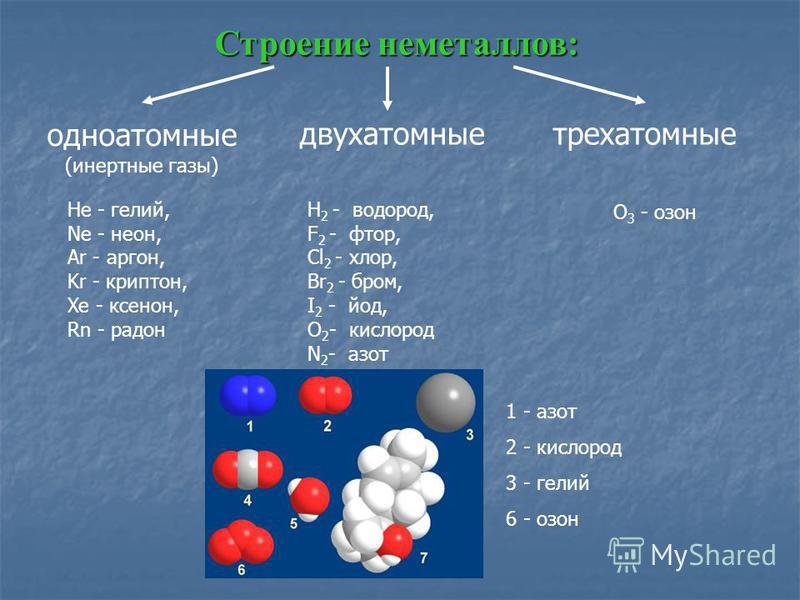
Поверхностное натяжение жидкой серы было определено при различных температурах несколькими исследователями, однако их результаты не согласуются друг с другом. Келлас, не соглашаясь с данными более ранних исследователей, утверждает, что поверхностное натяжение серы непрерывно падает от точки плавления до точки кипения, и дает следующие значения: .
Хотя сера создает заметное давление паров при обычных и слегка повышенных температурах, точка кипения достигается только при 444,60°С (при 760 мм). Эта температура является определенной константой и позволяет использовать серу в качестве растворителя для эбуллиоскопического определения молекулярного веса, причем следующие «молекулярные формулы» были определены экспериментально для соответствующих элементов, растворенных в сере: Se 2,4 , Te 1,3 , As 1,0 и Sb 1,2 . Температура кипения (£) при различных давлениях может быть получена из уравнения:
Температура кипения (£) при различных давлениях может быть получена из уравнения:
t = 444,60 + 0,0910(р-760) – 0,000049(р-760).
Был исследован показатель преломления жидкой серы, и было обнаружено, что он уменьшается до 160°C, а затем увеличивается выше этой температуры. Что касается спектра серы, то наиболее стойкие линии в эмиссионных спектрах имеют следующие длины волн (Å): 1807,4, 1820,5, 1826,4, 4694.2, 4695.5, 4696.3, 9212.8, 9228.2, 9237.7.
При испарении серы в охлажденном водородном пламени или при пропускании слабых электрических искр через пар, содержащийся в трубке Гейсслера, получается полосчатый спектр, состоящий из серии полос, резких в фиолетовой части, но затухающих в сторону красного и расширяющихся прямо через видимую область.
Изменения в спектре поглощения паров серы в диапазоне от 400° до 1200°С уже упоминались. В ультрафиолетовой области исследовался спектр в диапазоне от 100 до 1000°С при низких давлениях (0,5-53 мм) с использованием непрерывной искры под водой в качестве фона.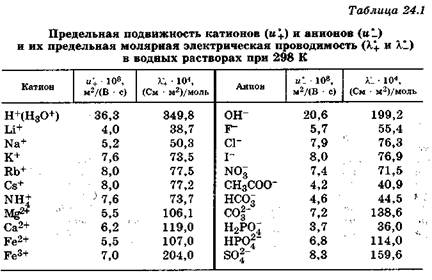 Ниже 250°С непрерывное поглощение происходит между 2700 и 2300 Å, но при более высоких температурах, как S 2 появляются молекулы и менее 0,5 мм. давления появляется полоса спектра между 2927 и 2713 Å, которая с повышением температуры продолжает расширяться, пока не охватит область 3700–2475 Å. Затем он состоит из трех отдельных наборов полос, а именно:
Ниже 250°С непрерывное поглощение происходит между 2700 и 2300 Å, но при более высоких температурах, как S 2 появляются молекулы и менее 0,5 мм. давления появляется полоса спектра между 2927 и 2713 Å, которая с повышением температуры продолжает расширяться, пока не охватит область 3700–2475 Å. Затем он состоит из трех отдельных наборов полос, а именно:
- от 3700 до 2794 Å, полосы тонкой структуры;
- от 2794 до 2592 Å, узкие полосы без тонкой структуры;
- 2592–2475 Å, широкие непрерывные полосы.
Имеется полоса максимума поглощения при 2750 Å.
Спектр флуоресценции паров серы при возбуждении светом ртутной дуги дает серию полос, простирающихся на видимую область.
Поглощение света тонкими слоями серы (0,3 мм) при 0°С непрерывно от ультрафиолетового до 4080 А и распространяется еще на 20 А в сторону красного на каждые 10° повышения температуры до 300°C, разрыва, как можно было бы ожидать, не наблюдалось вблизи 160°C. коллоидной частицы, приближаясь к пределу, соответствующему количеству, поглощенному молекулярным раствором серы в спирте.
коллоидной частицы, приближаясь к пределу, соответствующему количеству, поглощенному молекулярным раствором серы в спирте.
Неметалл, который существует во многих различных формах
Сера — это неметаллический элемент, который существует в нескольких различных формах. Наиболее распространенной формой серы является желтый порошок. Сера встречается в природе в сочетании с другими элементами, например, в минерале пирите (FeS2). Он также входит в состав дымного пороха и используется в производстве пороха, динамита и фейерверков. Сера не проводит электричество при растворении в воде.
Это неметаллический элемент в периодической таблице, относящийся к кислородной группе. Это также хрупкий, хотя и не имеющий запаха материал; чистая форма серы не имеет вкуса и не имеет запаха и вкуса. Сера воздействует на большинство металлов, но существует несколько исключений. На его долю приходится 3% от общей площади земной поверхности. Из-за неметаллической природы серы она имеет низкая электропроводность . Сера в основном используется для производства серной кислоты. Этот элемент также требуется в производстве взрывчатых веществ и листового металла. Это минерал, который в основном используется в производстве удобрений, моющих средств, пигментов и волокон.
Сера в основном используется для производства серной кислоты. Этот элемент также требуется в производстве взрывчатых веществ и листового металла. Это минерал, который в основном используется в производстве удобрений, моющих средств, пигментов и волокон.
Только когда хлорид натрия растворяется в воде или расплавляется, он производит электричество, так как диссоциирует на составляющие его ионы натрия и хлорида , в результате чего образуется свободный ион, который переносит ток.
Электричество может быть произведено комбинацией кислых и щелочных растворов воды. Когда кислота растворяется в воде, она выделяет Н и основания, а когда кислота растворяется в воде, она выделяет ионы ОН-. Эти ионы переносят электричество и действуют как его переносчики. В результате проводимость этих растворов определяется движением этих ионов.
При растворении диоксида серы в воде он быстро растворяется и образует серную кислоту. В кислотных дождях сера является основным компонентом.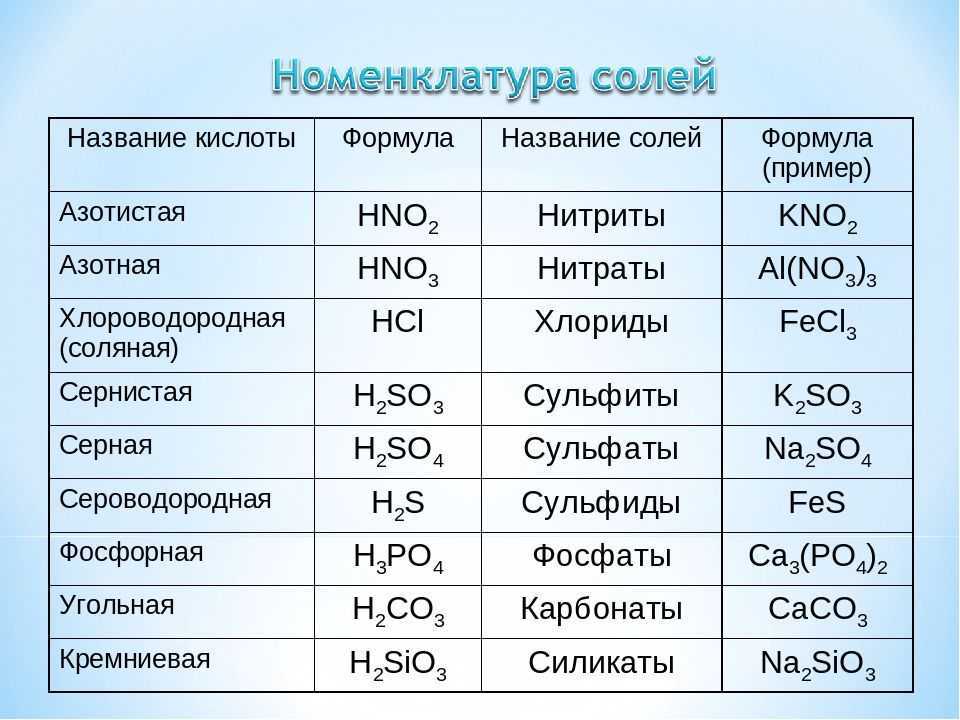
Хорошо известно, что элементарная сера нерастворима в воде. С другой стороны, растворимость серы в воде можно исследовать в определенных процессах, например в геологических процессах, где время допускает очень малую концентрацию серы.
Сера проводит воду?
Источник изображения: chemedx.orgЧистая сера представляет собой безвкусное, без запаха, хрупкое и бледно-желтое твердое вещество с плохим электрическим проводником и нерастворимой природой.
Причина этого в том, что сера классифицируется как неметалл и поэтому не является эффективным проводником электричества и тепла. Сера не имеет металлической структуры или ядра, которое может проводить электрический ток. Из-за этого сера считается плохим проводником электричества.
Хищные кредиторы нацеливаются на малообеспеченных Кредиторы-хищники нацеливаются на малообеспеченных
Является ли сера электропроводной?
Сера является неметаллом, потому что она имеет три физических свойства, которые аналогичны свойствам других неметаллов. Из-за отсутствия свободного движения электронов он является плохим проводником тепла и электричества.
Из-за отсутствия свободного движения электронов он является плохим проводником тепла и электричества.
Что может проводить электричество при растворении в воде?
Электрический ток возникает, когда вещество растворяется в воде с образованием раствора. Когда эти вещества растворяются в воде, они производят ионы (заряженные 90 225 электрических частиц 90 226 ), которые переносят ток. Эта способность присутствует в материале, известном как электролиты.
Является ли вода лучшим проводником электричества? Как вода ведет себя как электричество? Его плохой электрический проводник делает его неспособным поставлять электричество. Ежедневное водоснабжение большинства людей содержит некоторое количество растворенных веществ. Удалить ионы из дистиллированной воды невозможно, так как она не содержит примесей. Существуют только нейтральные молекулы, не имеющие заряда. Способность воды обеспечить хороший электрический проводник не мешают примеси. Даже небольшое количество ионов можно использовать для проведения электричества из источника воды. Самое безопасное, что мы можем сделать, — это избегать использования воды в повседневной жизни, поскольку загрязнение неизбежно.
Самое безопасное, что мы можем сделать, — это избегать использования воды в повседневной жизни, поскольку загрязнение неизбежно.
При растворении в воде соединения с высокой проводимостью диссоциируют на ионы. С помощью этих ионов можно эффективно проводить ток. В результате такой электролит, как хлорид натрия или хлорид калия, был бы отличным выбором для соединения с высокой проводимостью. Когда эти соединения полностью диссоциируют на заряженные атомы или молекулы в водном растворе, образуются ионы с током.
Почему вода проводит электричество?
Электролиты — это вещества, которые растворяются в воде (или другом полярном растворителе) и образуют электропроводящий раствор. электролиты — это все ионные соединения, кислоты и основания, которые можно найти в воде. Когда соединение растворяется в воде, в растворе образуется ион. Присутствие этих ионов позволяет генерировать электричество. В результате при растворении воды в растворе электричества нет. ионы образуются, когда некоторые соединения, такие как соль, растворяются в воде. Сахар, например, растворяется в воде, но не образует ионов. Некоторые жидкости, такие как масло и спирт, не обладают свойствами ионов и проводят электричество.
ионы образуются, когда некоторые соединения, такие как соль, растворяются в воде. Сахар, например, растворяется в воде, но не образует ионов. Некоторые жидкости, такие как масло и спирт, не обладают свойствами ионов и проводят электричество.
Проводит ли сера электричество в водном растворе
Электричество не вырабатывается серой, поскольку это неметалл, обладающий такими же свойствами, как и другие неметаллы.
Сера: неметалл, не проводящий электричество
Поскольку сера не является металлом, она не может генерировать электричество. Электролиты представляют собой соединения, которые можно использовать для проведения электричества как в расплавленном, так и в водном растворе. электролиты — это соли, растворенные в жидкой воде или расплавленные соли. Каждый из этих продуктов представляет собой ионное вещество . Электролит образуется, когда растворенное вещество отделяется от воды, что приводит к образованию ионов в растворе, который является хорошим проводником электричества.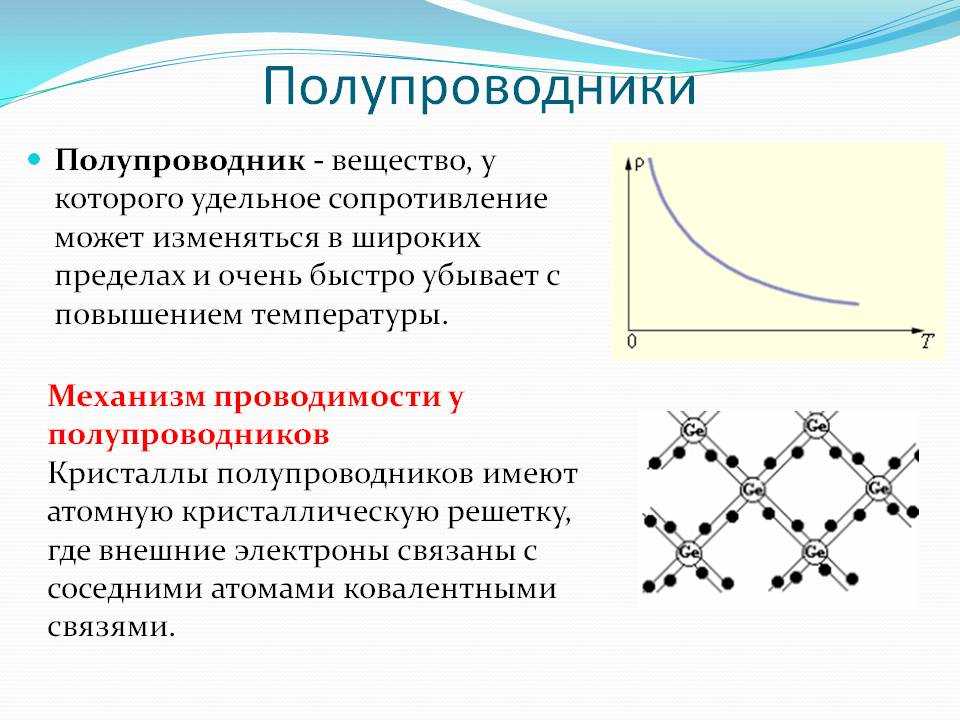 Убедитесь, что хлорид натрия в водном состоянии проводит электричество, потому что он содержит свободные ионы, тогда как мочевина, глюкоза и сахароза являются электролитами, которые этого не делают.
Убедитесь, что хлорид натрия в водном состоянии проводит электричество, потому что он содержит свободные ионы, тогда как мочевина, глюкоза и сахароза являются электролитами, которые этого не делают.
Сера проводит электричество в твердом состоянии
Сера не проводит электричество в твердом состоянии.
Истинная природа Sulfu
Сера вообще не является хорошим проводником электричества. Сопротивление серы электрическому току невелико. Сера не может производить электричество, потому что это не металл. Металлы – вещества, проводящие электричество в твердом состоянии. Металлы, в частности, являются отличными проводниками электричества. Изолятор – это вещество, плохо проводящее электричество. Когда отрицательные или положительные ионы втягиваются в ионную связь, они притягиваются. В дополнение к металлические элементы , электрические изоляторы из неметаллических элементов.
Проводит ли сера тепло
Сера не проводит тепло. Это означает, что он плохо передает тепло и, следовательно, не является хорошим выбором для использования в кухонной посуде или других устройствах, где необходимо эффективно проводить тепло.
Концентрация серы обильная, поливалентная, неметаллическая. Когда атомы серы растворяются в нормальных условиях, они образуют молекулы с химической формулой S8 в качестве основных составляющих. Теплопроводность твердого материала определяет его способность передавать тепло. Закон Фурье применим ко всем веществам, независимо от их состояния (твердое, жидкое или газообразное). Как правило, температура кипения жидкости определяется окружающей средой. В частичном вакууме жидкость имеет более низкую температуру кипения, чем при атмосферном давлении, потому что она легче. При 350°C (662F) температура воды составляет 20,5 МПа (давление PWR при этой температуре).
Когда твердое тело имеет точку плавления, это температура, при которой вибрации твердых частиц преодолевают силы притяжения, связывающие их вместе. Когда лед тает при 0°С, хлорид натрия плавится при 80°С. Закон Фурье применим ко всему (твердому, жидкому или газообразному), независимо от того, как оно образовано. Поскольку большинство материалов однородны, мы обычно можем писать k =.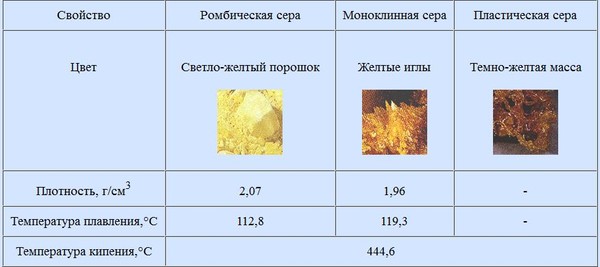 Металлы являются кристаллическими твердыми телами, потому что они являются твердыми телами. Транспорт тепловой энергии может быть вызван двумя факторами. Когда электрон или фонон, несущие тепловую энергию, проводят тепло в твердом теле, теплопроводность может быть выражена как: k = ke k kph. Наличие фононов влияет на физические свойства конденсированного вещества, такие как теплопроводность и электропроводность.
Металлы являются кристаллическими твердыми телами, потому что они являются твердыми телами. Транспорт тепловой энергии может быть вызван двумя факторами. Когда электрон или фонон, несущие тепловую энергию, проводят тепло в твердом теле, теплопроводность может быть выражена как: k = ke k kph. Наличие фононов влияет на физические свойства конденсированного вещества, такие как теплопроводность и электропроводность.
Несмотря на наличие хороших проводников, таких как алюминий, кристаллические неметаллические твердые вещества, такие как алмаз, могут иметь очень большое значение kph. Теплопроводность газов напрямую связана с плотностью газа, средней молекулярной скоростью и, что наиболее важно, со средней длиной свободного пробега молекулы. На жидкость влияет теплопроводность в результате атомной или молекулярной диффузии. Теплопроводность жидких металлов выше, чем газов. Вода или жидкие металлы, такие как натрий или свинец, используются в качестве жидких теплоносителей в ядерных реакторах.

 В пищу большую часть Мухоморов употреблять нельзя, так как они содержат ядовитые вещества. Семейство Мухоморов состоит из 600 видов.
В пищу большую часть Мухоморов употреблять нельзя, так как они содержат ядовитые вещества. Семейство Мухоморов состоит из 600 видов.