ХиМиК.ru — ЭЛЕКТРОПРОВОДНОСТЬ ЭЛЕКТРОЛИТОВ — Химическая энциклопедия
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
ЭЛЕКТРОПРОВОДНОСТЬ ЭЛЕКТРОЛИТОВ,
способность
электролитов проводить электрич. ток при приложении электрич. напряжения.
Носителями тока являются положительно и отрицательно заряженные ионы -
катионы и анионы, к-рые существуют в р-ре вследствие электролитич. диссоциации.
Ионная электропроводность электролитов, в отличие от электронной, характерной для металлов, сопровождается
переносом в-ва к электродам с образованием вблизи них новых хим. соед.
(см. Электролиз). Общая (суммарная) проводимость состоит из проводимости
катионов и анионов, к-рые под действием внешнего электрич. поля движутся
в противоположных направлениях. Доля общего кол-ва электричества, переносимого
отд. ионами, наз. числами переноса, суммак-рых для всех видов ионов, участвующих
в переносе, равна единице.
Доля общего кол-ва электричества, переносимого
отд. ионами, наз. числами переноса, суммак-рых для всех видов ионов, участвующих
в переносе, равна единице.
где с — концентрация р-ра в г-экв/л.
Эквивалентная электропроводность зависит от природы растворенного в-ва
и р-рителя, структуры р-ра, а также от концентрации, т-ры, давления. Предельно
разбавленному р-ру, в к-ром все молекулы диссоциированы на ионы, соответствует
предельное значение
В соответствии с Кольрауша закономравна
сумме эквивалентных электропроводностей катионов и анионов. Эквивалентная
электропроводность отд. иона пропорциональна скорости его движения в р-ре
и характеризует подвижность иона в р-ре.
Описание концентрац. зависимостикак и других св-в р-ров электролитов (см. Растворы электролитов), обычно базируется на ионном подходе, в рамках к-рого р-ритель рассматривается как бесструктурная диэлектрич. среда, в к-рой ионы движутся в соответствии с законами гидродинамики и характером межионного взаимодействия. Простейшей моделью является модель заряженных твердых сфер, движущихся в вязком р-рителе под влиянием силы, обусловленной градиентом потенциала. При этом сила сопротивления движению иона в р-ре определяется ур-нием Стокса (см. Вискозиметрия). В рамках применимости этого ур-ния выполняется правило Вальдена-Писаржевского, в соответствии с к-рым для одного и того же электролита в любых р-рителях произведение предельного значения эквивалентной электропроводности на вязкость р-рителя является постоянной величиной, к-рая не зависит от природы р-рителя, но является ф-цией т-ры. Сравнительно хорошо это правило выполняется только для слабо сольватир.

В р-рах сильных электролитов концентрац.
зависимость
определяется межионным взаимодействием. В области применимости Дебая-Хюккеля
теории имеются две причины для торможения ионов вследствие межионного
взаимодействия. Первая из них связана с тем, что движение иона тормозится
ионной атмосферой, к-рая имеет заряд, противоположный центральному иону,
и под влиянием поля движется в направлении, противоположном перемещению
иона (электрофоретич. эффект). Вторая причина связана с тем, что при движении
иона под действием электрич. поля его ионная атмосфера деформируется и
теряет сферич. симметрию, причем большая часть заряда ионной атмосферы
концентрируется позади центрального иона (релаксац.
где А и В — эмпирич. постоянные,
являющиеся ф-циями т-ры, вязкости и диэлектрич. проницаемости р-рителя.
Как и теория Дебая-Хюккеля, ур-ние Онсагера
ограничено областью умеренно разбавленных р-ров. Для описания концентрир.
р-ров возникает необходимость в учете некулоновской части межионного взаимод.,
в частности в учете ионных размеров. Для этой цели применяют методы кинетич.
теории ионных систем. К дополнит. уменьшению
приводит образование ионных ассоциатов — пар, тройников и т. п., к-рое,
как и эффект неполной диссоциации, сокращает общее число своб. ионов в
р-ре. Для учета этого эффекта в ур-нии Онсагера заменяют общую концентрацию
ионов концентрацией своб. ионов
(- степень
электролитич. диссоциации), что приводит к ур-нию Фуосса-Онсагера:
В переменных электрич. полях при достаточно
высокой частоте ион не уходит далеко от центра ионной атмосферы, вследствие
чего она не деформируется. Обусловленный деформацией релаксац. эффект не
возникает, что приводит к увеличению-т.наз.
эффект Дебая-Фалькенхагена. Величина
возрастает также в постоянных электрич. полях достаточно высокой напряженности
(104-105 В/см). В этих условиях ионы движутся настолько
быстро, что ионная атмосфера не успевает образоваться, вследствие чего
практически отсутствуют и релаксац. и электрофоретич. эффекты. В результате
стремится к предельному значению
(т. наз. эффект Вина). В слабых электролитах эффект Вина вызывается также
смещением диссоциативного равновесия в сильном электрич. поле в сторону
образования ионов.
Обусловленный деформацией релаксац. эффект не
возникает, что приводит к увеличению-т.наз.
эффект Дебая-Фалькенхагена. Величина
возрастает также в постоянных электрич. полях достаточно высокой напряженности
(104-105 В/см). В этих условиях ионы движутся настолько
быстро, что ионная атмосфера не успевает образоваться, вследствие чего
практически отсутствуют и релаксац. и электрофоретич. эффекты. В результате
стремится к предельному значению
(т. наз. эффект Вина). В слабых электролитах эффект Вина вызывается также
смещением диссоциативного равновесия в сильном электрич. поле в сторону
образования ионов.
 При этом уд.
электропроводность рассчитывают через электрич. поток j(t)=
и автокорреляц. ф-цию
с помощью соотношения:
При этом уд.
электропроводность рассчитывают через электрич. поток j(t)=
и автокорреляц. ф-цию
с помощью соотношения:
где-
кол-во ионов электролита в единице объема р-ра, е -элементарный
электрич. заряд,
— приведенная масса катиона и аниона, za — степень окисления
иона сорта a, vа(t) — его скорость в момент времени
t.
Специфич. механизм электропроводности
характерен для к-т и оснований, содержащих соотв. ионы Н+ и
ОН—, к-рые в водных р-рах (или других протонных р-рителях) имеют
подвижность на порядок больше остальных ионов. Для объяснения аномально
высокой проводимости ионов Н+ и ОН—предполагается,
что под влиянием электрич. поля протоны перемещаются не только путем миграции,
но и по механизму протонного обмена, включающему перенос протона в кислой
среде от ионов гидроксония Н3О+ к молекуле воды,
а в щелочной — от молекулы воды к иону ОН—.
Эксперим. изучение электропроводности электролитов- важное направление физико-химического анализа, поскольку зависимость электропроводности электролитов от состава р-ра позволяет судить о концентрации солей, качественный, состав к-рых известен (см. также Кондуктометрия). Измерения l используют для определения подвижностей ионов.
Лит.: Скорчеллетти В. В., Теоретическая электрохимия, 4 изд., Л., 1974; Измайлов Н. А., Электрохимия растворов, 3 изд., М., 1976; Эрдеи-Груз Т., Явления переноса в водных растворах, пер. с англ., М., 1976. См. также лит. к ст. Растворы электролитов.
М. Ф. Головко.
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
Основы аналитической химии, Т3
ОглавлениеПРЕДИСЛОВИЕВВЕДЕНИЕ ГЛАВА I. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКИХ (ИНСТРУМЕНТАЛЬНЫХ) МЕТОДОВ АНАЛИЗА § 1. Особенности физико-химических методов анализа § 2.  Области применения инструментальных методов анализа Области применения инструментальных методов анализа§ 3. Анализ веществ высокой чистоты § 4. Повышение чувствительности и точности методов определения следов примесей § 5. Инструментальные методы титрования § 6. Применение физико-химических методов анализа для определения индивидуальных соединений § 7. Применение физико-химических методов для анализа смесей веществ § 8. Классификация инструментальных количественных методов анализа § 9. Электрохимические методы анализа § 10. Спектральные (оптические) методы анализа § 11. Хроматографические методы анализа § 13. Масс-спектрометрические методы анализа § 14. Физико-химический анализ по Н. С. Курнакову § 15. Другие методы анализа ГЛАВА II. ПОТЕНЦИОМЕТРИЯ И ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ § 1. Зависимость величины электродных потенциалов от концентрации (активности) § 2. Применение потенциометрического метода анализа § 3. Потенциометрическое титрование § 4.  Потенциометрическое титрование без тока (i=0) Потенциометрическое титрование без тока (i=0)§ 5. Различные способы нахождения конечной точки потенциометрического титрования § 6. Некомпенсационный метод потенциометрического титрования § 7. Потенциометрическое титрование под током (i != 0) Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 8. Измерение электродвижущей силы § 9. Установка для поляризации электродов при потенциометрическом титровании под током § 10. Некоторые приборы, применяемые в потенциометрическом титровании § 11. Электроды В. ПРАКТИЧЕСКИЕ РАБОТЫ ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ БЕЗ ТОКА (i=0) § 12. Кислотно-основное титрование § 13. Титрование по методу окисления — восстановления § 14. Титрование по методу осаждения § 15. Титрование по методу комплексообразования ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ ПОД ТОКОМ (i != 0) § 16. Титрование по методу окисления — восстановления ГЛАВА III. КОНДУКТОМЕТРИЯ и КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ § 1. Удельная и эквивалентная электропроводность § 2.  Кондуктометрическне методы анализа Кондуктометрическне методы анализа§ 3. Кислотно-основное титрование § 4. Титрование, основанное на реакциях осаждения § 5. Титрование, основанное на реакциях окисления — восстановления § 6. Титрование, основанное на реакциях комплексообразования Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 7. Измерение электропроводности растворов § 8. Конструкции электролитических ячеек § 9. Измерения в хронокондуктометрическом титровании В. ПРАКТИЧЕСКИЕ РАБОТЫ § 10. Подготовка к определению §11. Определение индивидуальных кислот методом кондуктометрического титрования § 12. Определение индивидуальных оснований методом кондуктометрического титрования § 13. Анализ смесей оснований методом кондуктометрического титрования § 14. Определение солей методом кондуктометрического титрования § 15. Анализ смесей кислот и солей слабых оснований методом кондуктометрического титрования § 16. Анализ смесей кислот методом хронокондуктометрического титрования § 17.  Анализ смесей оснований и солей слабых кислот методом хронокондуктометрического титрования Анализ смесей оснований и солей слабых кислот методом хронокондуктометрического титрованияГЛАВА IV. ВЫСОКОЧАСТОТНОЕ ТИТРОВАНИЕ § 1. Общие положения теории высокочастотного титрования § 2. Физические основы и погрешности метода высокочастотного титрования § 3. Физические основы метода диэлкометрического титрования § 4. Погрешности метода диэлкометрического титрования ТЕОРИЯ ИЗМЕРИТЕЛЬНЫХ ЯЧЕЕК ЕМКОСТНОГО ТИПА § 5. Электрическая эквивалентная схема ячейки и физические процессы, протекающие в ее объеме § 6. Импеданс и полная проводимость ячейки § 7. Характеристические кривые ячейки § 8. Чувствительность ячейки § 9. Критерий применимости и постоянная с-ячейки ТЕОРИЯ ИЗМЕРИТЕЛЬНЫХ ЯЧЕЕК ИНДУКТИВНОГО ТИПА § 10. Электрическая эквивалентная схема ячейки § 11. Импеданс и характеристические кривые ячейки § 12. Критерий применимости и постоянная L-ячейки § 13. Влияние на характеристические кривые ячейки ее некомпенсированного электрического поля ДИАГРАММЫ СООТВЕТСТВИЯ § 14.  Диаграмма соответствия для титрования по активной составляющей полной проводимости Диаграмма соответствия для титрования по активной составляющей полной проводимости§ 15. Диаграмма соответствия для титрования по реактивной составляющей полной проводимости § 16. Выбор типа диаграмм Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 17. Измерительные ячейки (датчики) высокочастотного метода и области их применения § 18. Классификация аппаратуры высокочастотного метода § 19. Высокочастотные титраторы § 20. Общие правила работы с приборами для высокочастотного анализа В. ПРАКТИЧЕСКИЕ РАБОТЫ § 21. Высокочастотное титрование стандартных растворов § 22. Высокочастотное титрование растворов неизвестной концентрации ГЛАВА V. ПОЛЯРОГРАФИЧЕСКИЙ МЕТОД АНАЛИЗА И АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ § 1. Предельный, или диффузионный, ток § 2. Возникновение диффузионного тока на твердых микроэлектродах Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ ПОЛЯРОГРАФИЧЕСКОГО АНАЛИЗА § 3. Полярографы § 4. Электролитическая ячейка § 5. Электролизеры § 6.  Электроды сравнения Электроды сравнения§ 7. Снятие полярограммы на полярографической установке с визуальным полярографом § 8. Методы количественного полярографического анализа § 9. Правила техники безопасности при работе с металлической ртутью В. НОВЫЕ НАПРАВЛЕНИЯ В ПОЛЯРОГРАФИИ § 10. Амальгамная полярография с накоплением § 11. Осциллографическая полярография § 12. Переменнотоковая полярография Г. ПРАКТИЧЕСКИЕ РАБОТЫ С ПРИМЕНЕНИЕМ ПОЛЯРОГРАФИЧЕСКОГО МЕТОДА АНАЛИЗА § 13. Примеры полярографических определений АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ § 14. Особенности амперометрического титрования Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АМПЕРОМЕТРИЧЕСКОГО ТИТРОВАНИЯ § 15. Схема установки и применяемые электроды § 16. Амперометрическое титрование с двумя индикаторными электродами В. ПРАКТИЧЕСКИЕ РАБОТЫ С ПРИМЕНЕНИЕМ АМПЕРОМЕТРИЧЕСКОГО ТИТРОВАНИЯ § 17. Примеры амперометрического титрования ГЛАВА VI. КУЛОНОМЕТРИЯ И КУЛОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ § 1. Сущность и классификация кулонометрических методов ПРЯМАЯ КУЛОНОМЕТРИЯ § 2.  Прямая кулонометрия при постоянном потенциале рабочего электрода (прямая потенциостатическая кулонометрия) Прямая кулонометрия при постоянном потенциале рабочего электрода (прямая потенциостатическая кулонометрия)§ 3. Использование прямой потенциостатической кулонометрии § 4. Прямая кулонометрия при постоянной силе тока электролиза (прямая амперостатическая кулонометрия) § 5. Использование прямой амперостатической кулонометрии КУЛОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ § 6. Кулонометрическое титрование при постоянной силе тока электролиза § 7. Использование амперостатического кулонометрического титрования § 8. Кулонометрическое титрование првд постоянном потенциале рабочего электрода § 9. Особенности кулонометрических методов анализа Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 10. Электроды § 11. Электролизеры § 12. Приборы для измерения количества электричества, израсходованного на электролиз вещества § 13. Приборы, обеспечивающие стабильность потенциала рабочего электрода или силы тока электролиза, и установки для кулонометрического анализа В. ПРАКТИЧЕСКИЕ РАБОТЫ § 14.  Работы, выполняемые методом прямой кулонометрии Работы, выполняемые методом прямой кулонометрии§ 15. Работы, выполняемые методом косвенной кулонометрии, или кулонометрического титрования, при постоянной силе тока электролиза ГЛАВА VII. СПЕКТРАЛЬНЫЕ (ОПТИЧЕСКИЕ) МЕТОДЫ АНАЛИЗА § 1. Общая характеристика метода § 2. Классификация методов эмиссионного спектрального анализа § 3. Качественный спектральный анализ § 4. Полуколичественные методы спектрального анализа § 5. Количественный спектральный анализ § 6. Основы фотографического метода эмиссионного количественного анализа § 7. Зависимость между почернением фотопластинки и интенсивностью излучения Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 8. Источники возбуждения спектров § 9. Спектральные приборы § 10. Вспомогательные приборы и принадлежности § 11. Микрофотометр МФ-2 В. ПРАКТИЧЕСКИЕ РАБОТЫ § 12. Качественный анализ при помощи стилоскопа § 13. Качественный анализ фотографическим методом при помощи спектра железа в ультрафиолетовой области § 14.  Полуколичественный анализ Полуколичественный анализ§ 15. Количественный анализ СПЕКТРОФОТОМЕТРИЯ ПЛАМЕНИ § 16. Общая характеристика метода Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 17. Схема установки, применяемой для анализа методом спектрофотометрии пламени В. ПРАКТИЧЕСКИЕ РАБОТЫ § 18. Определения по методу спектрофотометрии пламени АТОМНО-АБСОРБЦИОННЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ § 19. Общая характеристика метода МОЛЕКУЛЯРНО-АБСОРБЦИОННЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ § 20. Общая характеристика метода § 21. Законы поглощения света § 22. Отклонения от закона Бугера—Ламберта—Бера § 23. Качественный анализ спектрофотометрическим методом § 24. Количественный анализ спектрофотометрическим методом § 25. Методы определения концентрации веществ, поглощающих в видимой и ультрафиолетовой областях спектра § 26. Определение нескольких компонентов в растворе § 27. Определение концентрации вещества в растворе дифференциальным методом § 28. Выбор толщины слоя и оптимальной концентрации исследуемого раствора § 29.  Выбор длины волны поглощаемого излучения при спектрофотометрических измерениях Выбор длины волны поглощаемого излучения при спектрофотометрических измеренияхБ. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 30. Приборы, применяемые для спектрофотометрического анализа в ультрафиолетовой и видимой областях спектра § 31. Приборы, применяемые для колориметрического анализа § 32. Приборы, применяемые для спектрофотометрического анализа в инфракрасной области спектра § 33. Нулевые растворы В. ПРАКТИЧЕСКИЕ РАБОТЫ § 34. Определение в ультрафиолетовой области спектра § 35. Определение в видимой области спектра § 36. Определение в инфракрасной области спектра СПЕКТРОФОТОМЕТРИЧЕСКИЕ (ФОТОМЕТРИЧЕСКИЕ) МЕТОДЫ ТИТРОВАНИЯ § 37. Общая характеристика метода § 38. Кривые спектрофотометрического титрования Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ ТИТРОВАНИЯ § 39. Установки для спектрофотометрического титрования В. ПРАКТИЧЕСКИЕ РАБОТЫ § 40. Спектрофотометрическое титрование НЕФЕЛОМЕТРИЧЕСКИЙ И ТУРБИДИМЕТРИЧЕСКИЙ МЕТОДЫ АНАЛИЗА § 41.  Общая характеристика методов Общая характеристика методовБ. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 42. Приборы, применяемые для нефелометрических и турбидиметрических измерений В. ПРАКТИЧЕСКИЕ РАБОТЫ § 43. Нефелометрические и турбидиметрические определения § 44. Фототурбидиметрическое и фотонефелометрическое титрование ГЛАВА VIII. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА § 1. Классификация хроматографических методов анализа § 2. Адсорбционная хроматография § 3. Разновидности газовой хроматографии § 4. Распределительная хроматография § 5. Ионообменная хроматография § 6. Константа ионного обмена § 7. Осадочная хроматография § 8. Окислительно-восстановительная хроматография § 9. Адсорбционно-комплексообразовательная хроматография § 10. Хроматографические колонки, применяемые в адсорбционно-жидкостной хроматографии § 11. Аппаратура, применяемая в газовой хроматографии § 12. Приборы и материалы, применяемые в распределительной хроматографии § 13.  Колонки, применяемые в ионообменной хроматографии Колонки, применяемые в ионообменной хроматографии§ 14. Колонки, применяемые в осадочной и окислительновосстановительной хроматографии В. ПРАКТИЧЕСКИЕ РАБОТЫ § 15. Работы по методу адсорбционной (жидкостной и газовой) хроматографии § 16. Работы по методу распределительной хроматографии § 17. Работы по методу ионообменной хроматографии § 18. Работы по методу осадочной хроматографии § 19. Работы по методу окислительно-восстановительной хроматографии § 20. Работы по методу адсорбционно-комплексообразовательной хроматографии ГЛАВА IX. РАДИОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА § 1. Виды радиоактивного распада § 2. Скорость распада § 3. Взаимодействие излучения с веществом § 4. Ошибки при измерении радиоактивности Б. ЭЛЕМЕНТЫ ТЕХНИКИ БЕЗОПАСНОСТИ ПРИ РАБОТЕ С РАДИОАКТИВНЫМИ ВЕЩЕСТВАМИ § 5. Понятия и единицы измерения § 6. Классификация источников радиоактивного излучения и радиоактивных изотопов § 7. Классификация химических операций с радиоактивными веществами § 8. 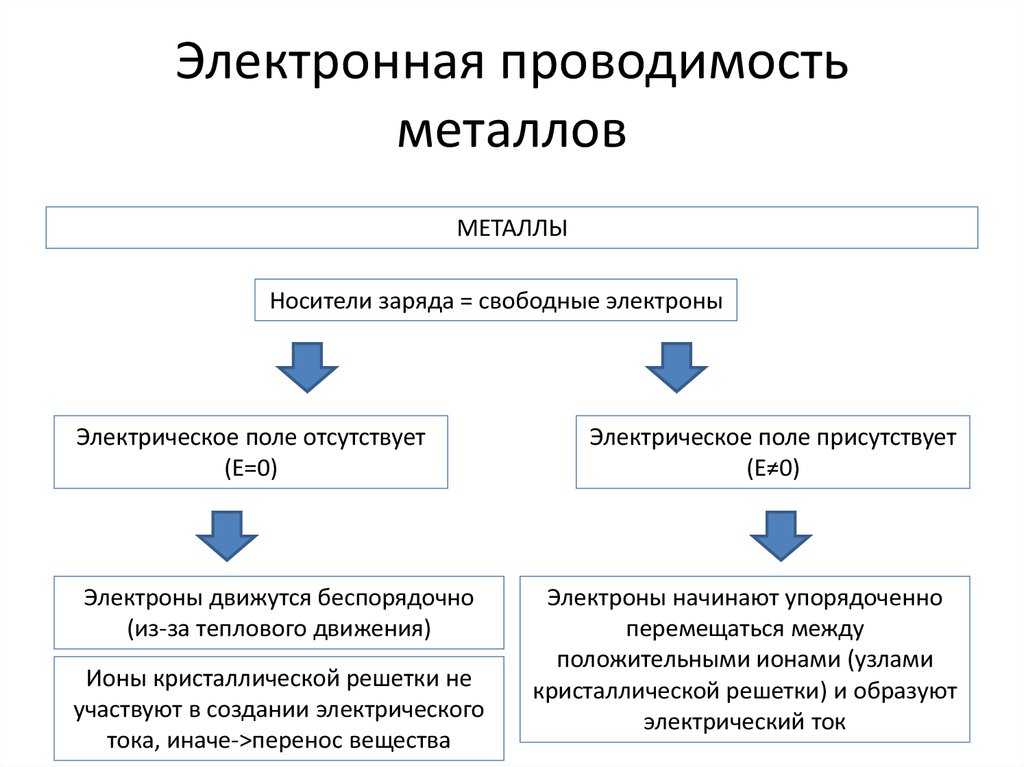 Устройство лабораторий и классификация работ Устройство лабораторий и классификация работ§ 9. Специальное оборудование для работ с радиоактивными веществами § 10. Средства индивидуальной защиты § 11. Проведение работ в химической лаборатории с радиоактивными веществами § 12. Правила работы с радиоактивными веществами В. МЕТОДЫ РЕГИСТРАЦИИ РАДИОАКТИВНОГО ИЗЛУЧЕНИЯ § 13. Ионизационные методы § 14. Сцинтилляционный метод Г. АППАРАТУРА И ТЕХНИКА ИЗМЕРЕНИЯ РАДИОАКТИВНОСТИ § 15. Радиометрические установки § 16. Измерение радиоактивности § 17. Измерение дозы на рабочем месте, индивидуальной дозы, полученной работающим, и загрязненности рабочих поверхностей, рук и одежды § 18. Абсолютные и относительные измерения активности Д. РАДИОМЕТРИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ § 19. Приготовление раствора с заданной активностью § 20. Прямое определение ионов химических элементов в растворе с помощью радиоактивных реагентов § 21. Практические работы, выполняемые методом прямого определения § 22.  Метод радиометрического титрования Метод радиометрического титрования§ 23. Практические работы, выполняемые методом радиометрического титрования § 24. Метод изотопного разбавления § 25. Практические работы, выполняемые методом изотопного разбавления § 26. Метод активационного анализа § 27. Практические работы, выполняемые методом активационного анализа § 28. Фотонейтронный метод § 29. Практические работы, выполняемые фотонейтронным методом § 30. Методы определения содержания химических элементов по излучению их естественных радиоактивных изотопов § 31. Практические работы по определению содержания химических элементов методом измерения излучения их естественных радиоактивных изотопов § 32. Методы анализа, основанные на поглощении излучения § 33. Практические работы, выполняемые по методу анализа, основанному на поглощении излучения § 34. Метод, основанный на отражении бетта-излучения § 35. Практические работы, выполняемые по методу, основанному на отражении бетта-излучения ГЛАВА X.  ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ РЕДКИХ ЭЛЕМЕНТОВ ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ РЕДКИХ ЭЛЕМЕНТОВ§ 1. Работы, выполняемые методом амперометрического титрования § 2. Работы, выполняемые полярографическим методом § 3. Работы, выполняемые фотометрическим методом § 4. Работы, выполняемые экстракционно-фотометрическим методом § 5. Работы, выполняемые спектрофотометрическим методом § 6. Работы, выполняемые флуориметрическим методом § 7. Работы, выполняемые методом потенциометрического титрования ГЛАВА XI. ФИЗИКО-ХИМИЧЕСКИЕ (ИНСТРУМЕНТАЛЬНЫЕ) МЕТОДЫ АНАЛИЗА НЕВОДНЫХ РАСТВОРОВ § 1. Влияние химической природы и физико-химических свойств растворителей на свойства растворенного вещества § 2. Классификация неводных растворителей по их протонно-донорно-акцепторным свойствам § 3. Классификация неводных растворителей по признаку их влияния на относительную силу электролитов § 4. Дифференцирующее действие растворителей § 5. Константы диссоциации, потенциалы полунейтрализации в неводных средах и относительная шкала кислотности § 6.  Шкала pH и константы автопротолиза неводных растворителей Шкала pH и константы автопротолиза неводных растворителей§ 7. Абсолютная (единая) шкала кислотности растворителей § 8. Химико-аналитическое использование неводных растворителей Б. АППАРАТУРА И ТЕХНИКА ТИТРОВАНИЯ НЕВОДНЫХ РАСТВОРОВ § 9. Установки, используемые при амперометрическом титровании неводных растворов § 10. Установки, используемые при потенциометрическом титровании неводных растворов § 11. Установки, используемые при кондуктометрическом титровании неводных растворов § 12. Установки, используемые при высокочастотном титровании неводных растворов § 13. Установки, используемые при спектрофотометрическом титровании неводных растворов В. ПРАКТИЧЕСКИЕ РАБОТЫ § 14. Очистка и обезвоживание неводных растворителей § 15. Титранты, применяемые для титрования кислот и оснований в неводных растворах § 16. Амперометрическое титрование § 17. Методы прямого потенциометрического титрования § 18. Методы косвенного потенциометрического титрования § 19.  Дифференцированное потенциометрическое титрование Дифференцированное потенциометрическое титрование§ 20. Комбинированные методы потенциометрического титрования § 21. Хронопотенциометрическое титрование § 22. Кондуктометрическое титрование § 23. Хронокондуктометрическое титрование § 24. Спектрофотометрическое титрование |
Проводимость, TDS, соленость, удельное сопротивление
29 января 2018 г. 20:19
С помощью соответствующего прибора измерения электропроводности (EC) выполняются относительно быстро и просто. EC измеряет способность воды проводить электрический ток, которая, в свою очередь, зависит от концентрации ионов в растворе. Из-за этого EC предоставляет полезную информацию о растворе и может использоваться для оценки общего содержания растворенных твердых веществ (TDS).
Электропроводность воды измеряется с помощью зонда, который вводится в воду. Используя электроды в зонде и электронику в приборе, прибор может измерять проводимость и сообщать значение проводимости с температурной компенсацией (наиболее типичны единицы измерения мкСм/см). Чтобы обеспечить точный результат, перед измерением прибор обычно калибруют по одному или нескольким стандартам.
Чтобы обеспечить точный результат, перед измерением прибор обычно калибруют по одному или нескольким стандартам.
Калибровка прибора
Для проведения точных измерений прибор проводимости обычно калибруется с использованием растворов хлорида калия (KCl) известной концентрации. Обычно используется стандарт, состоящий из 0,01 М KCl, который имеет проводимость 1412 мкСм/см при 25°C [1], но идеальным является стандарт, который имеет проводимость, аналогичную анализируемым растворам. Для большей точности в широком диапазоне значений электропроводности для калибровки прибора можно использовать до 3-5 стандартов с различной концентрацией KCl.
Факторы, влияющие на проводимость
На проводимость раствора влияют три основных фактора: концентрация ионов, тип ионов и температура раствора.
1) Концентрация растворенных ионов. Электролит состоит из растворенных ионов (таких как Na+ и Cl-), которые несут электрические заряды и могут перемещаться в воде. Поскольку каждый ион способен нести электрический заряд, вода с большим количеством присутствующих ионов способна проводить больший ток. Это самый важный из трех основных факторов.
Поскольку каждый ион способен нести электрический заряд, вода с большим количеством присутствующих ионов способна проводить больший ток. Это самый важный из трех основных факторов.
2) Типы ионов в растворе. Разные ионы обладают разной способностью передавать заряд. Неорганические ионы, такие как Na+, K+, Mg+2, Ca+2, HCO 3-, Cl- и SO4-2, как правило, хорошо проводят электричество, хотя каждый ион обладает разной способностью проводить электричество. Это зависит от таких факторов, как заряд иона, его размер и склонность к взаимодействию с молекулами воды. Более тяжелые ионы имеют тенденцию двигаться медленнее, но маленькие ионы часто могут сильнее притягивать молекулы воды, в результате чего получается медленно движущийся гидратированный ион. Например, легкий ион Li + на самом деле переносит электричество примерно вдвое меньше, чем более тяжелый ион K+[2], из-за его более сильного взаимодействия с молекулами воды.
Органические вещества, как правило, являются более бедными электролитами, чем неорганические вещества, в основном потому, что они имеют относительно слабую склонность к диссоциации на ионы. Например, уксусная кислота является слабой кислотой с тенденцией оставаться в незаряженной форме CH3COOH0, а не разделяться на ионы водорода (H+) и ацетата (Ch4COO-). Поскольку многие органические вещества являются слабыми кислотами, проводимость растворов, содержащих их, будет повышаться с увеличением рН. Это связано с тем, что органические кислоты имеют тенденцию превращаться в свои ионные формы по мере того, как раствор становится более щелочным.
Например, уксусная кислота является слабой кислотой с тенденцией оставаться в незаряженной форме CH3COOH0, а не разделяться на ионы водорода (H+) и ацетата (Ch4COO-). Поскольку многие органические вещества являются слабыми кислотами, проводимость растворов, содержащих их, будет повышаться с увеличением рН. Это связано с тем, что органические кислоты имеют тенденцию превращаться в свои ионные формы по мере того, как раствор становится более щелочным.
3) Температура. Это относительно небольшой, но значительный эффект. Поскольку ионы могут двигаться быстрее в более теплой воде, проводимость воды увеличивается с повышением температуры. Электропроводность будет увеличиваться примерно на 1,9 % при повышении температуры на каждый 1 °C [1] (или чуть более 1 % на каждый разность в 1 °F), что делает необходимым компенсацию температуры, чтобы можно было сравнивать различные измерения электропроводности. .
Температурная компенсация
Чтобы упростить сравнение результатов для образцов, испытанных при разных температурах, измерения электропроводности обычно представляются как значения с температурной компенсацией. Это означает, что указанное значение соответствует проводимости при температуре 25°C. Например, фактическая проводимость раствора, испытанного при 20°C, будет ниже заявленного значения с температурной компенсацией. Температурная компенсация обычно выполняется автоматически с помощью термистора, встроенного в датчик проводимости. Если показания электропроводности не компенсированы по температуре, особенно когда температура далеко от 25°C, результаты не будут надежными.
Это означает, что указанное значение соответствует проводимости при температуре 25°C. Например, фактическая проводимость раствора, испытанного при 20°C, будет ниже заявленного значения с температурной компенсацией. Температурная компенсация обычно выполняется автоматически с помощью термистора, встроенного в датчик проводимости. Если показания электропроводности не компенсированы по температуре, особенно когда температура далеко от 25°C, результаты не будут надежными.
Можно ли определить проводимость без использования прибора для измерения проводимости?
Как описано выше, электропроводность воды зависит от типа и количества заряженных ионов в растворе. Если известен химический состав раствора и если присутствующие ионы ограничены хорошо охарактеризованными неорганическими ионами, такими как Na +, K+, Mg+2, Ca+2, HCO3-, Cl — и SO4-2, или некоторыми органическими ионов, проводимость раствора можно рассчитать на основе свойств проводимости каждого иона. Это проще всего сделать с помощью специализированного химического программного обеспечения, такого как PHREEQC [3]. Однако обычно проще и точнее измерить электропроводность с помощью прибора.
Это проще всего сделать с помощью специализированного химического программного обеспечения, такого как PHREEQC [3]. Однако обычно проще и точнее измерить электропроводность с помощью прибора.
Ссылки
[1] Американская ассоциация общественного здравоохранения (APHA) (2005 г.) Стандартные методы исследования воды и сточных вод, 21-е изд. APHA, AWWA, WPCF, Вашингтон.
[2] Haynes, WM (2009). Справочник CRC по химии и физике: готовый справочник химических и физических данных. Бока-Ратон: CRC Press.
[3] Паркхерст, Д.Л., и Аппело, К.А.Дж. (2013), Описание входных данных и примеры для PHREEQC версии 3 — Компьютерная программа для определения состава, периодической реакции, одномерного переноса и обратных геохимических расчетов: Методы и методы геологической службы США, книга 6, гл. А43, 497 р.
0 Комментарий Posted in Проводимость, TDS, Соленость, Удельное сопротивление
Понедельник, 15 января 2018 г. , 20:16
, 20:16
Проверка электропроводности воды дает много практической информации о решении. Мало того, что само измерение проводимости полезно, его также можно использовать для оценки общего содержания растворенных твердых веществ (TDS) или солености воды. Поскольку измерения электропроводности просты и быстры, они отлично подходят для рутинных испытаний и долгосрочного мониторинга. Некоторые примеры применения измерения проводимости описаны ниже.
Природные воды, аквакультура и охрана окружающей среды
Электропроводность природных вод в основном используется для оценки концентрации растворенных солей в воде, что может дать представление о процессах, влияющих на воду. В речных водах, например, проводимость (и TDS) воды может увеличиваться летом, когда эвапотранспирация высока, и уменьшаться, когда вода разбавляется таянием снега или сильными дождями. В прибрежных районах проводимость воды может изменяться при смешивании с соленой водой, а проводимость воды может повышаться при ее загрязнении дорожной солью в районах с прохладным климатом.
Для водных ресурсов проводимость может указывать на то, является ли вода слишком соленой, чтобы ее можно было пить или использовать для орошения или промышленного использования.
В местах, где возможно загрязнение воды, можно контролировать изменение электропроводности воды, которое может указывать на загрязнение в результате разлива или утечки. В экосистемах и аквакультуре водные растения и животные имеют определенные диапазоны солености, которые они могут переносить. Из-за этого проводимость водоемов, таких как пруды, можно контролировать, чтобы предупредить, если соленость может выйти за пределы допустимого диапазона, например, для определенных видов рыб.
Очистка воды и промышленное применение
Обработка воды может использоваться для того, чтобы сделать воду пригодной для питья или для промышленного использования. Во многих промышленных применениях проблемой могут быть накипь (осаждение минеральных отложений) или коррозия. Поскольку проводимость можно использовать для оценки содержания растворенных минералов в воде, ее можно использовать для мониторинга процессов деминерализации, используемых для предотвращения образования накипи, или процессов реминерализации, используемых для предотвращения коррозии. Электропроводность также может использоваться для контроля эффективности опреснения, которое представляет собой еще один процесс очистки воды, при котором удаляются соли, чтобы сделать воду пригодной для питья или использования в промышленных процессах.
Поскольку проводимость можно использовать для оценки содержания растворенных минералов в воде, ее можно использовать для мониторинга процессов деминерализации, используемых для предотвращения образования накипи, или процессов реминерализации, используемых для предотвращения коррозии. Электропроводность также может использоваться для контроля эффективности опреснения, которое представляет собой еще один процесс очистки воды, при котором удаляются соли, чтобы сделать воду пригодной для питья или использования в промышленных процессах.
В других промышленных применениях измерения проводимости могут использоваться для обнаружения утечек (например, в теплообменниках), где вытекающая вода может иметь более высокую проводимость. Электропроводность также может использоваться для контроля эффективности процедур ополаскивания, когда низкая электропроводность воды, контактирующей с ополаскиваемым объектом, указывает на эффективное ополаскивание. В особых случаях, например, в растворах аммиака, электропроводность может даже использоваться для измерения рН с большей точностью, чем обычный рН-метр, благодаря тесной взаимосвязи между электропроводностью и рН.
Применение в сельском хозяйстве и гидропонике
Для орошения важным фактором является соленость воды. Если соленость слишком высока, соли будут накапливаться в почве по мере испарения воды, что может ухудшить качество почвы и замедлить рост растений. Вода с электропроводностью менее 700 мкСм/см приемлема для неограниченного использования в орошении, а использование воды с электропроводностью более 3000 мкСм/см должно быть строго ограничено[1].
Проводимость также можно использовать для контроля концентрации питательных веществ в жидких удобрениях. Быстрая проверка проводимости жидких удобрений может защитить от ошибок, таких как неправильное смешивание или неисправность инжекторов, защитить урожай от расточительного чрезмерного внесения удобрений или неадекватного внесения удобрений.
Подобно внесению удобрений, проводимость используется в гидропонике для контроля концентрации питательных растворов. Если проводимость становится слишком высокой, что указывает на токсическую концентрацию питательных веществ, растения могут быть повреждены или погибнуть. Низкая проводимость может указывать на недостаточное снабжение питательными веществами. Мониторинг проводимости можно использовать как часть автоматизированных систем подачи питательных веществ. В дополнение к мониторингу поступления питательных веществ можно использовать измерения электропроводности, чтобы убедиться, что концентрация солей находится в допустимом для растения диапазоне.
Низкая проводимость может указывать на недостаточное снабжение питательными веществами. Мониторинг проводимости можно использовать как часть автоматизированных систем подачи питательных веществ. В дополнение к мониторингу поступления питательных веществ можно использовать измерения электропроводности, чтобы убедиться, что концентрация солей находится в допустимом для растения диапазоне.
Заключение
Измерение электропроводности выполняется просто и быстро, что делает его очень удобным для рутинной оценки концентрации солей в воде. Будь то оценка концентрации солей, загрязняющих веществ или питательных веществ, измерение электропроводности может уменьшить потребность в более дорогих или трудоемких тестах. На электропроводность влияет множество факторов, таких как концентрации и типы растворенных солей, присутствующих в воде, поэтому для интерпретации измерений электропроводности часто необходимо знание химии рассматриваемой системы.
Ссылки
[1] Аброль, И.П., Ядав, Дж.С.П., и Массуд, Ф.И. (1988). Засоленные почвы и обращение с ними (№ 39). Продовольственная и сельскохозяйственная организация
0 Комментарий Posted in Проводимость, TDS, Соленость, Удельное сопротивление
Понедельник, 1 января 2018 г. 20:14
Вода обладает способностью проводить электричество из-за присутствия в растворе заряженных ионов. Ионы — это атомы молекул, которые имеют общий электрический заряд, и они включают катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы). Наиболее распространенные заряженные ионы в природной воде обычно включают катионы натрия (Na+), калия (K+), кальция (Ca+2) и магния (Mg+2), а также анионы хлорида (Cl-), сульфата (SO4-2). , нитрат (NO3-) и бикарбонат (HCO3-). Многие другие ионы также можно найти в воде, включая органические ионы и другие неорганические ионы.
Эти ионы несут электрический заряд и могут перемещаться в воде, что позволяет воде проводить электрический ток. Мера способности воды проводить электрический ток называется ее электропроводностью. Более высокие концентрации ионов в воде увеличивают ее способность проводить электричество и, следовательно, проводимость. С другой стороны, дистиллированная вода имеет очень низкую концентрацию ионов и низкую электропроводность.
Техническое примечание: Иногда электропроводность называют удельной проводимостью. |
Противоположностью проводимости является удельное сопротивление. Удельное сопротивление — это способность материала (например, воды) сопротивляться потоку электричества. Удельное сопротивление обратно пропорционально проводимости, так что
Удельное сопротивление = 1/Электропроводность
Из этого соотношения видно, что вода с высокой проводимостью имеет низкое удельное сопротивление, и наоборот. Например, дистиллированная вода будет иметь высокое сопротивление и низкую проводимость.
Например, дистиллированная вода будет иметь высокое сопротивление и низкую проводимость.
Обычной единицей измерения проводимости является микросименс на см (мкСм/см). Эту единицу также иногда записывают как микромхо на см (мкмхо/см), где 1 мкСм/см равен 1 мкмо/см. Питьевая вода обычно имеет значения электропроводности в диапазоне от 50 до 1500 мкмо/см[1]. При более высокой проводимости вода становится слишком соленой для питья.
Техническое примечание: Обратите внимание, что «мхо» — это обратное написание «Ом», общепринятой единицы измерения электрического сопротивления. |
Поскольку проводимость незначительно зависит от температуры, значения проводимости обычно представляются как значения с температурной компенсацией, которые представляют собой значение проводимости при 25°C. Это упрощает сравнение значений проводимости для образцов с разной температурой.
Как электропроводность связана с общим содержанием растворенных твердых веществ (TDS)?
Общее количество растворенных твердых веществ (TDS) относится к общему количеству растворенных веществ, присутствующих в воде. TDS обычно указывается в миллиграммах на литр (мг/л) или ppm (частях на миллион). Это означает, что если полностью испарить один литр воды с TDS 500 мг/л, останется 500 мг твердого остатка. Обычно растворенные твердые вещества включают главным образом растворенные минеральные ионы, такие как натрий, хлорид и другие упомянутые выше ионы. TDS также может включать другие неорганические ионы, растворенные органические вещества и неионогенные вещества, такие как растворенный кремнезем. Хотя относительно небольшое количество TDS включает неионогенные вещества, не несущие электрического заряда, воды с более высокими значениями TDS обычно имеют более высокие значения проводимости.
Из-за этого измерение электропроводности (быстрое и простое) можно использовать для оценки TDS (прямое измерение более дорого и требует больше времени). Однако взаимосвязь между проводимостью и TDS зависит от химического состава воды, поскольку ионы различаются по своей способности передавать электрический заряд через воду. Некоторые ионы несут электрические заряды быстрее, чем другие, из-за таких факторов, как размер и масса ионов и то, как они взаимодействуют с молекулами воды.
Однако взаимосвязь между проводимостью и TDS зависит от химического состава воды, поскольку ионы различаются по своей способности передавать электрический заряд через воду. Некоторые ионы несут электрические заряды быстрее, чем другие, из-за таких факторов, как размер и масса ионов и то, как они взаимодействуют с молекулами воды.
Общее уравнение для оценки TDS по проводимости выглядит следующим образом:
TDS (мг/л) = k · EC (мкСм/см)
, где EC – электрическая проводимость, а k k – коэффициент преобразования, что связано с химическим составом воды.
Для типичных природных вод, таких как речная и озерная вода, значение коэффициента преобразования обычно составляет от 0,6 до 0,7, а значение 0,64 считается типичным. Для раствора, содержащего в основном ионы натрия и хлорида, значения 0,49до 0,56 типичны, в зависимости от концентрации соли.
Для точной оценки TDS по проводимости при выборе коэффициента преобразования следует учитывать химический состав раствора. Если состав раствора известен, то истинное TDS репрезентативной пробы воды можно рассчитать, взяв сумму измеренных концентраций. В качестве альтернативы можно напрямую измерить истинное значение TDS репрезентативного образца. Затем можно рассчитать правильное значение коэффициента преобразования на основе истинного TDS и измеренной проводимости.
Если состав раствора известен, то истинное TDS репрезентативной пробы воды можно рассчитать, взяв сумму измеренных концентраций. В качестве альтернативы можно напрямую измерить истинное значение TDS репрезентативного образца. Затем можно рассчитать правильное значение коэффициента преобразования на основе истинного TDS и измеренной проводимости.
Если невозможно рассчитать правильное значение коэффициента преобразования, то обычное значение коэффициента преобразования или значение коэффициента преобразования по умолчанию (например, 0,64) приведет к оценке TDS, которая, по крайней мере, находится на правильном уровне.
Как проводимость связана с соленостью?
Соленость относится к содержанию соли в воде. Поскольку большинство растворенных твердых веществ обычно состоят из неорганических ионов, которые являются компонентами солей, концепции солености и TDS очень похожи. На самом деле эти два понятия иногда считаются синонимами. Однако соленость часто выражается в единицах массы соли на массу воды. Например, океанская вода обычно содержит около 35 граммов соли на один килограмм воды, поэтому ее соленость можно выразить как 35/1000 или 0,035. Это также может быть выражено как 3,5% или 35 частей на тысячу (ppt).
Однако соленость часто выражается в единицах массы соли на массу воды. Например, океанская вода обычно содержит около 35 граммов соли на один килограмм воды, поэтому ее соленость можно выразить как 35/1000 или 0,035. Это также может быть выражено как 3,5% или 35 частей на тысячу (ppt).
Соленость часто используется для описания морской и солоноватой воды, но также может использоваться для описания пресной воды и рассолов. Поскольку пропорции наиболее важных ионов в морской воде почти постоянны, океанографы могут использовать очень точные формулы для оценки солености по электропроводности и температуре[1].
В случаях, когда соленость измеряется в мг/л (например, для озерной воды, плавательных бассейнов или воды для орошения), соленость можно оценить по электропроводности, используя ту же формулу, которая представлена для TDS в предыдущем разделе.
Ссылки
[1] Американская ассоциация общественного здравоохранения (APHA) (2005 г. ) Стандартные методы исследования воды и сточных вод, 21-е изд. APHA, AWWA, WPCF, Вашингтон.
) Стандартные методы исследования воды и сточных вод, 21-е изд. APHA, AWWA, WPCF, Вашингтон.
0 Комментарий Рубрика: Проводимость, TDS, Соленость, Удельное сопротивление
Сортировать по Создан в Добавлено
3 шт.
Показать 5
Электропроводность в водной химии и молекулярной науке
Электропроводность — это базовое измерение качества воды, которое напрямую измеряет способность воды проводить электрический ток. Это измерение обычно используется для определения того, что растворилось в образце или водоеме. Если показания электропроводности высокие, это указывает на то, что вода содержит высокую концентрацию загрязняющих веществ. Низкие показания означают, что вода относительно чистая.
Тестирование проводимости регулярно используется для сбора данных, касающихся ионных концентраций , которые распространяются на растворенные соединения, обнаруженные в водных растворах. Стандартные приложения, для которых используются датчики электропроводности, включают определение величин концентрации в различных растворах и очистку воды.
Стандартные приложения, для которых используются датчики электропроводности, включают определение величин концентрации в различных растворах и очистку воды.
Электропроводность является очень важным измерением для химии воды, а также для молекулярной науки. Это измерение сообщает предприятиям и коммунальным службам, достаточно ли качество воды. На самом деле проводимость является одним из немногих измерений, которые дают вам возможность напрямую определить, достаточно ли чистая вода для питья или нуждается в очистке.
Электропроводность обычно измеряется в микросименсах на сантиметр или миллисименсах на сантиметр . Собирая базовые показания, вы можете постоянно проверять качество воды, чтобы поддерживать надлежащие уровни проводимости. В этой статье более подробно рассматривается проводимость и то, как она используется в химии воды.
Электропроводность и вода
Вода и электричество обычно несовместимы. Например, если вода окажется слишком близко к электрической розетке, она, скорее всего, вообще перестанет работать.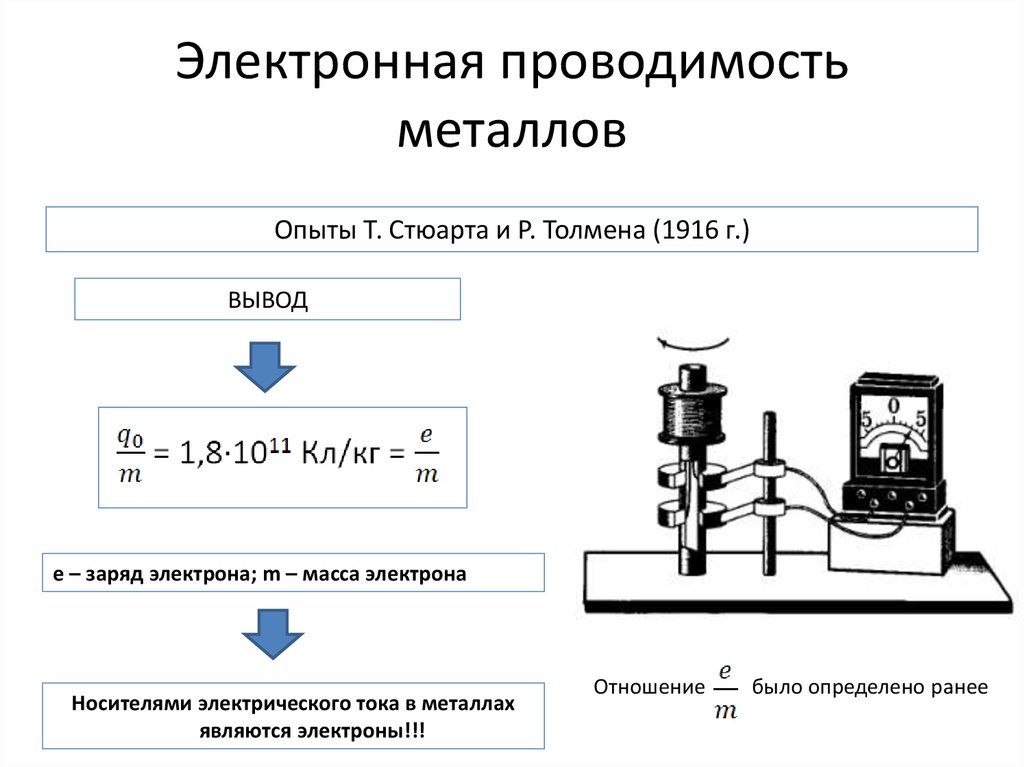 Возможно даже, что искры летят и вызывают пожар. Однако чистая вода, свободная от всех примесей, считается фантастическим изолятором, а это означает, что она не проводит электричество. Поскольку примесей нет, нет и ионов, от которых можно было бы проводить электричество.
Возможно даже, что искры летят и вызывают пожар. Однако чистая вода, свободная от всех примесей, считается фантастическим изолятором, а это означает, что она не проводит электричество. Поскольку примесей нет, нет и ионов, от которых можно было бы проводить электричество.
В действительности трудно найти чистую воду, так как вода растворяет практически все. Будь то вода из плавательного бассейна или из кухонного крана, в ней, вероятно, содержится значительное количество растворенных веществ, химических веществ и минералов. Эти растворенные вещества растворяются в воде и приводят к увеличению показаний электропроводности . Удаление этих химических веществ посредством фильтрации приведет к падению показаний проводимости.
Свободные ионы в воде проводят электричество
Вода перестает быть отличным изолятором, когда начинает растворять вещества. В этом случае образуются свободные ионы. Вещества, которые обычно растворяются в воде, представляют собой соли, представляющие собой ионные соединения, состоящие из катионов и анионов. Катионы — это положительно заряженные ионы, а анионы — отрицательно заряженные ионы.
Катионы — это положительно заряженные ионы, а анионы — отрицательно заряженные ионы.
При использовании в растворе эти ионы компенсируют друг друга, в результате чего раствор становится электрически нейтральным. Если в водном растворе присутствует только небольшая концентрация ионов, раствор может проводить электричество. Например, добавление соли в ванну во время грозы повышает вероятность удара молнии. Электричество неизменно ищет противоположно заряженные ионы, присутствующие в воде.
Когда вода состоит из большого количества ионов и растворенных веществ, она становится высокоэффективным проводником электричества. В этом сценарии электрический ток, проходящий через воду, может игнорировать все, что находится в воде. Если человек стоит в воде, состоящей из большого количества растворенных веществ и ионов, ему может не угрожать опасность поражения электрическим током в случае удара молнии. Вот почему риск поражения электрическим током в открытом море относительно низок.
Является ли проводимость физическим или химическим свойством?
Прежде чем приступить к измерению электропроводности, вам может понадобиться узнать, является ли электропроводность физическим или химическим свойством. Физическое свойство — это такое свойство, при котором материю можно наблюдать или измерять без необходимости каким-либо образом изменять химические компоненты. Наиболее распространенные примеры физических свойств включают:
- Молекулярный вес
- Объем
- Цвет
- Твердость
- Плотность
- Температура плавления
- Температура кипения
Химическое свойство становится видимым только при изменении химической идентичности вещества, а это означает, что вы должны провести какую-то химическую реакцию, чтобы эффективно увидеть химическое свойство . Наиболее распространенные примеры химических свойств включают:
- Воспламеняемость
- Реакционная способность
- Кислотность
- Токсичность
- Теплота сгорания
Электропроводность считается физическим свойством , так как сущность этого вещества не изменена. Химический состав не меняется. Все, что происходит, — это передача энергии, которая может быть теплом или электричеством.
Химический состав не меняется. Все, что происходит, — это передача энергии, которая может быть теплом или электричеством.
Как проводимость влияет на качество воды?
Электропроводность напрямую влияет на качество воды, определяя концентрацию растворенных солей в пробе воды. Любые неорганические химические вещества в воде также увеличивают проводимость. Когда уровень солености в воде повышается, то же самое произойдет с показаниями электропроводности. Поскольку высокая соленость свидетельствует о загрязнении воды, измерения электропроводности являются прямыми индикаторами качества воды .
Как измерить электропроводность воды?
Если вы хотите измерить проводимость воды, вы можете сделать это с помощью специального измерения проводимости, которое можно выполнить с любым датчиком проводимости. Удельная проводимость измеряет, насколько хорошо вода способна проводить электрический ток.
Как упоминалось ранее, проводимость будет увеличиваться при увеличении концентрации и подвижности ионов. Эти ионы образуются в результате растворения соединений. Они проводят электричество, так как после растворения в воде заряжаются положительно или отрицательно.
Эти ионы образуются в результате растворения соединений. Они проводят электричество, так как после растворения в воде заряжаются положительно или отрицательно.
Какие изменения электропроводности указывают на плохое качество воды?
Существует несколько различных источников изменения проводимости качества воды. Если эти изменения достаточно существенны, они могут указывать на изменение качества воды. Если загрязнение пробы воды увеличивается, показания электропроводности будут увеличиваться, а качество воды падать.
Соленость
Соленость является одним из основных факторов, влияющих на показания электропроводности воды. Если вода чистая и не содержит соли, водоем не будет проводить электричество. Несмотря на то, что соленость и электропроводность сильно коррелируют друг с другом, 9Электропроводность 0198 считается более легкой для измерения , поэтому эти измерения используются для оценки концентрации солености в пробе воды.
Общее количество растворенных твердых веществ
Общее количество растворенных твердых веществ – это любые соли, металлы или минералы, растворенные в воде. В большинстве случаев TDS включает неорганические соли, такие как:
В большинстве случаев TDS включает неорганические соли, такие как:
- Магний
- Натрий
- Калий
- Кальций
- Хлориды
- Сульфаты
- Бикарбонаты
Если вода имеет высокую концентрацию общего количества растворенных твердых веществ, клетки могут сжиматься, что влияет на способность организмов двигаться в этой воде. В этом сценарии пораженные организмы могут утонуть или всплыть далеко за пределы своего стандартного диапазона.
Температура
Температура также может влиять на проводимость воды. Более теплая вода имеет тенденцию вызывать увеличение проводимости воды, а это означает, что падение температуры воды приведет к падению показаний проводимости .
Как мониторинг проводимости может помочь защитить качество воды
Если вы хотите защитить качество воды, настоятельно рекомендуется регулярно контролировать проводимость, выполняя измерения проводимости. Как упоминалось ранее, существует множество датчиков проводимости, которые могут предоставить вам точные показания. Когда дело доходит до проводимости, очень важно, чтобы проводимые вами измерения были очень точными.
Когда дело доходит до проводимости, очень важно, чтобы проводимые вами измерения были очень точными.
Если вам необходимо убедиться, что качество воды выше заданных параметров, неточные показания могут привести к тому, что вы будете использовать воду не такой чистой и фильтрованной, как должна быть. Измерение электропроводности позволяет определить общую концентрацию растворенных твердых веществ и химических веществ в воде. Если проводимость увеличивается, вода будет содержать больше примесей. В этой ситуации должно быть что-то, что приводит к ухудшению качества воды.
В вашем распоряжении два типа датчиков проводимости, , которые включают в себя контактные датчики проводимости и тороидальные датчики проводимости . Оба типа датчиков обеспечивают точные показания. Однако тороидальные датчики предназначены для использования в сильно загрязненных водах. Даже если датчик покроется грязью и другими загрязнениями, он все равно должен работать. Тороидальные датчики проводимости состоят из:
- Одной цепи, обеспечивающей непрерывную форму волны в передающей катушке
- Переменное магнитное поле в передающей катушке создает напряжение в среде.


 П. Крешков. Основы аналитической химии. Физико-химические (инструментальные) методы анализа, Изд. «Химия», 1970, стр. 472.
П. Крешков. Основы аналитической химии. Физико-химические (инструментальные) методы анализа, Изд. «Химия», 1970, стр. 472.
