Железо теплопроводность и электропроводность
- 5 — 9 классы
- Химия
- 8 баллов
свойства железа и серы (агр.состояние. теплопроводность электропроводность . запах
Все изделия, используемые человеком, способны передавать и сохранять температуру прикасаемого к ним предмета или окружающей среды. Способность отдачи тепла одного тела другому зависит от вида материала, через который проходит процесс. Свойства металлов позволяют передавать тепло от одного предмета другому, с определенными изменениями, в зависимости от структуры и размера металлической конструкции. Теплопроводность металлов — один из параметров, определяющих их эксплуатационные возможности.
Что такое теплопроводность и для чего нужна
Процесс переноса энергии атомов и молекул от горячих предметов к изделиям с холодной температурой, осуществляется при хаотическом перемещении движущихся частиц. Такой обмен тепла зависит от агрегатного состояния металла, через который проходит передача. В зависимости от химического состава материала, теплопроводность будет иметь различные характеристики. Данный процесс называют теплопроводностью, он заключается в передаче атомами и молекулами кинетической энергии, определяющей нагрев металлического изделия при взаимодействии этих частиц, или передается от более теплой части – к той, которая меньше нагрета.
В зависимости от химического состава материала, теплопроводность будет иметь различные характеристики. Данный процесс называют теплопроводностью, он заключается в передаче атомами и молекулами кинетической энергии, определяющей нагрев металлического изделия при взаимодействии этих частиц, или передается от более теплой части – к той, которая меньше нагрета.
Способность передавать или сохранять тепловую энергию, позволяет использовать свойства металлов для достижения необходимых технических целей в работе различных узлов и агрегатов оборудования, используемого в народном хозяйстве. Примером такого применения может быть паяльник, нагревающийся в средней части и передающий тепло на край рабочего стержня, которым выполняют пайку необходимых элементов. Зная свойства теплопроводности, металлы применяют во всех отраслях промышленности, используя необходимый параметр по назначению.
Факторы, влияющие на физическую величину
Способность проводить тепло зависит от ряда факторов, включая температуру, структуру и электрические свойства вещества.
Температура материала
Влияние температуры на способность проводить тепло различается для металлов и неметаллов. В металлах проводимость главным образом связана со свободными электронами. Согласно закону Видемана—Франца теплопроводность металла пропорциональна произведению абсолютной температуры, выраженной в Кельвинах, на его электропроводность. В чистых металлах с увеличением температуры уменьшается электропроводность, поэтому теплопроводность остается приблизительно постоянной величиной. В случае сплавов электропроводность мало изменяется с ростом температуры, поэтому теплопроводность сплавов растет пропорционально температуре.
С другой стороны, передача тепла в неметаллах главным образом связана с колебаниями решетки и обмене решеточными фононами. За исключением кристаллов высокого качества и низких температур, путь пробега фононов в решетке значительно не уменьшается при высоких температурах, поэтому и теплопроводность остается постоянной величиной во всем температурном диапазоне, то есть является незначительной. При температурах ниже температуры Дебая способность неметаллов проводить тепло, наряду с их теплоемкостью, значительно уменьшается.
При температурах ниже температуры Дебая способность неметаллов проводить тепло, наряду с их теплоемкостью, значительно уменьшается.
Фазовые переходы и структура
Когда материал испытывает фазовый переход первого рода, например, из твердого состояния в жидкое или из жидкого в газ, то его теплопроводность может измениться. Ярким примером такого изменения является разница этой физической величины для льда (2,18 Вт/(м*К) и воды (0,90 Вт/(м*К).
Изменения кристаллической структуры материалов также влияют на теплопроводность, что объясняется анизотропными свойствами различных аллотропных модификаций вещества одного и того же состава. Анизотропия влияет на различную интенсивность рассеивания решеточных фононов, основных переносчиков тепла в неметаллах, и в различных направлениях в кристалле. Здесь ярким примером является сапфир, проводимость которого изменяется от 32 до 35 Вт/(м*К) в зависимости от направления.
Электрическая проводимость
Теплопроводность в металлах изменяется вместе с электропроводностью согласно закону Видемана—Франца. Это связано с тем, что валентные электроны, свободно перемещаясь по кристаллической решетке металла, переносят не только электрическую, но и тепловую энергию. Для других материалов корреляция между этими типами проводимости не является ярко выраженной, ввиду незначительного вклада электронной составляющей в теплопроводность (в неметаллах основную роль в механизме передачи тепла играют решеточные фононы).
Это связано с тем, что валентные электроны, свободно перемещаясь по кристаллической решетке металла, переносят не только электрическую, но и тепловую энергию. Для других материалов корреляция между этими типами проводимости не является ярко выраженной, ввиду незначительного вклада электронной составляющей в теплопроводность (в неметаллах основную роль в механизме передачи тепла играют решеточные фононы).
Процесс конвекции
Воздух и другие газы являются, как правило, хорошими теплоизоляторами при отсутствии процесса конвекции. На этом принципе основана работа многих теплоизолирующих материалов, содержащих большое количество небольших пустот и пор. Такая структура не позволяет конвекции распространяться на большие расстояния. Примерами таких материалов, полученных человеком, являются полистирен и силицидный аэрогель. В природе на том же принципе работают такие теплоизоляторы, как шкура животных и оперение птиц.
Читать также: Как замерить амперы мультиметром на аккумуляторе
Легкие газы, например, водород и гель, имеют высокие значения теплопроводности, а тяжелые газы, например, аргон, ксенон и радон, являются плохими проводниками тепла. Например, аргон, инертный газ, который тяжелее воздуха, часто используется в качестве теплоизолирующего газового наполнителя в двойных окнах и в электрических лампочках. Исключением является гексафторид серы (элегаз), который является тяжелым газом и обладает относительно высокой теплопроводностью, ввиду его большой теплоемкости.
Например, аргон, инертный газ, который тяжелее воздуха, часто используется в качестве теплоизолирующего газового наполнителя в двойных окнах и в электрических лампочках. Исключением является гексафторид серы (элегаз), который является тяжелым газом и обладает относительно высокой теплопроводностью, ввиду его большой теплоемкости.
Понятие термического сопротивления и коэффициента теплопроводности
Если теплопроводность характеризует способность металлов передавать температуру тел от одной поверхности к иной, то термическое сопротивление показывает обратную зависимость, т.е. возможность металлов препятствовать такой передаче, иначе выражаясь, – сопротивляться. Высоким термическим сопротивлением обладает воздух. Именно он, больше всего, препятствует передаче тепла между телами.
Количественную характеристику изменения температуры единицы площади за единицу времени на один градус (К), называют коэффициентом теплопроводности. Международной системой единиц принято измерять этот параметр в Вт/м*град. Эта характеристика очень важна при выборе металлических изделий, которые должны передавать тепло от одного тела к другому.
Эта характеристика очень важна при выборе металлических изделий, которые должны передавать тепло от одного тела к другому.
Коэффициент теплопроводности металлов при температура, °С
Применение
Агрегатное состояние материалов имеет отличительную структуру строения молекул и атомов. Именно это оказывает большое влияние на металлические изделия и их свойства, в зависимости от назначения.
Отличающийся химический состав узлов и деталей из железа, позволяет обладать различной теплопроводностью. Это связано со структурой таких металлов как чугун, сталь, медь и алюминий. Пористость чугунных изделий способствует медленному нагреванию, а плотность медной структуры – наоборот, ускоряет процесс теплоотдачи. Эти свойства используют для быстрого отвода тепла или постепенного нагревания продукции инертного назначения. Примером использования свойств металлических изделий является:
- кухонная посуда с различными свойствами;
- оборудование для пайки труб;
- утюги;
- подшипники качения и скольжения;
- сантехническое оборудование для подогрева воды;
- приборы отопления.

Медные трубки широко используют в радиаторах автомобильных систем охлаждения и кондиционеров, применяемых в быту. Чугунные батареи сохраняют тепло в квартире, даже при непостоянной подаче теплоносителя требуемой температуры. А радиаторы из алюминия, способствуют быстрой передаче тепла отапливаемому помещению.
При возникновении высокой температуры, в результате трения металлических поверхностей, также важно учитывать теплопроводность изделия. В любом редукторе или другом механическом оборудовании, способность отводить тепло, позволит деталям механизма сохранить прочность и не быть подвергнутыми разрушению, в процессе эксплуатации. Знание свойств теплопередачи различных материалов, позволит грамотно применить те или иные сплавы из цветных или черных металлов.
Методы измерения
Для измерения теплопроводности металлов используют два метода: стационарный и нестационарный. Первый характеризуется достижением постоянной величины изменившейся температуры на контролируемой поверхности, а второй – при частичном изменении таковой.
Стационарное измерение проводится опытным путем, требует большого количества времени, а также применения исследуемого металла в виде заготовок правильной формы, с плоскими поверхностями. Образец располагают между нагретой и охлажденной поверхностью, а после прикосновения плоскостей, измеряют время, за которое заготовка может увеличить температуру прохладной опоры на один градус по Кельвину. Когда рассчитывают теплопроводность, обязательно учитывают размеры исследуемого образца.
Нестационарную методику исследований используют в редких случаях из-за того, что результат, зачастую, бывает необъективным. В наши дни никто, кроме ученых, не занимается измерением коэффициента, все используют, давно выведенные опытным путем, значения для различных материалов. Это обусловлено постоянством данного параметра при сохранении химического состава изделия.
Проводимость металлов
Само понятие электрического тока как направленного потока заряженных частиц кажется более гармоничным для веществ, основанных на кристаллических решетках свойственных металлам. Носителями зарядов при возникновении электрического тока в металлах являются свободные электроны, а не ионы, как это бывает в жидких средах. Экспериментально установлено, что при возникновении тока в металлах не происходит переноса частиц вещества между проводниками.
Носителями зарядов при возникновении электрического тока в металлах являются свободные электроны, а не ионы, как это бывает в жидких средах. Экспериментально установлено, что при возникновении тока в металлах не происходит переноса частиц вещества между проводниками.
Металлические вещества отличаются от других более свободными связями на атомарном уровне. Внутреннее устройство металлов отличается присутствием большого числа «одиноких» электронов. которые при малейшем воздействии электромагнитных сил образуют направленный поток. Поэтому не зря именно металлы являются лучшими проводниками электрического тока, и именно такие молекулярные взаимодействия отличают самый электропроводный металл. На особенностях структуры кристаллической решетки металлов основано еще одно их специфическое свойство — высокая теплопроводность.
Теплопроводность стали, меди, алюминия, никеля и их сплавов
Обычное железо и цветные металлы имеют разное строение молекул и атомов. Это позволяет им отличаться друг от друга не только механическими, но и свойствами теплопроводности, что, в свою очередь, влияет на применение тех или иных металлов в различных отраслях хозяйства.
Это позволяет им отличаться друг от друга не только механическими, но и свойствами теплопроводности, что, в свою очередь, влияет на применение тех или иных металлов в различных отраслях хозяйства.
Сталь имеет коэффициент теплопроводности, при температуре окружающей среды 0 град. (С), равный 63, а при увеличении градуса до 600, он снижается до 21 Вт/м*град. Алюминий, в таких же условиях, наоборот – увеличит значение от 202 до 422 Вт/м*град. Сплавы из алюминия, будут также повышать теплопроводность, по мере увеличения температуры. Только величина коэффициента будет на порядок ниже, в зависимости от количества примесей, и колебаться в пределах от 100 до 180 единиц.
Применение
Агрегатное состояние материалов имеет отличительную структуру строения молекул и атомов. Именно это оказывает большое влияние на металлические изделия и их свойства, в зависимости от назначения.
Отличающийся химический состав узлов и деталей из железа, позволяет обладать различной теплопроводностью. Это связано со структурой таких металлов как чугун, сталь, медь и алюминий. Пористость чугунных изделий способствует медленному нагреванию, а плотность медной структуры – наоборот, ускоряет процесс теплоотдачи. Эти свойства используют для быстрого отвода тепла или постепенного нагревания продукции инертного назначения. Примером использования свойств металлических изделий является:
Это связано со структурой таких металлов как чугун, сталь, медь и алюминий. Пористость чугунных изделий способствует медленному нагреванию, а плотность медной структуры – наоборот, ускоряет процесс теплоотдачи. Эти свойства используют для быстрого отвода тепла или постепенного нагревания продукции инертного назначения. Примером использования свойств металлических изделий является:
- кухонная посуда с различными свойствами;
- оборудование для пайки труб;
- утюги;
- подшипники качения и скольжения;
- сантехническое оборудование для подогрева воды;
- приборы отопления.
Медные трубки широко используют в радиаторах автомобильных систем охлаждения и кондиционеров, применяемых в быту. Чугунные батареи сохраняют тепло в квартире, даже при непостоянной подаче теплоносителя требуемой температуры. А радиаторы из алюминия, способствуют быстрой передаче тепла отапливаемому помещению.
При возникновении высокой температуры, в результате трения металлических поверхностей, также важно учитывать теплопроводность изделия. В любом редукторе или другом механическом оборудовании, способность отводить тепло, позволит деталям механизма сохранить прочность и не быть подвергнутыми разрушению, в процессе эксплуатации. Знание свойств теплопередачи различных материалов, позволит грамотно применить те или иные сплавы из цветных или черных металлов.
В любом редукторе или другом механическом оборудовании, способность отводить тепло, позволит деталям механизма сохранить прочность и не быть подвергнутыми разрушению, в процессе эксплуатации. Знание свойств теплопередачи различных материалов, позволит грамотно применить те или иные сплавы из цветных или черных металлов.
Руководство по материалам электротехники для всех. Часть 2 / Хабр
Продолжение руководства по материалам электротехники. В этой части продолжаем разбирать проводники: Железо, Золото, Никель, Вольфрам, Ртуть.
Добро пожаловать под кат (ТРАФИК)
Железо
Fe — железо. Основной конструкционный материал в промышленности используется также и в электротехнике. Плохая, по сравнению с медью, электропроводность компенсируется очень низкой ценой. И, что важнее в России, меньшей привлекательностью для охотников за металлом, заземление из толстой ржавой трубы простоит без охраны дольше красивой медной шины.
В технике железо применяется почти исключительно в виде сплавов с углеродом — чугуна и сталей. Свойства сталей разных марок весьма различны: от мягких и до твердых инструментальных.
Примеры применения
Метизы. Винты, шайбы, гайки из стали изготавливаются огромными количествами на специально разработанном для этого оборудовании. Метизы из других металлов встречаются очень редко и значительно дороже. Поэтому, в большинстве случаев, медный наконечник медного провода будет притянут к медной же шине стальным болтом. Также важным является высокая прочность стали, медный болт не затянуть с усилием стального. Обратите внимание на цифры на головке болта: они обозначают его прочность. Чем больше число, тем сильнее можно затягивать болт.
Клеммные колодки, соединители. Всем известные «орехи» содержат стальные пластинки с защитным покрытием от коррозии. Также, применение стали необходимо для предотвращения гальванической коррозии при соединении медных и алюминиевых проводов.
Соединитель «орех». Внутри пластиковой оболочки комплект стальных пластин с винтами, позволяет сделать ответвление от жилы кабеля не разрезая саму жилу. Также позволяет перейти от алюминиевой жилы на медную.
Контуры заземления. Требования электробезопасности обязывают предусматривать заземление. Часто, в промышленных условиях, заземляющую шину изготавливают из стального проката, закрепленного по периметру стены. Плохая электропроводность стали компенсируется большим сечением проводника. Во многих случаях правила безопасности и стандарты предписывают делать детали заземления именно из стали по соображениям механической прочности.
Стальная полоса, огибающая колонну — шина заземления.
Широко используются магнитные свойства стали — из стальных пластин собирают сердечники трансформаторов, дросселей.
Недостатки
Коррозия. Железо ржавеет, при этом плотность ржавчины ниже плотности исходного железа, из-за этого конструкция распухает. Поэтому железо покрывают защитными покрытиями — оцинковка, лужение, хромирование, окраска и т.д. Разные марки стали подвержены коррозии в разной степени, причем по закону подлости сильнее всего ржавеют именно те, которые легче всего обрабатываются на станках.
Поэтому железо покрывают защитными покрытиями — оцинковка, лужение, хромирование, окраска и т.д. Разные марки стали подвержены коррозии в разной степени, причем по закону подлости сильнее всего ржавеют именно те, которые легче всего обрабатываются на станках.
Золото
Au — Золото. Самый бестолковый драгоценный металл. Имеет меньше всего применений в технике из всех драгоценных металлов, но является символом богатства. На удивление дороже платины (2017 г.), что лишено здравого смысла и является лишь результатом спекуляций.
Примеры применения
Покрытия контактов. Благодаря тому, что золото на воздухе не окисляется, контакты покрывают очень тонким слоем золота.
Золотое покрытие на различных электронных компонентах: покрытие на контактах платы для установки в слот, покрытие на контактах мембранных кнопок мобильного телефона, покрытие на штырьках процессора.
Защита от коррозии. В некоторых ответственных применениях используется золотое покрытие для защиты проводников от коррозии (в основном — военка). Когда-то покрытие золотом являлось единственным способом защитить детали электроники от коррозии в условиях джунглей, поэтому у многих старых радиодеталей позолочены даже корпуса. А сейчас обычно просто заливают плату компаундом в «кирпич».
В некоторых ответственных применениях используется золотое покрытие для защиты проводников от коррозии (в основном — военка). Когда-то покрытие золотом являлось единственным способом защитить детали электроники от коррозии в условиях джунглей, поэтому у многих старых радиодеталей позолочены даже корпуса. А сейчас обычно просто заливают плату компаундом в «кирпич».
Интересные факты о золоте
- Золото — один из четырех металлов, имеющий оттенок в не окислившемся состоянии. Все остальные металлы белые (желтоватый цвет имеют золото и цезий, медь — красноватая и в сплавах золотистая, осмий имеет голубой отлив).
- Плотность золота отличается от плотности вольфрама незначительно (19,32 г/см3 у золота, 19,25 г/см3 ), этим пользуются для подделки золотых слитков, покрывая вольфрамовый слиток слоем золота. Возможно, это одна из причин, почему американцы никому не дают проверить подлинность их золотого запаса. И, возможно, поэтому они отдали Германии их золото не сразу.

- Можно извлечь золото химически из горы старой электроники, но это не всегда экономически целесообразно и преследуется по закону (ст. 191, 192 УК РФ).
Никель
Ni — Никель. Замечательный металл, но в электронной технике основное применение — как дешевая альтернатива золоту — покрытие контактов. Если контакт покрыт белым блестящим металлом, то это скорее всего никель.
Примеры применения
Покрытие контактов. Наносится на медь, пластик, для надежного контакта и для декоративных целей. Жадные китайцы иногда вообще делают контакты из пластмассы, покрывая сверху слоем никеля и хрома, внешне выглядит нормальным, даже как то работает, но ни о какой надежности речи не идет.
Различные разъемы, покрытые никелем для надежного контакта.
У разъема справа для экономии металла сердцевина штыря сделана полой с заливкой пластиком. Латунная никелированная трубочка, из которой сделан штырь, не самый худший вариант.
Тоководы у ламп. Сплав Платинит (46% Ni, 0,15% C, остальное — Fe) не содержит платины, но имеет очень близкое к платине значение линейного температурного расширения, что позволяет делать из него надежные электроды, проходящие через стекло. Такие электроды при изменении температуры не вызывают растрескивания стекла и потерю герметичности.
Промежуточные защитные слои. Для защиты от коррозии, взаимной диффузии металлов при создании покрытий, могут формироваться промежуточные слои из никеля. Жала современных паяльников защищены слоем никеля, жало из голой меди медленно растворяется в олове, теряя форму.
Вольфрам
W — Вольфрам. Тугоплавкий металл, температура плавления 3422 градусов Цельсия, что определяет основное его использование — нити накала и электроды.
Примеры применения
Нити накала. В лампах накаливания, в галогеновых лампах спираль изготовлена из вольфрама, нагревается электрическим током до белого каления, при этом сохраняя свою форму. Также катоды в радиолампах изготавливаются из вольфрама, но раскаливаются не до таких высоких температур, как осветительные лампы, специальное покрытие на катоде позволяет протекать термоэлектронной эмиссии при невысоких температурах.
Также катоды в радиолампах изготавливаются из вольфрама, но раскаливаются не до таких высоких температур, как осветительные лампы, специальное покрытие на катоде позволяет протекать термоэлектронной эмиссии при невысоких температурах.
Мощная лампа накаливания от проектора. Даже тугоплавкий вольфрам со временем испаряется и оседает на стенках колбы в виде темного налета. Данного недостатка лишены галогеновые лампы.
Нить накаливания этой галогеновой лампы изготовлена из вольфрама. Галоген, обычно пары иода, химически связывает испаряющийся с нити вольфрам и возвращает его на нить, что позволяет повысить температуру накала спирали и уменьшить габарит лампы без страха, что вольфрам постепенно осядет на стенках колбы.
Электроды дуговых ламп и сварочные электроды. В ксеноновых дуговых лампах, ртутных дуговых лампах, электроды должны выдерживать температуру электрической дуги, при этом не расплавляясь и не изменяя своей формы, что под силу только вольфраму. Также электроды для сварки неплавящимся электродом изготовлены из вольфрама (TIG сварка).
Также электроды для сварки неплавящимся электродом изготовлены из вольфрама (TIG сварка).
Аноды рентгеновских трубок. Поток электронов от катода в рентгеновской трубке, разогнанный высоким напряжением тормозится бомбардируя анод, очень сильно нагревая его, поэтому такие аноды, особенно если они не имеют водяного охлаждения, зачастую изготавливаются из вольфрама. Однако в физических лабораториях часто применяют и аноды из меди или кобальта в связи с особенностями спектра рентгеновского излучения от таких
Источники
Вольфрам — не очень пластичный материал, поэтому спиральку из лампы накаливания вряд ли удастся выпрямить и использовать по своему разумению. Если вдруг понадобится вольфрамовый стержень — вам пригодится любой магазин по сварочному делу, электрод для TIG-горелки без содержания лантана и других присадок. Проволоку для нитей накала самодельной техники нетрудно купить на eBay.
Цветовая маркировка электродов:
- Зеленый — чистый вольфрам.

- Красный, оранжевый — вольфрам + торий (Радиоактивно! Не шлифовать, не резать — пыль опасна!).
- Голубой — вольфрам + сложная смесь.
- Черный, желтый, синий — вольфрам + лантан.
- Серый — вольфрам + церий.
- Белый — вольфрам + цирконий.
Ртуть
Hg — Ртуть. При комнатной температуре — блестящий, собирающийся в шарики жидкий металл. По экологическим соображениям использование ртути сокращается, но она широко использовалась в старых приборах, поэтому заслуживает упоминания.
Как и большинство металлов, ртуть образует сплавы. Но ртуть, будучи жидкой при комнатной температуре, способна сплавляться с металлами без дополнительного нагревания, растворять их. Растворенный в ртути металл, сплав металла с ртутью называется «амальгама».
Примеры применения
Жидкий контакт в датчиках положения, ртутных электроконтактных термометрах.
Различные ртутные приборы. Слева — мощный ртутный переключатель, замыкающий/размыкающий цепь при наклоне. Ниже на чёрных платках — аналогичные китайские ртутные переключатели — датчики положения из детского набора с Arduino. Сверху — колба ртутного электроконтактного термометра. В стекло вплавлены проволочки так, что при температуре 70°С столбик ртути в капилляре замыкает цепь (температура указана на корпусе).
В термометрах. Низкая температура замерзания, высокая температура кипения и большой коэффициент теплового расширения делают ртуть одним из самых удобных веществ для лабораторных и медицинских термометрах. В бытовых термометрах ртуть уже очень давно не используется.
В манометрах и барометрах. Ртуть тяжелая, поэтому для уравновешивания атмосферного давления достаточно 70-80 см высоты столбика ртути. Хотя ртутные барометры в основном вышли из употребления, единицы измерения давления «миллиметр ртутного столба», а в вакуумной технике — «микрон ртутного столба» и «торр» (округленный вариант мм. рт. ст.) используются и по сей день. Нормальным атмосферным давлением считается 760 мм. рт. ст.
рт. ст.) используются и по сей день. Нормальным атмосферным давлением считается 760 мм. рт. ст.
В нормальных элементах. Батарейка (Попытка запитать от такой батарейки самоделку обернется провалом — батарейка имеет большое внутренее сопротивление (порядка единиц кОм) и не предназначена отдавать токи больше сотых долей микроампера, да и то с
перерывами.
Элемент нормальный насыщенный, НЭ-65, класс точности 0,005. Внешний вид корпуса нормальных элементов может различаться. Ниже — содержимое корпуса, видна ртуть в нижней части колб. Такие элементы должны утилизироваться специализированной организацией.
Внешний вид корпуса нормальных элементов может различаться. Ниже — содержимое корпуса, видна ртуть в нижней части колб. Такие элементы должны утилизироваться специализированной организацией.
В диффузионных вакуумных насосах. Струя ртутного пара, выходящая из сопла с большой скоростью, захватывает молекулы воздуха и вытягивает их из откачиваемого объема. Затем ртутный пар конденсируется за счет охлаждения жидким азотом и используется снова. Насосы такого типа когда-то использовались для откачки радиоламп. Сейчас вместо ртути используются нетоксичные и не требующие жидкого азота силиконовые масла, но в
некоторых лабораториях до сих пор можно найти старые ртутные системы.
Пары ртути — рабочий газ люминесцентных ламп. Несмотря на то, что люминесцентная лампа должна содержать небольшое количество ртути, в некоторых лампах ртути добавлено от души, и видно, как в колбе перекатывается шарик ртути. Пары ртути при возбуждении их электрическим током излучают яркий свет, преимущественно в синей и ультрафиолетовой области.
В мощных тиратронах и ртутных выпрямителях. Используется так же, как и в ртутных лампах. Мощные ртутные вентили широко использовались для питания локомотивов на железных дорогах и в других подобных задачах до появления полупроводниковых приборов.
Как растворитель для металлов при выделении золота и платины из сырья амальгамацией и в производстве зеркал. Ртуть выпаривается, металл остается. Иногда этот процесс неправильно называют «аффинаж», путая его с совершенно другим способом выделения драгметаллов.
В ртутных счетчиках времени наработки. В старой технике ртутный капиллярный кулономер использовался как счетчик часов, которые проработал прибор. Гениальная по простоте и надёжности конструкция.
В амальгамных зубных пломбах. Встречаются и по сей день, особенно в США.
Токсичность
Все изделия, содержащие ртуть, должны утилизироваться специализированной службой. Недопустимо выбрасывать их с бытовым мусором во избежание скопления ртути на свалке.
Все разливы ртути должны быть собраны, а поверхности демеркуризованы. Ртуть хорошо испаряется при комнатной температуре, поэтому закатившийся в щель шарик ртути долгое время будет отравлять воздух.
Демеркуризация
Если у вас разбилось изделие с ртутью, то предпринимайте следующие действия:
1. Откройте форточки и обеспечьте проветривание.
2. Вызовите специализированную службу демеркуризации в вашем городе. Профессионалы не только грамотно уберут ртуть, но также и произведут замеры концентрации паров ртути

3. Соберите видимые шарики ртути в герметичную тару. Их удобно собирать вместе при помощи двух хорошо обрезанных листов бумаги, сливая шарики в подготовленную тару. Мельчайшие шарики ртути из щелей можно вытянуть при помощи спиринцовки, или щетки из металла, которые смачивает ртуть (например медь). Разумеется после использования такой «инструмент» окажется загрязнен ртутью и подлежит утилизации.
Затем при помощи химических средств оставшаяся, не видимая глазу ртуть переводится в нелетучие но по прежнему ядовитые соли, которые спокойно можно удалить с поверхности моющими средствами. Для этого используются 0,2% водный раствор перманганата натрия («марганцовка») подкисленный добавлением 0,5% соляной кислоты или 20% раствор хлорного железа (того, которым платы травят). Вопреки указаниям в старых книгах, засыпание места разлива порошком серы не эффективно.
4. Тщательно промыть обработанные площади водой с моющим средством.
5. Всю собранную ртуть и загрязненные предметы герметично упаковать и сдать в специализированную организацию.
Что однозначно не стоит делать при разливе ртути:
1. Паниковать и спешить. Иногда, при небольших авариях больше вреда наносит паника и спешка, чем сама авария. Вспоминается байка, записанная Ю.А.Золотовым:
Однажды, когда профессор МГУ Алексей Николаевич Кост вел практикум по органической химии, у одного из студентов разбилась колба с эфиром и его пары вспыхнули. Началась паника, кто-то прибежал с углекислотным огнетушителем и с трудом погасил пожар. Все это время Кост совершенно невозмутимо сидел за своим столом и с кем-то разговаривал. Потом, когда все успокоились, подошел к месту происшествия и приказал:
— Спички!
Ему дали коробок, он чиркнул спичкой и бросил ее в еще не просохшую эфирную лужу. Огонь вспыхнул вновь, все оторопели. А Кост, не суетясь, взял противопожарное одеяло, ловко накрыл им пламя и изрек:
— Гореть надо умеючи!
2. Пытаться собрать ртуть пылесосом, пылесос только в турборежиме раздробит и испарит шарики ртути, в итоге все помещение и сам пылесос окажутся загрязнены рутью. Аналогично не стоит использовать для сбора ртути веники, щетки — они только раскидывают и дробят шарики ртути.
Аналогично не стоит использовать для сбора ртути веники, щетки — они только раскидывают и дробят шарики ртути.
3. Сливать ртуть в раковину или унитаз. Ртуть значительно тяжелее воды, поэтому навсегда осядет в первом попавшемся изгибе трубы — в гидрозатворе или колене.
Пару слов о токсикологии ртути
Некоторые в детстве играли шариками ртути, и «с ними ничего не было». Действительно, вопреки распространенному мнению металлическая ртуть при кратковременном контакте малоопасна. Причина малой токсичности металлической ртути — в ее плохой биодоступности. Нерастворимая в воде и химически инертная, почти как благородные металлы, она не может быстро попасть в организм.
Опасно вдыхание паров ртути, и это практически единственный путь поступления ее в организм. Касание ртути пальцами никакой дополнительной опасности не добавляет. Более того, даже проглатывание ртути обычно проходит без последствий для здоровья. Ртуть химически достаточно инертна и выходит из организма естественным путем. Поэтому она является причиной не острых отравлений, а вялотекущих хронических, проявляющихся в медленном постепенном ухудшении здоровья и не всегда вовремя диагностируемых врачами. Именно этим ртуть и коварна: маленький шарик, закатившийся под плинтус, будет годами испаряться и отравлять воздух в квартире, а жильцы не будут понимать, чем и почему они болеют.
Поэтому она является причиной не острых отравлений, а вялотекущих хронических, проявляющихся в медленном постепенном ухудшении здоровья и не всегда вовремя диагностируемых врачами. Именно этим ртуть и коварна: маленький шарик, закатившийся под плинтус, будет годами испаряться и отравлять воздух в квартире, а жильцы не будут понимать, чем и почему они болеют.
Растворимые соединения ртути намного опаснее, и именно они образуются, когда ртуть так или иначе попадает в организм человека, животных или в растений. Рекорд по токсичности принадлежит диметилртути — это ужасно токсичное из известных человечеству веществ, настолько токсичное, что при первой возможности ищут менее опасную альтернативу если предстоит работа с ней. Капля диметилртути способна убить человека сквозь резиновые перчатки, причем первые симптомы отравления могут появиться только на следующий день.
Если вы выкинув ртуть подальше от дома думаете, что проблема устранена — то вы серьезно ошибаетесь. Ртуть — яд кумулятивный, способный к накоплению в живых организмах и передаче дальше по пищевой цепочке. Примером отравления человека ртутью является болезнь Минамата. Ртуть из выброшенной люминесцентной лампы отравит если не вас, то ваших потомков.
Примером отравления человека ртутью является болезнь Минамата. Ртуть из выброшенной люминесцентной лампы отравит если не вас, то ваших потомков.
Дополнительные сведения
Если вы нашли где-нибудь ртуть, не пытайтесь ее продать. Ртуть и ее соли считаются сильнодействующими ядовитыми веществами (ст. 234 УК РФ). На содержащие ртуть приборы заводского производства, соответствующие официальным стандартам, запрет не распространяется. Найденную ртуть и неисправные ртутьсодержащие приборы, следует сдавать на переработку в специализированные службы в вашем городе. Единственный широко доступный источник ртути (если вдруг понадобится в научной работе) — медицинские термометры.
Ссылки на части руководства:
1: Проводники: Серебро, Медь, Алюминий.
2: Проводники: Железо, Золото, Никель, Вольфрам, Ртуть.
3: Проводники: Углерод, нихромы, термостабильные сплавы, припои, прозрачные проводники.
4: Неорганические диэлектрики: Фарфор, стекло, слюда, керамики, асбест, элегаз и вода.
5: Органические полусинтетические диэлектрики: Бумага, щелк, парафин, масло и дерево.
6: Синтетические диэлектрики на базе фенолформальдегидных смол: карболит (бакелит), гетинакс, текстолит.
7: Диэлектрики: Стеклотекстолит (FR-4), лакоткань, резина и эбонит.
8: Пластики: полиэтилен, полипропилен и полистирол.
9: Пластики: политетрафторэтилен, поливинилхлорид, полиэтилентерефталат и силиконы.
10: Пластики: полиамиды, полиимиды, полиметилметакрилат и поликарбонат. История использования пластиков.
11: Изоляционные ленты и трубки.
12: Финальная
Сравнение элементов периодической таблицы | Сравните железо и серу
Сравните железо и серу
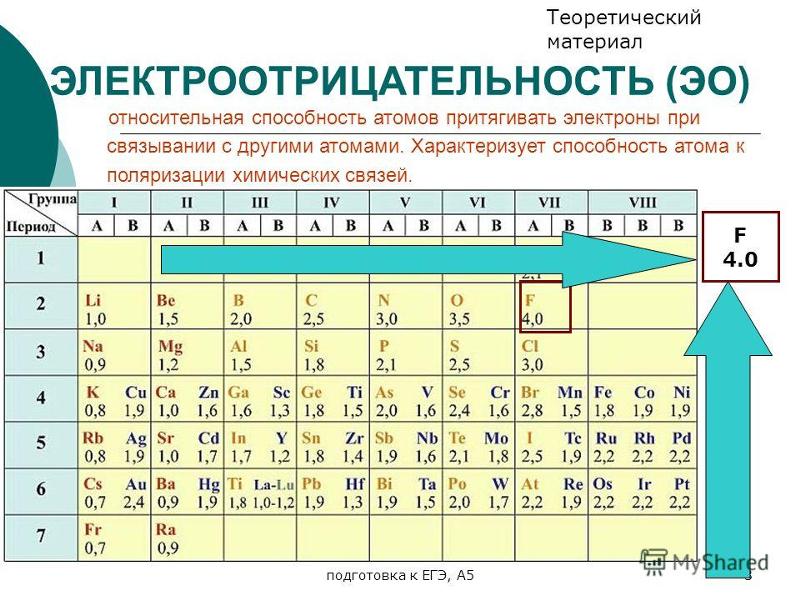
Сравните железо и серу на основе их свойств, атрибутов и фактов периодической таблицы. Сравните элементы по более чем 90 свойствам. Все элементы подобных категорий обнаруживают много сходств и различий в своих химических, атомных, физических свойствах и использовании. Эти сходства и различия следует знать, изучая элементы таблицы Менделеева.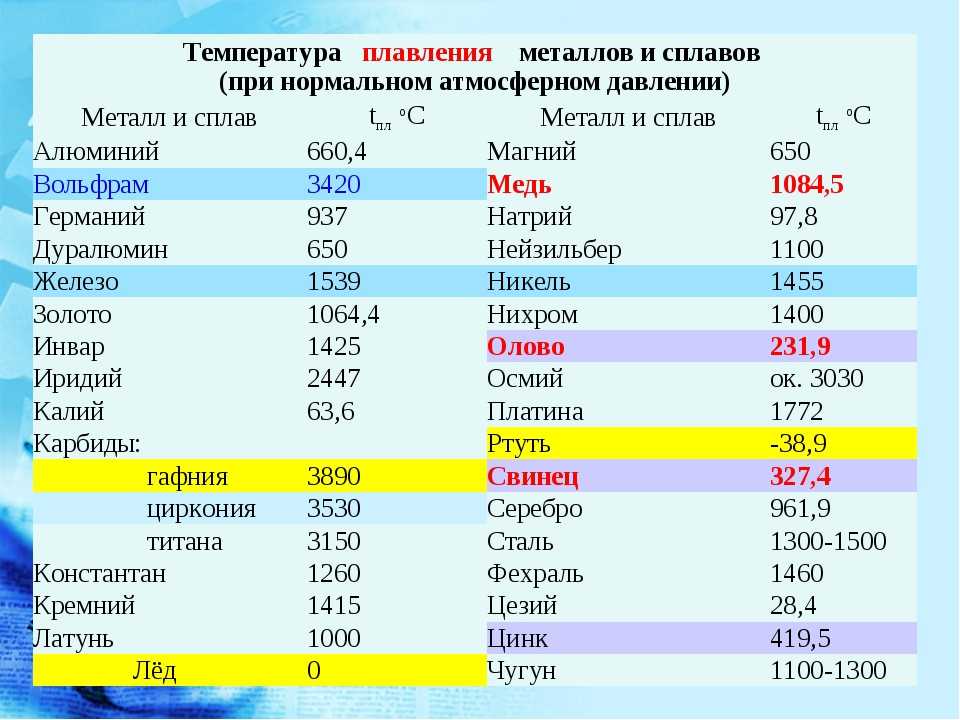 Вы можете изучить подробное сравнение между железом и серой с наиболее надежной информацией об их свойствах, атрибутах, фактах, использовании и т. д. Вы можете сравнить железо и серу по более чем 90 такие свойства, как электроотрицательность, степень окисления, атомные оболочки, орбитальная структура, электросродство, физические состояния, электрическая проводимость и многое другое.
Вы можете изучить подробное сравнение между железом и серой с наиболее надежной информацией об их свойствах, атрибутах, фактах, использовании и т. д. Вы можете сравнить железо и серу по более чем 90 такие свойства, как электроотрицательность, степень окисления, атомные оболочки, орбитальная структура, электросродство, физические состояния, электрическая проводимость и многое другое.
26 Fe Iron
Swap Sulfur vs Iron
Periodic Table Element Comparison
16 S Sulfur
Facts
| Name | Iron | Sulfur | |||
| Atomic Number | 26 | 16 | |||
| Атомный символ | Fe | S | |||
| Atomic Weight | 55.845 | 32.065 | |||
| Phase at STP | Solid | Solid | |||
| Color | Gray | Yellow | |||
| Metallic Classification | Переходный металл | Другой неметалл | |||
| Группа в периодической таблице | группа 8 | группа 16 | |||
| Название группы | iron family | oxygen family | |||
| Period in Periodic Table | period 4 | period 3 | |||
| Block in Periodic Table | d -block | p -block | |||
| Electronic Configuration | [Ar] 3d6 4s2 | [Ne] 3s2 3p4 | |||
| Структура электронной оболочки (количество электронов на оболочку) | 2, 8, 14, 2 | 2, 8, 6 | 96 Температура плавления0021 | 1811 K | 388. 36 K 36 K |
| Boiling Point | 3134 K | 717.87 K | |||
| CAS Number | CAS7439-89-6 | CAS7704-34-9 | |||
| Neighborhood Elements | До Соседства Элементы Железа | Соседства Элементы Серы |
История
| История | Элемент Железо был открыт Неизвестно в 500 г. до н.э. Железо получило свое название от английского слова (ferrum на латыни). | Элемент Сера был открыт китайцами/индейцами за год до 2000 г. до н.э. Сера получила свое название от латинского слова sulphur, «огонь и сера». |
| Discovery | Unknown (Before 5000 BCE) | Chinese/Indians (Before 2000 BCE) |
| Isolated | Egypt (4000 BCE) | () |
Presence: Abundance in Nature и вокруг нас
Части на миллиард (млрд) по массе / по атомам (1 ч/млрд = 10^-7 %)
| Abundance in Universe | 1100000 / 20000 | 500000 / 20000 |
| Abundance in Sun | 1000000 / 30000 | 400000 / 10000 |
| Abundance in Meteorites | 220000000 / 77000000 | 41000000 / 22000000 |
| Изобилие в земной коре0021 | 3 / 0. 33 33 | 928000 / 179000 |
| Abundance in Humans | 60000 / 6700 | 2000000 / 3 |
Crystal Structure and Atomic Structure
| Atomic Volume | 7.0923 cm3/ Мол | 15,53 см3/моль | ||||
| Атомный радиус | 156 PM | 88 PM | ||||
| Covalent Radius | 125 PM | 102 PM | 125 PM | 102 PM | 125 PM | 102 вечера | 0026
| Van der Waals Radius | — | 180 pm | ||||
| Atomic Spectrum | ||||||
| Lattice Constant | 286.65, 286.65, 286.65 pm | 1043.7, 1284.5, 2436.9 pm | ||||
| Угол решетки | π/2, π/2, π/2 | π/2, π/2, π/2 | ||||
| Наименование космической группы | IM_ 3M | FDD | ||||
| Группа Космос номер | FDD | |||||
| ГРУППА НОМЕР | ||||||
| Космос номер | ||||||
| № | ||||||
| № | ||||||
| № | 229 | 70 | ||||
| Crystal Structure | Body Centered Cubic | Face Centered Orthorhombic |
Atomic and Orbital Properties
| Atomic Number | 26 | 16 |
| Количество электронов (бесплатно) | 26 | 16 |
| Количество протонов | 26 | 16 |
| Mass Number | 55.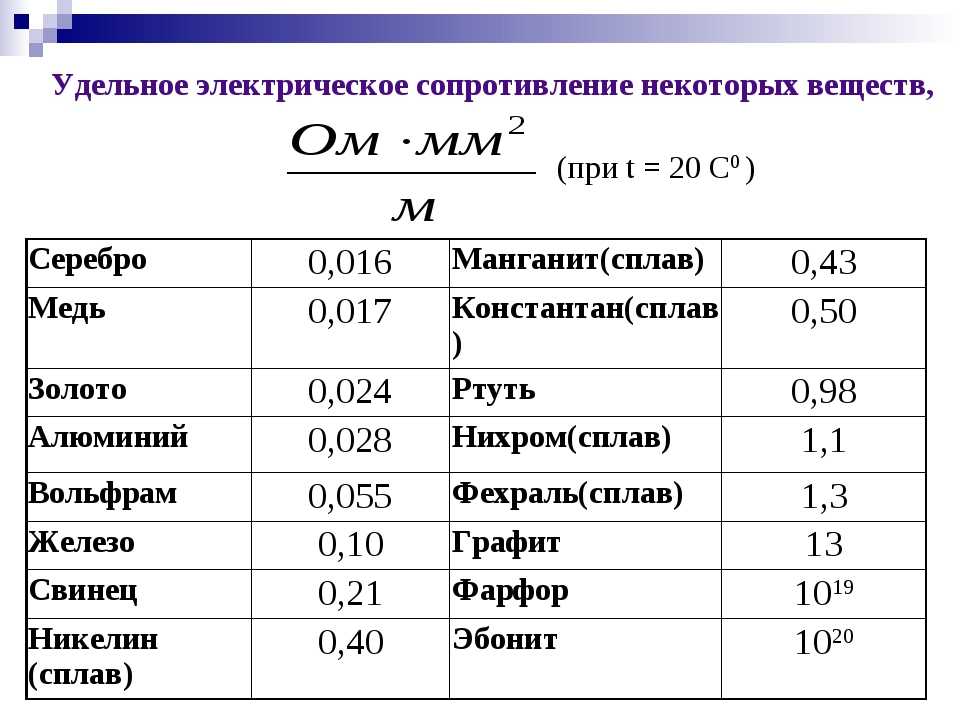 845 845 | 32.065 |
| Number of Neutrons | 30 | 16 |
| Shell structure (Electrons per energy level) | 2, 8, 14, 2 | 2, 8 , 6 |
| Electron Configuration | [Ar] 3d6 4s2 | [Ne] 3s2 3p4 |
| Valence Electrons | 3d6 4s2 | 3s2 3p4 |
| Oxidation State | 2, 3 | -2, 2, 4, 6 |
| Atomic Term Symbol (Quantum Numbers) | 5D4 | 3P2 |
| Shell structure |
Isotopes and Nuclear Свойства
Железо имеет 4 стабильных природных изотопа, в то время как сера имеет 4 стабильных природных изотопа.
| Известные изотопы | 45Fe, 46Fe, 47Fe, 48Fe, 49Fe, 50Fe, 51Fe, 52Fe, 53Fe, 54Fe, 55Fe, 56Fe, 57Fe, 58Fe, 59Fe, 60Fe, 61Fe, 62Fe, 63Fe, 64Fe, 65Fe, 66Fe, 67Fe, 68Fe, 69Fe, 70Fe, 71Fe, 72Fe | 26S, 27S, 28S, 29S, 30S, 31S, 32S, 33S, 34S, 3 35 , 37S, 38S, 39S, 40S, 41S, 42S, 43S, 44S, 45S, 46S, 47S, 48S, 49S |
| Стабильные изотопы | .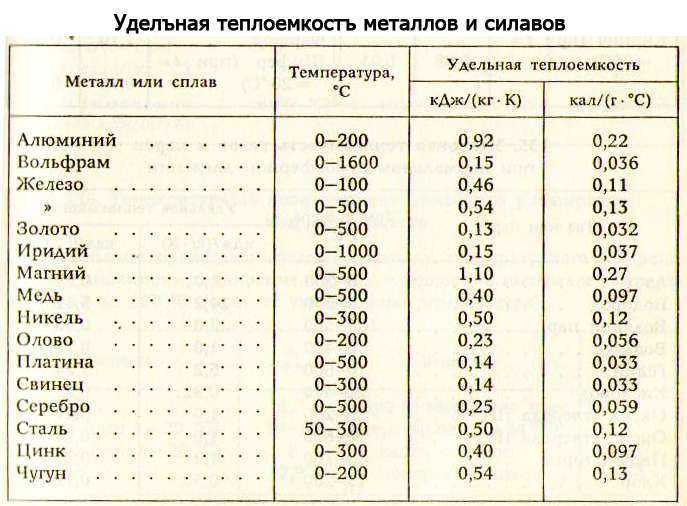 Природные стабильные изотопы: Природные стабильные изотопы:32S, 33S, 34S, 36S | |
| Нейтронное сечение | 2,56 | 0.52 |
| Neutron Mass Absorption | 0.0015 | 0.00055 |



 22 -й: 173600 кДж/моль
22 -й: 173600 кДж/моль 0923 cm3/mol
0923 cm3/mol 0021
0021 8 kJ/mol
8 kJ/mol
 Притяжение электронов связано с вакансией на электронной орбитали серы. Электронная конфигурация серы [Ne] 3s 2 3p 4 с двумя вакантными местами, а электронная конфигурация железа — [Ar] 3d 6 4s 2 с четырьмя вакантными орбиталями.
Притяжение электронов связано с вакансией на электронной орбитали серы. Электронная конфигурация серы [Ne] 3s 2 3p 4 с двумя вакантными местами, а электронная конфигурация железа — [Ar] 3d 6 4s 2 с четырьмя вакантными орбиталями.  Проанализируем причину плохой проводимости пирита.
Проанализируем причину плохой проводимости пирита.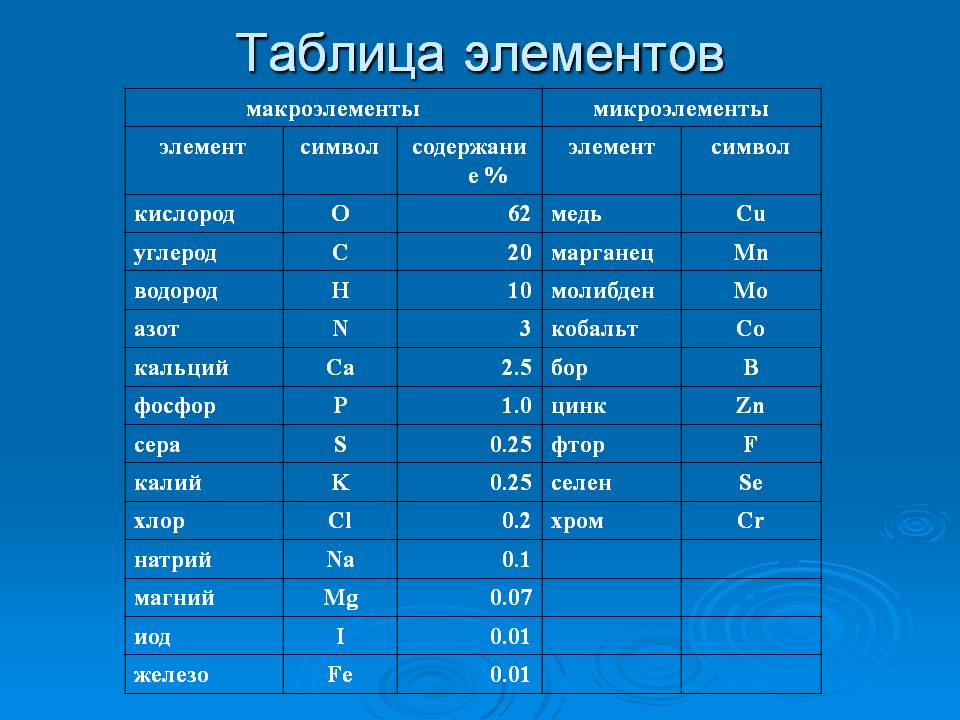 Остановимся хотя бы на некоторых примерах использования пирита в качестве проводника.
Остановимся хотя бы на некоторых примерах использования пирита в качестве проводника.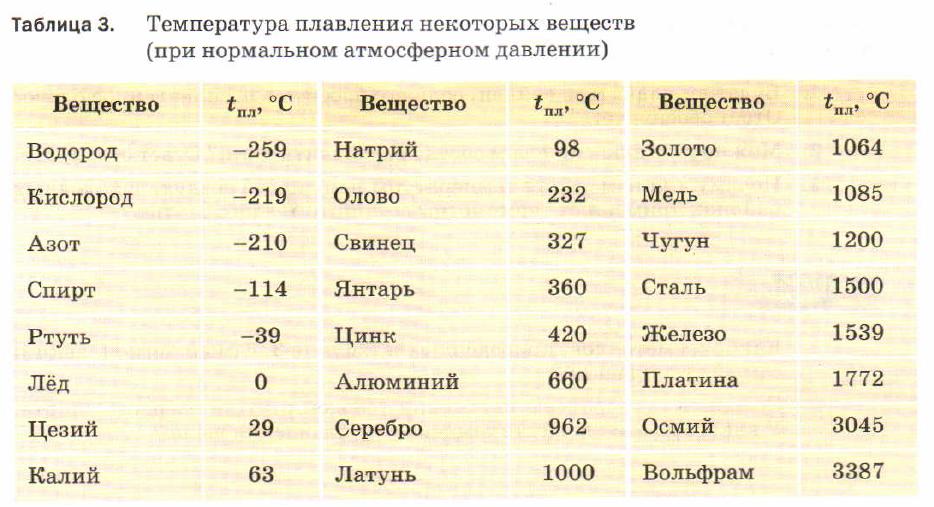 Размер зерен пирита больше или равен 5 мм, а коэффициент теплопроводности пирита низкий.
Размер зерен пирита больше или равен 5 мм, а коэффициент теплопроводности пирита низкий. 