Ртуть, электропроводность — Справочник химика 21
Простые вещества по свойствам составляющих их элементов делятся на металлы и неметаллы. Металлы имеют ряд общих свойств. Это — металлический блеск, высокая теплопроводность и электропроводность. Бее металлы, кроме ртути, при нормальных условиях (температура 0°С, давление 1 атм.) являются твердыми веществами, прочными и пластичными. Металлы обладают более высокими восстановительными свойствами, чем неметаллы. Подробнее о металлах и неметаллах разговор пойдет в главе 2 и в главе 7, В приведенной на форзаце Периодической системе элементов разными цветами выделены типичные металлы и неметаллы. [c.10]Наиболее изученный из всех четырех элементов — лантан — проводит электрический ток почти вдвое лучше ртути. Электропроводность иттрия и скандия немного ниже. [c.228]
Способность тел проводить электричество называется их электропроводностью.
Здесь и далее электропроводность ртути принята за единицу. [c.277]
Электропроводность расплавленных солей, как правило, с температурой увеличивается (исключение составляют соли ртути, индия и некоторые другие). Особенно быстро увеличивается электропроводность при температурах, незначительно превышающих температуры плавления. [c.452]
Металлы — хорошие проводники тепла и электричества. При прохождении электрического тока через металлические проводники не происходит переноса частиц металла (электронная проводимость, или проводимость первого рода). По способности проводить тепло и электричество металлы располагаются приблизительно в одном и том же порядке лучшие проводники —серебро и медь, затем золото, алюминий, железо и худшие —свинец и ртуть. Следовательно, между теплопроводностью металлов и их электропроводностью наблюдается почти постоянное соотношение.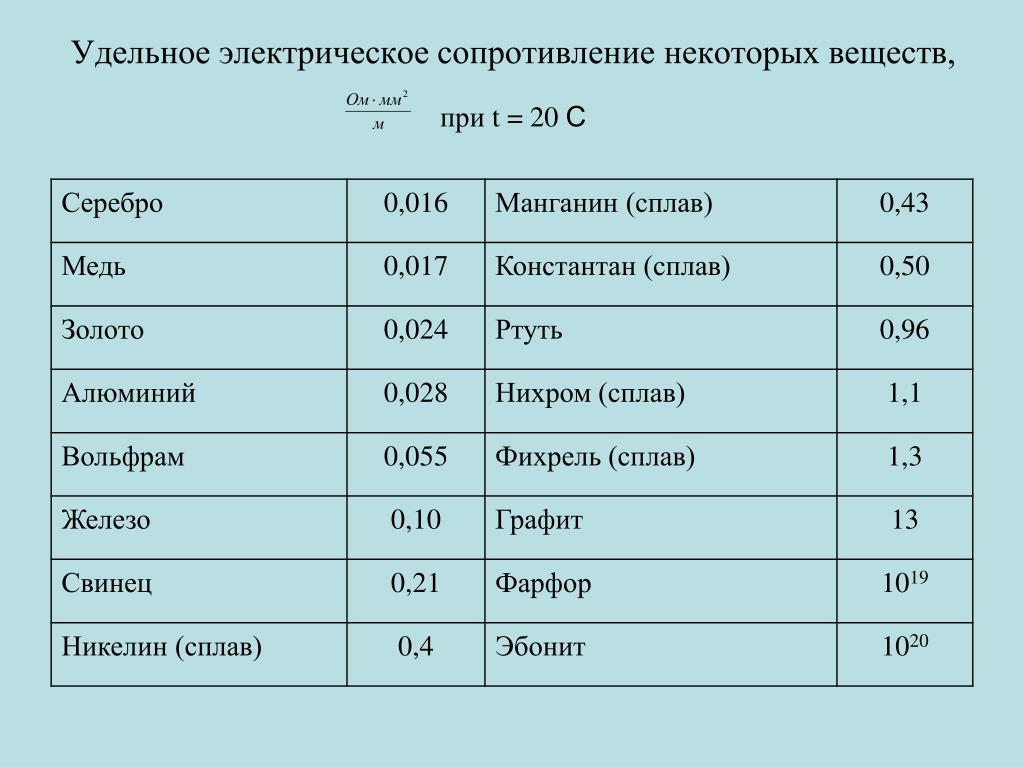
Конвективный ток зарядов внутренней обкладки замыкается омическим током, который течет внутра капли ртути. Электропроводность ртути велика по сравнению с электропроводностью раствора, поэтому возникающим падением потенциала можно пренебречь. Это условие [c.500]
Существенные сведения относительно природы химической связи в металлах можно получить на основании двух характерных особенностей по сравнению с ковалентными и ионными соединениями. Металлы, во-первых, отличаются от других веществ высокой электропроводностью и теплопроводностью, во-вторых, в обычных условиях являются кристаллическими веществами (за исключением ртути), структуры которых характеризуются высокими координационными числами. [c.104]
Ка —> Ка+ + е НгО + е —> ОН + 1/2Н2 В результате разложения образуются едкий натр и водород. Вследствие высокого перенапряжения водорода на ртути процесс протекает очень медленно. Для ускорения процесса разложения амальгаму натрия необходимо ввести в контакт с металлом или другим электропроводным материалом, имеющим низкое перенапряжение водорода. Металл и амальгама образуют короткозамкнутый элемент, при работе которого водород будет выделяться на металле, а натрий переходить в раствор. [c.162]
Металл и амальгама образуют короткозамкнутый элемент, при работе которого водород будет выделяться на металле, а натрий переходить в раствор. [c.162]
Электропроводность расплавленной ионной соли обычно на один-два порядка превышает электропроводность водного раствора того же электролита. Так, например, удельная электропроводность расплава КС1 при 800°С равна 24,2 См/м, тогда как удельная электропроводность водного раствора хлорида калия Проводимость расплавов остается, однако, на 3—4 порядка ниже проводимости жидких металлов, например ртути. Для сравнения электропроводности различных расплавленных солей, как и водных растворов, используют эквивалентную электропроводность. Однако при рассмотрении расплавов возникает проблема, связанная с сильной зависимостью Л от температуры и с необходимостью выбора соответствующей температуры сравнения, тем более что температуры плавления разных веществ существенно отличны. Особенно резкое изменение электропроводности происходит вблизи температуры плавления, так как при плавлении разрушается (диссоциирует) ионная решетка.
Здесь и далее условно за единицу электропроводности принята электропроводность ртути.
Лантаноиды ковки, имеют относительно невысокую твердость, по электропроводности сходны с ртутью. [c.551]
Металлические решетки образуют простые вещества большинства элементов периодической системы — металлы. По прочности. металлические решетки находятся между атомными и молекулярными кристаллическими решетками. Это связано с тем, что металлической связи присущи и характерные черты ковалентной связи, и отдельные черты дальнодействующей связи. Металлические решетки бывают и малопрочные, например, ртуть — жидкая. Металлам свойственны непрозрачность, характерный металлический блеск, хорошая тепло- и электропроводность и другие характерные свойства. Упрощенно металлическая решетка представляется в виде положительно заряженных ионов, располагающихся в узлах ее, и электронов, двигающихся между ними. Атомы металлов, с характерным для них дефицитом валентных электронов, должны иметь как можно больше соседних атомов, чтобы этот дефицит компенсировать за счет электронов соседей. Поэтому координационное число здесь достигает больших значений (8—12). [c.161]
Упрощенно металлическая решетка представляется в виде положительно заряженных ионов, располагающихся в узлах ее, и электронов, двигающихся между ними. Атомы металлов, с характерным для них дефицитом валентных электронов, должны иметь как можно больше соседних атомов, чтобы этот дефицит компенсировать за счет электронов соседей. Поэтому координационное число здесь достигает больших значений (8—12). [c.161]
По физическим свойствам все металлы — твердые вещества (кроме ртути, которая при обычных условиях жидкая), они отличаются от неметаллов особым видом связи (металлическая связь). Валентные электроны слабо связаны с конкретным атомом и внутри каждого металла существует так называемый электронный газ. Поэтому все металлы обладают высокой электропроводностью (т. е. они — проводники в отличие от неметаллов-диэлектриков), особенно медь, серебро, золото, ртуть и алюминий высока и теплопроводность металлов. Отличительным свойством многих металлов является их пластичность (ковкость), вследствие чего они могут быть прокатаны в тонкие листы (фольгу) и вытянуты в проволоку (олово, алюминий и др.
Измерение электропроводности растворов уксуснокислых солей ртути, меди и других тяжелых металлов показывает, что такие соли очень мало диссоциируют. Это характеризует наличие прочной химической связи между анионом СН3СОО и катионом. Образуют,иеся соли или более сложные по составу соединения диссоциируют часто также мало, и в этом отношении подобны комплексным аммиакатам ионов металлов и другим комплексным соединениям. Таким образом, солеобразующая группа — СООН является в то же время и комплексообразующей группой, причем образование комплексных групп происходит одновременно с замещением иона водорода на ион металла. Поэтому состояние равновесия существенно зависит от кислотности раствора. [c.98]
Они обладают очень хорошей удельной электропроводностью электропроводность лития в 10,9, натрия — в 22, калия — в 15, рубидия — в 8 и цезия — в 5,2 раза больше электропроводности ртути (при 0 С).
Физические свойства. Ртуть представляет собой серебристо-белый жидкий металл. Физические константы ее приведены в табл. 121. Удельная электропроводность ртути при 0° С равна 58% электропроводности серебра. Электропроводность ртути является стандартной единицей сопротивления — столбик ртути сечением в 1 мм и длиной в 106,3 см оказывает сопротивление в 1 ом. Молекулы ртути в парах моноатомны. [c.424]
Электропроводность а-марганца примерно в 3 раза ниже, а жидкого — примерно в 2,5 раза выше, чем у ртути (при обычных условиях). Как видно из рис. V11-24, аллотропия марганца отчетливо сказывается на характере изменения его электропроводности (и на растворимости в нем водорода).
Графит хорошо проводит тепло (в 3 раза лучше ртути) и обладает близкой к металлам электропроводностью (0,1 от электропроводности ртути). И электро- и теплопроводность больше параллельно слоям, чем перпендикулярно им. Максимум теплопроводности графита наблюдается около 0°С, а электропроводности — около 600 °С. Механическая прочность графита при переходе от обычных температур к 2500 °С возрастает почти вдвое. Его сжимаемость примерно в 20 раз больше сжимаемости алмаза. Заметное окисление графита при нагревании на воздухе наступает лишь выше 700 С. [c.502]
И электро- и теплопроводность больше параллельно слоям, чем перпендикулярно им. Максимум теплопроводности графита наблюдается около 0°С, а электропроводности — около 600 °С. Механическая прочность графита при переходе от обычных температур к 2500 °С возрастает почти вдвое. Его сжимаемость примерно в 20 раз больше сжимаемости алмаза. Заметное окисление графита при нагревании на воздухе наступает лишь выше 700 С. [c.502]
Электропроводность расплавленных солей, за исключением некоторых (соли ртути и индия), с температурой увеличивается. Особенно быстро увеличивается электропроводность при температурах, незначительно превышающих температуру плавления. В табл. 14.6 приведены удельные электропроводности некоторых [c.313]
Атомы металлов в твердой и жидкой фазах образуют в основном плотноупакованные структуры. При плавлении металлов электропроводность а обычно падает примерно в 1,5—2 раза. При повышении температуры жидкого металла электропроводность уменьшается, но медленнее, чем у твердых металлов.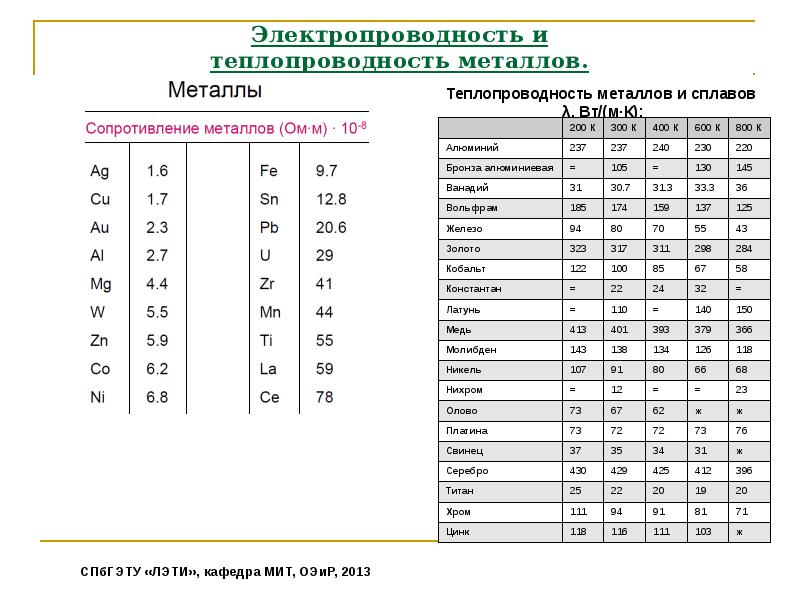 В жидких свинце и висмуте электропроводность почти не зависит от температуры, а у жидких цинка, кадмия и ртути она даже растет с увеличением температуры. Число электронов проводимости в единице объема жидких металлов часто почти совпадает с числом валентных электронов. Подвижность электронов в металлах, как было показано А. Р. Регелем [7], при плавлении меняется мало. Плотность жидких металлов меняется при их затвердевании незначительно. Сжимаемость жидких металлов, как и твердых, мала. Она примерно на порядок меньше сжимаемости жидких диэлектриков.
В жидких свинце и висмуте электропроводность почти не зависит от температуры, а у жидких цинка, кадмия и ртути она даже растет с увеличением температуры. Число электронов проводимости в единице объема жидких металлов часто почти совпадает с числом валентных электронов. Подвижность электронов в металлах, как было показано А. Р. Регелем [7], при плавлении меняется мало. Плотность жидких металлов меняется при их затвердевании незначительно. Сжимаемость жидких металлов, как и твердых, мала. Она примерно на порядок меньше сжимаемости жидких диэлектриков.
Хотя среднее число почти свободных электронов на один атом у всех металлов подгруппы цинка близко к двум, поведение электронов ртути во многом аномально. Ее электропроводность почти в три раза меньше, чем у цинка и кадмия, и быстро растет с увеличением давления. Термоэлектродвижущая сила ртути тоже аномально велика. [c.197]
Связи между атомами углерода одной и той же плоскости в решетке графита имеют типичный ковалентный характер. Отдельные плоскости связаны друг с другом в основном межмолекулярными силами, но отчасти между ними действуют и металлические связи (примерно один свободный электрон на 18 тыс. атомов углерода). Наличием последних обусловлена высокая электропроводность графита (0,1 от электропроводности ртути) и его хорошая теплопроводность (в три раза больше, чем у ртути). [c.300]
Отдельные плоскости связаны друг с другом в основном межмолекулярными силами, но отчасти между ними действуют и металлические связи (примерно один свободный электрон на 18 тыс. атомов углерода). Наличием последних обусловлена высокая электропроводность графита (0,1 от электропроводности ртути) и его хорошая теплопроводность (в три раза больше, чем у ртути). [c.300]
Электропроводность тория примерно в 5 раз, а урана в 3 раза выше электропроводности ртути. [c.370]
В случае использования активных веществ с низкой электропроводностью для повышения коэффициента использования применяется электропроводная добавка графита и сажи, которая образует токоотвод от большинства частиц активного вещества. Подобные добавки используются в активных массах, содержащих окись ртути, двуокись марганца. [c.30]
Для протекания токообразующей реакции необходимо поступление электронов к каждой частице окиси ртути, которая имеет очень низкую электропроводность в отличие от обычно применяемых разновидностей двуокиси марганца. Электропро- щ водной добавкой, обеспечивающей подвод электронов при разрядке к каждой частице окиси ртути, является графит. [c.252]
Электропро- щ водной добавкой, обеспечивающей подвод электронов при разрядке к каждой частице окиси ртути, является графит. [c.252]
Примером синтеза прямой конденсацией может служить получение золя ртути. Для этого Нордлунд пропускал пары ртути через слой воды и. получал довольно высокодисперсную эмульсию ртутц в воде. Аналогичным способом могут быть получены золн серы, селена и теллура. Путем конденсации в жидкости паров меди, серебра, золота и платины,. полученных в вольтовой дуге, можно получить соответствующие золи в воде, спиртах, глицерине или бензоле. Строение мицелл этих золей мало изучено. Стабилизатором при получении всех этих систем служат окислы веществ, получающиеся при соприкосновении их паров с воздухом при высокой температуре. Образование в таких условиях окислов, обладающих свойствами электролитов, подтверждается заметным возрастанием электропроводности системы. Однако более стойкие-золи получаются в том случае, если в воду, в которой происходит конденсация паров, вводят стабилизующие электролиты. [c.245]
[c.245]
Свойства металлов з- и р-элементов. Как известно, металлическая связь является многоцентровой, многоэлектронной и нелока-лизованной связью. Металлы отличаются тем, что у них по-разному заполнены электронами валентные энергетические зоны и зоны проводимости. -Металлы хорошие проводники электрического тока. Электрбпроводность р-металлов, как правило, много ниже. Так, натрий проводит ток примерно в 20 раз, олово в 6,7 раза, а сурьма только в 2,5 раза лучше ртути, электропроводность которой равна 1,06-10 ° мк-0м-м2 (273 К). [c.400]
Металлы отличаются характерным металлп геским блеском, ковкостью, тягучестью, могут прокатываться в листы или вытягиваться в нроволому, обладают хорошей тепло- и электропроводностью. При компатноп температуре все металлы (кроме ртути) находятся в твердом состоянии. [c.39]
Активная масса положительного электрода состоит из к15асной окиси ртути, к которой для повышения электропроводности добавляют 5—107о графита. Эту смесь запрессовывают в стальной корпус элемента. В одном из видов окиснортутных элементов активную массу отрицательного электрода составляет порошок цинка с добавкой / 1% ртути, которые запрессовывают в крышку элемента. Между электродами прокладывают фильтровальную бумагу. В качестве электролита (в виде геля или жидкости) применяют 36—40%-ный раствор едкого кали с добавкой 5% окиси цинка. В другом виде oки нopтytныx элементов отрицательным электродом служит металлизированная цинком бумага или фольга из амаль-гам.ированного цинка. Применение электродов с большой поверхностью (из порошкообраз ного цинка или фольги) вызвано необходимостью уменьшить пассивацию цинка. [c.877]
Эту смесь запрессовывают в стальной корпус элемента. В одном из видов окиснортутных элементов активную массу отрицательного электрода составляет порошок цинка с добавкой / 1% ртути, которые запрессовывают в крышку элемента. Между электродами прокладывают фильтровальную бумагу. В качестве электролита (в виде геля или жидкости) применяют 36—40%-ный раствор едкого кали с добавкой 5% окиси цинка. В другом виде oки нopтytныx элементов отрицательным электродом служит металлизированная цинком бумага или фольга из амаль-гам.ированного цинка. Применение электродов с большой поверхностью (из порошкообраз ного цинка или фольги) вызвано необходимостью уменьшить пассивацию цинка. [c.877]
Из уравнения (38.7) видно, что скорость движения поверхности ртути падает при увеличении электропроводности раствора. Из соотношения (38.7) и условия (ЭУ//( е = О можно рассчитать заряд Втах, при котором ток максимален [c.207]
Хорошо известны меркаптиды (тиолаты) тяжелых металлов. Из них наиболее распространены соли ртути, меди, серебра, висмута, олова и свинца. Соли свинца, например, издавна используются в зарубежной практике для очистки бензинов от меркаптанов ( докторские растворы ). Меркаптиды серебра могут быть использованы для получения серебряных поверхностей с хорошей электропроводностью на керамике. Имеются сведения о применении фторсодержащих меркаптанов в виде защитных пленок, предохраняющих металлы от атмосферной коррозии. Металлические соли некоторых аминомеркантаносоединений применяются в качестве, медицинских препаратов. [c.29]
Из них наиболее распространены соли ртути, меди, серебра, висмута, олова и свинца. Соли свинца, например, издавна используются в зарубежной практике для очистки бензинов от меркаптанов ( докторские растворы ). Меркаптиды серебра могут быть использованы для получения серебряных поверхностей с хорошей электропроводностью на керамике. Имеются сведения о применении фторсодержащих меркаптанов в виде защитных пленок, предохраняющих металлы от атмосферной коррозии. Металлические соли некоторых аминомеркантаносоединений применяются в качестве, медицинских препаратов. [c.29]
Электропроводность рения в 4,5 раза выше, чем у ртути, и при обучных температурах в 4 раза меньше, чем у вольфрама (при 2500 °С—в 1,6 раза меньше). Металл этот пригоден для изготовления нитей электроламп, более прочных и долговечных, чем обычные вольфрамовые. Рений является также хорошим катализатором некоторых органических реакций. В виде сплава с платиной он применяется для изготовления термоэлементов.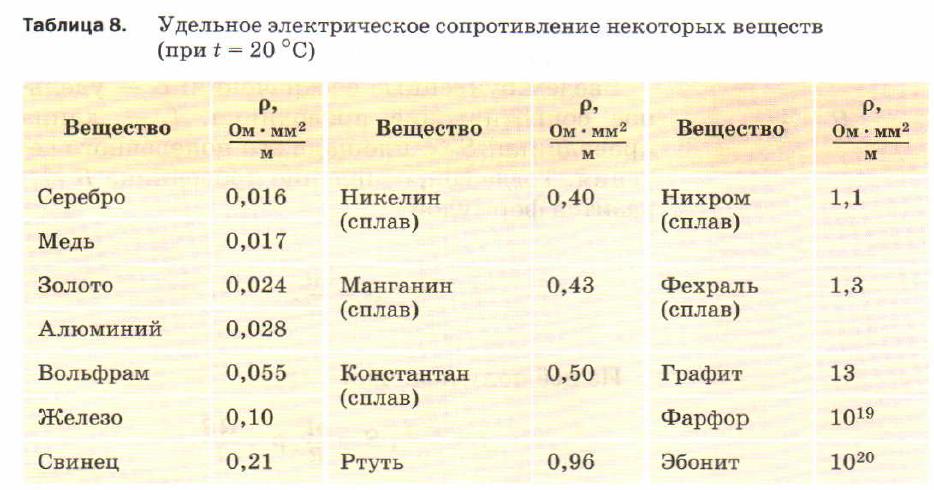 [c.301]
[c.301]
В кристаллическом состоянии кремний хорощо проводит тепло. Его электропройодность составляет 0,007 (для обычного) —0,000001 (для особо чистого) от электропроводности ртути, причем при нагревании она не понижается (как то характерно для металлов), а повышается. Повышается она и с увеличением давления, а при 120 тыс. ат кремний приобретает свойства металла. Теплота плавления кремния равна II, теплота атомизации — 108 ккал1г-атом. [c.587]
Плотность, г/см Твердость по шкале Моося Тпл, К КИП к Электропроводность (293 К) (здесь и далее относительнв ртути) 0,5 0,6 453 1613 11,2 1,8 4 1558 2743 15,1 [c.401]
Если в качестве критерия ирименягь электропроводность водных растворов, сильными электролитами оказываются почти все соли, щелочи и сильные кислоты. Слабые кислоты и основания, а также некоторые соли [хлорид ртути (II), бромид кадмия и др.] представляют собой слабые электролиты. При изменении раство- [c. 27]
27]
Электропроводность — ртуть — Большая Энциклопедия Нефти и Газа, статья, страница 2
Электропроводность — ртуть
Cтраница 2
В отличие от алмаза графит является хорошим проводником тепла и электрического тока, сравнимым с металлами. Монокристаллы графита имеют электропроводность, вдвое превышающую электропроводность ртути. [16]
Литий — весьма пластичный металл с очень высоким значением удлинения, легко обрабатывается прокаткой, волочением, ковкой, штамповкой и вытяжкой. Удельная электропроводность лития составляет приблизительно Vs электропроводности серебра и в 11 раз выше электропроводности ртути. [17]
В кристаллическом состоянии кремний хорошо проводит тепло. Его электропроводность составляет 0 007 ( для обычного) — 0 000001 ( для особо чистого) от электропроводности ртути, причем при нагревании она не понижается ( как то характерно для металлов), а повышается.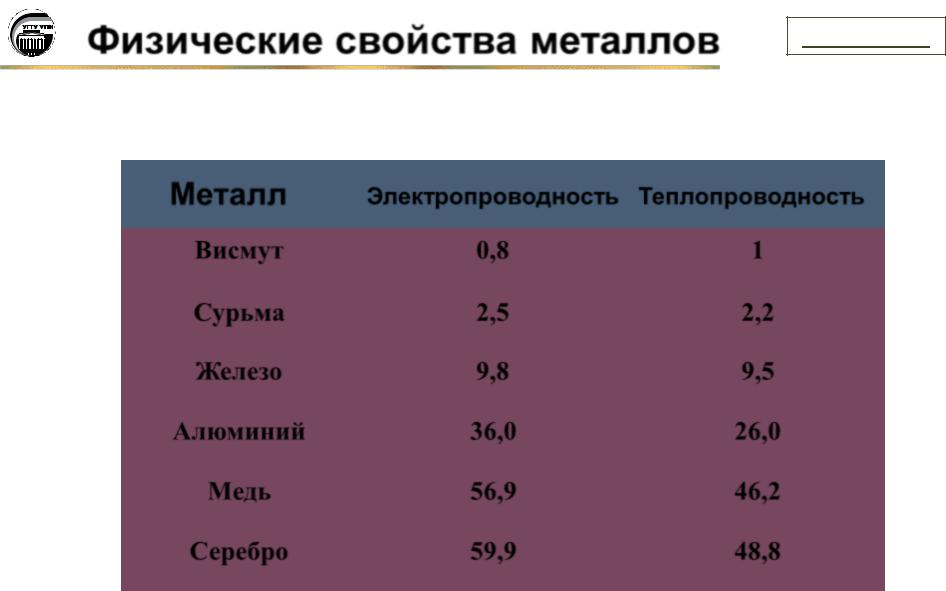 Повышается она и с увеличением давления. Теплота плавления кремния равна 11, теплота атомизации-108 ккал / г-атом. Резко ( в 29 раз) возрастает при плавлении и электропроводность кремния.
[18]
Повышается она и с увеличением давления. Теплота плавления кремния равна 11, теплота атомизации-108 ккал / г-атом. Резко ( в 29 раз) возрастает при плавлении и электропроводность кремния.
[18]
В кристаллическом состоянии кремний хорошо проводит тепло. Его электропроводность составляет 0 007 ( для обычного) — 0 000001 ( для особо чистого) от электропроводности ртути, причем при нагревании она не понижается ( как то характерно для металлов), а повышается. Повышается она и с увеличением давления, а при 120 тыс. ат кремний приобретает свойства металла. Теплота плавления кремния равна 11, теплота атомизации-108 ккал / г-атом. Резко ( в 20 раз) возрастает при плавлении и электропроводность кремния. [19]
Яков Ильич стремился развить в своих учениках способность критически относиться к теориям, в том числе и общепринятым, вошедшим в учебники. Хорошо помню его замечания в адрес зонной теории металлов, в том числе и замечание о том, что электропроводность ртути меняется всего на 30 % при переходе из твердого состояния в жидкое, где никаких зон нет. Любую теорию Яков Ильич склонен был считать скорее карикатурой, чем портретом действительности.
[20]
Любую теорию Яков Ильич склонен был считать скорее карикатурой, чем портретом действительности.
[20]
Ртуть представляет собой серебристо-белый жидкий металл. Удельная электропроводность ртути при 0 С равна 58 % электропроводности серебра. Электропроводность ртути является стандартной единицей сопротивления — столбик ртути сечением в 1 мм2 и длиной в 106 3 — см. оказывает сопротивление в 1 ом. Молекулы ртути в парах моноатомны. [21]
Ртуть, как и цезий, обладает низкой критической температурой. Изохоры а приведены на рис. 2.12. Для этого плотность была определена экстраполяцией экспериментальных р-р — Т — данных, полученных при более высоких плотностях. На рис. 2.12 видно, что электропроводность ртути при постоянной плотности растет с температурой, если плотность не достигает критической р рс. С увеличением плотности наклон кривых уменьшается, указывая на то, что уменьшается энергетическая щель АЕ. [23]
[23]
К тому же электропроводность нового материала близка к электропроводности ртути. Это дало основания говорить о том, что получен полимер с металлическими свойствами. Правда, здесь, видимо, уместно напомнить, что ртуть проводит электрический ток хуже всех металлов. [24]
Еще в конце прошлого столетия изобретательская мысль часто обращалась к различным вариантам электролизеров с вертикальным катодом. В этом случае не возникает опасности оголения стальной основы катода и интенсивного выделения водорода. Однако электролизеры со струйчатыми катодами имеют два существенных недостатка. Один из них связан с относительно небольшой электропроводностью ртути, другой обусловлен тем, что ртутная струя на относительно небольшой высоте разрывается на капли. [25]
Германий имеет серовато-белый, олово — серебристо-белый, а свинец — синевато-белый цвет. Твердость и хрупкость металлов в ряду Ge-Sn-Pb заметно уменьшается: германий тверд и хрупок, свинец царапается ногтем и прокатывается в листы. Олово по пластичности занимает промежуточное положение между германием и свинцом. Электропроводность германия составляет 0 001 электропроводности ртути, у олова она в 8 раз больше, чем у ртути, а у свинца — в 5 раз. Плотность рассматриваемых металлов возрастает от германия к свинцу. Кроме обыкновенного белого олова — [ 3-форма с плотностью 7 3 г / см3, существует серое олово с плотностью 5 75 г / см3, называемое а-формой.
[27]
Твердость и хрупкость металлов в ряду Ge-Sn-Pb заметно уменьшается: германий тверд и хрупок, свинец царапается ногтем и прокатывается в листы. Олово по пластичности занимает промежуточное положение между германием и свинцом. Электропроводность германия составляет 0 001 электропроводности ртути, у олова она в 8 раз больше, чем у ртути, а у свинца — в 5 раз. Плотность рассматриваемых металлов возрастает от германия к свинцу. Кроме обыкновенного белого олова — [ 3-форма с плотностью 7 3 г / см3, существует серое олово с плотностью 5 75 г / см3, называемое а-формой.
[27]
Германий имеет серовато-исльш, олово — ссребристо-белын, а свинец — синевато-белый цвет. Твердость и хрупкость металлов в ряду Ge-Sn-Pb заметно уменьшается: германий тверд и хрупок, свинец царапается ногтем и прокатывается в листы. Олово по пластичности занимает промежуточное положение между германием и свинцом. Электропроводность германия составляет 0 001 электропроводности ртути, у олова она в 8 раз больше, чем у ртути, а у свинца — в 5 раз. Плотность рассматриваемых металлов возрастает от германия к свинцу. Кроме обыкновенного белого олова — 5-форма с плотностью 7 3 г / сы3, существует серое олово с плотностью 5 75 г / см3, называемое а-формой.
[29]
Плотность рассматриваемых металлов возрастает от германия к свинцу. Кроме обыкновенного белого олова — 5-форма с плотностью 7 3 г / сы3, существует серое олово с плотностью 5 75 г / см3, называемое а-формой.
[29]
Страницы: 1 2
Milli-Q IQ
Полностью интегрируемая система очистки воды Milli-Q® IQ 7003/7005/7010/7015 — это идеальное решение для лабораторной воды, обеспечивающее воду высшего качества типа 1 и 2 непосредственно из водопроводной воды.Благодаря технологии Elix® EDI, интуитивно понятным сенсорным экранам, диспенсерам Q-POD® и E-POD® и УФ-лампам без содержания ртути система превзойдет ваши самые высокие требования — от повышения производительности до снижения воздействия на окружающую среду.
Milli-Q® IQ 7003/05/10/15 обеспечивает неизменно высококачественную воду типа 1 и 2 непосредственно из водопроводной воды.
Очистка до следовых уровней достигается с помощью мощных и запатентованных очищающих сред, в том числе высокоэффективных очистительных картриджей IPAK® и технологии электродеионизации Elix® (EDI).
Модернизированное решение для хранения с 3 вариантами баков (25/50/100 л) защищает качество хранящейся воды лучше, чем когда-либо прежде, с функциями, которые снижают застой и риск бактериального загрязнения.
Высокоточный мониторинг качества удобно отображается на большом цифровом сенсорном экране диспенсера POD.
Благодаря широкому выбору конечных фильтров на каждом из 4 дозирующих устройств POD, вода может быть адаптирована к каждому потребителю
Характеристики сверхчистой воды Тип 1 (из устройства Q-POD®)| Удельное сопротивление при 25°C | 18.2 MОм·cм |
| Удельная электропроводность при 25°C |
0. 055 мкСм/см 055 мкСм/см
|
| ТОС (Общий органический углерод) | ≤2 ppb (мкг/л)3; обычно ≤5 ppb |
| Частицы | Нет частиц размером >0.22 мкм |
| Бактерии | <0.01 КОЕ/мл |
| Пирогены (эндотоксины) | <0.001 ЕЭ/мл |
| РНКазы | <1 пг/мл |
| ДНКазы | <5 пг/мл |
| Протеазы | <0.15 мкг/мл |
| Производительность | до 2 л/мин |
Характеристики чистой воды Тип 2
| Удельное сопротивление при 25°C | >5 MОм·cм; обычно 10–15 MОм·cм |
| Удельная электропроводность при 25°C |
0. 2 мкСм/см; обычно 0.1 мкСм/см 2 мкСм/см; обычно 0.1 мкСм/см
|
| ТОС (Общий органический углерод) | ≤30 мкг/л (ppb) |
| Скорость |
3 л/ч (Milli-Q® IQ 7003) 5 л/ч (Milli-Q® IQ 7005) 10 л/ч (Milli-Q® IQ 7010) 15 л/ч (Milli-Q® IQ 7015) |
Ключевые особенности:
• Интуитивно понятные диспенсеры ультрачистой и чистой воды Q-POD® E-POD®
• Новое решение для хранения чистой воды
• УФ-лампы без ртути
• Компактная конструкция
• Универсальные варианты установки
Технические характеристики
| Производящий блок | 7003 | 7005 | 7010 | 7015 |
| Габаритные размеры, ШхГхВ, мм | 315 x 380 x 498 | 315 x 380 x 498 | 375 x 380 x 498 | 375 x 380 x 498 |
| Вес в сухом состоянии | 21 кг | 21 кг | 23,7 кг | 24 кг |
| Резервуар-накопитель | 25 л | 50 л | 100 л |
| Габаритные размеры, ШхГхВ, мм | 400 x 415 x 503 | 400 x 415 x 706 | 400 x 415 x 1118 |
| Вес в сухом состоянии | 6,7 кг | 7,6 кг | 10,9 кг |
youtube.com/embed/i8V1Pm8Un0Q?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»>
Серебро, Медь, Алюминий, Железо, Золото, Никель, Вольфрам, Ртуть.
Автор: Серков Павел- 1. Проводники: Серебро, Медь, Алюминий, Железо, Золото, Никель, Вольфрам, Ртуть.
- 2. Проводники: Углерод, нихромы, термостабильные сплавы, припои, прозрачные проводники.
- 3. Неорганические диэлектрики: Фарфор, стекло, слюда, керамики, асбест, элегаз и вода
- 4. Органические полусинтетические диэлектрики.
- 5. Синтетические диэлектрики на базе фенолформальдегидных смол.
- 6. Пластики. История использования пластиков.
- 7. Изоляционные ленты и трубки
Проводники
Двадцатый век — век пластмасс. До появления широкого спектра синтетических полимерных материалов, человек использовал в конструировании металлы и материалы природного происхождения — дерево, кожу и т. д. Сегодня мы завалены пластмассовыми изделиями, начиная от одноразовой посуды, заканчивая тяжелонагруженными деталями двигателей автомобилей. Пластмассы во многом превосходят металлы, но никогда не вытеснят их полностью, поэтому рассказ начнется с металлов. Металлам посвящены сотни книг, дисциплина, посвященная им, называется «металловедение».
д. Сегодня мы завалены пластмассовыми изделиями, начиная от одноразовой посуды, заканчивая тяжелонагруженными деталями двигателей автомобилей. Пластмассы во многом превосходят металлы, но никогда не вытеснят их полностью, поэтому рассказ начнется с металлов. Металлам посвящены сотни книг, дисциплина, посвященная им, называется «металловедение».
Нас интересуют металлы с точки зрения электронной техники. Как проводники, как часть электронных приборов. Все остальные применения — например такие, как конструкционные материалы, в данное пособие пока не вошли.
Главное для электронной техники свойство металлов — это способность хорошо проводить электрический ток. Посмотрим на таблицу удельного сопротивления различных чистых металлов:
| Металл | Удельное сопротивление Ом*мм2/м |
| Серебро | 0,0159 |
| Медь | 0,0157 |
| Золото | 0,023 |
| Алюминий | 0,0244 |
| Иридий | 0,0474 |
| Вольфрам | 0,053 |
| Молибден | 0,054 |
| Цинк | 0,059 |
| Никель | 0,087 |
| Железо | 0,098 |
| Платина | 0,107 |
| Олово | 0,12 |
| Свинец | 0,192 |
| Титан | 0,417 |
| Висмут | 1,2 |
Видим лидеров нашего списка: Ag, Cu, Au, Al.
Серебро
Ag — Серебро. Драгоценный металл. {Понятие «драгоценный металл» означает в том числе особые условия по работе с металлом, устанавливаемые законодательством.}Серебро — самый дешевый из драгоценных металлов, но, тем не менее, слишком дорог, чтобы массово делать из него провода. На 5% лучшая электропроводность по сравнению смедью, при разнице в цене почти в 100 раз.
Примеры применения
В виде покрытий проводников в СВЧ технике. Ток высокой частоты, из-за скин-эффекта в большей части течет по поверхности проводника, а не в его толще, поэтому тонкое покрытие высокочастотного волновода серебром дает бОльший прирост проводимости, чем покрытие серебром проводника для постоянного тока.
Волновод для СВЧ излучения, покрытый изнутри слоем серебра.
В сплавах контактных групп. Контакты силовых, сигнальных реле, рубильников, выключателей чаще всего изготовлены из сплава с содержанием серебра. Переходное сопротивление такого контакта получается ниже медного, он меньше подвержен окислению. Так как контакт обычно миниатюрен, вклад этой малой добавки серебра в стоимость всего изделия незначителен. Хотя при утилизации большого количества реле, стоимость серебра делает целесообразным работу по отделению контактов в кучку для последующего аффинажа.
Переходное сопротивление такого контакта получается ниже медного, он меньше подвержен окислению. Так как контакт обычно миниатюрен, вклад этой малой добавки серебра в стоимость всего изделия незначителен. Хотя при утилизации большого количества реле, стоимость серебра делает целесообразным работу по отделению контактов в кучку для последующего аффинажа.
Согласно документации производителя контакты содержат серебро и кадмий.
Различные реле. Верхнее реле имеет даже посеребренный корпус с характерной патиной. Содержание драгметаллов в изделиях, выпущенных в СССР было указано в паспортах на изделия.
В качестве присадки в припоях. Качественные припои (как твёрдые так и мягкие) часто содержат серебро.
Проводящие покрытия на диэлектриках. Например, для получения контактной площадки на керамике, на неё наносится суспензия из серебряных частиц с последующим запеканием в печи (метод «вжигания»).
Компонент электропроводящих клеев и красок. Электропроводящие чернила часто содержат суспензию серебряных частиц. По мере высыхания таких чернил, растворитель испаряется, частицы в растворе оказываются всё ближе, слипаясь и создавая проводящие мостики, по которым может протекать ток. Хорошее видео с рецептом по созданию таких чернил.
Электропроводящие чернила часто содержат суспензию серебряных частиц. По мере высыхания таких чернил, растворитель испаряется, частицы в растворе оказываются всё ближе, слипаясь и создавая проводящие мостики, по которым может протекать ток. Хорошее видео с рецептом по созданию таких чернил.
Недостатки
Несмотря на то, что серебро благородный металл, оно окисляется в среде с содержанием серы:
4Ag,+,2H2S,+,O2,->,2Ag2S,+,2H2O
Образуется темный налет — «патина». Также источником серы может служить резина, поэтому провод в резиновой изоляции и посеребренные контакты — плохое сочетание.
Потемневшее серебро можно очистить химически. В отличии от чистки абразивными пастами (в том числе зубной пастой) это самый нежный способ чистки, не оставляющий царапин.
Медь
Cu — медь. Основной металл проводников тока. Обмотки электродвигателей, провода в изоляции, шины, гибкие проводники — чаще всего это именно медь.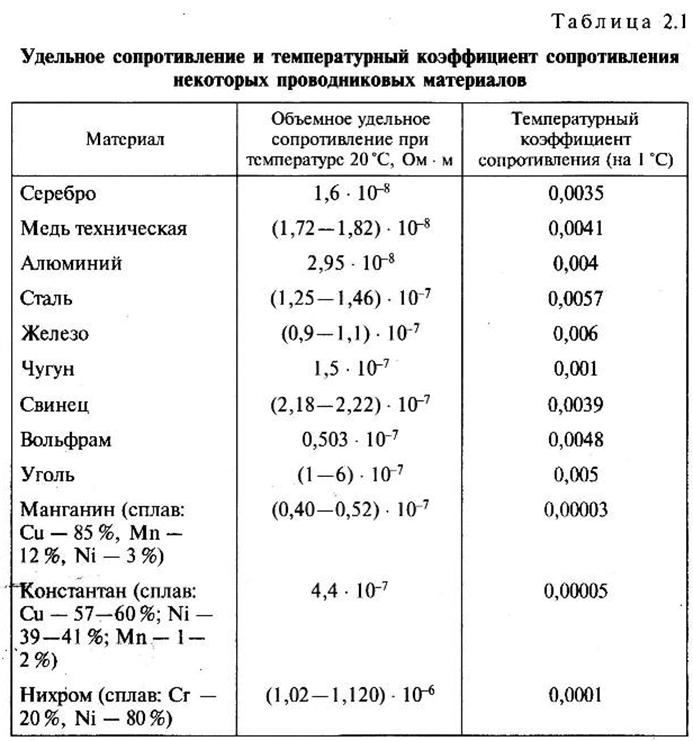 Медь нетрудно узнать по характерному красноватому цвету. Медь достаточно устойчива к коррозии.
Медь нетрудно узнать по характерному красноватому цвету. Медь достаточно устойчива к коррозии.
Примеры применения
Провода. Основное применение меди в чистом виде. Любые добавки снижают электропроводность, поэтому сердцевина проводов обычно чистейшая медь.
Гибкие многожильные провода различного сечения.
Гибкие тоководы. Если проводники для стационарных устройств можно в принципе изготовить из любого металла, то гибкие проводники делают почти всегда только из меди, алюминий для этих целей слишком ломкий. Содержат множество тоненьких медных жилок.
Теплоотводы. Медь не только на 56\% лучше алюминия проводит ток, но ещё имеет почти вдвое лучшую теплопроводность. Из меди изготавливают тепловые трубки, радиаторы, теплораспределяющие пластины. Так как медь дороже алюминия, часто радиаторы делают составными, сердцевина из меди, а остальная часть из более дешевого алюминия.
Радиаторы охлаждения процессора. Центральный стержень изготовлен из меди,он хорошо отводит тепло от кристалла процессора, а алюминиевый радиатор сразвитым оребрением уже охлаждает сам стержень.
Центральный стержень изготовлен из меди,он хорошо отводит тепло от кристалла процессора, а алюминиевый радиатор сразвитым оребрением уже охлаждает сам стержень.
При изготовлении фольгированных печатных плат. Печатные платы, в любом электронном устройстве изготовлены из пластины диэлектрика, на который наклеена медная фольга. Все соединения между элементами печатной платы выполнены дорожками из медной фольги.
Техника сверхвысокого вакуума. Из металлов и сплавов только нержавеющая сталь и медь пригодны для камер сверхвысокого вакуума в таких приборах, как ускорители элементарных частиц или рентгеновские спектрометры. Все остальные металлы в вакууме слегка испаряются и портят вакуум.
Аноды рентгеновских трубок. В рентгеноструктурном анализе требуется монохроматическое рентгеновское излучение. Его источником зачастую является облучаемая электронами медь (спектральная линия Cu Kα), которая к тому же прекрасно отводит тепло. Если же требуется другое излучение (Co или Fe), его получают от маленького кусочка соответствующего металла на массивном медном теплоотводе. Такие аноды всегда охлаждаются проточной водой.
Если же требуется другое излучение (Co или Fe), его получают от маленького кусочка соответствующего металла на массивном медном теплоотводе. Такие аноды всегда охлаждаются проточной водой.
Интересные факты о меди
Алюминий
Al — Алюминий. «Крылатый металл» четвертый по проводимости после серебра, золота и меди. Алюминий хоть и проводит ток почти в полтора раза хуже меди, но он легче в 3,4 раза и в три раза дешевле. А если посчитать проводимость, то эквивалентный медному проводник из алюминия будет дешевле в 6,5 раз! Алюминий бы вытеснил медь как проводник везде, если бы не пара его противных свойств, но об этом в недостатках.
Чистый алюминий, как и чистое железо, в технике практически не применяется. Любой «алюминиевый» предмет состоит из какого-нибудь сплава алюминия. Сплавы могут содержать кремний, магний, медь, цинк и другие металлы. Их свойства отличаются очень сильно, и это необходимо учитывать при обработке. Ниже перечислены несколько самых распространенных марок алюминия: (Даны марки сплавов согласно номенклатуре Американской Алюминиевой Ассоциации (АА), Первая цифра — серия марок сплава, в зависимости от того, какой легирующей добавки больше, остальные цифры обычно не соотносятся с концентрацией и необходимо обращение к справочнику. )
)
- 1199. Чистый 99,99% алюминий. Бывает почти исключительно в виде фольги.
- 1050 и 1060. Чистый алюминий 99,5% и 99,6% соответственно. Из-за высокой теплопроводности иногда используется как материал для радиаторов. Мягок, легко гнется. Провода, пищевая фольга, посуда.
- 6061 и 6082. Сплавы: 6061: Si 0,6%, Mg 1,0%, Cu 0,28%, 6082: Si, Mg, Mn. Первый более распространен в США, второй — в Европе. Легко точить, фрезеровать. Наилучший материал для самоделок. Прочен. Легко поддается сварке, паяется твердыми припоями. Легко анодируется. Плохо гнется. Не годится для литья.
- 6060. Состав: Mg, Si. Более мягок, чем 6061 и 6082, при обработке резанием слегка «пластилиновый», за что его не любят токари. Распространен и дешев, других особых преимуществ не имеет. Дешевый алюминиевый профиль из непонятного сплава имеет хорошие шансы оказаться им.
- 5083. Сплав с магнием (>4% Mg). Отличная коррозионная стойкость, устойчив в морской воде.
 Один из лучших вариантов для деталей, работающих под дождем. Тоже может встретиться в магазине стройматериалов, наряду с другими подобными марками.
Один из лучших вариантов для деталей, работающих под дождем. Тоже может встретиться в магазине стройматериалов, наряду с другими подобными марками. - 44400, он же «силумин». Сплав с большим процентом кремния (Si >8%). Литейный. Низкая температура плавления, при пайке твердыми припоями риск расплавить саму деталь. Хрупок, при изгибе ломается. На изломе видны характерные кристаллы.
- 7075. 2,1–2,9% Mg, 5,1–6,1% Zn, 1,2–1,6% Cu. Очень своеобразный сплав, отличается даже цветом (пленка окислов слегка золотистая). Неожиданно твердый для алюминия, по твердости сравним с мягкой сталью. Плохо анодируется. Не паяется вообще. Не предназначен для сварки. Не гнется и не куется вообще. Не годится для литья. Резанием обрабатывается отлично, прекрасно полируется. Хорош для ответственных деталей. Используется для винтов в велосипедах, в оружии (материал многих деталей винтовки M16).
Относительно невысокая температура плавления (660°С у чистого, меньше 600°С у литейных сплавов) алюминия делает возможным отливку деталей в песочные формы в условиях гаража/мастерской. Однако многие марки алюминия не годятся для литья.
Однако многие марки алюминия не годятся для литья.
Примеры применения
Провода. Алюминий дешев, поэтому толстые силовые кабели, СИП, ЛЭП выгодно делать из алюминия. В старых домах квартирная проводка сделана алюминиевым проводом (с 2001 года ПУЭ запрещает в квартирах использовать алюминиевый провод, только медный, см ниже. (Правила устройства электроустановок, 7-е издание, п. 7.1.34). Также алюминий не используется как проводник в ответственных применениях.
Слева старый алюминиевый провод. Справа алюминиевые кабели различного сечения, пригодные для укладки в грунт. В частности, кабелем справа был подключен к электроэнергии целый этаж здания. Кабель помимо наружной резиновой оболочки имеет бронирующую стальную ленту для защиты нижележащей изоляции от повреждений, к примеру, лопатой при раскопке.
Теплоотводы. Не только домашние батареи делают из алюминия, но и радиаторы у микросхем, процессоров.
Различные алюминиевые радиаторы.
Корпуса приборов. Корпус жёсткого диска в вашем компьютере отлит из алюминиевого сплава. Небольшая добавка кремния улучшает прочностные качества алюминия, сплав силумин: это корпуса жёстких дисков, бытовых приборов, редукторов и т. д. Анодированный алюминий (алюминий, у которого электрохимическим путем окисная
пленка на поверхности сделана потолще и прочнее) хорошо окрашивается и просто красив. Окисная пленка (Al2O3 — из того же вещества состоят драгоценные
камни рубины и сапфиры) достаточно твёрдая и износостойкая, но, к сожалению, алюминий под ней мягок, и при сильном воздействии ломается как лёд на воде.
Экраны. Электромагнитное экранирование часто делается из алюминиевой фольги или тонкой алюминиевой жести. Можете провести простой эксперимент, мобильный телефон завернутый в фольгу потеряет сеть — он будет заэкранирован.
Отражающее покрытие у зеркал. Тонкая пленка алюминия на стекле отражает 89% (значения примерные, точное значение зависит от длины волны и типа покрытия) падающего света (Серебро 98%, но на воздухе темнеет из-за сернистых соединений). Любой лазерный принтер содержит вращающееся зеркало, покрытое тонким слоем алюминия.
Зеркала от оптической системы планшетного сканера. Обратите внимание, оптические зеркала имеют металлизацию стекла снаружи, в отличии от привычных бытовых зеркал, где отражающее покрытие для защиты за стеклом. Бытовые зеркала дают двойное отражение — от поверхности стекла и от отражающего покрытия, что не так критично в быту, как защищенность отражающего покрытия.
Электроды обкладок конденсаторов. Алюминиевая фольга, разделенная слоем диэлектрика и туго свернутая в цилиндр — часть электрических конденсаторов (впрочем, для уменьшения габаритов конденсаторов фольгу заменяют алюминиевым напылением). Тот факт, что пленка оксида алюминия тонкая, прочная и не проводит ток, используется
в электролитических конденсаторах, обладающими огромными для своих габаритов электрическими емкостями.
Микропровод. Тончайшей проволокой из алюминия подключают кристаллы микросхемы к выводам корпуса. Также может использоваться медная и золотая проволока.
Недостатки
Алюминий — металл активный, но на воздухе покрывается оксидной пленкой, которая предохраняет металл от разрушения и скрывает его активную натуру. Если не дать алюминию формировать стабильную защитную пленку, например капелькой ртути, алюминий активно реагирует с водой. В щелочной среде алюминий растворяется, попробуйте залить алюминиевую фольгу средством для прочистки труб — реакция будет бурная, с выделением взрывоопасного водорода. Химическая активность алюминия, в паре с большой
разницей в электроотрицательности с медью делает невозможным прямое соединение проводов из этих двух металлов. В присутствии влаги (а она в воздухе есть почти всегда)
начинает протекать гальваническая коррозия с разрушением алюминия.
Два идентичных трансформатора от микроволновых печей. Левый вышел из строя по причине алюминиевых обмоток — отгорел провод от контакта — алюминий плохо паяется мягкими припоями, попытка обеспечить контакт также как и у медного провода привела к поломке.
Алюминий ползуч. Если алюминиевый провод очень сильно сжать, он деформируется и сохранит новую форму — это называется «пластическая деформация». Если сжать его
не так сильно, чтобы он не деформировался, но оставить под нагрузкой надолго — алюминий начнет «ползти» меняя форму постепенно. Это пакостное свойство ведет к тому, что хорошо затянутая клемма с алюминиевым проводом спустя 5–10–20 лет постепенно ослабнет и будет болтаться, не обеспечивая былого электрического контакта. Это одна из причин, почему ПУЭ запрещает тонкий алюминиевый провод для разводки электроэнергии по конечным потребителям в зданиях. (См п. 7.1.34 ПУЭ 7 издания) В промышленности не сложно обеспечить регламент — так называемая «протяжка» щитка, когда электрик периодически (1–2 раза в год) проверяет затяжку всех клемм в щитке. В домашних же условиях, обычно пока розетка с дымом не сгорит — никто и не озаботится качеством контакта. А плохой контакт — причина пожаров.
Алюминий, по сравнению с медью, менее пластичный, риска от ножа на жиле, при сьёме изоляции с провода быстрее приведет к сломавшейся жиле, чем у меди, поэтому изоляцию с алюминиевых проводов надо счищать как с карандаша, под углом, а не в торец.
Интересные факты об алюминии
Еще раз важное замечание. Алюминиевые и медные проводники напрямую соединять нельзя!
Для соединения проводников из меди и алюминия используйте промежуточный металл,
например, стальную клемму.
Источники
В крупных строительных магазинах (OBI, Leroy Merlin, Castorama) обычно есть в наличии алюминиевый профиль разных размеров и форм. Неплохим источником может послужить штампованная алюминиевая посуда — она очень дешева и существует разных форм. Но обратите внимание на марки. Если нужен 6061 и тем более 7075, придется покупать его у фирмы, специализирующейся на продажах металлов.
Железо
Fe — железо. Основной конструкционный материал в промышленности используется также и в электротехнике. Плохая, по сравнению с медью, электропроводность компенсируется очень низкой ценой. И, что важнее в России, меньшей привлекательностью для охотников за металлом, заземление из толстой ржавой трубы простоит без охраны дольше красивой медной шины.
В технике железо применяется почти исключительно в виде сплавов с углеродом — чугуна и сталей. Свойства сталей разных марок весьма различны: от мягких до твердых инструментальных.
Примеры применения
Метизы. Винты, шайбы, гайки из стали изготавливаются огромными количествами на специально разработанном для этого оборудовании. Метизы из других металлов встречаются очень редко и значительно дороже. Поэтому, в большинстве случаев, медный наконечник медного провода будет притянут к медной же шине стальным болтом (или омеднённым). Также важным является высокая прочность стали, медный болт не затянуть с усилием стального. Обратите внимание на цифры на головке болта: они обозначают его прочность. Чем больше число, тем сильнее можно затягивать болт.
Клеммные колодки, соединители. Соединители типа «орех» содержат стальные пластинки с защитным покрытием от коррозии. Также, применение стали необходимо для предотвращения гальванической коррозии при соединении медных и алюминиевых проводов.
Соединитель «орех». Внутри пластиковой оболочки комплект стальных пластин с винтами, позволяет сделать ответвление от жилы кабеля не разрезая саму жилу. Также позволяет перейти от алюминиевой жилы на медную.
Контуры заземления. Требования электробезопасности обязывают предусматривать заземление. Часто, в промышленных условиях, заземляющую шину изготавливают из стального проката, закрепленного по периметру стены. Плохая электропроводность стали компенсируется большим сечением проводника. Во многих случаях правила безопасности и стандарты предписывают делать детали заземления именно из стали по соображениям механической прочности.
Стальная полоса, огибающая колонну — шина заземления.
Широко используются магнитные свойства стали — из стальных пластин собирают сердечники трансформаторов, дросселей.
Недостатки
Коррозия. Железо ржавеет, при этом плотность ржавчины ниже плотности исходного железа, из-за этого конструкция распухает. Поэтому железо покрывают защитными покрытиями — оцинковка, лужение, хромирование, окраска и т.д. Разные марки стали подвержены коррозии в разной степени, причем по закону подлости сильнее всего ржавеют именно те, которые легче всего обрабатываются на станках.
Золото
Au — Золото. Самый бестолковый драгоценный металл. Имеет меньше всего применений в технике из всех драгоценных металлов, но является символом богатства. На удивление дороже платины (2017 г.), что лишено здравого смысла и является лишь результатом спекуляций.
Примеры применения
Покрытия контактов. Благодаря тому, что золото на воздухе не окисляется, контакты покрывают очень тонким слоем золота. В силу мягкости золота покрытие не подходит для контактов много работающих на истирание, в таких случаях подбирают более твердые покрытия (например родиевые), или легируют золото.
Золотое покрытие на различных электронных компонентах: покрытие на контактах платы для установки в слот, покрытие на контактах мембранных кнопок мобильного телефона, покрытие на штырьках процессора.
Защита от коррозии. В некоторых ответственных применениях используется золотое покрытие для защиты проводников от коррозии (в основном — военка). Когда-то покрытие золотом являлось единственным способом защитить детали электроники от коррозии в условиях джунглей, поэтому у многих старых радиодеталей позолочены даже корпуса. А сейчас обычно просто заливают плату компаундом в «кирпич».
Интересные факты о золоте
Золото — один из четырех металлов, имеющий оттенок в не окислившемся состоянии. Все остальные металлы белые (желтоватый цвет имеют золото и цезий,
медь — красноватая и в сплавах золотистая, осмий имеет голубой отлив).
Плотность золота отличается от плотности вольфрама незначительно (19,32 г/см3} у золота, 19,25 г/см3), этим пользуются для подделки золотых слитков, покрывая вольфрамовый слиток слоем золота. Некоторые теории заговора утверждают, что возможно это одна из причин, почему США никому не дают проверить подлинность их золотого
запаса. И, возможно, поэтому они отдали Германии их золото не сразу.
Можно извлечь золото химически из горы старой электроники, но это не всегда экономически целесообразно и преследуется по закону (ст. 191, 192 УК РФ).
Бестолковость золота требует пояснений. Представим добычу благородных металлов в 2016 году.
Из всей добытой платины 64% потребила промышленность. (Здесь и далее цифры примерные, усредненные по нескольким источникам).
Из всего добытого серебра 68% потребила промышленность.
Из всего добытого палладия 96% потребила промышленность.
Из всего добытого золота всего 10% потребила промышленность. Остальное ушло на украшения и на слитки в сейфах.
Никель
Ni — Никель. Замечательный металл, но в электронной технике основное применение в виде покрытий, как в чистом виде, так и в паре с хромом.
Примеры применения
Покрытие контактов. Наносится на медь, пластик для надежного контакта и для декоративных целей. Жадные китайцы иногда вообще делают контакты из пластмассы, покрывая сверху слоем никеля и хрома, внешне выглядит нормальным, даже как то работает, но ни о какой надежности речи не идет.
Различные разъемы, покрытые никелем для надежного контакта.
У разъема справа для экономии металла сердцевина штыря сделана полой с заливкой пластиком. Латунная никелированная трубочка, из которой сделан штырь, не самый худший вариант.
Тоководы у ламп. Сплав Платинит (46% Ni, 0,15% C, остальное — Fe) не содержит платины, но имеет очень близкое к платине значение линейного
температурного расширения (и близкое к стеклу), что позволяет делать из него надежные электроды, проходящие через стекло. Для аналогичных целей используют сплав Ковар (29% Ni, 17% Co, 54% Fe). Такие электроды при изменении температуры не вызывают растрескивания стекла и потерю герметичности. Место сплавления стекла с этими сплавами имеет красноватый оттенок что ошибочно воспринимается за медь.
Промежуточные защитные слои. Для защиты от коррозии, взаимной диффузии металлов при создании покрытий, могут формироваться промежуточные слои из никеля. Например при покрытии меди слоем золота, если не предусмотрен разделительный слой из никеля, золотое покрытие со временем из-за диффузии растворится в меди и потеряет целостность. Жала современных паяльников защищены слоем никеля, так как жало из голой меди медленно растворяется в олове, теряя форму.
Вольфрам
W — Вольфрам. Тугоплавкий металл, температура плавления 3422°С, что определяет основное его использование — нити накала и электроды.
Примеры применения
Нити накала. В лампах накаливания, в галогеновых лампах спираль изготовлена из вольфрама, нагревается электрическим током до белого каления, при этом сохраняя свою форму. Также катоды в радиолампах изготавливаются из вольфрама, но раскаливаются не до таких высоких температур, как осветительные лампы, специальное покрытие на катоде позволяет протекать термоэлектронной эмиссии при невысоких температурах.
Нить накаливания этой галогеновой лампы изготовлена из вольфрама. Галоген, обычно пары иода, химически связывает испаряющийся с нити вольфрам и возвращает его на нить, что позволяет повысить температуру накала спирали и уменьшить габарит лампы без страха, что вольфрам постепенно осядет на стенках колбы.
Мощная лампа накаливания от проектора. Даже тугоплавкий вольфрам со временем испаряется и оседает на стенках колбы в виде темного налета. Данного недостатка лишены галогеновые лампы.
Электроды дуговых ламп и сварочные электроды. В ксеноновых дуговых лампах, ртутных дуговых лампах, электроды должны выдерживать температуру электрической
дуги, при этом не расплавляясь и не изменяя своей формы, что под силу только вольфраму. Также электроды для сварки неплавящимся электродом изготовлены из вольфрама (TIG сварка).
Аноды рентгеновских трубок. Поток электронов от катода в рентгеновской трубке, разогнанный высоким напряжением тормозится бомбардируя анод, очень сильно нагревая его, поэтому такие аноды, особенно если они не имеют водяного охлаждения, зачастую изготавливаются из вольфрама. Однако в физических лабораториях часто применяют и аноды из меди или кобальта в связи с особенностями спектра рентгеновского излучения от таких анодов.
Источники
Вольфрам — не очень пластичный материал, поэтому спиральку из лампы накаливания
вряд ли удастся выпрямить и использовать по своему разумению. Если вдруг понадобится
вольфрамовый стержень — вам пригодится любой магазин по сварочному делу, электрод для
TIG-горелки без содержания лантана и других присадок. Проволоку для нитей накала самодельной
техники нетрудно купить на eBay.
- Цветовая маркировка электродов:
- Зеленый — чистый вольфрам.
- Красный, оранжевый — вольфрам + торий. Радиоактивно! Не шлифовать, не резать — пыль опасна!
- Голубой — вольфрам + сложная смесь.
- Черный, желтый, синий — вольфрам + лантан.
- Серый — вольфрам + церий.
- Белый — вольфрам + цирконий.
Ртуть
Hg — Ртуть. При комнатной температуре — блестящий, собирающийся в шарики жидкий металл. По экологическим соображениям использование ртути сокращается, но она широко использовалась в старых приборах, поэтому заслуживает упоминания.
Как и большинство металлов, ртуть образует сплавы. Но ртуть, будучи жидкой при комнатной температуре, способна сплавляться с металлами без дополнительного нагревания, растворять их. Растворенный в ртути металл, сплав металла с ртутью называется «амальгама».
Примеры применения
Жидкий контакт в датчиках положения, ртутных электроконтактных термометрах.
Различные ртутные приборы. Слева — мощный ртутный переключатель, замыкающий/размыкающий цепь при наклоне. Ниже на чёрных платках — аналогичные китайские ртутные переключатели — датчики положения из детского набора с Arduino. Сверху — колба ртутного электроконтактного термометра. В стекло вплавлены проволочки так, что при температуре 70°С столбик ртути в капилляре замыкает цепь (температура указана на корпусе).
В термометрах. Низкая температура замерзания, высокая температура кипения и большой коэффициент теплового расширения делают ртуть одним из самых удобных веществ для лабораторных и медицинских термометров. В бытовых термометрах ртуть уже очень давно не используется.
В манометрах и барометрах. Ртуть тяжелая, поэтому для уравновешивания атмосферного давления достаточно 70–80 см высоты столбика ртути. Хотя ртутные барометры в основном вышли из употребления, единицы измерения давления «миллиметр ртутного столба», а в вакуумной технике — «микрон ртутного столба» и «торр» (округленный вариант мм. рт. ст.) используются и по сей день. Нормальным атмосферным давлением считается 760 мм. рт. ст.
В нормальных элементах. Батарейка (Попытка запитать от такой батарейки самоделку обернется провалом — батарейка имеет большое внутреннее сопротивление (порядка единиц кОм) и не предназначена отдавать токи больше сотых долей микроампера, да и то с перерывами.) с электродами из жидкой ртути, в которой растворены сульфаты ртути и кадмия, имеет ЭДС, известную и стабильную до единиц микровольт (теоретически 1,018636 В при 20°С). Такие элементы до сих пор используются в метрологии в качестве опорных источников напряжения, хотя и вытесняются полупроводниковыми схемами. Сосуд с ртутью в нормальном элементе запаян, однако он стеклянный, и ртути в нем много. Поэтому будьте осторожны, если найдете где-нибудь круглую железную банку с бакелитовой крышкой, клеммами и надписью «нормальный элемент» на бакелите. Внутри у нее — стеклянная колба с весьма опасными веществами.
Элемент нормальный насыщенный, НЭ-65, класс точности 0,005. Внешний вид корпуса нормальных элементов может различаться. Справа — содержимое корпуса, видна ртуть в нижней части колб. Такие элементы должны утилизироваться специализированной организацией.
Фото внутренностей Нормального Элемента
В диффузионных вакуумных насосах. Струя ртутного пара, выходящая из сопла с большой скоростью, захватывает молекулы воздуха и вытягивает их из откачиваемого объема. Затем ртутный пар конденсируется за счет охлаждения жидким азотом и используется снова. Насосы такого типа когда-то использовались для откачки радиоламп. Сейчас вместо ртути используются нетоксичные и не требующие жидкого азота силиконовые масла, но в некоторых лабораториях до сих пор можно найти старые ртутные системы.
Пары ртути — рабочий газ люминесцентных ламп. Несмотря на то, что люминесцентная лампа должна содержать небольшое количество ртути, в некоторых лампах ртути добавлено от души, и видно, как в колбе перекатывается шарик ртути. Пары ртути при возбуждении их электрическим током излучают яркий свет, преимущественно в синей и ультрафиолетовой области. Помимо них в спектре ртути есть яркие желтый и зеленый дублеты, по наличию которых ртутную лампу легко отличить от любой другой, посмотрев на нее через призму или отражение в компакт-диске. Специальная ртутная лампа в лабораториях используется как источник зеленого света с известной длиной волны.
В мощных тиратронах и ртутных выпрямителях. Используется так же, как и в ртутных лампах. Мощные ртутные вентили широко использовались для питания локомотивов на железных дорогах и в других подобных задачах до появления полупроводниковых приборов.
Как растворитель для металлов при выделении золота и платины из сырья амальгамацией и в производстве зеркал. Ртуть выпаривается, металл остается. Иногда этот процесс неправильно называют «аффинаж», путая его с совершенно другим способом очистки драгметаллов.
В ртутных счетчиках времени наработки. В старой технике ртутный капиллярный кулономер использовался как счетчик часов, которые проработал прибор. Гениальная по простоте и надёжности конструкция.
Ртутный счетчик времени наработки от осцилографа. В углу показан крупным планом разрыв столбика ртути в капилляре каплей электролита. Ртуть под действием тока растворяется на одном конце капли и восстанавливается на другом, в результате этот разрыв движется по капилляру на расстояние, пропорциональное пропущенному через капилляр количеству электричества. Благодарю Александра @Talion_amur за предоставленный образец.
В амальгамных зубных пломбах. Встречаются и по сей день, особенно в США.
Токсичность
Все изделия, содержащие ртуть, должны утилизироваться специализированной службой. Недопустимо выбрасывать их с бытовым мусором во избежание скопления ртути на свалке.
Все разливы ртути должны быть собраны, а поверхности демеркуризованы. Ртуть хорошо испаряется при комнатной температуре, поэтому закатившийся в щель шарик ртути долгое время будет отравлять воздух.
Демеркуризация:
Если у вас разбилось изделие с ртутью, то предпринимайте следующие действия:
1. Откройте форточки и обеспечьте проветривание.
2. Вызовите специализированную службу демеркуризации в вашем городе. Профессионалы не только грамотно уберут ртуть, но также и произведут замеры концентрации паров ртути в помещении.
Если вдруг в вашем городе не оказалось службы демеркуризации, вы находитесь вдали от цивилизации то процесс демеркуризации придется продолжить самостоятельно.
3. Соберите видимые шарики ртути в герметичную тару. Их удобно собирать вместе при помощи двух хорошо обрезанных листов бумаги, сливая шарики в подготовленную тару. Мельчайшие шарики ртути из щелей можно вытянуть при помощи спиринцовки, или щетки из металла, которые смачивает ртуть (например медь). Разумеется после использования такой «инструмент» окажется загрязнен ртутью и подлежит утилизации.
Затем при помощи химических средств оставшаяся, не видимая глазу ртуть переводится в нелетучие, но по прежнему ядовитые соли, которые спокойно можно удалить с поверхности моющими средствами. Для этого используются 0,2% водный раствор перманганата натрия («марганцовка») подкисленный добавлением 0,5% соляной кислоты или 20% раствор хлорного железа (того, которым платы травят). Вопреки указаниям в старых книгах, засыпание места разлива порошком серы не эффективно.
4. Тщательно промыть обработанные площади водой с моющим средством.
5. Всю собранную ртуть и загрязненные предметы герметично упаковать и сдать в специализированную организацию.
Что однозначно не стоит делать при разливе ртути:
1. Паниковать и спешить. Иногда, при небольших авариях больше вреда наносит паника и спешка, чем сама авария. Вспоминается байка, записанная Ю.А.Золотовым:
Однажды, когда профессор МГУ Алексей Николаевич Кост вел практикум по органической
химии, у одного из студентов разбилась колба с эфиром и его пары вспыхнули.
Началась паника, кто-то прибежал с углекислотным огнетушителем и с трудом погасил
пожар. Все это время Кост совершенно невозмутимо сидел за своим столом и с
кем-то разговаривал. Потом, когда все успокоились, подошел к месту происшествия и приказал:— Спички!
Ему дали коробок, он чиркнул спичкой и бросил ее в еще не просохшую эфирную
лужу. Огонь вспыхнул вновь, все оторопели. А Кост, не суетясь, взял противопожарное
одеяло, ловко накрыл им пламя и изрек:— Гореть надо умеючи!
2. Пытаться собрать ртуть пылесосом, пылесос только в турборежиме раздробит и испарит шарики ртути, в итоге все помещение и сам пылесос окажутся загрязнены ртутью. Аналогично не стоит использовать для сбора ртути веники, щетки — они только раскидывают и дробят шарики ртути.
3. Сливать ртуть в раковину или унитаз. Ртуть значительно тяжелее воды, поэтому навсегда осядет в первом попавшемся изгибе трубы — в гидрозатворе или колене.
Пара слов о токсикологии ртути.
Некоторые в детстве играли шариками ртути, и «с ними ничего не было». Действительно, вопреки распространенному мнению металлическая ртуть при кратковременном контакте малоопасна. Причина малой токсичности металлической ртути — в ее плохой биодоступности. Нерастворимая в воде и химически инертная, почти как благородные металлы, она не может быстро попасть в организм.
Опасно вдыхание паров ртути, и это практически единственный путь поступления ее в организм. Касание ртути пальцами никакой дополнительной опасности не добавляет. Более того, дажепроглатывание ртути обычно проходит без последствий для здоровья. Ртуть химически достаточно инертна и выходит из организма естественным путем. Поэтому она является причиной не острых отравлений, а вялотекущих хронических, проявляющихся в медленном постепенном ухудшении здоровья и не всегда вовремя диагностируемых врачами. Именно этим ртуть и коварна: маленький шарик, закатившийся под плинтус, будет годами испаряться и отравлять воздух в квартире, а жильцы не будут понимать, чем и почему они болеют. Порча здоровья от контакта со ртутью в течение нескольких дней может быть необратима.
Растворимые соединения ртути намного опаснее, и именно они образуются, когда ртуть так или иначе попадает в организм человека, животных или в растений. Рекорд по токсичности принадлежит диметилртути — это ужасно токсичное из известных человечеству веществ, настолько токсичное, что при первой возможности ищут менее опасную альтернативу если предстоит работа с ней. Капля диметилртути способна убить человека сквозь резиновые перчатки, причем первые симптомы отравления могут появиться только на следующий день.
Если вы выкинув ртуть подальше от дома думаете, что проблема устранена — то вы серьезно ошибаетесь. Ртуть — яд кумулятивный, способный к накоплению в живых организмах
и передаче дальше по пищевой цепочке. Примером отравления человека ртутью является болезнь Минамата. Ртуть из выброшенной люминесцентной лампы отравит если не вас, то ваших потомков.
Дополнительные сведения
Если вы нашли где-нибудь ртуть, не пытайтесь ее продать. Ртуть и ее соли считаются сильнодействующими ядовитыми веществами (ст. 234 УК РФ). На содержащие ртуть приборы заводского производства, соответствующие официальным стандартам, запрет не распространяется. Найденную ртуть и неисправные ртутьсодержащие приборы, следует сдавать на переработку в специализированные службы в вашем городе. Единственный широко доступный источник ртути (если вдруг понадобится в научной работе) — медицинские термометры.
ИМСС УрО РАН — Снова турбулентность, теперь
- Details
- Category: Интервью
- Published: 10 August 2016
- Hits: 6743
В Институте механики сплошных сред (г. Пермь) действует уникальная лабораторная площадка для работы с жидким натрием — большой натриевый контур. О том, какие исследования проводятся на этой принципиально новой экспериментальной установке и какие прикладные задачи можно решать на их основе, мы поговорили с заведующим лабораторией физической гидродинамики ИМСС УрО РАН, доктором физико-математических наук Петром Готлобовичем Фриком.
— Прежде всего вопрос: чем так интересен для ученых жидкий натрий?
— Этот металл плавится при относительно низкой температуре (98º С) и обладает в жидком состоянии уникальной комбинацией теплофизических и динамических свойств: у него высокая электропроводность, гораздо выше, чем у ртути или низкотемпературных сплавов галлия, очень низкая плотность (все помнят со школы, что натрий плавает в воде). И динамически он ведет себя, как вода, позволяя получать развитые турбулентные потоки в лабораторных условиях. Однако жидкий натрий — опасное вещество, он легко воспламеняется и взрывается, поэтому требует осторожного обращения.
В нашем институте ведутся магнитогидродинамические исследования с использованием различных жидких металлов. Натрий мы применяем в экспериментах по изучению процессов генерации магнитных полей потоками проводящей жидкости.
— Каким образом эти фундаментальные исследования получили практический выход?
— Благодаря своим свойствам жидкий натрий используется в качестве теплоносителя в ряде атомных реакторов. При проектировании таких реакторов нужно решать задачи по расчету теплопереноса при вынужденной и свободной конвекции, а также тепловых нагрузок при смешении разнотемпературных турбулентных потоков натриевого теплоносителя. Дело в том, что при таком смешении возникают пульсации температуры, которые создают дополнительные термоциклические нагрузки на оборудование и могут существенно снижать ресурс конструкций. Для обеспечения надежности расчетов требуется верификация вычислительных пакетов на экспериментальные данных, полученных при значениях управляющих параметров, близких к натурным.
Именно за экспериментальной базой для верификации программ обратились к нам несколько лет назад специалисты Опытного конструкторского бюро машиностроения им. И.И. Африкантова, по заказу которого мы начали исследования турбулентного теплопереноса при свободноконвективных течениях натрия в цилиндрических сосудах. Удалось выяснить зависимость характеристик теплообмена, тепломассопереноса и турбулентности от внешних параметров. Чтобы расширить экспериментальную базу для работы с жидким натрием, в ИМСС УрО РАН был создан большой натриевый контур, который введен в эксплуатацию в 2013 году, тогда еще при финансовой поддержке УрО РАН.
— В чем уникальность вашей установки?
— Натриевых контуров в мире вообще немного, они строятся по индивидуальным заказам с определенными целями. Наш натриевый контур — это, точнее, стенд с двумя контурами, в каждом из которых создается контролируемый поток натрия с фиксированной температурой: в одном — горячий, в другом — холодный. В контуре имеется система электрического нагрева и воздушного охлаждения жидкого натрия. Течение металла генерируется электромагнитными насосами бегущего поля, а его интенсивность измеряется электромагнитными расходомерами. Турбулентное смешение разнотемпературных потоков натрия происходит в рабочей зоне, куда устанавливаются тестируемые элементы конструкций. Рабочая температура жидкого металла — от 150 до 300 градусов.
По существу, молодые сотрудники нашей лаборатории создали установку своими руками, в мастерских института: разработали систему охлаждения, спроектировали и собрали электромагнитные насосы, всю измерительную часть, расходомеры для жидкого натрия. В команду входили кандидаты физико-математических наук Александр Шестаков (на фото слева), Илья Колесниченко, Руслан Халилов (на фото вверху), Андрей Васильев, а также Андрей Мамыкин и Александр Павлинов — на тот момент аспиранты, которые теперь уже представили диссертации по результатам исследований потоков жидкого натрия.
Беседовала Е. Понизовкина
Газета «Наука Урала»
Год: 2016
Месяц: июль
Номер выпуска: 13-14
Абсолютный номер: 1140
http://uran.ru/node/4634
Стандартные образцы удельной электропроводности (УЭП), Inorganic Ventures
Для производства всех стандартных образцов удельной электропроводности (УЭП) в компании Inorganic Venrures используются исходные вещества только высшей степени очистки.
Объем флаконов: 125, 500, 1000 мл
Вещество: KCl
Растворитель: H2O
№ | Стандартный образец УЭП, при 25оС |
1 | 10 мкСм/см |
2 | 100 мкСм/см |
3 | 1000 мкСм/см |
4 | 10 000 мкСм/см |
5 | 100 000 мкСм/см |
6 | 1200 мкСм/см |
7 | 1400 мкСм/см |
8 | 1413 мкСм/см |
9 | 1430 мкСм/см |
10 | 147 мкСм/см |
11 | 2 мкСм/см |
12 | 500 мкСм/см |
Если Вы не нашли интересующий Вас страндартный образец удельной электропроводности (УЭП) компания Inorganic Ventures изготовит его по Вашим требованиям.
Задать вопрос по e-mail или по тел.: (812) 448-73-43
Стандартные образцы Inorganic Ventures
Графит и его соединения включения
Графит и его соединения включения
Ю. А. ДЯДИН
Новосибирский государственный университет
СТРОЕНИЕ И СВОЙСТВА ГРАФИТА
Углерод имеет несколько аллотропных модификаций, из которых наиболее известны графит и алмаз. Можно упомянуть также карбин — линейные полимерные цепочки (=С=С=С=)n или (-СЇС-СЇ)n , фуллерены — сферические и эллипсоидальные молекулы (например, С60 и С70), аморфный углерод (сажу, например). Графит — наиболее стабильная при обычных условиях модификация, имеет ярко выраженное слоистое строение. В слоях атом углерода прочно связан химической связью с тремя другими находящимися на расстоянии 1,42 Б, угол С-С-С равен 120?. Таким образом, плоский слой представляет собой как бы паркет из гексагонов, в вершинах которых расположены центры атомов углерода (рис. 1, а, б ). Расстояние между слоями значительно больше — 3,35 Б, слои связаны друг с другом фактически лишь слабыми ван-дер-ваальсовыми силами. Слои расположены таким образом, что половина атомов одного слоя находится под центрами гексагонов другого, а вторая половина — друг под другом (рис. 1, а, в), то есть в графите два вида кристаллографически разных атомов углерода. В обычном гексагональном графите слои расположены точно один под другим через один (чередование слоев АБАБАБ_). Напомним, что в кристаллохимии есть понятие элементарная ячейка — наименьший объем кристалла с максимальным набором элементов симметрии, повторением которого можно воспроизвести весь кристалл [1]. Обычный графит имеет гексагональную элементарную ячейку с параметрами a = b = 2,464 Б, c = 6,701 Б, z = 4; ячейка представляет собой призму, в основании которой лежит ромб с острым углом в 60? и длиной ребра 2,464 Б, высота призмы 6,701 Б, и такая ячейка содержит четыре атома углерода. На рис. 1 элементарная ячейка выделена. Реже встречается ромбоэдрическая модификация, у которой чередование слоев через два — АБВАБВ_
Как видно из расстояний между атомами в слоях и расстояний между слоями, все четыре валентных электрона участвуют в образовании химических связей в слое. Поэтому кратность связи 1,33 (длина одинарной связи в алмазе равна 1,544 Б). Однако очень малая часть электронов (примерно 1 на 18 000 атомов) находится в зоне проводимости, формируя металлическую связь между слоями. По этой причине металлическая связь вносит крайне небольшой вклад в энергетику взаимодействия между слоями, которая определяется в основном ван-дер-ваальсовыми силами, но существенным образом определяет свойства графита, такие, как теплопроводность, которая в три раза превышает теплопроводность ртути, электропроводность, которая соизмерима с металлической (0,1 от электропроводности ртути), и характерный металлический блеск графита. Слоистость структуры определяет ярко выраженную анизотропию свойств: электропроводность вдоль направления слоев на два порядка выше, чем перпендикулярно им, и теплопроводность также гораздо (в пять раз) выше в направлении параллельно слоям, коэффициент теплового расширения перпендикулярно слоям примерно в 20 раз больше, чем параллельно им. И это понятно, так как слабая связь между слоями легче расшатывается тепловым движением, чем сильная химическая связь в слоях. Относительно слабая связь между слоями позволяет широко использовать графит в качестве скользящих контактов для электрических машин, делает графит удобным твердым смазочным материалом для нагретых частей установок и двигателей (однако заметим, что при температурах порядка 2500?С и выше графит в значительной мере теряет свои смазочные свойства). С химической точки зрения графит достаточно инертен: заметное окисление на воздухе начинается лишь при температуре выше 500?С и даже при воздействии такого агрессивного реагента, как фтор, при комнатной температуре и давлении 5 кбар в течение 19 дней не наблюдалось никаких изменений.
Указанные физические свойства вместе с химической стойкостью графита позволяют использовать его в широчайшем диапазоне человеческой деятельности — от приготовления красок и грифелей для карандашей (название «графит» произошло от греч. grafw — писать) до сопел ракетных двигателей и замедлителей нейтронов в атомных реакторах. Графит широко используют в химической промышленности для изготовления теплообменников, трубопроводов для агрессивных сред, как наполнитель пластмасс, материал для электродов разного назначения и многое, многое другое. Он является неоценимым материалом в металлургии для изготовления плавильных тиглей, труб, кристаллизаторов, чехлов для термопар и т.д. Однако, несмотря на свою достаточно высокую химическую инертность, графит довольно легко дает так называемые интеркалаты (слоистые соединения включения [2]) и с гораздо менее химически активными реагентами.
СОЕДИНЕНИЯ ГРАФИТА
Почему мы говорим «соединения графита», а не карбиды или соединения углерода? Дело в том, что во многих реакциях графитовые слои не разрушаются и ведут себя как гигантские молекулы, которые при разложении соединения сохраняют свою индивидуальность. Графитовый слой может выступать как акцептор электронов при взаимодействии с сильными восстановителями и, наоборот, как донор электронов при взаимодействии с окислителями.
Соединения с избытком электронов в слое графита
Соединения с тяжелыми щелочными металлами. Наиболее легко образуются соединения с тяжелыми щелочными металлами (начиная с калия). Для этого достаточно контакта графита с избытком жидкого или парообразного металла при температурах порядка 300-500?С. Открыты они были Фреденхагеном в 1926 году. Соединение калия с графитом КС8 имеет вид желтой бронзы и обладает гораздо более высокой электропроводностью, чем сам графит. Реакции внедрения металла в межслоевое пространство графита экзотермична, и выделение тепла возрастает в ряду К (360) Rb (486) Cs (666 Дж/г графита). Из рис. 2 видно, что при плавном изменении условий синтеза (изменение температуры образца при постоянном давлении паров калия) на кривой состава соединения калия с графитом (аналогично с Rb и Cs) наблюдаются четкие площадки, говорящие об образовании нескольких соединений практически определенного состава, а не о твердых растворах (с заметной областью гомогенности) за счет постепенного заполнения межслоевого пространства щелочным металлом.
Структурные исследования показали, что при внедрении атомов металла (М) слои графита раздвигаются (от l = 3,35 Б в графите до l = 5,40 (К), 5,65 (Rb) и 5,95 Б (Cs)) и смещаются таким образом, что становятся точно друг под другом (чередование АМАМА_). Такое смещение требует всего около 8 кДж/г » атом и окупается благоприятной геометрией. Гостевые атомы располагаются не беспорядочно, а как показано на рис. 1, в на расстоянии 4,91 Б друг от друга. Стехиометрия при таком расположении атомов (см. выделенную элементарную ячейку) составляет МС8 . Как видно из рис. 3, а также из данных по межслоевым расстояниям, металл внедряется в виде иона, отдавая свой электрон в графитовый слой. Графит, таким образом, является макроанионом. При понижении концентрации металла (давления паров) в исходной реакционной смеси снижается и его содержание в соединении за счет как понижения концентрации в слое (убирается каждый третий атом металла, сетка расположения ионов из треугольной становится гексагональной и стехиометрия в слое становится МС12), так и за счет появления незаполненных слоев. Если слои металла отделены друг от друга двумя (тремя, четырьмя и т.д.) слоями графита, то соединение называется соединением второй (n = 2) (третьей, n = 3, четвертой, n = 4 и т.д.) ступени. Стехиометрия для соединения II ступени — МС24 , для III ступени — МС36 , для IV ступени — МС48 и т.д. Чередование слоев графита для соединения II ступени таково: АМАВМВАМА, то есть через слой металла слои графита расположены одинаково, а граничащие друг с другом смещены как в чистом графите. Нетрудно видеть, что период идентичности в Б вдоль оси с = (n — 1) » 3,35. Встречаются соединения и дробных ступеней, например соединение степени 3/2, в котором чередование слоев таково: АМАВМВМВМВА_, то есть как бы сочетаются в соотношении 1 : 1 соединения первой и второй ступеней.
Соединения с литием и натрием. Расположение ионов лития в межслоевом пространстве графита отличается от описанного выше для тяжелых щелочных металлов (см. рис. 1, д, е): они расположены ближе друг к другу — а = 4,29 Б и стехиометрия для соединений первой ступени LiC6 . Поскольку ион лития маленький (r = = 0,68 Б), графитовые слои раздвигаются незначительно (l = 3,73 Б) и расположение их друг относительно друга такое же, как в графите, то есть параметр с = 2l. Известны соединения от LiС6 до LiС72 (XII ступень). Но непосредственно с графитом при обычных условиях литий не взаимодействует. Для этого нужны высокие температуры (Т > 400?С) и давления (Р > 10 кбар). Обычно соединения лития получают обработкой графита раствором лития в аммиаке или метиламине.
С натрием графит взаимодействует хуже всего. Известны только соединения высоких ступеней (NaС48 — NaС64). Нужно, однако, заметить, что при очень больших давлениях и температурах были получены фазы с гораздо более высоким содержанием металла в графите (вплоть до LiC2 , NaC2 , MC4-6 , где М = K, Rb, Cs). При этом наблюдается явление «гнездования» гостевых ионов с некоторым перекрыванием их сфер, очерченных ионными радиусами.
Соединения с другими металлами. Непосредственно щелочноземельные металлы (Ca, Sr, Ba) и лантаниды (Sm, Eu, Yb) образуют соединения МС8 в условиях, близких к таковым для лития. Нагревание должно быть осторожным, так как перегрев ведет к образованию карбидов. В этих случаях металл внедряется в виде иона. Прямым синтезом с переходными металлами (Mn, Fe, Co, Ni, Cu, Mo) по понятным причинам не удавалось получить подобные соединения. Красивый обходной маневр предложили Ю.Н. Новиков и М.Е. Вольпин. Они осторожно восстанавливали (водородом или лучше анион-радикалом, например натрий-нафталином) слоистые соединения хлоридов соответствующих металлов. Интересно, что дляFe0 было получено соединение первой ступени с межслоевым расстоянием 5,8 Б и это соответствует внедрению скорее свободного атома железа с его ван-дер-ваальсовыми размерами. В некоторых случаях, однако, со временем межслоевое пространство уменьшалось до 4,66 Б, и это авторы объясняют взаимодействием гость-хозяин по типу образования p-комплексов.
Тройные соединения. Соединение КС8 , имеющее цвет желтой бронзы, уже при обычных условиях в атмосфере водорода медленно его адсорбирует и превращается в соединение второй ступени КС8Н2/3 , окрашенное в голубой цвет. В этом соединении между двумя слоями графита, расположенными на расстоянии 8,53 Б, помещается тройной гостевой слой — калий-водород-калий. Реакцией гидрида калия с кристаллическим графитом удалось получить не только это соединение, но и фиолетовое соединение первой ступени КС8Н4 . Интересно, что давление десорбции подобных дейтеридов в шесть раз выше, чем у гидридов, и в этом отношении интеркалаты графита имеют преимущества перед гидридами металлов при разделении изотопов. Имеется также сообщение о том, что при низких температурах (ниже -180?С) довольно быстро сорбируются и водород и дейтерий, но при этом не наблюдается обменной реакции h3 + D2 2HD, и теплота сорбции составляет всего — 9 и 11 кДж/моль соответственно. И то и другое свидетельствует о том, что в данном случае наблюдается обычная физическая сорбция в отличие от описанной выше хемосорбции. Сорбционная способность КС24 для Н2 составляет 144 см3 » г-1, что позволяет ему конкурировать с такими сорбентами, как активированный уголь или цеолиты. При этом изотопный эффект в некоторых случаях значительно выше, чем для синтетических цеолитов, использующихся для разделения изотопов водорода в газовой хроматографии.
Аммиак и амины образуют синие соединения состава С12М(Nh4)2 , в которых толщина межслоевого пространства l = 6,6 Б не зависит от природы металла, но зависит от природы амина (6,9 Б для метиламина и 8,5 Б для этилендиамина). Это и понятно, поскольку размер молекул аминов больше размера катиона любого из рассматриваемых металлов.
До середины 90-х годов не были известны соединения включения графита с органическими молекулами в отличие от некоторых глин — слоистых силикатов (например, монтморилонит) и слоистых дисульфидов (например, MoS2). И связано это, скорее всего, с тем, что только ван-дер-ваальсового взаимодействия недостаточно для раздвижения слоев и образования соединений. Интеркалаты графита в значительной мере образуются за счет переноса заряда от гостевой подсистемы к хозяйской или наоборот. Однако соединения графита с щелочными металлами могут включать многие органические молекулы, образуя тройные соединения. При этом взаимодействие между металлом и органической молекулой играет важную роль. ТГФ и бензол легко взаимодействуют с соединениями второй ступени МС24 (M = K, Rb, Cs) и LiC12 , образуя соединения первой ступени. Бензол не взаимодействует с КС8 , но включается в него вместе с ТГФ, образуя уже четверное соединение К(ТГФ)0,4(С6Н6)0,4С8 . А вот удалить бензол из этого соединения в отличие от ТГФ практически невозможно, и связано это с тем, что бензол олигомеризуется в межслоевом пространстве с образованием не только бифенила, но даже три- и тетрафенила. Аналогично при — 80?С этилен обратимо внедряется в CsC24 , однако уже при 0?С реакция становится необратимой благодаря полимеризации.
Соединения с недостатком электронов в слое графита
Соединения с галогенами. При контакте графита с газообразным или жидким бромом легко образуется соединение, состав которого можно передать формулой С8Br. В этом соединении графит выступает в роли донора электронов. Поэтому формула более правильна, так как указывает на то, что в межслоевое пространство включается молекулярный бром с переносом одного электрона примерно на каждые три молекулы брома. Казалось бы, хлор как более электроотрицательный элемент должен образовывать еще более прочное соединение. Но аналогичное соединение с хлором крайне неустойчиво и существует при очень низких температурах (- 78?С). Иод вообще не образует соединений с графитом, фтор хотя и взаимодействует с графитом, но внедряется не молекула, тогда как молекулы ICl и IBr внедряются в межслоевое пространство графита даже лучше, чем бром. В чем же дело? Очевидно, что не химическая природа галогена определяет его реакционную способность в данном случае. Картина проясняется, если мы вспомним, что расстояния между впадинами в центре гексагонов графитового слоя (см. рис. 1 и 3) равно 2,46 Б, расстояния между атомами в Br2 , ICl и IBr равны 2,27; 2,40 и 2,49 Б, тогда как в молекулах F2 , Cl2 и I2 межатомные расстояния 1,42; 1,99 и 2,67 Б соответственно, то есть либо слишком малы, либо слишком велики для удобного расположения молекулы гостя между слоями графита. Более того, молекула брома даже несколько растягивается при интеркаляции (расстояние между атомами в молекуле брома увеличивается на 0,04 Б), приспосабливаясь таким образом к геометрии межслоевого пространства.
Как мы уже отмечали, непосредственно фтор не взаимодействует с графитом при обычных условиях. Но при повышенных температурах (350-630?С) образуются нестехиометрические соединения валового состава CхF (0,8 < x <2). Цвет изменяется от черного через разные тона коричневого и желтого к белому по мере увеличения содержания фтора в соединении. Эти так называемые высокотемпературные фториды графита разделяют на два типа нестехиометрических соединений: полифториддиуглерод, у которого состав близок к C2F, и полифторидмоноуглерод — CF [3]. Первый получается в интервале температур 350-400?С, второй — 400-600?С. Интересно, что если уж получен полифториддиуглерод, то он не переходит в полифторидмоноуглерод даже за 120 ч при температуре 600?С. В этих соединениях между углеродом и фтором образуются связи в значительной степени ковалентные. В результате этого графитовый слой теряет свою индивидуальность, угол С-С-С в соединении становится меньше 120?, а углеродный слой — не плоским, а складчатым, длина связи С-С увеличивается, существенно уменьшается электропроводность и CF является изолятором. Строение рассмотренных соединений, по данным их первооткрывателя японского исследователя Н. Ватанабэ, представлено на рис. 4, из которого видно, что каждый атом углерода имеет четыре ковалентные связи. В случае CF к каждому атому углерода поочередно с одной и другой стороны слоя присоединяется по атому фтора, а в случае C2F атомы углерода поочередно связаны с атомами фтора с одной, а с атомами углерода соседнего слоя с другой стороны. Для этих соединений не характерно образование интеркалатов. Другое дело — фториды графита, получаемые при низких температурах (15-100?С) с помощью катализаторов (HF, AgF и т.д.). При таком осторожном фторировании дело не доходит до образования ковалентных связей C-F, и так называемые низкотемпературные фториды графита — неплохие проводники электрического тока и весьма склонны к образованию соединений включения. Их состав CxF, где 2 < х < 24. Здесь, как и в рассмотренном выше случае, выделяются несколько доминирующих составов с х ї 2, 4 и 6.
Соединение C6F является соединением включения ионов фтора в графит, матрица которого выполняет роль макрокатиона (рис. 4, в). В соединениях C4F и C2F графитовый слой остается плоским, связь в значительной мере сохраняет ионный характер, они достаточно хорошо проводят электрический ток и легко образуют соединения включения с неорганическими (например, ClF3 , N2O4) и органическими (ацетон, бензол, толуол) молекулами. Синтезированное при низких температурах соединение C2F имеет приблизительно тот же интервал составов, что и высокотемпературная модификация C2F, о которой речь шла выше, но существенно отличается, как показали новосибирские исследователи А.С. Назаров, В.Г. Макотченко и другие, строением и свойствами. В отличие от высокотемпературной модификации в низкотемпературной C2F (как и в C4F) графитовый слой одинарный с расположением фтора по обе стороны. Фтор достаточно прочно удерживается в отличие от упомянутых только что гостевых органических и неорганических молекул, которые относительно легко могут быть удалены при нагревании или замещены другими гостевыми молекулами обменными реакциями, что позволяет говорить о фторграфитовой матрице и фтор, расположенный в межслоевом пространстве, относить к хозяину, а не к гостю. Подобные фторграфитовые матрицы кроме прямого фторирования графита могут быть получены из слоистых соединений графита с фторирующими агентами, такими, как XeF2 в HF, ClF3 и др.
Соединения с галогенидами металлов. Гексафториды некоторых переходных элементов, обладающие высоким сродством к электрону (PtF6 , IrF6 , OsF6), образуют с графитом соединения включения I ступени. С AsF5 образуется аналогичное соединение по реакции
3AsF5 + 32Cграфит = 2C16AsF6 + AsF3
Нужно заметить, что соединения включения графита с дефицитом электронов в графитовом слое (так же как и с их избытком) с одним и тем же гостем в зависимости от условий равновесия могут образовывать соединения разных ступеней. Причем при монотонном изменении условий равновесия состав интеркалата меняется скачкообразно, с четко выраженными остановками на изобаре, говорящими об образовании фактически соединений определенного состава (см. рис. 2, б ).
Хлориды железа (II) и (III), никеля, кобальта, марганца, меди, алюминия, галлия, редкоземельных элементов в присутствии окислителя (обычно Cl2) достаточно легко образуют интеркалаты разных ступеней в зависимости от условий синтеза. Некоторые из них, как соединения с хлоридом алюминия, легко разлагаются водой, другие, как соединения с хлоридом железа, довольно устойчивы к ней.
Соединения с кислотами. В присутствии сильных окислителей графит взаимодействует со многими кислотами: азотной, фтористоводородной, фосфорной, трифторуксусной и хлорной. Вообще первым обнаруженным соединением включения графита был его бисульфат открытый П. Шауфхейтлем в 1841 году. Возможны реакции обмена кислотами, например
Оксиды и фтороксиды графита в какой-то мере аналогичны высокотемпературным фторографитам: в них также связь углерод-кислород (фтор) в значительная степени ковалентная и графитовые слои теряют свою планарность. Окись графита может быть получена окислением графита сильными окислителями (KClO3 , KMnO4) в крепких растворах серной кислоты. Здесь реакция идет в две стадии: сначала (в считанные минуты) образуется бисульфат графита с включенными окислителями, а затем уже идет (в течение нескольких часов) реакция окисления графита. Оксифториды получают фторированием окиси графита, изучены они мало.
Окись графита. Окись графита — широко употребляемый термин для продуктов окисления графита, далеко не полностью соответствует этому. Любая окись графита, даже высушенная над Р2О5 , содержит водород, и состав ее переменный (С7О4Н2-С8О4Н3). В высушенной над Р2О5 окиси графита межплоскостные расстояния порядка 6 Б, и это расстояние практически не меняется при поглощении до 4,5% воды, тогда как в дальнейшем межслоевое расстояние увеличивается пропорционально содержанию воды и может достигать 12 Б. Кроме воды окись графита способна сорбировать другие полярные жидкости. На этом основано приготовление мембран, проницаемых для воды и непроницаемых для неполярных веществ (например, благородных газов, азота). При внедрении в окись графита н-спиртов и н-аминов слои могут раздвигаться до 40 Б и более, и в этом окись графита очень похожа на слоистые алюмосиликаты (глины, натриевый монтмориллонит, например).
ИСПОЛЬЗОВАНИЕ СОЕДИНЕНИЙ ГРАФИТА
Сам графит обладает исключительно большим набором полезных физико-химических свойств, которые позволяют широко использовать его в различных областях человеческой деятельности. Способность графита включать ионы (атомы, молекулы) разнообразных веществ позволяет в некоторых случаях существенно усилить его полезные свойства. Интеркаляция, как правило, приводит к существенному увеличению электропроводности. Так, проводимость C24ICl превышает проводимость золота при одинаковых условиях. Это обусловлено ростом концентрации носителей тока по сравнению с графитом при сохранении их высокой подвижности, связанной с двухмерным характером явления переноса. На рис. 5 показана электропроводность некоторых соединений включения графита наряду с электропроводностью металлов. Это сравнение показывает перспективность использования интеркалатов графита в качестве электропроводников, особенно если учесть, что сейчас хорошо развито изготовление углеродных волокон и ведутся работы по получению волоконных интеркалатов. Основной недостаток этих материалов — неустойчивость их работы во времени.
Второе перспективное направление — это использование в качестве электродов в различных батареях и аккумуляторах. Очевидно, батарея, основанная на фторе и литии, является в теоретическом плане лучшей по всем показателям, но, увы, создать обратимые электроды в этой системе напрямую не удается. Сейчас удалось создать батарейку с разностью потенциалов до 4,8 В, схема одной из них: Li / LiClO4-ПК / CxF, CxMFy (ПК — пропиленкарбонат). Японская фирма «Sony» создала аккумулятор, выдерживающий более 1000 циклов «заряд — полный разряд», основанный на идеализированной реакции
Заряд
6Сграфит + LiCoO2 = LiC6 + CoO2
Разряд
Кроме этого, хорошо просматривается возможность применения интеркалатов графита как смазочных материалов в химически агрессивных средах, как хранителей агрессивных веществ (например, ClF3 в полифториддиуглероде).
ЛИТЕРАТУРА
1. Сережкин В.Н., Блатов В.А. Координационные числа атомов и структура металлов // Соросовский Образовательный Журнал. 1999. № 8. С. 35-39.
2. Дядин Ю.А. Супрамолекулярная химия: Клатратные соединения // Там же. 1998. № 2. С. 79-88.
3. Okino F., Touhara H. Graphite and Fullerene Intercalation Compounds // Comprehensive Supramolecular Chemistry / Ed. by J.L. Atwood et al. Oxford: Pergamon Press, 1996. Vol. 7. P. 25-76.
Рецензент статьи А.Р. Кауль
* * *
Юрий Алексеевич Дядин, доктор химических наук, профессор кафедры неорганической химии факультета естественных наук Новосибирского государственного университета, зав. лабораторией клатратных соединений Института неорганической химии СО РАН. Область научных интересов — клатратные соединения, супрамолекулярная химия. Автор около 200 научных публикаций, двух монографий и двух учебных пособий.
Руководство по применению ртути в металлургии
Ртуть, или «ртуть», как ее еще называют, представляет собой плотный токсичный металлический элемент, который существует в жидкой форме при комнатной температуре. Использование ртути, производимой и изучаемой на протяжении тысячелетий, неуклонно сокращалось с 1980-х годов в результате повышенного внимания к негативным последствиям для здоровья человека и окружающей среды.
Недвижимость
- Атомный символ: Hg
- Атомный номер: 80
- Категория элемента: Переходный металл
- Плотность: 15.534 г / см³
- Точка плавления: -38,9 ° C (102 ° F)
- Точка кипения: 356,9 ° C (674,4 ° F)
- Удельное электрическое сопротивление: 95,8 мкОм / см (20 ° C)
Характеристики
При комнатной температуре ртуть представляет собой густую серебристую жидкость с очень высокой плотностью и низкой теплопроводностью. Он имеет относительно высокую электропроводность и легко образует амальгамы (сплавы) с золотом и серебром.
Одной из наиболее ценных характеристик ртути является ее способность равномерно расширяться и сжиматься во всем диапазоне жидкостей в ответ на изменения давления и температуры.Ртуть также очень токсична как для человека, так и для окружающей среды, что привело к резкому сокращению ее производства и использования за последние несколько десятилетий.
История
Самое раннее использование Меркурия восходит к 1500 г. до н.э., когда его использовали для украшения гробниц в Древнем Египте. Вероятно, из-за своих уникальных свойств ртуть использовалась, изучалась и ценилась многими цивилизациями, включая древних греков, римлян, китайцев и майя.
На протяжении веков люди верили, что ртуть обладает особыми лечебными свойствами, и, следовательно, использовали ее как мочегонное и болеутоляющее, а также в лекарствах для лечения различных заболеваний, от депрессии до сифилиса.Его использовали в косметике и в качестве декоративного материала. Средневековые алхимики особенно интересовались способностью ртути извлекать золото из руды.
С самого начала стало ясно, что таинственный жидкий металл токсичен для людей из-за большого количества случаев безумия и смерти в ртутных рудниках. Однако это не помешало экспериментам. Использование нитрата ртути для преобразования меха в войлок, которое часто использовалось мастерами шляп 18 и 19 веков, привело к выражению «безумный как шляпник».’
Между 1554 и 1558 годами Бартоломе де Медина разработал внутренний дворик для извлечения серебра из руд с использованием ртути. Процесс обработки внутреннего дворика основан на способности ртути соединяться с серебром. Поддерживаемый крупными ртутными рудниками в Альмадене, Испания, и Уанкавелика, Перу, внутренний дворик имел решающее значение для быстрого расширения производства серебра в Испании в 17-18 веках. Позже, во время золотой лихорадки в Калифорнии, для добычи золота использовались вариации процесса патио.
Ко второй половине 20-го века все большее количество исследований начало доказывать взаимосвязь между стоком химических отходов и содержанием метилртути в морепродуктах.Было обращено внимание на влияние металла на здоровье человека. В последние годы в США и Европейском союзе введены строгие правила производства, использования и удаления ртути.
Производство
Ртуть — очень редкий металл и чаще всего встречается в рудах киновари и ливингстонита. Он производится как основной продукт и как побочный продукт из золота, цинка и меди.
Ртуть может быть произведена из киновари, сульфидной руды (HgS), путем сжигания сульфида во вращающейся печи или многоподовых печах.Измельченная ртутная руда смешивается с древесным углем или коксующимся углем и сжигается при температуре выше 300 ° C (570 ° F). Кислород закачивается в печь, которая соединяется с серой, выделяя диоксид серы и создавая пары ртути, которые можно собирать и охлаждать для дальнейшей переработки до получения чистого металла.
Пропуская пары ртути через конденсатор с водяным охлаждением, ртуть, которая имеет высокую температуру кипения, первой конденсируется и собирается в жидкометаллическую форму. С помощью этого процесса можно извлечь около 95% ртути из киноварной руды.
Ртуть также можно выщелачивать из руд с помощью гидроксида натрия и сульфида натрия. Восстановление ртути осуществляется осаждением с использованием алюминия или электролизом. Путем перегонки ртуть может быть очищена до более чем 99,999%.
Коммерческая ртуть с содержанием 99,99% ртути продается в стальных или кованых фляжках весом 76 фунтов (34,5 кг).
Мировое производство ртути оценивается Геологической службой США (USGS) в 2250 тонн в 2010 году. Китай в настоящее время обеспечивает около 70% мирового производства, за ним следует Кыргызстан (11.1%), Чили (7,8%) и Перу (4,5%).
К крупнейшим производителям и поставщикам ртути относятся Хайдарканский ртутный завод в Кыргызстане, производители ртутного пояса Тонгрен-Фэнхуан в Китае и Minas de Almadén y Arrayanes, SA, которая ранее эксплуатировала исторический ртутный рудник Альмаден в Испании и теперь отвечает за производство ртути. переработка и управление большим процентом европейской ртути.
Приложения
Производство и спрос на ртуть неуклонно снижались с момента своего пика в начале 1980-х годов.
Основное применение металлической ртути в Северной Америке и Европе — катодные ячейки, которые используются для производства каустической соды. В США на нее приходится 75% потребности в ртути, хотя потребность в таких элементах снизилась на 97% с 1995 г., поскольку современные хлорно-щелочные заводы применяют технологии мембранных элементов или мембранных элементов.
В Китае промышленность поливинилхлорида (ПВХ) является крупнейшим потребителем ртути. Производство ПВХ на основе угля, как и в Китае, требует использования ртути в качестве катализатора.По данным USGS, на ртуть, используемую в производстве пластмасс, таких как ПВХ, может приходиться до 50% мирового спроса.
Возможно, наиболее известное применение ртути — это термометры и барометры. Однако это использование также неуклонно сокращается. Галинстан (сплав галлия, индия и олова) в основном заменил ртуть в термометрах из-за более низкой токсичности сплава.
Способность ртути соединяться с драгоценными металлами, способствуя их извлечению, привела к тому, что она продолжает использоваться во многих развивающихся странах с россыпными золотыми приисками.
Несмотря на споры, использование ртути в зубных пломбах продолжается и, несмотря на разработку альтернатив, по-прежнему является основной отраслью производства металлов.
Одно из немногих применений ртути, которое растет в последние годы, — это компактные люминесцентные лампы (КЛЛ). Государственные программы, поощряющие отказ от менее энергоэффективных ламп накаливания, поддержали спрос на КЛЛ, для которых требуется газообразная ртуть.
Соединения ртути также используются в батареях, лекарствах, промышленных химикатах, красках и гремучей ртути, детонаторе для взрывчатых веществ.
Торговые правила
В последнее время США и ЕС предприняли усилия по регулированию торговли ртутью. В соответствии с Законом о запрещении экспорта ртути от 2008 года экспорт ртути из США будет запрещен с 1 января 2013 года. Экспорт ртути из всех стран-членов ЕС был запрещен с марта 2011 года. Норвегия уже ввела запрет на производство, импорт и экспорт ртути.
Источники:
Введение в металлургию .Джозеф Ньютон, второе издание. Нью-Йорк, John Wiley & Sons, Inc. 1947 г.
Меркурий: Элемент Древних.
Источник: http://www.dartmouth.edu/~toxmetal/toxic-metals/mercury/
Британская энциклопедия. Обработка ртути (2011 г.).
Получено с http://www.britannica.com/EBchecked/topic/375927/mercury-processing.
Ртуть — единственный распространенный металл, который является жидким при обычных температурах.Ртуть иногда называют ртутью. Это тяжелый жидкий металл серебристо-белого цвета. Это довольно плохой проводник тепла по сравнению с другими металлами, но это хороший проводник электричества. Он легко сплавляется со многими металлами, такими как золото, серебро и олово. Эти сплавы называются амальгамами. Наиболее важными солями ртути являются хлорид ртути HgCl 2 (коррозионный сублимат — сильный яд), хлорид ртути Hg 2 Cl 2 (каломель, до сих пор иногда используется в медицине), фульминат ртути (Hg (ONC) 2 , детонатор, используемый во взрывчатых веществах) и сульфид ртути (HgS, киноварь, высококачественный пигмент краски). Приложения Металл ртути имеет множество применений. Из-за высокой плотности используется в барометрах и манометрах. Он широко используется в термометрах благодаря высокой скорости теплового расширения, которая остается довольно постоянной в широком диапазоне температур. Его легкость в слиянии с золотом используется для извлечения золота из его руд. Промышленность использует металлическую ртуть в качестве жидкого электрода при производстве хлора и гидроксида натрия путем электролиза рассола.Ртуть до сих пор используется в некоторых электрических устройствах, таких как переключатели и выпрямители, которые должны быть надежными, а также для промышленного катализа. В бытовых батареях и люминесцентном освещении сейчас используется гораздо меньше ртути, но полностью исключить ее не удалось. Соединения ртути имеют множество применений. Каломель (хлорид ртути, Hg 2 Cl 2 ) используется в качестве стандарта в электрохимических измерениях и в медицине как слабительное средство. Хлорид ртути (коррозионный сублимат, HgCl 2 ) используется как инсектицид, крысиный яд и дезинфицирующее средство.Оксид ртути используется в мазях для кожи. Сульфат ртути используется в качестве катализатора в органической химии. Киноварь, красный пигмент, представляет собой сульфид ртути; другая кристаллическая форма сульфида (также используемого в качестве пигмента) — черная. Фульминат ртути Hg (CNO) 2 используется в качестве детонатора. Ртуть в окружающей среде Ртуть в ограниченной степени встречается в несвязанном виде. В природе он редко встречается в свободном виде и встречается в основном в киноварной руде (HgS) в Испании, России, Италии, Китае и Словении.Мировое производство ртути составляет около 8 000 тонн в год. Добываемые запасы составляют около 600 000 тонн. Ртуть — это соединение, которое естественным образом встречается в окружающей среде. Его можно найти в металлической форме, в виде солей ртути или в виде органических соединений ртути. Ртуть попадает в окружающую среду в результате нормального разложения минералов в горных породах и почве под воздействием ветра и воды. Выбросы ртути из природных источников оставались практически неизменными на протяжении многих лет. Тем не менее, концентрация ртути в окружающей среде увеличивается; это приписывается человеческой деятельности. Ртуть в естественных условиях не содержится в пищевых продуктах, но она может присутствовать в продуктах питания, поскольку может распространяться в пищевых цепочках более мелкими организмами, которые потребляются людьми, например, через рыбу.Концентрация ртути в рыбе обычно значительно превышает ее концентрацию в воде, в которой она обитает. Продукты животноводства также могут содержать большое количество ртути. Ртуть обычно не содержится в растительных продуктах, но она может попадать в организм человека через овощи и другие культуры, когда в сельском хозяйстве используются спреи, содержащие ртуть.
Чтобы узнать больше о влиянии на пресноводную экосистему, взгляните на ртуть в пресной воде Вернуться к периодической диаграмме | |
Справочная таблица по электропроводности элементов — Angstrom Sciences
Справочная таблица по электропроводности элементов — Angstrom Sciences Перейти к основному содержанию| Электропроводность | Имя | Символ | # |
|---|---|---|---|
| 5.0E -24 10 6 / см Ом | Сера | S | 16 |
| 1.0E -17 10 6 / см Ω | фосфор | -п. | 15 |
| 8.0E -16 10 6 / см Ω | Йод | I | 53 |
| 1.0E -12 10 6 / см Ω | Селен | SE | 34 |
| 1.0E -12 10 6 / см Ом | Бор | В | 5 |
| 2,52E -12 10 6 / см Ω | Кремний | Si | 14 |
| 1.45E -8 10 6 / см Ω | Германий | Ge | 32 |
| 2.0E -6 10 6 / см Ω | Теллур | Te | 52 |
| 0.00061 10 6 / см Ω | Углерод | С | 6 |
| 0,00666 10 6 / см Ом | Плутоний | Pu | 94 |
| 0,00695 10 6 / см Ом | Марганец | Mn | 25 |
| 0,00736 10 6 / см Ом | Гадолиний | Gd | 64 |
| 0.00822 10 6 / см Ω | Нептуний | Np | 93 |
| 0,00867 10 6 / см Ом | Висмут | Bi | 83 |
| 0,00889 10 6 / см Ом | Тербий | ТБ | 65 |
| 0,00956 10 6 / см Ом | Самарий | см | 62 |
| 0.0104 10 6 / см Ω | Меркурий | Hg | 80 |
| 0,0108 10 6 / см Ом | Диспрозий | Ду | 66 |
| 0,0112 10 6 / см Ом | Европий | Eu | 63 |
| 0,0115 10 6 / см Ом | Церий | CE | 58 |
| 0.0117 10 6 / см Ω | Эрбий | Er | 68 |
| 0,0124 10 6 / см Ом | Гольмий | Ho | 67 |
| 0,0126 10 6 / см Ом | Лантан | La | 57 |
| 0,0148 10 6 / см Ом | празеодим | Pr | 59 |
| 0.015 10 6 / см Ω | Тулий | ТМ | 69 |
| 0,0157 10 6 / см Ом | Неодим | Nd | 60 |
| 0,0166 10 6 / см Ом | Иттрий | Y | 39 |
| 0,0177 10 6 / см Ом | Скандий | сбн | 21 |
| 0.0185 10 6 / см Ω | Лютеций | Лю | 71 |
| 0,0219 10 6 / см Ом | Полоний | Po | 84 |
| 0,022 10 6 / см Ом | Америций | Am | 95 |
| 0,0234 10 6 / см Ом | Титан | Ti | 22 |
| 0.0236 10 6 / см Ω | Цирконий | Zr | 40 |
| 0,0288 10 6 / см Ом | Сурьма | Сб | 51 |
| 0,03 10 6 / см Ом | Франций | Fr | 87 |
| 0,03 10 6 / см Ом | Барий | Ba | 56 |
| 0,0312 10 6 / см Ом | Гафний | Hf | 72 |
| 0.0345 10 6 / см Ω | Мышьяк | как | 33 |
| 0,0351 10 6 / см Ом | Иттербий | Yb | 70 |
| 0,038 10 6 / см Ом | Уран | U | 92 |
| 0,0481 10 6 / см Ом | Свинец | Пб | 82 |
| 0,0489 10 6 / см Ом | Ванадий | В | 23 |
| 0.0489 10 6 / см Ω | Цезий | CS | 55 |
| 0,0529 10 6 / см Ом | Протактиний | Па | 91 |
| 0,0542 10 6 / см Ом | Рений | Re | 75 |
| 0,0617 10 6 / см Ом | Таллий | Тл | 81 |
| 0.0653 10 6 / см Ω | Торий | Чт | 90 |
| 0,067 10 6 / см Ом | Технеций | Tc | 43 |
| 0,0678 10 6 / см Ом | Галлий | Ga | 31 |
| 0,0693 10 6 / см Ом | Ниобий | Nb | 41 |
| 0.0761 10 6 / см Ω | Тантал | Ta | 73 |
| 0,0762 10 6 / см Ом | Стронций | Sr | 38 |
| 0,0774 10 6 / см Ом | Хром | Cr | 24 |
| 0,0779 10 6 / см Ом | Рубидий | руб. | 37 |
| 0.0917 10 6 / см Ω | Олово | Sn | 50 |
| 0,095 10 6 / см Ом | Палладий | Pd | 46 |
| 0,0966 10 6 / см Ом | Платина | Pt | 78 |
| 0,0993 10 6 / см Ом | Утюг | Fe | 26 |
| 0,108 10 6 / см Ом | Литий | Ли | 3 |
| 0.109 10 6 / см Ом | Осмий | Ос | 76 |
| 0,116 10 6 / см Ом | Индий | В | 49 |
| 0,137 10 6 / см Ом | Рутений | Ру | 44 |
| 0,138 10 6 / см Ом | Кадмий | Кд | 48 |
| 0,139 10 6 / см Ом | Калий | К | 19 |
| 0.143 10 6 / см Ом | Никель | Ni | 28 |
| 0,166 10 6 / см Ом | Цинк | Zn | 30 |
| 0,172 10 6 / см Ом | Кобальт | Co | 27 |
| 0,187 10 6 / см Ом | молибден | Пн | 42 |
| 0,189 10 6 / см Ом | Вольфрам | Вт | 74 |
| 0.197 10 6 / см Ω | Иридий | Ir | 77 |
| 0,21 10 6 / см Ом | Натрий | Na | 11 |
| 0,211 10 6 / см Ом | Родий | Rh | 45 |
| 0,226 10 6 / см Ом | Магний | мг | 12 |
| 0,298 10 6 / см Ом | Кальций | Ca | 20 |
| 0.313 10 6 / см Ом | Бериллий | Be | 4 |
| 0,377 10 6 / см Ом | Алюминий | Al | 13 |
| 0,452 10 6 / см Ом | Золото | Au | 79 |
| 0,596 10 6 / см Ом | Медь | Cu | 29 |
| 0,63 10 6 / см Ом | Серебро | Ag | 47 |
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Продольные токи на ртути и их влияние на электропроводность земной коры
Аннотация
Данные магнитного поля, полученные на орбите вокруг Меркурия с помощью магнитометра на космическом корабле MErcury Surface, Space Environment, GEochemistry and Ranging (MESSENGER), используются для определения сигнатур стационарных продольных токов или токов Биркеланда в северной полярной области.Эти сигнатуры позволяют нам определять распределение, площадь и общий ток, который обычно течет к планете и от нее и закрывается на малых высотах. Результаты показывают, что ток течет вниз на рассветной стороне и вверх на стороне сумерек, что соответствует системе токов Региона-1 на Земле. Типичная плотность тока составляет от 10 до 20 нА / м2. Полный ток колеблется от 10 кА в магнитно-спокойных условиях до почти 40 кА в периоды возмущений. И плотность тока, и полный ток примерно на два порядка ниже, чем на Земле.Электрический потенциал, соответствующий дневному магнитному пересоединению магнитопаузы, оценивается в ~ 30 кВ при типичных условиях, что подразумевает, что полное сопротивление замыканию токов Биркеланда составляет порядка 1 Ом. На Земле это сопротивление обычно составляет 0,02 Ом, и если бы интегрированная по высоте проводимость на малых высотах была такой же, сопротивление на Меркурии было бы даже ниже, чем на Земле, ~ 0,01 Ом. Наблюдаемый сравнительно низкий ток и предполагаемое высокое сопротивление согласуются с ожиданиями, что замыкание по току на Меркурии заметно отличается от того, что на Земле.Мы решаем потенциал, подразумеваемый наблюдаемыми токами при замыкании через планету. Мы считаем, что проводимость коры и мантии согласуется с экспериментальными результатами для оливина, и мы используем номинальный современный профиль радиальной температуры для Меркурия. Чистые потенциалы, сравнимые с 30 кВ, требуют, чтобы ток замыкался в радиальном направлении через кору и горизонтально через мантию с более высокой проводимостью на глубинах от 50 до 400 км. Кора составляет почти все сопротивление току, и результаты согласуются с проводимостью земной коры порядка 10-8 См / м.
% PDF-1.4 % 14 0 объект > эндобдж xref 14 79 0000000016 00000 н. 0000002368 00000 н. 0000002528 00000 н. 0000002590 00000 н. 0000002640 00000 н. 0000002696 00000 н. 0000002775 00000 н. 0000002811 00000 н. 0000002843 00000 н. 0000002877 00000 н. 0000002912 00000 н. 0000002968 00000 н. 0000003047 00000 н. 0000003083 00000 н. 0000003115 00000 н. 0000003149 00000 п. 0000003184 00000 п. 0000003310 00000 н. 0000003377 00000 н. 0000003445 00000 н. 0000003512 00000 н. 0000003580 00000 н. 0000003788 00000 н. 0000003823 00000 н. 0000006516 00000 н. 0000006745 00000 н. 0000006822 00000 н. 0000006868 00000 н. 0000006914 00000 н. 0000007215 00000 н. 0000007267 00000 н. 0000007300 00000 н. 0000007407 00000 н. 0000007471 00000 н. 0000007648 00000 н. 0000007700 00000 н. 0000007746 00000 н. 0000007820 00000 н. 0000008239 00000 п. 0000008291 00000 н. 0000008324 00000 н. 0000008431 00000 н. 0000008495 00000 н. 0000008672 00000 н. 0000008724 00000 н. 0000008770 00000 н. 0000008844 00000 н. 0000008893 00000 н. 0000008942 00000 н. 0000010315 00000 п. 0000011778 00000 п. 0000013185 00000 п. 0000014485 00000 п. 0000015845 00000 п. 0000016977 00000 п. 0000018276 00000 п. 0000019548 00000 п. 0000019645 00000 п. 0000019742 00000 п. 0000020163 00000 п. 0000020413 00000 п. 0000020553 00000 п. 0000020787 00000 п. 0000021068 00000 п. 0000021165 00000 п. 0000032822 00000 н. 0000033130 00000 н. 0000033749 00000 п. 0000034017 00000 п. 0000076220 00000 п. 0000076351 00000 п. 0000076657 00000 п. 0000076901 00000 п. 0000076973 00000 п. 0000083044 00000 п. 0000083411 00000 п. 0000083854 00000 п. 0000084111 00000 п. 0000002000 00000 н. трейлер ] / Размер 93 / Назад 316203 >> startxref 0 %% EOF 92 0 объект > поток xc«g`a`c` Ȁ
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.

 Один из лучших вариантов для деталей, работающих под дождем. Тоже может встретиться в магазине стройматериалов, наряду с другими подобными марками.
Один из лучших вариантов для деталей, работающих под дождем. Тоже может встретиться в магазине стройматериалов, наряду с другими подобными марками.