ЭЛЕКТРОПРОВОДНОСТЬ
Количество просмотров публикации ЭЛЕКТРОПРОВОДНОСТЬ — 1014
Способность электролита пропускать электрический ток можно характеризовать его электропроводностью или сопротивлением. Электропроводность – величина, обратная сопротивлению. Электро-проводность выражается в ом-1. Различают удельнуюэлектропроводность (χ) и эквивалентную электропроводность (λ). Удельной электропровод-ностью раствора принято называть электропроводность раствора, помещенного между электродами с поверхностью в 1 см2 , находящихся на расстоянии 1см друг от друга.
χ=1/ p (61)
р- удельное сопротивление.
Эквивалентной электропроводностью принято называть электропроводность столба раствора, содержащего 1г/экв электролита и заключенного между электродами, расположенными на расстоянии 1см друг от друга.
λV = χ / С или λV = χ / V (62)
λV — эквивалентная электропроводность
χ — удельная электропроводность
С- концентрация
V- разведение (или разбавление), выраженное в литрах.
Разбавление есть величина обратная концентрации, т е
V= 1/С (63)
Разбавление, при котором достигается предельное значение эквивалентной электропроводности слабых электролитов, бесконечно велико и соответствующая этому разбавлению электропроводность принято называть эквивалентной электропроводностью при бесконечном разбавлении λ∞. В предельно разбавленных растворах абсолютные скорости движения ионов достигают максимального значения. Ф.Кольрауш нашел, что в предельно разбавленном растворе сумма подвижностей катиона и аниона равна эквивалентной электропроводности при бесконечном разбавлении (закон Кольрауша, независимого движения ионов).
λ∞ = λк + λА (64)
Отношение эквивалентной электропроводности при данном разбавлении к эквивалентной электропроводности при бесконечном разбавлении дает значение степени диссоциации:
α= λV / λ∞ (65)
Важно заметить, что для сильных электролитов это отношение дает коэффициент электропроводности:
f= λV / λ∞ (66)
Количество электричества, переносимое ионами, при прохождении через раствор электрического тока, зависит от абсолютной скорости движения ионов. Доля электричества, которая переносится катионом, принято называть числом переноса катиона:
nk =Vk / Vk + VA (67)
Vk — абсолютная скорость движения катиона,
VA – абсолютная скорость движения аниона,а доля электричества, переносимая анионом, принято называть числом переноса аниона:
nА =VА / Vk + VA (68)
Отношение расстояния между электродами к площади поперечного сечения электродов для данного сосуда является величиной постоянной, называемой константой емкости сосуда К
Кс = χ · R
Читайте также
ЭЛЕКТРОМАГНИТНЫЕ СВОЙСТВА ГОРНЫХ ПОРОД Тепловое расширение и термические напряжения в горных породах Нагревание тел приводит не только к увеличению кинетической энергии колебания частиц, но и сопровождается совершением внешней… [читать подробнее].
Для того, чтобы вещество обладало электропроводностью, оно должно содержать свободные носители заряда. Такими носителями заряда в металлах являются электроны, а в полупроводниках –электроны и дырки. Рассмотрим электропроводность собственных полупроводников, т.е…. [читать подробнее].
Если в полупроводник внести примесь, то он будет обладать помимо собственной электропроводности еще и примесной. Примесная электропроводность может быть электронной или дырочной. В качестве примера рассмотрим случай, когда в чистый германий (четырехвалентный… [читать подробнее].
Если в полупроводник внести примесь, то он будет обладать помимо собственной электропроводности еще и примесной. Примесная электропроводность может быть электронной или дырочной. В качестве примера рассмотрим случай, когда в чистый германий (четырехвалентный… [читать подробнее].
Растворы электролитов являются проводниками второго рода, в которых заряд переносится ионами: в отличие от проводников первого рода (металлы) с электронной проводимостью. Движение ионов в растворе электролита при прохождении через электролит электрического тока… [читать подробнее].
В газовой среде при нормальных условиях практически отсутствуют свободные заряды и она не проводит электрический ток, её молекулы нейтральны. Прохождение тока через газы возможно при ионизации последних, например, рентгеновским излучением. При этом процесс называется… [читать подробнее].
Хотя для понимания свойств электролитов удельная электропроводность представляет собой малоудобную величину, зато ее можно измерить непосредственно и затем пересчитать в эквивалентную электропроводность &… [читать подробнее].
ЛЕКЦИЯ 8 Пиктограммы услуг в гостиницах Удельная и эквивалентная электропроводность, их зависимость от концентрации для сильных и слабых электролитов. Подвижность ионов. Закон независимости движения ионов Кольрауша, предельная эквивалентная… [читать подробнее].
При наложении разности потенциалов к раствору, ионы находившиеся в непрерывном хаотическом тепловом движении, приобретают направленное движение от одного полюса к другому: катионы и анионы движутся в противоположных направлениях – возникает электрический ток. Так как… [читать подробнее].
При наложении разности потенциалов к раствору, ионы находившиеся в непрерывном хаотическом тепловом движении, приобретают направленное движение от одного полюса к другому: катионы и анионы движутся в противоположных направлениях – возникает электрический ток. Так как… [читать подробнее].
referatwork.ru
Электропроводность — Справочник химика 21
Глава 4. Электропроводность растворов электролитов
Опытами установлено, что способность топлива подвергаться электризации при перекачке находится в зависимости от его электропроводности чем меньше электропроводность топлива, тем легче накапливается заряд статического электричества и тем медленнее он рассеивается. Кроме этого, на скорость образования статического электричества влияют эксплуатационные факторы скорость перекачки, присутствие в топливе механических примесей, воды, воздуха, условия хранения, температура и др. Чем больше скорость перекачки, тем сильнее электризуется топливо (табл. 50). Чем дольше перекачивать топливо, тем оно сильнее электризуется. Большое влияние на электризацию топлив оказывают также механические примеси и пузырьки воздуха чем их больше, тем сильнее электризуется топливо. Растворенная или диспергированная в топливе вода значительно увеличивает образование статического электричества. Однако вода, находящаяся на дне емкости в виде отдельного слоя, или не оказывает никакого влияния на скорость образования статического электричества, или способствует уменьшению его. [c.231]
Измерение электропроводности растворов [c.106]
Т а 6 л и ц а I 2, Степень электролитической диссоциации H I по данным измерений электропроводности (ui) и э.д.с. (о.з) [c.43]
Говоря об открытии и изучении электролитической диссоциации, нельзя забывать о работах прибалтийского ученого Теодора Гротгуса (1785—1822). В 1805 г. он развил теорию электропроводности растворов, в 1818 г. предложил теорию состояния молекул (ионов) в растворе. В этой теории он развил представление о том, что атомы вещества могут приобретать электрические заряды и что свойства таких атомов отличны от свойств атомов нейтральных. Биографию Т. Гротгуса см.1 Страдынь Я- П. Теодор Гротгус. 1785—1822.—М. Наука, 1966, 184 с. [c.184]
При добавлении в топливо незначительного количества веществ, повышающих электропроводность (соли щелочных металлов и др.), скорость образования статического электричества резко падает, а Б некоторых случаях полностью устраняется. Вместе с тем добавление к топливу углеродистых веществ (асфальта, нефтяного битума) в незначительных количествах (0,005—0,0005%) повышает способность топлива образовывать статическое электричество во время перекачки. [c.231]
Напомним, что электрические заряды в растворах переносятся ионами, и поэтому чем больше в растворе ионов и чем быстрее они движутся, тем больше будет электропроводность раствора, и наоборот. [c.194]
Пример. Столб воздуха в течение ОВ должен быть электропроводным, чтобы отводить молнию, и дол- [c.195]
Эта формулировка наводит на ответ столб воздуха должен быть электропроводным при разряде молнии и должен быть неэлектропроводным в остальное время. Разряд молнии сравнительно редкое явление, к тому же очень быстро проходящее. Закон согласования ритмики периодичность появления молниеотвода должна быть та же, что и периодичность появления молнии. [c.196]
Пример. В столбе воздуха (при разряде молнии) должны быть свободные заряды, чтобы обеспечить электропроводность (для отвода молнии), и не должны быть (в остальное время) свободные заряды, чтобы не было электропроводности (из-за которой поглощаются радиоволны). [c.196]
Смешанные проводники — тела, сочетающие электронную и ионную проводимости, например растворы щелочных и щелочноземельных металлов в жидком аммиаке, некоторые твердые соли. Их электропроводность, а также знак температурного коэффициента проводимости зависят от состава проводника и температуры (от относительного вклада электронной и ионной составляющих), изменяясь от значений, характерных для чисто ионных проводников, до значений, присущих металлам. [c.103]
Электропроводность электролита, так же как и его молярную электропроводность, можно выразить через ионные электропроводности [c.105]
Ионные электропроводности обычно различны, и вклад каждого вида ионов в перенос тока неодинаков доля тока, переносимая [c.105]
Уменьшение коррозии при введении ингибиторов может произойти в двдствйе» торможения анодного процесса ионизации металла (анодные ингибиторы), катодного процесса деполяризации катодные ингибиторы), обоих процессов одновременно (смешанные анодно-катодные ингибиторы) ч- и увеличения омического сопротивления системы при образовании на металлической поверхнооти сорбционной плёнки, обдадающей пониженной электропроводностью . у. [c.59]
Степень электролитической диссоциации а, определяющая долю ионизироваиных молекул в данном растворе, должна быть при заданных условиях одной и той >1се (независимо от метода ее измерения), причем в согласии с ее 4 изическим смыслом она не может быть бо.льше единицы и меньше гуля. Насколько хорошо это согласуется с опытом, видно нз табл. ], 1, где для ряда электролитов дано сопоставление величин а, найденных при помощи измерения их осмотического давления и электропроводности. [c.42]
Нитрид бора обладает низкой электропроводностью и высокой термической стабильностью. При высоких температурах он окисляется и образует окись бора В2О3, которая также является хорошей смазкой. Коэффициент трения у него более высок, чем у графита и двусернистого молибдена. [c.206]
В методах электрохимического анализа сохраняется обычный иринцин титриметрических определений (см. выше), но момент окончания соответствующей реакции устанавливают либо путем измерения электропроводности раствора [кондуктометрический метод), либо путем измерения потенциала того или иного электрода, погруженного в исследуемый раствор потенциометрический метод), и нр. К электрохимическим методам относится и так назы-вгемый полярографический метод. В этом методе о количестве огределяемого элемента (иона) в исследуемом растворе судят по вольт-амнерной кривой (или нолярограмме ), получаемой при электролизе исследуемого раствора в особом приборе — поляро-графе. [c.13]
В таких случаях точку эквивалентности иногда фиксируют по изменению некоторых физических свойств раствора при титровании. На этом принципе основаны электротитриметричес-кне методы анализа. Таковы, например, кондуктометрический метод, при котором точку эквивалентности находят, измеряя электропроводность раствора, потенциометрический метод, основанный на измерении окислительно-восстановительного потенциала раствора, и др. [c.194]
При этом титровании Н -иоиы соляной кислоты постепенно связываются ОН -ионами щелочи с образованием неионизированных молекул воды, а в растворе накапливаются Na -ионы щелочи, замещая таким образом И+-ионы. Но так как скорость движения Н при электролизе значительно больше, чем скорость движения Na , указанное замещение понижает электропроводность раствора . В точке эквивалентности все Н+-ионы соляной кислоты окажутся замещенными На+-ионами, и электропроводность раствора будет иметь наименьшую величину. При добавлении же избытка щелочи она будет снова возрастать [c.194]
Ну, а дальше — всевозможные добавки, отзывчивые к действию магнитного или электрического полей, и вода становится водой , приобретая новые свойства и функции. Скажем, по а. с. 931959 шланг, заполненный феррожидкостью, используют как рабочий орган насоса. А плоскую гибкую оболочку, заполненную электрорео-логической жидкостью,— как щит опалубки (а. с. 883524). Вода и кирпич постепенно сближаются по устройству и свойствам. Трудно, например, сказать, чего больше — кирпича или воды — в структуре по а. с. 934143 Шланг, содержащий внутренний и наружный слой, между которыми расположены слои электропроводных нитей, разделенных между собой слоем гибкого изоляционного материала, отличающийся тем, что, с целью возможности управления жесткостью, гибкий изолирующий материал выполнен пористым и пропитан электрореологической суспензией . [c.117]
Задача 9.3. Схема электроконтактной наплавки проста. На поверхности заготовки (допустим, это вал, диаметр которого надо увеличить) размещают присадочную проволоку и прижимают ее электродом-роликом. Заготовку и ролик врашают, подводя к ним импульсы тока, расплавляющие проволоку. При многих достоинствах способ имеет существенный недостаток — быстро возникают дефекты поверхности ролика (подплавленные участки, раковины и т. д.). Приходится прерывать процесс, менять ролик. Расходуются ролики быстро, поэтому их необходимо восстанавливать. Для этого с ролика снимают стружку, а затем обновляют рабочую часть поверхности, напрессовывая электропроводный материал. Восстановленный таким образом ролик имеет весьма ограниченный срок службы из-за сравнительной непроч- [c.160]
Вернемся теперь к задаче 9.3. Ролик покрыт тонким и легко деформирующимся слоем электропроводного материала. Идеально было бы после каждого оборота — на ходу — снимать деформированный слой и наносить новый слой ровный, неде рмированный. Два противоположных действия, для выполнения которых нужен инверсный биэффект электролитическое растворение и электролитическое же осаждение (а. с. 872165). При решении этой задачи часто выходят на идею электролиза. И останавливаются перед психологическим барьером электролитическое осаждение металла на неровную поверхность только увеличит степень ее неровности. Весь фокус в том, что нужен эффект-антиэффект сначала удаление неровностей, потом нанесение нового слоя. [c.165]
На основе представлений об электролитической диссоциации были созданы теории электропроводности и диффузии в растворах электролитов, разработана осмотическая теория возпикновения э.д.с. и т. д. [c.36]
В табл. 1.2 приведены значения (I для растворов соляной кислоты, вычисленные на основанин измерений электропроводности (ai) и э. д. с. (аз). Расхождение между значениями а, полученное этими методами, тоже увеличив,а-ется по мере возрастания концентрации электролита, причем в области высоких коицентрацин аз становится больню единицы. [c.43]
В отличие от стеиени электролитической диссоциации коэффициенты активности, полученные различными методами, совпадают друг с другом (табл. 3.5). Поправочные коэффициенты, отражающие эффект взаимодействия в неравиовеспых условиях (иапример, при явлениях электропроводности или диффузии), для тех же растворов будут ины.ми. [c.79]
Проводники П рода, или ионные проводники,—вещества, в которых ток иереносптся ионами. К ним относятся многие твердые соли (Ю р Ю Ом-м), ионные расплавы (1() Температурный коэффициент электропроводности иончых проводников положителен. [c.103]
В электрохимической литературе широко используется молярная (молекуля рная) электропроводность Я, связанная с электропроводностью раствора х соотношением [c.104]
Когда в растворе присутствует больше чем два вида ионов, т. е. не бинарные, а тернарные, кватернаргые и другие сложные электролиты или смеси любых электролитов, электропроводность определяется уравнением [c.105]
Г г1КЦИП1.1 ЭКСПЕРИМЕНТАЛЬНОГО ОПРЕДЕЛЕНИЯ ЭЛЕКТРОПРОВОДНОСТИ РАСТВОРОВ ЭЛЕКТРОЛИТОВ [c.106]
Электропроводность электролитов обычно определяется при помощи мостовой схемы, используемой для измерения сопротивления проводников I рода. В случае растворов электролитов применяют мосты, работающие на переменном токе, пак как прохождение постоянного тока через растворы приводит к значительным ошибкам, связанным с явлениями электролиза и поляризации (изменение состава ])аствора вблизи электродов, изменение состояния электродов, налолэлектродной поляризации на подаваемое папряженне н т. д.). Необходимость применения переменного тока достаточно высокой частоты (для избежания указанных ошибок) усложняет измерительную схему. Кроме моста она содержит генератор неременного тока, а также специальные устройства для выпрямления тока перед прохождением его через нуль-инструмеи и для компенсации емкостных эффектов. Современные установки по измерению электропроводности электролитов, и которых учтены все особенности проводников II рода, позволяют получать надежные результаты. [c.106]
Определение ионных подвижносгей. Опытные данные по электропроводности и числам переноса можно использовать для вычисления ионных подвижностей. Из уравнения (4,18) следует, что для 1 — 1-зарядного электролита [c.109]
Введение в современную теорию растворов (1976) — [ c.162 , c.169 ]
Коллоидная химия 1982 (1982) — [ c.0 ]
Краткий курс физической химии (1979) — [ c.108 ]
Физическая химия (1987) — [ c.193 ]
Учебник общей химии (1981) — [ c.0 ]
Химия (1978) — [ c.307 ]
Курс коллоидной химии (1976) — [ c.0 ]
Перекись водорода и перекисные соединения (1951) — [ c.2 , c.55 ]
Общая химия (1979) — [ c.129 , c.169 , c.266 , c.391 ]
Краткий справочник физико-химических величин (1974) — [ c.0 ]
Физическая химия (1978) — [ c.343 , c.588 ]
Цеолитовые молекулярные сита (1974) — [ c.102 , c.405 , c.418 , c.422 , c.472 , c.593 ]
Органические растворители (1958) — [ c.44 ]
Химия твердого тела Теория и приложения Ч.2 (1988) — [ c.2 , c.5 , c.39 , c.50 , c.59 , c.65 , c.82 , c.102 , c.265 ]
Физико-химические основы производства радиоэлектронной аппаратуры (1979) — [ c.61 , c.72 , c.74 , c.85 , c.93 , c.99 , c.103 , c.138 , c.144 ]
Химия и периодическая таблица (1982) — [ c.70 ]
Основы аналитической химии Часть 2 Изд.2 (2002) — [ c.190 ]
Справочник химика Том 3 Изд.2 (1965) — [ c.0 ]
Краткий химический справочник Ч.1 (1978) — [ c.0 ]
Справочник Химия изд.2 (2000) — [ c.166 ]
Основы физико-химического анализа (1976) — [ c.49 , c.57 , c.80 , c.85 , c.137 , c.139 ]
Практикум по физической химии изд3 (1964) — [ c.0 ]
Химия справочное руководство (1975) — [ c.478 , c.480 ]
Методы измерения в электрохимии Том2 (1977) — [ c.0 ]
Электрохимия растворов (1959) — [ c.4 , c.12 , c.13 , c.22 , c.27 , c.32 , c.34 , c.38 , c.191 , c.206 , c.216 , c.220 , c.221 , c.231 , c.232 , c.269 , c.497 , c.503 , c.522 ]
Методы сравнительного расчета физико — химических свойств (1965) — [ c.79 , c.80 , c.101 , c.103 , c.105 , c.183 ]
Краткий курс физической химии Изд5 (1978) — [ c.0 ]
Физико-химические методы анализа Изд4 (1964) — [ c.347 , c.367 ]
Практические работы по физической химии (1961) — [ c.0 ]
Современная аналитическая химия (1977) — [ c.405 ]
Водородная связь (1964) — [ c.35 ]
Учебник физической химии (1952) — [ c.251 , c.257 ]
Равновесия в растворах (1983) — [ c.168 , c.169 ]
Теории кислот и оснований (1949) — [ c.0 ]
Комплексообразование в растворах (1964) — [ c.256 ]
Современные и перспективные углеводородные реактивные и дизельные топлива (1968) — [ c.0 ]
Современная общая химия Том 3 (1975) — [ c.2 , c.3 , c.9 , c.22 , c.97 , c.98 , c.303 ]
Общая химия (1964) — [ c.21 ]
Курс неорганической химии (1963) — [ c.86 ]
Перекись водорода (1958) — [ c.0 ]
Физическая химия силикатов (1962) — [ c.69 ]
Физическая химия Термодинамика (2004) — [ c.181 ]
Нестехиометрические соединения (1971) — [ c.255 , c.271 , c.272 ]
Курс химии Часть 1 (1972) — [ c.198 ]
Общая химия и неорганическая химия издание 5 (1952) — [ c.145 , c.152 ]
Курс общей химии (1964) — [ c.108 , c.111 ]
Свойства редких элементов (1953) — [ c.69 , c.87 , c.94 , c.124 , c.214 , c.337 ]
Явления переноса в водных растворах (1976) — [ c.13 ]
История органической химии (1976) — [ c.132 , c.133 , c.142 ]
Теоретическая электрохимия (1965) — [ c.0 ]
Теоретическая электрохимия Издание 2 (1969) — [ c.88 , c.104 ]
Теоретическая электрохимия Издание 3 (1975) — [ c.97 , c.98 , c.101 ]
Курс теоретической электрохимии (1951) — [ c.0 ]
Теоретическая электрохимия (1959) — [ c.0 ]
Инструментальные методы химического анализа (1960) — [ c.12 ]
Качественный анализ (1951) — [ c.53 ]
Качественный анализ 1960 (1960) — [ c.53 ]
Курс качественного химического полумикроанализа 1962 (1962) — [ c.79 ]
Техно-химические расчёты Издание 2 (1950) — [ c.349 ]
Краткий справочник по химии (1965) — [ c.670 ]
Справочник полимеров Издание 3 (1966) — [ c.28 , c.516 ]
Общая химическая технология неорганических веществ 1964 (1964) — [ c.308 , c.315 , c.350 ]
Общая химическая технология неорганических веществ 1965 (1965) — [ c.308 , c.315 , c.350 ]
Общая и неорганическая химия (1981) — [ c.245 ]
Краткий инженерный справочник по технологии неорганических веществ (1968) — [ c.0 ]
Учебник общей химии 1963 (0) — [ c.0 ]
Производство хлора и каустической соды (1966) — [ c.0 ]
Физико-химия полимеров 1963 (1963) — [ c.246 , c.251 , c.274 ]
Методы аналитической химии Часть 2 (0) — [ c.0 ]
Термическая фосфорная кислота, соли и удобрения на ее основе (1976) — [ c.0 ]
Технология содопродуктов (1972) — [ c.188 , c.189 , c.199 ]
Кристаллизация каучуков и резин (1973) — [ c.79 ]
Машинный расчет физико химических параметров неорганических веществ (1983) — [ c.0 ]
Инструментальные методы химического анализа (1960) — [ c.12 ]
История органической химии (1976) — [ c.132 , c.133 , c.142 ]
Графит и его кристаллические соединения (1965) — [ c.0 ]
Общая химия (1974) — [ c.455 , c.506 ]
Кристаллография (1976) — [ c.215 ]
Эмульсии (1972) — [ c.0 , c.318 , c.334 ]
Современная общая химия (1975) — [ c.2 , c.3 , c.9 , c.22 , c.97 , c.98 , c.303 ]
Теоретическая электрохимия Издание 3 (1970) — [ c.0 ]
Производство серной кислоты Издание 3 (1967) — [ c.0 ]
Пластификация поливинилхлорида (1975) — [ c.91 , c.184 , c.187 ]
Инструментальные методы химического анализа (1989) — [ c.380 ]
Химия полисопряженных систем (1972) — [ c.38 , c.39 ]
Промышленные полимерные композиционные материалы (1980) — [ c.284 , c.303 , c.311 ]
Химия и радиоматериалы (1970) — [ c.77 ]
Производство серной кислоты Издание 2 (1964) — [ c.0 ]
Физическая и коллоидная химия (1957) — [ c.126 , c.131 ]
Получение и свойства поливинилхлорида (1968) — [ c.286 ]
Химико-технический контроль и учет гидролизного и сульфитно-спиртового производства (1953) — [ c.66 , c.67 , c.68 , c.69 , c.70 ]
Применение электронных приборов и схем в физико-химическом исследовании (1961) — [ c.233 ]
Современные электронные приборы и схемы в физико-химическом исследовании Издание 2 (1971) — [ c.0 ]
Основы физической и коллоидной химии Издание 3 (1964) — [ c.0 ]
Кинетика гетерогенных процессов (1976) — [ c.77 ]
Тепло и термостойкие полимеры (1984) — [ c.184 ]
Физико-химические методы анализа Издание 3 (1960) — [ c.290 ]
Физико-химические методы анализа Издание 4 (1964) — [ c.347 , c.367 ]
Справочник сернокислотчика Издание 2 1971 (1971) — [ c.0 ]
Краткий справочник химика Издание 6 (1963) — [ c.0 ]
Краткий справочник физико-химических величин Издание 6 (1972) — [ c.0 ]
Краткий справочник физико-химических величин Издание 7 (1974) — [ c.0 ]
Технология серной кислоты (1985) — [ c.0 ]
Практикум по физической химии (1950) — [ c.0 ]
Курс физической химии Том 2 Издание 2 (1973) — [ c.0 ]
Физико-химический анализ гомогенных и гетерогенных систем (1978) — [ c.25 ]
Химическая стойкость полимеров в агрессивных средах (1979) — [ c.105 , c.134 ]
Химия несовершенных ионных кристаллов (1975) — [ c.34 , c.37 , c.46 , c.53 ]
Введение в физическую химию и кристаллохимию полупроводников (1968) — [ c.0 ]
Введение в физическую химию и кристаллохимию полупроводников Издание 2 (1973) — [ c.10 , c.11 , c.55 , c.386 , c.401 , c.403 , c.403 , c.523 , c.523 , c.525 , c.525 , c.556 , c.556 , c.557 ]
Как квантовая механика объясняет химическую связь (1973) — [ c.0 ]
Неорганическая химия Том 1 (1971) — [ c.27 , c.29 ]
Введение в химию полупроводников Издание 2 (1975) — [ c.0 ]
Учебник физической химии (0) — [ c.268 ]
Перемешивание в химической промышленности (1963) — [ c.251 ]
Справочник по производству хлора каустической соды и основных хлорпродуктов (1976) — [ c.88 ]
Курс качественного химического полумикроанализа (1950) — [ c.0 ]
Карбониевые ионы (1970) — [ c.334 , c.359 ]
Химия изотопов (1952) — [ c.20 , c.175 ]
Химия изотопов Издание 2 (1957) — [ c.278 , c.291 ]
Катализ в химии и энзимологии (1972) — [ c.286 ]
Качественный химический полумикроанализ (1949) — [ c.0 ]
Курс физической химии Издание 3 (1975) — [ c.0 ]
Руководство по аналитической химии (1975) — [ c.103 , c.111 ]
Основы аналитической химии Кн 3 Издание 2 (1977) — [ c.0 ]
Справочное руководство по эпоксидным смолам (1973) — [ c.237 ]
Физическая химия Книга 2 (1962) — [ c.17 , c.60 , c.580 ]
Метод физико-химического анализа в неорганическом синтезе (1975) — [ c.0 ]
Краткий справочник химика Издание 4 (1955) — [ c.0 ]
Основы общей химии Т 1 (1965) — [ c.207 ]
Основы общей химии Том 2 Издание 3 (1973) — [ c.0 ]
Общая химия (1968) — [ c.0 , c.575 ]
Краткий справочник химика Издание 7 (1964) — [ c.0 ]
Курс неорганической химии (1972) — [ c.78 ]
Проблемы физики и химии твердого состояния органических соединений (1968) — [ c.9 ]
Практикум по общей химии (1948) — [ c.0 ]
Практикум по общей химии Издание 2 1954 (1954) — [ c.0 ]
Методы аналитической химии — количественный анализ неорганических соединений (1965) — [ c.0 ]
Анионная полимеризация (1971) — [ c.0 ]
Краткий химический справочник Издание 2 (1978) — [ c.0 ]
Физическая химия неводных растворов (1973) — [ c.0 ]
Химия нитро- и нитрозогрупп Том 1 (1972) — [ c.0 ]
Термодинамика необратимых процессов (1956) — [ c.86 ]
Структура и симметрия кристаллов (0) — [ c.213 , c.259 ]
Физическая химия Издание 2 1967 (1967) — [ c.0 ]
Справочник химика Издание 2 Том 1 1963 (1963) — [ c.0 , c.937 , c.940 , c.941 , c.943 ]
Справочник химика Том 1 Издание 2 1962 (1962) — [ c.0 , c.937 , c.940 , c.941 , c.943 ]
Справочник химика Том 1 Издание 2 1966 (1966) — [ c.0 , c.937 , c.940 , c.941 , c.943 ]
Справочник химика Том 3 Издание 2 (1964) — [ c.0 ]
Краткий химический справочник (1977) — [ c.0 ]
Практикум по физической химии Изд 3 (1964) — [ c.0 ]
Практикум по физической химии Изд 4 (1975) — [ c.0 ]
Практические работы по физической химии Изд4 (1982) — [ c.0 ]
Физическая химия (1967) — [ c.384 , c.390 ]
Технология серной кислоты (1950) — [ c.0 ]
Основы общей химии том №1 (1965) — [ c.207 ]
Теоретические основы органической химии Том 2 (1958) — [ c.258 , c.259 , c.552 , c.553 ]
Эмульсии, их теория и технические применения (1950) — [ c.308 ]
Справочник по физико-техническим основам криогенетики Издание 3 (1985) — [ c.150 ]
Основы переработки пластмасс (1985) — [ c.85 , c.95 ]
Справочник по физико-техническим основам глубокого охлаждения (1963) — [ c.134 , c.140 ]
Справочник химика Изд.2 Том 1 (1962) — [ c.0 , c.937 , c.940 , c.941 , c.943 ]
Справочник химика Изд.2 Том 3 (1964) — [ c.0 ]
Защита от коррозии на стадии проектирования (1980) — [ c.30 , c.45 , c.46 , c.300 , c.353 ]
chem21.info
ЭЛЕКТРОПРОВОДНОСТЬ ЭЛЕКТРОЛИТОВ — это… Что такое ЭЛЕКТРОПРОВОДНОСТЬ ЭЛЕКТРОЛИТОВ?
, способность электролитов проводить электрич. ток при приложении электрич. напряжения. Носителями тока являются положительно и отрицательно заряженные ионы — катионы и анионы, к-рые существуют в р-ре вследствие электролитич. диссоциации. Ионная Э. э., в отличие от электронной, характерной для металлов, сопровождается переносом в-ва к электродам с образованием вблизи них новых хим. соед. (см. Электролиз). Общая (суммарная) проводимость состоит из проводимости катионов и анионов, к-рые под действием внешнего электрич. поля движутся в противоположных направлениях. Доля общего кол-ва электричества, переносимого отд. ионами, наз. числами переноса, суммак-рых для всех видов ионов, участвующих в переносе, равна единице.
Количественно Э. э. характеризуют эквивалентной электропроводностью — проводящей способностью всех ионов, образующихся в 1 грамм-эквиваленте электролита. Величина связана с уд. электропроводностью соотношением:
где с — концентрация р-ра в г-экв/л. Эквивалентная электропроводность зависит от природы растворенного в-ва и р-рителя, структуры р-ра, а также от концентрации, т-ры, давления. Предельно разбавленному р-ру, в к-ром все молекулы диссоциированы на ионы, соответствует предельное значение В соответствии с Кольрауша законом равна сумме эквивалентных электропроводностей катионов и анионов. Эквивалентная электропроводность отд. иона пропорциональна скорости его движения в р-ре и характеризует подвижность иона в р-ре.
Описание концентрац. зависимости как и других св-в р-ров электролитов (см. Растворы электролитов), обычно базируется на ионном подходе, в рамках к-рого р-ритель рассматривается как бесструктурная диэлектрич. среда, в к-рой ионы движутся в соответствии с законами гидродинамики и характером межионного взаимодействия. Простейшей моделью является модель заряженных твердых сфер, движущихся в вязком р-рителе под влиянием силы, обусловленной градиентом потенциала. При этом сила сопротивления движению иона в р-ре определяется ур-нием Стокса (см. Вискозиметрия). В рамках применимости этого ур-ния выполняется правило Вальдена-Писаржевского, в соответствии с к-рым для одного и того же электролита в любых р-рителях произведение предельного значения эквивалентной электропроводности на вязкость р-рителя является постоянной величиной, к-рая не зависит от природы р-рителя, но является ф-цией т-ры. Сравнительно хорошо это правило выполняется только для слабо сольватир. ионов, в частности ионов, имеющих большие размеры в кристаллич. фазе. С увеличением концентрации значение уменьшается в осн. в р-рах слабых электролитов и в области малых концентраций удовлетворительно описывается законом разведения Оствальда (см. Электролитическая диссоциация).
В р-рах сильных электролитов концентрац. зависимость определяется межионным взаимодействием. В области применимости Дебая-Хюккеля теории имеются две причины для торможения ионов вследствие межионного взаимодействия. Первая из них связана с тем, что движение иона тормозится ионной атмосферой, к-рая имеет заряд, противоположный центральному иону, и под влиянием поля движется в направлении, противоположном перемещению иона (электрофоретич. эффект). Вторая причина связана с тем, что при движении иона под действием электрич. поля его ионная атмосфера деформируется и теряет сферич. симметрию, причем большая часть заряда ионной атмосферы концентрируется позади центрального иона (релаксац. эффект). Учет обоих эффектов приводит кур-нию Онсагера:
где Аи В — эмпирич. постоянные, являющиеся ф-циями т-ры, вязкости и диэлектрич. проницаемости р-рителя.
Как и теория Дебая-Хюккеля, ур-ние Онсагера ограничено областью умеренно разбавленных р-ров. Для описания концентрир. р-ров возникает необходимость в учете некулоновской части межионного взаимод., в частности в учете ионных размеров. Для этой цели применяют методы кинетич. теории ионных систем. К дополнит. уменьшению приводит образование ионных ассоциатов — пар, тройников и т. п., к-рое, как и эффект неполной диссоциации, сокращает общее число своб. ионов в р-ре. Для учета этого эффекта в ур-нии Онсагера заменяют общую концентрацию ионов концентрацией своб. ионов (- степень электролитич. диссоциации), что приводит к ур-нию Фуосса-Онсагера:
В переменных электрич. полях при достаточно высокой частоте ион не уходит далеко от центра ионной атмосферы, вследствие чего она не деформируется. Обусловленный деформацией релаксац. эффект не возникает, что приводит к увеличению -т. наз. эффект Дебая-Фалькенхагена. Величина возрастает также в постоянных электрич. полях достаточно высокой напряженности (104-105 В/см). В этих условиях ионы движутся настолько быстро, что ионная атмосфера не успевает образоваться, вследствие чего практически отсутствуют и релаксац. и электрофоретич. эффекты. В результате стремится к предельному значению (т. наз. эффект Вина). В слабых электролитах эффект Вина вызывается также смещением диссоциативного равновесия в сильном электрич. поле в сторону образования ионов.
Влияние т-ры и давления на Э. э. обусловлено изменением предельного значения вследствие изменения структуры р-рителя и характера ион-молекулярного взаимод., изменения влияния межионного взаимод. и смещения диссоциативного равновесия. Более детальное описание механизма Э. э. в широкой области концентраций, т-р и давлений возможно в рамках ион-молекулярного подхода. При этом уд. электропроводность рассчитывают через электрич. поток j(t)= и автокорреляц. ф-цию с помощью соотношения:
где — кол-во ионов электролита в единице объема р-ра, е — элементарный электрич. заряд, — приведенная масса катиона и аниона, a -> степень окисления иона сорта физико-химического анализа, поскольку зависимость Э. э. от состава р-ра позволяет судить о концентрации солей, качественный, состав к-рых известен (см. также Кондуктометрия). Измерения l используют для определения подвижностей ионов.
Лит.: Скорчеллетти В. В., Теоретическая электрохимия, 4 изд., Л., 1974; Измайлов Н. А., Электрохимия растворов, 3 изд., М., 1976; Эрдеи-Груз Т., Явления переноса в водных растворах, пер. с англ., М., 1976. См. также лит. к ст. Растворы электролитов.
М. Ф. Головко.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
dic.academic.ru
Электрохимия Электропроводность растворов — Справочник химика 21
Учение об электропроводности растворов обычно не включается в этот раздел, хотя формально оно является частью электрохимической кинетики, если учение об электролитах считать частью электрохимии, а не учения [c.606]Электрохимия изучает некоторые особенности свойств растворов электролитов, электропроводность растворов, процессы электролиза, работу гальванических элементов и электрохимическую коррозию металлов. [c.23]
Значительный вклад в развитие электрохимии внесли также русские ученые. В. В. Петров (1761—1834) изучал электропроводность растворов, химические действия электрического тока, электрические явления в газах и т. п. С помощью созданного им крупнейшего для того времени химического источника тока в 1802 г. он открыл электрическую дугу. Б. С. Якоби (1801—1874) в 1834 г. изобрел электродвигатель, работавший на токе от химического источника. В 1838 г. он предложил гальванопластический метод (см. разд. У.П). П. Н. Яблочков (1848—1914) изобрел электродуговую лампу (1875 г., свеча Яблочкова ), работал над созданием химических источников тока, выдвинул (1877 г.) идею создания топливного элемента (см. разд. А.12). Н. А. Изгарышев (1884—1956) развил теорию химического источника тока, работал над проблемой защиты металлов от коррозии, открыл явление пассивности металлов в неводных растворах электролитов, и по праву считается одним из основателей электрохимии неводных растворов. А. Н. Фрумкин (1895—1971) разрабатывал вопросы кинетики электрохимических процессов, развил теорию строения двойного электрического слоя. [c.233]
Электрохимия. Изучает взаимосвязь химических и физических процессов в растворах с электрическими явлениями. Делится в свою очередь на изучение электропроводности растворов и изучение электродвижущих сил, т. е. возникновения разности потен-. циалов при химических процессах. [c.6]
Можно отметить два больших раздела электрохимии учение об электропроводности растворов электролитов и учение об электродвижущих силах. [c.344]
Электрохимия рассматривает электропроводность растворов, работу гальванических элементов, процессы электролиза. [c.255]
В книге рассмотрены основные понятия электрохимии и современные методы исследования кинетики электродных процессов. Описаны классические и релаксационные методики изучения электродной поляризации. Представлены специальные и вспомогательные приборы, применяемые в электрохимических исследованиях. Уделено внимание особенностям лабораторного эксперимента. В задачах установлены закономерности фарадеевских реакций, электропроводности растворов, чисел переноса, э. д, с. элементов, электрокапиллярных явлений и строения двойного электрического слоя, диффузионной кинетики и полярографии, механизма образования на электродах новой фазы, пассивности и коррозии металлов. [c.2]
Развитие отечественной электрохимии началось с выдающихся исследований В. В. Петрова по электролитическому разложению воды и других жидкостей (1801 г.). Он же впервые получил металлы электролизом их окислов. Вскоре (1805 г.) Ф. Ф. Гротгус разработал теорию электропроводности растворов (переход протонов от ионов к молекулам воды). Наряду с этим он заметил, что … расщепление молекул. .. происходит до всякого действия электрического тока (1818 г.). В этом предположении содержится предвидение основных идей теории электролитической диссоциации. [c.7]
Наиболее четко позиции Киевской электрохимической школы были сформулированы в докторский диссертации В. А. Плотникова Исследования по электрохимии неводных растворов , в которой отрицается идея классификации растворителей, основанная на диссоциирующей способности . В качестве основного условия образования электролитного раствора В. А. Плотников выдвинул химическое взаимодействие между компонентами раствора. Разделяя этот основной тезис химической теории растворов, В. А. Плотников широко использует весь арсенал методов физической теории растворов и именно это позволило ему решить основную проблему теории электролитных растворов того времени, дав в высшей степени убедительное и очевидное объяснение так называемым аномальным кривым электропроводности. [c.174]
Начало изучению электропроводности неводных растворов было положено работой И, А. Каблукова [Об электропроводности хлористого водорода и серной кислоты в различных растворителях, ЖРФХО, 22, отд. I, 79 (1890)] затем оно продолжалось в работах других советских ученых [А. И. Бродский, Ф. Трахтенберг, ДАН, 2, 490 (1934) В. А. Плесков, ЖФХ, 10, 601 (1938)1. В связи с этим большое значение имели также работы В. А. Плотникова (Исследования по электрохимии неводных растворов, Киев, 1908) и его учеников по изучению ионогенных комплексных соединений, способных электролитически диссоциировать в данной системе и обнаруживаемых методами физико-химического анализа [М. И. Усанович, Сборник, посвященный юбилею В. А. Плотникова, Киев, 1935 Я. А. Ф и а л к о в, Успехи химии, 15, 485 (1947) Е. Я. Г о р е н б е й н, ЖФХ, 20, вып. 6, 547 (1946)]. (Прим. ред.) [c.167]
Используя данные таких таблиц, включенных в справочники по электрохимии, а также приведенное выше выражение, можно рассчитать электропроводность любого раствора. Полученная точность в большинстве случаев достаточна для оценки экспериментальных условий, необходимых для проведения измерений. Такие расчеты полезны также для предсказания изменений электропроводности, которые могут наблюдаться в ходе титрования. Электропроводность раствора может заметно изменяться в ходе титрования в связи с добавлением или уда- [c.406]
В дальнейшем изучению этой зависимости менаду электропроводностью и вязкостью растворов, проявляющейся именно в органических растворителях, занимались многие химики, из которых в первую очередь следует упомянуть Вальдена (1906 г. и далее). Изучая электропроводность иодистого тетраэтиламмония в нескольких десятках растворителей, он нашел, что произведение электропроводности на вязкость при бесконечном разбавлении представляет постоянную величину. Вальдену принадлежит также обстоятельное изучение зависимости диссоциации электролитов от диэлектрической постоянной органических растворителей. Полученные результаты были обобщены им в монографии Электрохимия неводных растворов (Лейпциг, 1924 г.). [c.134]
Величина электропроводности растворов имеет большое значение для условий протекания электрохимических процессов. На ее основе возможно сделать рациональный выбор состава электролита, при котором непроизводительные затраты электроэнергии будут минимальными. Знание электропроводности растворов необходимо при составлении энергетических и тепловых балансов электролизеров и химических источников тока. С величиной электропроводности связана рассеивающая способность гальванических ванн, т. е. возможность получения равномерного осадка металла на участках покрываемого изделия, различно удаленных от анода. Однако использование данных по определению электропроводности не ограничивается электрохимией. Кондуктометр и я находит самое разнообразное применение как метод научного исследования, химического анализа и производственного контроля. [c.128]
Величина электропроводности растворов имеет большое значение для протекания электрохимических процессов. На ее основе можно сделать рациональный выбор состава электролита, при котором непроизводительные затраты электроэнергии будут минимальными. Знание электропроводности растворов необходимо при составлении энергетических и тепловых балансов электролизеров и химических источников тока. С величиной электропроводности связана рассеивающая способность гальванических ванн, т. е. возможность получения равномерного осадка металла на участках покрываемого изделия, различно удаленных от анода. Однако использование данных по определению электропроводности не ограничивается только электрохимией. Кондуктометрия находит самое широкое применение как метод химического анализа, производственного контроля и научного исследования. Она обладает рядом преимуществ перед химическими методами анализа, так как позволяет определить содержание индивидуального вещества в растворе простым измерением электропроводности раствора. Для этого нужно только иметь предварительно вычерченную калибровочную кривую зависимости электропроводности от концентрации вещества. Кроме того, в процессе измерения электропроводности анализируемый раствор практически не изменяется, благодаря чему можно проводить повторные измерения и, сохранив его, в любое время проверить полученные результаты. [c.104]
Электрохимия составляет часть физической химии, основоположником которой является великий русский ученый М. В. Ломоносов. Развитие отечественной электрохимии начинается с выдающихся исследований В. В. Петрова по электролитическому разложению воды и других жидкостей (1801). Он же впервые получил металлы при электролизе их окислов. Вскоре после этих открытий (1805) Ф. Ф. Гротгус разработал теорию электропроводности растворов, с помощью которой теперь объясняют электропроводность кислот и щелочей (перескок протонов между ионами и молекулами воды). Наряду с этим Ф. Ф. Гротгус [c.17]
Развитие электрохимии позволило русскому ученому Гротгусу создать первую теорию электропроводности растворов (1806 г.). В основе этой теории лежало представление о цепном расположении положительных и отрицательных полюсов в частицах воды. [c.12]
Электролиз расплавленных солей подчиняется тем же основным законам, которые выведены для электрохимии водных растворов. Ток через расплавленные соли проходит так же, как и в водных растворах электролитов, с помощью ионов, поэтому электролиз солевых расплавов подчиняется законам Фарадея. Электропроводность солевых расплавов при высоких температурах несколько выше, чем электропроводность водных электролитов при комнатной температуре. Положение металлов в ряде напряжений для расплавленных солей [364] и в водных электролитах принципиально мало различается между собой. Как и в водных растворах, наиболее отрицательные значения электродных потенциалов имеют щелочные и щелочноземельные металлы более положительные потенциалы имеют сурьма, висмут, медь, ртуть и серебро. Электродные потенциалы одних и тех же металлов в расплавленных хлоридах, бромидах и йодидах сравнительно мало отличаются. Это объяснимо, если считать, что электродные потенциалы металлов в основном определяются, электронным строением атомов, т. е. положением их в периодической системе элементов Д. И. Менделеева. Как и в водных электролитах, электроосаждение металлов из солевых расплавов протекает с поляризацией, однако степень ее значительно меньше, чем в водных растворах. Электролиз расплавленных солей проводится при высоких температурах в электролизерах, обычно имеющих огнеупорную футеровку, диафрагму, отделяющую анодное пространство от катодного. В ряде случаев необходима герметизация электролизера или защитная атмосфера. [c.102]
Все основные законы электрохимии водных растворов применимы и к расплавленным средам. Однако, отсутствие воды, как растворителя, и высокая температура электролиза вносят в процессы при электролизе расплавленных солей некоторые особенности. Электропроводность расплавленных электролитов выше, чем в водных растворах. Выход же по току, как правило, меньше, что связано, главным образом, с явлением растворимости выделенного на катоде металла в электролите с последующим окислением этого металла на аноде или на поверхности электролита. Выход по току может понижаться также за счет испарения катодного металла или взаимодействия его с материалами футеровки ванн при высоких температурах электролиза. [c.56]
Электрохимия изучает связь между электрической и химической энергией, свойства растворов электролитов, электропроводность растворов, процессы электролиза, работу гальванических элементов, электродные процессы и электрохимическую коррозию металлов. [c.5]
Следует иметь в виду, что величина а, а следовательно, и i зависят от температуры, и поэтому найденный коэффициент Вант-Гоффа имеет смысл только для температуры, при которой выполнены измерения. При переходе от одного растворителя к другому степень диссоциации растворенного вещества изменяется, а следовательно, изменяется и коэффициент Вант-Гоффа. Наиболее точный путь определения а и i — это расчет, основанный на результатах измерения электропроводности растворов. Этот метод рассматривается в электрохимии. [c.99]
Большое значение для аналитической химии имели работы Ивана Алексеевича Каблукова (1857—1942) по исследованию электропроводности растворов. В области электрохимии невод-чых растворов И. А. Каблуков изучил ряд вопросов зависимость степени диссоциации растворенного вещества от свойств [c.29]
Наряду с процессами электролиза электрохимия изучает химические источники электрической энергии, электропроводность растворов, вопросы коррозии металлов, электрохимические способы получения важных для народного хозяйства веществ и т. д. [c.146]
Для незаряженной молекулы в сильноразбавленных растворах коэффициенты активности стремятся к единице однако в случае ионов дело обстоит иначе. Согласно теории сильных электролитов (П. Дебай, Е. Хюккель, 1923.), любой ион в растворе (независимо от того, происходит ли он из сильного или слабого электролита) стремится окружить себя атмосферой разноименных ионов. Это изменяет подвижность иопа (что в свою очередь влияет на электропроводность раствора), а также и его химическое каталитическое действие. Аналогичный эффект производят и посторонние электролиты, добавляемые к раствору, например к буферным растворам (солевые эффекты). Теория сильных электролитов указывает методы работы в условиях, в которых эти эффекты можно контролировать (при постоянной ионной силе) и для оценки коэффициентов активности (см. пособия по электрохимии). [c.212]
Здесь прежде всего должны быть упомянуты исследования по электрохимии неводных растворов галогенидов сурьмы и мышьяка, выполненные В. А. Плотниковым совместно с М. И. Усановичем и О. К. Кудрой. Эти работы позволили установить однозначное соответствие между концентрационной зависимостью электропроводности и составом образующихся в системе комплексных и молекулярных соединений. [c.175]
В книге изложены основы следующих методов кондуктометрии, потен-ииометрии, полярографии, амперометрии, кулоиометрии. Описанию каждого метода предпослана теоретическая часть, где в сжатой форме даны положения электрохимии, относящиеся к данному разделу (электропроводность растворов электролитов, электродные потенциалы, поляризация и электролиз растворов). [c.2]
Обширные исследования электродных потенциалов (а так)](е электропроводности растворов) в жидких аммиаке и двуокиси серы н других неводных растворителях были выполнены советскими учеными [В. А. Плесков, Успехи химии, 16, 254 (1947) А. И. Бродский, Исследования по термодинамике и Электрохимии растворов, Техиздат УССР, 1931 А. И. Шатенштейн, Сжиженные газы как растворители, т. I, Госхимтехиздат, М., 1934 т. П, Оборонгиз, М., 1939 Н. А. Изгарышев, Электрохимия и ее техническое применение, ГНТИ, Л., 1931, стр. 92 ]. Прим. ред.) [c.337]
Большое значениё Для дальнейших успехов электрохимии имели исследования электропроводности растворов. Работами Гитторфа (1853 г.) было установлено, что ионы в растворе движутся под действием электрического поля с различными скоростями, определяемыми природой ионов. [c.13]
В электрохимии подвижность ионов выражают как отношение скоростей движения ионов под действием электри ческого поля к его напряженности, умноженное на число Фарадея. Сумма подвижностей аниона и катиона равна эквивалентной электропроводности раствора электролита при бесконечном разбавлении. [c.53]
Излагается курс физической и коллоидной химии для сельскохо-эяйст еиных вузов. Агрегатные, состояния вещества, современное учение о растворах, явления диффузии и осмоса тургора и плазмолиза, электропроводность растворов, основы химической термодинамики, и термохимии, вопросы химической кинетики и катализа и химических равновесий, электрохимия рассмотрены с точки зрения их приложения биологии и сельском хозяйстве. Рассмотрены также коллоидно-химические свойства белков, роль свободной воды в коллоидах, коллоидно-химические свойства протоплазмы, свойства коллоидов почвы. [c.2]
Успешно продолжались в Советском Союзе и работы по изучению электрохимии неводных растворов В. А. Плотниковым и учениками его школы — В. А. Избековым, Я. А. Фиалковым, О. А. Кудра и др. [33]. Особенно важны их работы по электропроводности в связи с теорией ком-плексообразования. Эти исследования внесли большой вклад в химию комплексных соединеиий. [c.16]
chem21.info
Молярная электропроводность — Мегаобучалка
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Электролит – это вещество, которое при определенных условиях способно распадаться на заряженные частицы, называемые ионами.
Под определенными условиями может подразумеваться раствор, расплав, распад на ионы под действием температуры (термодиссоциация CaCO3 « CaO + CO2), в плазме и фотодиссоциация – разложение веществ под действием ионизирующего излучения (Cl2 2Cl).
Раствор электролита – это раствор, который способен проводить электрический ток.
КЛАССИФИКАЦИЯ ЭЛЕКТРОЛИТОВ
| Сильные Электролиты, которые полностью диссоциируют в растворе АВ®А+ + В— | Слабые Электролиты, которые не диссоциируют полностью АВ« А+ + В— |
| 1) соли (NaCl, KCl, MgSO4, CH3COONa) | 1) соли (Hg2Cl2) |
| 2) щелочи (NaOH, KOH, Ca(OH)2) | 2) основания (NH3) |
| 3) кислоты (HNO3, H2SO4, HCl, HClO4) | 3) кислоты (H2CO3, H3BO3, CH3COOH, C6H5COOH) |
| 4) органические соединения (C6H4(OH)2 (гидрохинон), C6H5NH2 (анилин)) |
Диссоциация электролитов наблюдается в полярных растворителях и зависит от их диэлектрической проницаемости e. Чем выше значение диэлектрической проницаемости, тем полнее диссоциация.
Большая диэлектрическая проницаемость наблюдается для воды (при 25 0С e=78,3). Лишь незначительное количество неводных растворов, например, формамид, имеют диэлектрическую проницаемость выше, чем у воды. Растворы электролитов в подобных растворителях обладают высокой электрической проводимостью.
В неполярных растворителях, таких как четыреххлористый углерод (e=2,238), электролитической диссоциации практически не происходит.
В зависимости от числа образующихся в результате электролитической диссоциации катионов и анионов различают симметричные и несимметричные электролиты.
ЭЛЕКТРОЛИТЫ
| Симметричные число катионов = числу анионов | Несимметричные число катионов ¹ числу анионов |
| 1) NaCl, KBr, HCl 1,1 – зарядные (одно-одно-зарядные) | 1) K2SO4, H2SO4 1,2 — зарядные |
| 2) MgSO4, ZnSO4 2,2 — зарядные (двух-двух-зарядные) | 2) MgCl2, CaBr2 2,1 — зарядные |
ТЕОРИЯ СЛАБЫХ ЭЛЕКТРОЛИТОВ.
СТЕПЕНЬ И КОНСТАНТА ДИССОЦИАЦИИ
Первая количественная теория растворов электролитов (теория электролитической диссоциации) была высказана Аррениусом. По этой теории молекулы электролитов при растворении распадаются на противоположно заряженные ионы. Процесс диссоциации слабого электролита обратим, т.е. наряду с диссоциацией молекул происходит образование молекул из ионов и, таким образом, в растворе наряду с ионами существуют и молекулы.
Доля молекул, распадающихся на ионы, оценивается степенью электролитической диссоциации, которую обычно обозначают a. Степень диссоциации – это отношение числа молекул, распавшихся на ионы, к числу молекул растворенного вещества.
Степень диссоциации является характеристикой электролита:
Для неэлектролитов (сахароза) a = 0;
Для сильных электролитов a ≥ 1;
Для слабых электролитов 0 < a < 1.
Рассмотрим диссоциацию уксусной кислоты: СН3СООН Н+ + СН3СОО—
Так как процесс диссоциации слабого электролита обратим, то он характеризуется константой равновесия. Константа равновесия для процесса диссоциации есть константа диссоциации. Т.е. все закономерности, характерные для константы равновесия, справедливы и для константы диссоциации.
.
Константа диссоциации зависит от природы растворителя и температуры ( =f(Т)), но не зависит от концентрации электролита в растворе ( ¹f(С)).
Зависимость константы диссоциации от температуры описывается уравнением изобары Вант-Гоффа: .
Пусть концентрация растворенной уксусной кислоты будет С, а степень диссоциации равна a. Тогда , ; ; .
Подставим эти значения в выражение константы диссоциации:
; — аналитическое выражение закона разбавления Оствальда, где С – общая концентрация электролита [моль/дм3].
Рассмотрим очень слабый электролит, степень диссоциации которого намного меньше единицы (a<<1). Тогда закон разбавления Оствальда преобразуется: .
Как видно, степень диссоциации обратно пропорциональна корню квадратному из концентрации электролита. Чем больше концентрации, тем меньше степень диссоциации. В связи с этим вводится понятие бесконечно разбавленного раствора, в котором даже слабые электролиты полностью диссоциируют на ионы и отсутствуют силы электростатического взаимодействия.
ПРИЧИНЫ И МЕХАНИЗМ ИОНИЗАЦИИ
В ВОДНЫХ РАСТВОРАХ
1. Ионизация в ионных соединениях.
К ионным соединениям относятся в основном соли с ионной кристаллической решеткой. Такие соединения состоят из ионов не только в растворе, но и в кристаллическом и парообразном состоянии:
NaCl Na· + ·Cl ® Na+Cl—
Молекула воды полярна из-за разности электроотрицательности кислорода и водорода. Молекула воды имеет угловое строение. Кислород оттягивает на себя электронную плотность, так как его электроотрицательность выше, чем у водорода. На атоме кислорода возникает двойной частично отрицательный заряд, а на каждом из двух атомов водорода частично положительный заряд. Поэтому молекула воды поляризована и её можно представить в виде диполя.
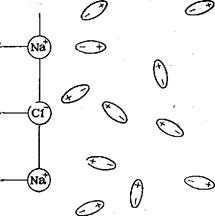 Диполи воды подходят к ионам электролита в кристаллической решетке, ориентируются в его электростатическом поле и ослабляют взаимодействие между ионами в кристалле.
Диполи воды подходят к ионам электролита в кристаллической решетке, ориентируются в его электростатическом поле и ослабляют взаимодействие между ионами в кристалле.
Происходит отрыв иона, его гидратация, то есть электролит растворяется в воде.
2. Диссоциация полярных соединений.Кроме гидратации (сольватации) важным фактором, приводящим к диссоциации электролита, является способность молекул растворителя образовывать разного типа связи с частицами электролита.
Например, молекулы воды обладают способностью образовывать водородные связи не только между собой, но и с другими молекулами, содержащими атомы сильно отрицательных элементов, таких как фтор, кислород, азот, хлор и другие. Например, при растворении в воде хлороводорода происходит ориентация диполей воды вокруг растворенных молекул, вызывающая ещё большую поляризацию молекул хлороводорода.
Полярная связь между атомами водорода и хлора переходит в ионную. При этом общая электронная пара целиком сдвигается к атому хлора, и в результате происходит гетеролитический разрыв молекулы. Атом хлора превращается в гидратированный хлорид-ион, а протон с молекулой воды образует сложную положительно заряженную частицу H3O+, называемую гидроксонием.
HCl + xH2O = H3O+ + Cl—(x-1)H2O
Так как гидратированная частица H3O+ и гидратированный хлорид-ион в уравнении электролитической диссоциации могут быть заменены знаками иона водорода и хлора, то уравнение можно записать так:
HCl = Н+ + Cl—.
ТЕОРИЯ СЛАБЫХ ЭЛЕКТРОЛИТОВ АРРЕНИУСА
По этой теории:
1. Электролиты – это вещества, которые в соответствующих условиях диссоциируют на ионы.
2. Процесс диссоциации характеризуется степенью диссоциации, которая возрастает с уменьшением концентрации.
3. Между ионами в растворе нет взаимодействия.
Пользуясь теорией Аррениуса, нельзя было объяснить, почему разные методы определения константы диссоциации для некоторых электролитов дают разные значения, почему для ряда электролитов константа диссоциации зависит от концентрации раствора. А также тот экспериментальный факт, что для некоторых электролитов при высоких концентрациях раствора степень диссоциации a получалась больше единицы. Теория не указывает причин, вызывающих диссоциацию молекул на ионы, и не объясняет, за счет каких сил она происходит. Поэтому существует ещё одна теория – теория сильных электролитов Кольрауша.
ТЕОРИЯ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ КОЛЬРАУША
По этой теории:
1. Сильные электролиты диссоциируют нацело даже в очень концентрированных растворах.
2. Между ионами в растворе сильных электролитов существует взаимодействие: образуются двойники, тройники и т.д., которые по своим свойствам отличаются от нейтральной молекулы.
3. Вокруг каждого иона образуется оборочка из противоположно заряженных ионов, так называемая ионная атмосфера («шуба»).
4. Ионы – это точечные заряды.
ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Растворы электролитов – это проводники 2 рода, обладающие ионной проводимостью. Количественной характеристикой способности растворов переносить электрический ток является электропроводность.
Электропроводность –это величина, обратная сопротивлению.
, — сопротивление,
где R – сопротивление [Ом]; r — удельное сопротивление [Ом·м]; l – длина проводника [м]; S – площадь поперечного сечения [м2].
Различают два вида электропроводности:
1. Удельная электропроводность – то величина, обратная удельному сопротивлению.
æ= , [Ом-1·м-1] = [См/м], где См [Сименс= ].
Удельная электрическая проводимость раствора электролита – это электрическая проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь по 1 м2 и расположенными на расстоянии 1 м друг от друга.
Величина удельной электропроводности прямо пропорционально зависит от концентрации ионов в единице объема, скорости их движения и переносимого каждым ионом заряда.
Молярная электропроводность.
Молярная электрическая проводимость раствора – мера электрической проводимости всех ионов, образующихся при диссоциации 1 моль электролита при данной концентрации. Молярная электропроводность –это электрическая проводимость объема раствора V(м3), заключенного между двумя параллельными электродами, с межэлектродным расстоянием 1 м, причем каждый электрод имеет такую площадь, чтобы в этом объеме содержался 1 моль растворенного вещества.
Между молярной и удельной электрическими проводимостями имеется соотношение
l=æV=æ/C, где
l — молярная электрическая проводимость, См·м2/моль; æ – удельная электрическая проводимость, См/м; V – разведение раствора, м3/моль; С – концентрация, моль/м3. Если концентрация раствора выражена в моль/дм3, а æ – в См/см, то это уравнение записывается в виде
l=1000·æ/С.
Электропроводность зависит от:
1. концентрации;
2. температуры;
3. вязкости раствора;
4. диэлектрической проницаемости среды.
megaobuchalka.ru
МИНИСТЕРСТОВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Химический факультет
кафедра физической химии
Курсовая работа
на тему:
«Определение электропроводности лизина»
Выполнил: студент 2 курса 4 группы
Научный руководитель: асс. Козадеров О.А.
Воронеж - 2000
Содержание
Введение.......................................................................3
Обзор литературы...............................................................4
Измерение электропроводности растворов.........................................6
Методика измерения электрической проводимости электролитов.....................6
Результаты эксперимента........................................................7
Обработка результатов.........................................................10
Выводы........................................................................11
Литература....................................................................12
Введение
В зависимости от природы токопроводящих частиц и от их электропроводности все
вещества можно условно разделить на пять групп.
1. Непроводящие тела, или изоляторы.
2. Проводники первого рода, или электронопроводящие тела.
3. Полупроводники – вещества, в которых ток переносится электронами и
дырками.
4. Проводники второго рода, или ионные проводники, - вещества, в которых
ток переносится ионами.
5. Смешанные проводники – тела, сочетающие электронную ионную проводимости.
Исследуемая α-аминокислота относится к проводникам второго рода, для
которых характерна ионная проводимость.
Цель данной работы заключается в определении эквивалентной электропроводности
лизина и установлении зависимости эквивалентной электропроводности от
концентрации.
Обзор литературы
Мерой способности веществ проводить электрический ток является электрическая
проводимость L – величина, обратная электрическому сопротивлению R. Так как,
то
где ρ – удельное сопротивление, Ом*м; S – поперечное сечение, м2
; 1/ρ = – удельная электрическая проводимость.
Удельная электрическая проводимость раствора электролита (Ом-1*см
-1) – это электрическая проводимость объема раствора, заключенного между
двумя параллельными электродами, имеющими площадь 1 м2 и
расположенными на расстоянии 1 м друг от друга.
Кривая зависимости удельной электропроводности раствора от концентрации
обычно имеет максимум. Наличие максимумов кривых становится понятным, если
учесть, что в разбавленных растворах сильных электролитов скорость движения
ионов почти не зависит от концентрации, и электропроводность растет почти
прямо пропорционально числу ионов, которое, в свою очередь, растет с
концентрацией. В концентрированных растворах сильных электролитов ионная
атмосфера существенно уменьшает скорость движения ионов, и электропроводность
падает. В слабых электролитах плотность ионной атмосферы мала и скорость
движения ионов мало зависит от концентрации, однако с увеличением
концентрации раствора заметно уменьшается степень диссоциации, что приводит к
уменьшению концентрации ионов и падению электропроводности.
Молярная электрическая проводимость раствора – мера электрической проводимости
всех тонов, образующихся при диссоциации 1 моль электролита при данной
концентрации. Она численно равна электрической проводимости объема V(м3
) раствора заключенного между двумя параллельными электродами, с межэлектродным
расстоянием 1 м, причем каждый электрод имеет такую площадь, чтобы в этом
объеме содержался 1 моль растворенного вещества. Между молярной и
удельной электрическими проводимостями имеется соотношение: λ= V= /с,
где λ – молярная электрическая проводимость; - удельная электрическая
проводимость; V – разведение раствора, м3/моль; с – концентрация,
моль/м3. С увеличением разведения молярная электрическая
проводимость стремится к предельному значению
. Эта величина отвечает электрической проводимости гипотетического бесконечно
разбавленного раствора, характеризующегося полной диссоциацией электролита и
отсутствием сил электростатического взаимодействия между ионами. Величина
молярной электрической проводимости бесконечно разбавленного раствора
электролита представляет собой сумму двух независимых слагаемых, каждая из
которых соответствует определенному виду ионов. Рост молярной электрической
проводимости с увеличением разведения для слабых электролитов может быть
объяснен на основе представлений классической теории электролитической
диссоциации, согласно которой с увеличением разведения степень диссоциации
электролита возрастает и в пределе стремится к 1. Для сильных электролитов,
диссоциирующих полностью,
Изменение молярной электрической проводимости от концентрации для сильных
электролитов объясняется иначе. По теории Дебая – Онзагера снижение молярной
электрической проводимости при переходе от бесконечно разбавленного раствора к
растворам конечных концентраций связано с уменьшением скоростей движения ионов.
Это объясняется появлением эффектов торможения движения ионов, возникающих за
счет сил электростатического взаимодействия между ионом и его ионной
атмосферой.
Эквивалентная электропроводность
(Ом-1*см2*моль-1) – это электрическая
проводимость такого объема раствора, в котором содержится 1 моль эквивалентов
растворенного вещества, причем электроды находятся на расстоянии 1 см друг от
друга.
Электропроводность растворов электролитов зависит в первую очередь от природы
электролита и растворителя. Если сравнить между собой значения молярной
электропроводности, измеренной в водных растворах при бесконечно больших
разбавлениях, то наибольшей она будет у кислот, затем у щелочей и, наконец, у
солей.
В водных растворах удельная электрическая проводимость электролитов при
повышении концентрации раствора сначала увеличивается, достигает некоторого
максимума и затем, при дальнейшем увеличении концентрации, уменьшается.
Положение максимума зависит от природы электролита и его температуры.
Эквивалентная электропроводность водных растворов электролитов уменьшается с
ростом их концентрации. При нулевой концентрации, когда λс =
λ0, она наибольшая. Часто молярную электропроводность λ
выражают как функцию разведения. В этом случае наблюдается рост
электропроводности с разведением, причем в области больших разведений она
стремится к некоторому пределу – к электропроводности при бесконечном
разведении .
Кольрауш нашел, что в области малых концентраций молярная электропроводность
сильного электролита изменяется с концентрацией по эмпирическому уравнению
закон квадратного корня (А – эмпирическая константа). При несколько более
высоких концентрациях сильных электролитов лучшее согласие с опытом дает
уравнение
закон кубического корня.
Температурная зависимость молярной электропроводности для узкого интервала
температур выражается уравнением:
или, в более широком интервале:
где λt, λt=0 – молярные электропроводности
соответственно при температуре t и 0 ˚С; α и β – эмпирические
коэффициенты.
На электропроводность слабых и сильных электролитов влияет кроме температуры
также давление, под которым находится раствор. Молярная электропроводность
для большинства сильных электролитов при прогрессирующем увеличении давления
вначале возрастает, достигает некоторого максимума, а затем вновь
уменьшается, часто до значений более низких, чем те, которые наблюдаются при
обычном давлении.
Измерение электропроводности растворов
Для измерения электрической проводимости раствора прибегают к измерению его
сопротивления. Раствор помещают в специальный сосуд, имеющий два
металлических электрода. Измерение может быть проведено как с помощью
постоянного, так и с помощью переменного тока.
Электропроводность электролитов обычно определяется при помощи мостовой
схемы, используемой для измерения сопротивления проводника первого рода. В
случае растворов электролитов применяются мосты, работающие на переменном
токе, так как прохождение постоянного тока через растворы приводит к
значительным ошибкам, связанным с явлениями электролиза и поляризации
(изменение состава раствора вблизи электродов, изменение состояния
электродов, наложение электродной поляризации на подаваемое напряжение).
Необходимость применения переменного тока достаточно высокой частоты (для
избежания указанных ошибок) усложняет измерительную схему. Изменение
направления тока служит оптимальным средством для устранения поляризационного
сопротивления. Кроме моста она содержит генератор переменного тока, а также
специальные устройства для выпрямления тока перед прохождением его через
нуль-инструмент и для компенсации емкостных эффектов.
|
works.tarefer.ru
Электропроводность химических соединений — Справочник химика 21
Включает описание различных физических свойств химических соединений (термические величины, вязкость, электропроводность, плотность, дипольный момент и др.). [c.128]В 1896 г. Беккерель обнаружил, что соли урана испускают какие-то лучи, которые проходят через черную бумагу и засвечивают фотопластинку, подобно известным уже в то время лучам Рентгена. Эти же лучи вызывают флуоресценцию некоторых веществ, а также появление электропроводности в воздухе. Открытое явление было названо радиоактивностью. Беккерель установил, что радиоактивность — это свойство элемента урана, не зависящее от его агрегатного состояния или формы химических соединений, в состав которых он входит. [c.575]
В полупроводнике, представляющем собой химическое соединение, свободных носителей тока нет. Только тепловое движение, поглощение света или другие энергетические факторы приводят к возбуждению электронов и делают вещество проводником электричества. Тепловое движение ослабевает с понижением температуры, соответственно убывает и электропроводность полупроводников, падая до нуля. При достаточно низкой температуре полупроводник становится изолятором, и резкой границы между ними нет. В то же время металл нельзя превратить в проводники другого типа термической обработкой. [c.160]
Учение о химической связи занимает центральное место в современной химии. Без понимания природы взаимодействия атомов нельзя понять многообразия химических соединений, причин их образования и реакционной способности. От характера сил, действующих между атомами элементов, зависят и свойства образующихся веществ механические, оптические, электрические и др. В сущности все свойства тел непосредственно связаны с особенностями химической связи в них. Например, зависимость электрических свойств от типа связей в них в самых общих чертах обнаруживается в электропроводности. [c.86]
Чистый фторид водорода (температура плавления —83,36 С,, температура кипения 19,52 °С) ток не проводит, но его расплавленные химические соединения диссоциированы и обладают заметной электропроводностью ( 18 Ом/м при 100 °С). При осуществлении электролиза в расплаве протекает суммарная полезная реакция [c.246]
Облучение кристаллов ведет как к изменению регулярности строения кристаллической решетки, так и к радиолизу химического соединения, образующего кристалл. Исследования показали, что облучение ионных кристаллов ведет к увеличению числа анионных и катионных вакансий. При этом часть электронов, образовавшихся в результате радиолиза, занимают анионные вакансии. Подобное расположение электронов обусловливает изменение электропроводности по сравнению с электропроводностью не-облученного кристалла. [c.216]
Электропроводность индивидуального химического соединения — характеристика, обладающая известным своеобразием по сравнению с большинством иных физических свойств. Точные значения X определены лишь для жидких металлов, многих металлических и гораздо меньшего числа ионных расплавов. Электропроводность индивидуальных неорганических и органических жидкостей (вопрос, имеющий большое значение для проблематики данной книги, поскольку он связан с подбором жидких композиций для электроосаждения металлов) существенно зависит от их чистоты. Кроме того, величина ус зависит от условий и способа измерений, в частности от частоты тока [96] при измерениях на переменном токе. Относительно последних в настоящее время нет установившейся точки зрения. Поэтому нередки случаи, когда значения у, индивидуальных жидкостей по данным разных авторов (например, [79, 959, 136]) различны (до двух порядков). [c.21]
Проводниковые материалы, как правило, обладают высокой пластичностью, антикоррозионной стойкостью, достаточной механической прочностью такие свойства необходимы при изготовлении из них проводов, профилированных токонесущих деталей и т.п. Проводниковые материалы обладают электронной проводимостью. Наиболее электропроводны, при обычных температурах, химически чистые I-валентные металлы. При весьма низких температурах некоторые металлы и сплавы обладают сверхпроводимостью. Статические искажения кристаллической решетки, ее динамические нарушения, а также процессы, связывающие электроны, понижают электропроводность проводниковых материалов первое имеет место при образовании твердых растворов, пластической деформации, воздействии проникающего ядерного излучения второе -при нагреве третье — при образовании некоторых растворов и химических соединений. [c.412]
Определение температуры насыщения растворов по измерению электропроводности требует довольно кропотливой предварительной работы по построению графика зависимости удельного сопротивления растворов от температуры и концентрации для каждого конкретного химического соединения. [c.147]
Компоненты сплава в расплавленном состоянии могут растворяться друг в друге и сохранять однородность при переходе в твердое состояние, образуя твердый раствор. Твердый раствор отличается от механических смесей тем, что имеет одну фазу и образует одну кристаллическую решетку, а от химических соединений тем, что может существовать при различном соотношении компонентов. Коли-личество компонентов и их состояние влияют на свойства сплава (на твердость, упругость, плавление, плотность, стойкость к химическим воздействиям и т. п.). Так, наличие серы в металлах вызывает хрупкость в нагретом состоянии и понижает стойкость к химическим воздействиям. Присутствие кремния повышает стойкость сплава к действию кислот, увеличивает жаростойкость его. Углерод повышает текучесть, но увеличивает хрупкость на холоду. Медь повышает антикоррозийные свойства железных сплавов, однако, как и сера, вызывает красноломкость металла. Алюминий придает легкость, пластичность сплавам. Иногда необходимо применять чистый металл. Например, чистая медь обладает более высокой электропроводностью, поэтому при изготовлении электрических проводов медь очищают от других элементов. [c.268]
Теория электролитической диссоциации приписывает возникновение электропроводности растворов диссоциации, т. е. разложению растворенного вещества там, где налицо наиболее явные признаки химического соединения с растворителем, т. е. ассоциации . [c.62]
Появление определенного химического соединения, о котором можно судить, воспользовавшись методом физико-химического анализа,— условие необходимое, но не достаточное для того, чтобы вызвать электропроводность системы, составленной из компонентов, не проводящих тока. Например, система треххлористый мышьяк — анизол не обладает электропроводностью, хотя в ней отмечено наличие соединения. [c.247]
На-коррозионную агрессивность почвы влияет ряд физических, химических и биологических факторов. К ним относятся структура почвы, содержание влаги, насыщенность кислородом, концентрация химических соединений, кислотность, электропроводность, присутствие микроорганизмов и т. д. [c.84]
Почвы с большим содержанием растворимых химических соединений и со значительной влажностью обычно характеризуются хорошей электропроводностью. Поэтому величину удельного электрического сопротивления почвы часто принимают за основной критерий ее коррозионной агрессивности. В табл. П1-3 представлена оценка коррозионной агрессивности почвы в зависимости от удельного сопротивления. [c.87]
Твердые электролиты, состоящие из оксидов металлов, могут применяться для получения некоторых химических соединений. Наибольшее расиространение получили твердые электролиты на основе диоксида циркония, модифицированные для повышения электропроводности добавками иттрия [10—15% (мол.)]. Оксидные электролиты обладают достаточно высокой электропроводностью лишь при высоких температурах. Электропроводность оксидных электролитов на основе диоксида циркония, применяемых для синтеза некоторых химических продуктов, обусловлена способностью ионов кислорода перемещаться в оксидах, имеющих большое число кислородных вакансий. Например, при электролитическом разложении воды ионы кислорода образуются в результате катодной реакции выделения кислорода [c.242]
Д. И. Менделеев создал химическую теорию растворов (1865 г. и позже), согласно которой растворы представляют собой непрочные диссоциирующие химические соединения, называемые в настоящее время сольватами, а в частном случае воды — гидратами. Его ученик Д. П. Коновалов один из первых применил термодинамический метод для изучения растворов. Он же установил одну из причин возникновения электропроводности неводных растворов — взаимодействие молекул, приводящее к образованию ионов. Л. В. Писаржевский и другие русские физико-химики с успехом исследовали неводные электролиты. [c.18]
Второй сингулярной точки, отвечающей второму химическому соединению MgзAg, на кривой 2 нет. Но зато на кривой 3, описывающей зависимость температурного коэффициента электропроводности от состава, имеются две сингулярные точки, отвечающие каждому из химических соединений. [c.411]
Г. Дальтониды и бертоллиды. Часто, особенно в металлических системах, твердые фазы переменного состава образуются не на основе чистых компонентов, а на основе химических соединений, плавящихся конгруэнтно или инконгруэнтно. Существуют твердые растворы с неограниченной и ограниченной растворимостью химического соединения и компонентов системы в твердом состоянии. Наиболее распространены твердые растворы, образованные из химических соединений с ограниченной растворимостью. В системах такого типа твердые растворы образуются на основе действительных химических соединений, называемых дальтонидами. Состав дальтонидов удовлетворяет строго стехиометрическим соотношениям компонентов, подчиняющимся закону Дальтона. Дальтониду на диаграмме плавкости (рис. 151) соответствует рациональный максимум и сингулярная (особая) точка как на линии ликвидуса, так и на линии солидуса (фигуративная точка С). Для дальтонидов характерно также наличие сингулярных точек, соответствующих химическому соединению А Вп и на изотермах состав — свойство (электропроводность, твердость, температурный коэффициент электрического сопротивления). Примерами систем с образованием твердых растворов такого типа могут служить системы Mg—Ар, Мр—Аи, Аи—7п. [c.415]
В отличие от плотности и электропроводности вязкость — не аддитивное свойство для смеси солей. Изотермы вязкости смесей (т] — концентрация, мольн. %, при / = onst) дают экстремумы при определенном содержании соли, вводимой для снижения вязкости. В том случае, когда имеется ион с высокой поляризующей силой, т. е. когда группы ионов похожи на комплексные соединения, изотермы бывают достаточно сложными, указывающими не только на наличие эвтектических смесей, но и отдельных химических соединений. [c.473]
После того как в конце прошлого века Вант-Гоффом было сформулировано представление о твердых растворах, выяснилось, что множество твердых веществ самого различного происхождения—сп-лавы, стекла, многие горные породы и минералы — представляют собой твердые растворы. В результате термодинамического исследования Розебума (1899 г.) установлены основные тины диаграмм состояния двойных систем с твердыми растворами. В начале нашего века Н. С. Курнаков заложил основы физико-химического анализа и развил физико-химическое направление изучения твердых веществ. При исследовании металлических сплавов он применил не только диаграммы состояния типа состав — температура плавления, но и типа состав — электропроводность, состав — твердость, разработанные им совместно с С. Ф. Жемчужиным, а также изобрел самопищущий прибор для термического анализа — пирометр Курнакова. Исходя из идеи Д. И. Менделеева о неопределенных соединениях как настоящих химических соединениях, Н. С. Курнаков, как мы помним, постулировал существование двух типов индивидуальных химических соединений — дальто-нидов и бертоллидов и указал, что первые имеют постоянный, а вторые переменный состав. Бертоллиды, по Курнакову, представляют собой твердые растворы неустойчивых в свободном состоянии соединений постоянного состава. [c.164]
ДАЛЬТОНИДЫ И БЕРТОЛЛИДЫ. Д.— химические соединения постоянного состава. Преобладающее большинство обычных химических соединений, описанных в курсах химии, т. е. соединений, состав которых подчиняется законам постоянных и кратных отношений, и образованию которых отвечает появление сингулярных (или дальтоновских) точек на диаграммах состав — свойство. Термин Д. ввел Н. С. Курнаков в 1914 г. для отличия от термина Б., при помощи которого обозначают соединения переменного состава, занимающие промежуточное положение между соединениями постоянного состава и твердыми растворами. Физические свойства (электропроводность, твердость и др.) Б. изменяются по плавным кривым, не имеющим дальтоновских [c.82]
НИТРИДЫ — соединения азота с эле ктроположительнымп элементами (глав ным образом, с металлами), Н. обладают высокой твердостью, термической устойчивостью, тепло-и электропроводностью, химической стойкостью против действия кислот и щелочей, огнеупорностью. Н, применяются в сплавах. Некоторые Н обладают высокими каталитическими свойствами. [c.175]
Во-первых, не существует простой функциональной зависимости между значением диэлектрической проницаемости раствора и его составом,. В особенности это относится к спиртам, которые могут давать с водой ряд нестойких химических соединений. Во-вторых, работа по методу диэлкометрнческих онределенщ затрудняется или становится невозможной, если растворы обладают заметной электропроводностью. Для проводящих объектов эквивалентная емкость ячейки становится сложной функцией диэлектрической проницаемости, что сильно усложняет, а в ряде случаев делает невозможным получение искомы величин г и А Кроме того, приборы, предназначенные для определения емкости, в условиях проводящих растворов, особенно при наличии ионов, как правило, не могут работать. [c.116]
Вода (оксид водорода) НгО — химическое соединение водорода с кислородом. Содержит 88,8 % кислорода и 11,2 % водорода. Бесцветная жидкость, без запаха, вкуса и цвета. Состав В. был установлен А. Лавуазье в 1783 г. синтезом из водорода и кислорода. В.— самое распространенное на Земле соединение. Оно образует гидросферу, входит в состав минералов и горных пород, растений и животных. Ряд физических свойств В. аномален. Электропроводность чистой В. объясняется частичной диссоциацией ее молекул на иины Н иОН . Жидкая вода, леди пар находятся в равновесии при 6 10 Па и 0,0100°С. Процесс растворения веществ в [c.31]
Для предотвращения возникновения и накопления в пласт ических массах электрических зарядов используются различные способы. Распространено использование специальных химических соединений с электронной или ионной проводимостью. Действие этих соединений основано на повышении электропроводности и увеличении диэлектрической проницаемости магериалов. Внутренние антистатики вводят в полимер перед переработкой внешние -наносят иа поверхность изделия из полимера (2, с,212-221). В связи с каждым конкретным случаем необходимо оцениваггьтермостабильность и все свойства композиции и получаемых маггерналов и изделий. [c.100]
При температуре 1401 С у-железо превращается в б-железо, кристаллизующееся снова в форме центрированного куба, которая сохраняется до температуры плавления железа— 1540 °С. Химическое соединение железа с углеродом (карбид железа) РезС называется цементитом. Химически чистое железо серебристо-белого цвета, с плотностью 7890 кг1м . Оно обладает высокой теплопроводностью, электропроводностью, магнитной проницаемостью, высокой пластичностью, хорошо деформируется при ковке, штамповке и прокате, оно хорошо сваривается. [c.385]
Однако, исследуя электропроводность, вязкость и поверхностное натяжение смесей безводных H IO4—h3SO4 при различных температурах и соотношениях компонентов, М.. И. Уса-нович с сотрудниками [21] не смогли установить существования определенного химического соединения между ними и пришли к выводу об отсутствии какого-либо химического взаимодействия между безводными серной и хлорной кислотами. [c.65]
Условия протекания того или иного технологического процесса определяются значениями различных физических величия. Для процессов, регулированию которых посвящена настоящая работа, наиболее характерными параметрами являются расход жидкости, уровень, температура, показатель pH, конценграцил химических соединений, плотность, электропроводность, прозрачность. Например, оптимальный расход реагента (известкового молока) при нейтрализации. кислых сточных вод определяется по величине pH обработанных или исходных стоков, а [c.48]
В последнее время стали применять в качестве полупроводников также и химические соединения, в первую очередь между элементами третьей ж пятой групп (полупроводники типа В ). Особенно ценными свойствами обладают сурьмянистый индии 1п8Ь, чувствительный к инфракрасному свету с очень большой длиной волны и ьшшьяковистый галлий ОаАз, в котором рекомбинация электронов и дырок дает интенсивное световое излучение (квантовый генератор света или полупроводниковый лазер, превращающий энергию электрического тока непосредственно в световую). Полупроводниковыми свойствами обладают и многие окислы. Так, окись цинка является электронным полупроводником роль доноров играют при этом избыточные атомы или однозарядные ионы цинка. Окись меди(1) является дырочным полупроводником роль акцепторов играют избыточные атомы кислорода. Однако подвижность носителей тока (электронов или дырок) в окисных полупроводниках низка, так что для радиотехники они менее ценны. Для выпрямления сильных токов используют тонкий слой окиси меди(1), нанесенный окислительным процессом на поверхность металлической меди (купроксный выпрямитель). Это — простейший аналог полупроводникового диода, в котором, однако, роль электронного проводника играет обычный металл. Свойства окисных полупроводников сильно зависят от состояния их поверхности. Так, электропроводность окиси цинка понижается в атмосфере кислорода, который адсорбируется поверхностью и захватывает свободные электроны. Способность окислов ускорять (катализировать) газовые реакции связана с полупроводниковыми свойствами, т. е. с наличием свободных электронов.— Доп. ред. [c.457]
Различают электролиты и неэлектролиты. К первым принадлежат вещества, водный раствор которых проводит электрический ток. Химические соединения, имеющие гетерополярное (ионное) строение (например, Na l, KNO3, aFg и т.д.), проводят ток также и в расплавленном состоянии. Неэлектролиты — вещества, неспособные обусловливать электропроводность систем ни в растворенном, ни в расплавленном состоянии. [c.234]
Вернемся теперь к химической теории растворов. В 1887 г. Менделеев опубликовал монографию Исследование водных растворов по удельному весу . Им были изучены, в частности, растворы метилового спирта и его гомологов, глицерина, органических кислот и азотпроизводных. Менделеев заключает, что в водных растворах существуют гидраты определенного состава, в частности соединения молекулы этилового спирта с одной, тремя и двенадцатью молекулами воды, причем в растворе происходит, согласно взглядам Менделеева, непрерывный процесс образования (ассоциации) и распада (диссоциации) гидратов. С этой точки зрения Менделеев объясняет и данные по электропроводности …в соединении растворенного тела с растворителем можно искать скорее всего причину электропроводности, как видно из того, что (Д. П. Коновалов) ни анилин, ни уксусная кислота в отдельности не проводят тока…, а раствор анилина в уксусной кислоте составляет хороший электролит, в котором непременно должны действовать химические силы, влекущие анилин, подобно аммиаку, к соединению с уксусной и всякими другими кислотами [47, с. 542—544]. [c.141]
Теория неводкых растворов была особенно развита и углу блена (начиная с 1902 г.) В. А. Плотниковым, широко использо вавшим электрохимические методы изучения. Исследуя растворители с малой диэлектрической постоянной, Плотников пришел к выводу, что электропроводность многих растворов может быть весьма значительной, несмотря на малую величину О. Отрицая на этом основании то, что величина В является единственной причиной, определяющей способность растворителя к диссоциированию электролитов, он высказал предположение, что более или менее сильные электролиты могут вновь создаваться в самом рас творе. Это происходит за счет взаимодействия между растворителем и растворенным веществом, которое само по себе не является электролитом оба вещества должны находиться в особом электрохимическом соответствии, чтобы образовать подходящую пару . Таким образом, Плотников рассматривает их как особые более или менее устойчивые химические соединения. [c.175]
А. А. Кракау [499, 500], изучая электропроводность и упругость диссоциации водородистого палладия, установил, что до поглощения 40 объемов водорода закономерность поглощения подчиняется закону Генри, а затем устанавливается постоянная упругость водорода, соответствующая определенному химическому соединению. [c.130]
Белая бронза отличается высоким блеском и твердостью, имеет хорошую электропроводность, хорошо полируется до зеркального блеска. Коэффициент отражения бронзы выше, чем у хрома, поэтому ее можно использовать для декоративной отделки. При испытании в условиях тропического климата покрытия бронзой с содержанием 40—80% олова показали нкз ю защитную способность. Это объясняется большой пористостью и наличием внутренних напряжений в осадках, что приводит К растрескиванию их. Поэтому покрытие бронзой, содержащей более 30% олова, нецелесообразно применять в жестких коррозионньПс условиях. По данным Вячеславова и сотр. [5], высокооловянистая бронза (40—45% олова) имеет большее удельное электросопротивление, чем медь и олово максимум твердости почти совпадает с наибольшим значением электросопротивления, что характерно для сплавов, образующих твердые растворы или химические соединения. Тем не менее в условиях эксплуатации электрических контактов при наличии в воздухе сернистых соединений покрытие белой бронзой может конкурировать с серебром, вследствие большей стабильности величин переходного сопротивления. [c.216]
chem21.info
