Термодинамика смешения — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1917
Когда твердые тела, жидкости или газы объединяются, термодинамические величины системы претерпевают изменения в результате смешивания. В этом модуле будет обсуждаться влияние смешения на энергию Гиббса, энтальпию и энтропию раствора с особым акцентом на смешивание двух газов.
Введение
Раствор создается, когда два или более компонентов смешиваются до однородного состояния, образуя единую фазу. Изучение растворов важно, потому что большинство химических и биологических жизненных процессов происходят в системах с множеством компонентов. Понимание термодинамического поведения смесей является неотъемлемой частью изучения любой системы, включающей идеальные или неидеальные растворы, поскольку оно дает ценную информацию о молекулярных свойствах системы.
Понимание термодинамического поведения смесей является неотъемлемой частью изучения любой системы, включающей идеальные или неидеальные растворы, поскольку оно дает ценную информацию о молекулярных свойствах системы.
Большинство реальных газов ведут себя как идеальные газы при стандартной температуре и давлении. Это позволяет нам объединить наши знания об идеальных системах и растворах с термодинамикой стандартного состояния, чтобы вывести набор уравнений, количественно описывающих влияние перемешивания на термодинамические параметры данного газофазного раствора.
Свободная энергия Гиббса смешения
В отличие от экстенсивных свойств однокомпонентной системы, которые зависят только от количества присутствующей системы, экстенсивные свойства раствора зависят от его температуры, давления и состава. Это означает, что смесь должна быть описана в терминах парциальных молярных количеств ее компонентов. Полная свободная энергия Гиббса двухкомпонентного раствора определяется выражением
\[ G=n_1\overline{G}_1+n_2\overline{G} _2 \label{1}\] 9\circ_i+RT \ln \frac{P_i}{1 bar} \label{4}\]
где
- µ i — химический потенциал i -го компонента,
- µ i ° – стандартный химический потенциал компонента i при 1 бар, а
- P i – парциальное давление компонента i .

Теперь предположим, что у нас есть два газа с одинаковой температурой и давлением, газ 1 и газ 2. Энергия Гиббса системы до смешивания газов определяется уравнением \(\ref{1}\), которое можно объединить с уравнением \(\ref{4}\), чтобы получить выражение 9\circ_2+RT \ln P_2) \label{6}\]
Энергия смешения Гиббса, \(Δ_{mix}G\), может быть найдена вычитанием \(G_{initial}\) из \( G_{финал}\).
\[ \begin{align} Δ_{mix}G &= G_{final} — G_{initial}\\[4pt] &=n_1RT \ln \frac{P_1}{P}+n_2RT \ln \frac{ P_2}{P} \\[4pt] &=n_1 RT \ln \chi_1+n_2 RT \ln \chi_2 \label{7} \end{align} \]
, где
\[P_i = \chi_iP\]
и \(\chi_i\) — молярная доля газа \(i\). Это уравнение можно еще больше упростить, зная, что молярная доля компонента равна количеству молей этого компонента по отношению к общему количеству молей системы, или
\[\chi_i = \dfrac{n_i}{n}.\]
Уравнение \ref{7} затем становится
\[\Delta_{mix} G=nRT(\chi_1 \ln \chi_1 + \chi_2 \ln \chi_2) \label{8}\]
Это выражение дает нам влияние перемешивания на свободную энергию Гиббса раствора.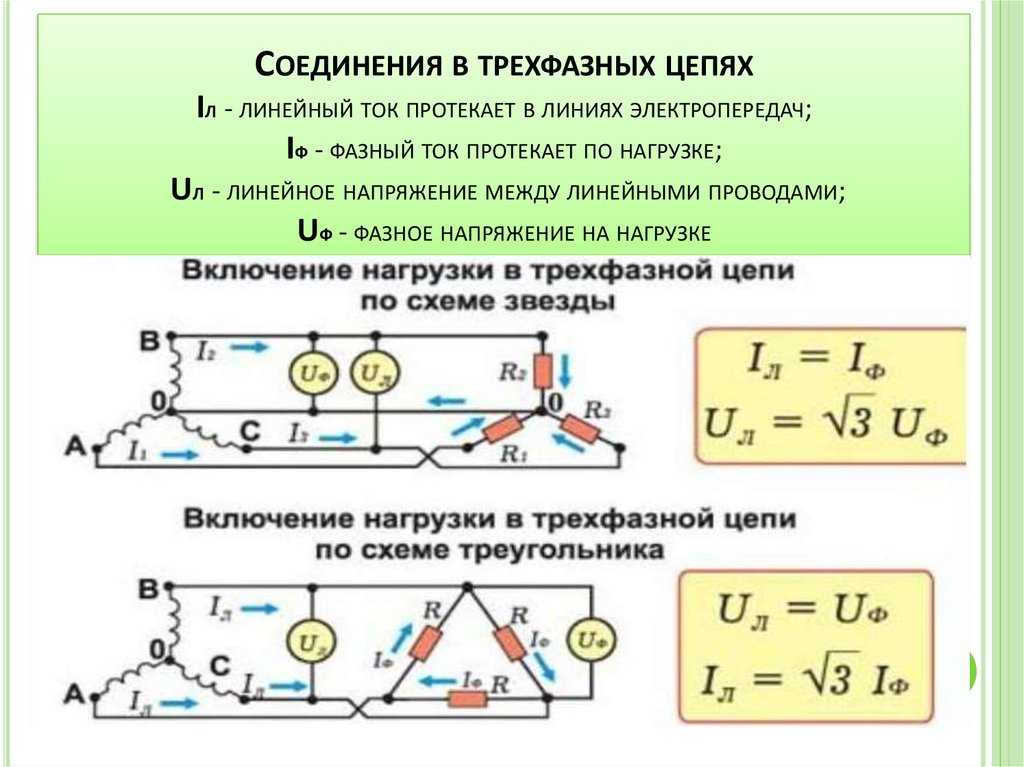 Поскольку \(\chi_1\) и \(\chi_2\) являются молярными долями в диапазоне от 0 до 1, мы можем сделать вывод, что \(Δ_{mix}G \) будет отрицательным числом. Это согласуется с идеей о самопроизвольном смешивании газов при постоянном давлении и температуре.
Поскольку \(\chi_1\) и \(\chi_2\) являются молярными долями в диапазоне от 0 до 1, мы можем сделать вывод, что \(Δ_{mix}G \) будет отрицательным числом. Это согласуется с идеей о самопроизвольном смешивании газов при постоянном давлении и температуре.
Энтропия смешения
На рисунке \(\PageIndex{1}\) показано, что когда два газа смешиваются, это действительно можно рассматривать как два газа, расширяющиеся в два раза по сравнению с их первоначальным объемом. Это значительно увеличивает количество доступных микросостояний, и поэтому мы ожидаем, что энтропия системы также увеличится.
Рисунок \(\PageIndex{1}\): Смешивание двух газов можно рассматривать как два расширения. (а) Расширение только газа 1 при удалении барьера. Молекулы имеют в два раза больше микросостояний в открытом ящике. (б) Расширение газа 2 вдоль. в) одновременное расширение газов 1 и 2 эквивалентно смешениюТермодинамические исследования зависимости свободной энергии Гиббса идеального газа от температуры показали, что
\[ \left( \dfrac {d G} {d T} \right )_P=-S \label{9}\]
Это означает, что дифференцирование уравнения \(\ref{8}\) при постоянном давлении по отношению к температуре даст выражение для влияния перемешивания на энтропию раствора. Мы видим, что
Мы видим, что
\[ \begin{align} \left( \dfrac {d G_{mix}} {d T} \right)_P &=nR(x_1 \ln x_1+x_2 \ln x_2) \\[4pt ] &=-\Delta_{mix} S \end{align}\]
\[\Delta_{mix} S=-nR(x_1 \ln x_1+x_2 \ln x_2) \label{10}\]
Поскольку мольные доли снова приводят к отрицательным значениям для ln x 1 и ln x 2 , отрицательный знак перед уравнением делает Δ mix S положительным, как и ожидалось. Это согласуется с идеей о том, что смешение является самопроизвольным процессом.
Энтальпия смешения
Мы знаем, что в идеальной системе \(\Delta G= \Delta H-T \Delta S\), но это уравнение также можно применить к термодинамике смешения и решить для энтальпии смешения так, что он читает
\[\Delta_{mix} H=\Delta_{mix} G+T\Delta_{mix} S \label{11}\]
Подставляем наши выражения для \(Δ_{mix}G\) (Уравнение \(\ref{8}\)) и \(Δ_{mix}S\) (уравнение \(\ref{10}\)) , мы получаем
\[\Delta_{mix} H=nRT(x_1 \ ln x_1+x_2 \ln x_2)+T \left[-nR(x_1 \ln x_1+x_2 \ln x_2) \right] = 0\]
Этот результат имеет смысл при рассмотрении системы. Молекулы идеального газа разбросаны достаточно, чтобы не взаимодействовать друг с другом при смешивании, что означает, что тепло не поглощается и не выделяется, и в результате \(Δ_{mix}H\) равно нулю. На рисунке \(\PageIndex{2}\) показано, как \(TΔ_{mix}S\) и \(Δ_{mix}G\) изменяются в зависимости от мольной доли, так что \(Δ_{mix}H\) раствора всегда будет равна нулю (это при смешении двух идеальных газов).
Молекулы идеального газа разбросаны достаточно, чтобы не взаимодействовать друг с другом при смешивании, что означает, что тепло не поглощается и не выделяется, и в результате \(Δ_{mix}H\) равно нулю. На рисунке \(\PageIndex{2}\) показано, как \(TΔ_{mix}S\) и \(Δ_{mix}G\) изменяются в зависимости от мольной доли, так что \(Δ_{mix}H\) раствора всегда будет равна нулю (это при смешении двух идеальных газов).
Ссылки
- Чанг, Р. Физическая химия для биологических наук, 1-й Хердон, Вирджиния: University Science Books, 132-133. Распечатать.
- Мейер, Э. Ф. (1987). Термодинамика «смешивания» идеальных газов. Дж. Хим. Образовательный 64, 676-677.
Внешние ссылки
- Саттер, С. (2000). Термодинамика смешения реальных газов. Дж. Хим. Образовательный 77, 1361-1365.
- Брандани, В.
 , Евангелиста, Ф. (1987). Корреляция и предсказание энтальпий смешения для систем, содержащих спирты, с помощью теории связанных растворов UNIQUAC. Инд.Инж. хим. Рез. 26 (12), 2423–2430.
, Евангелиста, Ф. (1987). Корреляция и предсказание энтальпий смешения для систем, содержащих спирты, с помощью теории связанных растворов UNIQUAC. Инд.Инж. хим. Рез. 26 (12), 2423–2430.
Проблемы
- Используйте рисунок 2, чтобы найти x 1 , который оказывает наибольшее влияние на термодинамические величины конечного решения. Объясните, почему это так.
- Рассчитайте влияние смешивания 2 молей азота и 3 молей кислорода на энтропию конечного раствора.
- Другой способ найти энтропию системы — использовать уравнение ΔS = n Rln(V 2 /V 1 ). Используйте это уравнение и тот факт, что объем прямо пропорционален количеству молей газа при постоянной температуре и давлении, чтобы получить окончательное выражение для \(T\Delta_{mix}S\). (Подсказка: используйте вывод \(T\Delta_{mix}G\) в качестве руководства).
Ответы
- x 1 = 0,5
- Увеличивает энтропию системы на 27,9.
 8 Дж/мольК
8 Дж/мольК
Авторы и ссылки
- Элизабет Биллквист (Hope College)
Термодинамика смешивания распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- энтальпия смешения
- энтропия смешения
- Энергия смешения Гиббса
Энергетическая связь.
 Определение и примеры
Определение и примеры Энергетическая связь
сущ., [ˈɛnədʒɪ ˈkʌplɪŋ]
Определение: сочетание двух биологических реакций
Содержание
Что такое энергосвязь?
Работа, будь то физическая или биологическая, требует затрат энергии. В биологических организмах АТФ является источником энергии для всей клеточной работы. Когда мы обсуждаем роль молекул АТФ, важное значение приобретают реакции сопряжения энергии. Теперь возникает вопрос, что такое энергетическая связь и как мы определяем энергетическую связь!
Определение биологии:
Энергетическая связь , по определению, представляет собой концепцию связи двух биологических реакций; это означает, что энергия, полученная в результате одной реакции, используется для запуска второй реакции. Две разные реакции или биологические системы соединяются или синхронизируются таким образом. Во всех клетках в основном протекают 2 типа реакций: (1) экзергонические реакции которые являются реакциями высвобождения энергии (таким образом, энергетически выгодными) и (2) эндергонические реакции , которые являются энергоемкими реакциями (таким образом, энергетически невыгодными).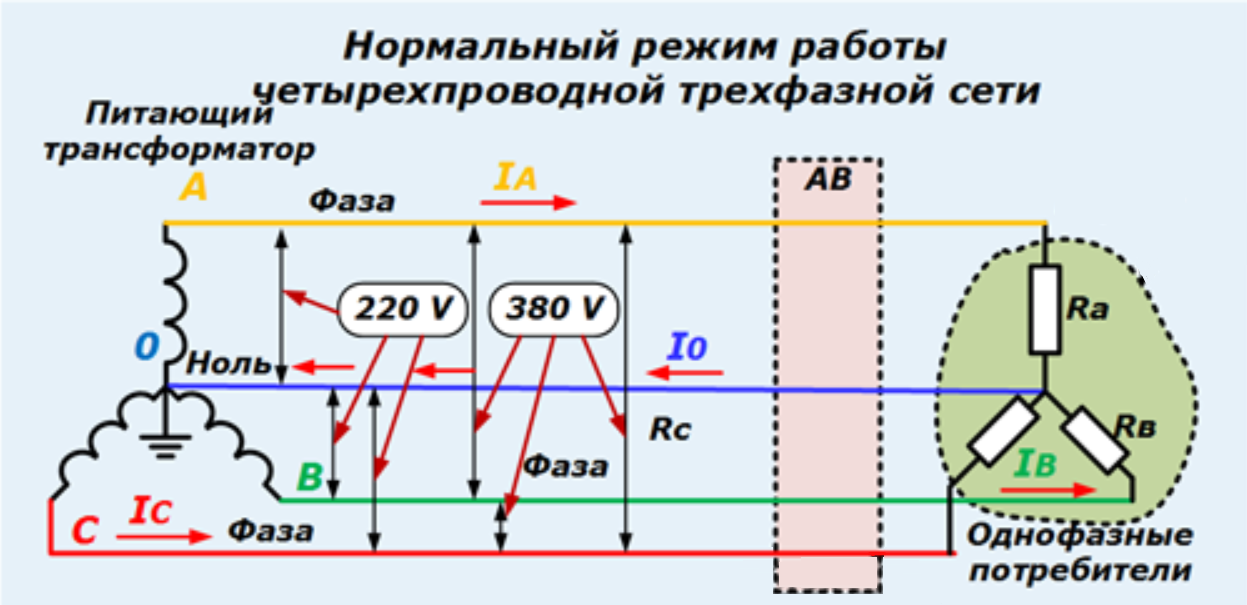 Во многих случаях клетка связывает эти две реакции и наводит мост между ними. Энергия, высвобождаемая экзергоническими реакциями, направляется вниз к эндергоническим реакциям, чтобы сделать их энергетически выгодными.
Во многих случаях клетка связывает эти две реакции и наводит мост между ними. Энергия, высвобождаемая экзергоническими реакциями, направляется вниз к эндергоническим реакциям, чтобы сделать их энергетически выгодными.
Эта умная работа клетки гарантирует, что клеточные реакции никогда не исчерпают источник энергии, то есть АТФ. Это «реакции, связывающие 9соединение 0044 или » — жизненно важный механизм, который гарантирует, что клеточный механизм никогда не остановится и клетка останется живой! Именно благодаря этой энергетической связи клетки используют АТФ в эндергонических реакциях…
Какова роль АТФ в этом процессе?
АТФ означает а денозин т ри р фосфат . Это небольшая молекула, которую обычно называют энергетической валютой клетки. Базовая структура АТФ состоит из 3 основных компонентов. Это аденин (азотистое основание), рибоза (сахар) и три фосфатные группы, связанные одна за другой (обозначены как 9). 0043 альфа , бета , гамма от точки крепления до конца).
0043 альфа , бета , гамма от точки крепления до конца).
Связывание происходит, когда энергия, высвобождаемая экзергонической реакцией, соединяется с эндергонической реакцией. Три фосфата АТФ энергетически связаны с основной структурой (нуклеозид-аденозин). Хотя не все фосфатные группы связаны высокоэнергетической связью, количество энергии, высвобождаемой в процессе гидролиза АТФ, просто поразительно. Многочисленные клеточные реакции от метаболических трансформаций до клеточных ответов на клеточные сигнальные события обеспечиваются гидролизом АТФ.
Реакция гидролиза АТФ
ATP + H3O 🡪 ADP + PI (ADP в биологии средний A Denosine D I P HOSPHATE)
ADP + PI AMP + PI AMP + PI AMP + PI AMP + PI AMP + PI AMP + PI AMP + PI AMP + PI AMP + PI AMP + H3O AMP + PI AMP + PI AMP + PI AMP + PI AMP + PI AMP + PI AMP + PI AMP + PI AMP + PI AMP + PI AMP + PI AMP + PI AMP + PI PI.A денозин M оно p фосфат)
Эта реакция гидролиза АТФ (что означает превращение аденозинтрифосфата в аденозиндифосфат ) происходит в результате разрыва двух фосфоангидрида. Количество энергии, связанной с этими реакциями гидролиза, варьируется от клетки к клетке и зависит от условий микросреды, организмов, ионной силы (особенно Mg
- В стандартных условиях свободная энергия Гиббса, связанная с гидролизом АТФ, находится в диапазоне от -35,0 до -40,0 кДж/моль .
- Но в физиологических условиях (в живой клетке) свободная энергия Гиббса, связанная с гидролизом АТФ, находится в диапазоне от -50,0 до -72,0 кДж/моль .
Посмотрите на рисунок ниже, чтобы понять различия и диапазон высвобождения энергии у разных организмов.
Какую роль играет АТФ в энергетическом соединении?
Теперь давайте ответим на несколько основных вопросов.Вопрос 1: Какова роль АТФ в энергетическом соединении?
Ответ: АТФ – это молекула, выброс энергии которой используется для сопряжения экзергонической реакции с усилением эндергонической реакции в энергетическом соединении. Связывание АТФ обеспечивает эту эндергоническую реакцию, которая потенциально может проявиться сейчас. Без подвода энергии свободная энергия Гиббса реагентов в эндергонической реакции «слишком мала» . Только при добавлении энергии от гидролиза АТФ может произойти эндергоническая реакция. Следовательно, незаменимая роль молекулы АТФ в энергетическом соединении несравнима и непреодолима.
Вопрос 2: Высвобождается ли энергия при гидролизе?
Ответ: Да, потому что реакции гидролиза включают присоединение молекулы воды к большой молекуле/полимеру и его расщепление на более мелкие молекулы/мономеры. Это сопровождается выделением энергии.
Вопрос 3: Обратим ли гидролиз АТФ?
Ответ: Да, преобразование АТФ в АДФ обратимо. Это происходит через фосфорилирование и дефосфорилирование. Здесь АТФ, однажды преобразованный в АДФ путем гидролиза, может быть повторно преобразован в АТФ на “chemiosmotic coupling/phosphorylation” in the inner membranes (IM) of mitochondria:
909 993 I + Free Energy 34090909 9.Phosphorylation : Adenosine-P i -P i + P i + Free Energy 🡪 Adenosine-P i -P i-Pi
Дефосфорилирование : Аденозин-P I -P I-PI 🡪 Аденозин-P I -P I + P I + Free Energy
 0023 Чтобы узнать больше о хемиосмотическом связывании/фосфорилировании и образовании АТФ, прочитайте нашу статью о «МИТОХОНДРИЯХ»
0023 Чтобы узнать больше о хемиосмотическом связывании/фосфорилировании и образовании АТФ, прочитайте нашу статью о «МИТОХОНДРИЯХ» Вопрос 4: Является ли гидролиз АТФ экзэргоническим ?
Ответ: Да, потому что свободная энергия Гиббса продуктов меньше, чем свободная энергия Гиббса реагентов.
Вопрос 5: Является ли анаболизм эндергоническим ?
Ответ: Да, все анаболические реакции являются эндергоническими, что означает, что они требуют затрат энергии. Напротив, катаболические реакции (или катаболизм) экзэргонический ; то есть они высвобождают энергию.
Как работает энергетическая связь
Прежде чем мы начнем объяснять вам, как работает энергетическая связь, вы должны сначала понять значение связанных реакций. «Связанные реакции» являются результатом хорошо сбалансированного сочетания двух разных типов реакций:
Таблица 1: Спонтанная реакция и неспонтанная реакция | ||
|---|---|---|
| Символ | Спонтанная реакция | Несамопроизвольная реакция |
| Энергетический | Экзергоник | Эндергоник |
| ΔG | ΔG>0 | ΔG<0 |
| Термодинамический | Благоприятный | Неблагоприятный |
| Действующий | Управляет термодинамически неблагоприятной реакцией | Требовать подачи энергии извне |
Рисунок 3: Взаимосвязь между спонтанностью и энергиями реагентов и продуктов.
 Изображение предоставлено: Muessig, лицензия CC.
Изображение предоставлено: Muessig, лицензия CC.
Энергетическая связь в гликолизе
Теперь, чтобы понять, как работает энергетическая связь, давайте рассмотрим пример связанных реакций в гликолизе. Для различных типов клеточных реакций и путей биохимические молекулы нуждаются в модификации, чтобы стать «подходящим конформным субстратом» для какой-то конкретной стадии, в которой они участвуют. Глюкоза — один из таких примеров. Для пути гликолиза в клеточном дыхании к глюкозе должна быть присоединена фосфатная группа. Вам должно быть интересно, кто в живой клетке достаточно добр, чтобы пожертвовать эту фосфатную группу глюкозе???
Да, вы правы. Это АТФ!
Внутри клетки гидролиз АТФ связан с этим превращением глюкозы в глюкозо-6-фосфат. Эта стадия фосфорилирования делает глюкозу конформационно пригодной для дальнейшей стадии превращения во фруктозу. И таким образом гликолиз идет дальше, и клеточное дыхание продолжается, не останавливаясь…
Рисунок 4: Превращение глюкозы в глюкозо-6-фосфат является важным этапом гликолиза. Это недостижимо для глюкозы до тех пор, пока не сработает энергетическая связь! Энергия гидролиза АТФ обеспечивает необходимую энергию для этого. Изображение предоставлено: профессор Доутор Педро Силва.
Это недостижимо для глюкозы до тех пор, пока не сработает энергетическая связь! Энергия гидролиза АТФ обеспечивает необходимую энергию для этого. Изображение предоставлено: профессор Доутор Педро Силва.Теперь, когда вы разобрались с энергетической связью, давайте разберемся, какую роль она играет в некоторых других системах живой клетки.
Энергетическая связь в натрий-калиевых насосах
Натрий-калиевый насос является важным трансмембранным ионным насосом внутри всех клеток. Этот насос Na + / K + выталкивает три Na + из цитоплазмы во внеклеточную жидкость и два K + из внеклеточной жидкости внутрь цитоплазмы. Функционирование этого насоса жизненно важно для поддержания полярности мембраны и потенциала покоя. Он также служит нескольким другим целям внутри клеточного преобразователя сигналов, контроллера состояния активности нейронов, регулятора объема клетки, транспорта и т. д.
Поскольку и Na + , и K + необходимо перекачивать в направлении, противоположном градиенту их концентрации, это требует «потребности энергии» . Здесь начинается роль гидролиза АТФ. На каждые три Na + , которые выкачиваются из клетки, и на каждые два K + , которые закачиваются в клетку, гидролизуется одна молекула АТФ. Этот гидролиз обеспечивает изменение конформации натрий-калиевого насоса в соответствии с переносом соответствующих молекул в клетку и из нее.
Здесь начинается роль гидролиза АТФ. На каждые три Na + , которые выкачиваются из клетки, и на каждые два K + , которые закачиваются в клетку, гидролизуется одна молекула АТФ. Этот гидролиз обеспечивает изменение конформации натрий-калиевого насоса в соответствии с переносом соответствующих молекул в клетку и из нее.
Энергетическая связь и метаболизм
Механизм энергетической связи играет важную роль в уравновешивании двух типов метаболизма, происходящих внутри клеток; анаболизм и катаболизм . Для анаболических реакций требуется энергия (эндергоническая по своей природе). Чтобы поддерживать анаболические реакции в биологической системе, к ним должен быть подключен какой-то источник энергии. Следовательно, катаболические реакции часто сочетаются с ними, поскольку они экзергоничны по своей природе (высвобождают энергию).
Чтобы поддерживать анаболические реакции в биологической системе, к ним должен быть подключен какой-то источник энергии. Следовательно, катаболические реакции часто сочетаются с ними, поскольку они экзергоничны по своей природе (высвобождают энергию).
Важность энергетического взаимодействия
Энергетическое взаимодействие эндергонических и экзергонических реакций внутри клеток гарантирует, что любое количество энергии, произведенное в первой экзергонической реакции, не рассеивается в виде тепла. Кроме того, энергетическая связь гарантирует, что она правильно направлена внутри биологической системы на вторичную реакцию — эндергоническую, где она может быть использована, а не потрачена впустую!
Короче говоря, энергетическая связь обеспечивает использование энергии РЕАКЦИИ-1 в качестве «ТОПЛИВА» для РЕАКЦИИ-2.
Примеры сочетания энергии
Благодаря сочетанию энергии клетки используют АТФ для различных целей, таких как:
- Гидролиз АТФ в сочетании с преобразованием глюкозы в глюкозо-6-фосфат
- Гидролиз АТФ в сочетании с натриево-калиевыми насосами
- Гидролиз АТФ в сочетании с образованием крахмала/гликогена/целлюлозы (образование цепочек сахаров)
- Гидролиз АТФ с образованием РНК
- Гидролиз АТФ в сочетании с синтезом биомолекулярных полимеров – углеводов, липидов, белков и нуклеиновых кислот
- Гидролиз АТФ связан с важными биологическими путями, такими как гликолиз, цикл Кребса, глюконеогенез и т. д.
Попробуйте ответить на приведенный ниже тест, чтобы проверить, что вы уже узнали о связи энергии.
Викторина
Выберите лучший ответ.
1. Что такое энергетическая связь?
Сочетание двух биологических реакций
Сочетание одной биологической реакции
Сочетание одной или нескольких биологических реакций
2. АТФ означает ….
Аденинтрифосфат
Альфа-трифосфат
Аденозинтрифосфат
3. Сахарный компонент АТФ
Аденин
Аденозин
Фосфат
4. Превращение АТФ в АДФ
Гидролиз АТФ
Сочетание АТФ
Фосфорилирование
5. Превращение глюкозы в глюкозо-6-фосфат является стадией ….

 , Евангелиста, Ф. (1987). Корреляция и предсказание энтальпий смешения для систем, содержащих спирты, с помощью теории связанных растворов UNIQUAC. Инд.Инж. хим. Рез. 26 (12), 2423–2430.
, Евангелиста, Ф. (1987). Корреляция и предсказание энтальпий смешения для систем, содержащих спирты, с помощью теории связанных растворов UNIQUAC. Инд.Инж. хим. Рез. 26 (12), 2423–2430. 8 Дж/мольК
8 Дж/мольК A денозин M оно p фосфат)
A денозин M оно p фосфат)