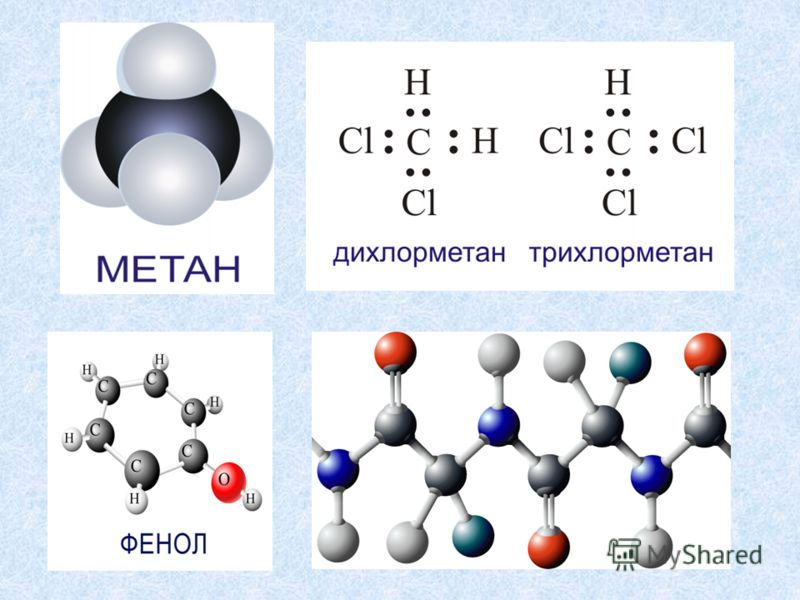
Дихлорометан
Телефонуйте:
Youtube Video 🙂
Вікіпедія
Серпень 08, 2021
Дихлорометан (хлористий метилен, ДХМ, CH2Cl2) — прозора легкорухома і легколетка рідина з характерним для галогенпохідних солодкуватим запахом. Вперше був синтезований 1840 року витримуванням суміші хлору з хлористим метилом на світлі. В цілому найбезпечніший серед галогеноалканів.
Зміст
- 1 Отримання
- 2 Фізичні властивості
- 3 Хімічні властивості
- 4 Джерела
- 5 Примітки
Отримання
Отримують прямим хлоруванням метану хлором в умовах радикального механізму при 400—500 °C при співвідношенні рівному 5:1
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
У результаті виходить суміш всіх можливих хлоридів: хлорометан, діхлорометан, хлороформ та чотирихлористий вуглець, які потім розділяються дистиляцією. Після чого він має чистоту не менше 99,7%.
Після чого він має чистоту не менше 99,7%.
Фізичні властивості
Розчинність у воді 2% за масою (13 г/л), змішується з більшістю органічних розчинників. Легколеткий (39,7 °C), утворює азеотропну суміш з водою (Ткип 38,1 °C, 98,5% діхлорометану).
Хімічні властивості
Метиленхлорид (діхлорометан) реагує з хлором з поетапним утворенням хлороформу і чотирихлористого вуглецю.
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
З йодом при 200 °C дає СН2l2, з бромом при 25—30 °C у присутності алюмінію — бромхлорметан.
При нагріванні з водою гідролізується до метаналю:
- CH2Cl2 + H2O → НCOH + HCl
При нагріванні зі спиртовим розчином амоніаку NH3 до 100—125 °C утворює гексаметилентетрамін.
Реакція з водним розчином NH3 при 200 °C приводить до утворення метиламіну, мурашиної кислоти і HCl.
З ароматичними сполуками в присутності AlCl3 метиленхлорид вступає в реакцію Фріделя — Крафтса, наприклад з бензеном утворюється дифенілметан.
Джерела
- Химическая энциклопедия. Т. 3. — М. : 1988. — C. 60—61
Примітки
- ↑ а б в г д е Внесок про дихлорометан в базі даних GESTIS
- ↑ а б в г W. M. Haynes, CRC Handbook of Chemistry and Physics, 97th Edition, CRC Press, 2016-2017
| Це незавершена стаття про органічну сполуку. Ви можете допомогти проєкту, виправивши або дописавши її. |
Дихлорометан, хлористий, метилен, ДХМ, ch3cl2, прозора, легкорухома, легколетка, рідина, характерним, для, галогенпохідних, солодкуватим, запахом, Вперше, був, синтезований, 1840, року, витримуванням, суміші, хлору, хлористим, метилом, на, світлі, цілому, найб. Dihlorometan hloristij metilen DHM Ch3Cl2 prozora legkoruhoma i legkoletka ridina z harakternim dlya galogenpohidnih solodkuvatim zapahom Vpershe buv sintezovanij 1840 roku vitrimuvannyam sumishi hloru z hloristim metilom na svitli V cilomu najbezpechnishij sered galogenoalkaniv Strukturna formulaZagalna informaciyaPreferencijna nazva IYuPAK DihlorometanSistematichna nazva IYuPAK DihlorometanInshi nazvi Metilenhlorid Metilendihlorid DHM DCM R 30Himichna formula Ch3Cl23D Struktura JSmol Interaktivne zobrazhennyaZovnishni identifikatori Bazi danihCAS 75 09 2ECHA ID 100 000 763PubChem 6344ChemSpider 6104ChEBI 15767EINECS 200 838 9InChI 1S Ch3Cl2 c2 1 3 h2h3SMILES ClCClVlastivostiMolyarna masa 84 93 g mol 1Agregatnij stan RidinaGustina 1 33 g sm 3 20 C 1 Temperatura plavlennya 97 C 1 Temperatura kipinnya 40 C 1 Tisk nasichenoyi pari 470 gPa 20 C 701 gPa 30 C 1016 gPa 40 C 1 Rozchinnist 20 g dm 3 h3O 20 C 1 Zmishuyetsya z etanolom i dietilolvim efirom Rozchinyayetsya v tetrahlorometani 2 Dipolnij moment 1 62 D 2 Koeficiyent zalomlennya 1 4242 20 C 2 Termodinamichni vlastivostiDfH 298 124 2 kDzh mol 1 2 BezpekaMarkuvannya zgidno sistemi UGS UvagaH frazi H h415 h419 h435 h436 h451 h473P frazi P P261 P305 P351 P338LD50 1600 mg kg oralno pacyuk 1 Naskilki ce mozhlivo znachennya velichin podani v odinicyah sistemi SI Yaksho ne vkazano inshogo usi dani vidnosyatsya do standartnogo stanu Zmist 1 Otrimannya 2 Fizichni vlastivosti 3 Himichni vlastivosti 4 Dzherela 5 PrimitkiOtrimannya RedaguvatiOtrimuyut pryamim hloruvannyam metanu hlorom v umovah radikalnogo mehanizmu pri 400 500 C pri spivvidnoshenni rivnomu 5 1 Ch5 Cl2 Ch4Cl HCl Ch4Cl Cl2 Ch3Cl2 HCl Ch3Cl2 Cl2 CHCl3 HCl CHCl3 Cl2 CCl4 HClU rezultati vihodit sumish vsih mozhlivih hloridiv hlorometan dihlorometan hloroform ta chotirihloristij vuglec yaki potim rozdilyayutsya distilyaciyeyu Pislya chogo vin maye chistotu ne menshe 99 7 Fizichni vlastivosti RedaguvatiRozchinnist u vodi 2 za masoyu 13 g l zmishuyetsya z bilshistyu organichnih rozchinnikiv Legkoletkij 39 7 C utvoryuye azeotropnu sumish z vodoyu Tkip 38 1 C 98 5 dihlorometanu Himichni vlastivosti RedaguvatiMetilenhlorid dihlorometan reaguye z hlorom z poetapnim utvorennyam hloroformu i chotirihloristogo vuglecyu Ch3Cl2 Cl2 CHCl3 HCl CHCl3 Cl2 CCl4 HClZ jodom pri 200 C daye SN2l2 z bromom pri 25 30 C u prisutnosti alyuminiyu bromhlormetan Pri nagrivanni z vodoyu gidrolizuyetsya do metanalyu Ch3Cl2 h3O NCOH HClPri nagrivanni zi spirtovim rozchinom amoniaku Nh4 do 100 125 C utvoryuye geksametilentetramin Reakciya z vodnim rozchinom Nh4 pri 200 C privodit do utvorennya metilaminu murashinoyi kisloti i HCl Z aromatichnimi spolukami v prisutnosti AlCl3 metilenhlorid vstupaye v reakciyu Fridelya Kraftsa napriklad z benzenom utvoryuyetsya difenilmetan Dzherela RedaguvatiHimicheskaya enciklopediya T 3 M 1988 C 60 61Primitki Redaguvati a b v g d e Vnesok pro dihlorometan v bazi danih GESTIS a b v g W M Haynes CRC Handbook of Chemistry and Physics 97th Edition CRC Press 2016 2017 Ce nezavershena stattya pro organichnu spoluku Vi mozhete dopomogti proyektu vipravivshi abo dopisavshi yiyi Otrimano z https uk wikipedia org w index php title Dihlorometan amp oldid 28702074, Вікіпедія, Українська, Україна, книга, книги, бібліотека, стаття,
Dihlorometan hloristij metilen DHM Ch3Cl2 prozora legkoruhoma i legkoletka ridina z harakternim dlya galogenpohidnih solodkuvatim zapahom Vpershe buv sintezovanij 1840 roku vitrimuvannyam sumishi hloru z hloristim metilom na svitli V cilomu najbezpechnishij sered galogenoalkaniv Strukturna formulaZagalna informaciyaPreferencijna nazva IYuPAK DihlorometanSistematichna nazva IYuPAK DihlorometanInshi nazvi Metilenhlorid Metilendihlorid DHM DCM R 30Himichna formula Ch3Cl23D Struktura JSmol Interaktivne zobrazhennyaZovnishni identifikatori Bazi danihCAS 75 09 2ECHA ID 100 000 763PubChem 6344ChemSpider 6104ChEBI 15767EINECS 200 838 9InChI 1S Ch3Cl2 c2 1 3 h2h3SMILES ClCClVlastivostiMolyarna masa 84 93 g mol 1Agregatnij stan RidinaGustina 1 33 g sm 3 20 C 1 Temperatura plavlennya 97 C 1 Temperatura kipinnya 40 C 1 Tisk nasichenoyi pari 470 gPa 20 C 701 gPa 30 C 1016 gPa 40 C 1 Rozchinnist 20 g dm 3 h3O 20 C 1 Zmishuyetsya z etanolom i dietilolvim efirom Rozchinyayetsya v tetrahlorometani 2 Dipolnij moment 1 62 D 2 Koeficiyent zalomlennya 1 4242 20 C 2 Termodinamichni vlastivostiDfH 298 124 2 kDzh mol 1 2 BezpekaMarkuvannya zgidno sistemi UGS UvagaH frazi H h415 h419 h435 h436 h451 h473P frazi P P261 P305 P351 P338LD50 1600 mg kg oralno pacyuk 1 Naskilki ce mozhlivo znachennya velichin podani v odinicyah sistemi SI Yaksho ne vkazano inshogo usi dani vidnosyatsya do standartnogo stanu Zmist 1 Otrimannya 2 Fizichni vlastivosti 3 Himichni vlastivosti 4 Dzherela 5 PrimitkiOtrimannya RedaguvatiOtrimuyut pryamim hloruvannyam metanu hlorom v umovah radikalnogo mehanizmu pri 400 500 C pri spivvidnoshenni rivnomu 5 1 Ch5 Cl2 Ch4Cl HCl Ch4Cl Cl2 Ch3Cl2 HCl Ch3Cl2 Cl2 CHCl3 HCl CHCl3 Cl2 CCl4 HClU rezultati vihodit sumish vsih mozhlivih hloridiv hlorometan dihlorometan hloroform ta chotirihloristij vuglec yaki potim rozdilyayutsya distilyaciyeyu Pislya chogo vin maye chistotu ne menshe 99 7 Fizichni vlastivosti RedaguvatiRozchinnist u vodi 2 za masoyu 13 g l zmishuyetsya z bilshistyu organichnih rozchinnikiv Legkoletkij 39 7 C utvoryuye azeotropnu sumish z vodoyu Tkip 38 1 C 98 5 dihlorometanu Himichni vlastivosti RedaguvatiMetilenhlorid dihlorometan reaguye z hlorom z poetapnim utvorennyam hloroformu i chotirihloristogo vuglecyu Ch3Cl2 Cl2 CHCl3 HCl CHCl3 Cl2 CCl4 HClZ jodom pri 200 C daye SN2l2 z bromom pri 25 30 C u prisutnosti alyuminiyu bromhlormetan Pri nagrivanni z vodoyu gidrolizuyetsya do metanalyu Ch3Cl2 h3O NCOH HClPri nagrivanni zi spirtovim rozchinom amoniaku Nh4 do 100 125 C utvoryuye geksametilentetramin Reakciya z vodnim rozchinom Nh4 pri 200 C privodit do utvorennya metilaminu murashinoyi kisloti i HCl Z aromatichnimi spolukami v prisutnosti AlCl3 metilenhlorid vstupaye v reakciyu Fridelya Kraftsa napriklad z benzenom utvoryuyetsya difenilmetan Dzherela RedaguvatiHimicheskaya enciklopediya T 3 M 1988 C 60 61Primitki Redaguvati a b v g d e Vnesok pro dihlorometan v bazi danih GESTIS a b v g W M Haynes CRC Handbook of Chemistry and Physics 97th Edition CRC Press 2016 2017 Ce nezavershena stattya pro organichnu spoluku Vi mozhete dopomogti proyektu vipravivshi abo dopisavshi yiyi Otrimano z https uk wikipedia org w index php title Dihlorometan amp oldid 28702074, Вікіпедія, Українська, Україна, книга, книги, бібліотека, стаття,
читати
, завантажити, безкоштовно, безкоштовно завантажити, mp3, відео, mp4, 3gp, jpg, jpeg, gif, png, малюнок, музика, пісня, фільм, книга, гра, ігриЗаконы :: Методические указания по газохроматографическому измерению концентраций ацетона, дихлорметана, дихлорэтана, трихлорэтилена, бензола в воздухе рабочей зоныПриказ Главного государственного санитарного врача СССР от 1986-11-06 N 4166-86МУ от 06.
 11.1986
11.1986МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ГАЗОХРОМАТОГРАФИЧЕСКОМУ ИЗМЕРЕНИЮ КОНЦЕНТРАЦИЙ АЦЕТОНА,
ДИХЛОРМЕТАНА, ДИХЛОРЭТАНА, ТРИХЛОРЭТИЛЕНА, БЕНЗОЛА
В ВОЗДУХЕ РАБОЧЕЙ ЗОНЫ
УТВЕРЖДЕНЫ Заместителем Главного государственного санитарного врача СССР А.И.Заиченко 6 ноября 1986 г. N 4166-86
Таблица 4
Физико-химические свойства веществ
Название вещества | Структурная формула | Агрегатное состояние | Мол. масса | Плотность, Т | Температура кипения, °С | Раство- |
Ацетон | СНСОСН |  | 58,08 | 0,7908 | 56,24 | Э, сп, хл. |
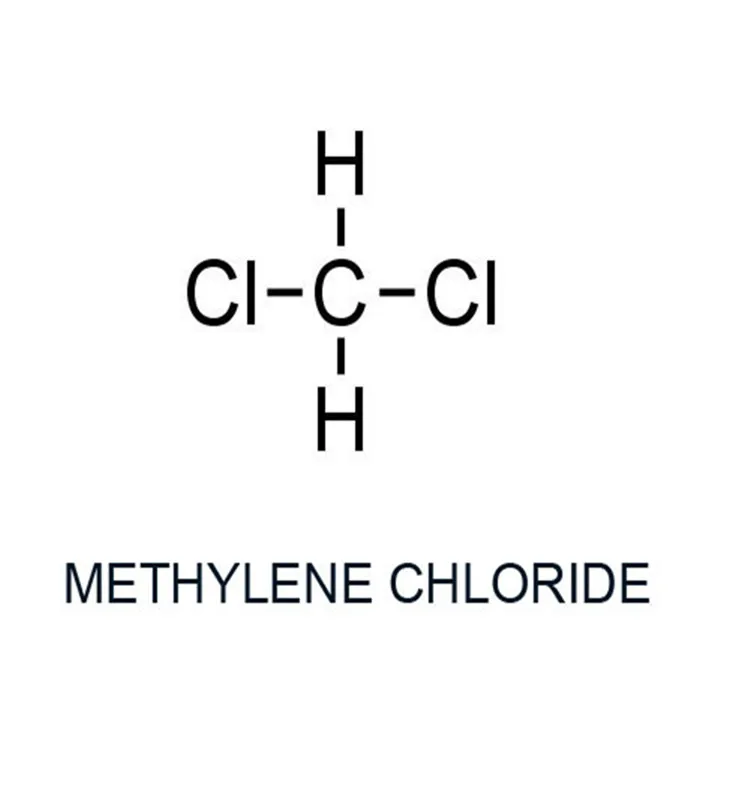
Дихлорметан | CHCl | жидк. | 84,93 | 1,3348 | 40,1 | сп, э. |
Дихлорэтан | CHCl-CHCl | жидк. | 98,95 | 1,2576 | 83,7 | сп, э. |
Трихлорэтилен | CHCl=CCl | жидк. | 131,38 | 1,4397 | 88,90 | сп, э. |
Бензол |
| жидк. | 78,12 | 0,879 | 80,10 | сп, э. |
В воздухе вещества находятся в виде паров.
1. Характеристика метода
Определение основано на использовании газожидкостной хроматографии на приборе с пламенно-ионизационным детектором.
Отбор проб проводится без концентрирования.
Предел измерения в анализируемом объеме пробы 0,005 мкг.
Предел измерения веществ в воздухе 1,0 мг/м (при анализе 5 мл воздуха).
Диапазон измеряемых концентраций веществ 1,0-100 мг/м.
Определению не мешают алифатические углеводороды.
Граница суммарной погрешности измерения не превышает ±25%.

Предельно допустимая концентрация в воздухе рабочей зоны (мг/м): ацетона — 200, дихлорметана — 50, дихлорэтана — 10, трихлорэтилена — 10, бензола — 5.
2. Реактивы, растворы и материалы
Ацетон, х.ч., ТУ 6-09-1707-77.
Бензол, х.ч., ТУ 6-09-779-76.
Дихлорметан, х.ч., ТУ 6-09-2662-77.
Дихлорэтан, х.ч., ТУ 6-09-2661-78.
Трихлорэтилен, х.ч., МРТУ 6-09-5300-68.
Носитель-хроматон N-AW-ДМСS, фракции 0,20-0,25 мм.
Жидкая фаза — Апиезон .
Азот газообразный в баллонах с редуктором, ГОСТ 3022-80.
Водород газообразный в баллонах с редуктором, ГОСТ 3022-80.
Воздух ГСП в баллонах с редуктором, ГОСТ 1182-73.
3. Приборы и посуда
Хроматограф с пламенно-ионизационным детектором.
Колонка хроматографическая стальная, длиной 2 мм*, диаметром 3 мм.
_________________
* Соответствует оригиналу. — Примечание .
Аспирационное устройство.
Пипетки газовые, вместимостью 200-300 мл, ГОСТ 18954-73.
Микрошприцы МШ-10 и МШ-1, ГОСТ 8043-74.
Шприцы медицинские со стеклянным поршнем, вместимостью 5 мл, ТУ 64-1-1279-75.
Бутыли дозировочные, вместимостью 20 л.
Секундомер, ГОСТ 5072-79.
Линейка измерительная.
Лупа измерительная, ГОСТ 8309-75.
Насос вакуумный.
4. Проведение измерения
Условия отбора проб воздуха
Десятикратный объем воздуха со скоростью 1-2 л/мин аспирируют через газовые пипетки. По окончании отбора пипетки закрывают стеклянными заглушками. Анализ необходимо проводить в день отбора проб.
Приготовление насадки для хроматографической колонки
Фракцию 0,20-0,25 мм хроматона N-AW-ДМСS отсеивают от пыли, затем высушивают в течение 2-3 часов в сушильном шкафу при температуре 200 °С. Апиезон в количестве 10% от массы носителя растворяют в хлороформе. В полученный раствор вносят твердый носитель, перемешивают, остатки растворителя удаляют выпариванием на водяной бане.
Приготовленной насадкой заполняют хроматографические колонки с применением вакуума. Колонки помещают в термостат и продувают газом-носителем в течение 3-4 часов при температуре 160 °С.
Условия анализа
Для анализа отбирают из газовых пипеток медицинским шприцем 1-5 мл пробы и вводят посредством прокола самоуплотняющейся мембраны испарителя в хроматографическую колонку. Скорость ввода и шприц должны быть постоянными.
Температура колонки 80 °С.
Температура испарителя 125 °С.
Скорость потока газа-носителя 25 мл/мин.
Скорость потока водорода 30 мл/мин.
Скорость потока воздуха 300 мл/мин.
Скорость движения диаграммной ленты 240 мм/час.
Чувствительность измерения 50х10 А.
Максимальный объем анализируемой пробы 5 мл.
Время удерживания:
ацетона | 0,9 мин |
дихлорметана | 1,4 мин |
дихлорэтана | 2,0 мин |
трихлорэтилена | 2,7 мин |
бензола | 2,2 мин |
Продолжительность анализа | 3 мин. |
Количественное определение проводят методом абсолютной калибровки по каждому компоненту отдельно,
Для этого в бутылях емкостью 20 л готовят искусственные газовоздушные смеси ацетона, дихлорметана, дихлорэтана, трихлорэтилена, бензола с концентрацией 0,05 мг/л. Затем отбирают 0,1; 0,2; 0,3; 0,5; 1,0; 5,0; 10,0 мл смеси, что соответствует 0,005; 0,010; 0,015; 0,025; 0,050; 0,25; 0,50 мкг каждого компонента и хроматографируют 5 раз.
Определяют площади пиков путем умножения высоты пика на его ширину, измеренную на половине высоты. По полученным данным строят графики зависимости площади пика от количества каждого компонента (мкг) в смесях. Условия градуировки и проведения анализа должны быть идентичными.
Концентрацию каждого компонента в мг/м воздуха () вычисляют по формуле:
,
где — количество компонента, найденное по градуировочному графику, мкг;
— объем воздуха, отобранный для анализа, мл.
Текст документа сверен по:
Методические указания по измерению концентраций
(переработанные технические условия, выпуск N 9): Сборник
/ Министерство здравоохранения СССР. — М., 1986
Дихлорметан (CCl2h3) Свойства (25 фактов, которые вы должны знать) Давайте кратко рассмотрим некоторые факты о дихлорметане в этой статье.
Дихлорметан получают реакцией хлорметана (CH 3 Cl) с хлором, что приводит к получению хлорметана, дихлорметана, хлористого водорода, являющегося побочным продуктом, и газообразного хлороформа при температуре 400–500 °C. Позже метод, который используется для их разделения, — дистилляция 9.0010 .
Обладает отличной способностью растворять большое количество органических соединений, что делает его очень полезным растворителем. Далее в статье мы обсудим физико-химические свойства, такие как температура кипения и степень окисления дихлорметана.
Название IUPAC для CCl 2 H 2 – дихлорметан.
Химическая формула дихлорметанаХимическая формула дихлорметана CCl 2 H 2 . химическая формула CCl 2 H 2
Дихлорметан Номер CASНомер CAS (подлинный числовой идентификатор, который может содержать до 10 цифр) дихлорметана
Дихлорметан ChemSpider IDChemSpider ID (Chemspider — бесплатная база данных химической структуры) для дихлорметана — 6104.
Химическая классификация дихлорметанаДихлорметан химически классифицируется как хлорорганическое соединение.
Молярная масса дихлорметана Молярная масса (масса одного моля вещества) дихлорметана составляет 84,93 г/моль.
Дихлорметан выглядит как бесцветная жидкость.
Вязкость дихлорметанаВязкость дихлорметана составляет 0,437 мПа .
Молярная плотность дихлорметанаМолярная плотность дихлорметана составляет 1,3266 г/см 3 .
Температура плавления дихлорметанаТемпература плавления дихлорметана составляет -96,7 °C или -142,06 °F. Это означает, что он имеет очень низкие межмолекулярные силы.
Температура кипения дихлорметанаТемпература кипения дихлорметана составляет 39,6 °C или 103,3 °F. Причина, по которой дихлорметан имеет низкую температуру кипения, заключается в том, что это негорючий растворитель.
Состояние дихлорметана при комнатной температуре При комнатной температуре дихлорметан представляет собой жидкость. Он не смешивается с водой, но растворяется в большинстве органических растворителей, таких как этанол, эфир, фенолы, альдегиды и кетоны.
Он не смешивается с водой, но растворяется в большинстве органических растворителей, таких как этанол, эфир, фенолы, альдегиды и кетоны.
Дихлорметан не имеет ковалентного радиуса, так как по своей природе нереактивен.
Ковалентная связь дихлорметанаДихлорметан проявляет ковалентную связь, поскольку центральный атом углерода гибридизуется, имея гибридизацию sp 3 , и молекула образует все четыре связи в соединении.
Электронные конфигурации дихлорметанаЭлектронные конфигурации показывают, как происходит распределение электронов по орбиталям. Давайте обсудим это более подробно, поскольку мы не можем предсказать электронную конфигурацию комплекса.
- Электронная конфигурация углерода записывается как [He] 2s 2 2p 2 .

- Электронная конфигурация для водорода: 1s 1 .
- Электронная конфигурация хлора [Ne] 3s 2 3p 5 .
Степень окисления дихлорметана равна 0, потому что степень окисления водорода всегда +1, а для галогенов, то есть хлора, -1.
Кислотность дихлорметанаДихлорметан является кислотой Льюиса, и дихлорметан очень легко принимает электроны, что делает его кислотой Льюиса.
Дихлорметан без запахаДихлорметан имеет сладкий запах хлороформа.
Является ли дихлорметан парамагнитным Соединение считается парамагнитным, если его электроны не полностью спарены. Выясним, является ли дихлорметан парамагнитным или нет.
Дихлорметан диамагнитен по своей природе, так как все электроны полностью спарены.
Дихлорметан умеренно растворим в воде.
Кристаллическая структура дихлорметанаВ своей кристаллической форме дихлорметан имеет тетраэдрическую структуру.
Полярность дихлорметана и электропроводность- Дихлорметан полярен по своей природе из-за своей тетраэдрической геометрии, а также, отдельные диполи связи не компенсируют друг друга. Другим важным объяснением этого является различие в электроотрицательности атомов углерода, хлора и водорода.
- Теплопроводность дихлорметана составляет 0,1392 Вт/м/К
Дихлорметан не реагирует ни с какой кислотой. На самом деле, он очень неактивен по своей природе.
Реакция дихлорметана с основанием Дихлорметан не реагирует с основаниями из-за своей инертности. Дихлорметан, наряду с производными пиридина, используется в реакциях из-за того, что дихлорметан очень универсален в качестве растворителя.
Дихлорметан, наряду с производными пиридина, используется в реакциях из-за того, что дихлорметан очень универсален в качестве растворителя.
Никакой реакции не происходит, поскольку он очень стабилен.
Реакция дихлорметана с металломДихлорметан не реагирует с металлами из-за своей инертности.
ЗаключениеДихлорметан представляет собой негорючую жидкость, которая широко используется в качестве растворителя благодаря своей универсальности в качестве растворителя. Пищевые технологии и фармацевтические компании являются основными областями, где используется дихлорметан, что делает его очень полезным. Он имеет тетраэдрическую геометрию и полярен по своей природе.
c2h3cl2-lewis-structure-molecular-geometry — Google Suche
AlleBilderVideosBücherMapsNewsShopping
Suchoptionen
C2h3Cl2 Lewis structure, Molecular geometry, Polar or nonpolar . ..
..
topblogtenz.com › c2h3cl2-lewis-structure-molecula …
29.12.2022 · Молекулярная геометрия C2h3Cl2 по отношению к обоим атомам углерода тригонально-плоская. Поскольку оба центральных атома углерода связаны с тремя …
Выполните несколько шагов для рисования… · Что такое молекулярная…
Ähnliche Fragen
Какова молекулярная геометрия C2h3Cl2?
Является ли C2h3Cl2 тригонально-плоским?
Является ли ch3cl2 тетраэдрическим или тригонально-пирамидальным?
Какова молекулярная геометрия структуры Льюиса?
Картинка
Alle anzeigen
Alle anzeigen
Как нарисовать структуру Льюиса для C2h3Cl2. — YouTube
www.youtube.com › смотреть
26.07.2013 · Пошаговое объяснение того, как нарисовать точечную структуру Льюиса C2h3Cl2 (1,2 …
Dauer: 2:15
Прислан: 26.07.2013
Как нарисовать структуру Льюиса для C2h3Cl2 — YouTube
www.youtube. com › смотреть
com › смотреть
20.07.2022 · Ch3cl1, химическая формула 2 для C2h3Cl2 дихлорэтилен. И чтобы помочь вам понять Льюис …
Дауэр: 1:56
Прислан: 20.07.2022
Химическая связь: C 2 H 2 Cl 2 Структура Льюиса — Geoexchange
www.thegeoexchange.org › химия › C2h3Cl2-le…
Расшифровка: Это структура Льюиса C2h3Cl2. У углерода 4 валентных электрона, два углерода; Водород имеет 1 валентный электрон, но у нас есть два Водорода; …
Как можно определить точечную структуру Льюиса для C2h3Cl2? — Quora
www.quora.com › Как определить структуру точек Льюиса для C2…
Структура Льюиса, показывающая расположение всех валентных электронов, указывает какие атомы связаны с какими другими. Молекулярная формула, подобная той, что …
Нарисуйте структуру молекулы C2h3Cl2 по Льюису — Study.com
homework.study.com › объяснение › нарисуйте-Льюи…
Ответ на: Изобразите структуру Льюиса молекулы C2h3Cl2.