Дигидроксосульфат алюминия, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
3. Сооружения реагентного хозяйства для осветления и обесцвечивания воды
36
3.1. Выбор реагентов, определение их доз
В сооружениях реагентного хозяйства предусматривается приготовление и дозирование всех растворов реагентов, используемых для подготовки воды, кроме обеззараживающих.
Коагулянт
Коагулянты,
используемые в настоящее время для
осветления и обесцвечивания природных
вод представляют собой соли слабых
оснований многовалентных металлов и
сильных кислот. Вид применяемых реагентов
для коагуляции принимается на основании
результатов технологических испытаний
и технико-экономического анализа. При
этом следует учитывать требования,
предъявляемые к качеству очищенной
воды. Чем меньше в коагулянте нерастворимых
в воде примесей и чем больше в нем
активного вещества, тем эффективней
будет протекать процесс коагуляции.
Классификация современных коагулянтов
приведена на рис. 3.1. Сведения о коагулянтах,
рекомендуемых для выбора при выполнении
курсовых и дипломных проектов приведены
в таблице 3.1.
3.1. Сведения о коагулянтах,
рекомендуемых для выбора при выполнении
курсовых и дипломных проектов приведены
в таблице 3.1.
Таблица 3.1.
Коагулянты, применяемые в водоподготовке
Наименование | Хим.формула | ГОСТ | Содержание активного вещества, % | Эквивалентная масса, мг/мг-экв | Вид поставки |
Алюминий сернокислый технический (очищенный) | AI2(SO4)3·10 H2O | 12966-85 | высший сорт – 16,3 1 сорт — 15 2 сорт – 14 | 57 | навалом |
Глинозем сернокислый неочищщенный | AI2(SO4)3·18 H2O | сорт А – 9,5 сорт Б -9,5 | 57 | навалом | |
Оксихлорид алюминия | AI2(OH)5CI·6 H2O | 40-44 | 57 | 35% раствор | |
Алюминат натрия | NaAIO2 | 55 | 57 | мешки 40-50 кг | |
Хлорное железо | FeCI3 | 11159-76 | 1 сорт -97 2 сорт -95 | 54 | стальные барабаны |
Железный купорос | FeSO4·7 H2O | 6881-75 | 1 сорт -53 2 сорт — 47 | 76 | мешки |
Рис. 3.1. Классификация
коагулянтов
3.1. Классификация
коагулянтов
СА-сульфат алюминия, АК- алюминиевые квасцы, ДГСА – дигидроксосульфат алюминия, КАСОФТ- очищенный СА (сухой), ALG — коагулянт на основе СА, ГОСХА — гидроксосульфат алюминия, ХА — хлорид алюминия, ХПА – хлорид полиалюминия, НХА — низкоосновной хлорид алюминия, ВХА — высокоосновной хлорид алюминия, ПАХ — полиалюминий-хлорид, PAX- — полиалюминий-хлорид, ГХА — гидроксохлорид алюминия, ГОХА — гидрооксихлорид алюминия, ОХА — оксихлорид алюминия, ОГХА — оксигидратхлорид алюминия, ПОХА — полиоксихлорид алюминия, ПА — полиоксид алюминия, ПХСА – полихлорсульфат, ХСПА — хлорсульфат полиалюминия, ПОХСА (РАС) — полиоксихлорсульфат алюминия, ОСХА — оксисульфатхлорид алюминия, ГХСА — гидроксохлорид-сульфат алюминия, СЖ — сульфат железа, СПФ – сульфат полиферрита, ПЖ — полисульфат железа, ХЖ — хлорид железа, ХЖК — хлорированный железный купорос, АЖК — алюмо-железный коагулянт, AVR — алюмо-железный коагулянт, САХЖ — сульфат алюминия +хлорид железа, САиЖ — сульфат алюминия +сульфат железа, ХА+ХЖ — хлорид алюминия+ +хлорид железа, PASIC — полиалюминий-силикат хлорида, ПАСХ — полиалюминий-силикат хлорида, АКФК — алюмо-кремниевый коагулянт, ДК+ОА — диоксид кремния+ оксид алюминия, ПК+СА+СЖ — полисиликатный смешанный реагент, СА+СЖ+КК — сульфат алюминия и железа+кремнекислота, экозоль — 401 — трехфазный реагент, СА-ЗН-600 — композиционный коагулянт-флокулянт, АН — алюминат натрия, ХА+ДЦ — хлорид алюминия+ +диоксид циркония, POLYPOR — соединения фосфора, КМДГ — композиция молекулярно-диахлорных гидроксидов, пэк — полиэфирные коагулянты, АКА — активированный кальций-алюминий, АКФК — алюмо-кремниевый коагулянт-флокулянт, КК+ФКДА — Композиционный коагулянт с флокулянтом в виде коллоидно-дисперсных алюмосиликатов, ТК — титановый коагулянт, МПФ — мономерно-полимерный флокулян
Согласно требованиям
п. 6.16 [1] дозу коагулянта для обесцвечивания
воды определяют по формуле:
6.16 [1] дозу коагулянта для обесцвечивания
воды определяют по формуле:
, мг/л, (3.1.)
где Ц — цветность воды, град. ПКШ.
Для осветления воды дозу коагулянта в зависимости от мутности исходной воды принимают из таблицы 3.2.
Таблица 3.2.
Дозы коагулянта для вод разной мутности
Мутность воды, мг/л | Дк, мг/л, по безводному веществу | Мутность воды, мг/л | Дк, мг/л, по безводному веществу |
До 100 | 25…35 | 600…800 | 50…60 |
100…200 | 30…40 | 800…1000 | 60…70 |
200…400 | 35…40 | 1000…1500 | 70…80 |
400…600 | 45…50 |
Меньшие значения
доз относятся к воде, содержащей
грубодисперсные примеси. Если требуется
осветление и обесцвечивание воды, для
дальнейших расчетов принимается бóльшая
из доз коагулянта.
Если требуется
осветление и обесцвечивание воды, для
дальнейших расчетов принимается бóльшая
из доз коагулянта.
Реакция алюминия с водородом и другими веществами
Похоже, вы зашли на наш сайт из Германия . Пожалуйста, перейдите на наш региональный сайт для получения более актуальных цен, сведений о продуктах и специальных предложениях.
Выбрать другую страну
Химические свойства наиболее распространенных металлов
Алюминий — активный металл, стабилен на воздухе и быстро окисляется при нормальной температуре, образуя плотную оксидную пленку, защищающую металл от дальнейшего повреждения.
[Депозитные фотографии]Взаимодействие алюминия с другими веществами
В обычных условиях вода не влияет на этот металл даже в кипящем состоянии. Если с поверхности алюминия снять защитную оксидную пленку, металл вступает в энергичное взаимодействие с водяным паром воздуха, превращаясь в рассыпчатую массу гидроксида алюминия с выделением водорода и тепла. Уравнение реакции:
Если с поверхности алюминия снять защитную оксидную пленку, металл вступает в энергичное взаимодействие с водяным паром воздуха, превращаясь в рассыпчатую массу гидроксида алюминия с выделением водорода и тепла. Уравнение реакции:
2Al + 6H₂O = 2Al(OH)₃ + 3H₂
Гидроксид алюминия [Википедия]Если с алюминия снять защитную оксидную пленку, металл вступает в бурное взаимодействие с кислородом. Алюминиевый порошок сгорает, образуя оксид. Уравнение реакции:
4Al + 3O₂ = 2Al₂O₃
Этот металл также активно взаимодействует со многими кислотами. В реакции с соляной кислотой наблюдается выделение водорода. Уравнение реакции:
2Al + 6HCl = 2AlCl3 + 3H₂
В обычных условиях концентрированная азотная кислота не взаимодействует с алюминием, так как азотная кислота, как сильный окислитель, делает оксидную пленку еще прочнее.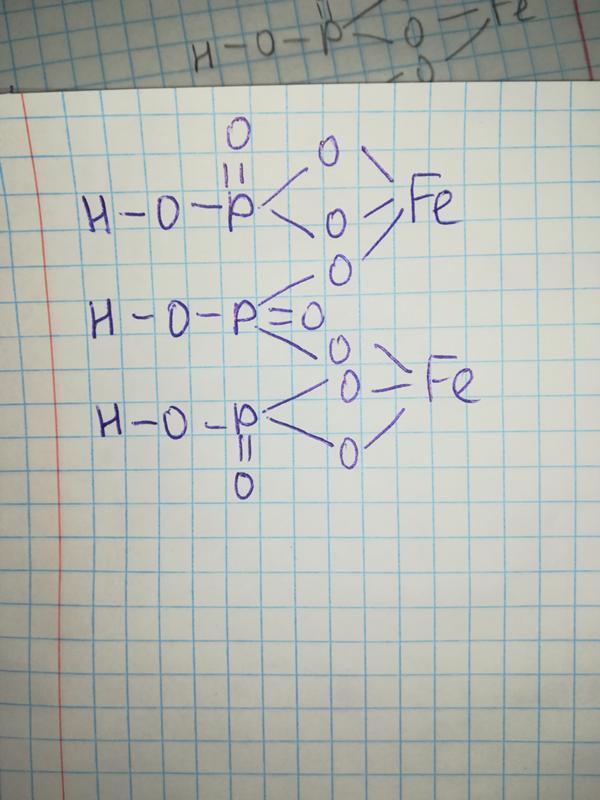 По этой причине азотную кислоту хранят и транспортируют в алюминиевой таре.
По этой причине азотную кислоту хранят и транспортируют в алюминиевой таре.
Алюминий при обычной температуре пассивен к разбавленной азотной и концентрированной серной кислоте. В горячей серной кислоте металл растворяется, и уравнение реакции:
2Al + 4H₂SO4 = Al₂(SO4)₃ + S + 4H₂O
Взаимодействие алюминия с неметаллами
Реагирует с галогенами, серой, азот, углерод и все неметаллы. Для реакции требуется тепло, после чего происходит взаимодействие с выделением большого количества тепла.
Взаимодействие алюминия с водородом
Алюминий не реагирует напрямую с водородом, хотя существует твердое полимерное соединение алан, в котором существуют так называемые трехцентровые связи. При температуре свыше 100 градусов Цельсия алан необратимо распадается на простые вещества. Гидрид алюминия бурно реагирует с водой.
Алюминий не реагирует с водородом напрямую — металл образует соединения, отдавая электроны, которые получают другие элементы. Атом водорода не получает электронов, которые отдают металлы для образования соединений — атомы водорода можно только «заставить» принять электроны с образованием твердых ионных соединений (гидридов) очень реакционноспособными металлами (калием, натрием, магнием, кальцием). Прямой синтез гидрида алюминия из водорода и алюминия требует огромного давления около 2 миллиардов атмосфер и температуры более 800 К. Здесь вы узнаете о химических свойствах других металлов.
Гидрид алюминия бурно реагирует с водой.
Алюминий не реагирует с водородом напрямую — металл образует соединения, отдавая электроны, которые получают другие элементы. Атом водорода не получает электронов, которые отдают металлы для образования соединений — атомы водорода можно только «заставить» принять электроны с образованием твердых ионных соединений (гидридов) очень реакционноспособными металлами (калием, натрием, магнием, кальцием). Прямой синтез гидрида алюминия из водорода и алюминия требует огромного давления около 2 миллиардов атмосфер и температуры более 800 К. Здесь вы узнаете о химических свойствах других металлов.
Следует отметить, что водород является единственным газом, который значительно растворяется в алюминии и его сплавах. Растворимость водорода изменяется пропорционально величине температуры и квадратному корню из давления. Растворимость водорода в жидком алюминии значительно выше, чем в твердом алюминии; это свойство незначительно изменяется в зависимости от химического состава сплавов.
Алюминий и его водородная пористость
Алюминиевая пена [Викимедиа]Образование в алюминии пузырей водорода напрямую зависит от скорости охлаждения и закалки, а также наличия очагов образования выделения водорода — оксидов, попавших внутрь сплава. Чтобы алюминий стал пористым, содержание растворенного водорода должно значительно превышать растворимость водорода в твердом алюминии. Если нет центров образования выделения водорода, требуется относительно высокая концентрация вещества.
Расположение водорода в закаленном алюминии зависит от уровня его содержания в жидком алюминии и условий, в которых происходило закаливание. Поскольку водородная пористость является результатом механизмов образования и роста, контролируемых диффузией, такие процессы, как уменьшение концентрации водорода и увеличение скорости твердения, подавляют образование и рост пор. По этой причине алюминий, отлитый методом разъемной формы, более подвержен дефектам, связанным с водородом, чем алюминий, отлитый под давлением.
По этой причине алюминий, отлитый методом разъемной формы, более подвержен дефектам, связанным с водородом, чем алюминий, отлитый под давлением.
Существуют различные источники поступления водорода в алюминий .
Плавильный материал — металлолом, слитки, литейные отходы, оксиды, песок и смазки, используемые при механической обработке. Эти загрязняющие вещества являются потенциальными источниками водорода, образующегося при химическом распаде водяного пара или восстановлении органических веществ.
Плавильные инструменты — скребки, пики и лопаты являются источником водорода. Оксиды и остатки флюсов на инструментах поглощают влагу из окружающего воздуха. Кирпичи для печей, распределительные каналы, ковши для отбора проб, желоба для извести и растворы цемента являются потенциальными источниками водорода.
Атмосфера печи — если плавильная печь работает на мазуте или природном газе, возможно неполное сгорание топлива с образованием свободного водорода.
Флюсы представляют собой гигроскопичные соли , способные мгновенно поглощать воду. По этой причине влажный флюс неизбежно добавляет водород в сплав, который образуется при химическом распаде воды.
Литейные формы — в процессе заполнения литейной формы жидкий алюминий течет турбулентно и захватывает воздух внутри себя. Если воздух не выйдет из формы до того, как алюминий начнет затвердевать, алюминий попадет в металл.
У нас есть для вас еще статьи по химии:
- Курение тыквы на Хэллоуин Как сделать дым из тыквы
- Эта жидкость меняет цвет при встряхивании. Чем быстрее вы встряхнете его, тем быстрее он станет синим!
Вы можете провести десятки химических опытов дома!
Трансмутация
Узнать больше
Попробуй
алюминий дигидрофосфат
- Главная
- Результаты для «дигидрофосфат алюминия»
| ID | КАС | Имя | Синонимы | Молекулярная формула | Категория |
|---|---|---|---|---|---|
| 1 | 13530-50-2 | Aluminium dihydrogen phosphate | trialuminum triphosphate ALUMINUM PHOSPHATE MONOBASIC Aluminum dihydrogen phosphate Aluminium phosphate,monobasic Aluminium dihydrogen phosphate ALUMINIUM DIHYDROGEN PHOSPHATE aluminum tris(dihydrogen phosphate) aluminumdihydrogenphosphatesolution aluminium tris(dihydrogen phosphate) | AlH6O12P3 | Inorganics;Organic materials;Organometallic compounds;Industrial/Fine Chemicals |
| 2 | 13530-50- 2 | Фосфат алюминия | Фосфат алюминия ФОСФАТ АЛЮМИНИЯ ОДНООСНОВНЫЙ Фосфат алюминия одноосновный ФОСФАТ АЛЮМИНИЯ ДВУВОДОРОДНЫЙ раствор алюминийдигидрофосфата трис(дигидрофосфата алюминия) | AlH6O12P3 | Нет; неорганические; промышленные/тонкие химикаты |
| 91 ID | 91 | КАС | Название продукта | Поставщики | Описания | |||
|---|---|---|---|---|---|---|---|---|
| 1 | 13530-50-2 | Алюминиевый дигидрофосфат основной продукт | Шанхай Маклин Биохимический Ко. | |||||
| 2 | 13530-50-2 | Aluminium dihydrogen phosphate Main Продукт | Shanghai Macklin Biochemical Co., Ltd ПРЕМИУМ-ПОСТАВЩИКИ Упаковка: 100 г | |||||
| 3 | 13530-50-2 | Aluminhure Dihydroden Phosple. кг Цена (внутренняя, в юанях) : 1198 Тел.:+86-18821248368 Мобильный :+86-18821248368 Электронная почта : [email protected] WhatsApp:+86-18811212436868 QN :+86-18811212436868 . | 4 | 13530-50-2 | Aluminium dihydrogen phosphate Main Product | Shanghai Macklin Biochemical Co., Ltd PREMIUM SUPPLIERS Package:25g | ||
| 5 | 13530-50-2 | Aluminium dihydrogen phosphate Main Product | Shanghai Macklin Biochemical Co., Ltd PREMIUM SUPPLIERS Package:500g | 7 Shanghai Yuanye Bio-Technology Co., Ltd. Premium Suppliers Спецификация : 95% | Алюминиевый дигидрофосфат 95% Yuanye S42226 | |||
| 7 | 13530-50-2 | Aluminum Dihydrogen Phosphate | Aluminum Dihydrogen Phosphate | Tuminum Dihydrogen FoposhAte | 9 | . ПРЕМИУМ-ПОСТАВЩИКИ ТЕЛ: 0086-551-65418684 |

 -18821248368
-18821248368 
