Амфотерные металлы: цинк и алюминий
На этой странице вы узнаете- Особенности строения атомов амфотерных металлов;
- Физические и химические свойства;
- И нашим, и вашим: обсудим амфотерность цинка и алюминия.
Кто-то любит соленое, кто-то любит сладкое, а кто-то — и то, и другое. То же самое происходит и с амфотерными металлами.
Характеристика амфотерных металловПод амфотерностью понимают способность соединений проявлять одновременно и кислотные, и основные свойства в зависимости от условий и природы реагентов, участвующих в реакции.
Список амфотерных металлов включает в себя множество наименований. Из них мы рассмотрим цинк и алюминий.
Характеристики элементов-металловАлюминий — элемент IIIA группы третьего периода. Его электронная конфигурация [Ne]3s23p1.
В возбужденном состоянии электронная пара на 3s-орбитали распаривается. В результате образуются три неспаренных электрона, которые способны образовывать химические связи. Поэтому у алюминия постоянная степень окисления +3.
В результате образуются три неспаренных электрона, которые способны образовывать химические связи. Поэтому у алюминия постоянная степень окисления +3.
Цинк — расположен во IIВ группе в четвертом периоде. Цинк относится к d-элементам, при этом атом цинка имеет полностью заполненные 3d– и 4s– электронные подуровни.
Его электронная конфигурация в основном состоянии [Ar]3d104s2. В соединениях цинк проявляет постоянную степень окисления +2.
Физические свойстваАлюминий — лёгкий серебристо-белый металл, покрывающийся на воздухе оксидной плёнкой из-за взаимодействия с кислородом (на фото расположен слева). Из алюминия часто делают тысячи вещей, которые окружают нас в быту: от фольги на баночке йогурта до стильного корпуса смартфона.
Цинк — голубовато-белый металл (на фото расположен справа).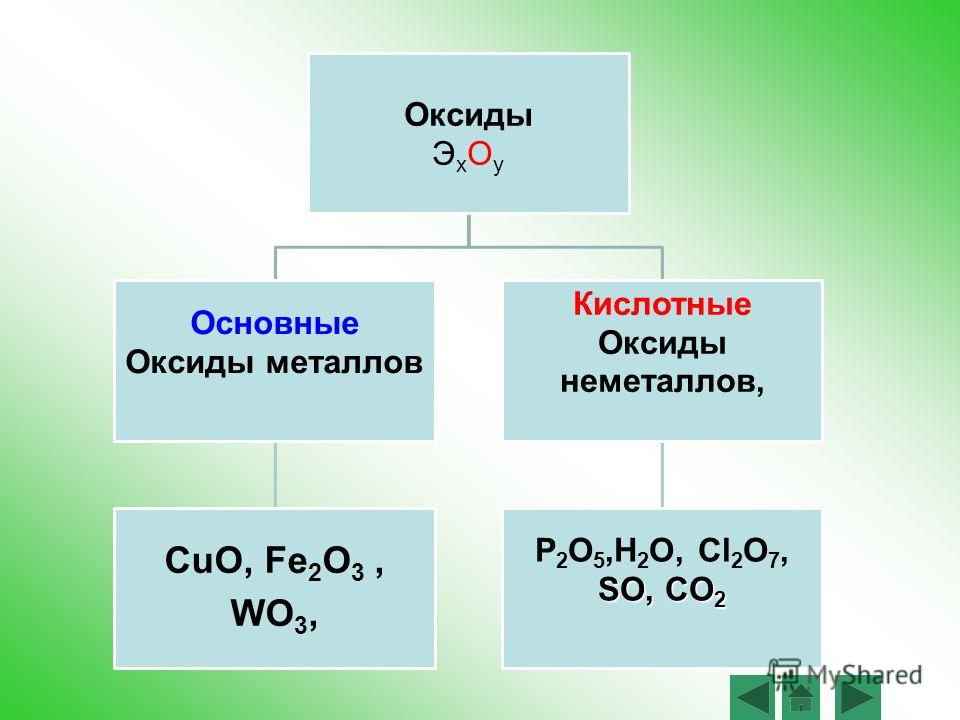
По химическим свойствам они являются типичными восстановителями, а значит, способны реагировать с окислителями. Как и другие металлы, они будут взаимодействовать со своими противоположностями — неметаллами. Также они будут вступать в реакции вытеснения с водой, кислотами-неокислителями, щелочами и солями менее активных металлов.
- Реакции с неметаллами
Как типичные металлы, алюминий и цинк способны вступать в реакции с неметаллами и образовывать различные бинарные соединения.
- Реакции с оксидами
Ввиду низких значений электроотрицательности алюминий и цинк, как и другие металлы, являются отличными восстановителями. Настолько сильными, что они даже способны восстанавливать некоторые металлы и неметаллы из их оксидов. Этот процесс называется металлотермией.
| Активные металлы (стоящие до алюминия в ряду активности) не получают путём восстановления из оксидов. |
Алюминий является очень активным металлом, который, помимо этого, ещё и является одним из наиболее распространённых в земной коре.
Его очень часто используют в металлургии для получения других металлов из их оксидов. Этот процесс называется алюмотермией.
- Реакции с водой
Так как алюминий и цинк — металлы, стоящие в ряду активности левее водорода, то они способны вытеснять водород из воды.
Алюминий, подобно другим активным металлам, при взаимодействии с водой образует гидроксид и водород.
Цинк является уже менее активным металлом, поэтому нуждается в создании более жёстких условий для реакции с водой. Он взаимодействует только с перегретым водяным паром и в таких жёстких условиях вытесняет из воды ОБА атома водорода, превращаясь в оксид.
- Реакции с кислотами
Алюминий и цинк также способны вытеснять водород не только из воды, но и из кислот-неокислителей.
С кислотами-окислителями протекают более сложные ОВР, при этом помним, что в холодных концентрированных растворах кислот-окислителей алюминий пассивируется из-за наличия оксидной плёнки на его поверхности.
- Реакции со щелочами
Амфотерные металлы реагируют со щелочами, причем продукты зависят от определенных условий:
- Реакции с солями
Как и другие металлы, алюминий и цинк способны вытеснять менее активные металлы из их солей.
Оксиды алюминия и цинкаОксиды алюминия и цинка по физическим свойствам представляют собой бесцветные порошки, нерастворимые в воде.
По химическим свойствам это типичные амфотерные оксиды, которые способны вступать в основно-кислотные взаимодействия как с основным, так и с кислотным. Как и другие оксиды, они могут вступать в ОВР с сильными восстановителями с восстановлением из них металла.
Как и другие оксиды, они могут вступать в ОВР с сильными восстановителями с восстановлением из них металла.
- Реакции с водой
Оксидам алюминия и цинка соответствуют нерастворимые гидроксиды Al(OH)3 и Zn(OH)2, поэтому и сами оксиды с водой не взаимодействуют.
- Амфотерные свойства оксидов
Как типичные амфотерные оксиды, оксиды алюминия и цинка будут реагировать как с веществами, проявляющими основные свойства (основаниями, основными оксидами), так и с веществами, проявляющими кислотные свойства (кислотами, кислотными оксидами):
- ОВР с сильными восстановителями
Как и другие оксиды, оксид цинка может вступать в ОВР с сильными восстановителями (C, CO, H2, Al, Mg, Ca и т. д.) с восстановлением из них металла.
Гидроксиды алюминия и цинкаПо физическим свойствам гидроксиды алюминия и цинка представляют собой белые порошкообразные вещества, нерастворимые в воде. Все их химические свойства обусловлены тем, что они являются амфотерными гидроксидами: они способны вступать в реакции как с основным, так и с кислотным.
Все их химические свойства обусловлены тем, что они являются амфотерными гидроксидами: они способны вступать в реакции как с основным, так и с кислотным.
Помимо этого, как и для других нерастворимых гидроксидов, для гидроксидов алюминия и цинка характерны реакции термического разложения.
- Гидроксиды алюминия и цинка как амфотерные гидроксиды
- Термическое разложение гидроксидов
Подобно другим нерастворимым гидроксидам, нерастворимые Al(OH)3 и Zn(OH)2 способны разлагаться при нагревании на соответствующий оксид и воду.
Важнейшие химические свойства солей- Реакции с растворами щелочей
Соли алюминия и цинка реагируют с растворами щелочей.
- Разрушение комплексных солей и их аналогов кислотами
Если сильная кислота находится в недостатке, её хватает только для самого сильного металла (щелочного или щелочно-земельного). В результате образуется соль и амфотерный гидроксид, возможно также образование воды.
В результате образуется соль и амфотерный гидроксид, возможно также образование воды.
Если сильная кислота находится в избытке, её хватает на оба металла: образуются две соли и вода.
Со слабыми кислотами (угольной CO2(р-р), сернистой SO2(р-р), сероводородной H2S) ситуация немного сложнее:
- Если слабая кислота находится в недостатке, её также хватает только для самого сильного металла (щелочного или щелочно-земельного).
— Если слабая кислота находится в избытке, в продуктах образуется кислая соль (из-за избытка кислотного) и амфотерный гидроксид.Со слабой кислотой он не взаимодействует, так как сам слабый.
- Термическое разложение
При нагревании комплексной соли будет происходить выпаривание из неё воды. В анионе там, где нет воды (например, в расплаве), образуются средние соли с амфотерными металлами.
- Реакции с солями
Самые “страшные” реакции с участием комплексных солей — их реакции с солями. Чтобы их написать, можно для себя представить комплексную соль как совокупность щёлочи и амфотерного гидроксида.
Чтобы их написать, можно для себя представить комплексную соль как совокупность щёлочи и амфотерного гидроксида.
- Алюминий и цинк относятся к амфотерным металлам, то есть таким, которые могут реагировать и с кислотами, и со щелочами в зависимости от природы реагирующих веществ.
- Алюминий относится к p-элементам, его постоянная степень окисления +3; цинк относится к d-элементам, его постоянная степень окисления +2.
- Алюминий и цинк реагируют с рядом веществ: неметаллами, водой, кислотами, щелочами, солями.
- Оксиды и гидроксиды алюминия и цинка также обладают амфотерными свойствами ,что определяет их химическое поведение в различных реакциях.
- Алюминий и цинк способны образовывать особый тип солей, называемый комплексными.
Задание 1.
Какими свойствами обладают алюминий, цинк и их оксиды и гидроксиды?
- Основными свойствами;
- Кислотными свойствами;
- Амфотерными свойствами;
- Нейтральными свойствами.

Задание 2.
Цинк реагирует с водой с образованием:
- Оксида цинка и водорода;
- Гидроксид цинка и водорода;
- Цинката и водорода;
- Гидрида цинка и кислорода.
Задание 3.
Что можно наблюдать при приливании раствора гидроксида натрия к раствору хлорида алюминия?
- Выделение газа;
- Выпадение осадка;
- Видимых изменений не наблюдается;
- Выпадение осадка, а затем его растворение.
Задание 4.
Что образуется в реакции оксида цинка и сернистого газа?
- Сульфат цинка;
- Сульфит цинка;
- Сульфид цинка и кислород;
- Реакция не идет.
Задание 5.
Какая соль образуется при взаимодействии тетрагидроксоалюмината натрия и избытка сероводорода?
- Средняя соль;
- Комплексная соль;
- Кислая соль;
- Основная соль.
ОТВЕТЫ: 1. — 3; 2. — 1; 3. — 4; 4. — 4; 5. — 3
— 1; 3. — 4; 4. — 4; 5. — 3
Амфотерные металлы — список и свойства
Простые вещества сходные с металлическими элементами по структуре и ряду химических и физических параметров называют амфотерными, т.е. это те элементы, проявляющие химическую двойственность. Надо отметить, что это не сами металли, а их соли или оксиды. К, примеру, оксиды некоторых металлов могут обладать двумя свойствами, при одних условиях они могут проявлять свойства присущие кислотам, в других, они ведут себя как щелочи.
К основным амфотерным металлам относят алюминий, цинк, хром и некоторые другие.
Термин амфотерность был введен в оборот в начале XIX века. В то время химические вещества разделяли на основании их сходных свойств, проявляющиеся при химических реакциях.
Что такое амфотерные металлы
Список металлов, которые можно отнести амфотерным, достаточно велик. Причем некоторые из них можно назвать амфотерными, а некоторые – условно.
Перечислим порядковые номера веществ, под которыми они расположены в Таблице Менделеева. В список входят группы с 22 по 32, с 40 по 51 и еще много других. Например, хром, железо и ряд других можно с полным основанием называть основными, к последним можно отнести и стронций с бериллием.
Кстати, самым ярким представителем амфорных металлов считают алюминий.
Именно его сплавы в течение длительного времени используют практически во всех отраслях промышленности. Из него делают элементы фюзеляжей летательных аппаратов, кузовов автомобильного транспорта, и кухонную посуду. Он стал незаменим в электротехнической промышленности и при производстве оборудования для тепловых сетей. В отличии от многих других металлов алюминий постоянно проявляет химическую активность. Оксидная пленка, которая покрывает поверхность металла, противостоит окислительным процессам. В обычных условиях, и в некоторых типах химических реакций алюминий может выступать в качестве восстановительного элемента.
Этот металл способен взаимодействовать с кислородом, если его раздробить на множество мелких частиц. Для проведения операции такого рода необходимо использование высокой температуры. Реакция сопровождается выделением большого количества тепловой энергии. При повышении температуры в 200 ºC, алюминий вступает в реакцию с серой. Все дело в том, что алюминий, не всегда, в нормальных условиях, может вступать в реакцию с водородом. Между тем, при его смешивании с другими металлами могут возникать разные сплавы.
Еще один ярко выраженный металл, относящийся к амфотерным – это железо. Этот элемент имеет номер 26 и расположен между кобальтом и марганцем. Железо, самый распространенный элемент, находящийся в земной коре. Железо можно классифицировать как простой элемент, имеющий серебристо-белый цвет и отличается ковкостью, разумеется, при воздействии высоких температур. Может быстро начинать коррозировать под воздействием высоких температур. Железо, если поместить его в чистый кислород полностью прогорает и может воспламениться на открытом воздухе.
Такой металл обладает способностью быстро переходить в стадию корродирования при воздействии высокой температуры. Помещенное в чистый кислород железо полностью перегорает. Находясь на воздухе металлическое вещество, быстро окисляется вследствие чрезмерной влажности, то есть, ржавеет. При горении в кислородной массе образуется своеобразная окалина, которая называется оксидом железа.
Свойства амфотерных металлов
Они определены самим понятием амфотерности. В типовом состоянии, то есть обычной температуре и влажности, большая часть металлов представляет собой твердые тела. Ни один металл не подлежит растворению в воде. Щелочные основания проявляются только после определенных химических реакций. В процессе прохождения реакции соли металла вступают во взаимодействие. Надо отметить что правила безопасности требуют особой осторожности при проведении этой реакции.
Соединение амфотерных веществ с оксидами или самими кислотами первые показывают реакцию, которая присуща основаниями. В тоже время если их соединять с основаниями, то будут проявляться кислотные свойства.
В тоже время если их соединять с основаниями, то будут проявляться кислотные свойства.
Нагрев амфотерных гидроксидов вынуждает их распадаться на воду и оксид. Другими словами свойства амфотерных веществ весьма широки и требуют тщательного изучения, которое можно выполнить во время химической реакции.
Свойства амфотерных элементов можно понять, сравнив их с параметрами традиционных материалов. Например, большинство металлов имеют малый потенциал ионизации и это позволяет им выступать в ходе химических процессов восстановителями.
Амфотерные — могут показать как восстановительные, так и окислительные характеристики. Однако, существуют соединения которые характеризуются отрицательным уровнем окисления.
Абсолютно все известные металлы имеют возможность образовывать гидроксиды и оксиды.
Всем металлам свойственна возможность образования основных гидроксидов и оксидов. Кстати, металлы могут вступать в реакцию окисления только с некоторыми кислотами. Например, реакция с азотной кислотой может протекать по-разному.
Амфотерные вещества, относящиеся к простым, обладают явными различиями по структуре и особенностям. Принадлежность к определенному классу можно у некоторых веществ определить на взгляд, так, сразу видно что медь – это металл, а бром нет.
Как отличить металл от неметалла
Главное различие заключается в том, что металлы отдают электроны, которые находятся во внешнем электронном облаке. Неметаллы, активно их притягивают.
Все металлы являются хорошими проводниками тепла и электричества, неметаллы, такой возможности лишены.
Основания амфотерных металлов
В нормальных условиях это вещества не растворяются в воде и их можно спокойно отнести к слабым электролитам. Такие вещества получают после проведения реакции солей металла и щелочи. Эти реакции довольно опасны для тех, кто их производит и поэтому, например, для получения гидроксида цинка в емкость с хлоридом цинка медленно и аккуратно, по капле надо вводить едкий натр.
Вместе тем, амфотерные — взаимодействуют с кислотами как основания. То есть при выполнении реакции между соляной кислотой и гидроксидом цинка, появится хлорид цинка. А при взаимодействии с основаниями, они ведут себя как кислоты.
То есть при выполнении реакции между соляной кислотой и гидроксидом цинка, появится хлорид цинка. А при взаимодействии с основаниями, они ведут себя как кислоты.
Оцените статью:
Рейтинг: 0/5 — 0 голосов
Свойства амфотерных металлов
Амфотерные металлы представлены не сложными элементами, являющимися неким аналогом группы компонентов металлического типа. Сходство прослеживается в ряде свойств физического и химического направления. Причем, за самими веществами не замечено способности к свойствам амфотерного типа, а различные соединения вполне способны к их проявлению.
Для примера можно рассмотреть гидроксиды с оксидами. У них явно прослеживается двойственная химическая природа. Она выражена в том, что, в зависимости от условий, выше названные соединения могут обладать свойствами либо щелочей, либо кислот. Понятие амфотерности появилось достаточно давно, оно знакомо науке еще с 1814 года. Термин «амфотерность» выражал способность химического вещества вести себя определенным образом при проведении кислотной (главной) реакции. Получаемые свойства зависят от того, каков тип самих присутсвующих реагентов, вида растворителя и условий, при которых проводится реакция.
Получаемые свойства зависят от того, каков тип самих присутсвующих реагентов, вида растворителя и условий, при которых проводится реакция.
Что представляют собой амфотерные металлы?
Список амфотерных металлов включает в себя множество наименований. Некоторые из них можно с уверенность назвать амфотерными, некоторые – предположительно, иные – условно. Если рассматривать вопрос масштабно, то для краткости можно назвать просто порядковые номера выше указанных металлов. Эти номера: 4,13, с 22 до 32, с 40 до 51, с 72 до 84, со 104 до 109. Но есть металлы, которые вправе назваться основными. К ним относятся хром, железо, алюминий и цинк. Дополняют основную группу стронций и бериллий. Самым распространенным из всех перечисленных на данный момент является алюминий. Именно его сплавы уже много столетий используются в самых разнообразных сферах и областях применения. Металл имеет отличную антикоррозийную стойкость, легко поддается литью и различным типам механической обработки. Кроме того, популярность алюминия дополняется такими преимуществами, как высокая теплопроводность и хорошая электропроводность.
Кроме того, популярность алюминия дополняется такими преимуществами, как высокая теплопроводность и хорошая электропроводность.
Алюминий — амфотерный металл, для которого свойственно проявлять химическую активность. Стойкость данного металла определяется прочной оксидной пленкой и, в обычных условиях окружающей среды, при реакциях химического направления, алюминий выступает восстановительным элементом. Такое амфотерное вещество способно взаимодействовать с кислородом, в случае раздробления металла на мелкие частицы. Для такого взаимодействия необходимо влияние высокого температурного режима. Химическая реакция при соприкосновении с кислородной массой сопровождается огромным выделением тепловой энергии. При температуре свыше 200 градусов взаимодействие реакций при соединении с таким веществом, как сера, образовывает сульфид алюминия. Амфотерный алюминий не способен напрямую взаимодействовать с водородом, а при смешивании этого металла с другими металлическими компонентами возникают различные сплавы, содержащие соединения интерметаллического типа.
Железо — амфотерный металл, который является одной из побочных подгрупп группы 4 периода в системе элементов химического типа. Данный элемент выделяется как самое распространенное составляющее группы металлических веществ, в составе компонентов земной коры. Железо классифицируется как простое вещество, среди отличительных свойств которого можно выделить его ковкость, серебристо-белую цветовую гамму. Такой металл обладает способностью провоцировать возникновение повышенной химической реакции и быстро переходит в стадию корродирования при воздействии высокой температуры. Помещенное в чистый кислород железо полностью перегорает, а доведенное до мелкодисперсного состояния может самовоспламеняться на простом воздухе. Находясь на воздухе металлическое вещество быстро окисляется вследствие чрезмерной влажности, то есть, ржавеет. При горении в кислородной массе образуется своеобразная окалина, которая называется оксидом железа.
Основные свойства амфотерных металлов
Свойства амфотерных металлов — основное понятие в амфотерности. Рассмотрим, что же они из себя представляют. В стандартном состоянии каждый металлов является твердым телом. Поэтому их принято считать слабыми электролитами. Кроме того, ни один металл не может растворяться в воде. Основания получаются путем специальной реакции. В ходе этой реакции соль металла соединяется с небольшой дозой щелочи. Правила требуют проводить весь процесс аккуратно, осторожно и довольно медленно.
Рассмотрим, что же они из себя представляют. В стандартном состоянии каждый металлов является твердым телом. Поэтому их принято считать слабыми электролитами. Кроме того, ни один металл не может растворяться в воде. Основания получаются путем специальной реакции. В ходе этой реакции соль металла соединяется с небольшой дозой щелочи. Правила требуют проводить весь процесс аккуратно, осторожно и довольно медленно.
При соединении амфотерных веществ с кислотными оксидами или непосредственно кислотами, первые выдают реакцию, свойственную основаниям. Если же такие основания соединять с основаниями, проявляются свойства кислот. Сильное нагревание амфотерных гидроксидов приводит к их распаду. В результате распада образуется вода и соответствующий амфотерный оксид. Как видно из наведенных примеров, свойства достаточно обширны и требуют тщательного анализа, который можно провести в ходе химических реакций.
Химические свойства амфотерных металлов можно сравнить со свойствами обычных металлов, чтобы провести параллель или увидеть разницу.
Амфотерные металлы проявляют как восстановительные, так и окислительные свойства. Но при этом у амфотерных металлов имеются соединения, характеризующиеся отрицательной степенью окисления. Всем металлам свойственна возможность образования основных гидроксидов и оксидов. Зависимо от роста порядкового номера в периодическом ранжире замечено убывание основности металла. Следует также заметить, что металлы, в основной своей части, могут окисляться только определенными кислотами. Так, взаимодействие с азотной кислотой у металлов происходит по-разному.
Металлы неметаллы амфотерные, которые являются простыми веществами, имеют явное различие по своему строению и индивидуальным особенностям относительно физических и химических проявлений.
Чтобы не ошибиться в определении разновидности простых веществ необходимо четко знать все признаки, которые отличают металлы от неметаллов. Основным различием металлов и неметаллов выступает способность первых отдавать электроны, расположенные во внешнем энергетическом секторе. Неметаллы наоборот, притягивают электроны в зону внешнего накопителя энергетики. Все металлы имеют свойство передавать энергетический блеск, что делает их хорошими проводниками тепловой и электрической энергии, а неметаллы невозможно использовать в качестве пропускника электричества и тепла.
Амфотерные оксиды – синтез, свойства, идентификация
Термин «амфотерный» происходит от греческого слова amphoteroi (ἀμφότεροι) , что означает «оба». Амфотерные оксиды — это оксиды элементов (обычно металлов), проявляющие амфотерное поведение.
Амфотеризм или амфотерное поведение – это свойство соединения действовать как как кислота, так и как основание . В зависимости от реагентов и других условий реакции соединение ведет себя либо как кислота, либо как основание.
Пример амфотерных оксидов: Оксид алюминия Al 2 O 3 является амфотерным оксидом, поскольку он может нейтрализовать как HCl, так и NaOH.
Другими элементами, образующими амфотерные оксиды, являются галлий, индий, скандий, титан, цирконий, ванадий, хром, олово, железо, кобальт, медь, цинк, свинец, серебро, золото, германий, сурьма, висмут, бериллий и теллур.
СинтезТак как амфотерные оксиды являются оксидами определенных элементов, то они являются прямым результатом сжигания этих элементов на воздухе. Например, оксид цинка(II) образуется в результате прямого сжигания Zn в большом количестве приточного воздуха:
2Zn(т) + O 2 (г) -> 2ZnO(т)
Аналогично,
4Al(т) + 3O 2 (г) -> 2Al 2 O 3 90s )
Оксид свинца (II) получают путем нагревания Нитрат свинца (II):
2Pb(NO 3 ) 2 -> \(\Delta\) 2PbO(s) + 4NO 2 0 +1 O 9014 2 -> \(\Delta\) 2PbO(s) 2 (g)
Оксид олова(II), также известный как Оксид олова , может быть получен путем нагревания оксида олова(II) в инертной среде. Оксид олова (II) образуется, когда соли олова реагируют со щелочью, такой как гидроксид натрия.
Оксид олова (II) образуется, когда соли олова реагируют со щелочью, такой как гидроксид натрия.
SNCL 2 +2NAOH -> SN (OH) 2 +2NACL
SN (OH) 2 -> \ (\ Delta \) SNO +H 2 O
Амфотерные оксиды в периоде. Таблица Оксиды в таблице Менделеева (Источник)- В данный период таблицы Менделеева оксиды переходят от основных к амфотерным и, наконец, к кислотным. Например, рассмотрим 3 rd элементов периода: Na 2 O и MgO являются основными, Al 2 O 3 является амфотерическим, SIO 2 является слабым кислым, стр. 2 O 5 , стр. 2 O 3 , SO 2 , SO 3 , CL 2 O и CL CL O и CL CL O и CL CL O и CL CL O и CL CL O и CL CL , CL . 2 O 7 являются кислыми.
- Вниз по группам основность увеличивается с увеличением атомного номера.

Рассмотрим оксиды группы 15:
NO 2 и P 2 O 3 являются кислотными, As 2 O 3 и Sb 2 O 3 являются бифотиковыми0014 2 O 3 является основным. - Кислотность также увеличивается с увеличением степени окисления одного и того же оксида элемента. Example: Acidity series for manganese oxides is
Mn 2 O 7 > Mn 2 O 3 > MnO
Similarly, for Arsenic and Antimony,
As 2 O 5 > As 2 O 3
и
Sb 2 O 5 > Sb 2 O 3
Амфотерные оксиды обычно имеют очень высокие температуры плавления и кипения. Они имеют гигантские ковалентные структуры, для разрыва которых требуется много энергии.
Амфотерные оксиды нерастворимы в воде.
Амфотерные оксиды реагируют как с кислотами, так и с основаниями.
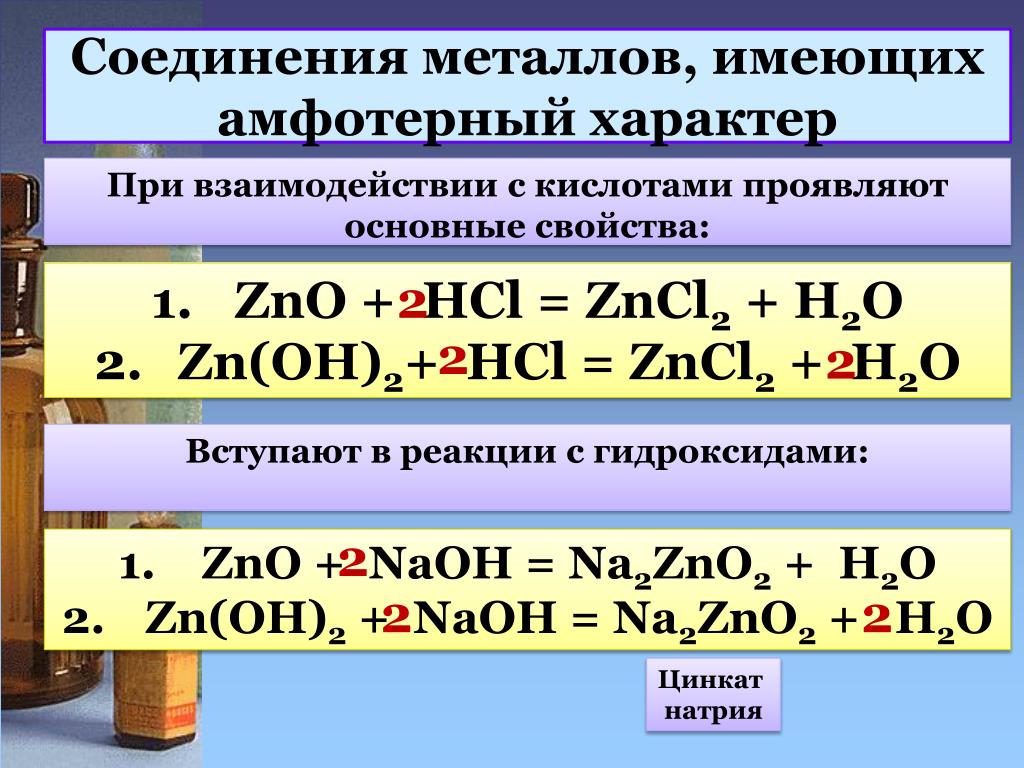
Основная природаОсновная природа амфотерных оксидов выявляется их реакцией с кислотами. Амфотерные оксиды реагируют с обычными неорганическими кислотами с образованием соли металла и воды.
ZnO(т) + 2HNO 3 (водн.) -> Zn(NO 3 ) 2 (водн.) + H 2 O(л)
Al 3 O ) + 6HCl(водн.) -> 2AlCl 3 (водн.) + 3H 2 O(ж)
SnO(т) + 2HCl(водн.) -> SnCl 2 (водн.) + H 2 O (л)
PbO(s) + 2HNO 3 (водн.) -> Pb(NO 3 ) 2 (водн.) + H 2 O(л)
As4 51 O 3 90 (с) + 6HCl (водн.) -> 2AsCl (водн.) + 3H 2 O(l)
Кислотная природа Кислотная природа амфотерных оксидов проявляется в их реакции с основаниями. Амфотерные оксиды реагируют с обычными неорганическими основаниями с образованием сложных солей металлов и воды.
Амфотерные оксиды реагируют с обычными неорганическими основаниями с образованием сложных солей металлов и воды.
ZnO(s) + 2NaOH(aq) -> Na 2 ZnO 2 (aq) + H 2 O(l)
Обратите внимание, что Na 2 ZnO 5 2 реальность.
Таким образом, более точное уравнение:
ZnO(s) + 2NaOH(aq) + H 2 O(l) -> Na 2 [Zn(OH) 4 ](водн.)
, где Na 2 [Zn(OH) 4 ] представляет собой гидрат цинката натрия, а анион представляет собой [ Zn(OH) 4 ] +2 .
AL 2 O 3 (S) + 2NAOH (AQ) -> 2NAALO 2 (AQ) + H 2 O (L)
или
AL 2 O 3 ( s) + 2NaOH(водн.) + 3H 2 O(ж) -> 2Na[Al(OH) 4 ](водн.)
где Na[Al(OH) 4 ] представляет собой гидратированный алюминат натрия, а [Al(OH) 4 ] +1 представляет собой анион.
PbO(s) + 2NaOH(aq) + H 2 O(l) -> Na 2 [Pb(OH) 4 ](aq)
SnO(s) + 4NaOH(aq) + H 2 O(l) <=> Na 4 [Sn(OH) 6 ](водн.)
Идентификация амфотерных оксидов база . Таким образом, чтобы определить, является ли соединение амфотерным, необходимо наблюдать за его реакцией с кислотой, такой как HCl, и реакцией с основанием, таким как NaOH.Убедившись, что данное вещество является амфотерным, нам необходимо выяснить, является ли данное вещество оксидом или нет. Проводятся тесты на другие анионы, такие как сульфат, нитрат, нитрит, хлорид и т. д. Если все тесты показывают отрицательный результат, данное соединение является оксидом.
Использование и применениеОбычное применение некоторых амфотерных оксидов:
- Оксид свинца(II): Добавление PbO в стекло увеличивает его электрическое сопротивление, показатель преломления и способность поглощать рентгеновские лучи.
 В то же время он снижает вязкость стекла. Следовательно, PbO необходим для стекольной промышленности.
В то же время он снижает вязкость стекла. Следовательно, PbO необходим для стекольной промышленности.
PbO также используется в керамической промышленности для изготовления керамических изделий, обладающих магнитной и электрической инертностью. - Оксид цинка: Оксид цинка широко используется в цементной и косметической промышленности. Он также используется для изготовления сухих элементов и других типов постоянных элементов.
- Оксид алюминия: Руды оксида алюминия, такие как бокситы, присутствуют в земной коре. Сначала эти руды концентрируются с образованием чистого оксида алюминия. Этот оксид алюминия затем используется в процессе Холла-Эру для получения чистого металлического алюминия.
Что такое амфотерные оксиды?
Амфотерные оксиды представляют собой оксиды элементов (обычно металлов), проявляющие амфотерные свойства. Амфотеризм или амфотерное поведение — это свойство соединения действовать как кислота и как основание. В зависимости от реагентов и других условий реакции соединение ведет себя либо как кислота, либо как основание.
Амфотеризм или амфотерное поведение — это свойство соединения действовать как кислота и как основание. В зависимости от реагентов и других условий реакции соединение ведет себя либо как кислота, либо как основание.
Как идентифицировать амфотерные оксиды?
Амфотерный оксид может нейтрализовать как кислоту, так и основание. Таким образом, чтобы определить, является ли соединение амфотерным, необходимо наблюдать за его реакцией с кислотой, такой как HCl, и реакцией с основанием, таким как NaOH.
Убедившись, что данное вещество является амфотерным, нам необходимо выяснить, является ли данное вещество оксидом или нет. Проводятся тесты на другие анионы, такие как сульфат, нитрат, нитрит, хлорид и т. д. Если все тесты показывают отрицательный результат, данное соединение является оксидом.
Является ли вода амфотерным соединением?
Да, вода является амфотерным соединением.
H 2 O <=> H 3 O + + OH —
Кислотное поведение:
H 2 O (кислота) + NH 3 (база) -> нм 4 66 3 (база) -> нм 4 6766766 3 (база) -> нм 4 9 3 (база) -> нм + + OH –
Основное поведение:
H 2 O(основание) + HCl(кислота) -> Cl – + H 3 O +
Цинк: Элемент Биполярный | Американский совет по науке и здоровью
Большинство специалистов в области психического здоровья согласятся с тем, что если бы можно было присвоить элементам критерии DSM V, диагноз цинка был бы простым:
Код F31.9, Биполярное расстройство I, текущий или недавний эпизод не указан.
Есть несколько причин, по которым я считаю этот диагноз верным, и я расскажу о них ниже. Во-первых, самое интересное. Минералы, в которых содержится цинк, очаровательны и впечатляющи.
Отдельные цинксодержащие минералы. Фотографии: 1. 911 Metallurgist 2. Geology.com 3. pierresdesante.com 4. Heavencanwaitgifts.
Итак, можно ли сказать, что цинк «биполярен»? В химическом смысле это именно так. Вот причины.
1. ЭТО ПОМОГАЕТ И ВРЕДИТ НАМ
Цинк содержится в металлопротеиназах, подгруппе огромного семейства ферментов, называемых протеиназами (1) (также называемыми протеазами). Ферменты протеазы требуют металла для запуска широкого спектра биохимических реакций, необходимых для жизни. Цинк считается важным питательным веществом для человека, но точная причина этого неизвестна.
Вред
Бактерии тоже используют цинк, но по другой причине — чтобы не отравиться. Он отвечает за один из самых известных (и наиболее распространенных) механизмов бактериальной резистентности — катализируемое цинковой металлопротеиназой раскрытие бета-лактамного кольца. На английском языке: бактерии используют цинк плюс ферменты для детоксикации бета-лактамных антибиотиков, таких как пенициллины и цефалоспорины. Делают они это очень хитро. (Рисунок 1)
На английском языке: бактерии используют цинк плюс ферменты для детоксикации бета-лактамных антибиотиков, таких как пенициллины и цефалоспорины. Делают они это очень хитро. (Рисунок 1)
Но сначала…
Исходное изображение: Disclose TV
Для работы металлопротеиназ необходим цинк. Он выполняет две задачи: 1) помогает бета-лактамному антибиотику более прочно связываться с активным центром металлопротеиназы, 2) помогает металлопротеиназе химически разрушать антибиотик. Вот подробности:
После того, как антибиотик связался с ферментом, атом цинка, который помог ему связать, выполняет другие функции. Цинк связывается с молекулой воды и удерживает ее в непосредственной близости от бета-лактамной части антибиотика. Это значительно облегчает способность воды реагировать с бета-лактамом. Во-вторых, цинк действует как катализатор, разрушающий бета-лактам, четырехчленное кольцо, которое является «рабочей частью» антибиотика. Как только кольцо открывается, антибиотик перестает быть антибиотиком.
Рисунок 1. Роль цинка в дезактивации бета-лактамных антибиотиков. ** На самом деле это немного сложнее, чем это. Вода существует частично ионизированной как H + и OH — . Атом цинка стабилизирует группу OH – (гидроксил), которая гораздо более реакционноспособна. Ион гидроксила является фактическим атакующим видом.
2. СОЕДИНЕНИЯ ЦИНКА МОГУТ БЫТЬ КИСЛОТНЫМИ ИЛИ ОСНОВНЫМИ
1. Основные
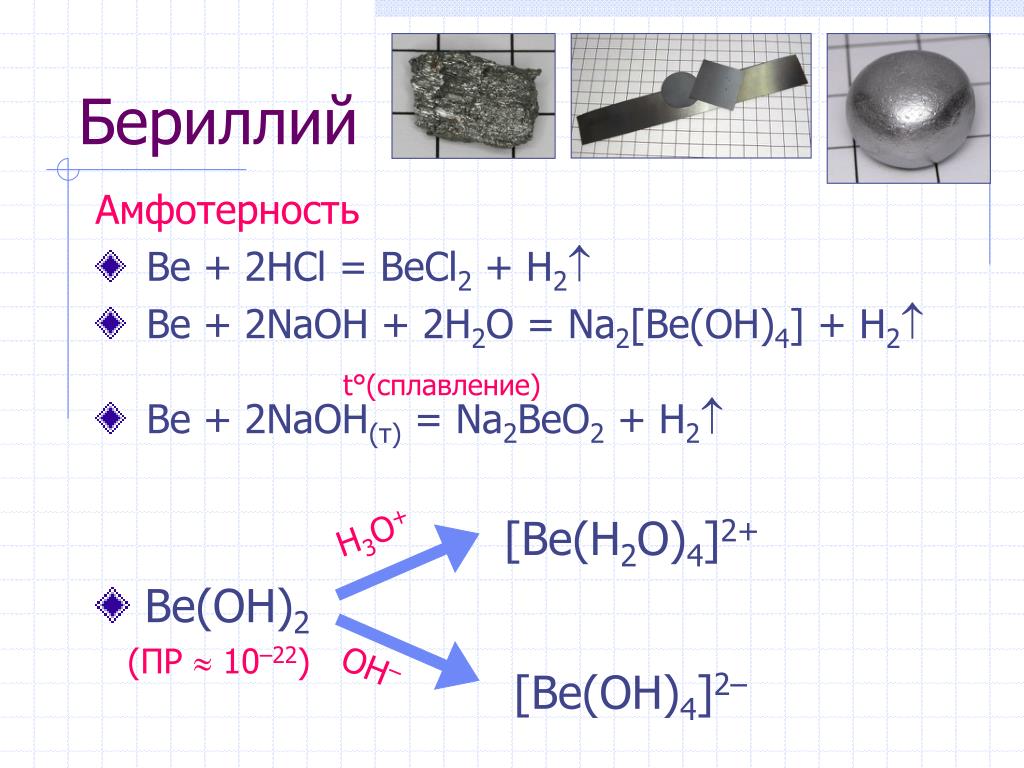
Металлический цинк реагирует с соляной кислотой с образованием хлорида цинка. При нейтрализации раствора гидроксидом цинка образуется нерастворимый белый осадок. Гидроксид цинка является амфотерным, что означает, что он реагирует либо с кислотами, либо с основаниями. Таким образом, если вы добавите больше соляной кислоты в пробирку с белым осадком, он снова превратится в водорастворимый хлорид цинка. В этом случае гидроксид цинка выступает в роли основания (реагирует с кислотой). (Рисунок 2)
. причина. В этом случае гидроксид цинка действует как кислота, реагируя с гидроксидом натрия (основанием) с образованием другого соединения, цинката натрия. Поскольку цинкат натрия растворим в воде, осадок снова растворяется, образуя прозрачный бесцветный раствор 9.0003 (1) . Оксиды или гидроксиды некоторых других металлов также являются амфотерными. Первая пробирка и последняя пробирка в этом эксперименте должны выглядеть одинаково — бесцветная прозрачная жидкость.
причина. В этом случае гидроксид цинка действует как кислота, реагируя с гидроксидом натрия (основанием) с образованием другого соединения, цинката натрия. Поскольку цинкат натрия растворим в воде, осадок снова растворяется, образуя прозрачный бесцветный раствор 9.0003 (1) . Оксиды или гидроксиды некоторых других металлов также являются амфотерными. Первая пробирка и последняя пробирка в этом эксперименте должны выглядеть одинаково — бесцветная прозрачная жидкость.
ЦИНК МОЖЕТ БЫТЬ СТАБИЛЬНЫМ МЕТАЛЛОМ ИЛИ ГАЗОМ, КОТОРЫЙ ВЗРЫВАЕТСЯ НА ВОЗДУХЕ
1. Элементарный цинк — стабильный металл найти в земле. Но он достаточно реакционноспособен, чтобы подвергаться воздействию сильных кислот, таких как соляная кислота, как показано выше.
Элементарный цинк, красивый и стабильный. Фото: ScienceMadness
2. Металлоорганический цинк – бесцветная летучая жидкость или газ, вызывающий психоз
С другой стороны, металлоорганические соединения цинка, в которых цинк химически связан с углеродом, совершенно разные. Обычные металлоорганические соединения цинка представляют собой летучие жидкости или газы. И постоянно в плохом настроении. На фото ниже показано, что произойдет, если вы позволите диметилцинку вступить в контакт с воздухом. Диметилцинк является одним из печально известных химических веществ, которые блогер-химик Дерек Лоу включил в свою чрезвычайно популярную статью «Вещи, с которыми я не буду работать».
Обычные металлоорганические соединения цинка представляют собой летучие жидкости или газы. И постоянно в плохом настроении. На фото ниже показано, что произойдет, если вы позволите диметилцинку вступить в контакт с воздухом. Диметилцинк является одним из печально известных химических веществ, которые блогер-химик Дерек Лоу включил в свою чрезвычайно популярную статью «Вещи, с которыми я не буду работать».
«Но диметилцинк в чистом виде… нет, я так не думаю. Мой коллега в аспирантуре приготовил его и прошел к нам по коридору довольно бледный. Он отсоединил кусок резиновой трубки. из своего перегонного аппарата и увидел, как он тут же вспыхнул сильным пламенем. «Эта штука делает трет-бутиллитий похожим на помои» — это утверждение я помню с того вечера». (3)
Дерек Лоу. В разработке
Диэтилцинк плюс воздух. Не пытайтесь повторить это дома. Фото: YouTube
РАЗНЫЕ ФАКТЫ О ЦИНКЕ
- Цинк был открыт Парацельсом в г.
 (4) Пенни
(4) Пенни - состояли из 95% меди до 1982 года, когда монетный двор изменил состав на 97,5% цинка. Если бы это не было сделано, пенни стоил бы около 0,02 доллара только за медь, поэтому люди копили бы их из-за «переплавленной стоимости». Если вам удастся найти в обращении пенни до 1982 года, подержите его в руке. Тогда держите цинковый пенни. Вы сможете сказать, что новые пенни значительно легче; 3,1 грамма для медного пенни и 2,5 г для цинкового пенни. Это из-за относительной плотности двух металлов; 8,96 для медной монеты и 7,13 г/мл для цинковой монеты. Медь на 25% плотнее цинка; медный пенни весит на 24% больше, чем цинковый пенни. Это не случайно.
- «Доктор» Axe утверждает, что цинк — это естественное лечение рака . «Доктор» Топор также продает цинк. Наверное совпадение. Доктор Акс тоже ненормальный чувак.
- Цинк либо предотвращает/лечит простуду, либо нет. Но если вы высосете слишком много пастилок с цинком , вы можете навсегда потерять обоняние.
 Не так уж и плохо для пассажиров метро. В противном случае не рекомендуется.
Не так уж и плохо для пассажиров метро. В противном случае не рекомендуется.
ПРИМЕЧАНИЯ:
(1) Протеазы (также известные как протеиназы) представляют собой огромный класс ферментов, которые функционируют путем расщепления (переваривания) белков с образованием более мелких белков или даже с образованием отдельных аминокислот, из которых состоят белки. Протеазы распространены повсеместно. Например, в настоящее время существуют препараты, ингибирующие протеазы, играющие важную роль в жизненном цикле ВИЧ и гепатита С. Когда вирусная протеаза ингибируется, вирус не может размножаться. Это торможение лежит в основе многих высокоэффективных лекарств от ВИЧ и гепатита С9.0005
(2) Люди, не являющиеся химиками, обычно не знают, что означает «клир». Прозрачный не значит бесцветный. Это означает, что свет может беспрепятственно проходить через раствор. Зеленый раствор, полученный путем добавления пищевого красителя в воду, будет прозрачным, но не бесцветным. Все решения понятны.
(3) См. Бутиллитий — то, с чем вам действительно не стоит связываться
(4) Парацельс крут. Он не только открыл цинк в 1526 году, но и стал отцом современной токсикологии, придумав выражение «доза делает яд». Вроде того. На самом деле он писал, что «Все вещи яд, и ничто не лишено яда; только доза делает вещь , а не ядом.» То же самое. Тем не менее, мы на 5 с лишним столетий позже, а обозреватель NY Times Ник Кристоф, пишущий о токсичности, еще не дожил до 15 века. Он абсолютно убежден, что доза не делает яд . Он также не открыл цинк.


 В то же время он снижает вязкость стекла. Следовательно, PbO необходим для стекольной промышленности.
В то же время он снижает вязкость стекла. Следовательно, PbO необходим для стекольной промышленности.  (4)
(4)  Не так уж и плохо для пассажиров метро. В противном случае не рекомендуется.
Не так уж и плохо для пассажиров метро. В противном случае не рекомендуется.

 Ион гидроксида удалил ион водорода из одной из молекул воды лиганда. Реакция также стала практически односторонней.
Ион гидроксида удалил ион водорода из одной из молекул воды лиганда. Реакция также стала практически односторонней. Образовался осадок гидроксида металла.
Образовался осадок гидроксида металла.

 При этом образуются оксиды, тесно связанные с потерянной водой. Эти изменения выходят за рамки этого сайта.
При этом образуются оксиды, тесно связанные с потерянной водой. Эти изменения выходят за рамки этого сайта. Потемнение осадка происходит от того же эффекта.
Потемнение осадка происходит от того же эффекта. Проверьте прошлые работы, отметьте схемы и отчеты экзаменатора.
Проверьте прошлые работы, отметьте схемы и отчеты экзаменатора.  Это более подробно описано на странице о кислотности ионов гексааква.
Это более подробно описано на странице о кислотности ионов гексааква.  Если вам нужно изучить эти имена более подробно, вы можете посмотреть страницу об именах, но это не очень важно для данной темы.
Если вам нужно изучить эти имена более подробно, вы можете посмотреть страницу об именах, но это не очень важно для данной темы. 
 Другими словами, он будет реагировать как с основаниями, так и с кислотами. Некоторые из гидроксидов металлов, которые мы рассматривали, делают именно это.
Другими словами, он будет реагировать как с основаниями, так и с кислотами. Некоторые из гидроксидов металлов, которые мы рассматривали, делают именно это.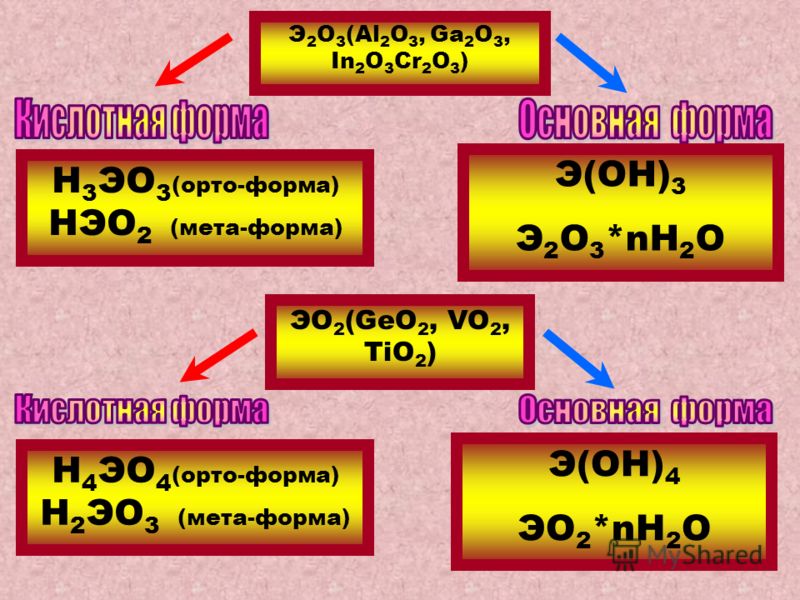 Это означает, что они не имеют какой-либо значительной кислотной природы.
Это означает, что они не имеют какой-либо значительной кислотной природы.