Карбонат кальция | это… Что такое Карбонат кальция?
Карбонат кальция (углекислый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула — . В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора. Нерастворим в воде и этаноле.
Зарегистрирован как белый пищевой краситель (E170).
Содержание
|
Применение
Используется как белый пищевой краситель Е170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование
Таблетки из карбоната кальция
Очищенный от посторонних примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
Производители пластмассы — одни из основных потребителей карбоната кальция (более 50 % всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т.
Строительство
Строительство — еще один из основных потребителей карбоната кальция. Шпатлевки, различные герметики — все они содержат карбонат кальция в значительных количествах. Также, карбонат кальция является важнейшим составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция также широко используется в очистительных системах, как средство борьбы с загрязнением окружающей среды, при помощи карбоната кальция восстанавливают кислотно-щелочной баланс почвы.
Нахождение в природе
Кристаллическая структура кальцита
Карбонат кальция находится в минералах в виде полиморфов:
- Арагонит
- Кальцит
- Фатерит (или μ-CaCO3)
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
- Мел
- Известняк
- Мрамор
- Травертин
Кальцит
Арагонит
Мрамор
Травертин
Геология
Карбонат часто встречается в геологической среде. Он находится как полиморф. Полиморфами являются минералы с той же химической формулой, но разной химической структуры. Арагонит, кальцит, известняк, мел, мрамор, травертин, туф и др. — все они имеют формулу CaCO3, но каждый из них имеет несколько иной химический состав. Кальцит, как карбонат кальция, геологи обычно находят в морских условиях. Также кальцит, как правило, находится около теплых тропических условий. Это связано с его химией и свойствами. Кальцит может выпадать чаще как осадок в теплой среде, чем в холодной, поскольку теплая среда не дает улетучиваться в больших объемах CO2. Это аналогично тому как CO2 растворяется в воде.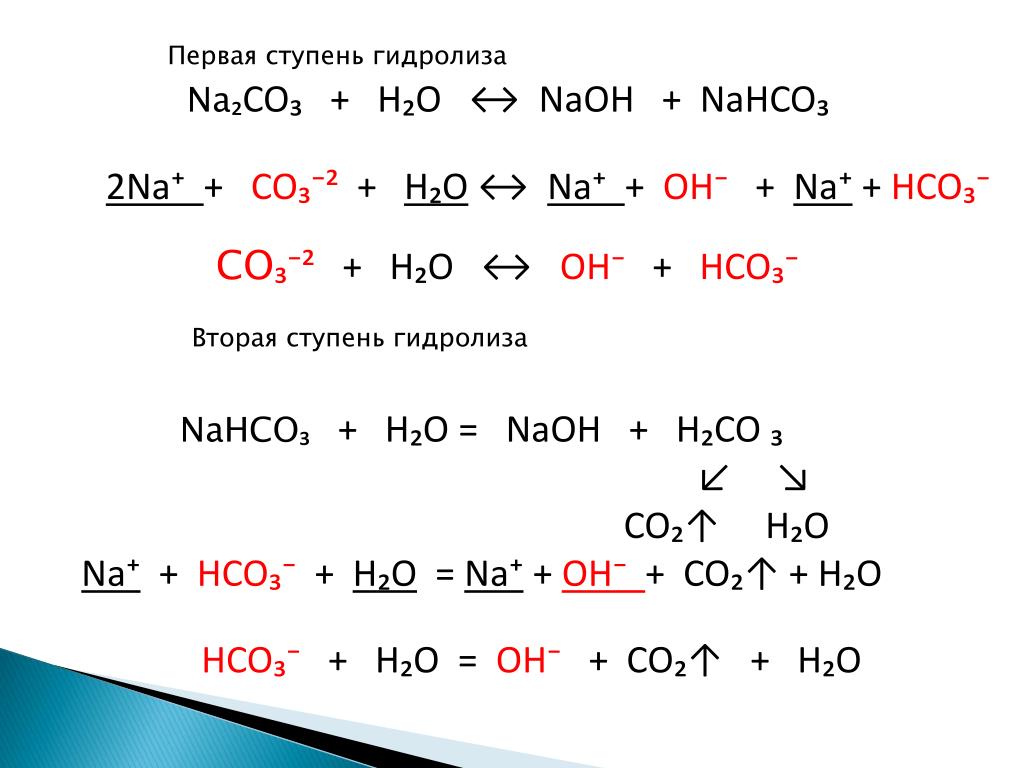 Когда вы открываете крышку пластиковой бутылки происходит выделение CO2. Из-за того что сода нагревается, выделяется углекислый газ. Этот же принцип может быть применен к кальциту и в океане. Карбонаты данного вещества в холодной воде существуют в более высоких широтах, но имеют очень медленный темп роста.
Когда вы открываете крышку пластиковой бутылки происходит выделение CO2. Из-за того что сода нагревается, выделяется углекислый газ. Этот же принцип может быть применен к кальциту и в океане. Карбонаты данного вещества в холодной воде существуют в более высоких широтах, но имеют очень медленный темп роста.
В тропических условиях вода теплая и чистая. Таким образом, вы можете увидеть много кораллов в данной среде по сравнению с холодной, где вода холодная. Производители карбоната кальция, такие как кораллы, водоросли и микроорганизмы, которые обычно встречаются в мелководных водоемах, как фильтраторы, требуют солнечный свет для производства карбоната кальция.
Изготовление
Подавляющее большинство карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из чистого источника (как правило, мрамор).
В качестве альтернативы карбонат кальция может быть приготовлен кальцинацией оксида кальция. Вода добавляется к этому оксиду, давая гидроксид кальция, и затем проводится углекислый газ, который проходит через этот раствор для осаждения желаемого карбоната кальция[1]:
Химические свойства
См. также: КарбонатыПри нагревании до 900−1000 °C расщепляется на кислотный оксид — углекислый газ CO2 и оксид — негашёную известь CaO по уравнению:
- .
В воде с углекислым газом растворяется, образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
- .
Существование именно этой реакции дает возможность образовываться сталактитам, сталагмитам и прочим красивейшим формам, да и вообще развиваться карсту.
При 1500 °C вместе с углеродом образует карбид кальция и оксид углерода (II)
- .
Примечания
- ↑ Solvay Precipitated Calcium Carbonate: Production.
 Solvay S. A. (9 марта 2007). Архивировано из первоисточника 9 февраля 2012.
Solvay S. A. (9 марта 2007). Архивировано из первоисточника 9 февраля 2012.
Ссылки
- Польза и возможный вред от карбоната кальция как пищевой добавки — е170
Соединения кальция
Алюминаты кальция (mCaO·nAl2O3) • Алюмогидрид кальция (Ca[AlH4]2) • Амид кальция (Ca(NH2)2) • Арсенат кальция (Ca3(AsO4)2) • Ацетат кальция ((CH3COO)2Ca) • Бисульфид кальция (Ca(HS)2) • Борат кальция (Ca3(BO3)2) • Бромид кальция (CaBr2) • Вольфрамат кальция (CaWO4) • Гексаборид кальция (CaB6) • Гексафторсиликат кальция (CaSiF6) • Гидрид кальция (CaH2) • Гидроксид кальция (Ca(OH)2) • Гидроортофосфат кальция (CaHPO4) • Гипофосфит кальция (Ca(PH2O2)) • Гипохлорит кальция (Ca(ClO)2) • Глицерофосфат кальция (C3H7CaO6P) • Глюконат кальция (C12H22CaO14) • Дигидрокарбонат кальция (Ca(HCO3) 2) • 2,5-дигидроксибензолсульфонат кальция (C12H10CaO10S2) • Дигидроортофосфат кальция (Ca(H2PO4)2) • Иодат кальция (Ca(IO3)2) • Иодид кальция (CaI2) • Карбид кальция (CaC2) • Карбонат кальция (CaCO3) • Моносилицид кальция (CaSi) • Нитрат кальция (Са(NО3)2) • Нитрид кальция (Ca3N2) • Оксалат кальция (СаС2О4) • Оксид кальция (CaO) • Ортофосфат кальция (Ca3(PO4)2) • Перманганат кальция (Ca(MnO4)2) • Пероксид кальция (CaO2) • Пирофосфат кальция (Ca2P2O7) • Силикат кальция (CaSiO3) • Силицид дикальция (Ca2Si) • Силицид кальция (CaSi2) • Сульфат кальция (CaSO4) • Сульфид кальция (CaS) • Сульфит кальция (CaSO3) • Тетрагидроалюминат кальция (Ca(AlH
Шаблон:АТХ код A02
Растворимость кислот, оснований и солей в воде
| H+ | Li+ | K+ | Na+ | NH4+ | Ba2+ | Ca2+ | Mg2+ | Sr2+ | Al3+ | Cr3+ | Fe2+ | Fe3+ | Ni2+ | Co2+ | Mn2+ | Zn2+ | Ag+ | Hg2+ | Hg22+ | Pb2+ | Sn2+ | Cu+ | Cu2+ | |
| OH− | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F− | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I− | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO32− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO42− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р | |
| NO2− | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO43− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO32− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | — | Н | — | Н | — | — | ? | — |
| CH3COO− | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN− | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO32− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Кальция карбонат + Магния карбонат — описание вещества, фармакология, применение, противопоказания, формула
Содержание
- Русское название
- Английское название
- Латинское название вещества Кальция карбонат + Магния карбонат
- Фармакологическая группа вещества Кальция карбонат + Магния карбонат
- Нозологическая классификация
- Торговые названия с действующим веществом Кальция карбонат + Магния карбонат
Русское название
Кальция карбонат + Магния карбонат
Английское название
Calcium carbonate + Magnesium carbonate
Латинское название вещества Кальция карбонат + Магния карбонат
Calcii carbonas + Magnii carbonas (род. Calcii carbonatis + Magnii carbonatis)
Calcii carbonatis + Magnii carbonatis)
Фармакологическая группа вещества Кальция карбонат + Магния карбонат
Антациды в комбинациях
Регуляторы водно-электролитного баланса и КЩС в комбинациях
Нозологическая классификация
Список кодов МКБ-10
- K21.0 Гастроэзофагеальный рефлюкс с эзофагитом
- K29.6.1* Гастрит гиперацидный
- K26 Язва двенадцатиперстной кишки
- K29.
 8 Дуоденит
8 Дуоденит - K29.1 Другие острые гастриты
- K27 Пептическая язва неуточненной локализации
- Q40.1 Врожденная грыжа пищеводного отверстия диафрагмы
- R10.
 1 Боли, локализованные в области верхней части живота
1 Боли, локализованные в области верхней части живота - K25 Язва желудка
- R12 Изжога
Торговые названия с действующим веществом Кальция карбонат + Магния карбонат
Сбросить фильтры
Лек. форма
таблетки жевательные
форма
таблетки жевательные
Дозировка Все дозировки 680 мг+80 мг Без дозировки
Производитель Все производители АЛКАЛОИД АД Скопье Алкалоид Байер Санте Фамильяль БиоФармКомбинат ООО Делфарм Гайярд Канонфарма продакшн ЗАО Обновление ПФК АО Татхимфармпрепараты АО Татхимфармпрепараты ОАО Эвалар ЮжФарм ООО
Наш сайт использует файлы cookie, чтобы улучшить работу сайта, повысить его эффективность и удобство. Продолжая использовать сайт rlsnet.ru, вы соглашаетесь с условиями использования файлов cookie.
Получите доступ к вашей Co3.wind.jp почте через IMAP — October 2022
Co3.wind.jp поддерживает IMAP / SMTP
Это значит, что вам не надо использовать Co3.wind.jp браузерный интерфейс! Вы можете просматривать свою почту использую другие почтовые приложения (like Mailbird, Microsoft Outlook или Mozilla Thunderbird). Работа с почтой на вашем компьютере сделает вас более продуктивным и ваша почта будет всегда в зоне доступности, даже когда у вас нет доступа к интернету.
Работа с почтой на вашем компьютере сделает вас более продуктивным и ваша почта будет всегда в зоне доступности, даже когда у вас нет доступа к интернету.
Настройте Ваш Co3.wind.jp Аккаунт с Вашей Почтовым Клиентом Используя IMAP
Для того, чтобы получить доступ к Co3.wind.jp почте из приложения на компьютере, вам надо IMAP и SMTP настройки ниже:
- IMAP Настройки
- SMTP Настройки
- POP3 Settings
| Co3.wind.jp IMAP Сервер | co3.wind.ne.jp |
| IMAP порт | 993 |
| IMAP безопасность | SSL |
| IMAP имя пользователя | Ваш почтовый адрес |
| IMAP пароль | Ваш Co3.wind.jp пароль |
| Co3.wind.jp SMTP Сервер | co3.wind.ne.jp |
| SMTP порт | 587 |
| SMTP безопасность | TLS |
| SMTP имя пользователя | Ваш полный почтовый адрес |
| SMTP пароль | Ваш Co3. wind.jp пароль wind.jp пароль |
| Co3.wind.jp POP3 Server | |
| POP3 port | 0 |
| POP3 security | |
| POP3 username | Your full email address |
| POP3 password | Your Co3.wind.jp password |
Трудности с IMAP? Откройте для себя Mailbird.
Mailbird автоматически найдет настройки вашей учетной записи.
Пользователи любят наш почтовый клиент.
Trustpilot
Введите вашу почту, чтобы получить ссыку и установить приложение на комьютер
Получить больше инструкций?
Проверьте нашу полную инструкцию для вашего почтового приложения
- Mailbird 3 шаги
- Gmail 5 шаги
- Outlook 5 шаги
- Thunderbird 4 шаги
- Windows Mail 6 шаги
Ваше полное имя
Ваш почтовый адрес
Шаг 1: Введите ваше имя и почту. Нажмите Продолжить.
Нажмите Продолжить.
Шаг 2: Mailbird автоматически обнаруживает настройки вашей почты. Нажмите Продолжить.
Step 3: Настройка завершена! Вы можете Добавить больше аккаунтов или начать использовать Mailbird.
Бонус-руководство: Как настроить IMAP / POP3 & SMTP E-mail почту в Gmail
Шаг 1: В верхнем правом углу, нажмите Настройки и Просмотреть все найстроки.
Шаг 2: Выберите Аккаунт и Импорт и затем нажмите на Добавить новый аккаунт.
Ваш почтовый адрес
Шаг 3: Введите адрес электронной почты, который Вы хотели бы добавить.
Шаг 4: Выберите один из двух вариантов.
Ваш почтовый адрес
Ваш пароль
co3. wind.ne.jp
wind.ne.jp
993
Шаг 5: Введите следующую информацию, чтобы закончить настройку.
Шаг 1: Нажмите на вкладку Файл в верхнем левом углу Outlook приложения.
Шаг 2: Нажмите добавить аккаунт.
Ваш почтовый адрес
Шаг 3: Введите вашу новую электронную почту и нажмите Соединиться
Шаг 4: На следующем экране, выберите IMAP
co3.wind.ne.jp
993
SSL
co3.wind.ne.jp
587
TLS
Шаг 5: Добавьте следующую информацию и нажмитеДалее
Шаг 1: В Mozilla Thunderbird, в меню выберите Настройки аккаунта.
Шаг 2: В левом нижнем углу, нажмите на Настройки аккаунта и Добавить Почтовый адрес…
Ваше полное имя
Ваш почтовый адрес
Ваш пароль
Шаг 3: Введите ваш почтовый адрес и нажмите н Настроить вручную…
co3.wind.ne.jp
993
SSL
co3.wind.ne.jp
587
TLS
Шаг 4: Добавьте следующую информацию и нажмите Завершить
Шаг 1: Нажмите на значок Настройки в нижнем левом углу.
Шаг 2: Нажмите на Управление аккаунтами.
Шаг 3: Нажмите на + Добавить аккаунт.
Шаг 4: Нажмите Расширенные Настройки.
Шаг 5: Нажмите на электронную почту.
Ваше полное имя
Ваш почтовый адрес
co3.wind.ne.jp
co3.wind.ne.jp
Шаг 6: Введи следующую информацию в соответствующие поля.
Часто задаваемые вопросы
Здесь мы собрали некоторые часто задаваемые вопросы для Co3.wind.jp с ответами
Контент
- Какая разница между IMAP и SMTP?
- Mailbird поддерживает IMAP? / Mailbird поддержиает POP3?
- Что означает ‘порт’ в настройках электронной почты?
- Как мне понять, что я должен использовать: POP3 или IMAP?
- Могу я использовать Mailbird на устройствах Mac?
- Как я могу скачать свои старые письма?
- Как я могу вручную настроить Co3.wind.jp на Mailbird?
- Как Mailbird защищает мою приватность?
1.
 Какая разница между IMAP и SMTP?
Какая разница между IMAP и SMTP?В узком смысле, IMAP подключается к серверу вашего почтового провайдера и используется для получения почты, когда SMTP используется для отправки почты на другие сервера.
IMAP (Internet Message Access Protocol) это протокол, который гарантирует, что Ваш почтовый провайдер сохранит все ваши сообщения и каталоги на своих собственных серверах. Именно поэтому, используете вы приложение на компьютере или в браузере, вы всегда сможете подключиться к вашей почте и просмотреть все письма, которые вы получили, потому что ваш провайдер обязан держать их на своих серверах.
STMP (Simple Mail Transfer Protocol) это протокол для отправки электронной почты с вашей почты на другие. Этот протокол позволяет, почтовому приложению подключиться к серверам вашего провайдера для отправки почты, особенно для отправки вашей почты на другие сервера.
Вернуться к ЧЗВ
2. Mailbird поддерживает IMAP? / Mailbird поддержиает POP3?
Да. Mailbird использует IMAP или POP3 для подключения к большинству email провайдерам. Кроме того, Mailbird использует технологии, которые позволяют обнаружить настройки серверов автоматически, Вам лишь необходимо ввести адрес электронной почты.
Кроме того, Mailbird использует технологии, которые позволяют обнаружить настройки серверов автоматически, Вам лишь необходимо ввести адрес электронной почты.
Если Mailbird не может обнаружить настройки серверов, вы можете настроить почту вручную введя детали серверов вашего поставщика: такие как IMAP или POP3 Порт и IMAP или POP3 Безопасность.
Вам также необходимо ввести имя пользователя и пароль для доступа к электронной почте.
Вернуться к ЧЗВ
3. Что означает ‘порт’ в настройках электронной почты?
Вы можете считать, что ‘порт’ это адресный номер. Так же само как IP адрес определяет нахождение компьютера, порт определяет приложение, работающее нам компьютере.
There are a few common port numbers, always use the recommended settings to configure your email server to Mailbird.
Вернуться к ЧЗВ
4. Как мне понять, что я должен использовать: POP3 или IMAP?
Если для Вас важно сохранить место на компьютере, или Вас беспокоит сохранность писем, то лучше выбрать IMAP. Это означает, что ваши письма будут сохранены на северах вашего провайдера.
Это означает, что ваши письма будут сохранены на северах вашего провайдера.
POP3 скачает все письма на компьютер и будет хранить их локально на вашем компьютере, а затем удалит из сервера. Это очистит место на сервере, но если что-то случиться с вашим компьютером, вы не сможете восстановить письма.
Прочитайте эту статью, чтобы узнать больше об их различиях и возможностях.
Вернуться к ЧЗВ
5. Могу я использовать Mailbird на устройствах Mac?
В данный момент, мы работаем над созданием копии Mailbird для устройств Mac! К сожалению, это значит, что, на данный момент, Mailbird не доступен для обладателей устройств Apple. Если вы бы хотели узнать первым, когда Mailbird станет доступен для обладателей Mac, нажмите здесь.
Вернуться к ЧЗВ
6. Как я могу скачать свои старые письма?
Если Ваши старые письма все еще доступны на вашем аккаунте, они будут автоматически загружены. IMAP протокол сихронизирует ваши сообщения и каталоги с информацией, хранящейся на серверах вашего провайдера, делая возможным управлять вашей почте на каждом компьютере, подключенным к вашей почте.
Как только вы добавитеr Co3.wind.jp аккаунт в Mailbird, вы получите доступ ко всей вашей почте мгновенно.
Важно: Если вы храните вашу почту на локальном сервере, вы не сможете импортировать их согласно IMAP протоколу.
Вернуться к ЧЗВ
7. Как я могу вручную настроить Co3.wind.jp на Mailbird?
Эта страница поможет Вам настроить Вашу почту на Mailbird. Шаг 6 описывает ручную настройку.
Вернуться к ЧЗВ
8. Как Mailbird защищает мою приватность?
Наша Политика Приватности и Условия Использования полность отвечают European General Data Protection Regulation (GDPR), 25 May 2018.
Mailbird не может прочитать вашу персональную информацию. Это включает ваше сообщения, вложения и пароли к почте. Mailbird это локальный почтовый клиент на вашем компьютере и все приватные данные остаются вашими и только вашими.
Вы можете нам написать напрямую в любое время, чтобы узнать какую информацию о вас или вашем аккаунте. Пожалуйста напишите на support@getmailbird. com.
com.
Вернуться к ЧЗВ
У вас другой провайдер почты?
Нажмите на вашего провайдера ниже, чтобы узнать как получить доступ к вашему аккаунту через IMAP:
Jazztel.es Google Mail Gmx.ru GMX Freemail Gmx.tm GMX Freemail Gmx.it GMX Freemail Gmx.pt GMX Freemail Gmx.net GMX Freemail Gmx.at GMX Freemail Gmx.de GMX Freemail Gmx.ch GMX Freemail Gmx.org GMX Freemail
Сколько стоит CO3?
Вещество с химической формулой CO 3 известно как карбонат . Карбонат состоит из 1 атома углерода и 3 атомов кислорода и имеет электрических зарядов –2 . Этот отрицательный заряд означает, что один ион карбоната имеет на 2 электрона больше, чем протонов.
Карбонат представляет собой гибкий многоатомный ион и характеризуется склонностью к образованию солевых соединений с щелочными и щелочноземельными металлами. Карбонатные соединения являются основным компонентом нескольких типов осадочных пород, наиболее известным из которых является известняк, состоящий в основном из карбоната кальция (CaCO 3 ). Карбонатные соединения также входят в состав раковин моллюсков и кораллов, а также в чистящих средствах, таких как карбонат натрия (Na 2 CO 3 ) и карбонат калия (K 2 CO 3 ). Карбонатные соединения также присутствуют в организме человека, где они используются в качестве буфера для регулирования уровня pH в крови.
Карбонатные соединения также входят в состав раковин моллюсков и кораллов, а также в чистящих средствах, таких как карбонат натрия (Na 2 CO 3 ) и карбонат калия (K 2 CO 3 ). Карбонатные соединения также присутствуют в организме человека, где они используются в качестве буфера для регулирования уровня pH в крови.
«Часто называемый остеопорозом океана, [закисление океана] не позволяет существам, строящим раковины, таким как лобстеры, устрицы, крабы, креветки и кораллы, извлекать из воды карбонат кальция, который им необходим для построения своих раковин и таким образом, не в состоянии выжить». — Филипп Кусто-младший
Карбонат – это многоатомный ион, состоящий из 2 или более атомов. Во-первых, давайте рассмотрим общую концепцию иона и подойдем к более сложной идее многоатомного иона.
Что такое ион?
В двух словах, ион — это атом, который имеет неравное количество протонов и электронов. Все атомы состоят из трех видов частиц: протонов, нейтронов и электронов. Протоны и нейтроны существуют вместе в ядре атома, в то время как электроны существуют в орбитальных оболочках, окружающих ядро. каждая частица имеет соответствующий электрический заряд. Протоны имеют заряд +1, а электроны имеют заряд –1. Нейтроны имеют нейтральный электрический заряд 0,
Все атомы состоят из трех видов частиц: протонов, нейтронов и электронов. Протоны и нейтроны существуют вместе в ядре атома, в то время как электроны существуют в орбитальных оболочках, окружающих ядро. каждая частица имеет соответствующий электрический заряд. Протоны имеют заряд +1, а электроны имеют заряд –1. Нейтроны имеют нейтральный электрический заряд 0,
В нормальном атоме существует равное количество протонов и электронов. В таких атомах положительные заряды протонов и отрицательные заряды электронов в точности равны и противоположны, поэтому заряды уравновешиваются, и атом в целом электрически нейтрален. Однако это не всегда так. Атомы могут приобретать или терять электроны и, таким образом, приобретать общий отрицательный или положительный заряд. Атомы с ненулевыми электрическими зарядами называются ионами .
Существует два основных типа ионов. Положительно заряженные атомы называются катионы . Катионы образуются, когда атом теряет электроны.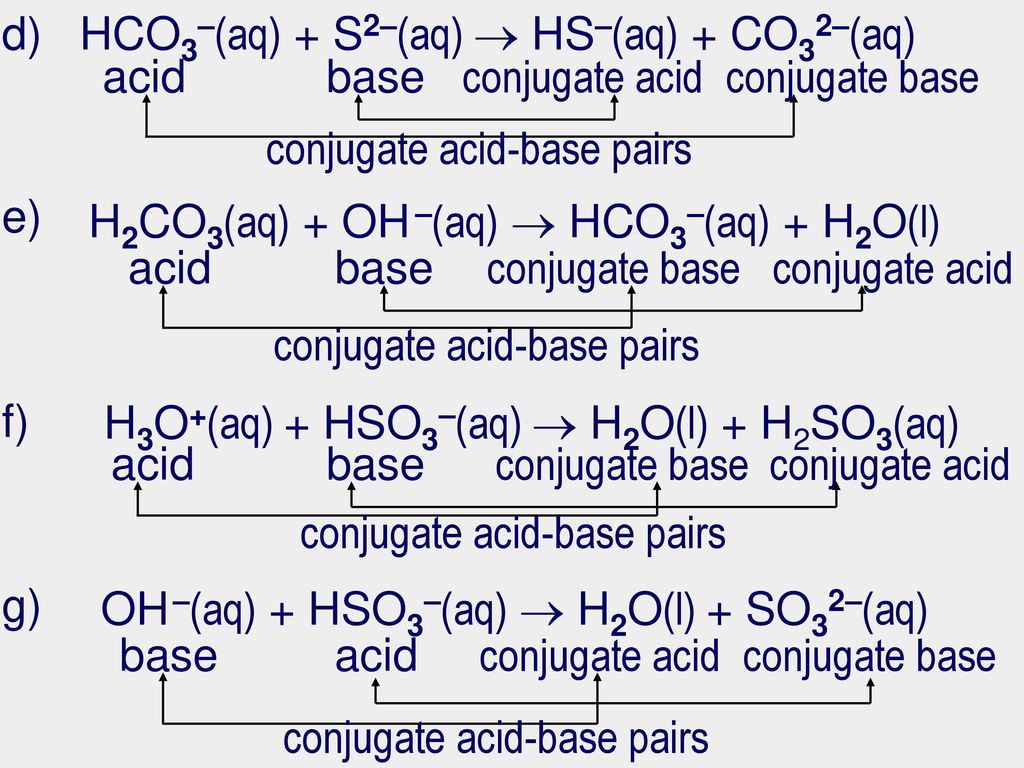 Теперь протонов больше, чем электронов, поэтому атом имеет общий положительный заряд. Отрицательно заряженные ионы называются анионами и образуются, когда атом приобретает электроны. Теперь электронов больше, чем протонов, поэтому атом имеет общий отрицательный заряд.
Теперь протонов больше, чем электронов, поэтому атом имеет общий положительный заряд. Отрицательно заряженные ионы называются анионами и образуются, когда атом приобретает электроны. Теперь электронов больше, чем протонов, поэтому атом имеет общий отрицательный заряд.
«Позволяя положительным ионам проходить через электрическое поле и таким образом придавая им определенную скорость, можно отличить их от нейтральных неподвижных атомов». — Йоханнес Старк
В качестве примера возьмем натрий (Na). Атом натрия имеет 11 протонов и 11 электронов. Натрий имеет относительно низкую энергию ионизации, а это означает, что его электроны могут быть легко удалены. Таким образом, натрий имеет тенденцию терять электронов и образовывать положительный катион. Электрический заряд иона обычно записывается в виде надстрочного числа рядом с химическим символом. В случае натрия натрий обычно теряет 1 электрон и образует ион с зарядом +1, обозначаемый Na + 9.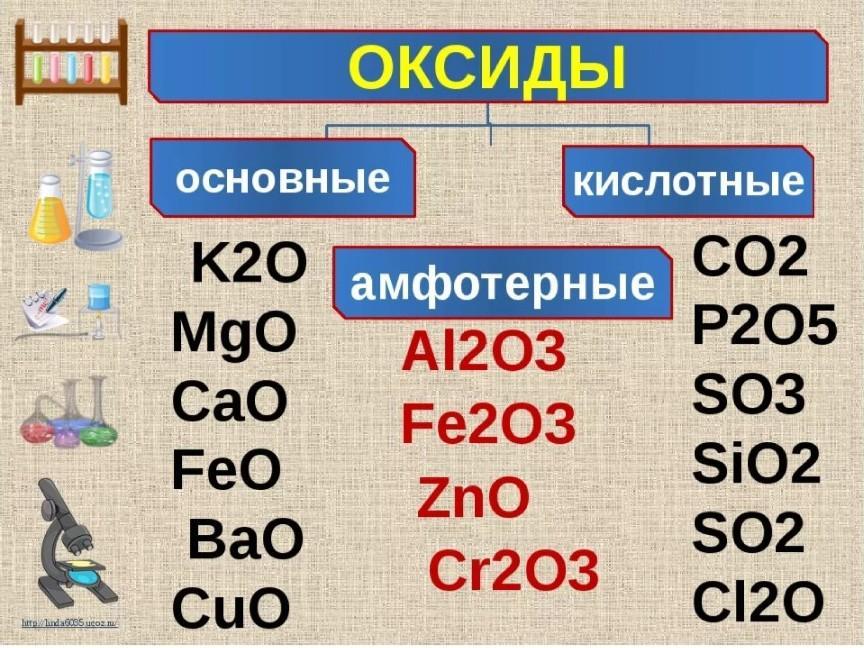 0052 . Фтор (F), с другой стороны, имеет высокую электроотрицательность и легко захватывает лишние электроны. Атом фтора забирает лишний электрон, чтобы заполнить его внешнюю оболочку, и образует ион с зарядом –1, обозначаемый F –
0052 . Фтор (F), с другой стороны, имеет высокую электроотрицательность и легко захватывает лишние электроны. Атом фтора забирает лишний электрон, чтобы заполнить его внешнюю оболочку, и образует ион с зарядом –1, обозначаемый F –
. Ионы образуют связи за счет сильного электростатического притяжения между положительными и отрицательными ионами. В случае хлорида натрия (NaCl) катион натрия будет связываться с анионом хлора следующим образом:
Ионная связь между катионом натрия и анионом хлорида. Предоставлено: Rhannosh через WikiCommons CC BY-SA 3.0
Ионные связи прочнее ковалентных из-за более сильного электростатического взаимодействия между ионами. Ионные соединения обычно хрупкие, имеют высокие температуры плавления/кипения и легко растворяются в полярных растворителях.
Многоатомные ионы
Многоатомные ионы, как следует из названия, представляют собой ионы, состоящие из нескольких атомов. Другими словами, многоатомный ион — это всего лишь молекула, в которой неодинаковое количество протонов и электронов. Как и одноатомные ионы, многоатомные ионы имеют общий положительный или отрицательный заряд.
Как и одноатомные ионы, многоатомные ионы имеют общий положительный или отрицательный заряд.
Возьмем, к примеру, аммоний (NH 4 + ). Аммоний представляет собой многоатомный ион, состоящий из одного атома азота и четырех атомов водорода. Аммоний имеет в общей сложности 9 протонов (5 для азота и по 1 для каждого водорода), но только 8 электронов. Итак, аммоний имеет общий заряд +1. Аммоний может быть образован протонированием (присоединением протона) к аммиаку (NH 3 ). Добавление дополнительного протона придает всей молекуле чистый положительный заряд.
Многоатомные ионы чаще всего встречаются в контексте кислотно-щелочных химических реакций. Кислые растворы образуются при диссоциации атомов водорода из вещества. В результате этого процесса образуются свободные протоны (H + ионов) и соответствующую многоатомную сопряженную пару оснований. Например, серная кислота (H 2 SO 4 ) будет диссоциировать в растворителе с образованием ионов 2 H + и их сопряженного основания, многоатомного иона сульфата SO 4 2− .
Диссоциация серной кислоты на катионы водорода и сульфат-анион. Предоставлено: Риккардо Ровинетти через WikiCommons CC BY-SA 3.0. Изображение обрезано.
Обратите внимание, как ион сульфата удерживает два электрона, которые изначально были общими для атомов водорода. Добавление двух электронов от диссоциированных атомов водорода придает иону сульфата его общий отрицательный заряд -2.
Ионы VS Полярность
Ионы и полярные молекулы — это не одно и то же. Полярные молекулы — это молекулы, которые имеют электрический диполь из-за неравномерного пространственного распределения атомов. Ионы — это атомы, которые имеют неравное количество электронов и протонов. Полярные соединения содержат ковалентные связи, ионные соединения — нет. Кроме того, полярные молекулы имеют частичные электрические заряды, в то время как одноатомные и многоатомные ионы имеют целые электрические заряды.
Карбонат как многоатомный ион
Карбонат — простейший вид оксоуглеродного иона. он состоит из 3 атомов кислорода, связанных с центральным атомом углерода, и имеет симметричную тригональную плоскую геометрию. Карбонат имеет молярную массу около 60 г/моль. Это сопряженное основание угольной кислоты (H 2 CO 3 ) и может быть получено путем диссоциации угольной кислоты в растворителе.
он состоит из 3 атомов кислорода, связанных с центральным атомом углерода, и имеет симметричную тригональную плоскую геометрию. Карбонат имеет молярную массу около 60 г/моль. Это сопряженное основание угольной кислоты (H 2 CO 3 ) и может быть получено путем диссоциации угольной кислоты в растворителе.
Атомная структура иона карбоната не может быть представлена одной структурой Льюиса. Здравый смысл подсказывает, что атом карбоната состоит из центрального атома углерода, имеющего две одинарные связи с отрицательным атомом кислорода и двойную связь с нейтральным кислородом. Эмпирические наблюдения показывают, что ион полностью симметричен, а каждая связь и атом кислорода эквивалентны. Таким образом, карбонат обычно представлен резонансной структурой Льюиса:
Резонансная структура карбоната. Предоставлено: WikiCommons CC0 1.0
Под фактической электронной структурой карбонат-иона понимается некоторое среднее значение этих трех отдельных цифр.
Карбонат-ионы электрически отрицательны и поэтому имеют сильную склонность к образованию ионных связей с положительно заряженными катионами. Полученное вещество обычно называют карбонатной солью. Обычно карбонат-ионы образуют соли с щелочными и щелочноземельными металлами 1-й и 2-й групп. Щелочные и щелочноземельные металлы, такие как натрий, калий, кальций и магний, склонны образовывать положительные катионы, поэтому они легко связываются с отрицательными карбонатными анионами. Одной из наиболее распространенных карбонатных солей является карбонат кальция (CaCO 3 ). Карбонат кальция представляет собой соль, образованную ионной связью между катионом кальция (Ca 2+ ) и карбонатным анионом. Другие распространенные карбонатные соли включают карбонат калия (K 2 CO 3 ), карбонат магния (MgCO 3 ) и карбонат натрия (Na 2 CO 3 ).
Карбонат
Карбонат кальция является основным компонентом большинства видов осадочных пород. Известняк, например, состоит в основном из карбоната кальция. Известняк может растворяться водой из-за его ионного состава. При растворении известняка в воде образуются катионы кальция и анионы карбоната. Отложение карбонатных солей минерализованной водой является основным механизмом образования сталактитов и сталагмитов в пещерах.
Известняк, например, состоит в основном из карбоната кальция. Известняк может растворяться водой из-за его ионного состава. При растворении известняка в воде образуются катионы кальция и анионы карбоната. Отложение карбонатных солей минерализованной водой является основным механизмом образования сталактитов и сталагмитов в пещерах.
Сталактиты образуются из карбонатных соединений, растворенных в воде. Фото: Pixabay CC0 1.0
Карбонат также является важным биологическим веществом. Наиболее очевидно, что карбонатные соединения выделяются человеческим организмом для регулирования внутреннего уровня pH. Например, когда рН крови становится слишком низким, что означает, что кровь кислая и имеет высокую концентрацию ионов водорода, организм вырабатывает ионы карбоната. Ионы карбоната поглощают избыточные протоны, которые возвращают pH крови к нормальному уровню. Когда pH крови слишком высок, почки выделяют ионы бикарбоната (HCO 3 − ), которые диссоциируют и вводят в кровь больше ионов водорода.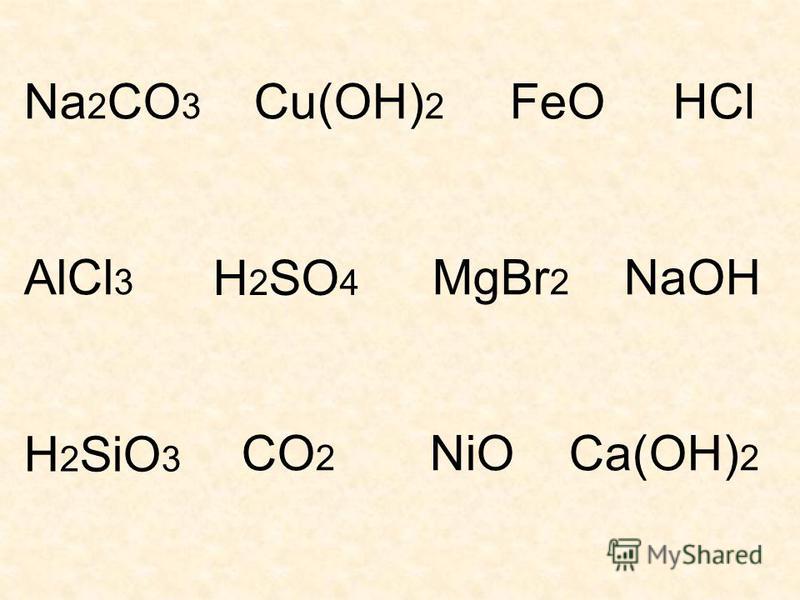 Тот же механизм лежит в основе использования карбонатных соединений в антацидах. Ионы карбоната вступают в реакцию и нейтрализуют желудочную кислоту, что облегчает симптомы кислотного рефлюкса и расстройства желудка.
Тот же механизм лежит в основе использования карбонатных соединений в антацидах. Ионы карбоната вступают в реакцию и нейтрализуют желудочную кислоту, что облегчает симптомы кислотного рефлюкса и расстройства желудка.
«Бог обвиняет расстройство желудка в навязывании морали желудку». — Виктор Гюго
Карбонатные соединения также играют важную роль в образовании углекислого газа в атмосфере. Многие морские организмы используют карбонатные буферные системы для регулирования внутреннего уровня pH. Они выделяют эти карбонатные соединения, которые, в свою очередь, превращаются в углекислый газ и выбрасываются в атмосферу из океанов Земли. Карбонатные системы в океанах являются одним из основных естественных производителей углекислого газа в атмосфере. Повышение температуры океана может привести к образованию большего количества углекислого газа из карбонатных соединений, растворенных в океане, что приведет к повышению концентрации углекислого газа в атмосфере.
В контексте органической химии функциональные группы, состоящие из одного атома углерода и трех атомов кислорода, часто называют карбонатами. Хотя технически это не многоатомные ионы, карбонатные функциональные группы сохраняют многие свойства своих свободно существующих ионных кузенов, включая свои свойства растворителя.
Структура Льюиса CO32, молекулярная геометрия, гибридизация и МО-диаграмма
Карбонаты являются одними из наиболее часто встречающихся и обсуждаемых ионных соединений в области химии. Соли угольной кислоты, карбонаты широко используются в различных промышленных и бытовых целях. Некоторые из них включают создание стекла и керамики, консервирование продуктов питания и добычу железа.
Ион CO32- является простейшим оксоуглеродным анионом, который разлагается при нагревании и обычно нерастворим в воде, за некоторыми исключениями.
Давайте теперь подробно изучим химическую связь иона CO32-.
CO32-Структура Льюиса
Если вы читаете эту статью, то наверняка уже встречали этот термин, не так ли?
Нет необходимости упоминать, когда кто-то узнает о природе химических связей между атомами и молекулами, Структура Льюиса — это концепция, которую мы не можем просто вынести за скобки.
Чтобы получить быстрый и четкий обзор атомных связей между элементами, все, что нам нужно сделать, это сначала начертить двухмерное схематическое представление данной молекулы. Структура Льюиса — это название, данное такой скелетной диаграмме, где мы используем символы атомов и точки для представления электронов валентной оболочки.
Следовательно, структура Льюиса также обычно называется структурой электронных точек.
Приступим к построению наиболее подходящей LS-диаграммы иона CO32-.
Шаг 1 : Подсчитайте общее количество валентных электронов.
В ионе CO32- у нас есть один атом углерода и три атома кислорода, а также два отрицательно заряженных электрона, несущих заряд.
Валентные электроны относятся к числу электронов в самой внешней оболочке атома вокруг ядра, которые помогают определить валентность данного атома. Мы можем легко узнать значение по атомному номеру, указанному в периодической таблице.
В случае карбонат-иона
Углерод имеет атомный номер 6 и валентность 4. Кислород имеет атомный номер 8 и валентность 6.
общее число валентных электронов в CO32- равно
= 4 + 6*3 + 2
= 24.
Шаг 2 : Определите центральный атом молекулы.
Теперь, чтобы нарисовать структуру Льюиса, мы должны определить, какой из атомов является центральным в многоатомной гетерогенной молекуле, в данном случае ион.
В карбонат-ионе среди двух элементов углерод имеет значение электроотрицательности 2,55, тогда как кислород имеет высокое значение 3,44.
Согласно обычной процедуре, атом с наименьшим значением электроотрицательности будет работать как центральный атом.
Углерод здесь является центральным атомом.
Шаг 3 : Нарисуйте схему молекулы.
С помощью точек для валентных электронов и атомных символов для элементов мы сможем нарисовать первичный набросок карбонат-иона.
Для этого нам сначала нужно включить правило октетов.
Октет Правило
Элементы, присутствующие в основной группе, обычно имеют тенденцию следовать концепции выполнения октетов. Это означает, что эти атомные элементы будут склоняться к тому, чтобы иметь восемь валентных электронов, как и конфигурации инертных газов того же периода.
Нарисуем скелетную диаграмму для иона СО32-:
Шаг 4 : Образование связи
Здесь, как видим, мы нарисовали эскиз.
- Общее число валентных электронов принято равным 24.
- Два электрона были разделены между углеродом и каждым из трех атомов кислорода, что указывает на существование одинарных связей.
- Правило октета выполнено для всех атомов кислорода.
- Однако у атома углерода всего шесть электронов, поэтому конфигурация октета не выполняется.
Мы можем рассмотреть возможность наличия двойной связи между любым из атомов кислорода и углерода, что приведет к тому, что углерод будет иметь восемь валентных электронов вокруг себя.
Посмотрите на эту структуру Льюиса.
Здесь,
У нас есть каждый кислород, имеющий октетную конфигурацию,
У нас есть углерод, имеющий октетную конфигурацию.
У нас есть две одинарные связи между углеродом и каждым из двух атомов кислорода.
У нас есть одна двойная связь между C и одним атомом O.
После рисования связей структура Льюиса выглядит следующим образом:
Это также можно показать на изображении ниже.
Шаг 5 : Формальный заряд
Чтобы проверить, является ли приведенный выше эскиз наилучшей возможной структурой Льюиса карбонатного (CO32-) иона, нам нужно будет проверить значения формального заряда.
Иногда мы приписываем заряд связанному атому, предполагая, что заряд поровну распределяется между всеми связанными атомами. Это называется формальным обвинением.
Формула формального начисления:
Найдем для CO32- :
Для углерода формальный заряд = 4 – 0,5*8 – 0 = 4 – 4 = 0.
Для каждого O в простой связи с углеродом формальный заряд
= 6 – 0,5*2 – 6 = 6 – 1 – 6 = -1.
Для атома О в двойной связи с углеродом формальный заряд
= 6 – 0,5*4 – 4 = 6 – 2 – 4 = 0.
Мы видим, что значения формального заряда каждого атома сохраняются при их низшие возможные формы. Таким образом, наша структура Льюиса завершена.
CO32- Молекулярная геометрия
Достаточно ли двухмерной структуры для глубокого понимания связи, происходящей внутри молекулы?
Хорошо нарисованная структура Льюиса знакомит нас с основным представлением составляющих атомов внутри любой молекулы или иона, а также говорит о типе образованных связей.
Но этого недостаточно.
А вот и теория VSEPR или модель теории отталкивания электронных пар валентной оболочки, которая занимается определением трехмерной природы любого молекулярного состава.
Это известно как молекулярная геометрия, в которой упоминается не только форма молекулы, но также длины связей и углы.
Это помогает нам лучше и яснее представить себе молекулу.
Здесь мы можем использовать обозначение AXn, чтобы выяснить точную молекулярную геометрию иона CO32-.
Это известно как нотация VSEPR. В этой теории мы говорим о минимальном отталкивании, происходящем между отрицательно заряженными электронными облаками, чтобы иметь сбалансированный молекулярный состав.
В нотации AXn
A означает центральный атом,
X означает количество атомов, окружающих центральный атом,
n означает количество связей, присоединенных к центральному атому внутри молекулы,
Ex обозначает количество неподеленных пар (несвязанных электронных пар) центрального атома.
Для иона карбоната,
A= атом углерода,
X= атом кислорода,
n= 3,
Ex= 0,
Следовательно, требуется обозначение AX3.
Давайте посмотрим на приведенную выше диаграмму. Согласно диаграмме VSEPR с обозначениями AXnEx, мы можем предсказать форму нашей молекулы.
Форма обозначения AX3, как и в случае с ионом CO32-, представляет собой тригональную плоскость с валентным углом около 120 градусов.
CO32-гибридизация
Если вы изучаете химию, можно с уверенностью предположить, что вы знаете разницу между орбиталью и орбиталью.
В то время как орбита говорит об определенном пути электрона вокруг атомных ядер, орбитальность связана с вероятностью присутствия электронов в любом заданном пространстве.
Атомные орбитали имеют различную форму, например, сферическую или гантелевидную. Соответственно они называются s,p,d,f.
Теперь, когда происходит химическое связывание, эти АО сходятся и объединяются, образуя гибридные орбитали, которые принимают участие в образовании связей внутри молекулы.
Этот процесс называется гибридизацией.
Если мы снова посмотрим на концепцию формального заряда в структуре Льюиса, мы увидим, что атомы кислорода, связанные одинарными связями в СО, имеют отрицательный заряд -1, присоединенный к каждому из них. Однако атом O с двойной связью в C = O не имеет значения заряда.
Однако атом O с двойной связью в C = O не имеет значения заряда.
Одинарные связи означают наличие сигма-связей, тогда как двойная связь указывает на наличие как сигма-, так и пи-связей.
Следовательно, у нас есть 3 сигмы и 1 пи вокруг центрального атома С в карбонат-ионе. Ниже приведена формула для быстрой расшифровки H (значение гибридизации) атома внутри молекулы.
Здесь V = 4, M = 0, C = 0, A = 2.
H = 0,5 ( 4 + 0 – 0 + 2 ) = 3.
Для значения 3 электронных пар, у нас есть гибридизация sp2 .
CO32- молекулярная орбитальная (МО) диаграмма
Что такое теория МО?
Теория молекулярных орбиталей — это концепция квантовой механики, которая используется для расшифровки природы химических связей внутри различных молекулярных структур.
Это сложный, но полезный инструмент, который помогает рисовать схемы МО для лучшего понимания. Эта теория рассматривает электроны как имеющие как корпускулярную, так и волновую природу.
Здесь, в отличие от теории валентных связей, где АО одного и того же атома могут сливаться только с образованием гибридизованных орбиталей, что приводит к гибридизации, мы можем считать, что валентные электроны являются общими для всех атомов.
Таким образом, АО разных атомов могут объединяться для слияния с образованием молекулярных орбиталей (МО).
В карбонат-ионе теория молекулярных орбиталей может быть лучше всего объяснена через делокализованную пи-связь. Делокализованная пи-связь означает, что электроны могут свободно перемещаться по нескольким ядрам, т. Е. Пи ( π ) может появляться в нескольких конформациях.
При построении структуры Льюиса мы обнаружили, что валентных электронов 24. Каждый атом кислорода внутри иона имеет четыре несвязывающих электрона.
У нас есть 3 сигма-связи, поэтому используется 6.
Атомный номер углерода: 6
Атомный номер кислорода: 8
Электронная конфигурация C: 1s2 2s2 2p2 .
Электронная конфигурация O: 1s2 2s2 2p4 .
2pz-орбитали углерода и три атома O доступны для делокализованной пи-связи. У нас есть два электрона, заполняющих связывающую молекулярную орбиталь, и четыре, заполняющих несвязывающие МО.
Таким образом, шесть доступных пи-электронов используются для занятия МО с наименьшей энергией – связывающих МО. Это пример четырехцентровой обработки π MO.
Заключение
Здесь, в этой подробной статье, мы провели подробное обсуждение природы химической связи знаменитого карбонат-аниона.
Мы рассмотрели формирование структуры Льюиса, расшифровали идеальную молекулярную геометрию и валентные углы трехмерного CO32-. Не только это, мы также занимались орбитальной гибридизацией и квантовой теорией МО.
Приятного обучения!
Типы лесной растительности — CO3
CO3 — Ель красная / Рябина / Лисичка
Picea rubens / Sorbus americana / Vaccinium vitis-idaea
Замочная скважина Брук, мыс Чиньекто, округ Камберленд |
Концепция: В этом позднем сукцессионном типе растительности (VT) преобладает красная ель с компонентом бальзамической пихты.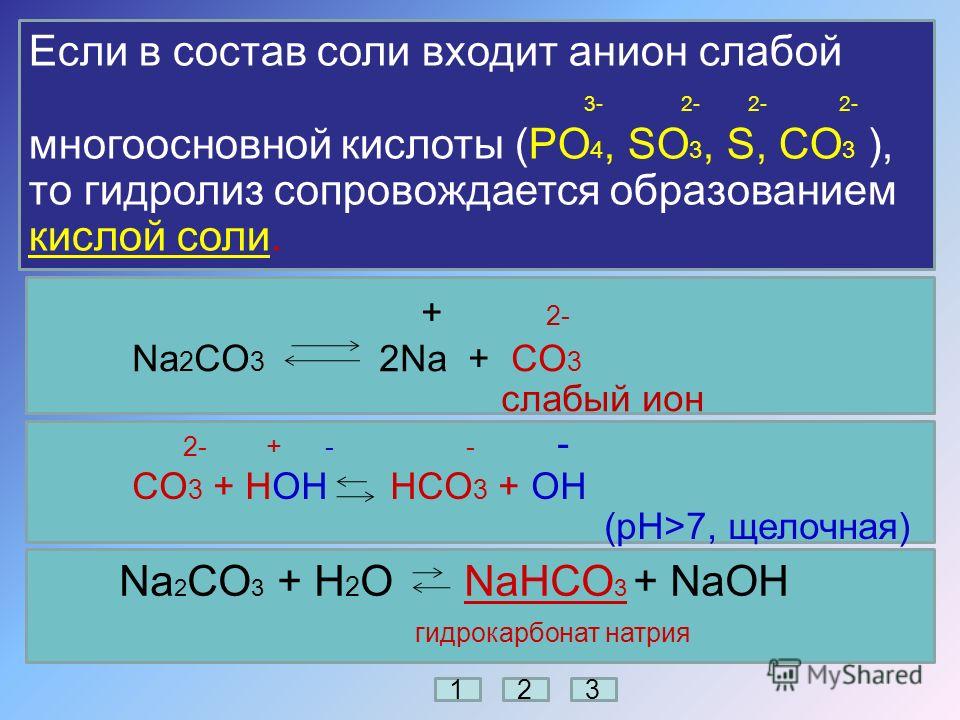 CO3 — единственный морской бореальный VT, в котором преобладает красная ель. Помимо присутствия типичных для прибрежных лесов видов (например, рябины и брусники), СО3 отличается от растительности акадской красной ели относительно толстым дафовым слоем и обширным покровом баззании. Отсутствие болиголова, который обычно является компонентом красных еловых лесов Новой Шотландии, также является отличительной чертой CO3. Ель красная / Рябина / Лисичка в основном встречается на склонах залива Фанди.
CO3 — единственный морской бореальный VT, в котором преобладает красная ель. Помимо присутствия типичных для прибрежных лесов видов (например, рябины и брусники), СО3 отличается от растительности акадской красной ели относительно толстым дафовым слоем и обширным покровом баззании. Отсутствие болиголова, который обычно является компонентом красных еловых лесов Новой Шотландии, также является отличительной чертой CO3. Ель красная / Рябина / Лисичка в основном встречается на склонах залива Фанди.
Растительность: Красная ель является преобладающим надярусным деревом, с бальзамической пихтой и белой березой в качестве обычных партнеров. В некоторых насаждениях также встречаются желтая береза, черная ель, красный клен и сердцевидная береза. В слаборазвитом кустарниковом ярусе преобладают деревья-регенеранты, а также рябина и голубика бархатнолистная. Травяной ярус более развит и включает в себя типичную горную флору, такую как твинфлауэр, грозди, златоцвет и сарсапарель. Также можно найти рассеянную бруснику с коричным папоротником и трехсемянной осокой на более влажных участках. Баззания доминирует в ярусе мохообразных.
Также можно найти рассеянную бруснику с коричным папоротником и трехсемянной осокой на более влажных участках. Баззания доминирует в ярусе мохообразных.
Окружающая среда: CO3 в основном связан с почвами ледникового происхождения, от свежих до влажных, с питательной средой. Эти почвы, как правило, имеют средний или крупный гранулометрический состав. CO3 и более ранние сукцессионные стадии покрывают большую часть скважины до несовершенно дренированных склонов вдоль залива Фанди. Лучшие примеры можно найти вдоль мыса Чиньекто, где крутые склоны ограничивали преобразование леса в сельскохозяйственные угодья (как это произошло на более пологих склонах Северной горы). Этот VT также можно найти в экорайоне островов Таскет. Сильные ветры и воздействие ограничивают потенциальную высоту деревьев в насаждениях CO3. VT происходит на побережье Фанди в Нью-Брансуике.
Сукцессионная динамика: CO3 представляет собой поздний сукцессионный VT, в котором преобладает красная ель. Этот VT обычно следует за нарушениями насаждений, такими как ветровал , заражение насекомыми и сбор урожая. Долговечность и теневыносливость ели красной дает возможность для развития разновозрастных лесов, поддерживаемых щелевыми нарушениями. CO4 (бальзамическая пихта / Foxberry — Twinflower) может быть средней сукцессионной стадией. В лесах, образующихся после рубок, первоначально могут преобладать черемуха, малина, белая береза, сердцевидная береза и рябина.
Этот VT обычно следует за нарушениями насаждений, такими как ветровал , заражение насекомыми и сбор урожая. Долговечность и теневыносливость ели красной дает возможность для развития разновозрастных лесов, поддерживаемых щелевыми нарушениями. CO4 (бальзамическая пихта / Foxberry — Twinflower) может быть средней сукцессионной стадией. В лесах, образующихся после рубок, первоначально могут преобладать черемуха, малина, белая береза, сердцевидная береза и рябина.
Экологические особенности: Этот закрытый полог, большой «> участок леса в первую очередь связан с экорегионом Фанди-Шор. Лучшие провинциальные примеры находятся на склонах мыса Чиньекто, где крутая топография ограничивала преобразование лесов в сельское хозяйство. Вдоль более пологих склонов Северной горы Фанди мало насаждений, сохранившихся от прошлого и настоящего земледелия. В этих лесах растут одни из самых старых красных елей в мире, в том числе рекордная 445-летняя ель, найденная в национальном парке Фанди. В зрелых лесах образуется обильная старческая борода, лишайник, используемый камышевками и другими видами в качестве материала для гнезд, а также зимняя пища для оленей, собирающихся на упавших деревьях. В некоторых насаждениях встречается редкий арктический почковый лишайник.
| Баззания |
Отличительные признаки : Красная ель является диагностическим признаком этого хвойного леса, произрастающего только вдоль залива Фанди и среди островов Таскет. Присутствие рябины, березы сердцевидной, брусники и баззании является индикатором прибрежного влияния, хотя они присутствуют не всегда.
Присутствие рябины, березы сердцевидной, брусники и баззании является индикатором прибрежного влияния, хотя они присутствуют не всегда.

 Solvay S. A. (9 марта 2007). Архивировано из первоисточника 9 февраля 2012.
Solvay S. A. (9 марта 2007). Архивировано из первоисточника 9 февраля 2012. 8 Дуоденит
8 Дуоденит 1 Боли, локализованные в области верхней части живота
1 Боли, локализованные в области верхней части живота