Экспериментальное исследование системы Na2CO3-CaCO3-MgCO3 при 3 и 6 ГПа — Novosibirsk State University
| Original language | Russian |
|---|---|
| Pages | 103 |
| Number of pages | 1 |
| Publication status | Published — 2021 |
| Event | Всероссийский ежегодный семинар по экспериментальной минералогии, петрологии, геохимии — ГЕОХИ РАН, Москва, Russian Federation Duration: 25 May 2021 → 26 May 2021 |
| Conference | Всероссийский ежегодный семинар по экспериментальной минералогии, петрологии, геохимии |
|---|---|
| Abbreviated title | ВЕСЭМПГ-2021 |
| Country/Territory | Russian Federation |
| City | Москва |
| Period | 25.05.2021 → 26.05.2021 |
- 1.
 05 EARTH AND RELATED ENVIRONMENTAL SCIENCES
05 EARTH AND RELATED ENVIRONMENTAL SCIENCES
Краткие тезисы ВЕСЭМПГ2021-31052021Final published version, 1.34 MB
- APA
- Author
- BIBTEX
- Harvard
- Standard
- RIS
- Vancouver
Подбородников, И. В., Шацкий, А. Ф., Арефьев, А. В., & Литасов, К. Д. (2021). Экспериментальное исследование системы Na2CO3-CaCO3-MgCO3 при 3 и 6 ГПа. 103. Abstract from Всероссийский ежегодный семинар
В., Шацкий, А. Ф., Арефьев, А. В., & Литасов, К. Д. (2021). Экспериментальное исследование системы Na2CO3-CaCO3-MgCO3 при 3 и 6 ГПа. 103. Abstract from Всероссийский ежегодный семинар
по экспериментальной минералогии, петрологии, геохимии, Москва, Russian Federation.
Подбородников, Иван Васильевич ; Шацкий, Антон Фарисович ; Арефьев, Антон Васильевич et al. / Экспериментальное исследование системы Na2CO3-CaCO3-MgCO3 при 3 и 6 ГПа. Abstract from Всероссийский ежегодный семинар
по экспериментальной минералогии, петрологии, геохимии, Москва, Russian Federation.1 p.
@conference{70c277389e0e44f3bbeefc785eef8e57,
title = «Экспериментальное исследование системы Na2CO3-CaCO3-MgCO3 при 3 и 6 ГПа»,
author = «Подбородников, {Иван Васильевич} and Шацкий, {Антон Фарисович} and Арефьев, {Антон Васильевич} and Литасов, {Константин Дмитриевич}»,
year = «2021»,
language = «русский»,
pages = «103»,
note = «Всероссийский ежегодный семинар <br/>по экспериментальной минералогии, петрологии, геохимии, ВЕСЭМПГ-2021 ; Conference date: 25-05-2021 Through 26-05-2021»,
}
Подбородников, ИВ, Шацкий, АФ, Арефьев, АВ & Литасов, КД 2021, ‘Экспериментальное исследование системы Na2CO3-CaCO3-MgCO3 при 3 и 6 ГПа’, Всероссийский ежегодный семинар
по экспериментальной минералогии, петрологии, геохимии, Москва, Russian Federation, 25.
Экспериментальное исследование системы Na2CO3-CaCO3-MgCO3 при 3 и 6 ГПа. / Подбородников, Иван Васильевич; Шацкий, Антон Фарисович; Арефьев, Антон Васильевич et al.
2021. 103 Abstract from Всероссийский ежегодный семинар
по экспериментальной минералогии, петрологии, геохимии, Москва, Russian Federation.
Research output: Contribution to conference › Abstract
TY — CONF
T1 — Экспериментальное исследование системы Na2CO3-CaCO3-MgCO3 при 3 и 6 ГПа
AU — Подбородников, Иван Васильевич
AU — Шацкий, Антон Фарисович
AU — Арефьев, Антон Васильевич
AU — Литасов, Константин Дмитриевич
PY — 2021
Y1 — 2021
M3 — тезисы
SP — 103
T2 — Всероссийский ежегодный семинар <br/>по экспериментальной минералогии, петрологии, геохимии
Y2 — 25 May 2021 through 26 May 2021
ER —
Подбородников ИВ, Шацкий АФ, Арефьев АВ, Литасов КД. Экспериментальное исследование системы Na2CO3-CaCO3-MgCO3 при 3 и 6 ГПа. 2021. Abstract from Всероссийский ежегодный семинар
Экспериментальное исследование системы Na2CO3-CaCO3-MgCO3 при 3 и 6 ГПа. 2021. Abstract from Всероссийский ежегодный семинар
по экспериментальной минералогии, петрологии, геохимии, Москва, Russian Federation.
что, как сбалансировать и часто задаваемые вопросы —
By Даршана Фендаркар
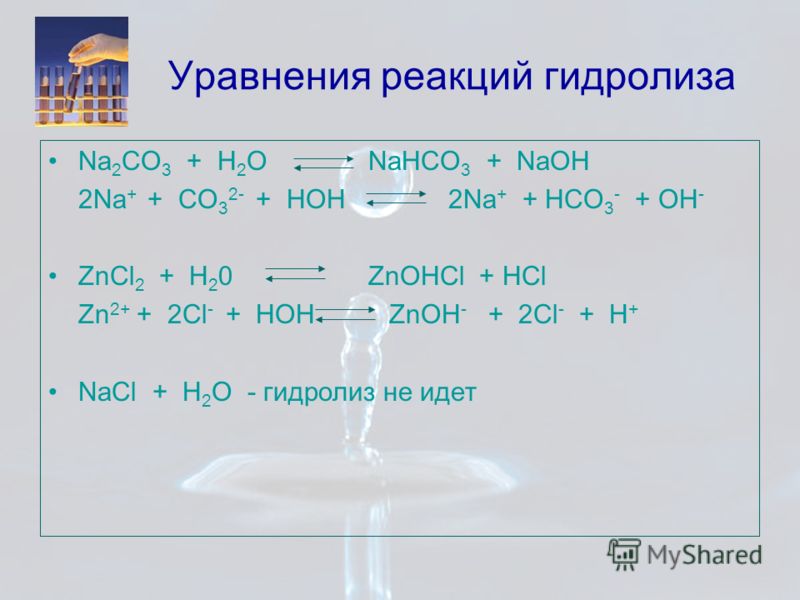
Карбонат натрия и сернистая кислота обозначаются Na2CO3 и Н2SO3 соответственно. Эти реакции неорганических соединений обсуждаются здесь, давайте посмотрим больше фактов об этой реакции.
H2SO3 представляет собой бесцветную жидкую кислоту с резким резким запахом. В то время как карбонат натрия также называют стиральной содой, это белая растворимая соль без запаха. Используется как очищающее средство в бытовых целях, также Na2CO3 устраняет жесткость воды.
В этой статье будет обсуждаться реакция между H2SO3 + На2CO3, тип реакции, буферный раствор, форма продукта, энтальпия реакции и многое другое.
Что является произведением H
2SO3 и Na2CO3?При взаимодействии сернистой кислоты с карбонатом натрия образуется углекислота и сульфит натрия. Реакция представлена следующим образом.
H2SO3 + На2CO3H2CO3 + На2SO3
Какой тип реакции Н
2SO3 + На2CO3?Эта реакция представляет собой реакцию двойного кислотно-щелочного замещения.
Как сбалансировать H
2SO3 + На2CO3?Неуравновешенная реакция это H2SO3 + На2CO3H2CO3 + На2SO3
Чтобы реакции были сбалансированными, количество атомов каждого элемента, присутствующего как на стороне реагента, так и на стороне продукта, должно быть одинаковым.
| Atom | Сторона реагента | Сторона продукта |
| водород | 2 | 2 |
| сера | 1 | 1 |
| кислород | 6 | 6 |
| Соль | 2 | 2 |
| углерод | 1 | 1 |
Все атомы реагента и продукта уже уравновешены. Следовательно, уравновешенная реакция
H2SO3 + На2CO3 H2CO3 + На2SO3
H
2SO3 + На2CO3 титрованиеH2SO3 + На2CO3 есть кислотно-основное титрование. Это титрование проводят следующим образом.
Это титрование проводят следующим образом.
Необходимые аппараты и химикаты
Бюретка на 50 мл, пипетка, коническая колба, мерная колба, химический стакан, воронка, дистиллированная вода, серная кислота, карбонат натрия.
Индикаторные
Титрование проводят с использованием в качестве индикатора метилового красного. Что дает точку равновесия между кислотой и основанием.
Процедура
- Стандарт H2SO3 и Na2CO3 растворы готовили с той же концентрацией.
- Затем 10 мл H2SO3 берут в коническую колбу и Na2CO3 раствор заливается в бюретку.
- Na2CO3 раствор добавляют по каплям в коническую колбу, содержащую H2SO3 индикатор метиловый красный.
- Титруйте до тех пор, пока цвет не изменится с оранжевого на светло-розовый.

- Когда кислота H2SO3 нейтрализуется основанием Na2CO3 это дает конечную точку, обозначенную изменением цвета.
- Окончательное чтение было отмечено и определено количество Na2O3 требуется для нейтрализации HCl с помощью M1V1 =M2V2 Формула.
H
2SO3 + На2CO3 чистое ионное уравнение- Компания чистое ионное уравнение из H2SO3 + На2CO3 как следует
- 2H+(aq) + ТАК32-(aq) + 2На+(aq) + СО32-(aq) = 2Н+(aq) + СО32-(aq) + 2На+(aq) + ТАК32-(aq)
- Чистое ионное уравнение включает вещества, участвующие в реакции.

H
2SO3 + На2CO3 сопряженные парыСопряженные пары H2SO3 + На2CO3 следующие.
- Сопряженное основание H2SO3 это HSO3–(бисульфитный анион).
- Сопряженная кислота CO32 — является ОХС3— так как Na2CO3 диссоциирует в воду в виде Na+ и СО32-
H
2SO3 + На2CO3 межмолекулярные силыМежмолекулярные силы H2SO3 + На2CO3 таковы
- H2SO3 показаны три межмолекулярные силы: Лондон – полюс дисперсии, диполь-дипольное взаимодействие и силы Ван-дер-Ваальса.
- Na2CO3 показывает ионную электростатическую силу.

H
2SO3 + На2CO3 энтальпия реакцииЭнтальпия реакции H2SO3 + На2CO3 is -2264.47 кДж/моль.
- Энтальпия образования H2SO3 составляет -655.5 кДж/моль.
- Энтальпия образования Na2CO3 составляет -1130.77 кДж/моль.
- Энтальпия образования H2CO3 составляет -612.10 кДж/моль.
- Энтальпия образования Na2SO3 составляет -1090.3 кДж/моль.
- Энтальпия реакции (-655.5) + (-1130.77) – (-612.10) + (-1090.3) = -2264.47 кДж/моль.
Н
2SO3 + На2CO3 буферный раствор?H2SO3 + На2CO3 является буферным раствором. Реакция включает как слабую кислоту, так и слабое основание, что делает ее буферной.
Н
2SO3 + На2CO3 полная реакция?H2SO3 + На2CO3 не является полной реакцией. ЧАС2SO3 является слабой кислотой, поэтому остается в реакции.
Н
2SO3 + На2CO3 экзотермическая или эндотермическая реакция?H2SO3+ На2CO3 является экзотермической реакцией. Энтальпия реакции отрицательна и энергия выделяется в виде тепла.
Н
2SO3 + На2CO3 окислительно-восстановительная реакция?H2SO3 + На2CO3 не окислительно-восстановительная реакция так как степень окисления атомов остается неизменной в ходе реакции.
Н
2SO3 + На2CO3 реакция осаждения?H2SO3 + На2CO3 является реакцией осаждения.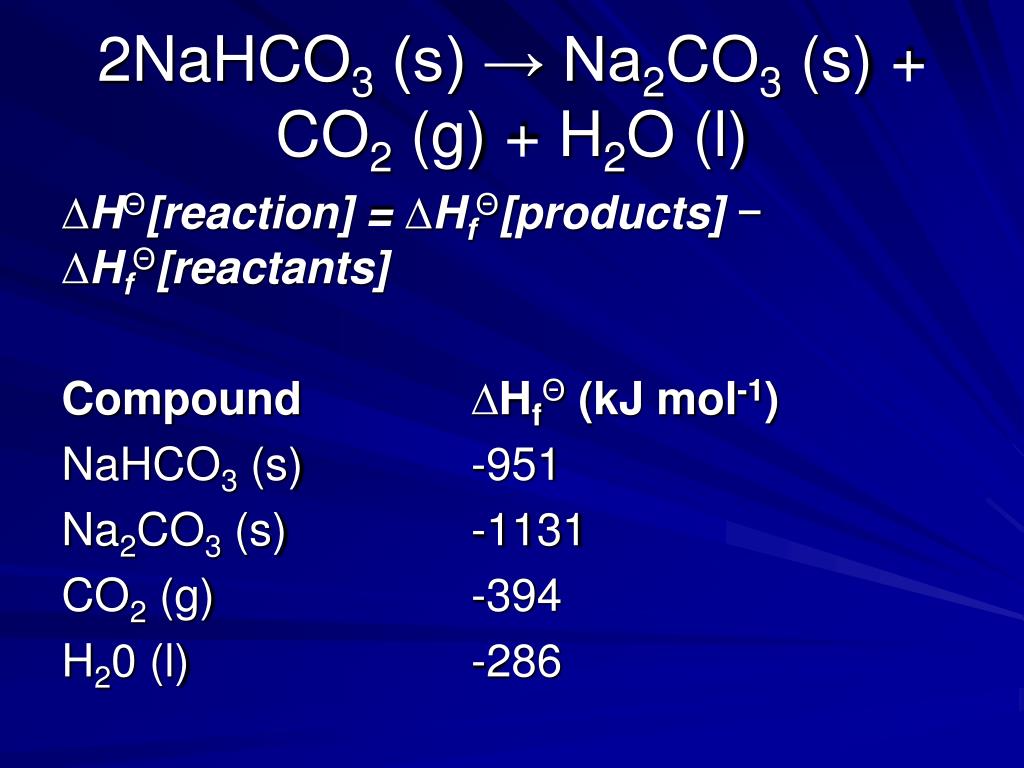 При этой реакции образуется белый кристаллический осадок натрия, сульфит, растворимый в воде.
При этой реакции образуется белый кристаллический осадок натрия, сульфит, растворимый в воде.
Н
2SO3 + На2CO3 обратимая или необратимая реакция?H2SO3 + На2CO3 является необратимым, потому что форма продукта не может вернуться обратно в реагент.
Н
2SO3 + На2CO3 реакция смещения?H2SO3 + На2CO3 является реакцией замещения, поскольку она включает обмен катионной и анионной частей молекулы.
Заключение
H2SO3 + На2CO3 представляет собой простую реакцию кислотно-щелочного замещения. В этой реакции H2CO3 и Na2SO3 соль — это продукт. Эта реакция включает диполь-дипольное взаимодействие или ион-дипольное взаимодействие. Это необратимая реакция.
Что, как сбалансировать и часто задаваемые вопросы —
Вишнуприя Тадури
Карбонат натрия представляет собой карбонатную соль и легко реагирует с H 2 SO 4.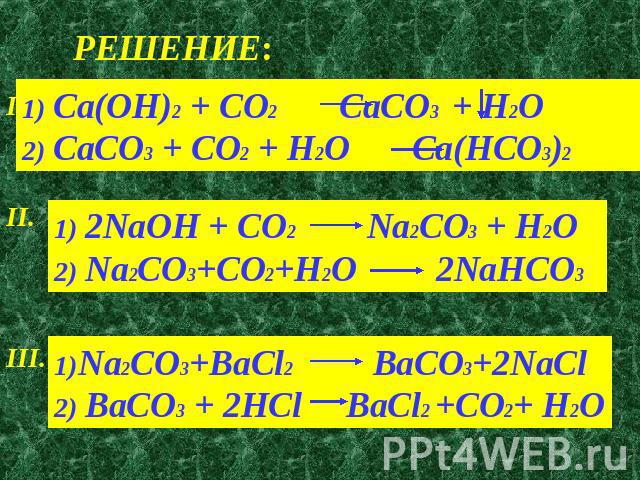 Сообщите нам больше о реакции между H 2 SO 4 и Na 2 CO 3.
Сообщите нам больше о реакции между H 2 SO 4 и Na 2 CO 3.
Na 2 CO 3 представляет собой карбонат основного металла белого цвета. Легко вступает в реакцию с H 2 SO 4, бесцветной сильной кислотой. Карбонат натрия представляет собой основание Лоури-Бренстеда, способное принимать H + из H 2 SO 4.
В этой статье мы обсудим некоторые факты о реакции H 2 SO 4 + Na 2 типа 60 CO реакция, сопряженные пары, метод уравновешивания и т. д.
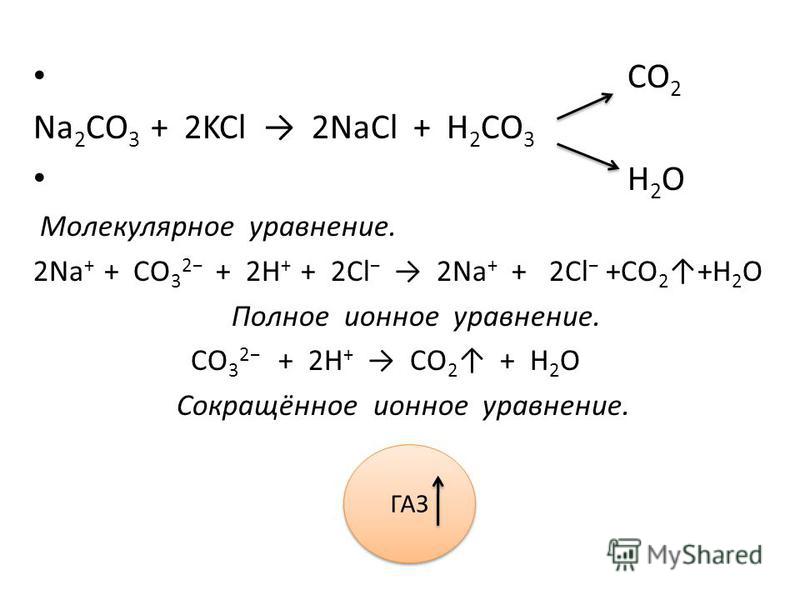
Что является продуктом H
2 SO 4 и Na 2 CO 3 ?Сульфат натрия, вода и пузырьки диоксида углерода получают при H 2 SO 4 добавляется к Na 2 CO 3 .
NA 2 CO 3 + H 2 Таким реакция H 2 SO 4 + Na 2 CO 3 ? Na 2 CO 3 + H 2 SO 4 является реакцией нейтрализации, наряду с двойной реакцией разложения. Уравнение балансируется с помощью следующих шагов. NA 2 CO 3 + H 2 SO 4 = NA 2 SO 4 + CO 2 + H 2 O 
Как сбалансировать H
2 SO 4 + Na 2 CO 3 ?
Number of elements on each side of the reaction Elements Reactant side Product side Na 2 2 C 1 1 S 1 1 O 7 7 H 2 2 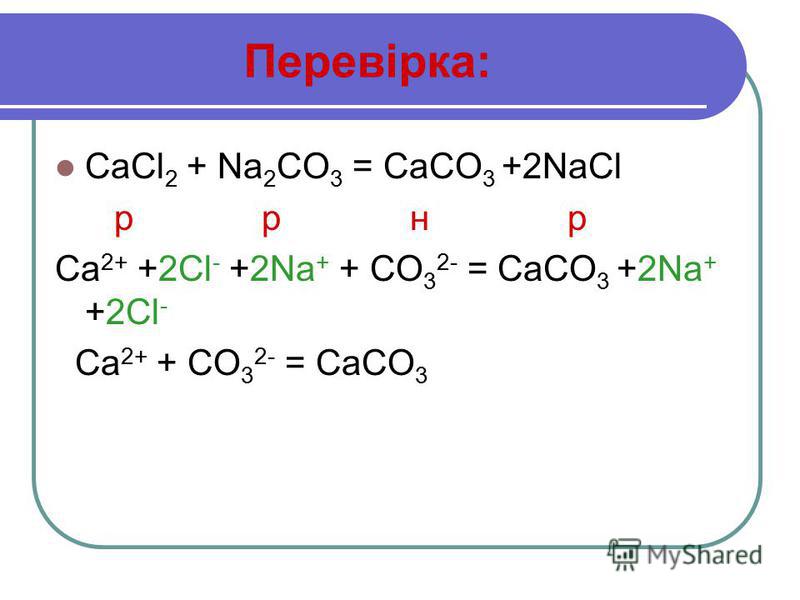 Следовательно, реакция является самоуравновешенной.
Следовательно, реакция является самоуравновешенной. H
2 SO 4 + NA 2 CO 3 Титт титрование слабым основанием. Для оценки нормальности H 2 SO 4, можно титровать Na 2 CO 3 и H 2 SO 4 , используя следующую процедуру.
Бюретка, штатив для бюретки, коническая колба, стеклянная воронка, пипетка на 10 мл и химический стакан.
ИндикаторВ качестве индикатора используется метиловый оранжевый .
Процедура- Пипеткой набрать 10 мл стандартизированного Na 2 CO 3 раствор и добавьте несколько капель индикатора.
- Наполните бюретку раствором H 2 SO 4 , нормальность которого должна быть известна.

- Медленно добавить H 2 SO 4 из бюретки в коническую колбу при постоянном перемешивании.
- Конечная точка – появление оранжево-красного цвета.
- Запишите показания бюретки и повторите процедуру для 3 одновременных измерений.
- Мы можем найти неизвестную нормальность H 2 SO 4 , используя формулу V 1 S 1 = V 2 S 2 .
H
2 SO 4 + NA 2 CO 3 Чистое ионное уравнение. Чистое ионное уравнение H 2 SO 4 + 199 2 CO 4 + 1919 2 3 40006 + 19 2 6 3 40006 + 19 2 3 3 3 + 19 2 3 40006. есть –
2H + (водн. ) + CO 3 2- (aq) = CO 2 (g) + H 2 O (L)
) + CO 3 2- (aq) = CO 2 (g) + H 2 O (L)
. :
- Напишите ионную форму каждого из веществ вместе с их состояниями. Полное ионное уравнение H 2 SO 4 + Na 2 CO 3 is –
- 2H + (водн.) + SO 4 2- (AQ) + 2NA + (AQ) + CO 3 2- (AQ) = 2NA + (AQ) + 2NA + (AQ) + + + (AQ) + так + . 2- (AQ) + CO 2 (G) + H 2 O (L)
- Отмените спектаторы (SO 4 2- , NA +, NA +, NA +, NA +, NA
2- , NA 4 2- , NA 4 2-, NA 4 2-, NA 4
- 2-
, NA 4- .
), которые появляются в обеих частях уравнения, чтобы получить результирующее ионное уравнение.
H
2 SO 4 + Na 2 CO 3 conjugate pairs- Conjugate base of the acid H 2 SO 4 = HSO 4 –
- Конъюгатная кислота основания NA 2 CO 3 = HCO 3 —
H
2 SO 4 + NA 2 CO 3 Intermolecular Firect- 3 . диполь-диполь, водородная связь и дисперсионная сила Ван-дер-Ваальса — межмолекулярные силы, существующие в H 2 СО 4 .
- Электростатическая сила притяжения существует в Na 2 CO 3 между металлическими ионами натрия и многоатомными ионами карбоната.
H
2 SO 4 + NA 2 CO 3 Энтальпия реакции H 2 SO 4 + NA 2 CO 3 ETRALPY ETRALPY IS — 2 CO 3 . кДж/моль, а знак минус означает, что в ходе этой реакции выделяется тепло.
кДж/моль, а знак минус означает, что в ходе этой реакции выделяется тепло.
Is H
2 SO 4 + Na 2 CO 3 буферный раствор?H 2 SO 4 + Na 2 CO 3 не является буферным раствором, так как реакционная смесь содержит H 2 SO 4 , который является сильной кислотой.
Является ли H
2 SO 4 + Na 2 CO 3 полной реакцией?H 2 SO 4 + Na 2 CO 3 является полной реакцией, так как водная серная кислота полностью нейтрализует карбонат натрия с образованием сульфата натрия.
Является ли H
2 SO 4 + Na 2 CO 3 экзотермической реакцией? H 2 SO 4 + Na 2 CO 3 является экзотермической реакцией, так как энтальпия реакции отрицательна.
Is H
2 SO 4 + Na 2 CO 3 окислительно-восстановительная реакция?H 2 SO 4 + Na 2 CO 3 не является окислительно-восстановительной реакцией, поскольку ни один элемент не окисляется и не восстанавливается.
Является ли H
2 SO 4 + Na 2 CO 3 реакцией осаждения?Реакция H 2 SO 4 + Na 2 CO 3 не является реакцией осаждения, так как образующийся продукт, сульфат натрия, полностью растворим в воде.
Is H
2 SO 4 + Na 2 CO 3 необратимая реакция? H 2 SO 4 + NA 2 CO 3 — необратимая реакция, потому что в равновесии реагенты полностью преобразуются в NA 2 SO 4 , вместе с выделение газа СО 2 .
Is H
2 SO 4 + Na 2 CO 3 реакция смещения?Реакция между H 2 SO 4 + Na 2 CO 3 является примером реакции двойного замещения , с последующей реакцией немедленного разложения нестабильной угольной кислоты (H 5 2 CO 0 0 3 ) в CO 2 и воду.
Двойная реакция смещения ВыводH 2 SO 4 + Na 2 CO 3 — типичная карбонатно-кислотная реакция, при которой термодинамически нестабильная угольная кислота разлагается на газообразный CO 2 и воду. Na 2 CO 3 используется в качестве смягчителя воды, а H 2 SO 4 широко используется в качестве промышленного агента.
Определить количество молей Na2CO3 в исходном 50,0 мл раствора
Химия
Хермон Т.
Студент фильтрует и сушит осадок CaCO 3 (молярная масса 100,1 г/моль) и записывает данные в таблицу ниже.
| Объем Na 2 CO 3 раствор | 50,0 мл |
| Объем 1,0 М Ca(NO 3 ) 2 добавлен | 100,0 мл |
| Масса CaCO 3 собранного осадка | 0,93 г |
Определить количество молей Na 2 CO 3 в исходных 50,0 мл раствора
Подписаться І 2
Подробнее
Отчет
1 ответ эксперта
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Дж. Р. С.
ответил 06.11.20
Р. С.
ответил 06.11.20
Репетитор
5,0 (140)
к.т.н. Профессор университета со стажем репетиторства более 10 лет
Об этом репетиторе ›
Об этом репетиторе ›
Прежде всего, нужно написать сбалансированное уравнение для происходящего:
Na 2 CO 3 (водн.) + Ca(NO 3 ) 2 (водн.) ==> CaCO 3 (тв.) + 2NaNO 3 (водн.) … сбалансированное уравнение
Моли Ca (№ 3 ) 2 Присутствует = 100,0 мл x 1 л/1000 мл x 1,0 моль/л = 0,100 моли Ca (№ 3 ) 2
Моли Caco 3 . 0,93 г x 1 моль/100,1 г = 0,00929 моль CaCO 3
Из сбалансированного уравнения видно, что Na 2 CO 3 и Ca(NO 3 ) 2 реагируют в мольном соотношении 1:1 с образованием CaCO 3 , который также находится в мольном соотношении 1:1. Используя тот факт, что 1 моль CaCO 3 происходит из 1 моля Na 2 CO 3 , мы можем определить количество молей Na 2 CO 3 , первоначально присутствующих следующим образом: x 1 моль Na 2 CO 3 / 1 моль CaCO 3 = 0,00929 моль Na 2 CO 3 первоначально присутствующий
Используя тот факт, что 1 моль CaCO 3 происходит из 1 моля Na 2 CO 3 , мы можем определить количество молей Na 2 CO 3 , первоначально присутствующих следующим образом: x 1 моль Na 2 CO 3 / 1 моль CaCO 3 = 0,00929 моль Na 2 CO 3 первоначально присутствующий
Примечание: тот факт, что это значение значительно меньше, чем количество добавленных молей Ca(NO 3 ) 2 , говорит нам о том, что Ca(NO 36 ) 2
не является лимитирующим реагентом.
Голосовать за 0 Понизить
Подробнее
Отчет
Все еще ищете помощи? Получите правильный ответ, быстро.
Задайте вопрос бесплатно
Получите бесплатный ответ на быстрый вопрос.

 05 EARTH AND RELATED ENVIRONMENTAL SCIENCES
05 EARTH AND RELATED ENVIRONMENTAL SCIENCES