Щёлочноземельные металлы | это… Что такое Щёлочноземельные металлы?
| Группа → | 2 | ||||||
|---|---|---|---|---|---|---|---|
| ↓ Период | |||||||
| 2 |
| ||||||
| 3 |
| ||||||
| 4 |
| ||||||
| 5 |
| ||||||
| 6 |
| ||||||
| 7 |
| ||||||
Щё́лочноземе́льные мета́ллы — химические элементы 2-й группы[1]периодической таблицы элементов: бериллий, магний, кальций, стронций, барий и радий[2][3]. Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают в воде щелочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов. Происхождение этого названия связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название «земли
Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают в воде щелочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов. Происхождение этого названия связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название «земли
Содержание
|
Физические свойства
Все щёлочноземельные металлы — серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций). Плотность щёлочноземельных металлов с порядковым номером растёт, хотя явно рост наблюдается только начиная с кальция, который имеет минимальную среди них плотность (ρ = 1,55 г/см³), самый тяжёлый — радий, плотность которого примерно равна плотности железа.
Химические свойства
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, так же и как щелочные металлы (и кальций), хранят под слоем керосина.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера: Be(OH)2 — амфотерный, нерастворимый в воде гидроксид, но растворим в кислотах (а также проявляет кислотные свойства в присутствии сильных щелочей), Mg(OH)2 — слабое основание, нерастворимое в воде, Ca(OH)2 — сильное, но малорастворимое в воде основание, Sr(OH)2 — лучше растворимо в воде, чем гидроксид кальция, сильное основание (щёлочь) при высоких температурах, близких к точке кипения воды (100 °C), Ba(OH)2 — сильное основание (щёлочь), по силе не уступающее KOH или NaOH, и Ra(OH)2 — одна из сильнейших щелочей, очень коррозионное вещество.
Нахождение в природе
Все щёлочноземельные металлы имеются (в разных количествах) в природе. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются. Самым распространённым щёлочноземельным металлом является кальций, количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры). Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10−4% от массы земной коры. Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в урановых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры)[4].
Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры). Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10−4% от массы земной коры. Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в урановых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры)[4].
См. также
Ссылки
- http://enc.mail.ru/article/74002900
Литература
- ↑ По новой классификации ИЮПАК. По устаревшей классификации, относятся к главной подгруппе 2-й группы периодической таблицы.
- ↑ Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005. — International Union of Pure and Applied Chemistry, 2005.
 — P. 51.
— P. 51. - ↑ Group 2 — Alkaline Earth Metals, Royal Society of Chemistry.
- ↑ Золотой фонд. Школьная энциклопедия. Химия. М.: Дрофа, 2003.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
Щёлочноземельные металлы | это.
 .. Что такое Щёлочноземельные металлы?
.. Что такое Щёлочноземельные металлы?| Группа → | 2 | ||||||
|---|---|---|---|---|---|---|---|
| ↓ Период | |||||||
| 2 |
| ||||||
| 3 |
| ||||||
| 4 |
| ||||||
| 5 |
| ||||||
| 6 |
| ||||||
| 7 |
| ||||||
Щё́лочноземе́льные мета́ллы — химические элементы 2-й группы[1]периодической таблицы элементов: бериллий, магний, кальций, стронций, барий и радий[2][3]. Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают в воде щелочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов. Происхождение этого названия связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название «земли
Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают в воде щелочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов. Происхождение этого названия связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название «земли
Содержание
|
Физические свойства
Все щёлочноземельные металлы — серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций). Плотность щёлочноземельных металлов с порядковым номером растёт, хотя явно рост наблюдается только начиная с кальция, который имеет минимальную среди них плотность (ρ = 1,55 г/см³), самый тяжёлый — радий, плотность которого примерно равна плотности железа.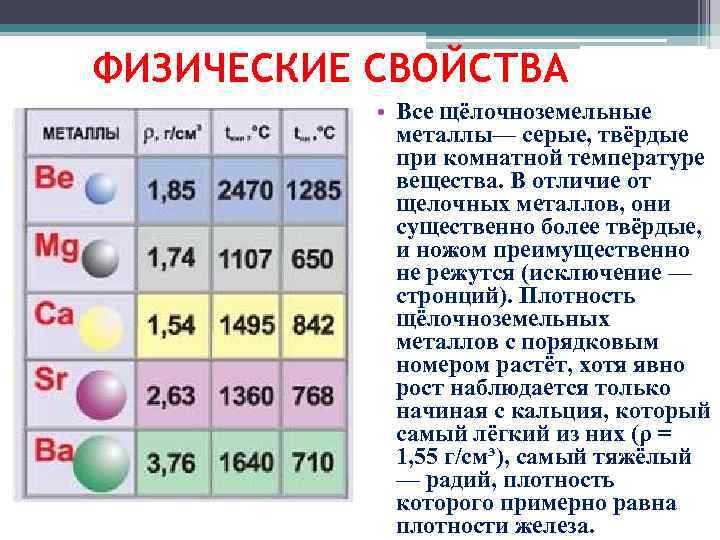
Химические свойства
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, так же и как щелочные металлы (и кальций), хранят под слоем керосина.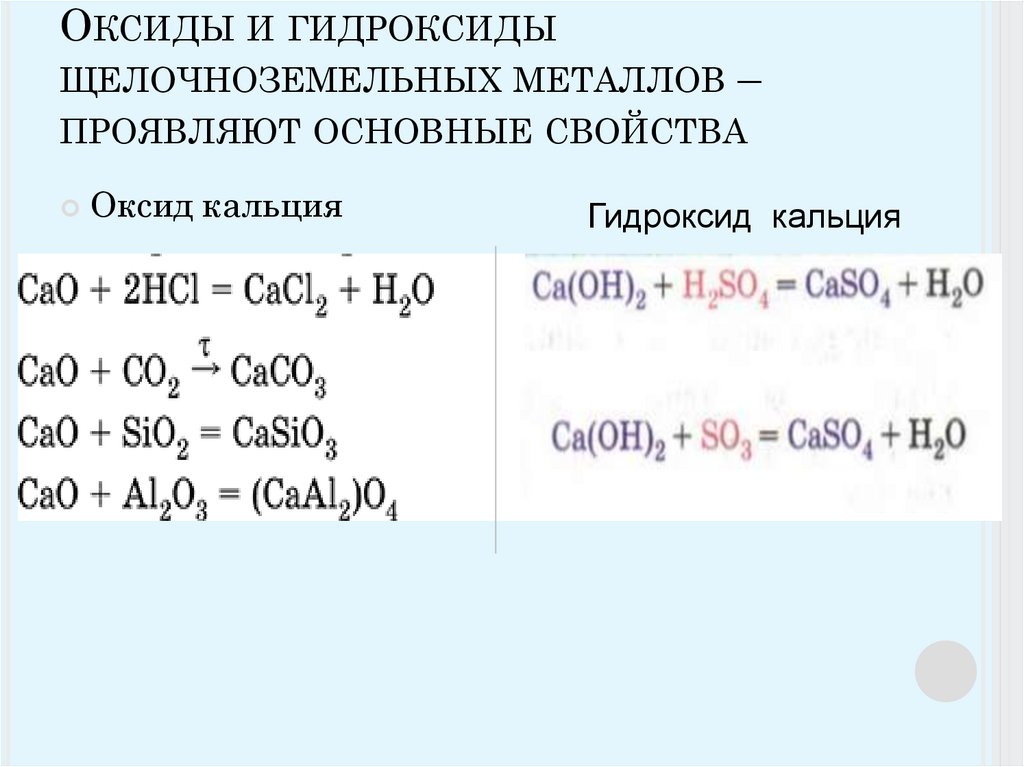
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера: Be(OH)2 — амфотерный, нерастворимый в воде гидроксид, но растворим в кислотах (а также проявляет кислотные свойства в присутствии сильных щелочей), Mg(OH)2 — слабое основание, нерастворимое в воде, Ca(OH)2 — сильное, но малорастворимое в воде основание, Sr(OH)2 — лучше растворимо в воде, чем гидроксид кальция, сильное основание (щёлочь) при высоких температурах, близких к точке кипения воды (100 °C), Ba(OH)2 — сильное основание (щёлочь), по силе не уступающее KOH или NaOH, и Ra(OH)2 — одна из сильнейших щелочей, очень коррозионное вещество.
Нахождение в природе
Все щёлочноземельные металлы имеются (в разных количествах) в природе. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются. Самым распространённым щёлочноземельным металлом является кальций, количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры). Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10−4% от массы земной коры. Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в урановых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры)[4].
Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры). Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10−4% от массы земной коры. Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в урановых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры)[4].
См. также
Ссылки
- http://enc.mail.ru/article/74002900
Литература
- ↑ По новой классификации ИЮПАК. По устаревшей классификации, относятся к главной подгруппе 2-й группы периодической таблицы.
- ↑ Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005. — International Union of Pure and Applied Chemistry, 2005.
 — P. 51.
— P. 51. - ↑ Group 2 — Alkaline Earth Metals, Royal Society of Chemistry.
- ↑ Золотой фонд. Школьная энциклопедия. Химия. М.: Дрофа, 2003.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 17 | 18 | ||||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
Щелочно-земельный металл | Свойства, список и реактивность
Таблица Менделеева
Просмотреть все СМИ
- Ключевые люди:
- Сэр Хамфри Дэви
- Похожие темы:
- кальций магний бериллий радий барий
См. все сопутствующие материалы →
все сопутствующие материалы →
щелочноземельный металл , любой из шести химических элементов, входящих в группу 2 (IIa) периодической таблицы. Элементами являются бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Происхождение, свойства и использование
До 19 века неметаллические вещества, нерастворимые в воде и не изменяющиеся при воздействии огня, назывались землями. Те земли, такие как известь (оксид кальция), которые напоминали щелочи (кальцинированную соду и поташ), были названы щелочными землями. Таким образом, щелочные земли отличались от щелочных и от других земель, таких как оксид алюминия и редкоземельные элементы. К началу 1800-х годов стало ясно, что земли, которые раньше считались элементами, на самом деле были оксидами, соединениями металла и кислорода. Металлы, оксиды которых составляют щелочноземельные металлы, впоследствии стали известны как щелочноземельные металлы и были отнесены к группе 2 (IIa) периодической таблицы с тех пор, как русский химик Дмитрий Менделеев предложил свою первую таблицу в 1869 году. .
.
Как и у щелочных металлов группы 1 (Ia), атомы щелочноземельных металлов легко теряют электроны, превращаясь в положительные ионы (катионы). Таким образом, большинство их типичных соединений являются ионными: соли, в которых металл встречается в виде катиона M 2+ , где M представляет собой любой атом группы 2. Соли бесцветны, если они не содержат окрашенный анион (отрицательный ион). Формулы типичных щелочноземельных соединений, таких как хлорид кальция (CaCl 2 ) и оксид кальция (CaO), можно противопоставить соответствующим соединениям щелочных металлов (которые содержат M 9ионы 0029 + ), хлорид натрия (NaCl) и монооксид натрия (Na 2 O).
Оксиды щелочноземельных металлов являются основными (т. е. щелочными, в отличие от кислых). Достаточно устойчивое усиление электроположительного характера наблюдается при переходе от бериллия, самого легкого члена группы, к радию, самому тяжелому. В результате этой тенденции оксид бериллия на самом деле является амфотерным, а не основным, тогда как оксид бария является сильно основным.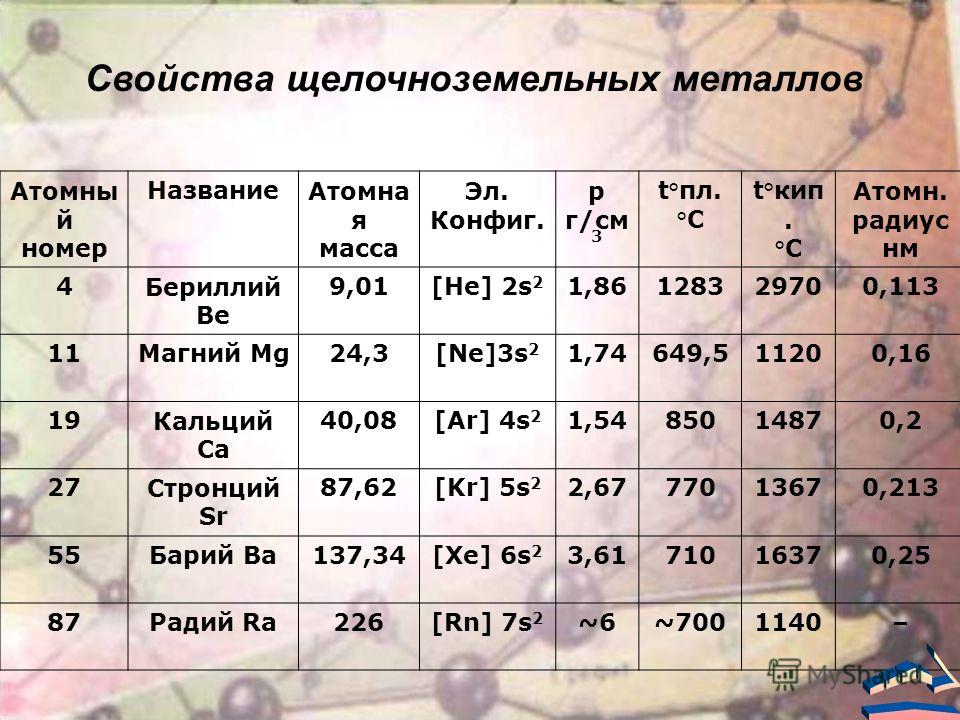 Сами металлы являются высокореактивными восстановителями; то есть они легко отдают электроны другим веществам, которые при этом восстанавливаются.
Сами металлы являются высокореактивными восстановителями; то есть они легко отдают электроны другим веществам, которые при этом восстанавливаются.
Викторина по Британике
Факты, которые вы должны знать: Викторина по периодической таблице
За исключением радия, все металлы и их соединения в той или иной степени находят коммерческое применение, особенно сплавы магния и различные соединения кальция. Магний и кальций, особенно последний, широко распространены в природе (они входят в число шести самых распространенных элементов на Земле) и играют значительную роль в геологических и биологических процессах. Радий — редкий элемент, и все его изотопы радиоактивны. Коммерческого производства этого металла никогда не было, и, хотя его соединения часто использовались в первой половине 20-го века для лечения рака, они в значительной степени были вытеснены менее дорогими альтернативами.
История
Самым ранним из известных щелочноземельных элементов была известь (лат. calx ), которая, как теперь известно, представляет собой оксид кальция; он использовался в древние времена в составе раствора. Магнезия (название, вероятно, происходит от Магнезии, района Фессалии в Греции), оксид магния, был показан шотландским химиком Джозефом Блэком в 1755 году как щелочная земля, отличная от извести; он заметил, что магнезия дает растворимый сульфат, тогда как известь, как известно, нерастворима. В 1774 году Карл Вильгельм Шееле, шведский химик, открывший кислород, обнаружил, что минерал, называемый тяжелым шпатом или барыс (греч. «тяжелый») содержал новую землю, которая стала известна как барит (окись бария). Еще одна земля, стронций (оксид стронция), была идентифицирована лондонскими химиками Уильямом Круикшенком и Адэром Кроуфордом в 1789 году при исследовании минерала (карбоната стронция), найденного в свинцовом руднике в Стронтиане в Аргайлшире, Шотландия. Бериллий (оксид бериллия) был извлечен из минерала берилла и признан землей французским химиком-аналитиком Николя-Луи Вокленом в 1798 году.
calx ), которая, как теперь известно, представляет собой оксид кальция; он использовался в древние времена в составе раствора. Магнезия (название, вероятно, происходит от Магнезии, района Фессалии в Греции), оксид магния, был показан шотландским химиком Джозефом Блэком в 1755 году как щелочная земля, отличная от извести; он заметил, что магнезия дает растворимый сульфат, тогда как известь, как известно, нерастворима. В 1774 году Карл Вильгельм Шееле, шведский химик, открывший кислород, обнаружил, что минерал, называемый тяжелым шпатом или барыс (греч. «тяжелый») содержал новую землю, которая стала известна как барит (окись бария). Еще одна земля, стронций (оксид стронция), была идентифицирована лондонскими химиками Уильямом Круикшенком и Адэром Кроуфордом в 1789 году при исследовании минерала (карбоната стронция), найденного в свинцовом руднике в Стронтиане в Аргайлшире, Шотландия. Бериллий (оксид бериллия) был извлечен из минерала берилла и признан землей французским химиком-аналитиком Николя-Луи Вокленом в 1798 году. ; в отличие от глинозема он переосаждается при кипячении щелочного раствора в течение некоторого времени. Первоначально Бериллия называлась 9.0049 glucina (греч. glykys , «сладкий») из-за сладкого вкуса. (Этот этимологический корень сохранился во Франции, где элемент бериллий также известен как глюциний.)
; в отличие от глинозема он переосаждается при кипячении щелочного раствора в течение некоторого времени. Первоначально Бериллия называлась 9.0049 glucina (греч. glykys , «сладкий») из-за сладкого вкуса. (Этот этимологический корень сохранился во Франции, где элемент бериллий также известен как глюциний.)
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Магний, кальций, стронций и барий — элементы, полученные из щелочноземельных металлов — были выделены в виде нечистых металлов английским химиком сэром Хамфри Дэви в 1808 году с помощью электролитического метода, который он ранее использовал для выделения щелочных металлов калия и натрия. . Позднее щелочноземельные металлы были получены восстановлением их солей свободными щелочными металлами, и именно таким путем (действием калия на хлорид бериллия) бериллий был впервые выделен немецким химиком Фридрихом Вёлером и французским химиком Антуаном Бюсси. независимо в 1828 г. Радий был открыт в 189 г.8 с помощью его радиоактивности французскими физиками Пьером и Марией Кюри, которые к 1902 году выделили его в виде хлорида радия из настурана. Металлический радий был выделен в 1910 году благодаря совместной работе Марии Кюри и французского химика Андре-Луи Дебьерна.
Радий был открыт в 189 г.8 с помощью его радиоактивности французскими физиками Пьером и Марией Кюри, которые к 1902 году выделили его в виде хлорида радия из настурана. Металлический радий был выделен в 1910 году благодаря совместной работе Марии Кюри и французского химика Андре-Луи Дебьерна.
Металл щелочноземельный | Свойства, список и реактивность
Таблица Менделеева
Просмотреть все СМИ
- Ключевые люди:
- Сэр Хамфри Дэви
- Похожие темы:
- кальций магний бериллий радий барий
См. все сопутствующие материалы →
щелочноземельный металл , любой из шести химических элементов, входящих в группу 2 (IIa) периодической таблицы. Элементами являются бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Возникновение, свойства и использование
До XIX века неметаллические вещества, нерастворимые в воде и не изменяющиеся при воздействии огня, назывались землями. Те земли, такие как известь (оксид кальция), которые напоминали щелочи (кальцинированную соду и поташ), были названы щелочными землями. Таким образом, щелочные земли отличались от щелочных и от других земель, таких как оксид алюминия и редкоземельные элементы. К началу 1800-х годов стало ясно, что земли, которые раньше считались элементами, на самом деле были оксидами, соединениями металла и кислорода. Металлы, оксиды которых составляют щелочноземельные металлы, впоследствии стали известны как щелочноземельные металлы и были отнесены к группе 2 (IIa) периодической таблицы с тех пор, как русский химик Дмитрий Менделеев предложил свою первую таблицу в 1869 году..
Те земли, такие как известь (оксид кальция), которые напоминали щелочи (кальцинированную соду и поташ), были названы щелочными землями. Таким образом, щелочные земли отличались от щелочных и от других земель, таких как оксид алюминия и редкоземельные элементы. К началу 1800-х годов стало ясно, что земли, которые раньше считались элементами, на самом деле были оксидами, соединениями металла и кислорода. Металлы, оксиды которых составляют щелочноземельные металлы, впоследствии стали известны как щелочноземельные металлы и были отнесены к группе 2 (IIa) периодической таблицы с тех пор, как русский химик Дмитрий Менделеев предложил свою первую таблицу в 1869 году..
Как и у щелочных металлов группы 1 (Ia), атомы щелочноземельных металлов легко теряют электроны, превращаясь в положительные ионы (катионы). Таким образом, большинство их типичных соединений являются ионными: соли, в которых металл встречается в виде катиона M 2+ , где M представляет собой любой атом группы 2. Соли бесцветны, если они не содержат окрашенный анион (отрицательный ион). Формулы типичных щелочноземельных соединений, таких как хлорид кальция (CaCl 2 ) и оксид кальция (CaO), можно противопоставить соответствующим соединениям щелочных металлов (которые содержат M 9ионы 0029 + ), хлорид натрия (NaCl) и монооксид натрия (Na 2 O).
Соли бесцветны, если они не содержат окрашенный анион (отрицательный ион). Формулы типичных щелочноземельных соединений, таких как хлорид кальция (CaCl 2 ) и оксид кальция (CaO), можно противопоставить соответствующим соединениям щелочных металлов (которые содержат M 9ионы 0029 + ), хлорид натрия (NaCl) и монооксид натрия (Na 2 O).
Оксиды щелочноземельных металлов являются основными (т. е. щелочными, в отличие от кислых). Достаточно устойчивое усиление электроположительного характера наблюдается при переходе от бериллия, самого легкого члена группы, к радию, самому тяжелому. В результате этой тенденции оксид бериллия на самом деле является амфотерным, а не основным, тогда как оксид бария является сильно основным. Сами металлы являются высокореактивными восстановителями; то есть они легко отдают электроны другим веществам, которые при этом восстанавливаются.
Викторина по Британике
Факты, которые вы должны знать: Викторина по периодической таблице
За исключением радия, все металлы и их соединения в той или иной степени находят коммерческое применение, особенно сплавы магния и различные соединения кальция. Магний и кальций, особенно последний, широко распространены в природе (они входят в число шести самых распространенных элементов на Земле) и играют значительную роль в геологических и биологических процессах. Радий — редкий элемент, и все его изотопы радиоактивны. Коммерческого производства этого металла никогда не было, и, хотя его соединения часто использовались в первой половине 20-го века для лечения рака, они в значительной степени были вытеснены менее дорогими альтернативами.
Магний и кальций, особенно последний, широко распространены в природе (они входят в число шести самых распространенных элементов на Земле) и играют значительную роль в геологических и биологических процессах. Радий — редкий элемент, и все его изотопы радиоактивны. Коммерческого производства этого металла никогда не было, и, хотя его соединения часто использовались в первой половине 20-го века для лечения рака, они в значительной степени были вытеснены менее дорогими альтернативами.
История
Самым ранним из известных щелочноземельных элементов была известь (лат. calx ), которая, как теперь известно, представляет собой оксид кальция; он использовался в древние времена в составе раствора. Магнезия (название, вероятно, происходит от Магнезии, района Фессалии в Греции), оксид магния, был показан шотландским химиком Джозефом Блэком в 1755 году как щелочная земля, отличная от извести; он заметил, что магнезия дает растворимый сульфат, тогда как известь, как известно, нерастворима. В 1774 году Карл Вильгельм Шееле, шведский химик, открывший кислород, обнаружил, что минерал, называемый тяжелым шпатом или барыс (греч. «тяжелый») содержал новую землю, которая стала известна как барит (окись бария). Еще одна земля, стронций (оксид стронция), была идентифицирована лондонскими химиками Уильямом Круикшенком и Адэром Кроуфордом в 1789 году при исследовании минерала (карбоната стронция), найденного в свинцовом руднике в Стронтиане в Аргайлшире, Шотландия. Бериллий (оксид бериллия) был извлечен из минерала берилла и признан землей французским химиком-аналитиком Николя-Луи Вокленом в 1798 году. ; в отличие от глинозема он переосаждается при кипячении щелочного раствора в течение некоторого времени. Первоначально Бериллия называлась 9.0049 glucina (греч. glykys , «сладкий») из-за сладкого вкуса. (Этот этимологический корень сохранился во Франции, где элемент бериллий также известен как глюциний.)
В 1774 году Карл Вильгельм Шееле, шведский химик, открывший кислород, обнаружил, что минерал, называемый тяжелым шпатом или барыс (греч. «тяжелый») содержал новую землю, которая стала известна как барит (окись бария). Еще одна земля, стронций (оксид стронция), была идентифицирована лондонскими химиками Уильямом Круикшенком и Адэром Кроуфордом в 1789 году при исследовании минерала (карбоната стронция), найденного в свинцовом руднике в Стронтиане в Аргайлшире, Шотландия. Бериллий (оксид бериллия) был извлечен из минерала берилла и признан землей французским химиком-аналитиком Николя-Луи Вокленом в 1798 году. ; в отличие от глинозема он переосаждается при кипячении щелочного раствора в течение некоторого времени. Первоначально Бериллия называлась 9.0049 glucina (греч. glykys , «сладкий») из-за сладкого вкуса. (Этот этимологический корень сохранился во Франции, где элемент бериллий также известен как глюциний.)
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
