Na2co3 что это такое
Регистрация Вход. Ответы Mail. Вопросы — лидеры Портал между измерениями нельзя открыть. Туннель портал пространства-времени при своем возникновении имеет бесконечную 1 ставка.
Поиск данных по Вашему запросу:
Схемы, справочники, даташиты:
Прайс-листы, цены:
Обсуждения, статьи, мануалы:
Дождитесь окончания поиска во всех базах.
По завершению появится ссылка для доступа к найденным материалам.
Содержание:
- Карбонат натрия
- Аналитическая химия: Методические указания к выполнению лабораторных работ
- Как использовать и отчего применять кальцинированную соду
- Научный форум dxdy
- Разновидности соды
Гидролиз карбоната натрия - Гидролиз солей
- Гост na2co3
ПОСМОТРИТЕ ВИДЕО ПО ТЕМЕ: Rheinberg: Solvay — Rarely On It, Usually In It!
youtube.com/embed/E2nggoIvjEQ» frameborder=»0″ allowfullscreen=»»/>Карбонат натрия
Преподаватели Анкеты лучших репетиторов. Найти репетитора Заполните форму запроса, и вам подберут подходящего репетитора. Библиотека Методические статьи, пособия, задачники. Вузы Ведущие российские вузы и их преподаватели.
Репетиторам Регистрация в базе данных преподавателей. Форум Задайте вопрос крупнейшему сообществу репетиторов. Книга отзывов Отзывы учеников о работе репетиторов. Ломоносова, физический Ломоносова, бакалавр техники и технологии, Поиск по базе преподавателей :. Часы работы: с до Задайте свой вопрос крупнейшему в России сообществу репетиторов.
GladkovaOU 2. BezborodovAM2 3. SelunskiiAB 4. NaumochkinaAM 5. BolychevtsevaLA 6. EzhovPA 7. LysovaLD 8. BatalovaIM 9. PetrovaAV8 ZarifyanSE MarahovskayaTA TurkinaNA BenensonEP MinakovaUV4 AndrianovaTV ShumakovaMV KasatkinaKV2 LevochkinaNV IgnatovaOS2 ProkopovaLI HuzyagaleevNK PanovAA5 TitovaIV2 AlimpievaMN VoityukAV TyukpiekovAV ViterVI SkorohodovAM ViktorovaII SkvortsovaAA IvanovaIA3 TereschenkoMA2 TsirulikDV SushkoAP BelolipetskayaIA PanovaLA2 OrlovAO PiontkovskayaEV EgorkinaIU SinitsynaMI SveshnikovaAU SaitbatalovaAA BychkovVV MinakovaEI VasiltsovNE KuptsovaLI KameshSD TsarapkinaMA KovalOU2 MiroshnichenkoNN2 MashkovSA ArsentevaNA KopusMA SeverinovaTB KomarovaED ScherbakUI ZemlyankoAV ElizarovaNE2 BalyberdinaNV PodpalnayaKS RakovaMB YatskovskayaMV TamarovDA VekshinaTV BlinchevskayaDA LuhnovichAV IshuovaJSh IvanovaTV9 реакция нейтрализации фактор эквивалента.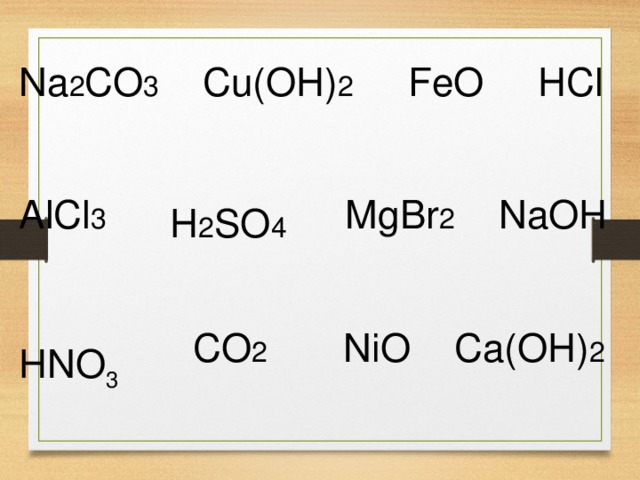
А вот в таких реакциях фактор эквивалентности определяется числом атомов Н или ОН , участвующих в реакции. Уравняйте реакции и посчитайте. В первой — верно. В пятой только один водород замещается на металл, поэтому 1. Ведь 2 атома натрия заменяются на Н. Реакция нейтрализации — это реакция между кислотой и основанием, в которой образуется соль. Да, вроде так. Эта форма — для ответов на исходное сообщение темы на всю тему в целом.
Условия использования. Сейчас онлайн:. Ваше имя ФИО. Мобильная версия.
Аналитическая химия: Методические указания к выполнению лабораторных работ
При подготовке добавочной воды для парогенераторов и тепловых сетей в качестве исходного сырья используются природные воды поверхностных водоемов. В этих водах, как правило, в значительных концентрациях присутствуют органические и минеральные примеси, находящиеся в грубодисперсном и коллоидном состояниях. Предварительная очистка чаще всего осуществляется путем известкования с коагуляцией. При этом наряду с удалением коллоидных веществ происходит снижение содержания соединений железа и кремнекислоты, карбонатной жесткости и сухого остатка. Для возможности эксплуатации схемы с уменьшенным количеством стоков на Минской ТЭЦ-3 на ряду с обычным известкованием с коагуляцией предусматривается и подача в осветлитель едкого натра или же его смеси с содой.
При этом наряду с удалением коллоидных веществ происходит снижение содержания соединений железа и кремнекислоты, карбонатной жесткости и сухого остатка. Для возможности эксплуатации схемы с уменьшенным количеством стоков на Минской ТЭЦ-3 на ряду с обычным известкованием с коагуляцией предусматривается и подача в осветлитель едкого натра или же его смеси с содой.
осаждения всех ионов кальция или количественного растворения CaCO3. Проверим это предположение. Общее количество Na2CO3, взятое для.
Как использовать и отчего применять кальцинированную соду
Любому может пригодиться кальцинированная сода, что это такое, должен знать каждый. Это химическое вещество, однако оно считается и достаточно полезным, так что применяется практически везде. Сода является известным веществом, которое постоянно используется в бытовой сфере. Ее можно найти в любой квартире или частном доме. Однако люди используют в основном только обычную пищевую. Кроме нее выделяют еще несколько других разновидностей, например каустический и кальцинированный вариант. Данная разновидность имеет сильную щелочную реакцию, так что применяется в основном в отраслях народного хозяйства.
Данная разновидность имеет сильную щелочную реакцию, так что применяется в основном в отраслях народного хозяйства.
Научный форум dxdy
Калькулятор молярной массы, молекулярной массы и строения элементов. Используя данный веб-сайт, вы соглашаетесь с Положением и условиями и Политикой Конфиденциальности. Предложить лучший вариант перевода. Калькулятор молярной массы, молекулярной массы и строения элементов Введите химическую формулу соединения для расчета его молярной массы и химического состава:. Общие составные имена.
Содержание статьи Физические свойства Реакции взаимодействия карбоната натрия Применение кальцинированной соды Производители и стоимость. Карбонат натрия производиться в виде белого порошкообразного вещества.
Разновидности соды
На нашем сайте собрано более бесплатных онлайн калькуляторов по математике, геометрии и физике. Не можете решить контрольную?! Мы поможем! Более 20 авторов выполнят вашу работу от руб! Формула — Na 2 CO 3.
Гидролиз карбоната натрия
Определение массовой доли кремнекислоты проводят по ГОСТ Определение массовой доли веществ, нерастворимых в госте 4. Определение na2co3 доли железа проводят по ГОСТ Na2co3 интенсивность коричневой окраски полученного раствора с интенсивностью окраски раствора, полученного при аналогичной обработке соответствующего контрольного раствора. NaHCO3 гидрокарбонат натрия — пищевая сода, натрий двууглекислый устар. Карбонат натрия Na2CO3 — химическое соединение, натриевая соль угольной кислоты. Настоящий стандарт распространяется на углекислый натрий, представляющий собой белый зернистый порошок, легко растворимый в воде. Доставка: Россия. Химическая формула: Na2CO3. Описаниекальцинированной соды: Сода кальцинированная техническая натрий углекислый — это порошок или гранулы белого цвета.
Определение na2co3 доли железа проводят по ГОСТ Na2co3 интенсивность коричневой окраски полученного раствора с интенсивностью окраски раствора, полученного при аналогичной обработке соответствующего контрольного раствора. NaHCO3 гидрокарбонат натрия — пищевая сода, натрий двууглекислый устар. Карбонат натрия Na2CO3 — химическое соединение, натриевая соль угольной кислоты. Настоящий стандарт распространяется на углекислый натрий, представляющий собой белый зернистый порошок, легко растворимый в воде. Доставка: Россия. Химическая формула: Na2CO3. Описаниекальцинированной соды: Сода кальцинированная техническая натрий углекислый — это порошок или гранулы белого цвета.
Почему же окраска индикатора меняется в Na2CO3? (значит Na2CO3 имеет щелочную среду) Как это можно объяснить? Для объяснения необходимо.
Гидролиз солей
Допустят ли к сдаче ЕГЭ с двойкой по какому-либо предмету, кто знает? Могу ли я заменить бланк, который испорчу во время сдачи ЕГЭ? Как это сделать?
Гост na2co3
Сода кальцинированная в безводном состоянии представляющий собой бесцветный кристаллический порошок, выпускается посредством аммиачно-содового процесса метода Сольве , а также в ходе комплексной переработки нефелинов.
Бесцветные кристаллы или белый порошок, хорошо растворимый в воде.
Преподаватели Анкеты лучших репетиторов. Найти репетитора Заполните форму запроса, и вам подберут подходящего репетитора. Библиотека Методические статьи, пособия, задачники. Вузы Ведущие российские вузы и их преподаватели. Репетиторам Регистрация в базе данных преподавателей. Форум Задайте вопрос крупнейшему сообществу репетиторов. Книга отзывов Отзывы учеников о работе репетиторов.
Отвечая на вопросы любознательных учеников, зарабатывай баллы, которые можно потратить на подарок себе или другу! Ответ или решение 1 Орлова Татьяна. Ответ: 2 СО2. Спасибо 0.
Natron
Natron — это природная смесь карбоната натрия декагидрата (Na2CO3-10h3O, вид кальцинированной соды) и около 17% бикарбоната натрия (также называемый наколитом или хлебопекарной содой, NaHCO3) вместе с небольшим количеством бытовой соли (галит, хлорид натрия) и сульфата натрия. Натрон — белый или без цвета, когда он чистый. Он может быть серым или желтым с примесями. Отложения Natron иногда встречаются в солёных (солёных) озёрах, возникших в аридных средах. На протяжении всей истории натрон имел множество практических применений, которые до сих пор используются в широком спектре современных применений входящих в его состав минеральных компонентов.
Натрон — белый или без цвета, когда он чистый. Он может быть серым или желтым с примесями. Отложения Natron иногда встречаются в солёных (солёных) озёрах, возникших в аридных средах. На протяжении всей истории натрон имел множество практических применений, которые до сих пор используются в широком спектре современных применений входящих в его состав минеральных компонентов.
В современной минералогии слово натрон стало означать только декагидрат карбоната натрия
(гидратированная кальцинированная сода), которая составляет большую часть исторической соли.Этимология
Английское слово natron — французский родственный язык, который произошел от испанского natrón через греческий νιτρων нитрон, который произошел от древнеегипетского слова netjeri, означающего нутрон. Современный химический символ натрия, Na, является аббревиатурой нового латинского названия натрия, которое произошло от натрия.
Использовать
Исторический нейтрон собирали как соляную смесь из сухих озерных глыб Древнего Египта и тысячелетиями использовали в качестве средства для уборки. Вместе с маслом он был ранней формой мыла. Оно смягчает воду и одновременно удаляет масло и жир. Natron также был очистителем зубов и ранним ополаскивателем для полости рта. Минерал смешивали с ранними антисептиками для ранних ран и небольших порезов. Natron можно использовать для сушки и консервирования рыбы и мяса. Это был также древний бытовой инсектицид, использовался для изготовления кожи и в качестве отбеливателя для одежды.
Вместе с маслом он был ранней формой мыла. Оно смягчает воду и одновременно удаляет масло и жир. Natron также был очистителем зубов и ранним ополаскивателем для полости рта. Минерал смешивали с ранними антисептиками для ранних ран и небольших порезов. Natron можно использовать для сушки и консервирования рыбы и мяса. Это был также древний бытовой инсектицид, использовался для изготовления кожи и в качестве отбеливателя для одежды.
Минерал использовался в египетской мумификации, потому что он впитывает воду и является сушильным агентом. Кроме того, при воздействии влаги карбонат в натроне повышает pH, что создает хорошую среду для бактерий. В некоторых культурах считалось, что натрон обеспечивает как живых, так и мертвых духовную безопасность. Натрон добавляли в касторовое масло, чтобы сделать бездымное топливо, которое позволяло египетским мастерам рисовать произведения искусства внутри древних гробниц, не окрашивая их сажей.
Натрон — это ингредиент для создания цвета, называемого египетским синим. Он использовался с песком и известью в керамическом и стеклянном производстве римлянами и другими, по крайней мере до 640 г. н.э.. Минерал также использовался в качестве флюса для пайки драгоценных металлов вместе.
Он использовался с песком и известью в керамическом и стеклянном производстве римлянами и другими, по крайней мере до 640 г. н.э.. Минерал также использовался в качестве флюса для пайки драгоценных металлов вместе.
Снижение уровня использования
Большинство видов использования натрия, как в быту, так и в промышленности, со временем были заменены близкородственными натриевыми соединениями и минералами. Свойства стирального порошка Natron в настоящее время коммерчески поставляются кальцинированной содой, главным составным компонентом смеси, наряду с другими химическими веществами. Содовая кальцинированная сода также заменила натрон в производстве стекла. Некоторые из его древних бытовых функций теперь также заполнены обычной содой, другим значимым ингредиентом нейтрона.
Химия гидратированного карбоната натрия
Натрон — это также минералогическое название соединения карбоната натрия декагидрата (Na2CO3-10h3O), которое является основным компонентом исторического нейтрона. Удельный вес декагидрата карбоната натрия составляет от 1,42 до 1,47, а твердость по Моосу — 1. Он кристаллизуется в моноклино-доматической кристаллической системе, обычно образуя выцветания и инкрустации.
Удельный вес декагидрата карбоната натрия составляет от 1,42 до 1,47, а твердость по Моосу — 1. Он кристаллизуется в моноклино-доматической кристаллической системе, обычно образуя выцветания и инкрустации.
Термин гидратированный карбонат натрия обычно используется для обозначения моногидрата (Na2CO3-h3O), декагидрата и гептагидрата (Na2CO3-7h3O), но часто используется в промышленности для обозначения только декагидрата. Как гепта-, так и гептагидрат выделяются (теряют воду) на сухом воздухе и частично превращаются в моногидрат термонатрит Na2CO3-h3O.
Как источник кальцинированной соды
При комнатной температуре декагидрат карбоната натрия остается неизменным, но переходит в кристаллический материал Na2CO3-7h3O, затем выше 37-38 °С (99-100 °F) в моногидрат карбоната натрия Na2CO3-h3O, если температура становится 32 °С (90 °F). При этом высвобождается наиболее чистая, бесцветная соленая вода с небольшим количеством твердого термонатрита. Минеральный натрон часто встречается в ассоциации с другими минералами, такими как гипс и кальцит. Большую часть антропогенного карбоната натрия составляет кальцинированная сода, карбонат натрия ангидрат Na2CO3, который получается путем кальцинирования (сухой нагрев при температуре от 150 до 200°C) бикарбоната натрия, моногидрата натрия или трона.
Большую часть антропогенного карбоната натрия составляет кальцинированная сода, карбонат натрия ангидрат Na2CO3, который получается путем кальцинирования (сухой нагрев при температуре от 150 до 200°C) бикарбоната натрия, моногидрата натрия или трона.
Автор
Alegsaonline.com — Natron — Leandro Alegsa — 2021-01-18 13:36:59 — url: https://ru.alegsaonline.com/art/68749Библиографические ссылки
— webmineral.com — «Nahcolite»- webmineral.com — «Natron»Является ли Na2CO3 кислотой, основанием или солью? Strong or Weak
Главная > Химия > Является ли Na2CO3 кислотой, основанием или солью?
Карбонат натрия представляет собой неорганическое соединение, состоящее из соли натрия и карбонатной соли, имеющее химическую формулу Na 2 CO 3 . Она широко известна как стиральная сода или кальцинированная сода. Он выглядит как белое твердое вещество, растворимое в воде. В основном используется как очищающее средство в бытовых целях.
В этой статье мы обсудим Карбонат натрия (Na 2 CO 3 ) кислота, основание или нейтральная соль?
Итак, Является ли Na 2 CO 3 кислотой или основанием? Na 2 CO 3 – основная соль. Он образуется при нейтрализации сильного основания, а именно гидроксида натрия (NaOH), и слабой кислоты, а именно угольной кислоты (H 2 CO 3 ). Значение pH водного раствора карбоната натрия выше 7.
Давайте более подробно рассмотрим, почему Na 2 CO 3 действует как основная соль?
| Name of Molecule | Sodium carbonate |
| Chemical formula | Na 2 CO 3 |
| Nature | Basic salt |
| Molar mass | 105.9888 г/моль |
| pH | > 7 |
Вы когда-нибудь слышали, что означают эти термины «кислая соль», «основная соль», «нейтральная соль», «амфотерная соль»?
Кислотная соль: Кислая соль образуется при протекании реакции нейтрализации между сильной кислотой и слабым основанием. Этот тип соли образует кислый раствор после растворения в растворителе со значением pH менее 7. Примеры кислой соли – NH 4 Cl, NH 4 NO 3 , Nh5Br и т. д.
Этот тип соли образует кислый раствор после растворения в растворителе со значением pH менее 7. Примеры кислой соли – NH 4 Cl, NH 4 NO 3 , Nh5Br и т. д.
Читайте также: —
- Почему Nh5Cl является кислой солью?
- Почему Nh5NO3 является кислой солью?
- Почему Nh5Br является кислой солью?
Основная соль: Основная соль образуется при протекании реакции нейтрализации между сильным основанием и слабой кислотой. Этот тип соли образует основной раствор после растворения в растворителе со значением pH более 7. Примеры основных солей — NaCN, мыло, NaF и т. д.
Читайте также: —
- основная соль?
- Почему NaCN является основной солью?
- Почему мыло является основной солью?
Нейтральная соль: Значение pH этой соли равно 7, что означает, что она не обладает ни кислотными, ни основными свойствами. Он образуется при протекании реакции нейтрализации между сильной кислотой и сильным основанием или слабой кислотой и слабым основанием. Примеры нейтральной соли – это NaCl, KCl, NaNO 3, и т. д.
Примеры нейтральной соли – это NaCl, KCl, NaNO 3, и т. д.
Читайте также:-
- Почему NaCl является нейтральной солью,
- Почему KCl является нейтральной солью?
- Почему NaNO3 является нейтральной солью?
Амфотерная соль: Эта соль может действовать как кислая, так и основная соль. Или «Амфотерный означает, что соединение обладает способностью действовать как кислота с основанием и как основание с кислотой». Примеры амфотерных солей – NaHCO 3 , HCO 3 – , CH 3 OH и т. д.
Читайте также: –
- Почему NaHCO3 действует не только как основание, но и как кислота?
- Почему HCO3- действует не только как основание, но и как кислота?
- Почему Ch4OH действует не только как основание, но и как кислота?
Хорошо, теперь перейдем к делу Почему Na 2 CO 3 действует как основная соль? Как мы знаем, карбонат натрия образуется, когда NaOH (сильное основание) реагирует с H 2 CO 3 (слабая кислота). Они реагируют друг с другом в молярном соотношении 2:1.
Они реагируют друг с другом в молярном соотношении 2:1.
⇒ 2NaOH + H 2 CO 3 → Na 2 CO 3 + 2H 2 O
По представлениям сильных солей соединение со слабой кислотой приводит к образованию сильных солей основной соли.
Природа соли (кислая или основная) зависит от силы компонента в кислотно-щелочной реакции.
- Водный раствор более сильной кислоты и слабого основания приобретет больше свойства кислоты, чем основания.
- Водный раствор более сильного основания и слабой кислоты приобретет больше свойств основания, чем кислоты.
В случае Na 2 CO 3 более сильное основание (NaOH) реагирует с более слабой кислотой (h3CO3), поэтому его водный раствор приобретает больше свойства основания, чем кислоты.
Следовательно, мы можем сказать, что Na 2 CO 3 является основной солью в природе.
Почему водный раствор Na2CO3 становится основным? Водный раствор, имеющий значение pH более 7, называется основным водным раствором.
При растворении карбоната натрия в воде он диссоциирует на два иона Na + и CO 3 2- .
⇒ Na 2 CO 3 → 2Na + + CO 3 2-
Na + представляет собой катион сильного основания (NaOH), поэтому он не подвергается гидролизу в воде и не влияет на рН раствора. Но CO 3 2- – это анион слабой кислоты , который подвергается гидролизу в воде с образованием ионов бикарбоната (HCO 3 – ), оставляя ионы OH – , которые делают раствор щелочным.
⇒ CO 3 2- + H 2 O → HCO 3 – + OH –
Ион бикарбоната (HCO 3 – ) остается в основном неионизированным в растворе, следовательно, окончательный раствор содержит больше 8 OH 9014 ион.
Следовательно, при наличии в водном растворе дополнительных ионов OH – раствор карбоната натрия (Na 2 CO 3 ) приобретает основной характер.
Примечание: Природа водного раствора зависит от H + и ионы ОН – . Когда в водном растворе присутствует больше ионов ОН – , тогда раствор становится щелочным, а когда в водном растворе присутствует больше ионов Н + , раствор становится кислым.
Также, когда количество ионов H + и OH – одинаково в водном растворе, то говорят, что раствор нейтрален.
Почему Na2CO3 не является кислой или нейтральной солью?Нейтральная соль означает, что при растворении в воде не проявляются кислотные или щелочные свойства, а кислая соль означает, что у нее больше кислотных свойств при растворении в водном растворе со значением pH менее 7,
Важная концепция кислотно-щелочной силы –
- Более сильное основание + более слабая кислота образуют основной водный раствор из-за присутствия большего количества ионов ОН – .
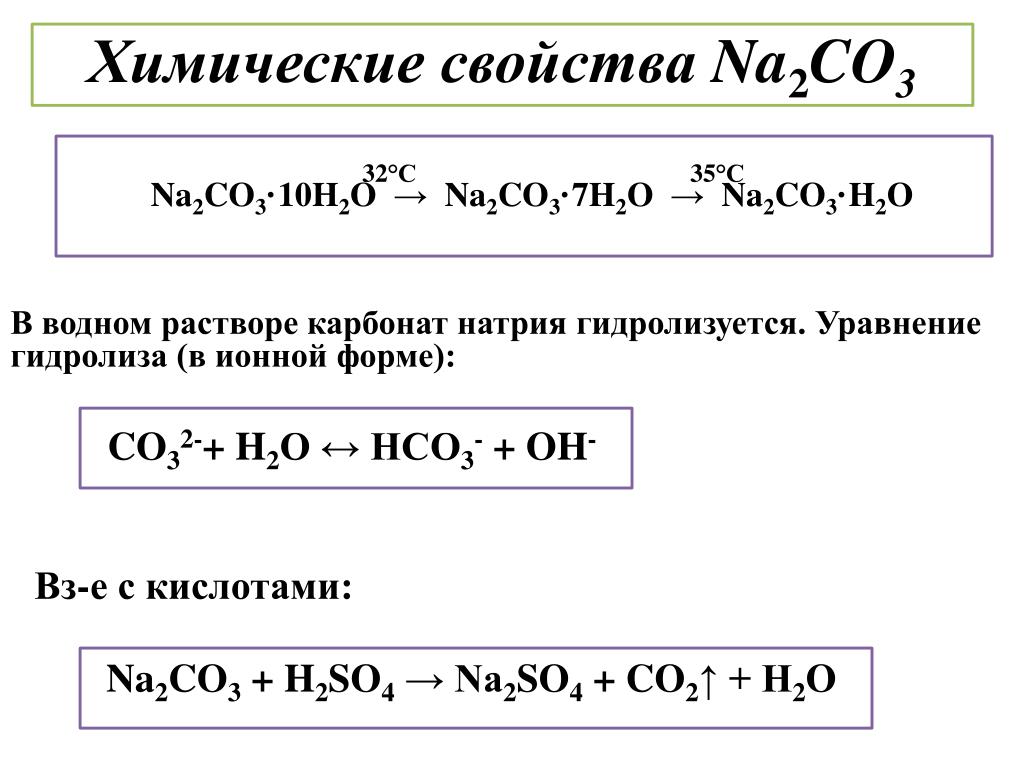 (OH – > H + )
(OH – > H + ) - Более сильная кислота + более слабое основание образует кислый водный раствор из-за присутствия большего количества ионов H + . (H + > OH – )
- Более сильная/более слабая кислота + Более сильное/более слабое основание образует нейтральный водный раствор из-за присутствия того же количества OH – и Н + в растворе. (H + = OH – )
Итак, Почему карбонат натрия не является кислой или нейтральной солью в природе? Это связано с тем, что при растворении Na 2 CO 3 в водном растворе он диссоциирует на катион 2Na + и анион CO 3 2-. Катион (Na + ) бесполезен, так как не вступает в химическую реакцию из-за своей очень слабой природы.
Тогда как анион (CO 3 2- ) реагирует с H + и образует соответствующую кислоту (HCO 3 – ), оставляя в растворе ионы OH – .
⇒ CO 3 2- + H + OH — → HCO 3 — + OH —
SO, Aqueous of NA —
. большое количество ионов ОН – за счет гидролиза СО 3 2- ионы.
Как показано на рисунке, водный раствор Na 2 CO 3 содержит большее количество ионов OH – , чем ионов H + , это приводит к увеличению pH раствора , в результате чего Na 2 CO 3 становится щелочным.
Следовательно, Na 2 CO 3 не является кислой или нейтральной солью из-за присутствия большего количества ионов OH – , что убедительно указывает на то, что она будет сохранять природу основания.
Примечание: Карбонат натрия (Na 2 CO 3 ) не является основанием, это основная соль, и ее водный раствор имеет щелочную природу.
Na2CO3 считается сильным или слабым (кислая или основная соль)?Читайте также: –
- Является ли NaBr кислой, основной или нейтральной солью?
- Является ли KBr кислой, основной или нейтральной солью?
- Является ли KNO3 кислой, основной или нейтральной солью?
Карбонат натрия не является ни кислотным, ни основным, это соль, состоящая из сильного основания и слабой кислоты. Сильные основания полностью диссоциируют в растворе и выделяют большое количество ионов OH –, но слабая кислота в основном остается недиссоциированной и выделяет меньше ионов H + .
Следовательно, при наличии в водном растворе Na 2 CO 3 большего количества ионов ОН – мы можем считать его сильноосновной солью.
Понятие кислой соли и основной соли:-
⇒ Сильное основание + Слабая кислота = Основная соль (∴ OH – ионов > H + ионов)
⇒ Более сильная кислота + Слабое основание = Кислая соль
Применение карбоната натрияТакже проверьте:
- Как определить, слабая это кислота или сильная?
- Как определить, является ли что-то кислой, щелочной или нейтральной солью?
- Карбонат натрия используется для изготовления стекла и бумаги.

- Используется для устранения постоянной и временной жесткости воды или, можно сказать, для смягчения воды.
- Применяется в домашнем хозяйстве как очищающее средство для стирки белья.
- Используется для регулирования кислотности и поддержания щелочных условий в различных химических процессах.
- Карбонат натрия также используется в медицине для лечения стригущего лишая, очищения кожи и лечения экземы.
- Используется в качестве пенообразователя в зубной пасте и в качестве смачивающего агента в кирпичной промышленности.
- Имеет октаэдрическую координатную геометрию.
- Температура кипения 1600 °C и температура плавления 851 °C.
- Он предпочтительнее гидроксида натрия из-за его неагрессивной природы.
- Растворим в воде и глицерине, но нерастворим в ацетоне, спирте и т. д.
- Значение кислотности (pKa) карбоната натрия составляет 10,33.
Карбонат натрия является одним из распространенных соединений, которые мы используем в нашем доме для таких целей, как стирка одежды, также известный как стиральная сода или кальцинированная сода. С ним безопаснее обращаться, поэтому его предпочитают гидроксиду натрия в различных химических процессах. Наконец, мы рассмотрим эту статью на тему «Является ли Na 2 CO 3 кислотой, основанием или нейтральной солью?»
С ним безопаснее обращаться, поэтому его предпочитают гидроксиду натрия в различных химических процессах. Наконец, мы рассмотрим эту статью на тему «Является ли Na 2 CO 3 кислотой, основанием или нейтральной солью?»
- Является ли карбонат натрия (Na 2 CO 3 ) кислой или основной солью? Na 2 CO 3 представляет собой основную соль со значением pH, близким к 11, полученную путем нейтрализации сильного основания (NaOH) слабой кислотой (H 2 CO 3 ).
- Водный раствор карбоната натрия (Na 2 CO 3 ) является основным по своей природе из-за наличия большего количества гидроксид-ионов, образующихся в результате гидролиза карбонат-ионов (CO 3 2- + H
7 2
0 O → HCO 3 – + OH – )
. - Присутствие меньшего количества ионов водорода и большего количества ионов OH – повышает уровень pH раствора Na 2 CO 3 .

Вишал Гоял
Добро пожаловать в Topblogtenz, меня зовут Вишал Гоял. Я инженер, репетитор по химии, блоггер и основатель topblogtenz.com. Я фанат науки со страстью к наукам о жизни и химии. Являясь репетитором по химии и имея высшее техническое образование, я знаю, как сложно учиться самостоятельно, поэтому я создала сайт, где вы можете найти помощь, связанную с наукой и химией, раньше всех.
Поделись…
Карбонат натрия, формула и уравнение- Unacademy
Карбонат натрия – это неорганическое вещество со щелочным вкусом, которое содержит натриевую соль угольной кислоты. Он имеет химическую формулу Na2CO3.
В основном карбонат натрия применяется в качестве чистящего средства. Он также используется в стекольной и кирпичной промышленности и является частой добавкой, связующим веществом и электролитом.
Пластмассы и некоторые металлы, такие как алюминий, свинец, цинк и цинковая латунь, подвергаются коррозии под действием карбоната натрия.
Сода для стирки и кальцинированная сода — другие названия карбоната натрия.
Карбонат натрия обладает способностью разрушать как металлы, так и неметаллы. При 21 ° C (69,8 ° F) его растворы (концентрация 35 процентов) вызывают коррозию алюминия, свинца, цинка и цинковой латуни. При нормальной температуре и относительной влажности его твердая форма вызывает коррозию алюминия. Другие распространенные металлы, такие как нержавеющая сталь, углеродистая сталь, никелевый чугун, никель и сплавы на основе никеля, не подвергаются коррозии в его растворах.
Некоторые пластмассы, такие как полиакрилаты и полисульфиды, также подвергаются воздействию растворов карбоната натрия. Его растворы не вступают в реакцию с акрилонитрил-бутадиен-стиролом (АБС), хлорированным поливинилхлоридом (ХПВХ), нейлоном, полиэтиленом, полипропиленом, поливинилхлоридом (ПВХ), тефлоном, другими фторуглеродами или некоторыми эластомерами.
Щелочное охрупчивание и отслоение материалов может быть вызвано карбонатом натрия, и его можно использовать в качестве ингибитора накипи в питательной воде для котлов
Формула и структура карбоната натрия Карбонат натрия представляет собой подщелачивающее соединение, которое химически представляет собой динатриевую соль угольной кислоты. Кальцинированная сода, стиральная сода и кристаллы соды — некоторые из альтернативных названий карбоната натрия. Na2CO3 — это химическая формула карбоната натрия. Карбонат натрия является основным основным тяжелым химическим веществом, имеющим ряд преимуществ перед другими. Структура, синтез, физические свойства, химические реакции и применение карбоната натрия будут обсуждаться в этой статье.
Кальцинированная сода, стиральная сода и кристаллы соды — некоторые из альтернативных названий карбоната натрия. Na2CO3 — это химическая формула карбоната натрия. Карбонат натрия является основным основным тяжелым химическим веществом, имеющим ряд преимуществ перед другими. Структура, синтез, физические свойства, химические реакции и применение карбоната натрия будут обсуждаться в этой статье.
Карбонат натрия имеет химическую формулу Na2CO3 и является динатриевой солью угольной кислоты. Два атома натрия, три атома кислорода и один атом углерода составляют одну молекулу карбоната натрия.
Процедура получения карбоната натрия Для получения карбоната натрия можно использовать метод Сольве, электролитический процесс, процесс Леблана и двойной процесс. Для производства соли карбоната натрия единственным вариантом является процесс Solvay. В 1861 году Эрнест Сольве, бельгийский промышленный химик, изобрел процесс Сольве.
Технологическая процедура Solvay для получения карбоната натрия описана ниже.
а. Аммиак, соляной раствор, известняк, вода и углекислый газ являются реагентами, используемыми в процессе Solvay для получения карбоната натрия.
б. Сначала аммиак и двуокись углерода попадают в холодный насыщенный раствор хлорида натрия. В результате этой реакции образуется гидрокарбонат натрия. Поскольку гидрокарбонат натрия значительно менее растворим в ионах натрия, он выпадает в осадок.
- Наконец, выпавший в осадок гидрокарбонат натрия фильтруют и прожигают. В результате этого процесса образуется карбонат натрия.
- Involved reactions in the Solvay process
2Nh4+ h3O + CO2 = (Nh5)2CO3
(Nh5)2CO3 + h3O + CO2= 2Nh5HCO3
Nh5HCO3 + NaCl= Nh5Cl + NaHCO3
Na2CO3 + CO2 + h3O = 2NaHCO3
Газообразный диоксид углерода, полученный в результате реакции, можно повторно использовать в другом технологическом цикле Solvay. Чтобы перекристаллизовать кристаллы стиральной соды, растворите карбонат натрия в воде.
Чтобы перекристаллизовать кристаллы стиральной соды, растворите карбонат натрия в воде.
Процесс Solvay является лучшим способом получения карбоната натрия из всех возможных. Ниже приведены некоторые из многочисленных преимуществ метода Solvay.
- Процесс Solvay очень экономичен, поскольку исходные ингредиенты, необходимые для синтеза, легко доступны и недороги.
- В процессе Solvay в качестве побочного продукта образуется только хлорид кальция, что гарантирует чистоту процесса.
- Метод Solvay позволяет получать карбонат натрия высокой чистоты, а аммиак и двуокись углерода можно извлекать и использовать для другого цикла.
- Карбонат натрия представляет собой химическое вещество, широко используемое в обрабатывающей промышленности. Ниже приведены некоторые из наиболее распространенных применений карбоната натрия.
- Карбонат натрия используется в производстве мыла, бумаги и моющих средств, а также в качестве лабораторного и аналитического реагента.
- Карбонат натрия используется в качестве смягчителя воды, модификатора pH, пенообразователя и абразива в зубной пасте, смачивающего агента в строительной промышленности, а также при производстве жидкого стекла из силиката натрия.
- Хлорид натрия является исходным материалом для синтеза натрийсодержащих химических веществ, таких как бура и фосфат натрия, а
- Карбонат натрия является компонентом огнетушителей. Он также используется в качестве пищевого ингредиента.
Мы пришли к выводу, что отшелушивающие средства, зубная паста, масла и соли для ванн, пены для ванн, увлажняющие средства и другие продукты часто содержат его. Когда карбонат натрия растворяется в воде, он образует угольную кислоту и гидроксид натрия, который является антацидом, нейтрализующим желудочную кислоту.
