Металлы — Химия
Металлы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск. Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
Таким образом, к металлам, возможно, относится 96 элементов из всех открытых. В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия Характерные свойства металлов
Физические свойства металлов Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже приводится твёрдость некоторых металлов по шкале Мооса. Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите. В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность. Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых. Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения. Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета. Химические свойства металлов На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны) Реакции с простыми веществами
оксид лития пероксид натрия надпероксид калия Чтобы получить из пероксида оксид, пероксид восстанавливают металлом: Со средними и малоактивными металлами реакция происходит при нагревании:
При нагревании:
Железо взаимодействует с серой при нагревании, образуя сульфид:
Взаимодействие кислот с металлами Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода Происходит реакция замещения, которая также является окислительно-восстановительной: Взаимодействие серной кислоты H2SO4 с металлами Окисляющие кислоты могут взаимодействовать и с металлами, стоящими в ЭРАМ после водорода: Очень разбавленная кислота реагирует с металлом по классической схеме: При увеличении концентрации кислоты образуются различные продукты: Реакции для азотной кислоты (HNO3) При взаимодействии с активными металлами вариантов реакций ещё больше: |
Металлы и неметаллы — Химия
Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск. Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят: 6 элементов в группе щелочных металлов: Li, Na, K, Rb, Cs, Fr 4 в группе щёлочноземельных металлов: Ca, Sr, Ba, Ra а также вне определённых групп бериллий и магний 38 в группе переходных металлов: — Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn; — Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd; — La, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg; 7 в группе лёгких металлов: Al, Ga, In, Sn, Tl, Pb, Bi 7 в группе полуметаллов: B, Si, Ge, As, Sb, Te, Po 14 в группе лантаноиды + лантан (La): Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu 14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний (Ac): Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr. Таким образом, к металлам, возможно, относится 94 элемента из всех открытых; все остальные являются неметаллами. В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия (см. Кроме того, в физике металлам [как проводникам] противоставляется полупроводники и диэлектрики (см. также Полуметалл (спинтроника)). Происхождение слова «металл»: Слово «металл» заимствовано из немецкого языка. Отмечается в «Травнике» Николая Любчанина, написанном в 1534 году: «…злато и серебро всех металей одолеваетъ». Окончательно усвоено в Петровскую эпоху. Первоначально имело общее значение «минерал, руда, металл»; разграничение этих понятий произошло в эпоху М. В. Ломоносова. Немецкое слово «metall» заимствовано из латинского языка, где «metallum» — «рудник, металл». Латинское, в свою очередь, заимствовано из греческого языка (μεταλλον — «рудник, копь»). Нахождение в природе: Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. Известно, что организм человека на 3 % состоит из металлов. Больше всего в организме кальция (в костях) и натрия, выступающего в роли электролита в межклеточной жидкости и цитоплазме. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови. Свойства металлов: Физические свойства металлов Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже в таблице приводится твёрдость некоторых металлов по шкале Мооса. Твёрдость некоторых металлов по шкале Мооса: Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность. Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения. Наименьшая теплопроводность — у висмута и ртути. Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета. Химические свойства металлов На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны) Реакции с простыми веществами С кислородом реагируют все металлы, кроме золота, платины. оксид лития пероксид натрия надпероксид калия Чтобы получить из пероксида оксид, пероксид восстанавливают металлом: Со средними и малоактивными металлами реакция происходит при нагревании: С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды: При нагревании: С серой реагируют все металлы, кроме золота и платины: Железо взаимодействует с серой при нагревании, образуя сульфид: С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп, кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1: С углеродом реагируют только наиболее активные металлы. Взаимодействие кислот с металлами: С кислотами металлы реагируют по-разному. Металлы, стоящие в электрохимическом ряду активности металлов (ЭРАМ) до водорода, взаимодействуют практически со всеми кислотами. 2. Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее:
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал. Благодаря высоким значениям энергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения. В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром. У некоторых неметаллов наблюдается проявление аллотропии. Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод. В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод. |
Объяснитель: Что такое металл?
Высокий небоскреб гнется под сильным порывом ветра, но не ломается. Это одно из преимуществ металлов. Будучи ковким (MAAL-ee-ah-bul), металлы можно сбивать в листы без разрушения. Поскольку они пластичны (ДУК-тул), их можно легко тянуть и растягивать в провода, не ломая. Металлы также могут проводить электричество.
Но не все металлы одинаково ценятся. Хотя более трех четвертей из 118 элементов периодической таблицы являются металлами, мы изготавливаем инструменты лишь из нескольких из них. Это потому, что знакомые металлы, такие как железо и серебро, особенные. Во-первых, их легче найти, чем другие металлы. (Хотя большинство известных элементов — это металлы, в природе они довольно редки.)
Во-первых, их легче найти, чем другие металлы. (Хотя большинство известных элементов — это металлы, в природе они довольно редки.)
Знакомые металлы также менее активны, чем большинство других металлов. Реактивность относится к тому, насколько легко вещество вступает в химическую реакцию с другими веществами. Металлы с низкой реакционной способностью более безопасны в обращении, чем металлы с высокой реакционной способностью. Чистое серебро настолько безопасно, что мы используем его для изготовления украшений и столовых приборов. Но чистый натрий, тоже металл, настолько реакционноспособен, что взрывается при контакте с водой!
Посмотрите, как ингредиенты поваренной соли — натрий (металл) и хлор — вступают в химическую реакцию. Остерегайтесь пламени!
Остерегайтесь пламени!Хорошо, что чистый натрий никогда не встречается в природе. Вместо этого мы находим его после того, как он уже химически связан с одним или несколькими другими элементами. Типичным примером является хлорид натрия или поваренная соль. И это подчеркивает еще одну причину, по которой металлы с низкой реакционной способностью так полезны. Они часто встречаются в природе в формах, с которыми легко работать. Например, серебро можно добывать как чистое серебро. Но если нам нужен чистый натрий, нам нужен способ отделить его от одного из химических веществ, с которым он связан. Это может быть трудно сделать.
Иногда для специального проекта — например, космического телескопа Джеймса Уэбба стоимостью 10 миллиардов долларов — может потребоваться довольно редкий металл. После 25 лет разработки телескоп был запущен рождественским утром 2021 года. Для этого небесного глаза НАСА выбрало редкий металл бериллий (Beh-RIL-ee-um), чтобы сделать соты из позолоченных зеркал. Бериллий очень легкий. Это облегчает запуск в космос. Бериллий также сохраняет свою форму при низких температурах. При переносе из относительно теплого воздуха Земли в криогенные (сверххолодные) температуры космоса металлы сжимаются и изгибаются. Поскольку телескопы работают, отражая свет, любое крошечное изменение их формы может испортить изображение телескопа. Но бериллий остается более устойчивым, чем большинство металлов, при таких резких перепадах температуры.
Бериллий очень легкий. Это облегчает запуск в космос. Бериллий также сохраняет свою форму при низких температурах. При переносе из относительно теплого воздуха Земли в криогенные (сверххолодные) температуры космоса металлы сжимаются и изгибаются. Поскольку телескопы работают, отражая свет, любое крошечное изменение их формы может испортить изображение телескопа. Но бериллий остается более устойчивым, чем большинство металлов, при таких резких перепадах температуры.
Металл против неметалла: в чем разница?
Если это возможно, атом будет красть электроны у соседнего атома. Он не украдет их все, но достаточно, чтобы быть стабильным. Разные элементы имеют разное количество электронов, которые — по крайней мере теоретически — могут быть украдены соседом. Они называются валентными (VAY-лентами) электронами. Это внешние вращающиеся электроны, которые могут стать частью химических связей.
Он не украдет их все, но достаточно, чтобы быть стабильным. Разные элементы имеют разное количество электронов, которые — по крайней мере теоретически — могут быть украдены соседом. Они называются валентными (VAY-лентами) электронами. Это внешние вращающиеся электроны, которые могут стать частью химических связей.
Атомы металлов отличаются от неметаллов тем, насколько хорошо они крадут валентные электроны у других атомов. Можно сказать, что металлы — плохие воры. Вместо того, чтобы захватывать чужие электроны, они обычно отдают свои. Эта склонность к потере электронов описывается как их «металлический характер».
Неметаллические элементы, таким образом, имеют низкий металлический характер. Среди этих неметаллов углерод, кислород и азот. Когда дело доходит до похитителей электронов, лучше всего подходят неметаллы. Король этих неметаллов — фтор. Когда дело доходит до кражи электронов, фтор — настоящий хулиган. Так что это очень реактивно.
Металлы хотят электронов, но очень слабо. Однако во многих отношениях эта слабость оказывается силой металлов. Их пластичность (изгибаемость), пластичность (растяжимость) и проводимость обусловлены склонностью этих элементов терять электроны.
Однако во многих отношениях эта слабость оказывается силой металлов. Их пластичность (изгибаемость), пластичность (растяжимость) и проводимость обусловлены склонностью этих элементов терять электроны.
Металлы могут даже образовывать особую связь
Большинство химических связей возникает, когда атомы борются за электроны. Металлическая связь возникает, когда связываются два атома металла. Никого из них, похоже, не слишком заботит, какой атом окажется с дополнительными электронами.
Сравните это с ионной связью. Это происходит, когда металл (например, натрий) связывается с неметаллом (например, хлором). Из-за больших различий в их металлическом характере неметалл крадет электроны у атома металла и сохраняет эти электроны.
Химическая связь происходит после кражи. Металл и неметалл остаются слипшимися, потому что теперь они имеют противоположные заряды. Оба атома начинались с нейтрального заряда. Как только неметалл получил электрон, он стал отрицательным. (Это потому, что электроны имеют отрицательный заряд.) Но металл потерял электрон. Это оставило металл с общим положительным зарядом. Обратите внимание, что металл не является положительным, потому что он приобрел положительный заряд. Он положительный, потому что потерял отрицательный. Эти противоположно заряженные атомы, называемые теперь ионами, притягиваются друг к другу и слипаются.
Металлические связи также отличаются от ковалентных связей, которые образуются при соединении двух неметаллов. Там оба неметалла пытаются отобрать электроны у другого. Но поскольку оба имеют сильные претензии на электроны друг друга, они оба терпят неудачу. Неметаллы в конечном итоге оказываются запертыми в вечном перетягивании каната. Поскольку ни один из атомов не «побеждает», эти атомы описываются как «делящие» свои электроны.
Но когда два атома металла сталкиваются друг с другом, они не борются за электроны. Ни один из них не хочет электронов достаточно сильно. Когда многие атомы металла в конечном итоге слипаются, как в куске металла, их электроны перемещаются от одного атома к другому, к другому, к другому. Ученые описывают эти электроны как «делокализованные».
Делокализованные электроны объясняют, почему металлы проводят электричество. В конце концов, электричество — это всего лишь движение электронов. Одна модель, используемая для объяснения металлических связей, предполагает, что атомы металла плывут в океане электронов.
Делокализованные электроны не просто объясняют проводимость металлов. Они также объясняют ковкость и пластичность металлов. Металлические связи позволяют атомам металла перемещаться в своем электронном море, но при этом оставаться связанными. Это было бы невозможно, если бы они были жестко связаны ковалентными или ионными связями.
Атомы одних металлов перемещаются легче, чем других.
Так как же это делают кузнецы? Имейте в виду, что атомы никогда не сидят на месте. Они двигаются и трясутся. А горячие атомы трясутся больше, чем холодные, что дает горячим атомам больше свободы. В расплавленном металле связи между атомами сильно ослабевают. Таким образом, кузнец разогреет кузницу до 1600º по Цельсию (2,900 градусов по Фаренгейту). Эта сильная лихорадка ослабляет эти металлические связи, позволяя кузнецу придать металлу форму.
Как только новый меч остывает, его атомы замедляются, а металлические связи вновь укрепляются.
Педагоги и родители, подпишитесь на шпаргалку
Еженедельные обновления, которые помогут вам использовать Science News Explores в учебной среде
Спасибо за регистрацию!
При регистрации возникла проблема.
сплавов и действительно
Титаник урокЮвелирные изделия почти никогда не содержат чистого золота. Это было бы просто слишком мягко. Поэтому мастера по металлу смешивают золото с другими металлами, часто с медью, чтобы сделать его менее ковким. Такие смешанные металлы называются сплавами. Сплавы также могут быть металлами, смешанными с небольшим количеством неметалла.
Углеродистая сталь представляет собой сплав железа с добавлением углерода. Небоскребы и мосты сделаны из большого количества углеродистой стали. Как и многие кухонные ножи и отвертки. Углерод в углеродистой стали упрочняет железо, делая его тверже. Но увеличение твердости металла снижает его пластичность.
На самом деле слишком много углерода делает сталь хрупкой. А по мере остывания металлов эта проблема только усугубляется. В апреле 1912 года круизный лайнер «Титаник » во время своего первого рейса столкнулся с айсбергом и затонул. Погибло более 1500 человек. Исследования пробитого корпуса корабля показывают, что сталь Титаник стала хрупкой в холодных водах Атлантики. Стальной сплав Titanic стал хрупким при температуре 32 ºC (90 ºF). В ночь, когда затонул «Титаник», температура воды составляла всего –2 ºC (28 ºF).
А по мере остывания металлов эта проблема только усугубляется. В апреле 1912 года круизный лайнер «Титаник » во время своего первого рейса столкнулся с айсбергом и затонул. Погибло более 1500 человек. Исследования пробитого корпуса корабля показывают, что сталь Титаник стала хрупкой в холодных водах Атлантики. Стальной сплав Titanic стал хрупким при температуре 32 ºC (90 ºF). В ночь, когда затонул «Титаник», температура воды составляла всего –2 ºC (28 ºF).
Современные инженеры использовали бы другую сталь. Например, современная сталь под названием ASTM A36 может выдерживать -27 ºC (-17 ºF), прежде чем стать такой же хрупкой, как Titanic . Разница в сплаве. В стали Titanic «было гораздо больше содержания серы и намного меньше марганца», — объясняет Эндрю Фальковски. Он инженер-материаловед в Солт-Лейк-Сити, штат Юта. Он также является соведущим подкаста «Материализм», шоу о материаловедении.
Периодическая таблица отделяет металлы от неметаллов
Вы можете определить металличность любого элемента, просто найдя его в периодической таблице. Металлический характер существует в спектре. Элементы находятся где-то между наименее металлическими — фтором — и наиболее металлическими — цезием (или францием, если вы включаете элементы, изготовленные в лаборатории). Таким образом, с точки зрения металлического характера цезий и фтор являются полярными противоположностями. Фтор является наиболее реакционноспособным
Металлический характер существует в спектре. Элементы находятся где-то между наименее металлическими — фтором — и наиболее металлическими — цезием (или францием, если вы включаете элементы, изготовленные в лаборатории). Таким образом, с точки зрения металлического характера цезий и фтор являются полярными противоположностями. Фтор является наиболее реакционноспособным
Найдите эти элементы в периодической таблице, и вы кое-что заметите. Они на противоположных сторонах. Это не случайно.
Неметаллы занимают верхнюю правую часть классической таблицы Менделеева, включая всю крайнюю правую колонку. Есть одно исключение. Водород — единственный неметалл, который относится к группе неметаллов под номером , а не . Водород странный, в основном потому, что его атомы такие крошечные.
Металлы занимают везде , кроме в правом верхнем углу. По мере удаления от неметаллов металлический характер усиливается. Она увеличивается при движении справа налево, а также при движении вниз.
По мере удаления от неметаллов металлический характер усиливается. Она увеличивается при движении справа налево, а также при движении вниз.
Похожие типы металлов группируются в периодической таблице. Например, крайний левый столбец содержит натрий и другие так называемые щелочные металлы. Все они бурно реагируют с неметаллами. Элементы, находящиеся между металлами и неметаллами, называются металлоидами или полуметаллами. Они обладают свойствами как металлов, так и неметаллов. Примерами являются мышьяк и кремний. В середине находятся так называемые переходные металлы. Именно там живут самые знакомые металлы, такие как золото, серебро и медь.
Силовые слова
Подробнее о сильных словахщелочной металл : любой из шести элементов (цезий, франций, литий, калий, рубидий или натрий), который вступает в реакцию с водой, образуя сильные основания или щелочи, способные нейтрализовать кислоты.
атом : Основная единица химического элемента.
связь : (в химии) Полупостоянное соединение между атомами или группами атомов в молекуле. Он формируется силой притяжения между участвующими атомами. После соединения атомы будут работать как единое целое. Чтобы разделить атомы компонентов, к молекуле должна быть подведена энергия в виде тепла или другого вида излучения.
углерод : Химический элемент, являющийся физической основой всей жизни на Земле. Углерод существует свободно в виде графита и алмаза. Он является важной частью угля, известняка и нефти и способен к самосвязыванию химическим путем с образованием огромного количества химически, биологически и коммерчески важных молекул. (в исследованиях климата)
цезий : Металлический химический элемент с атомным номером 55. Среди множества применений цезий служит основой современных атомных часов и используется во многих фотоэлектрических элементах.
химический : Вещество, состоящее из двух или более атомов, которые соединяются (связываются) в фиксированной пропорции и структуре. Например, вода — это химическое вещество, образующееся при соединении двух атомов водорода с одним атомом кислорода. Его химическая формула H 2 O. Химический также может быть прилагательным для описания свойств материалов, которые являются результатом различных реакций между различными соединениями.
химические связи : силы притяжения между атомами, достаточно сильные для того, чтобы связанные элементы функционировали как единое целое. Некоторые из сил притяжения слабы, некоторые очень сильны. Все связи, по-видимому, связывают атомы посредством совместного использования — или попытки поделиться — электронами.
химическая реактивность: Термин, обозначающий легкость, с которой вещество вступает в химические реакции.
медь : Металлический химический элемент того же семейства, что и серебро и золото. Поскольку он является хорошим проводником электричества, он широко используется в электронных устройствах.
Поскольку он является хорошим проводником электричества, он широко используется в электронных устройствах.
кора : (в геологии) самая внешняя поверхность Земли, обычно состоящая из плотной твердой породы.
делокализованные электроны : Электроны атома, молекулы или металла, которые не связаны с конкретным атомом или конкретной ковалентной связью. Вместо этого они свободно бродят. Делокализованные электроны характерны для металлических связей и часто описываются как море электронов.
пластичность : (прил. пластичность) Характеристика вещества (например, металла), которая позволяет вытягивать его в проволоку без разрушения.
электричество : Поток заряда, обычно возникающий в результате движения отрицательно заряженных частиц, называемых электронами.
электрон : Отрицательно заряженная частица, обычно вращающаяся вокруг внешних областей атома; также носитель электричества внутри твердых тел.
элемент : Строительный блок некоторой более крупной структуры. (в химии) Каждое из более чем ста веществ, для которых наименьшая единица каждого из них — один атом. Примеры включают водород, кислород, углерод, литий и уран.
инженер : Человек, который использует науку для решения проблем. Глагол «спроектировать» означает разработать устройство, материал или процесс, который решит какую-то проблему или неудовлетворенную потребность. (v.) Для выполнения этих задач или имя лица, которое выполняет такие задачи.
фтор : элемент, впервые открытый в 1886 году Анри Муассаном. Он получил свое название от латинского слова, означающего «течь». Очень реакционноспособный химически, этот элемент практически не использовался в коммерческих целях до Второй мировой войны, когда его использовали для изготовления топлива для ядерных реакторов. Позже он использовался в качестве ингредиентов (фторуглеродов) в хладагентах и аэрозольных пропеллентах. Совсем недавно он нашел широкое применение для изготовления антипригарных покрытий для сковородок, сантехнической ленты и водонепроницаемой одежды.
Совсем недавно он нашел широкое применение для изготовления антипригарных покрытий для сковородок, сантехнической ленты и водонепроницаемой одежды.
кузница : (существительное) Печь или цех, где металл обрабатывается и превращается в новые материалы. (глагол) Формировать металлы под воздействием тепла и/или давления или (в просторечии) формировать один элемент из другого под действием сильного тепла и давления внутри звезд.
водород : Самый легкий элемент во Вселенной. В виде газа он бесцветен, не имеет запаха и легко воспламеняется. Это неотъемлемая часть многих видов топлива, жиров и химических веществ, из которых состоят живые ткани. Он состоит из одного протона (который служит его ядром), вокруг которого вращается один электрон.
ion : (прил. ионизированный) Атом или молекула с электрическим зарядом из-за потери или приобретения одного или нескольких электронов. В ионизированном газе или плазме все электроны отделены от родительских атомов.
железо : Металлический элемент, распространенный среди минералов в земной коре и в ее горячем ядре. Этот металл также содержится в космической пыли и во многих метеоритах.
ковкий : То, чья форма может быть изменена, обычно путем удара молотком или другой деформации под давлением. (в социальных науках) Отношения или поведение, которые можно изменить с помощью социального давления или логики.
марганец : Химический элемент с атомным номером 25. Это твердый серый металл переходного ряда. Марганец является важным компонентом специальных сталей.
масса : число, показывающее, насколько объект сопротивляется ускорению и замедлению — в основном мера того, из какого количества материи состоит этот объект.
металл : Что-то, что хорошо проводит электричество, имеет тенденцию быть блестящим (отражающим) и податливое (это означает, что ему можно придать форму с помощью нагревания и без слишком большой силы или давления).
металлическая связь: Тип химической связи, которая соединяет атомы металла вместе. Металлы склонны отдавать электроны, поэтому для этой связи характерны свободные, так называемые делокализованные электроны. Вместе эти субатомные частицы часто называют электронным «морем».
металлический характер: Термин, описывающий реакционную способность металлов из-за их склонности отдавать электроны в химических реакциях. Элементы с высоким металлическим характером легче всего теряют электроны. Из встречающихся в природе элементов цезий обладает наиболее высокими металлическими свойствами. У фтора самое низкое.
металлоиды : Также известные как полуметаллы. Эти элементы имеют некоторые общие свойства как с металлами, так и с неметаллами. В периодической таблице они лежат на границе между металлами и неметаллами. Примерами являются кремний и мышьяк.
модель : имитация реального события (обычно с использованием компьютера), разработанная для предсказания одного или нескольких вероятных исходов. Или человек, который должен показать, как что-то будет работать или выглядеть на других.
Или человек, который должен показать, как что-то будет работать или выглядеть на других.
расплавленный : Слово, описывающее что-то расплавленное, например жидкий камень, из которого состоит лава.
НАСА : сокращение от Национального управления по аэронавтике и исследованию космического пространства. Созданное в 1958 году, это американское агентство стало лидером в области космических исследований и стимулирования общественного интереса к исследованию космоса. Именно через НАСА Соединенные Штаты отправили людей на орбиту и, в конечном итоге, на Луну. Он также отправил исследовательский корабль для изучения планет и других небесных объектов в нашей Солнечной системе.
реактивный : (в химии) Тенденция вещества принимать участие в химическом процессе, известном как реакция, которая приводит к новым химическим веществам или изменениям в существующих химических веществах.
соль : Соединение, полученное путем соединения кислоты с основанием (в результате реакции, при которой также образуется вода). В океане содержится много разных солей, которые в совокупности называются «морской солью». Обычная поваренная соль состоит из натрия и хлора.
В океане содержится много разных солей, которые в совокупности называются «морской солью». Обычная поваренная соль состоит из натрия и хлора.
небоскреб : Очень высокое здание.
натрий : Мягкий серебристый металлический элемент, который при добавлении в воду взаимодействует со взрывом. Это также основной строительный блок поваренной соли (молекула которой состоит из одного атома натрия и одного атома хлора: NaCl). Он также содержится в морской соли.
спектр : (множественное число: спектры) Диапазон связанных вещей, которые появляются в некотором порядке. (по свету и энергии) Диапазон видов электромагнитного излучения; они охватывают диапазон от гамма-лучей до рентгеновских лучей, ультрафиолетового света, видимого света, инфракрасной энергии, микроволн и радиоволн.
сера : Химический элемент с атомным номером шестнадцать. Сера, один из самых распространенных элементов во Вселенной, является важным элементом для жизни. Поскольку сера и ее соединения могут накапливать много энергии, она присутствует в удобрениях и многих промышленных химикатах.
Поскольку сера и ее соединения могут накапливать много энергии, она присутствует в удобрениях и многих промышленных химикатах.
теория : (в науке) Описание некоторых аспектов мира природы, основанное на обширных наблюдениях, тестах и рассуждениях. Теория также может быть способом организации обширной совокупности знаний, применимых в широком диапазоне обстоятельств для объяснения того, что произойдет. В отличие от общепринятого определения теории, теория в науке — это не просто догадка. Идеи или выводы, основанные на теории, но еще не на достоверных данных или наблюдениях, называются теоретическими. Ученые, которые используют математику и/или существующие данные для прогнозирования того, что может произойти в новых ситуациях, известны как теоретики.
инструмент : Предмет, который человек или другое животное изготавливает или получает, а затем использует для достижения какой-либо цели, такой как добыча пищи, самозащита или уход за собой.
переход : Граница, где одна вещь (параграфы, экосистемы, стадия жизни, состояние материи) изменяется или превращается в другую.
переходная мета л: Также известны как переходные элементы . Эти металлы находятся в центре таблицы Менделеева. По сравнению с другими элементами, их свойства более непредсказуемы. Эта непредсказуемость связана с тем, что их валентные электроны расположены в секции электронной оболочки, известной как д блок. Меркурий является одним из примеров.
валентность : (в химии и физике) Электроны атома, участвующие в химической связи. Обычно валентные электроны — это самые внешние электроны (те, которые вращаются дальше всего от ядра).
Цитаты
Подкаст: Материализм: Подкаст по материаловедению. Что на самом деле потопило Титаник? 18 июня 2021 г..
Книга: NJ Tro. Химия: молекулярный подход, издание AP. Пирсон, 2014.
Пирсон, 2014.
Журнал : K. Felkins et al. Королевский почтовый корабль «Титаник»: металлургическая авария заставила ночь вспомнить? ДжОМ. Том. 50, январь 1998 г., с. 12. doi: 10.1007/s11837-998-0062-7.
Кэти Грейс Карпентер — научный писатель и разработчик учебных программ со степенью в области биологии и биогеохимии. Она также пишет научную фантастику и снимает научные видеоролики. Кэти живет в США, но также проводит время в Швеции со своим мужем, шеф-поваром.
Периодическая таблица металлов и неметаллов
Учебные пособия
- Сообщение от Доннелл Грин
12 июль
Основные понятия
В этом уроке вы познакомитесь с металлами и неметаллами в периодической таблице элементов и их свойствами.
Темы, освещенные в других статьях
- Свойства металлов, неметаллов и металлоидов
- Ионные связи против.
 Ковалентные связи
Ковалентные связи - Электронное сродство
- Электроотрицательность
- Металлическое соединение
Металлы
Большинство элементов периодической таблицы элементов относятся к категории металлов. В периодической таблице металлы расположены слева от зигзагообразной линии, которая проходит между пятью элементами: бором, кремнием, мышьяком, теллуром и астатом. Элементы, попадающие на эту линию или чуть левее ее (бор, кремний, германий, мышьяк, теллур, сурьма и полоний), могут быть классифицированы как металлоиды или полуметаллы. Это означает, что они обладают свойствами как металлов, так и неметаллов.
Примеры металлов
Некоторые хорошо известные металлы периодической таблицы включают: железо, свинец, алюминий, серебро, кальций и натрий, которые находятся в твердом состоянии при комнатной температуре. Ртуть, классифицируемая как металл, является единственным металлом в периодической таблице, представленным в виде жидкости.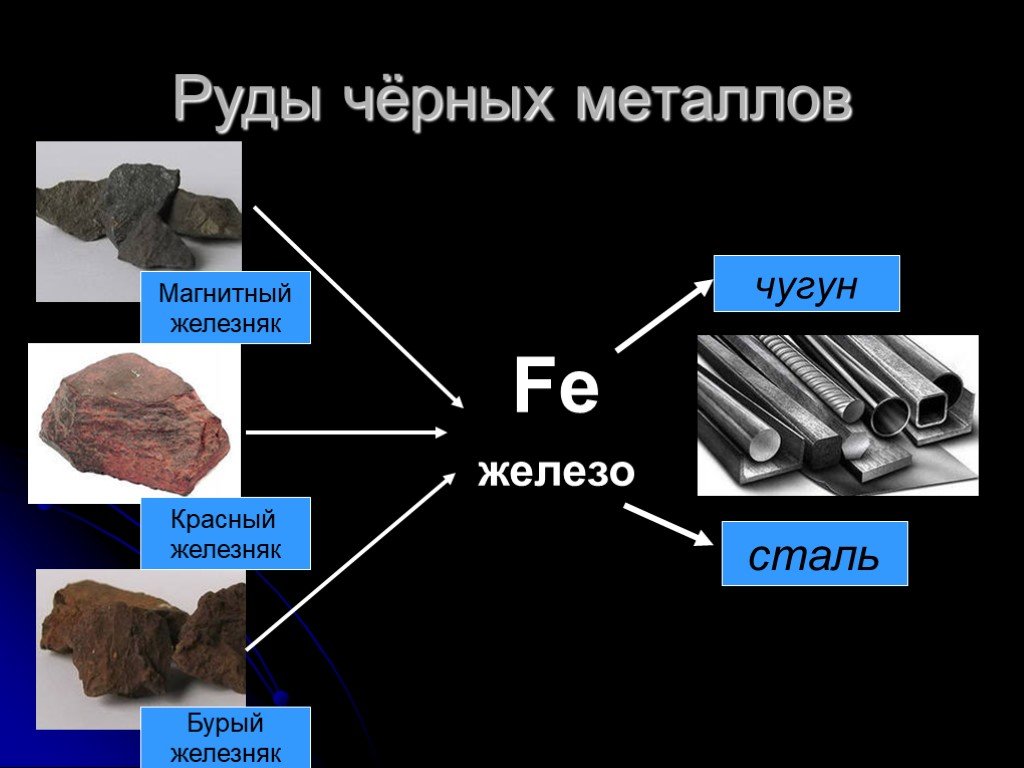 Из ста восемнадцати металлов таблицы Менделеева золото является самым податливым. Вот почему ювелирные изделия никогда не могут быть на 100% чистым золотом, иначе они не выдержат повседневного износа.
Из ста восемнадцати металлов таблицы Менделеева золото является самым податливым. Вот почему ювелирные изделия никогда не могут быть на 100% чистым золотом, иначе они не выдержат повседневного износа.
Свойства металлов
- Все металлы различаются по точкам плавления , но в целом все металлы имеют высокие температуры плавления и кипения.
- Большинство металлов представлены в виде твердых веществ при комнатной температуре, ртуть является единственным исключением из этого правила, поскольку она существует в жидком состоянии при комнатной температуре.
- Металлы блестящие по своей природе, то есть их поверхность блестящая. Медь — чрезвычайно блестящий металл.
- Металлы обычно более плотные, чем неметаллы.
- Как правило, металлы очень податливы , что означает, что их можно выбить в тонкие листы. Чистое золото — самый ковкий элемент.
- Металлы пластичны, это означает, что их можно раскатывать в тонкие листы.

- Наконец, металлы являются хорошими проводниками тепла и электричества.
Металлы и их заряды
Поскольку металлы расположены слева в периодической таблице, они часто имеют низкую энергию ионизации и низкое сродство к электрону, что означает, что они относительно легко отдают электроны, заставляя металлы становиться катионами. Металлы основной группы обычно образуют заряды, равные номеру их группы. Металлы группы 1А, такие как литий и натрий, имеют заряд +1, металлы группы 2А, такие как магний и кальций, имеют заряд +2.
Металлы, которые следуют за переходными металлами, могут терять свои s орбитальных и p орбитальных электронов и образовывать заряды, которые совпадают с номером их группы, или они могут терять свои p орбитальные электроны и сохранять свои два s орбитальных электроны; такие металлы, как олово и свинец в группе 4А, могут образовывать заряды +4 или +2. Когда эти металлы связываются с другими неметаллами, это известно как ионная связь, при которой происходит перенос электронов от одного вида к другому.
Неметаллы
Неметаллы составляют небольшую часть элементов периодической таблицы. В периодической таблице неметаллы лежат справа от зигзагообразной линии, которая проходит между элементами бором, кремнием, мышьяком, теллуром и астатом. Неметаллы также включают водород, который находится слева от металлоидов. Многие из этих элементов играют биологическую роль. Живые существа почти полностью состоят из неметаллов, таких как углерод или водород.
Это изображение не включает водород, который также является неметаллом.Примеры неметаллов
Хотя в периодической таблице всего семнадцать неметаллов, несколько распространенных примеров включают кислород и азот, которые составляют большую часть воздуха, которым мы дышим, наряду с несколькими другими газами, такими как неон или химическое вещество. сложный углекислый газ. Несвязывающие гелий, неон, радон, аргон, ксенон, криптон и оганесон, также известные как благородные газы, составляют часть неметаллов.
Свойства неметаллов
- Большинство металлов находятся в в газообразном состоянии , но вы можете найти некоторые в твердом или жидком состоянии.
 Как бром, который можно найти в виде жидкости.
Как бром, который можно найти в виде жидкости. - Как правило, неметаллы не блестящие или блестящие.
- Неметаллы имеют низкие температуры плавления и кипения.
- Неметаллы часто имеют более низкую плотность .
- В отличие от металлов, неметаллы часто являются очень плохими проводниками тепла и электричества.
Неметаллы и их сборы
Неметаллы обладают высокой энергией ионизации и высоким сродством к электрону, поэтому они могут легко приобретать электроны, но терять их с гораздо большими усилиями, в результате чего они классифицируются как анионы. Они будут продолжать приобретать электроны до тех пор, пока их количество не станет таким же, как у ближайшего к ним инертного газа. Их сборы можно отнести к группе минус восемь. Таким образом, неметаллы в группе 7А имеют заряд -1, в группе 6А -2 заряда, а в группе 5А -3 заряда. Благородные газы в группе 8A уже имеют свой октет, поэтому они не решаются образовывать связи.



 Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.
Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.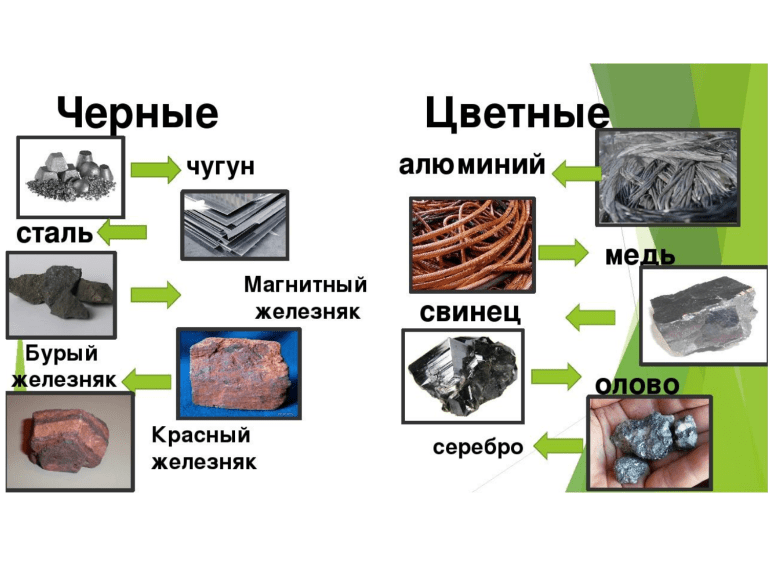
 В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды: При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
 Металличность).
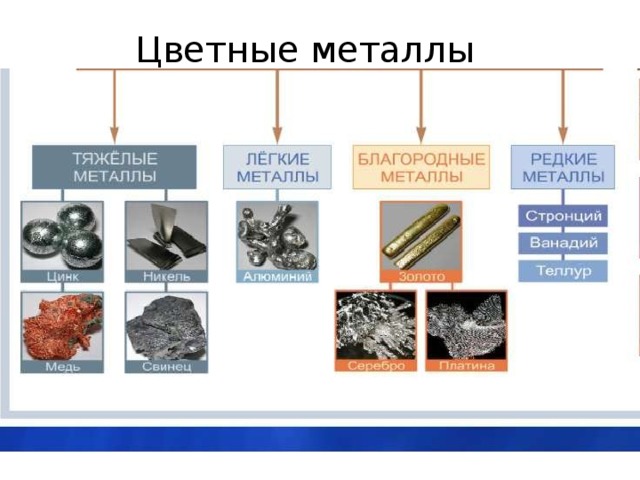
Металличность). При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде и в живых организмах (играя при этом важную роль).
При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде и в живых организмах (играя при этом важную роль). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например, олово и свинец, можно расплавить на обычной электрической или газовой плите.
Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например, олово и свинец, можно расплавить на обычной электрической или газовой плите. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды: При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
 Ковалентные связи
Ковалентные связи
 Как бром, который можно найти в виде жидкости.
Как бром, который можно найти в виде жидкости.