Методические рекомендации по подготовке к ЕГЭ по химии
Предметные результаты на профильном уровне ориентированы на более глубокое освоение систематических знаний и способов действий, присущих данному предмету, и решить задачи освоения основ базовых наук, подготовки к последующему профессиональному образованию
Для облегчения усвоения учебного материала предлагаю большое количество схем и таблиц, выражающих или иллюстрирующих наиболее важные теоретические положения
При подготовке к ЕГЭ по химии задания уровня С выходят далеко за рамки двухчасовой школьной программы, например составление уравнений окислительно-восстановительных реакций или уравнений реакций по разрушению комплексных солей. Найти ответы на некоторые вопросы порой не удается ни в одном учебнике или пособии.
Одно из заданий высокого уровня сложности (уровня С) проверяет знания об амфотерных свойствах веществ. Для успешного выполнения этого задания нужно знать в том числе и способы разрушения комплексных солей. В учебной литературе этому вопросу уделяется мало внимания.
В учебной литературе этому вопросу уделяется мало внимания.
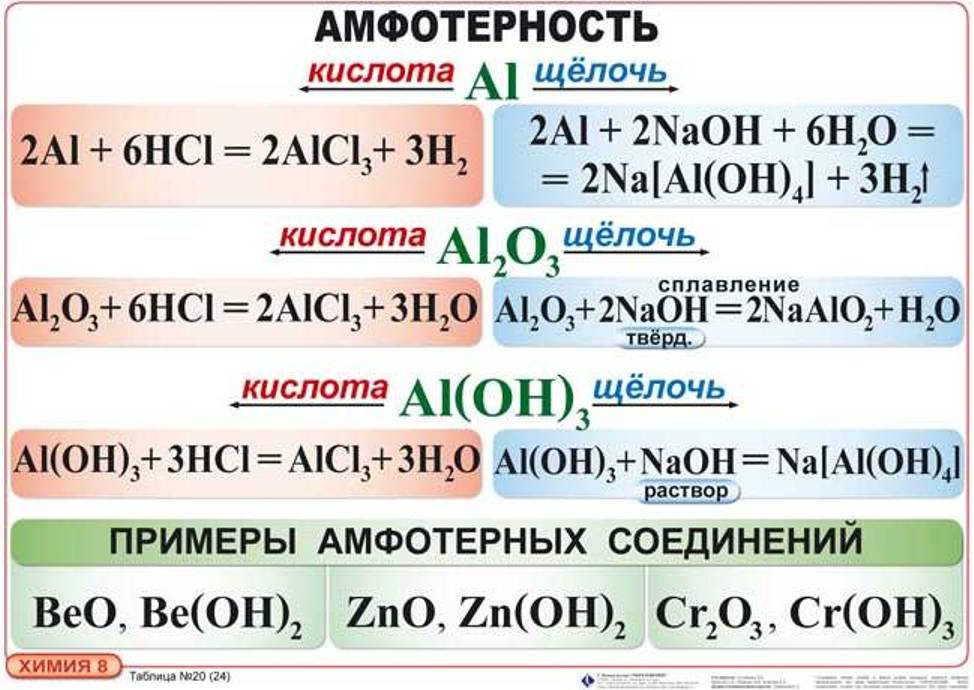
Амфотерные свойства имеют оксиды и гидроксиды многих металлов. Они не растворяются в воде, но растворяются в кислотах и щелочах. При подготовке к ЕГЭ нужно усвоить материал о свойствах соединений алюминия, цинка, бериллия, железа и хрома.
Основные свойства амфотерных соединений при взаимодействии с сильными кислотами
Например:
Zn O + 2HCI= Zn CI 2 + h3O ,
Zn(OH)2 +2HCI = ZnCI2 + 2h3O ,
AI2O3 +6HCI =2AICI3 + 3h3o ,
AI (OH)3 + 3HCI =AICI3 + 3h3O
Кислотные свойства при взаимодействии со щелочами
Реакции при сплавлении:
Формула гидроксида цинка записывают в кислотной форме — (цинковая кислота).
Кислотная форма гидроксида алюминия – (ортоалюминиевая кислота), но она неустойчива, и при нагревании отщепляется вода: получается метаалюминиевая кислота.
По этой причине при сплавлении соединений алюминия со щелочами получаются соли – метаалюминаты: Реакции в растворе происходят с образованием комплексных солей
Следует отметить, что при взаимодействии соединений алюминия со щелочами ( рН= 14) в растворе получаются разные формы комплексных солей ( к. ч.(АI) =6)
ч.(АI) =6)
т.е. гексагидроксоалюминат натрия и тетрагидроксодиакваалюминат натрия
Соединения бериллия (ВеО и Ве(ОН)2) взаимодействуют со щелочами аналогично соединениям цинка, соединения хрома (III) и железа (III) (Cr2O3, Cr(OH)3, Fe2O3, Fe(OH)3) — аналогично соединениям алюминия, но оксиды этих металлов взаимодействуют только при сплавлении.
Cr2O3 + 2Na OH = 2NaCrO2 +h3O
метахромит натрия ( хромат(III) натрия)
Fe2O3 +2NaOH =2NaFeO2 +h3O.
феррит натрия (феррат (III) натрия)
При взаимодействии гидроксидов этих металлов со щелочами в растворе образуются комплексные соли с координационным числом 6.
Гидроксид хрома (III) легко растворяется в щелочах:
Гидроксид железа (III) имеет очень слабые амфотерные свойства взаимодействует только с горячими концентрированными растворами щелочей:
Способы разрушения гидроксокомплексов
1) При действии избытка сильной кислоты получаются две средних соли и вода:
2) При действии сильной кислоты ( в недостатке ) получаются средняя соль активного металла, амфотерный гидроксид и вода:
3)При действии слабой кислоты получается кислая соль активного металла , амфотерный гидроксид и вода:
4)При действии углекислого или сернистого газа получается кислая соль активного металла и амфотерный гидроксид:
Применение таблиц , схем на уроках химии:
Химические свойства кислот
кислоты
Термическое разложение некоторых солей.
2KClO3 → 2KCl +3O2 ↑
2KMnO4 → K2MnO4 +MnO2 + O2 ↑
4KClO3 → 3KClO4 +KCl
4Na2SO3 → Na2S + Na2SO4
Оксиды. (не разлагаются все оксиды, кроме)
2HgO → 2Hg +O2
2PbO2 → 2Pb +O2
Кислоты. (не разлагаются все кислоты, кроме)
H2CO3 → H2O↑ + CO2↑
H2SiO3 → SiO2 + H2O↑
H2SO3 → H2O↑ + SO2↑
2HNO2 → NO↑ + NO2↑ + H2O↑
4HNO3 → 4NO2↑ + O2↑ + 2H2O
HCOOH→ CO↑ + H
H2C2O4 → HCOOH + CO2↑
|
№ |
Продукты реакции |
Условия протекания |
|
1 |
Гидроксид |
Только для восьми оксидов: Li2O,Na2O,K2O,Rb2O,Cs2O, CaO,SrO,BaO |
|
2 |
Кислота |
Кислота, растворимая в воде |
|
3 |
Соль |
Ограничений нет (проблемы с растворимостью нет) |
|
4 |
Соль + H2O |
1)кислота, растворимая в воде 2)желательно, чтобы соль была растворима в воде |
|
5 |
Соль + H2O |
1)Гидроксид растворим в воде |
|
6 |
Соль + H2O |
1)Хотя бы одно из исходных веществ, растворима в воде |
|
7 |
Новая соль + новый гидроксид |
1)оба исходных соединений растворимы в воде 2)образуется газ, осадок,H |
|
8 |
соль + соль |
1)Также как и 7 |
|
9 |
Новая соль + новая кислота |
1)Исходная кислота растворима в воде (искл. 2)Как правило, более сильная кислота вытесняет более слабую 3) принцип Ле — Шателье |
|
10 |
Соль + H2 |
1)кислота растворима в воде 2)Me активнее H2 3)факт ограничения: Me(Fe) →+2;HNO3;H2SO4(к) → H 2 не выделяется |
|
11 |
Соль + Me |
1)Обе соли растворимы в воде 2)более акт. Ме вытесняет менее акт. Ме 3)примечания 8Me(5 щ. Me и 3щ. з. Me не брать, одновременно идет 13 |
|
12 |
Соль амфотерного гидроксида (гидроксокомплекс) и H2 |
1)Только для амфотерных металлов (Al,Cr,Zn,Be,Pb,Sn) |
|
13 |
гидроксид + H2 |
1)8 Me, т. |
|
14 |
Смесь двух кислот + H2O |
SO2Cl2 + H2O → 2HCl + H2SO4 без ограничений сульфорилхлорид |
|
15 |
Две соли |
SO2Cl2 + 4KOH → K2SO4 + 2KCl + 2H2O |
KMnO4 в среде H2SO4 реагирует с различными восстановителями.
окислитель
Важнейшая задача химии – получение веществ с заранее заданными свойствами и интенсификация промышленных производств, создание безотходных технологий. Материальный мир в котором мы живём и крохотной частицей которого мы являемся, един и в тоже время бесконечно разнообразен.
Для осуществления превращений необходимо знать: химические свойства классов органических веществ, способы их получения. Именные реакции, распознавательные (качественные реакции) на органические вещества — уметь составлять данные уравнения с различными гомологами в присутствии окислителей в различных средах (в нейтральной, кислой и щелочной) с использованием метода электронного баланса или метода полуреакций.
Генетическая связь между классами органических соединений (подготовка к ЕГЭ)
Решение задач – это практическое применение теоретического материала, приложение научных знаний на практике. Успешное решение задач учащимися поэтому является одним из завершающихся этапов в самом познании. Типовой программой определены требования к знаниям и умениям учащихся в части решения расчётных задач по органической химии: «Уметь находить молекулярную формулу по массовой доли элементов, по массе, объёму или количеству вещества –продуктов его сгорания, по химическим свойствам».
1.Углеводороды. Природные источники углеводородов и их переработка
2.Кислородсодержащие органические соединения.
3.Азотсодержащие органические соединения.
Учащихся лучше знакомить с несколькими способами определения МФ. С этой целью классную доску делим на две половины вертикальной чертой. На одной половине доски решаем задачу первым способом, на другой – вторым. Такая организация обучения даёт хорошие результаты (т.е. рекомендуем включать зрительную память)
Задачи на нахождение молекулярной формулы вещества(С-5)
1.Предельный одноатомный спирт сожгли. В результате реакции получили 22,4 л (н.у.) углекислого газа и 22,5 г водяных паров. Определите молекулярную формулу исходного спирта. (C4H9OH)
2.На полное сгорание 0,5 моль алкина израсходовано 28 л кислорода (н.у.). Установите молекулярную формулу алкина. (C2H2)
3. На окисление предельного одноатомного спирта пошло 10 г оксида меди (II). В результате реакции получили альдегид массой 10,75 г, медь и воду. Определите молекулярную формулу исходного спирта. (C5H11OH)
На окисление предельного одноатомного спирта пошло 10 г оксида меди (II). В результате реакции получили альдегид массой 10,75 г, медь и воду. Определите молекулярную формулу исходного спирта. (C5H11OH)
4. Предельный одноатомный спирт обработали металлическим натрием. В результате реакции получили вещество массой 20,5 г и выделился газ объёмом 2,8 л(н.у.). Определите молекулярную формулу исходного спирта. (C3H7OH)
5.Предельный одноатомный спирт нагрели до 170 – 1800С в присутствии концентрированной серной кислоты. В результате реакции получили газообразное вещество при н.у. с массовой долей водорода 14,29%и с относительной плотностью по гелию 10,5.
6.Определите молекулярную формулу исходного спирта. (C3H7OH) Установите молекулярную формулу предельной одноосновной кислоты, бариевая соль которой содержит 60,35% бария.
Использование расчётных задач в школе позволяет в значительной мере решать основные функции обучения и воспитания. Представленные материалы призваны оказать содействие в организации эффективной подготовки к экзамену. Они также могут использованы на уроках в целях повторения, систематизации и обобщения знаний. В этом пособии учащиеся найдут реальные задания, которые были представлены на ЕГЭ в предыдущие годы.
Представленные материалы призваны оказать содействие в организации эффективной подготовки к экзамену. Они также могут использованы на уроках в целях повторения, систематизации и обобщения знаний. В этом пособии учащиеся найдут реальные задания, которые были представлены на ЕГЭ в предыдущие годы.
ЕГЭ. Химические свойства амфотерных соединений
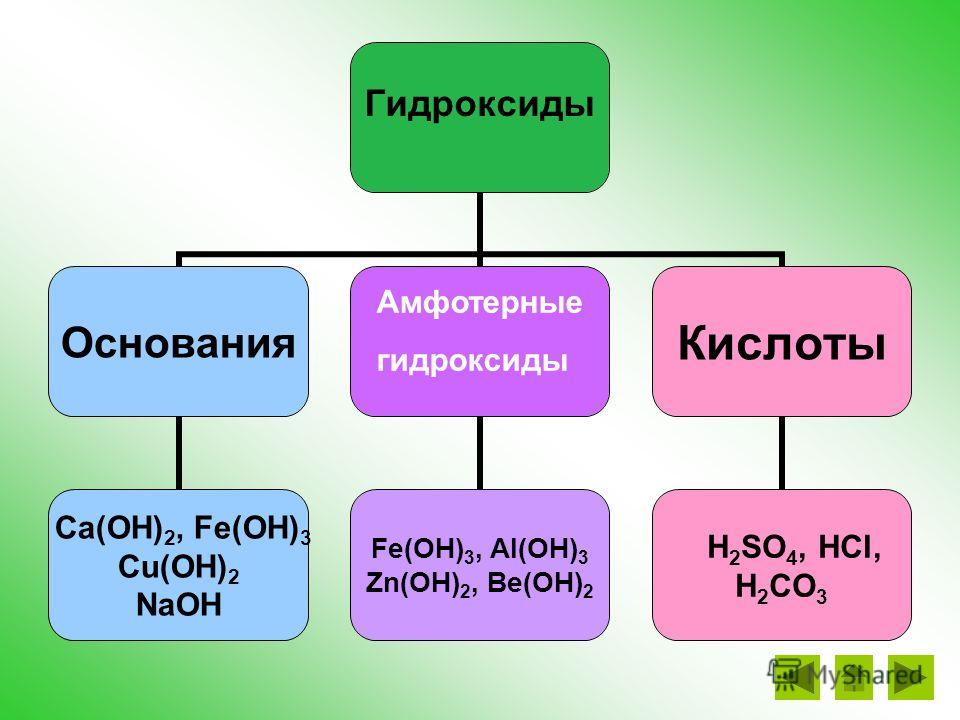
Правило 1. Амфотерными соединениями являются оксиды и гироксиды, имеющие в своем составе металл в степении окисения +3 или +4, а также оксиды и гидроксиды Zn, Be и Pb, например:
| ZnO | BeO | Al2O3 | Fe2O3* | Cr2O3* |
| Zn(OH)2 | Be(OH)2 | Al(OH)3 | Fe(OH)3 | Cr(OH)3 |
| PbO | PbO2 | SnO | SnO2 | |
| Pb(OH)2 | Pb(OH)4** | Sn(OH)2 | Sn(OH)4** |
*Оксиды железа и хрома реагируют с щелочами только при сплавлении.
**Представляют собой гидратированные диоксиды МO2 • хh3O.
Знание свойств соединений свинца и олова на ЕГЭ не проверяется.
Правило 2. В реакциях с растворами щелочей образуются комплексные соединения:
ZnO + 2NaOH + h3O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Zn(OH)2 + NaOH → Na2[Zn(OH)4]
BeO + 2NaOH + h3O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Be(OH)2 + NaOH → Na2[Be(OH)4]
Al2O3 + 2NaOH + 3h3O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Al(OH)3 + NaOH → Na[Al(OH)4]
Fe2O3 + NaOH → реакция не идет
Cr2O3 + NaOH → реакция не идет
Cr(OH)3 + 3NaOH → Na3[Cr(OH)6] (гексагидроксохромат натрия)
Правило 3. В реакциях сплавления с твердыми щелочами образуются соли соответствующих кислот (h3ZnO2, HAlO2 и др.):
ZnO + 2NaOH → Na2ZnO2 + h3O (цинкат натрия)
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2h3O (условно, кислота: h3ZnO2)
BeO + 2NaOH → Na2BeO2 + h3O (бериллат натрия)
Be(OH)2 + 2NaOH → Na2BeO2 + 2h3O (условно, кислота: h3BeO2)
Al2O3 + 2NaOH → 2NaAlO2 + h3O (алюминат натрия)
Al(OH)3 + NaOH → NaAlO2 + 2h3O (условно, кислота: HAlO2)
Cr2O3 + 2NaOH  → 2NaCrO2 + h3O (хромит натрия)
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
Cr(OH)3 + NaOH → NaCrO2 + 2h3O (условно, кислота HCrO2)
Fe2O3 + 2KOH → 2KFeO2 + h3O (феррит калия)
Fe(OH)3 + KOH → KFeO2 + 2h3O(условно, кислота HFeO2)
Правило 4.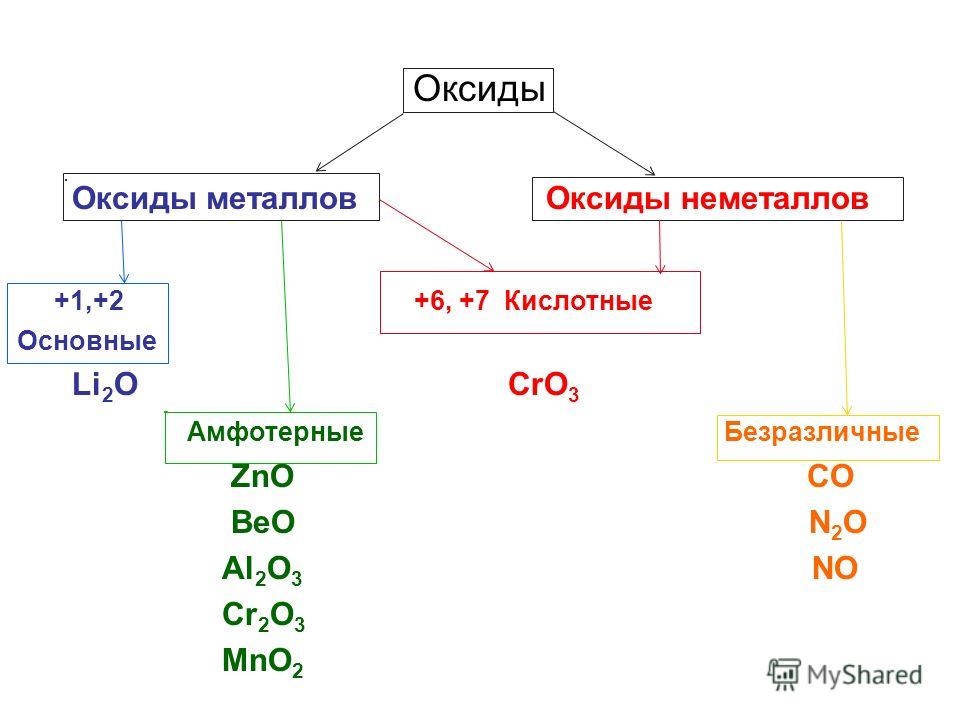 При сплавлении с карбонатами выделяется CO2:
При сплавлении с карбонатами выделяется CO2:
2Al(OH)3 + Na2CO3 → 2NaAlO2 + 3h3O + CO2
Правило 5. Амфотерные оксиды взаимодействуют с карбонатами и сульфитами Na и K с выделением более летучего оксида:
Al2O3 + Na2CO3 → 2NaAlO2 + CO2
Fe2O3 + Na2CO3 → 2NaFeO2 + CO2
ZnO + Na2SO3 → Na2ZnO2 + SO2
Правило 6. Соли соединений Zn, Be и Al разлагаются водой, кислотами, хлоридом аммония:
NaAlO2 + 2h3O → Na[Al(OH)4]
NaAlO2 + 4HCl → AlCl3 + NaCl + 2h3O (в избытке HCl)
NaAlO2 + HCl + h3O → NaCl + Al(OH)3 (в недостатке HCl)
NaAlO2 + Nh5Cl + h3O → Al(OH)3 + NaCl + Nh4.
Амфотеризм и амфотеризм — что означают эти термины?
- Главная
- / org/ListItem»> Что такое амфотерные и…
Что такое амфотерность и амфотерность? Слово «амфотерный» означает «оба». Металл или металлоид, проявляющий амфотеризм, образует два типа оксидов и гидроксидов. Это говорит о том, что они особенные, поскольку способны вступать в химическую реакцию как обе кислоты и в качестве основы.
Одним из амфотерных металлов является алюминий. Гидроксид алюминия Al(OH)₃ реагирует с соляной кислотой. Гидроксид действует как слабое основание с образованием соли и воды:
Al(OH)₃ + 3 HCl → AlCl3 + 3 H₂O
Амфотерный поворот
С другой стороны, гидроксид алюминия может реагировать с сильным основанием, натрием. гидроксид с образованием алюмината
Al(OH)₃ + NaOH → NaAlO₂ + 2 H₂O
В этом случае гидроксид алюминия действует как слабая кислота. Есть несколько металлов, проявляющих амофотеризм. К ним относятся цинк, свинец, олово и бериллий.
Металлоиды
Металлоиды – это элементы, которые, хотя и не считаются настоящими металлами, проявляют свойство амфотеризма. Например, мышьяк образует соли мышьяка и арсенаты и арсениты. Другие амфотерные металлоиды включают сурьму, бор, кремний, германий и теллур.
Например, мышьяк образует соли мышьяка и арсенаты и арсениты. Другие амфотерные металлоиды включают сурьму, бор, кремний, германий и теллур.
Интересно, что два первичных продукта, NaAlO₂ и AlCl₃, реагируют друг с другом, таким образом,
3 NaAlO₂ + AlCl₃ → 3 NaCl + 2 Al₂O₃
Да, алюминат натрия плюс хлорид алюминия образуют хлорид натрия (обычная поваренная соль) плюс оксид алюминия .
Примечание: Для получения дополнительной информации прочитайте Кислоты, основания, соли: может ли оксид быть солью?
Ссылки:
- Suny Oneonta: комплексные ионы и амфотеризм
← Назад к QS Nuggets
← Главная
Поддержите причудливую науку здесь!
Последние сообщения
- Вопрос с подвохом о воздушном шаре
- Папоротники папоротника: насколько токсичны для выпаса сельскохозяйственных животных?
- Вы заметили очень крошечные «сорняки» полевых цветов?
- Фотография: отражение в глазах канарейки
- Старик продолжает свое образование
Пожалуйста, подпишитесь на нас и поставьте лайк 🙂
Категории
КатегорииВыберите категориюживотныеАстрономияКрасотаБиологияБиологияХимияОбразованиеЭлектричествоРазвлеченияЕдаКриминалистикаГенеалогияГеологияЗдоровьеИсторияЮморЯзыкЛогикаПроизводствоМатематикаМедицинаМетеорологияПриродаНовостиЛюдифилософияФотографияФизикаРастенияТехнологияИскусствоТранспортБез категорииАрхивы
Архивы Выбрать месяц Сентябрь 2022 Октябрь 2020 Сентябрь 2020 Август 2020 Июль 2020 Июнь 2020 Май 2020 Апрель 2020 Март 2020 Февраль 2020 Январь 2020 Декабрь 2019 Ноябрь 2019 Октябрь 2019 Сентябрь 2019 Август 2019 Июль 2019 Июнь 2019 Май 2019 19 2 Февраль 2019 Апрель 2019 Март 2019 Март 2019 Ноябрь 2018 г. Октябрь 2018 г. Сентябрь 2018 г. Август 2018 г., июль 2018 г., июнь 2018 г., май 2018 г., апрель 2018 г. Март 2018 г. Февраль 2018 г., январь 2018 г., декабрь 2017 г., ноябрь 2017 г., октябрь 2017 г., сентябрь 2017 г., август 2017 г., июль 2017 г., июнь 2017 г., май 2017 г. Апрель 2017 г. Март 2017 г. Февраль 2017 г. Январь 2017 г. Декабрь 2016 г. 2016 г. 2016 г. 2016 г. Октябрь 2016 г., сентябрь 2016 август 2016 г., июль 2016 г., июнь 2016 г., май 2016 г., апрель 2016 г. Март 2016 г., февраль 2016 г., январь 2016 г., декабрь 2015 г., ноябрь 2015 г., октябрь 2015 г., сентябрь 2015 г., август 2015 г., июль 2015 г., июнь 2015 г., май 2015 г., апрель 2015 г., февраль 2015 г. Январь 2015 г. Декабрь 2014 г. Ноябрь 2014 г. Октябрь 2014 г. Сентябрь 2014 г. Август т 2014 г. июль 2014 г. май 2014 г. март 2014 г. февраль 2014 г. январь 2014 г. декабрь 2013 г. ноябрь 2013 г. октябрь 2013 г. сентябрь 2013 г. август 2013 г. июль 2013 г. июнь 2013 г. май 2013 г. апрель 2013 г.0000 КАТОДНАЯ ЗАЩИТА АМФОТЕРНЫХ МЕТАЛЛОВ (Технический отчет) КАТОДНАЯ ЗАЩИТА АМФОТЕРНЫХ МЕТАЛЛОВ (Технический отчет) | ОСТИ.
Октябрь 2018 г. Сентябрь 2018 г. Август 2018 г., июль 2018 г., июнь 2018 г., май 2018 г., апрель 2018 г. Март 2018 г. Февраль 2018 г., январь 2018 г., декабрь 2017 г., ноябрь 2017 г., октябрь 2017 г., сентябрь 2017 г., август 2017 г., июль 2017 г., июнь 2017 г., май 2017 г. Апрель 2017 г. Март 2017 г. Февраль 2017 г. Январь 2017 г. Декабрь 2016 г. 2016 г. 2016 г. 2016 г. Октябрь 2016 г., сентябрь 2016 август 2016 г., июль 2016 г., июнь 2016 г., май 2016 г., апрель 2016 г. Март 2016 г., февраль 2016 г., январь 2016 г., декабрь 2015 г., ноябрь 2015 г., октябрь 2015 г., сентябрь 2015 г., август 2015 г., июль 2015 г., июнь 2015 г., май 2015 г., апрель 2015 г., февраль 2015 г. Январь 2015 г. Декабрь 2014 г. Ноябрь 2014 г. Октябрь 2014 г. Сентябрь 2014 г. Август т 2014 г. июль 2014 г. май 2014 г. март 2014 г. февраль 2014 г. январь 2014 г. декабрь 2013 г. ноябрь 2013 г. октябрь 2013 г. сентябрь 2013 г. август 2013 г. июль 2013 г. июнь 2013 г. май 2013 г. апрель 2013 г.0000 КАТОДНАЯ ЗАЩИТА АМФОТЕРНЫХ МЕТАЛЛОВ (Технический отчет) КАТОДНАЯ ЗАЩИТА АМФОТЕРНЫХ МЕТАЛЛОВ (Технический отчет) | ОСТИ. GOV
GOVперейти к основному содержанию
- Полная запись
- Другое связанное исследование
Катодная защита определяется потенциалом. Амфотерные металлы определяются растворимостью оксида в зависимости от рН. Катодная защита амфотерных металлов обсуждается с точки зрения диаграмм потенциал-pH. Показана возможность катодной защиты Al в растворах кислот, катодной коррозии в щелочных растворах. Катодная коррозия и анодная защита наблюдаются давно. Возможна ли катодная защита в данной системе, должно быть установлено экспериментально. Диаграмма потенциал-pH для Fe гораздо более благоприятна для катодной защиты. (авт.)
- Авторов:
- Грут, С
- Дата публикации:
- Исследовательская организация:
- Knolls Atomic Power Lab, Скенектади, Нью-Йорк,
- Идентификатор ОСТИ:
- 4749297
- Номер(а) отчета:
- ТИД-17913
- Номер АНБ:
- НСА-17-014772
- Номер контракта с Министерством энергетики:
- W-31-109-ENG-52
- Тип ресурса:
- Технический отчет
- Отношение ресурсов:
- Прочая информация: ориг.
 Дата получения: 31-DEC-63
Дата получения: 31-DEC-63
- Страна публикации:
- США
- Язык:
- Английский
- Тема:
- МЕТАЛЛЫ, КЕРАМИКА И ПРОЧИЕ МАТЕРИАЛЫ; КИСЛОТНОСТЬ; КИСЛОТЫ; АЛЮМИНИЙ; АНОДЫ; КАТОДА; ЗАЩИТА ОТ КОРРОЗИИ; ДИАГРАММЫ; ЭЛЕКТРИЧЕСКИЙ ПОТЕНЦИАЛ; ЖЕЛЕЗО; МЕТАЛЛЫ; РЕШЕНИЯ
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Гроот, К. КАТОДНАЯ ЗАЩИТА АМФОТЕРНЫХ МЕТАЛЛОВ . США: Н. П., 1962.
Веб.
Копировать в буфер обмена
Гроот, К. КАТОДНАЯ ЗАЩИТА АМФОТЕРНЫХ МЕТАЛЛОВ .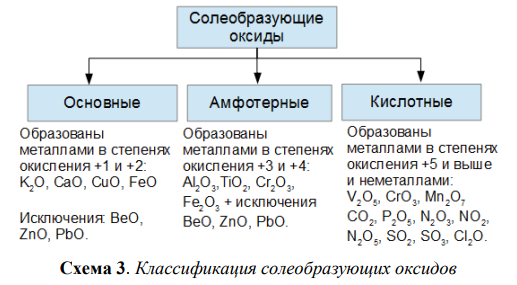 Соединенные Штаты.
Соединенные Штаты.
Копировать в буфер обмена
Грут, К. 1962.
"КАТОДНАЯ ЗАЩИТА АМФОТЕРНЫХ МЕТАЛЛОВ". Соединенные Штаты.
Копировать в буфер обмена
@статья{osti_4749297,
title = {КАТОДНАЯ ЗАЩИТА АМФОТЕРНЫХ МЕТАЛЛОВ},
автор = {Groot, C},
abstractNote = {Катодная защита определяется потенциалом. Амфотерные металлы определяются растворимостью оксида в зависимости от рН. Катодная защита амфотерных металлов обсуждается с точки зрения диаграмм потенциал-pH. Показана возможность катодной защиты Al в растворах кислот, катодной коррозии в щелочных растворах. Катодная коррозия и анодная защита наблюдаются давно. Возможна ли катодная защита в данной системе, должно быть установлено экспериментально. Диаграмма потенциал-pH для Fe гораздо более благоприятна для катодной защиты.

 H2SiO3)
H2SiO3) е 5щ. и 3щ.з. Ме
е 5щ. и 3щ.з. Ме Дата получения: 31-DEC-63
Дата получения: 31-DEC-63