Помогите, пожалуйста, решить задачу на смеси : Химия
Сообщения без ответов | Активные темы | Избранное
| acme |
| ||
18/01/11 |
| ||
| |||
| dr_alex |
| ||
31/03/11 |
| ||
|
| |||
| Tlalok |
| |||
14/03/10 |
| |||
| ||||
| dr_alex |
| ||
31/03/11 |
| ||
| |||
| Tlalok |
| |||
14/03/10 Одесса, Украина |
| |||
| ||||
| alisaV. |
| ||
05/04/11 |
| ||
| |||
| PAV |
| |||||
29/07/05 |
| |||||
| ||||||
| Показать сообщения за: Все сообщения1 день7 дней2 недели1 месяц3 месяца6 месяцев1 год Поле сортировки АвторВремя размещенияЗаголовокпо возрастаниюпо убыванию |
| Страница 1 из 1 | [ Сообщений: 7 ] |
Модераторы: photon, Toucan, Супермодераторы
Кто сейчас на конференции |
Сейчас этот форум просматривают: нет зарегистрированных пользователей |
| Вы не можете начинать темы Вы не можете отвечать на сообщения Вы не можете редактировать свои сообщения Вы не можете удалять свои сообщения Вы не можете добавлять вложения |
| Найти: |
Карбонат натрия (Na2CO3) структура, использование и свойства / химия | Thpanorama
карбонат натрия (Na2Колорадо3) Это неорганическая соль натрия, щелочного металла и углекислоты. Он также известен во всем мире как кальцинированная сода. Озера и вулканическая деятельность обогатили почвы натрием, из которого растения питались; затем, после пожара, эти растения разбросали карбонатный пепел.
Он также известен во всем мире как кальцинированная сода. Озера и вулканическая деятельность обогатили почвы натрием, из которого растения питались; затем, после пожара, эти растения разбросали карбонатный пепел.
Как возникает эта соль металлического натрия? Чистый натрий имеет валентную конфигурацию [Ne] 3s1. Электрон 3s орбитали1 он легко выделяется другими элементами природы (такими как сера, кислород, хлор, фтор и т. д.), образуя минеральные соединения, в которых участвует стабильный ион Na+.
На+ это сопровождается другими ионными разновидностями в этих твердых телах; Из них карбонат натрия является еще одним присутствующим в природе. С тех пор он использовался во всех цивилизациях на протяжении веков. Эти цивилизации находили в этой серовато-белой пыли полезные свойства для своих домов и людей..
Эти свойства отметили их использование, которые сегодня поддерживают традиционные аспекты прошлого, а другие адаптированы к текущим потребностям.
Карбонат натрия очень распространен в природе и, возможно, также на других территориях за пределами планеты Земля, таких как некоторые из спутников Солнечной системы..
индекс
- 1 Формула
- 2 Структура
- 3 использования
- 4 Как это сделать??
- 5 свойства
- 6 Ссылки
Химическая формула карбоната натрия Na2Колорадо3. Как это интерпретируется? Это означает, что в кристаллическом твердом теле для каждого иона СО32- Есть два иона Na+.
структураНа верхнем изображении представлена структура Na2Колорадо3 ангидрид (также называемый кальцинированной содой). Фиолетовые сферы соответствуют ионам Na+, в то время как черный и красный для ионов CO32-.
Карбонат-ионы имеют плоскую тригональную структуру с атомами кислорода в своих вершинах.
Изображение дает панораму, видимую с более высокой плоскости. Na-ионы+ они окружены шестью атомами кислорода, исходящими от ионов СО32-. То есть в На2Колорадо3 Ангидрид натрия соответствует октаэдрической координационной геометрии (он заключен в центр октаэдра).
Na-ионы+ они окружены шестью атомами кислорода, исходящими от ионов СО32-. То есть в На2Колорадо3 Ангидрид натрия соответствует октаэдрической координационной геометрии (он заключен в центр октаэдра).
Однако эта структура также способна содержать молекулы воды, взаимодействующие водородными связями с вершинами треугольников..
На самом деле, гидраты Na2Колорадо3 (Na2Колорадо3· 10H2О, На2Колорадо3· 7Н2О, На2Колорадо3· H2Или и другие) более распространены, чем безводная соль.
Термонатрит (Na2Колорадо3· H2О) натрон (Na2Колорадо3· 10H2О) и стульчик (Na3(HCO3) (CO3) · 2H2Или они являются основными природными источниками карбоната натрия, особенно минерала трона, представленного на первом изображении.
Карбонат натрия выполняет многочисленные функции в людях, домах и на производстве, в число которых входят следующие:
— Карбонат натрия используется во многих чистящих средствах. Это связано с его дезинфицирующей способностью, способностью растворять жиры и свойством умягчать воду. Он входит в состав моющих средств, используемых в прачечных, автоматических посудомоечных машинах, очистителях стекла, пятновыводителях, отбеливателях и т. Д..
— Карбонатное дезинфицирующее средство можно использовать на твердых, не шероховатых поверхностях, таких как полы, стены, фарфор и ванны, за исключением стекловолокно и алюминий, который может быть поцарапан этим.
— Он используется в некоторых продуктах, чтобы предотвратить спекание, которое может произойти в этих.
— Он присутствует в различных продуктах личной гигиены, таких как жемчужные ванны, зубные пасты и мыло.
— Используется в стекольной промышленности благодаря способности разлагать силикаты. .
.
— Используется для обслуживания бассейнов, где выполняет дезинфицирующую функцию и функцию регулирования pH..
— У людей он используется терапевтически при лечении кислотности и дерматита..
— В ветеринарной медицине его применяют при лечении стригущего лишая и очищении кожи.
Как это сделать??Карбонат натрия может быть изготовлен с использованием рассола из морей и известняка (CaCO3) в процессе Сольве. На верхнем изображении показана схема процесса с указанием маршрутов производства, а также реагентов, посредников и продуктов. Реагенты написаны зелеными буквами, а продукты — красными буквами..
Наблюдение за этими реакциями может быть немного сложным, но глобальное уравнение, которое указывает только на реагенты и продукты:
2NaCl (водн.) + CaCO3(S), не доступно2Колорадо3(s) + CaCl2(Aq)
CaCO3 Он имеет очень стабильную кристаллическую структуру, поэтому для его разложения на CO постоянно требуется много энергии. 2. Кроме того, этот процесс генерирует большое количество CaCl2 (хлорид кальция) и другие примеси, выбросы которых влияют на качество воды и окружающую среду.
2. Кроме того, этот процесс генерирует большое количество CaCl2 (хлорид кальция) и другие примеси, выбросы которых влияют на качество воды и окружающую среду.
Существуют также другие способы производства карбоната натрия в промышленных условиях, такие как процессы Хоу и Лебланк..
В настоящее время его можно получить из его природных минералов, так как трона является наиболее распространенным из них..
С другой стороны, наиболее традиционным методом было выращивание и сжигание растений и водорослей, богатых натрием. Затем пепел омывали водой и нагревали до получения продукта. Отсюда возник знаменитый пепел соды.
свойстваНа2Колорадо3 представляет собой гигроскопичное белое твердое вещество без запаха, с молекулярной массой 106 г / моль и плотностью 2,54 г / мл при 25 ° C.
Его свойства изменяются, поскольку он включает молекулу воды в свою кристаллическую структуру. Поскольку вода может образовывать водородные мостики, а ионы «открывают пространство» между ними, объем кристалла увеличивается, а плотность гидрата уменьшается.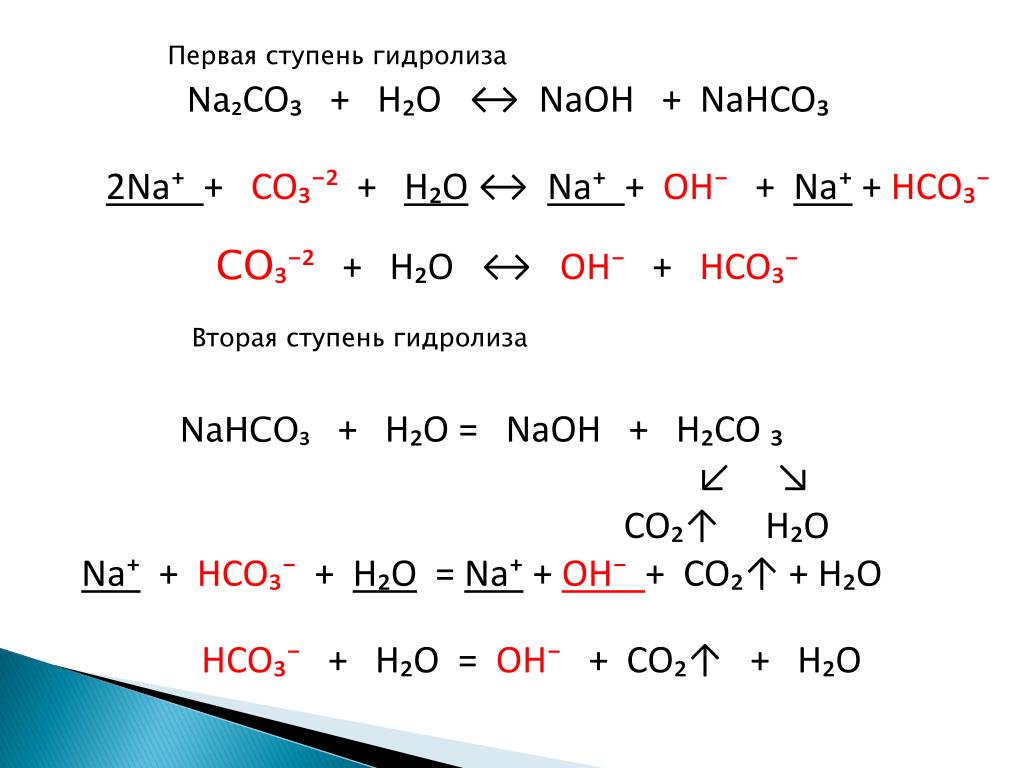 Например, для Na2Колорадо3· 10H2Или его плотность составляет 1,46 г / мл..
Например, для Na2Колорадо3· 10H2Или его плотность составляет 1,46 г / мл..
На2Колорадо3 плавится при 851 ° C, разлагается в соответствии со следующим уравнением:
не доступно2Колорадо3(s) => Na2O (s) + CO2(G)
Опять же, несмотря на то, что ионы СО32- и на+ Они отличаются по размерам, их электростатические взаимодействия очень эффективны и поддерживают стабильную кристаллическую сеть.
Молекулы воды «препятствуют» этим взаимодействиям, и в результате гидраты более подвержены разложению, чем ангидрид..
Это основная соль; растворение в воде приводит к образованию раствора с рН выше 7. Это связано с гидролизом СО32-, чья реакция высвобождает ОН— в середине:
Колорадо32-(ac) + H2O (l) HCO3—(ac) + OH—(Aq)
Он очень хорошо растворяется в воде и в полярных растворителях, таких как глицерин, глицерин, ацетон, ацетаты и жидкий аммиак. .
.
- Дрожь и Аткинс. (2008). Неорганическая химия В Элементы группы 1. (Четвертое издание, стр. 265). Mc Graw Hill.
- scifun.org. (2018). Карбонат натрия и карбонат натрия. Получено 8 апреля 2018 г. с сайта scifun.org.
- Wikipedia. (2018). Карбонат натрия. Получено 8 апреля 2018 г. с сайта en.wikipedia.org
- PubChem. (2018). Карбонат натрия. Получено 8 апреля 2018 г. из: pubchem.ncbi.nlm.nih.gov
- Ciner Resources Corporation. (2018). Кальцинированная сода Получено 8 апреля 2018 г. с сайта: ciner.us.com
- Qniemiec. (7 мая 2010 г.) Solvay процесс. [Рисунок]. Получено с: Wikimedia.org
- Пельтье К. (3 июля 2018 г.). Все, что вам нужно знать о карбоните натрия. Получено 8 апреля 2018 г. с сайта thespruce.com
- Net Industries. (2018). Карбонат натрия — Использование карбоната натрия. Получено 8 апреля 2018 г. с сайта: science.jrank.org
неорганическая химия — Что означает n(Na2CO3)?
$\begingroup$
В моей книге $n(\ce{Na2CO3})$ используется для обозначения количества молей $\ce{Na2CO3}$ без каких-либо пояснений. Известно ли химикам, что $n(\ce{Na2CO3})$ обозначает количество молей $\ce{Na2CO3}$?
Известно ли химикам, что $n(\ce{Na2CO3})$ обозначает количество молей $\ce{Na2CO3}$?
- неорганическая химия
- физико-химия
- термодинамика
- стехиометрия
$\endgroup$
0
$\begingroup$
Да, стандартизированный символ количества в соответствии с ISO 80000-9:2009 Величины и единицы. Часть 9: Физическая химия и молекулярная физика Зеленая книга) для количество вещества составляет $n$.
Величина «количество вещества» не может называться «количеством молей», равно как и величина «масса» не может называться «количеством килограммов». В названии «количество вещества» слова «вещества» можно для простоты заменить словами, указывающими на вещество, о котором идет речь в любом конкретном применении, так что можно, например, говорить о «количестве хлороводорода», или «количество бензола».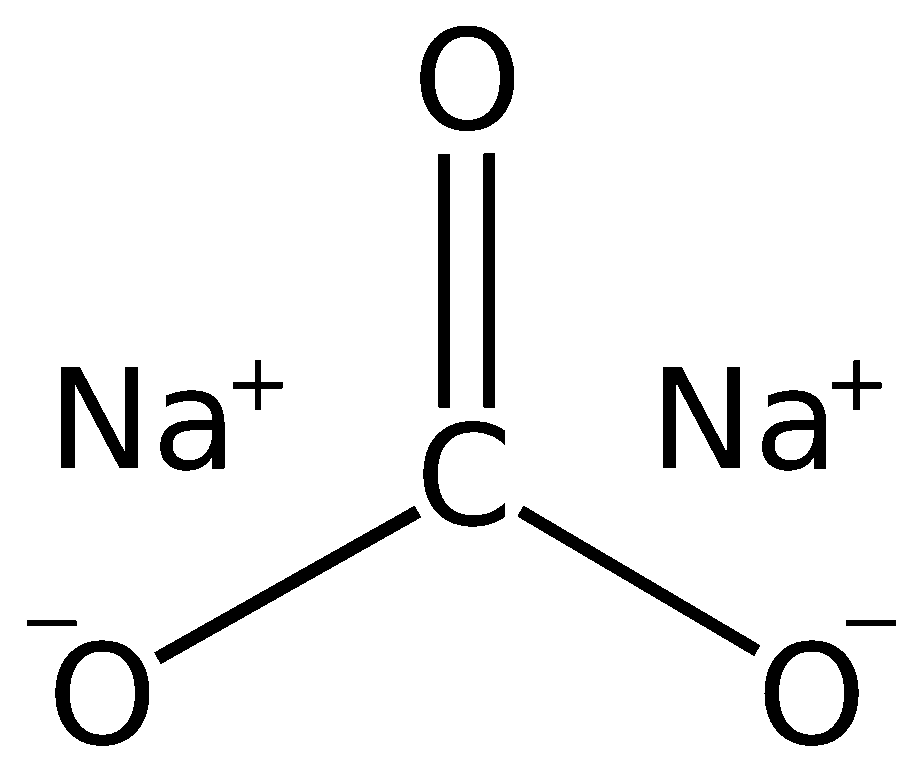 Хотя слово «количество» имеет более общее словарное определение, эта аббревиатура полного названия «количество вещества» может быть использована для краткости.
Хотя слово «количество» имеет более общее словарное определение, эта аббревиатура полного названия «количество вещества» может быть использована для краткости.
Таким образом, $n(\ce{Na2CO3})$ будет называться количеством карбоната натрия.
$\endgroup$
$\begingroup$
Вам непонятно, если вас смущает само $n$ или особое обозначение $n(\ce{Na2CO3})$
$n$ широко принято для обозначения количества вещества, выраженного в молях, как @ Лунг, ИЮПАК и Википедия говорят.
Если $n$ означает количество определенного вещества, например, $\ce{He}$ или $\ce{h3O}$, его часто записывают в форме индекса, например, $n_{\ce{He}}$ или $ n_{\ce{h3O}}$.
Несколько уровней подстрочных и надстрочных индексов часто вызывают типографские трудности. По этим причинам вместо ввода $n_{\ce{Na2CO3}}$ некоторые могут предпочесть вместо этого $n(\ce{Na2CO3})$.
Это не официальная рекомендация, и менее спорной может быть замена каким-либо заполнителем.
Я часто думаю, что термин количество вещества был выбран довольно неудачно, так как при совпадении с менее научными областями этот термин можно спутать с первичным пониманием составляет на обычном языке с очень расплывчатым значением.
$\endgroup$
6
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.


 03.2011, 23:00
03.2011, 23:00 

 е. нерастворимое вещество.
е. нерастворимое вещество. 03.2011, 23:59
03.2011, 23:59  04.2011, 05:24
04.2011, 05:24 