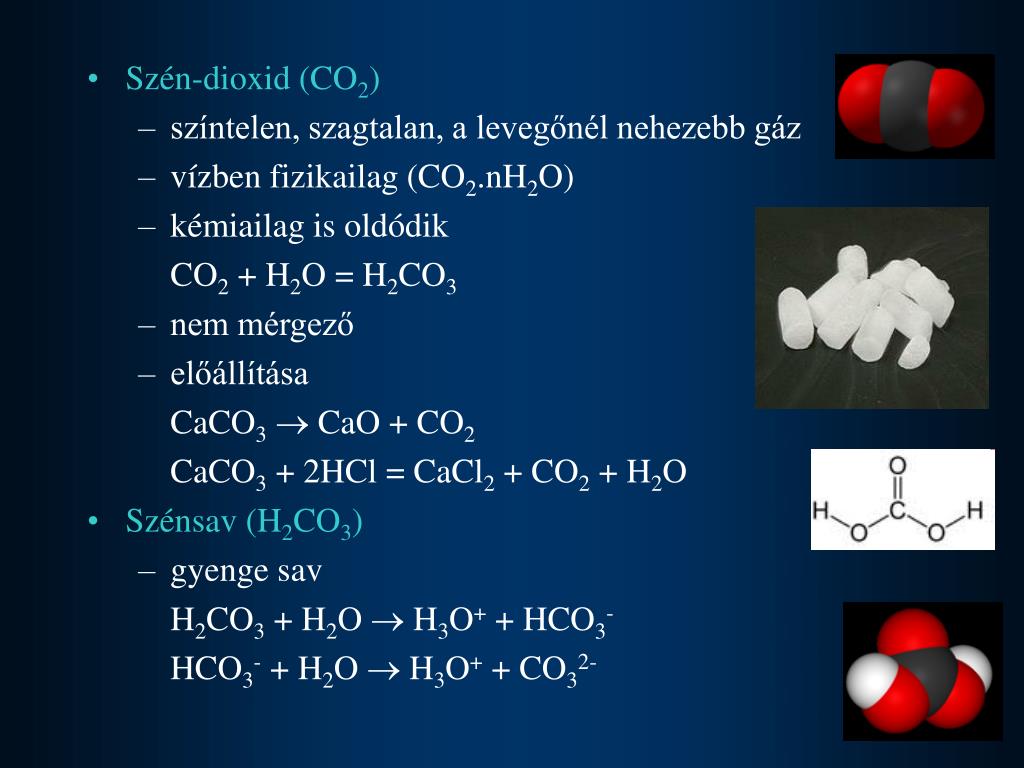
Углекислота (h3CO3) свойства, использование и значение / химия | Thpanorama
углекислота, ранее называемая воздушной кислотой или воздушной кислотой, она является единственной неорганической кислотой углерода и имеет формулу h3CO3.
Соли карбоновых кислот называются бикарбонатами (или гидрокарбонатами) и карбонатами (База данных метаболома человека, 2017). Его структура представлена на рисунке 1 (EMBL-EBI, 2016).
Говорят, что углекислота образуется из углекислого газа и воды. Углекислота встречается только через соли (карбонаты), соли кислот (гидрокарбонаты), амины (карбаминовая кислота) и хлориды кислот (карбонилхлорид) (MeSH, 1991).
Соединение не может быть выделено в виде чистой или твердой жидкости, поскольку продукты его разложения, углекислый газ и вода, намного более стабильны, чем кислота (Royal Society of Chemistry, 2015).
Углекислота находится в организме человека, CO2, присутствующий в крови, соединяется с водой, образуя углекислоту, которая затем выделяется легкими в виде газа.
Это также найдено в скалах и пещерах, где известняки могут быть растворены. h3CO3 также можно найти в угле, метеоритах, вулканах, кислотных дождях, подземных водах, океанах и растениях (формула углекислоты, S.F.).
индекс
- 1 Углекислота и карбонатные соли
- 2 «Гипотетический» углекислый газ и водная кислота
- 3 Физические и химические свойства
- 4 использования
- 5 Важность
- 6 Ссылки
Углекислота образуется в небольших количествах, когда ее ангидрид, углекислый газ (CO2), растворяется в воде.
CO2 + h3O ⇌ h3CO3
Преобладающими видами являются просто гидратированные молекулы CO2. Можно считать, что угольная кислота является дипротоновой кислотой, из которой могут образовываться две серии солей, а именно гидрокарбонаты или бикарбонаты, содержащие HCO3-, и карбонаты, содержащие CO32.-.
h3CO3 + h3O ⇌ h4O + + HCO3-
HCO3- + h3O ⇌ h4O + + CO32-
Однако кислотно-основное поведение углекислоты зависит от различных скоростей некоторых участвующих реакций, а также от ее зависимости от рН системы.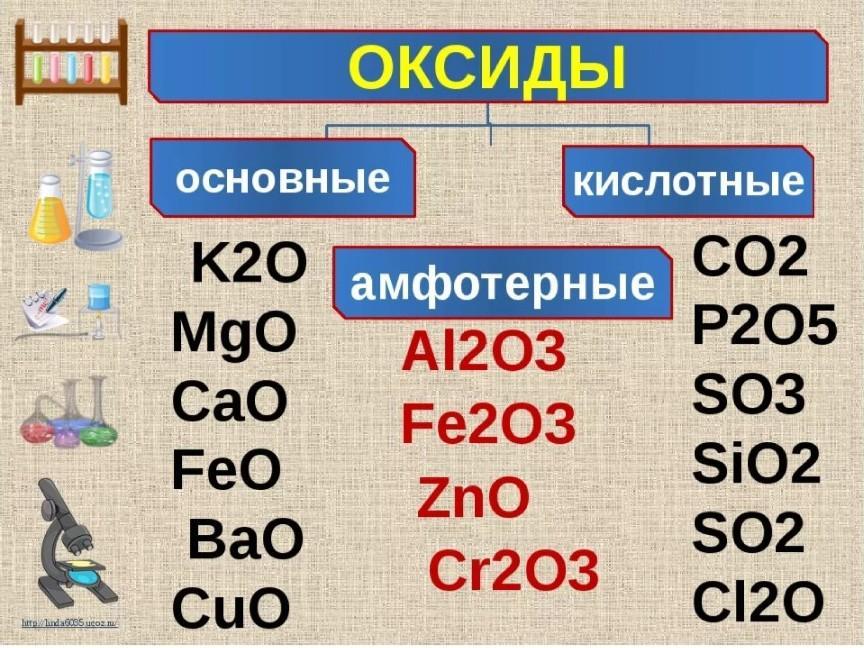 Например, при pH ниже 8 основными реакциями и их относительной скоростью являются следующие:
Например, при pH ниже 8 основными реакциями и их относительной скоростью являются следующие:
- CO2 + h3O ⇌ h3CO3 (медленно)
- h3CO3 + OH- ⇌ HCO3- + h3O (быстро)
При pH выше 10 важны следующие реакции:
- CO2 + OH- ⇌ HCO3- (медленно)
- HCO3- + OH- ⇌ CO32- + h3O (быстро)
При значениях рН от 8 до 10 все вышеуказанные равновесные реакции являются значительными (Zumdahl, 2008).
«Гипотетическая» углекислота и водная кислотаДо относительно недавнего времени ученые были убеждены, что углекислота не существует как стабильная молекула..
В журнале Angewandte Chemie немецкие исследователи представили простой пиролитический метод получения газофазной углекислоты, который позволил провести спектроскопическую характеристику газофазной углекислоты и ее монометилового эфира (Angewandte Chemie International Edition, 2014)..
Углекислота существует только в течение небольшой доли секунды, когда углекислый газ растворяется в воде, прежде чем он станет смесью протонов и бикарбонат-анионов. .
.
Однако, несмотря на свою короткую жизнь, углекислота оказывает длительное воздействие на атмосферу и геологию Земли, а также на организм человека..
Из-за короткого срока службы детальная химия углекислоты была завуалирована тайной. Исследователи, такие как Berkeley Lab. И Калифорнийский университет в Калифорнии (UC), помогают поднять эту завесу через серию уникальных экспериментов..
В своем последнем исследовании они показали, как молекулы газообразного диоксида углерода сольватируются водой, чтобы инициировать химию переноса протона, которая производит углекислоту и бикарбонат (Yarris, 2015).
В 1991 году ученым из Центра космических полетов имени Годдарда (США) НАСА удалось получить твердые образцы h3CO3. Они сделали это, подвергая замороженную смесь воды и углекислого газа воздействию высокоэнергетического протонного излучения, а затем нагревая ее, чтобы удалить избыток воды..
Оставшаяся углекислота характеризовалась инфракрасной спектроскопией. Тот факт, что углекислота была приготовлена облучением твердой смеси h3O + CO2 или даже облучением только сухого льда.
Это привело к предположениям, что h3CO3 можно найти в космическом пространстве или на Марсе, где можно найти мороженое h3O и CO2, а также космические лучи (Ханна, 1991)..
Физико-химические свойстваУглекислота существует только в водном растворе. Не удалось выделить чистое соединение. Это решение легко узнаваемо, потому что оно имеет газообразный диоксид углерода, выделяющийся из водной среды..
Он имеет молекулярную массу 62,024 г / моль и плотность 1668 г / мл. Углекислота является слабой и нестабильной кислотой, которая частично диссоциирует в воде на ионы водорода (H +) и бикарбонат-ионы (HCO3-), чья pKa составляет 3,6.
Будучи дипротоновой кислотой, она может образовывать соли двух типов: карбонаты и бикарбонаты. Добавление основания к избытку углекислоты дает соли бикарбоната, в то время как добавление основания к углекислоте дает соли карбоната (Национальный центр биотехнологической информации., 2017).
Углекислота не считается токсичной или опасной и присутствует в организме человека. Однако воздействие высоких концентраций может вызвать раздражение глаз и дыхательных путей..
Однако воздействие высоких концентраций может вызвать раздражение глаз и дыхательных путей..
По словам Мишель Макгуайр в Науки о питании иУглекислота содержится в сброженных продуктах в виде отходов, образующихся в результате бактерий, которые питаются разлагающимися продуктами..
Газовые пузырьки, образующиеся в пище, обычно являются углекислым газом углекислоты и признаком того, что пища бродит. Примерами обычно употребляемых ферментированных продуктов являются соевый соус, суп мисо, квашеная капуста, корейское кимчи, темпе, кефир и йогурт.
Ферментированные зерна и овощи также содержат полезные бактерии, которые могут контролировать потенциально патогенные микроорганизмы в кишечнике и улучшать выработку витаминов B-12 и K.
Углекислота, раствор диоксида углерода или дигидрокарбонат образуются в процессе карбонизации воды. Он отвечает за шипучий аспект безалкогольных и безалкогольных напитков, как указано в словаре пищевой науки и технологии.
Углекислота способствует высокой кислотности соды, но содержание рафинированного сахара и фосфорной кислоты является основной причиной указанной кислотности (DUBOIS, 2016).
Углекислота также используется во многих других областях, таких как фармацевтика, косметика, удобрения, пищевая промышленность, анестетики и т. Д..
важностьУглекислота обычно содержится в водах океанов, морей, озер, рек и дождей, потому что она образуется, когда широко распространенный в атмосфере углекислый газ вступает в контакт с водой..
Он даже присутствует во льду ледников, хотя и в меньших количествах. Углекислота является очень слабой кислотой, хотя со временем она может способствовать эрозии.
Увеличение содержания углекислого газа в атмосфере привело к образованию большего количества углекислого газа в океанах и, отчасти, является причиной небольшого повышения кислотности океанов за последние сто лет..
Углекислый газ, продукт клеточного метаболизма, содержится в тканях в относительно высоких концентрациях. Он диффундирует в крови и попадает в легкие, которые удаляются выдыхаемым воздухом..
Он диффундирует в крови и попадает в легкие, которые удаляются выдыхаемым воздухом..
Углекислый газ гораздо более растворим, чем кислород, и легко диффундирует в эритроциты. Реагирует с водой с образованием углекислоты, которая при щелочном рН крови появляется в основном в виде бикарбоната (Robert S. Schwartz, 2016).
Углекислый газ попадает в кровь и ткани, потому что его местное парциальное давление превышает его парциальное давление в крови, которая течет через ткани. Когда диоксид углерода попадает в кровь, он соединяется с водой, образуя углекислоту, которая диссоциирует на ионы водорода (H +) и бикарбонат-ионы (HCO3-)..
Естественное превращение диоксида углерода в углекислоту является относительно медленным процессом. Тем не менее, карбоангидраза, белковый фермент, присутствующий в эритроцитах, катализирует эту реакцию достаточно быстро, чтобы она достигалась всего за доли секунды..
CO2 + h3O ⇌ h3CO3
Поскольку фермент присутствует только внутри эритроцитов, бикарбонат накапливается в эритроцитах в гораздо большей степени, чем в плазме. .
.
Способность крови транспортировать углекислый газ в виде бикарбоната усиливается ионной транспортной системой в мембране эритроцитов, которая одновременно вытесняет бикарбонатный ион из клетки в плазму в обмен на хлорид-ион.
Одновременный обмен этими двумя ионами, известный как хлоридный обмен, позволяет использовать плазму в качестве места хранения бикарбоната без изменения электрического заряда плазмы или эритроцитов..
Только 26 процентов от общего содержания углекислого газа в крови существует в виде бикарбоната внутри эритроцитов, в то время как 62 процента присутствует в плазме в виде бикарбоната; однако большинство бикарбонат-ионов сначала образуется внутри клетки, а затем транспортируется в плазму..
Обратная последовательность реакций происходит, когда кровь достигает легких, где парциальное давление углекислого газа ниже, чем в крови. Реакция, катализируемая карбоангидразой, переворачивается в легких, где она превращает бикарбонат обратно в CO2 и позволяет его изгнать (Neil S. Cherniack, 2015).
Cherniack, 2015).
- Angewandte Chemie International Edition. (2014, 23 сентября). Углекислота — и все же она существует! Получено с chemviews.org.
- Углекислота Формула. (S.F.). Восстановлено от softschools.com.
- Дюбуа, С. (2016, 11 января). Углекислота в продуктах питания. Получено с livestrong.com.
- EMBL-EBI. (2016, 27 января). углекислота Восстановлено с ebi.ac.uk.
- База данных метаболома человека. (2017, 2 марта). Углекислота. Получено с hmdb.ca.
- Ханна М. М. (1991). Инфракрасные и масс-спектральные исследования протонно-облученного льда h3O + CO2: доказательства наличия углекислоты. Spectrochimica Acta Part A: Молекулярная спектроскопия, том 47, выпуск 2, 255-262. Получено с сайта science.gsfc.nasa.gov.
- (1991). Углекислота Получено от ncbi.nlm.nih.
- Национальный центр биотехнологической информации … (2017, 11 марта). База данных PubChem Compound; CID = 767. Получено из pubchem.ncbi.nlm.nih.
 gov.
gov. - Neil S. Cherniack, e. а. (2015, 20 марта). Дыхание человека Восстановлено с britannica.com.
- Роберт С. Шварц, К. Л. (2016, 29 апреля). Кровь. Восстановлено с britannica.com.
- Королевское химическое общество. (2015). Углекислота. Получено с: chemspider.com.
- Яррис Л. (2015, 16 июня). Раскрытие тайн угольной кислоты. Получено с: newscenter.lbl.gov.
- Zumdahl, S.S. (2008, 15 августа). Оксикислоты. Получено с: britannica.com.
|
Заглавная страница
КАТЕГОРИИ: Археология ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрации Техника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ? Влияние общества на человека Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. |
⇐ ПредыдущаяСтр 8 из 14Следующая ⇒
При поступлении в кровь более сильной кислоты, чем угольная, ионы бикарбоната натрия взаимодействуют с ней, происходит реакция обмена и образуется соответствующая соль и угольная кислота. NaНСО3 + Н-Анион > h3CO3 + Na+ + Анион– При поступлении оснований они реагируют с угольной кислотой и образуют соли бикарбонатов: h3CO3 + Катион-ОН > Катион+ + HCO3– + Н2О Возникающий при этом дефицит угольной кислоты компенсируется уменьшением выделения CO2 легкими (и в этот момент мы сами не замечаем как задерживаем дыхание на какое-то время. (и тоже, получается, сто очков в плюс к дыхательной практике, ведь если легкие работают не на полный объем — как это у нас столь распространено — СО2 выделяется не в полном объеме, и эффективность работы этого важнейшего буфера существенно снижается. ALG) Кроме эритроцитов, значительная активность карбоангидразы отмечена в эпителии почечных канальцев, клетках слизистой оболочки желудка, коре надпочечников и клетках печени, в незначительных количествах – в центральной нервной системе, поджелудочной железе и других органах.
Первое соединение слабо диссоциирует и ведет себя как слабая кислота, второе обладает щелочными свойствами. HPO42– + Н-Анион > h3PO4– + Анион– При поступлении оснований избыток ОН– групп нейтрализуется имеющимися в среде Н+, а расход ионов Н+ восполняется повышением диссоциации Nah3PO4. h3PO4– + Катион-ОН > Катион+ + HPO42– + Н2О Основное значение фосфатный буфер имеет для регуляции pH интерстициальной жидкости и мочи. Na2HPO4 + Н2СО3 > Nah3PO4 + NaНСО3 Кислотно-основная реакция мочи зависит только от содержания дигидрофосфата, т.к. бикарбонат натрия в почечных канальцах реабсорбируется.
Белки плазмы, в первую очередь альбумин, играют роль буфера благодаря своим амфотерным свойствам.
Пара ННb/ННbО2 является основной в работе гемоглобинового буфера. Присоединение ионов водорода к остатку гистидина дезоксигемоглобина выглядит так:
⇐ Предыдущая3456789101112Следующая ⇒ Читайте также: Алгоритмические операторы Matlab Конструирование и порядок расчёта дорожной одежды Исследования учёных: почему помогают молитвы? Почему терпят неудачу многие предприниматели? |
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 196; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia. |
Формула соли угольной кислоты. Химическая формула h3CO3 Вид молекулы Общие сведения Угольная кислота́ слабая двухосновная кислота. В чистом виде не выделена. Образуется в малых количествах
Чем больше человек узнает об окружающем его мире, тем больше осознает ограниченность и несовершенство своих знаний. Возьмем, к примеру, газированную воду. Как известно, данный напиток отличается от других тем, что в нем содержится в небольших дозах угольная кислота, которая сразу же начинает распадаться, как только мы открутим пробку на бутылке. Поэтому у нас не вызывает сомнений утверждение в учебнике химии о том, что данное вещество является крайне неустойчивым. В газовой фазе оно очень быстро превращается в смесь обычной воды и привычного углекислого газа. Однако, как показали последние исследования, с этим вполне можно поспорить.
Что такое угольная кислота?
Формула этого химического соединения выглядит довольно просто: Н 2 СО 3 . Наличие двух атомов водорода указывает на то, что эта кислота является двухосновной, а ее неустойчивость говорит о ее слабости. Как известно, в воде происходит диссоциация кислот, и рассматриваемое соединение не подпадает под исключение. Впрочем, здесь есть одна особенность: из-за наличия двух оснований данный процесс происходит в два этапа:
H 2 СО 3 ↔ Н + + НСО 3 — ,
НСО 3 — ↔ Н + + СО3 2- .
При взаимодействии с сильным основанием угольная кислота образовывает нормальные или кислые карбонаты. Последние отличаются тем, что у них замещается не два, а всего лишь один атом водорода. Ярким примером нормального карбоната является стиральная сода (Na 2 CO 3), а роль образца гидрокарбоната может играть пищевая сода (NaHCO 3).
Что удалось обнаружить ученым?
При протонировании безводного бикарбоната калия (КНСО 3) при температуре -110 o C водород выбивает атом К. В результате получается очень чистая угольная кислота. Позже был найден еще более легкий способ — нагрев в вакууме NH 4 HCO 3 . В результате такого разложения бикарбоната аммония выделяется аммоний и формируется безводная угольная кислота. Последняя проявляет удивительную стабильность при сублимации в вакууме. Когда ученые начали исследовать данный парадокс, оказалось, что причина кроется в значении энергетического барьера. Для безводного соединения Н 2 СО 3 он составляет 44 ккал/моль, а когда есть вода, его величина оказывается почти в два раза ниже — 24 ккал/моль. Так что при соответствующих условиях угольная кислота вполне может пребывать в свободном виде. Впрочем, данное открытие интересно не только с точки зрения теории химии. Его практическая ценность в том, что оно позволило по-новому изучить процесс дыхания. Теперь ученые считают, что формирование в живом организме угольной кислоты ускоряется при помощи особого фермента, и как раз это и позволяет быстро удалять углекислый газ из клеток сначала в кровь, а затем в легкие.
В результате получается очень чистая угольная кислота. Позже был найден еще более легкий способ — нагрев в вакууме NH 4 HCO 3 . В результате такого разложения бикарбоната аммония выделяется аммоний и формируется безводная угольная кислота. Последняя проявляет удивительную стабильность при сублимации в вакууме. Когда ученые начали исследовать данный парадокс, оказалось, что причина кроется в значении энергетического барьера. Для безводного соединения Н 2 СО 3 он составляет 44 ккал/моль, а когда есть вода, его величина оказывается почти в два раза ниже — 24 ккал/моль. Так что при соответствующих условиях угольная кислота вполне может пребывать в свободном виде. Впрочем, данное открытие интересно не только с точки зрения теории химии. Его практическая ценность в том, что оно позволило по-новому изучить процесс дыхания. Теперь ученые считают, что формирование в живом организме угольной кислоты ускоряется при помощи особого фермента, и как раз это и позволяет быстро удалять углекислый газ из клеток сначала в кровь, а затем в легкие.
Данным открытием также не преминули воспользоваться астрономы: свободное состояние углекислоты позволило им провести ее спектральный анализ, и теперь это соединение можно будет идентифицировать в атмосфере окружающих нас планет. Все это наводит на мысль о том, что в мире еще полно различных тайн и секретов. Похоже, современные учебники не раз придется переписывать, уточняя старые и открывая новые знания.
Общие сведения Угольная кислота́ слабая двухосновная кислота. В чистом виде не выделена. Образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Разложение При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
При кипении раствора угольная кислота разлагается полностью:
Получение Угольная кислота образуется при растворении в воде диоксида углерода. Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа. Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода
Применение Угольная кислота всегда присутствует в водных растворах углекислого газа (газированная вода). В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора
Органические производные Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот. Некоторые представители подобных соединений перечислены в таблице. Класс соединений Пример соединения Сложные эфиры поликарбонаты Хлорангидридыфосген Амидымочевина Нитрилыциановая кислота Ангидридыпироугольная кислота
В этом качестве она может образовывать все производные, характерные для карбоновых кислот. Некоторые представители подобных соединений перечислены в таблице. Класс соединений Пример соединения Сложные эфиры поликарбонаты Хлорангидридыфосген Амидымочевина Нитрилыциановая кислота Ангидридыпироугольная кислота
Оксид углерода (IV), угольная кислота и ее соли
Диоксид углерода СО 2 (углекислый газ) — при обычных условиях это газ без цвета и запаха, слегка кисловатого вкуса, тяжелее воздуха примерно в 1,5 раза, растворим в воде, достаточно легко сжижается (при комнатной температуре под давлением около 60 ∙ 10 5 Па его можно превратить в жидкость). При охлаждении до −56,2ºС жидкий диоксид углерода затвердевает и превращается в снегообразную массу.
Во всех агрегатных состояниях состоит из неполярных линейных молекул. Химическое строение молекулы СО 2 определяется sp-гибридизацией центрального атома углерода и образованием дополнительных π р-р -связей: О = С = О.
Некоторая часть растворенного в воле СО 2 взаимодействует с ней сообразованием угольной кислоты:
СО 2 + Н 2 О ↔ СО 2 ∙ Н 2 О ↔ Н 2 СО 3 .
Углекислый газ очень легко поглощается растворами щелочей с образованием карбонатов и гидрокарбонатов:
СО 2 + 2NaOH = Na 2 CO 3 + H 2 O; СО 2 + NaOH = NaHCO 3 .
Молекулы СО 2 очень устойчивы термически, распад начинается только при температуре 2000ºС. По этой причине диоксид углерода не горит и не поддерживает горения обычного топлива. Но в его атмосфере горят некоторые простые вещества, атомы которых проявляют большое сродство к кислороду, к примеру, магний при нагревании загорается в атмосфере СО 2 .
Угольная кислота H 2 CO 3 – соединение непрочное, существует только в водных растворах. Большая часть растворенного в воде углекислого газа находится в виде гидратированных молекул CO 2 , меньшая – образует угольную кислоту.
Водные растворы, находящиеся в равновесии с CO 2 атмосферы, являются кислыми: = 0,04 М и рН ≈ 4.
Угольная кислота – двухосновная, относится к слабым электролитам, диссоциирует ступенчато (К 1 = 4, 4 ∙ 10 −7 ; К 2 = 4, 8 ∙ 10 −11). При растворении CO 2 в воде устанавливается следующее динамическое равновесие:
H 2 O + CO 2 ↔ CO 2 ∙ H 2 O ↔ H 2 CO 3 ↔ H + + HCO 3 −
При нагревании водного раствора углекислого газа растворимость газа понижается, CO 2 выделяется из раствора, и равновесие смещается влево.
Будучи двухосновной, угольная кислота образует два ряда солей: средние соли (карбонаты) и кислые (гидрокарбонаты). Большинство солей угольной кислоты бесцветны. Из карбонатов растворимы в воде лишь соли щелочных металлов и аммония.
В воде карбонаты подвергаются гидролизу, и в связи с этим их растворы имеют щелочную реакцию:
Na 2 CO 3 + H 2 O ↔ NaHCO 3 + NaOH.
Дальнейший гидролиз с образованием угольной кислоты в обычных условиях практически не идет.
Растворение в воде гидрокарбонатов также сопровождается гидролизом, но в значительно меньшей степени, и среда создается слабощелочная (рН ≈ 8).
Карбонат аммония (NH 4) 2 CO 3 отличается большой летучестью при повышенной и даже при обычной температуре, особенно в присутствии паров воды, которые вызывают сильный гидролиз.
Сильные кислоты и даже слабая уксусная кислота вытесняют из карбонатов угольную кислоту:
K 2 CO 3 + H 2 SO 4 = K 2 SO 4 + H 2 O + CO 2 .
В отличие от большинства карбонатов, все гидрокарбонаты в воде растворимы. Οʜᴎ менее устойчивы, чем карбонаты тех же металлов и при нагревании легко разлагаются, превращаясь в соответствующие карбонаты:
2KHCO 3 = K 2 CO 3 + H 2 O + CO 2 ;
Ca(HCO 3) 2 = CaCO 3 + H 2 O + CO 2 .
Сильными кислотами гидрокарбонаты разлагаются, как и карбонаты:
KHCO 3 + H 2 SO 4 = KHSO 4 + H 2 O + CO 2
Из солей угольной кислоты наибольшее значение имеют карбонат натрия (сода), карбонат калия (поташ), карбонат кальция (мел, мрамор, известняк), гидрокарбонат натрия (питьевая сода) и основной карбонат меди (CuOH) 2 CO 3 (малахит).
Основные соли угольной кислоты в воде практически нерастворимы и при нагревании легко разлагаются:
(CuOH) 2 CO 3 = 2CuO + CO 2 + H 2 O.
Термическая устойчивость карбонатов зависит от поляризационных свойств ионов, входящих в состав карбоната. Чем больше поляризующее действие оказывает катион на карбонат-ион, тем ниже температура разложения соли. В случае если катион способен легко деформироваться, то карбонат-ион сам также будет оказывать поляризующее действие на катион, что приведет к резкому снижению температуры разложения соли.
Карбонаты натрия и калия плавятся без разложения, а большинство остальных карбонатов при нагревании разлагаются на оксид металла и углекислый газ:
MgCO 3 = MgO + CO 2 .
Оксид углерода (II)
Молекула СО имеет следующую структуру
: С≡ О:
Две связи образованы за счёт спаривания 2р-электронов атомов углерода и кислорода, третья связь образована по донорно-акцепторному механизму за счёт свободной 2р-орбитали углерода и 2р-электронной пары атома кислорода. Дипольный момент молекулы незначителен, при этом эффективный заряд на атоме углерода отрицательный, а на атоме кислорода – положительный.
Поскольку строение молекулы СО сходно со строением молекулы азота͵ похожи их физические свойства. СО имеет очень низкие температуры плавления (- 204ºС) и кипения (- 191,5ºС), это бесцветный, очень ядовитый газ, без запаха, совсем немного легче воздуха. Плохо растворим в воде, и с ней не взаимодействует.
СО считается несолеобразующим оксидом, т.к. при обычных условиях не взаимодействует ни с кислотами, ни со щелочами. Он образуется при горении угля и углеродистых соединений при ограниченном доступе кислорода, также при взаимодействии углекислого газа с раскаленным углем: СО 2 + С = 2СО.
В лаборатории его получают из мурвьиной кислоты действием на нее концентрированной серной кислоты при нагревании:
НСООН + H 2 SO 4 (конц.) = CO + H 2 SO 4 ∙ H 2 O.
Можно использовать также и щавелевую кислоту. Серная кислота в этих реакциях выступает как водоотнимающее средство.
В обычных условиях СО химически достаточно инертен, но при нагревании проявляет восстановительные свойства, что широко используется в пирометаллургии для получения некоторых металлов: Fe 2 O 3 + 3CO = 2Fe + 3CO 2 .
На воздухе СО горит голубоватым пламенем с выделением большого количества теплоты: 2СО + О 2 = 2СО 2 + 569 кДж.
Помимо кислорода на прямом солнечном свету или в присутствии катализатора (активного угля) СО соединяется с хлором, образуя фосген:
СО + Cl 2 = COCl 2 .
Фосген – бесцветный газ с характерным запахом. В воде он малорастворим, но как хлорангидрид угольной кислоты постепенно гидролизуется по схеме: COCl 2 + 2H 2 O = 2HCl + H 2 CO 3 . Вследствие высокой токсичности фосген применяли как боевое отравляющее средство в первую мировую войну. Обезвредить его можно с помощью гашеной извести.
При нагревании СО окисляется и серой: СО + S = COS.
Молекула СО может выступать в качестве лиганда в различных комплексных соединениях. За счёт несвязывающей электронной пары углерода она проявляет σ-донорные свойства, а за счёт свободных π-разрыхляющих орбиталей проявляет π-акцепторные свойства. Особый интерес представляют карбонильные комплексы d-металлов, т.к. термическим разложением карбонилов получают металлы высокой чистоты.
термическим разложением карбонилов получают металлы высокой чистоты.
Является ли h3CO3 сильной кислотой? – pH h3CO3
Углекислота – это двухосновная кислота, которая обозначается формулой h3CO3. Он представляет собой гидрид углекислого газа и разлагается при температуре выше -80°C.
Будучи дипротонным, он отвечает за образование двух типов солей, а именно. гидрокарбонаты (HCO3-) и карбонаты (CO3-2).
У многих учащихся возникают вопросы о кислотности h3CO3 (углекислоты), будь то сильная или слабая кислота.
Итак, в этой статье мы изучим кислотность h3CO3 и сообщим вам все основы.
Итак, угольная кислота — сильная кислота? Нет, h3CO3 не является сильной кислотой, так как полностью не диссоциирует в водном растворе. Молекула угольной кислоты имеет два атома водорода, которые нужно потерять, т. Е. Это двухосновная кислота и, следовательно, имеет две константы диссоциации кислоты, Ka. Значение константы диссоциации кислоты является отражением силы кислоты. Более высокое значение Ka указывает на более высокую силу кислоты.
Более высокое значение Ka указывает на более высокую силу кислоты.
Уравнения реакций вместе с их значениями Ka приведены ниже:
h3CO3(водн.) <=====> HCO3- + H+ Ka1 = 4,3 X 10–7 моль/л; pKa1 = 6,36 при 25°C
HCO3- <=====> CO3-2 + H+ Ka2 = 4,8 X 10–11 моль/л; pKa2 = 10,25 при 25°C
Из приведенных выше уравнений видно, что значение константы диссоциации кислоты очень низкое, а значение логарифмической константы для угольной кислоты выше, чем для сильных кислот.
В случае сильных кислот ожидается, что значение Ka достигнет бесконечности, а значение pKa должно быть ниже 2,9.0012
Следовательно, угольная кислота не является сильной кислотой. рН 0,1 М угольной кислоты составляет 3,68.
Почему угольная кислота является слабой кислотой?
Как обсуждалось в предыдущем разделе, угольная кислота сначала ионизируется в бикарбонат и протон, когда она растворяется в водном растворе.
Это означает, что ион бикарбоната в этой реакции работает как сопряженное основание для угольной кислоты.
Кроме того, хорошо известно, что ион бикарбоната является сильным сопряженным основанием и, следовательно, имеет тенденцию оставаться связанным со своим протоном, из-за чего молекулы кислоты лишь частично ионизуются в водном растворе.
Какой из них более кислый h3CO3 или Ch4COOH?
Как угольная, так и уксусная кислоты относятся к категории слабых кислот и не полностью ионизируются в водном растворе.
Однако, значение Ka для угольной кислоты составляет 4,3 X 10-7 моль/л, а для уксусной кислоты — 1,8 X 10-5 моль/л.
Кроме того, значение pKa угольной кислоты составляет 6,36 для первого уравнения диссоциации, тогда как для уксусной кислоты оно равно 4,76.
Эти значения показывают, что уксусная кислота сильнее угольной кислоты.
Теперь попробуем понять причину большей силы уксусной кислоты по сравнению с угольной кислотой. Начните с написания уравнения диссоциации для обеих кислот:
Начните с написания уравнения диссоциации для обеих кислот:
Для угольной кислоты, h3CO3(aq) <====> HCO3- + H+
Для уксусной кислоты, Ch4COOH(aq) <====> Ch4COO- + H+
Согласно приведенным выше уравнениям сопряженным основанием для угольной кислоты является бикарбонат-ион, а для уксусной кислоты сопряженным основанием служит ацетат-ион.
Ознакомьтесь с подробной статьей, которую я написал о том, является ли уксусная кислота сильной кислотой.
На данный момент мы можем оставить второе уравнение диссоциации угольной кислоты, так как сила измеряется только через высвобожденный первый протон.
Теперь нам нужно проанализировать силу этих сопряженных оснований, поскольку более сильное сопряженное основание означает более слабую кислоту, и наоборот.
Ион ацетата является более сильным сопряженным основанием, чем ион бикарбоната, из-за резонансного эффекта карбоксильного иона.
Другим фактором является нестабильность угольной кислоты, которая в основном разлагается на воду и молекулы углекислого газа, а в растворе остается очень небольшое количество угольной кислоты, из-за чего кислотность автоматически снижается.
Если вы также хотите знать химическую структуру угольной кислоты. прочитайте статью о структуре Льюиса угольной кислоты.
pH угольной кислоты
Шкала pH используется для выражения кислотности или щелочности вещества в водном растворе.
Значения по шкале pH находятся в диапазоне от 1 до 14. Все кислоты имеют значение pH ниже 7, а все основания имеют значение pH выше 7.
Нейтральные растворы, такие как чистая вода, имеют значение pH 7.
Теперь при расчете значения рН угольной кислоты мы должны иметь в виду, что это полипротонная кислота, т.е. она диссоциирует в растворе более одного раза и, таким образом, высвобождает различные ионы вместе с высвобождением протонов.
Таким образом, этапы расчета pH 0,1 М угольной кислоты будут отличаться от других простых кислот.
Во-первых, давайте начнем с первого уравнения диссоциации, приводящего к высвобождению ионов бикарбоната вместе с протонами.
Ниже приведено химическое уравнение:
h3CO3(aq) <====> HCO3- + H+
Теперь рассчитайте концентрацию ионов водорода по этому уравнению, зная, что значение Ka1 равно 4,3 X 10–7 Молл.
Уравнение записывается ниже:
Ka = ([HCO3-] [H+]) / h3CO3
Мы рассчитываем pH для 0,1 М раствора, поэтому исходная концентрация h3CO3 принята равной 0,1. Предполагая, что в конечном итоге образуется x протонов и x ионов бикарбоната, приведенное выше уравнение можно записать в виде: 9-4]
= 3,68
Что такое кислоты?
Вещество, которое легко отдает протоны при растворении в воде, известно как кислота. Это вещества, которые имеют кислый вкус, имеют рН ниже 7, окрашивают синюю лакмусовую бумагу в красную и образуют соли со щелочами.
В зависимости от степени их диссоциации в водном растворе кислоты далее классифицируются как сильные и слабые кислоты.
Кислоты, которые полностью ионизируются, известны как сильные кислоты, а те, которые полностью не диссоциируют в водных растворах, известны как слабые кислоты.
Считается, что три теории правильно определили свойства кислот.
Bronsted-Lowry Теория определяет кислоты как вещества, отдающие протоны в водном растворе или являющиеся донорами протонов.
Теория Аррениуса утверждает, что кислоты производят ионы водорода в воде.
Теория Льюиса определяет кислоты как акцепторы электронов.
Если о веществе говорят, что оно обладает одним или всеми перечисленными выше свойствами, его можно назвать кислотой.
Сопряженные кислотно-основные пары
Согласно теории кислот и оснований Бренстеда-Лоури, вещество, которое отдает свой протон, является кислотой, а вещество, которое принимает протоны, является основанием.
Например, в случае угольной кислоты уравнение диссоциации записывается следующим образом: отщепляет протон и поэтому является кислотой, в то время как вода принимает протон и, следовательно, в этой реакции ведет себя как основание.
Однако далее теория утверждает, что из-за этой потери и приобретения протона образуются сопряженное основание и сопряженная кислота, соответствующие кислоте и основанию, участвующим в качестве реагентов.
В приведенном выше примере HCO3- представляет собой сопряженное основание угольной кислоты, а h4O+ представляет собой сопряженную кислоту молекулы воды.
Сильное сопряженное основание указывает на слабую кислоту и наоборот. Точно так же сильная сопряженная кислота указывает на слабое основание и наоборот. Поэтому они помогают в оценке силы кислот и оснований.
Как образуется угольная кислота?
Углекислота производится путем растворения двуокиси углерода в воде.
Молекулы двуокиси углерода ведут себя как ангидрид угольной кислоты и легко принимают молекулу воды с образованием угольной кислоты.
Уравнение реакции записывается следующим образом:
CO2 + h3O <====> h3CO3
Он нестабилен и слаб, поэтому легко диссоциирует на бикарбонат-ионы и водород.
Является ли угольная кислота органической или неорганической кислотой?
Соединения, содержащие атомы углерода и водорода, называются органическими соединениями.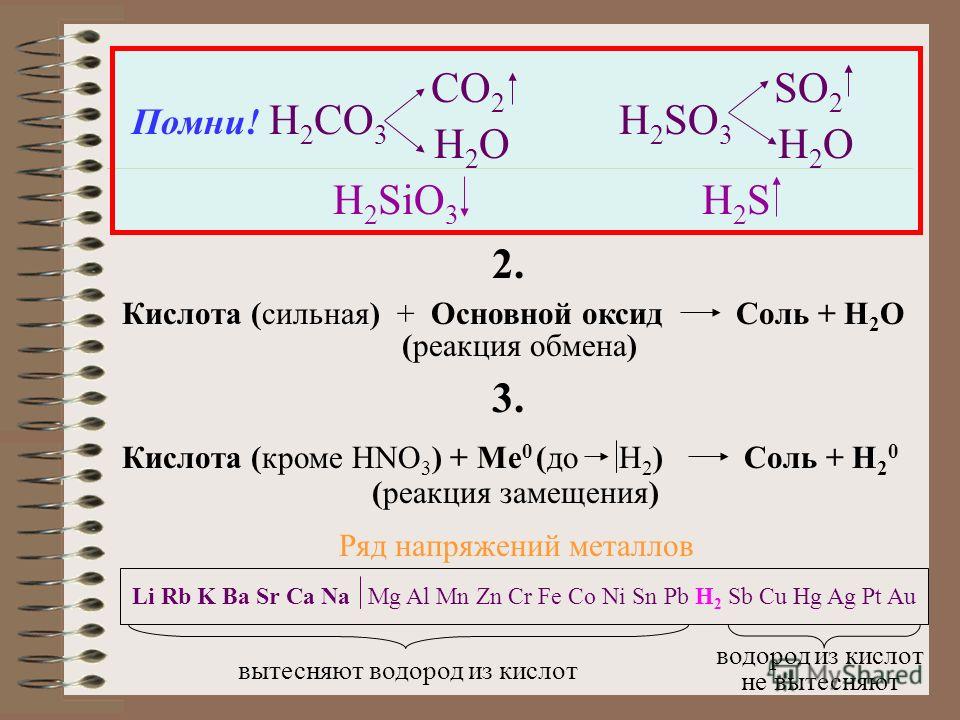 Существует специальный раздел химии, изучающий свойства и реакционную способность этих соединений.
Существует специальный раздел химии, изучающий свойства и реакционную способность этих соединений.
Хотя угольная кислота содержит как углерод, так и водород, она все же не считается органическим соединением.
Подобно двуокиси углерода, угольная кислота также является неорганической или минеральной кислотой.
Причину такого поведения можно понять, рассмотрев структуру молекулы угольной кислоты, которая состоит из одной двойной связи углерод-кислород и двух одинарных связей углерод-кислород.
Свойства угольной кислоты
Угольная кислота является нестабильной и слабой двухосновной или двухосновной кислотой. Это также происходит естественным образом внутри человеческого тела.
Некоторые важные свойства угольной кислоты приведены в таблице ниже:
| Химическое название | Угольная кислота |
| Внешний вид | Серовато-белый |
| Химическая формула | h3CO3 |
| Молекулярная масса | 62,024 г/моль |
| Точка плавления | 210 °С |
| Точка кипения | -78 °С |
| Плотность | 1,668 г/см3 |
| Запах | Без запаха |
| Ка1 | 4,3 X 10–7 моль/л |
| рКа1 | 6,35 |
| Токсичность | Нетоксичный |
Использование угольной кислоты
Некоторые важные области применения угольной кислоты перечислены ниже:
• Она используется при образовании солей.
• В нашем организме сопряженное основание угольной кислоты, ион бикарбоната используется для транспортировки CO2 наружу через дыхательный обмен.
• В сыворотке крови также способствует протонированию азотистых оснований.
• Он также действует как буферный агент в нашем организме и расщепляется на углекислый газ под действием карбоангидразы.
• Используется для приготовления газированных напитков, игристых вин и газированной воды.
• Он также входит в состав средств для полоскания рта и вагинальных растворов.
• Угольная кислота используется в качестве очищающего средства для контактных линз.
• Также используется в косметической и пищевой промышленности.
• Участвует в гидролизе крахмала.
Заключение
Угольная кислота является слабой кислотой, так как она не диссоциирует полностью в водном растворе.
Высокое значение константы диссоциации кислоты и более низкое значение логарифмической константы для угольной кислоты также указывают на то, что это слабая кислота.
Среди угольной и уксусной кислот h3CO3 слабее из-за более высокой стабильности сопряженного основания его сопряженного основания. Более того, он имеет тенденцию к преобразованию составляющих его соединений, то есть воды и углекислого газа.
Сопряженное основание угольной кислоты представляет собой HCO3-.
Если вам понравилась статья поделитесь ею в своих группах. И не стесняйтесь предлагать темы для написания статьи.
Удачи!!
Что такое угольная кислота? (с изображением)
`;
Наука
Факт проверен
М.
 Р. Энглин
Р. Энглин Угольная кислота — это слабая кислота, которая образуется при растворении диоксида углерода (CO 2 ) в воде (H 2 O), в результате чего получается химическая формула H 2 CO 3 . Когда кислота диссоциирует или отдает ион водорода, образующаяся молекула называется ионом бикарбоната. Углекислота часто встречается в природе. Его можно найти в газированных напитках, шампанском и крови. Кислота появляется даже в дождь.
При изготовлении соды углекислый газ растворяют в воде. Как уже говорилось, этот процесс также создает угольную кислоту. Эта кислота, наряду с фосфорной кислотой и другими кислотами, придает терпкий вкус многим газированным напиткам. Он также обеспечивает легкое жжение, которое человек ощущает при приеме внутрь шипучего напитка. Таким образом, именно кислота придает газированным напиткам шипучий вкус.
Как уже говорилось, этот процесс также создает угольную кислоту. Эта кислота, наряду с фосфорной кислотой и другими кислотами, придает терпкий вкус многим газированным напиткам. Он также обеспечивает легкое жжение, которое человек ощущает при приеме внутрь шипучего напитка. Таким образом, именно кислота придает газированным напиткам шипучий вкус.
Углекислота играет важную роль в поддержании стабильного pH организма. Нормальный pH жидкостей организма составляет около 7,4, и его необходимо поддерживать близко к этому значению, чтобы организм функционировал должным образом. Если рН изменяется, будь то вверх или вниз, ферменты могут перестать функционировать, мышцы и нервы могут начать ослабевать, а метаболическая активность нарушается. Ион бикарбоната, высвобождаемый из кислоты, служит буфером, который помогает противостоять изменениям pH. Это означает, что он может действовать как кислота или основание по мере необходимости.
Ион бикарбоната, высвобождаемый из кислоты, служит буфером, который помогает противостоять изменениям pH. Это означает, что он может действовать как кислота или основание по мере необходимости.
Кислоты определяются как любые вещества, которые выделяют ионы водорода в растворы. Основания — это вещества, которые принимают эти ионы водорода. Когда в организме накапливается избыток ионов водорода, то есть жидкости становятся более кислыми, тогда ионы бикарбоната принимают эти дополнительные ионы водорода и поддерживают pH тела на нормальном уровне. И наоборот, если уровень ионов водорода падает слишком сильно, т. е. жидкости становятся слишком щелочными, то угольная кислота отдает ионы водорода, чтобы поддерживать pH крови в норме. Этот процесс также наблюдается при транспортировке кислорода и углекислого газа.
е. жидкости становятся слишком щелочными, то угольная кислота отдает ионы водорода, чтобы поддерживать pH крови в норме. Этот процесс также наблюдается при транспортировке кислорода и углекислого газа.
Углекислота даже во время дождя является нормальным явлением. Когда дождевая вода попадает в воздух, она поглощает углекислый газ, образуя угольную кислоту. Таким образом, когда он достигает земли, его рН составляет около 5,5. Это не следует путать с кислотными дождями, которые возникают, когда выбросы, такие как оксиды серы и оксиды азота, от сжигания ископаемого топлива поднимаются в воздух. Когда дождь падает, он поглощает эти компоненты, образуя кислоты, из-за которых pH дождя может упасть всего до двух.
Когда дождь падает, он поглощает эти компоненты, образуя кислоты, из-за которых pH дождя может упасть всего до двух.
Вам также может понравиться
Рекомендуется
КАК ПОКАЗАНО НА:
УГОЛЬНАЯ КИСЛОТА | определение в кембриджском словаре английского языка
Примеры из литературы- Когда-то вдыхаемый воздух потерял большую часть своего кислорода и приобрел пропорциональное увеличение углекислого газа.

- Если при добавлении известковой воды выпадает осадок, это угольная кислота.
- Бикарбонат разлагается с выделением чистой углекислоты.
- Этот сладкий сидр бродит, и сахарная часть его превращается в углекислый газ и спирт.
- Таким образом, вдыхаемый воздух потерял около пяти процентов. кислорода и получил почти пять процентов. угольной кислоты.
Примеры угольной кислоты
угольная кислота
Растворенный углекислый газ принимает форму бикарбоната и угольной кислоты , которые создают кислую среду.
Из Phys.Org
После глотка ферменты во рту превращают оставшийся свободный углекислый газ в угольная кислота .
Из Phys.Org
Однако, стимулируя осязание во рту, пузырьки усиливают ощущение укуса, помимо химического раздражения, вызванного угольной кислотой .
От Phys.Org
Метан примерно в 100 раз сильнее парникового газа по сравнению с углекислым кислотным газом.
От ThinkProgress
Это угольная кислота , а не карболовая кислота.
Из журнала Slate
Хотя угольная кислота кислота 9 не упоминается в публичных заголовках,0439, гидратированная форма двуокиси углерода, имеет решающее значение как для здоровья атмосферы, так и для человеческого организма.
Из Phys.Org
Парестезии, скорее всего, являются следствием ингибирования ферментов карбоангидразы кислоты .
Из Кембриджского корпуса английского языка
Зуб, который грыз и продолжает грызть его, есть углекислая кислота , внесенная в землю дождевой водой.
Из проекта Гутенберг
Избыток углекислоты кислоты в воде также будет разъедать свинец.
Из проекта Гутенберг
Нужно только защитить их чехлом от действия угольная кислотная атмосферная.
Из проекта Гутенберг
Мертвые тела двадцати восьми крыс были чистым результатом этого нападения с углекислым кислотным газом.
Из проекта Гутенберг
Что ж; теперь вы видите, что пламя свечи — это горящий пар, а пар, горя, превращается в воду и газ.
Из проекта Гутенберг
При таком методе процедуры мы видим известь, но не видим углекислую кислоту .
Из проекта Гутенберг
Насыщение жидкости углекислый кислотный настолько полный и обильный, что не нужно спешить с укупоркой.

 gov.
gov.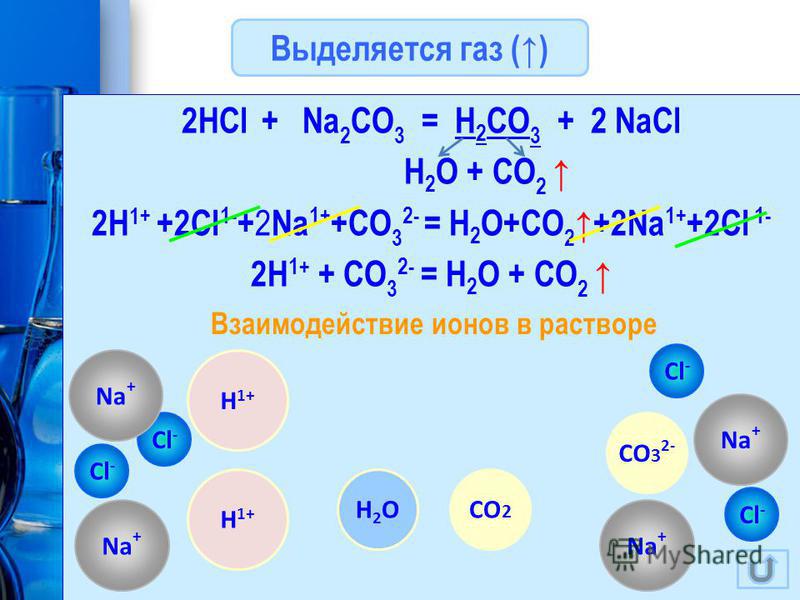


 В результате, благодаря связыванию введенной в систему кислоты, концентрация ионов водорода значительно понижается.
В результате, благодаря связыванию введенной в систему кислоты, концентрация ионов водорода значительно понижается.
 Установлено, что ННbО2 в 80 раз легче отдает ионы водорода, чем ННb.
Установлено, что ННbО2 в 80 раз легче отдает ионы водорода, чем ННb.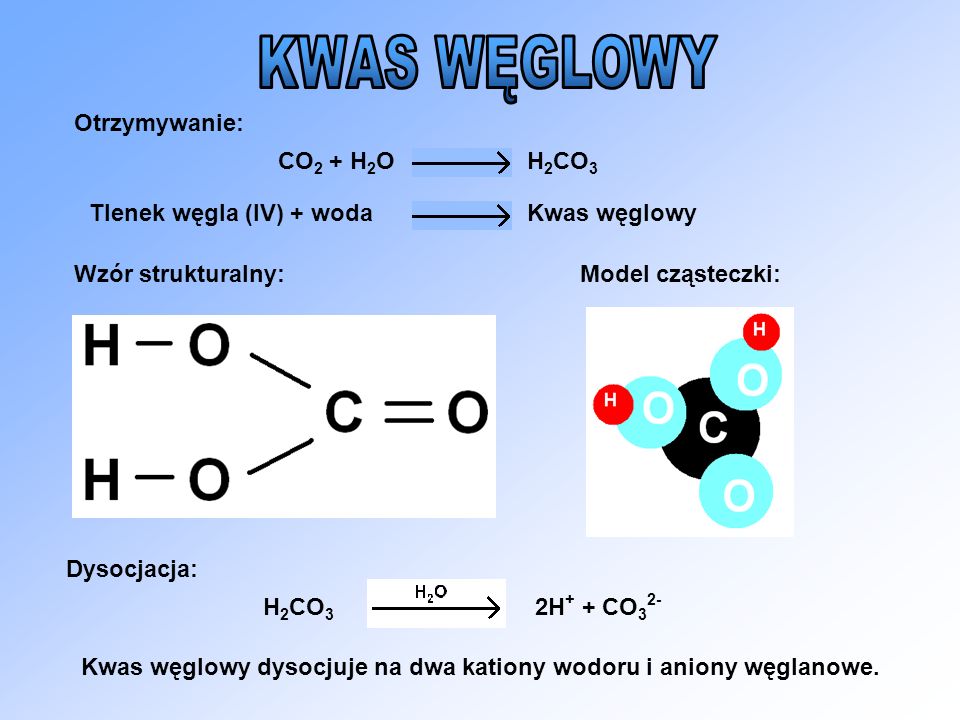 su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь — 161.97.168.212 (0.006 с.)
su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь — 161.97.168.212 (0.006 с.)