Общие свойства металлов
Цель урока: сформировать понятие о металлах как группе элементов, вещества которых проявляют общие свойства, обусловленные сходством строения.
Задачи урока.
Образовательные:
1) закрепить знания о положении металлов в периодической системе, характерных особенностях строения атомов больших и малых периодов;
2) познакомить с металлической связью, типами кристаллических решеток металлов и на основании этого выяснить причину особых физических свойств металлов;
3) познакомить со способностью металлов образовывать сплавы, рассмотреть свойства отдельных сплавов и их отличия от чистых металлов.
Развивающие: развить умения делать выводы о свойствах на основе строения, а также развитие способности анализировать и сравнивать.
Воспитательные: вызвать интерес у учащихся
к огромной роли металлов в жизни человека и в
развитии народного хозяйства.
Оборудование: образцы различных металлов и изделия из них.
— коллекция “металлы и сплавы”.
— компьютер, проектор, экран.
Основные понятия: окислитель, восстановитель, элемент, простое вещество, степень окисления, период, ряд, группа, подгруппа, типы химической связи, металлическая связь, кристаллические решетки металлов.
План урока:
- Организационный момент.
- Металл – химический элемент. Положение металлов в периодической системе Менделеева, особенности строения атомов металлов (свойства, нахождение в природе).
- Металл – простое вещество. Металлическая связь. Кристаллическое строение металлов.
- Физические свойства металлов.
- Сплавы.
Ход урока
1. Организационный момент.
Сегодня на уроке ребята мы с вами начнем
изучение нового материала, а именно рассмотрим
положение металлов в периодической системе,
рассмотрим особенности строения их атомов и
кристаллических решеток, а также поговорим о
физических свойствах металлов и рассмотрим
понятие сплавы.
2. Краткая вступительная беседа о практической важности металлов в жизни человека. Огромное значение металлов в нашей жизни. Георг Агрикола (ученый 16 века) писал: Человек не может обойтись без металлов….если бы не металлы человек влачил бы самую омерзительную и жалкую жизнь среди диких зверей. Ломоносов также посвятил металлам вдохновенные строки: металлы подают укрепление и красоту важнейшим вещам, в обществе потребным. Ими защищаемся от нападения неприятеля, ими утверждаются корабли и силою их связаны. Металлы служат нам в уловлении земных и морских животных для пропитания нашего… и кратко сказать ни едино художество, ни едино ремесло простое употребление металлов миновать не может. Давайте же познакомимся с ними поближе и взглянем на периодическую систему Менделеева.
І. Положение металлов в периодической системе Менделеева.
Металлы как химические элементы.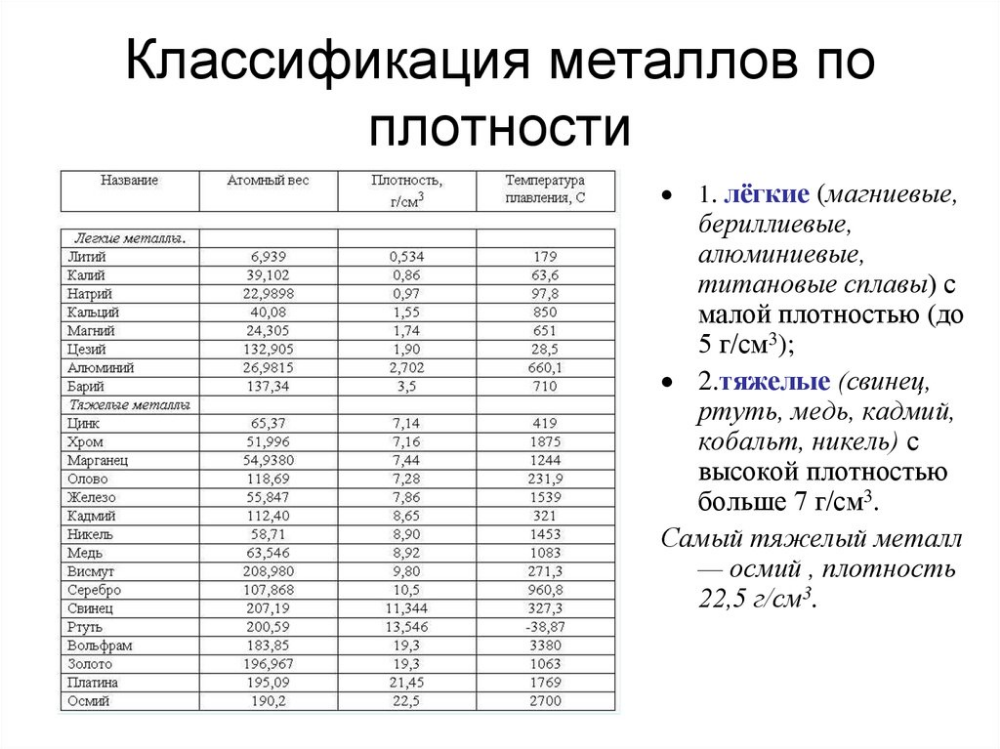 В настоящее
время официально зарегистрировано 108 хим.
элементов. Большинство из них металлы (более 80). В
периодической системе металлы имеются во всех
группах: І – ІІ гр. – все металлы, кроме H, в ІІІ гр.
– все металлы, кроме B, в ІV гр. – все металлы,
кроме C, Si, в V гр. – все металлы, кроме N, P, As, в VІ гр.
– все металлы, кроме O, S, Se, Te, в VІІ гр. – все
металлы, кроме п./гр. галогенов, в VІІІ гр. – все
металлы, кроме инертных элементов. Таким образом,
металлы располагаются в левой и нижней части
периодической системы, а неметаллы в правой
части наверху.
В настоящее
время официально зарегистрировано 108 хим.
элементов. Большинство из них металлы (более 80). В
периодической системе металлы имеются во всех
группах: І – ІІ гр. – все металлы, кроме H, в ІІІ гр.
– все металлы, кроме B, в ІV гр. – все металлы,
кроме C, Si, в V гр. – все металлы, кроме N, P, As, в VІ гр.
– все металлы, кроме O, S, Se, Te, в VІІ гр. – все
металлы, кроме п./гр. галогенов, в VІІІ гр. – все
металлы, кроме инертных элементов. Таким образом,
металлы располагаются в левой и нижней части
периодической системы, а неметаллы в правой
части наверху.
На экране таблица размещения неметаллов в периодической системе химических элементов <рисунок 1>.
Получается, что металлов в периодической системе больше, чем неметаллов. С чем же это связано спросите вы у меня, и я отвечу, что это связано с особенностями строения атомов металлов.
У атомов металлов на внешнем энергетическом
уровне обычно находится от 1 до 3-4 электронов.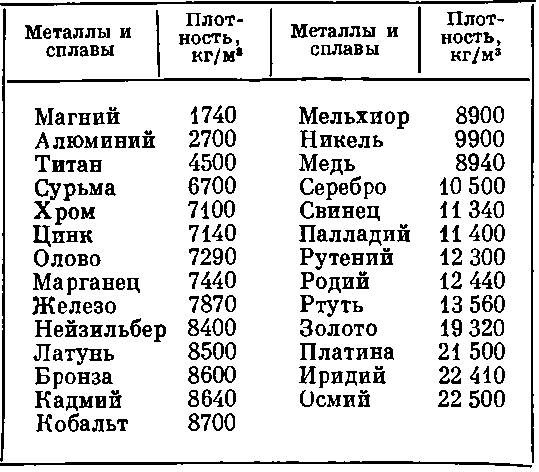 С
4-го периода начинается заполнение предвнешнего d
– подуровня, начиная со скандия (Sc), при этом на
внешнем уровне остается 2 электрона, реже 1, если
наблюдается провал электрона <рисунок
2>.
С
4-го периода начинается заполнение предвнешнего d
– подуровня, начиная со скандия (Sc), при этом на
внешнем уровне остается 2 электрона, реже 1, если
наблюдается провал электрона <рисунок
2>.
Значит, делаем вывод, что свойства металлов у этих элементов присутствуют. Такая же закономерность наблюдается и у атомов 6 периода. Таким образом, все элементы побочной подгруппы это металлы, причем четный ряд в больших периодах – металлы, а нечетный ряд – неметаллы.
Особенностью строения атомов металлов
является небольшое число электронов на внешнем
энергетическом уровне (от одного до трех).
Следовательно, атомы металлов в отличие от
атомов неметаллов легко отдают наружные
электроны, т.е. являются сильными
восстановителями, они проявляют только
положительные степени окисления от +1 до +3.
Давайте посмотрим, как изменяются свойства
металлов в периодах и группах. Итак, в группе
сверху вниз R атома увеличивается, следовательно,
способность притягивать электроны меньше, а
металлические свойства усиливаются.
ІІ. Нахождение металлов в природе.
На экране таблица. Металлы содержатся в ядре
Земли и в земной коре, в воде рек, озер, океанов, в
организмах животных и растений. Самым
распространенным металлом в земной коре
является AI, за ним следует Fe, Ca, Na, K, Mg, Ti.
Содержимое остальных металлов незначительно.
Так, например, в земной коре хрома Cr всего лишь 0,3%;
Ni – 0,2%, Cu – 0,01%. Металлы встречаются как в
свободном виде, как и в виде соединений. В
свободном виде существуют химически
малоактивные металлы (Cu, Ag, Au, Pt). Это так
называемые самородные металлы, которые
встречаются в виде отдельных кусков, зерен,
вкраплений в горные породы.
ІІІ. Металлы – простые вещества. Металлическая связь. Кристаллическое строение атомов.
Металлов в природе больше оттого, что у них у
всех одинаковое строение кристаллической
решетки и один тип химической связи. Это и
придает им ряд общих свойств. Это отличает
металлы от неметаллов, которым присуще больше
различие свойств, чем их общность. В виде
простого вещества атомы металлов связаны между
собой, так называемой металлической связью. У
металлов, особенно щелочных, валентные электроны
связаны с атомами слабо и при отрыве
затрачивается сравнительно немного энергии. При
этом возникают ионы, имеющие устойчивый
электронный слой из 8 электронов. Поэтому металлы
как в твердом, таки в жидком состоянии существуют
в виде ионов, между которыми в хаотичном движении
находятся электроны, получившие условное
название электронного газа.
Металлическая связь – это химическая связь, образующаяся в результате электростатического притяжения между ионами и обобществленными электронами, принадлежащим не отдельным атомам, а всему кристаллу в целом.
А теперь давайте вспомним, какие виды химической связи вам уже известны. В чем суть ковалентной и ионной связи, рисуем электронные формулы молекул хлора и хлороводорода. Подведем итоги: что общего и в чем отличие металлической связи от ковалентной?
Сходство: валентные электроны находятся во взаимном пользовании атомов.
Различие: металлическая связь не является
локализованной, электроны связывают не пару
атомов, а принадлежат одновременно всем атомам
данного металлического тела. На экране схема по
различным типам связи (на дискете).
На экране схема по
различным типам связи (на дискете).
Все металлы, кроме Hg, франция, в обычных условиях являются твердыми веществами, имеют кристаллическое строение. Различное расположение ион-атомов обуславливает различие видов металлических кристаллических решеток. Чаще всего образуются три вида кристаллических решеток, давайте посмотрим на экран:
- Кубическая объемно-центрированная решетка. Атомы металла находятся в вершинах и центре куба. Каждый атом окружен восьмью атомами. Такую решетку имеют: Na, K, Li, Ba, Cr, Mo, W, V <рисунок 5>.
- Кубическая гранецентрированная. Атомы металла расположены по вершинам и граням куба: Ca, Cu, Sr, Ag, Fe, Co, Al, Au, Pt, Sb, Ni, Pb <рисунок 6>.
- Гексагональная (шестиугольная) плотно упакованная решетка. Она встречается у Zn, Mg, Be, Ti, Cd <рисунок 7>.
В зависимости от типа решетки атомы занимают в
ней больше или меньше места. Например, в
кубической объемно-центрированной решетки атомы
занимают 68% пространства, а в кубической
гранецентрированной 74 %. На экране схемы
кристаллических решеток. Некоторые металлы Fe, Sn
могут существовать в разных кристаллических
решетках в зависимости от условий (явлений
полиморфизма).
Например, в
кубической объемно-центрированной решетки атомы
занимают 68% пространства, а в кубической
гранецентрированной 74 %. На экране схемы
кристаллических решеток. Некоторые металлы Fe, Sn
могут существовать в разных кристаллических
решетках в зависимости от условий (явлений
полиморфизма).
ІV. Физические свойства металлов.
Металлическая связь и особенности кристаллического строения обуславливают особые физические свойства металлов.
1. Агрегатное состояние. Все металлы твердые вещества, за исключением ртути и франция. А как вы думаете, почему так? Если не могут ответить сразу, на вопрос можно предложить ответить дома, используя дополнительную литературу.
В ртути присутствует некоторое количество молекул Hg с ковалентными связями, между собой они связаны слабыми вандерваальсовыми силами.
2. Металлический блеск. Электроны, заполняющие
межатомное пространство, отражают лучи видимого
спектра.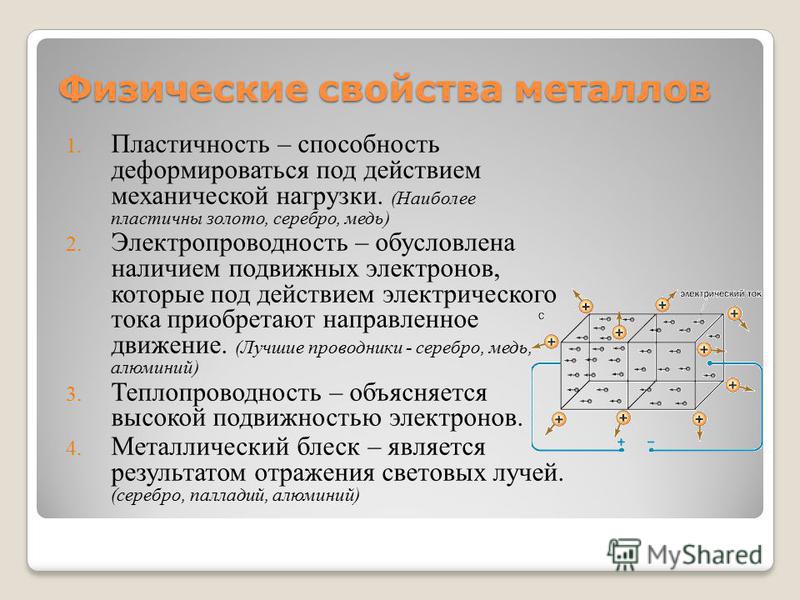 Это вызывает непрозрачность и блеск
металла. Как вы думаете, у какого элемента эта
способность наибольшая и где она применяется?
Это вызывает непрозрачность и блеск
металла. Как вы думаете, у какого элемента эта
способность наибольшая и где она применяется?
В наибольшей степени эта способность проявляется у серебра и индия, поэтому эти металлы нашли применение при изготовлении зеркал. Металлы имеют блеск только в компактной форме, а в мелкораздробленном виде все металлы, кроме Mg u Al, черного или серого цвета. У немногих неметаллов (Si, I, Se, Te) также имеется некоторый блеск, напоминающий металлический, что связано с наличием некоторого количества электронов.
3. Цвет. Большинство металлов, почти полностью
отражая лучи видимого спектра, приобретают
серебристо – белый (Ni, Al) или серебристо – серый
оттенки (Fe, Pb). Как вы думаете, почему золото
желтое, а медь красная? Медь, золото, висмут,
поглощают больше зеленые и голубые лучи
светового спектра, а потому приобретают
соответственно розово – красный, желтый и
розовый цвет.
4. Тепло и электропроводность. Случай: пошли всем классом в поход и взяли с собой алюминиевую посуду, чтоб не разбилась, налили в нее чай и решили посидеть у костра, а удержать ее голыми руками не удается. Почему? Быстро нагрелась, как объяснить? Для металлов характерна большая теплопроводность. Свободные электроны, находящиеся в постоянном движении, все время сталкиваются с колеблющимися ионами, обмениваются с ними энергией. Следствием чего является быстрое выравнивание температуры по всей массе тела.
Электропроводность объясняется присутствием в
металлах свободных электронов, которые под
влиянием даже небольшой разности потенциалов
приобретают направленное движение от
отрицательного к положительному полюсу.
Электрическая проводимость и теплопроводность
неодинакова: Как вы думаете, у какого из
известных вам металлов электропроводность самая
высокая? В ряду Hg, Pb, Fe, Zn, Mg, Al, Au, Cu, Ag она
увеличивается.
Электропроводность зависит от температуры: с
повышением температуры она понижается. Это
объясняется тем, что при повышении температуры
колебательное движение ионов, атомов
усиливается, и это мешает направленному движению
электронов. При температуре абсолютного нуля
сопротивление металлов исчезает. Это явление
называется сверхпроводимостью. У некоторых
неметаллов, относящихся к полупроводникам,
электропроводимость с повышением температуры
увеличивается, т.к. увеличивается количество
свободных электронов вследствие разрыва
ковалентных связей. Например, при нагревании
бора от комнатной температуры до 800° С его эл.
проводимость увеличивается в 2 млн. раз. При
снижении температуры, нарушенные ковалентные
связи восстанавливаются и, следовательно,
количество свободных электронов уменьшается.
При низких температурах неметаллы не проводят
электрического тока, т.к. у них отсутствуют
свободные электроны. В этом коренное отличие
между физическими свойствами металлов и
неметаллов.
В этом коренное отличие
между физическими свойствами металлов и
неметаллов.
5. Пластичность и ковкость.
Пластичность – это способность тела легко изменять форму под действием внешних сил и сохранять полученную форму, кода эти силы перестают действовать. Пластичность сводится к сдвигу атомно-ионных слоев в решетке металлов относительно друг друга. Поскольку слои связаны между собой электронным газом, то при сдвиге связь не рвется и кристалл не разрушается. Ребята, как вы думаете, какой наиболее пластичный металл?
Наибольшей пластичностью обладает золото. Из него можно раскатать фольгу толщиной 0,001 мм, что в 500 раз тоньше человеческого волоса.
Ковкость – это способность не рассыпаться при
ударе. Чем же объясняется ковкость многих
металлов (щелочные, золото, медь). И почему
некоторые металлы (сурьма, висмут) очень хрупкие?
Самые хрупкие металлы находятся в V, VІ, VІІ гр.
периодической системы. У атомов этих элементов
от 5 до 7 свободных электронов (кроме наружных
валентных электронов в электронный газ
поступают электроны предвнешнего слоя). Такое
большое число электронов сильнее связывает
отдельные слои ионов и препятствует их
свободному скольжению, пластичность металлов
уменьшается.
У атомов этих элементов
от 5 до 7 свободных электронов (кроме наружных
валентных электронов в электронный газ
поступают электроны предвнешнего слоя). Такое
большое число электронов сильнее связывает
отдельные слои ионов и препятствует их
свободному скольжению, пластичность металлов
уменьшается.
6. Несмотря на одинаковый вид связи, различные металлы обладают характерными для каждого из них свойствами: температурой плавления, плотностью, твердостью. Эти свойства обусловлены строением атомов, зарядностью, размерами ион-атомов в кристаллической решетке, а также плотностью их упаковки. Давайте вспомним, как изменяется атомная масса и радиус в таблице?
Плотность металлов определяется атомной
массой и размерами атома (радиус). Чем больше
атомная масса и меньше радиус, тем плотнее
металл. Поскольку атомная масса возрастает в
периодической системе сверху вниз, а радиусы
атомов уменьшаются при движении по ряду в
больших периодах, наиболее плотными должны быть
металлы побочных подгрупп І и VІІ гр. Действительно к наиболее тяжелым относятся
золото, платина, осмий, а к наиболее легким –
литий, калий, натрий. Можно сравнить щелочной
металл Na и металл побочной группы хром. Металлы
имеют один и тот же тип кристаллической решетки
(кубическая объемно-центрированная), в наружном
слое находится по 1 электрону, но натрий и хром
имеют различные атомные массы, радиус, и заряды
ионов. В отличие от натрия у хрома в образовании
металлической связи, принимают участие еще 5 d -
электронов предвнешнего уровня. В связи с этим
свойства, указанных металлов резко различны. Na –
мягок, легкоплавок, плотность его невелика, Cr –
тверд, плотен, имеет высокую температуру
плавления. Наименьшую плотность имеют щелочные
металлы, например, р лития 0,53 г/см3, а
наиболее плотными являются металлы VІІІ гр.
Плотность осмия 22,6 г/см3. Металлы, плотность
которых меньше пяти, называются легкими, а больше
пяти – тяжелыми <рисунок 8>.
Действительно к наиболее тяжелым относятся
золото, платина, осмий, а к наиболее легким –
литий, калий, натрий. Можно сравнить щелочной
металл Na и металл побочной группы хром. Металлы
имеют один и тот же тип кристаллической решетки
(кубическая объемно-центрированная), в наружном
слое находится по 1 электрону, но натрий и хром
имеют различные атомные массы, радиус, и заряды
ионов. В отличие от натрия у хрома в образовании
металлической связи, принимают участие еще 5 d -
электронов предвнешнего уровня. В связи с этим
свойства, указанных металлов резко различны. Na –
мягок, легкоплавок, плотность его невелика, Cr –
тверд, плотен, имеет высокую температуру
плавления. Наименьшую плотность имеют щелочные
металлы, например, р лития 0,53 г/см3, а
наиболее плотными являются металлы VІІІ гр.
Плотность осмия 22,6 г/см3. Металлы, плотность
которых меньше пяти, называются легкими, а больше
пяти – тяжелыми <рисунок 8>.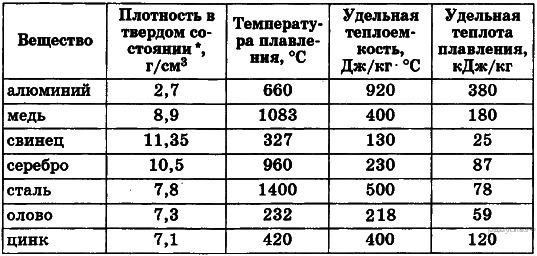
Металлы обладают различной твердостью. По степени твердости металлы сравнивают с алмазом, твердость которого принята за 10. Наиболее твердым является хром, а наиболее мягкими – щелочные металлы (легко режутся ножом) <рисунок 9>.
Сильно отличаются металлы и по температуре плавления. Самый легкоплавкий металл – ртуть (температура плавления – 38,8°С, самый тугоплавкий – вольфрам (3380°С). Металлы, плавящиеся при температуре выше 1000°С, называются тугоплавкими, ниже – легкоплавкими <рисунок 10>.
Чем же объясняется большое различие в плотности, твердости и температуре плавления? Установлено, что чем выше концентрация свободных электронов, тем ярче выражены перечисленные свойства.
В промышленности сложилось разделение
металлов на черные и цветные. К черным относятся
железо и его сплавы. К цветным: Cu, Zn, Pb, Sn. Особую
группу цветных металлов составляют благородные
металлы: серебро, золото, рутений, платина,
палладий. Эти металлы не окисляются на воздухе
даже при повышенной температуре и не разрушаются
при действии многих химических веществ. Таким
образом, мы рассмотрели основные физические
свойства металлов.
Эти металлы не окисляются на воздухе
даже при повышенной температуре и не разрушаются
при действии многих химических веществ. Таким
образом, мы рассмотрели основные физические
свойства металлов.
V. Сплавы.
С самых древних времен человечество имеет дело
не с чистыми металлами, а с их сплавами,
обладающими часто такими свойствами, которые не
имеют образующие их металлы. Как вы думаете
почему? Например, Fe, Al, сравнительно мягкие, а их
сплавы с металлами обладают достаточной
твердостью. Получение сплавов основано на
способности расплавленных металлов
растворяться друг в друге, при этом почти всегда
они свободно перемешиваются и образуют жидкие
системы. При охлаждении расплавленные смеси
затвердевают, образуются металлические сплавы с
нужными свойствами: легкоплавкие, жаростойкие,
кислотостойкие. Сплавы различают по составу и
строению. Характер взаимодействия в сплаве
зависит от их положения в периодической системе. Составные части могут образовывать либо твердый
раствор, либо механическую смесь, либо
химическое соединение. Твердые растворы:
образуются между металлами одной группы или
металлами, радиусы атомов которых мало
различаются по размерам (Au-Ag, Ag-Cu, Cu-Ni, Fe-Mn). Чем
дальше отстоят элементы друг от друга в таблице,
тем меньше их взаимная растворимость, в этом
случае образуется механические смеси. Такие
смеси неоднородны. Расплавленные металлы при
смешивании взаимодействуют друг с другом,
образуя химические соединения, называемые интерметаллическими.
Эти соединения не прочны, и в них не соблюдается
стехиометрическое соотношение компонентов (CaAl5,
AlCu3).
Составные части могут образовывать либо твердый
раствор, либо механическую смесь, либо
химическое соединение. Твердые растворы:
образуются между металлами одной группы или
металлами, радиусы атомов которых мало
различаются по размерам (Au-Ag, Ag-Cu, Cu-Ni, Fe-Mn). Чем
дальше отстоят элементы друг от друга в таблице,
тем меньше их взаимная растворимость, в этом
случае образуется механические смеси. Такие
смеси неоднородны. Расплавленные металлы при
смешивании взаимодействуют друг с другом,
образуя химические соединения, называемые интерметаллическими.
Эти соединения не прочны, и в них не соблюдается
стехиометрическое соотношение компонентов (CaAl5,
AlCu3).
Таким образом, способность металлов в
расплавленном состоянии не только механически
смешиваться, но и образовывать между собой
различные соединения – одна из причин,
объясняющая, почему сплавы по физическим
свойствам так резко отличаются от свойств,
составляющих их металлов.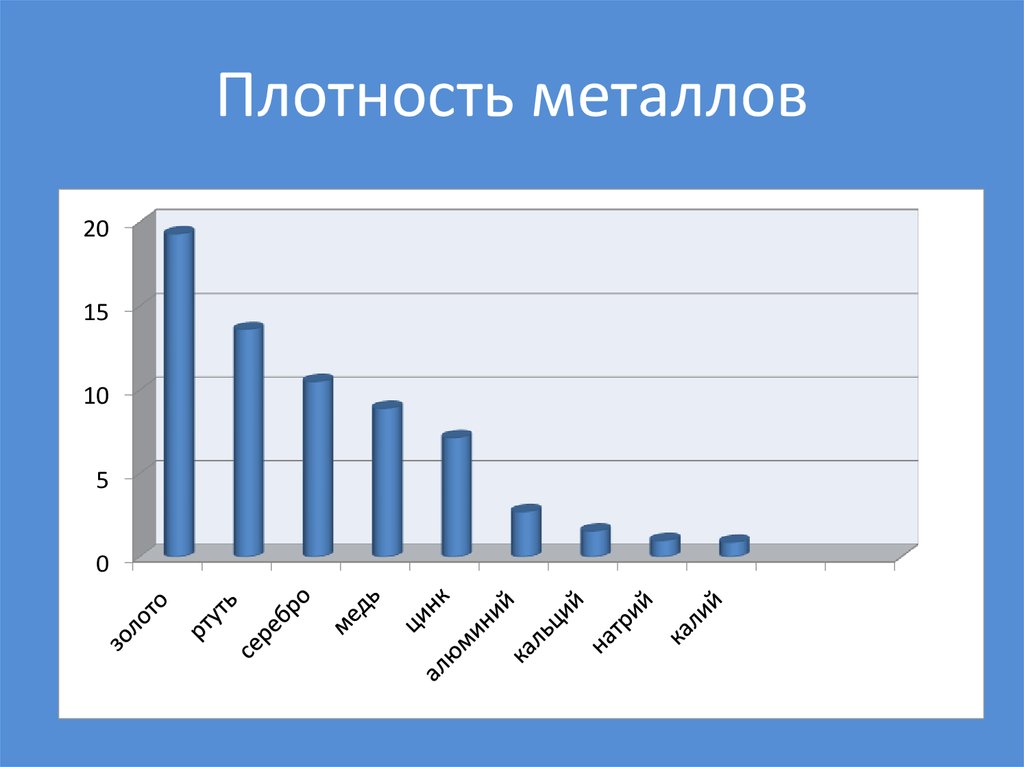 Так, например, сплав,
состоящий из одной части свинца и двух частей
олова, плавится при температуре 180°С, тогда как
свинец плавится при 328°С, а олово при 231°С. У
бронзы прочность выше, чем у составляющих ее меди
и олова. Сталь и чугун прочнее чистого железа.
Помимо большой прочности многие сплавы обладают
большой коррозийной стойкостью и твердостью.
Также компонентами сплавов могут быть и
неметаллы. Например, в состав чугуна входят C, Si, P,
S. Помимо понятия сплав вы должны отличать
понятие сталь. Различают два вида стали:
углеродистая (Fe+ C, S, P, Si) и легированная (Fe, C+ Cr, Ni, W,
Mo). Минус углеродистой в том, что она подвергается
коррозии, поэтому стали получать легированную,
нержавеющую и устойчивую к действию кислот.
Так, например, сплав,
состоящий из одной части свинца и двух частей
олова, плавится при температуре 180°С, тогда как
свинец плавится при 328°С, а олово при 231°С. У
бронзы прочность выше, чем у составляющих ее меди
и олова. Сталь и чугун прочнее чистого железа.
Помимо большой прочности многие сплавы обладают
большой коррозийной стойкостью и твердостью.
Также компонентами сплавов могут быть и
неметаллы. Например, в состав чугуна входят C, Si, P,
S. Помимо понятия сплав вы должны отличать
понятие сталь. Различают два вида стали:
углеродистая (Fe+ C, S, P, Si) и легированная (Fe, C+ Cr, Ni, W,
Mo). Минус углеродистой в том, что она подвергается
коррозии, поэтому стали получать легированную,
нержавеющую и устойчивую к действию кислот.
Латунь – сплав меди и цинка. Мельхиор – сплав,
содержащий около 80% меди и 20% никеля. Дюралюминий
– сплав на основе алюминия, содержащей медь,
магний, марганец и никель.
Заключение:
- Металлы располагаются в левой и нижней части периодической системы.
- У атомов металлов на внешнем энергетическом уровне обычно находится от 1 до 3-4 электронов.
- Атомы металлов – типичные восстановители.
- В природе металлы встречаются как в свободном виде, так и виде соединений.
- Для металлов характерна металлическая связь.
- Различное расположение ион-атомов обуславливает различие видов металлических кристаллических решеток.
- Металлическая связь и особенности кристаллического строения обуславливают особые физические свойства металлов.
- Получение сплавов основано на способности расплавленных металлов растворяться друг в друге, при этом почти всегда они свободно перемешиваются и образуют жидкие системы.
[Свойства металлов [Характерные свойства металлов
Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита)
Хорошая электропроводность
Возможность лёгкой механической обработки (см.
 : пластичность;
однако некоторые металлы,
например германий и висмут,
непластичны)
: пластичность;
однако некоторые металлы,
например германий и висмут,
непластичны)Высокая плотность (обычно металлы тяжелее неметаллов)
Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
Большая теплопроводность
В реакциях чаще всего являются восстановителями
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже приводится твёрдость некоторых металлов по шкале Мооса.
Твёрдость некоторых металлов по шкале Мооса:[6]
Твёрдость | Металл |
0. | Цезий |
0.3 | Рубидий |
0.4 | Калий |
0.5 | Натрий |
0.6 | Литий |
1.2 | Индий |
1.2 | Таллий |
1.25 | Барий |
1.5 | Стронций |
1. | Галлий |
1.5 | Олово |
1.5 | Свинец |
1.5 | Ртуть(тв.) |
1.75 | Кальций |
2.0 | Кадмий |
2.25 | Висмут |
2.5 | Магний |
2.5 | Цинк |
2. | Лантан |
2.5 | Серебро |
2.5 | Золото |
2.59 | Иттрий |
2.75 | Алюминий |
3.0 | Медь |
3.0 | Сурьма |
3.0 | Торий |
3.17 | Скандий |
3. | Платина |
3.75 | Кобальт |
3.75 | Палладий |
3.75 | Цирконий |
4.0 | Железо |
4.0 | Никель |
4.0 | Гафний |
4.0 | Марганец |
4.5 | Ванадий |
4. | Молибден |
4.5 | Родий |
4.5 | Титан |
4.75 | Ниобий |
5.0 | Иридий |
5.0 | Рутений |
5.0 | Тантал |
5.0 | Технеций |
5.0 | Хром |
5. | Бериллий |
5.5 | Осмий |
5.5 | Рений |
6.0 | Вольфрам |
6.0 | β-Уран |
Температуры плавления металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите.
В
зависимости от плотности,
металлы делят на лёгкие (плотность
0,53 ÷ 5 г/см³) и тяжёлые
(5 ÷ 22,5 г/см³). Самым лёгким
металлом является литий (плотность
0.53 г/см³). Самый тяжёлый металл в
настоящее время назвать невозможно,
так как плотности осмия и иридия —
двух самых тяжёлых металлов — почти
равны (около 22.6 г/см³ — ровно в два
раза выше плотности свинца), а вычислить
их точную плотность крайне сложно: для
этого нужно полностью очистить металлы,
ведь любые примеси снижают их плотность.
Самым лёгким
металлом является литий (плотность
0.53 г/см³). Самый тяжёлый металл в
настоящее время назвать невозможно,
так как плотности осмия и иридия —
двух самых тяжёлых металлов — почти
равны (около 22.6 г/см³ — ровно в два
раза выше плотности свинца), а вычислить
их точную плотность крайне сложно: для
этого нужно полностью очистить металлы,
ведь любые примеси снижают их плотность.
Большинство
металлов пластичны, то есть металлическую
проволоку можно согнуть, и она не
сломается. Это происходит из-за смещения
слоёв атомов металлов
без разрыва связи между
ними. Самыми пластичными являются
золото, серебро и медь.
Из золота можно изготовить фольгу
толщиной 0.003 мм, которую используют
для золочения изделий. Однако не все
металлы пластичны. Проволока
из цинка или олова хрустит
при сгибании; марганец и висмут при деформации вообще
почти не сгибаются, а сразу ломаются.
Пластичность зависит и от чистоты
металла; так, очень чистый хром весьма
пластичен, но, загрязнённый даже
незначительными примесями, становится
хрупким и более твёрдым.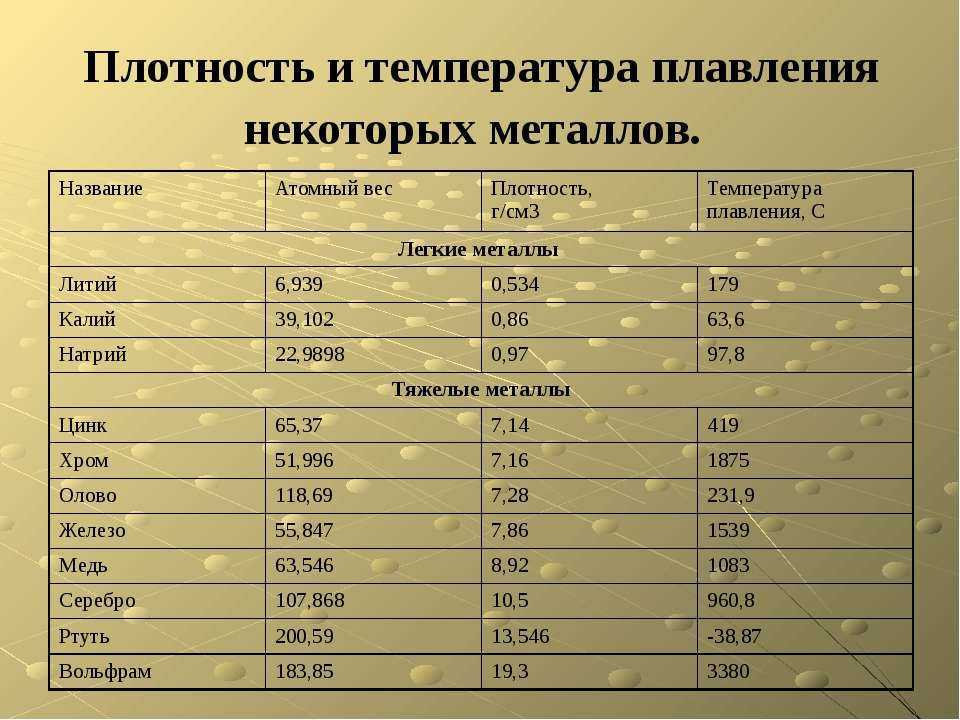
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов
также зависит от подвижности свободных
электронов. Поэтому ряд теплопроводностей
похож на ряд электропроводностей и
лучшим проводником тепла, как и
электричества, является серебро. Натрий
также находит применение как хороший
проводник тепла; широко известно,
например, применение натрия в клапанах
автомобильных двигателей для улучшения
их охлаждения.
Гладкая поверхность металлов отражает большой процент света — это явление называется металлическим блеском. Однако в порошкообразном состоянии большинство металлов теряют свой блеск; алюминий и магний, тем не менее, сохраняют свой блеск и в порошке. Наиболее хорошо отражают свет алюминий, серебро и палладий — из этих металлов изготовляют зеркала. Для изготовления зеркал иногда применяется и родий, несмотря на его исключительно высокую цену: благодаря значительно большей, чем у серебра или даже палладия, твёрдости и химической стойкости, родиевый слой может быть значительно тоньше, чем серебряный.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
]Химические свойства металлов
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
Реакции с простыми веществами
С кислородом реагируют все металлы, кроме золота, платины.
 Реакция с серебром происходит при
высоких температурах, но оксид серебра(II)
практически не образуется, так как он
термически неустойчив. В зависимости
от металла на выходе могут
оказаться оксиды, пероксиды, надпероксиды:
Реакция с серебром происходит при
высоких температурах, но оксид серебра(II)
практически не образуется, так как он
термически неустойчив. В зависимости
от металла на выходе могут
оказаться оксиды, пероксиды, надпероксиды:
оксид лития пероксид натрия надпероксид калия Чтобы получить из пероксида оксид, пероксид восстанавливают металлом: Со средними и малоактивными металлами реакция происходит при нагревании:
При нагревании:
Железо взаимодействует с серой при нагревании, образуя сульфид:
С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
[править]Взаимодействие кислот с металлами
С
кислотами металлы реагируют по-разному.
Металлы, стоящие в электрохимическом
ряду активности металлов (ЭРАМ)
до водорода, взаимодействуют практически
со всеми кислотами.
Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода
Происходит реакция замещения, которая также является окислительно-восстановительной:
[править]Взаимодействие серной кислоты H2SO4 с металлами
Окисляющие кислоты могут взаимодействовать и с металлами, стоящими в ЭРАМ после водорода:
Очень разбавленная кислота реагирует с металлом по классической схеме:
При увеличении концентрации кислоты образуются различные продукты:
[править]Реакции для азотной кислоты (HNO3)
Продукты взаимодействия железа с HNO3 разной концентрации
При взаимодействии с активными металлами вариантов реакций ещё больше:
[править]Легирование
Легирование —
это введение в расплав дополнительных
элементов, модифицирующих механические,
физические и химические свойства
основного материала.
[править]Микроскопическое строение
Характерные свойства металлов можно понять, исходя из их внутреннего строения. Все они имеют слабую связь электронов внешнего энергетического уровня (другими словами, валентных электронов) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов (называемых электронами проводимости) в кристаллической решётке. Совокупность таких электронов часто называют электронным газом. Вклад в теплопроводность, помимо электронов, дают фононы (колебания решётки). Пластичность обусловлена малым энергетическим барьером для движения дислокаций и сдвига кристаллографических плоскостей. Твёрдость можно объяснить большим числом структурных дефектов (междоузельные атомы, вакансии и др.).
Из-за
лёгкой отдачи электронов возможно
окисление металлов, что может приводить
к коррозии и
дальнейшей деградации свойств. Способность
к окислению можно узнать по стандартному
ряду активности металлов. Этот факт
подтверждает необходимость использования
металлов в комбинации с другими элементами
(сплав,
важнейшим из которых является сталь),
их легирование и применение различных
покрытий.
Этот факт
подтверждает необходимость использования
металлов в комбинации с другими элементами
(сплав,
важнейшим из которых является сталь),
их легирование и применение различных
покрытий.
Для более корректного описания электронных свойств металлов необходимо использовать квантовую механику. Во всех твёрдых телах с достаточной симметрией уровни энергии электронов отдельных атомов перекрываются и образуют разрешённые зоны, причём зона, образованная валентными электронами, называется валентной зоной. Слабая связь валентных электронов в металлах приводит к тому, что валентная зона в металлах получается очень широкой, и всех валентных электронов не хватает для её полного заполнения.
Принципиальная особенность такой частично заполненной зоны состоит в том, что даже при минимальном приложенном напряжении в образце начинается перестройка валентных электронов, т. е. течёт электрический ток.
Та
же высокая подвижность электронов
приводит и к высокой теплопроводности,
а также к способности зеркально отражать
электромагнитное излучение (что и
придаёт металлам характерный блеск).
Гру́ппа вана́дия — химические элементы 5-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы побочной подгруппы V группы)[1]. В группу входят ванадий V, ниобий Nb и тантал Ta[2]. На основании электронной конфигурации атома к этой же группе относится и элементдубний Db, искусственно синтезированный в наукограде Дубне в 1970 г. группой Г. Н. Флёрова путём бомбардировки ядер 243Am ионами 22Ne[3] и независимо в Беркли (США) в реакции 249Cf+15N→260Db+4n[4].
Гру́ппа
хро́ма —
химические элементы 6-й группы периодической
таблицы химических элементов (по устаревшей
классификации —
элементы побочной подгруппы VI группы)[1]. В группу входят хром Сr, молибден Mo
и вольфрам W[2].
На внешнем энергетическом уровне у
атомов хрома и молибдена находится один
электрон, у вольфрама — два, поэтому
характерным признаком данных элементов
является металлический блеск, что и
отличает эту побочную подгруппу от
главной. Степень окисления в соединениях
всех элементов подгруппы хрома равна
+6, а также +5, +4, +3 и +2. По возрастанию
порядкового номера элементов возрастает
и температура плавления. Например,
вольфрам — самый тугоплавкий метал,
его температура
плавления составляет
3390 °C. Элементы подгруппы достаточно
устойчивы к внешним факторам (воздух,
вода). По физическим и химическим
свойствам молибден и вольфрам сходны,
но отличаются от хрома[3].
В группу входят хром Сr, молибден Mo
и вольфрам W[2].
На внешнем энергетическом уровне у
атомов хрома и молибдена находится один
электрон, у вольфрама — два, поэтому
характерным признаком данных элементов
является металлический блеск, что и
отличает эту побочную подгруппу от
главной. Степень окисления в соединениях
всех элементов подгруппы хрома равна
+6, а также +5, +4, +3 и +2. По возрастанию
порядкового номера элементов возрастает
и температура плавления. Например,
вольфрам — самый тугоплавкий метал,
его температура
плавления составляет
3390 °C. Элементы подгруппы достаточно
устойчивы к внешним факторам (воздух,
вода). По физическим и химическим
свойствам молибден и вольфрам сходны,
но отличаются от хрома[3].
Подгру́ппа
ма́рганца —
химические элементы 7-й группы периодической
таблицы химических элементов (по устаревшей
классификации —
элементы побочной подгруппы VII группы)[1]. В группу входят переходные
металлы марганец Mn, технеций Tc
и рений Re.[2] На
основании электронной конфигурации
атома к этой же группе относится и
элемент борий Bh,
искусственно синтезированный в 1976 г.
группой Юрия
Оганесяна из Объединённого
института ядерных исследований вДубне[3].
В группу входят переходные
металлы марганец Mn, технеций Tc
и рений Re.[2] На
основании электронной конфигурации
атома к этой же группе относится и
элемент борий Bh,
искусственно синтезированный в 1976 г.
группой Юрия
Оганесяна из Объединённого
института ядерных исследований вДубне[3].
Как и в других группах, члены этого семейства элементов проявляют закономерности электронной конфигурации, особенно внешних оболочек, в результате проявляется сходство физических свойств и химического поведения:
Какова плотность нержавеющей стали?
В материальном мире плотность имеет значение.
Возможно, мы не тратим много времени на размышления о плотности вещества, но металлурги и инженеры, вероятно, думают о плотности больше, чем думает большинство потребителей.
Плотность объекта определяет, будет ли он плавать или тонет. Знаете ли вы, почему крошечный камешек падает на дно стакана с водой, а гигантское бревно плавает на поверхности реки? Плотность. Галька более плотная, чем вода, а дерево менее плотное.
Галька более плотная, чем вода, а дерево менее плотное.
Kloeckner Metals является поставщиком и сервисным центром полного ассортимента нержавеющей стали. Загрузите нашу спецификацию нержавеющей стали, чтобы узнать, что Kloeckner Metals регулярно поставляет на склад.
Спецификация из нержавеющей стали
Как и галька, сталь плотнее воды, но корабли, сделанные из тонн стали, постоянно перевозят грузы и пассажиров по поверхности океана. Как плотность объясняет это? И почему мы вообще обсуждаем плотность?
По мере того, как исследователи узнавали больше о плотности, они также обнаружили, как использовать эту концепцию для развития технологий. Возвращаясь к примеру с кораблем, мы знаем, что воздух внутри камер плавучести корабля менее плотный, чем вода под ним. Вот почему стальной корабль плавает, а стальная подводная лодка тонет.
Плотность важна для производителей, поскольку она связана с массой и объемом продукта. Вместе эти факторы определяют размер и плавучесть, которые влияют на транспортировку, вес и полезность металлического изделия в данной среде.
Вместе эти факторы определяют размер и плавучесть, которые влияют на транспортировку, вес и полезность металлического изделия в данной среде.
Что такое плотность?
В общих чертах слово плотность относится к количеству чего-то в пределах определенного пространства. Когда мы говорим, что Манхэттен густонаселен , мы имеем в виду, что многие люди живут в пределах района.
С научной точки зрения плотность определяется как массы на единицу объема . В алгебраическом выражении формула выглядит так:
p=m/V
В этом расчете плотность (p) равна массе (m), деленной на объем (V).
Плотность также является интенсивным свойством, что означает, что плотность объекта никогда не меняется независимо от того, сколько его присутствует.
Рассмотрим старый вопрос: Что весит больше, тонна кирпичей или тонна перьев? Ответ, конечно же, в том, что оба весят одинаково — одну тонну. Сила шутки заключается в концепции плотности, а не веса. Плотность кирпича составляет 1,992 грамма на кубический сантиметр, а плотность пера — около 0,0025 грамма на кубический сантиметр. Вот почему один квадратный дюйм кирпича весит больше, чем один квадратный дюйм перьев, фактически примерно в 800 раз больше.
Плотность кирпича составляет 1,992 грамма на кубический сантиметр, а плотность пера — около 0,0025 грамма на кубический сантиметр. Вот почему один квадратный дюйм кирпича весит больше, чем один квадратный дюйм перьев, фактически примерно в 800 раз больше.
Говоря о единицах измерения, плотность может быть измерена в килограммах на кубический метр (кг/м 3 ), граммах на кубический сантиметр (г/см 3 ), граммах на кубический метр (г/м 3 ), или фунтов на дюйм в кубе (lb/in 3 ). Чтобы рассчитать плотность объекта из нержавеющей стали или перевести плотность из одной единицы измерения в другую, вы можете воспользоваться нашим металлокалькулятором для расчета веса и плотности нержавеющей стали.
Почему важна плотность?
Промышленные дизайнеры учитывают несколько факторов, связанных с металлом, когда разрабатывают свои концепции. Плотность является одним из таких факторов. Один металл может быть намного плотнее другого. Например, если вы проектируете лампу для размещения на столе, плотность используемого материала может не иметь большого значения. Если вы проектируете самолет, который должен отрываться от земли и оставаться в воздухе, плотность вдруг становится действительно очень важной.
Например, если вы проектируете лампу для размещения на столе, плотность используемого материала может не иметь большого значения. Если вы проектируете самолет, который должен отрываться от земли и оставаться в воздухе, плотность вдруг становится действительно очень важной.
Плотность также имеет значение, когда металлурги смешивают один металл с другим для получения сплава. Сталь представляет собой сплав железа, углерода и других химических веществ. Различные типы стали состоят из различных смесей химических элементов. Нержавеющая сталь, например, содержит не менее 10,5% хрома, тогда как углеродистая сталь имеет более низкое содержание хрома. Следовательно, плотность простой стали немного отличается от плотности нержавеющей стали.
При создании новой марки стали или сварке одного вида стали с другим плотность влияет на прочность, твердость и пластичность получаемого материала.
По сравнению со многими другими металлами сталь является чрезвычайно плотным материалом. Титан, например, имеет плотность примерно в два раза меньше плотности стали, а алюминий — примерно одну треть плотности.
Титан, например, имеет плотность примерно в два раза меньше плотности стали, а алюминий — примерно одну треть плотности.
Плотность обычной стали составляет около 490 фунтов на кубический фут, что также может быть выражено как 7,85 г/см 3 . Плотность углеродистой стали около 7,84 г/см 3 , плотность чистого железа составляет около 7,86 г/см 3 , а плотность нержавеющей стали — около 8,03 г/см 3 . Из-за конкретной марки и химического состава стали ее плотность немного различается.
Нержавеющая сталь является самой плотной разновидностью стали, но как зависит плотность различных типов нержавеющей стали?
Давайте рассмотрим две наиболее часто используемые марки нержавеющей стали — нержавеющую сталь 304 и нержавеющую сталь 316. Плотность марки 304 составляет 79.30 кг/м 3 , тогда как плотность марки 316 составляет около 7980 кг/м 3 . Различный химический состав и содержание этих двух сортов определяют разницу в их плотности.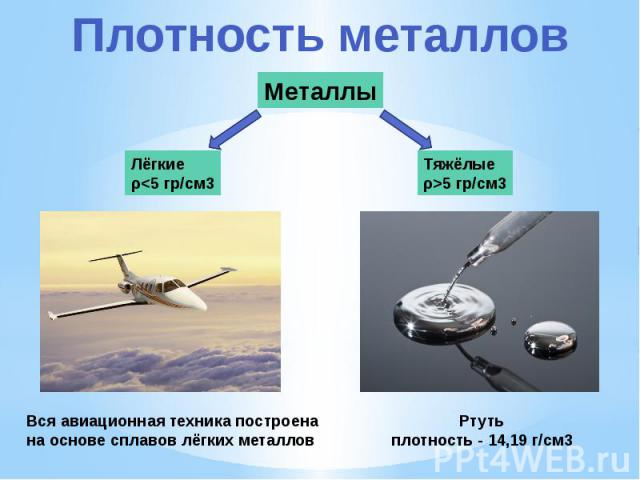 Нержавеющая сталь 304 менее плотная, чем 316, но имеет несколько более высокую плотность, чем нержавеющая сталь 430: 7750 г/м 3 .
Нержавеющая сталь 304 менее плотная, чем 316, но имеет несколько более высокую плотность, чем нержавеющая сталь 430: 7750 г/м 3 .
Плотность влияет на вес. (Помните пример с кирпичами и перьями?) Таким образом, изделие из нержавеющей стали весит больше, чем изделие из углеродистой стали того же размера, а изделие из нержавеющей стали марки 316 весит больше, чем такое же изделие, изготовленное из нержавеющей стали марки 304.
В целом, однако, один кубический фут нержавеющей стали весит около 490 фунтов.
Как использовать свои знания о плотности при выборе материалов
Что следует помнить о плотности при выборе материала для производства или строительства?
При выборе металла, подходящего для вашего проекта, учитывайте несколько факторов. Вы должны думать как о физических свойствах металла — его температуре плавления, проводимости, так и (да) о его плотности. Вы также должны учитывать его механические свойства, такие как прочность, пластичность и сопротивление.
Создавая свои изобретения, инженеры взвешивают относительные преимущества каждого свойства, определяя, из каких материалов должен состоять их новый продукт.
Плотность особенно важна для проектов, где вес имеет решающее значение. Инженеры попытаются найти продукт с низкой плотностью, если им нужно контролировать вес объекта. Тем не менее, они также должны учитывать соотношение прочности к весу, чтобы материал продукта был достаточно прочным, чтобы выполнять свою работу.
Высокоплотный сплав, такой как сталь, намного прочнее многих других металлов. А поскольку нержавеющая сталь также устойчива к коррозии и привлекательна для глаз, она является популярным выбором для всего, от кухонной утвари до хирургических принадлежностей.
Благодаря высокому коэффициенту относительной прочности нержавеющей стали инженеры могут использовать более тонкие варианты материала для изготовления различных изделий. Вот почему хирургическое лезвие может быть микротонким и одновременно очень прочным.
Чтобы узнать больше о составе и использовании нержавеющей стали, посетите другие статьи на нашем сайте.
Свяжитесь с нашей квалифицированной командой сегодняKloeckner Metals является поставщиком полного ассортимента нержавеющей стали и сервисным центром. Kloeckner Metals сочетает в себе национальное присутствие с новейшими технологиями производства и обработки и самыми инновационными решениями для обслуживания клиентов.
Свяжитесь с нами сейчас
плотности металлов и элементов Таблица
Связанные ресурсы: Материалы
Плотности металлов и элементов Таблица
Инженерные материалы
Двор. Дань металлов и элементы Таблицы
Дятель. масса на единицу объема
Преобразование:
Для плотности в фунтах/футах 3 , умножьте фунты/дюймы. 3 к 1728; для г/см 3 , умножьте плотность в фунтах/дюймах. 3 на 27,68; для кг/м 3 , умножьте плотность в фунтах/дюймах. 3 по 27679.9
3 по 27679.9

 : пластичность;
однако некоторые металлы,
например германий и висмут,
непластичны)
: пластичность;
однако некоторые металлы,
например германий и висмут,
непластичны) 2
2 5
5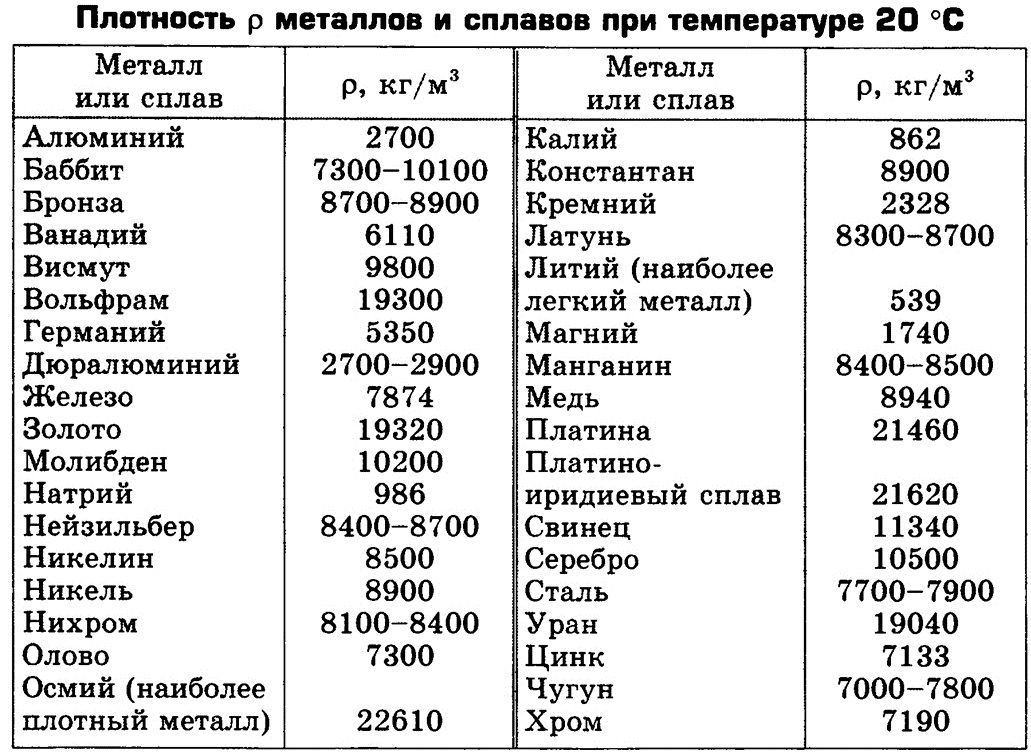 5
5 5
5 5
5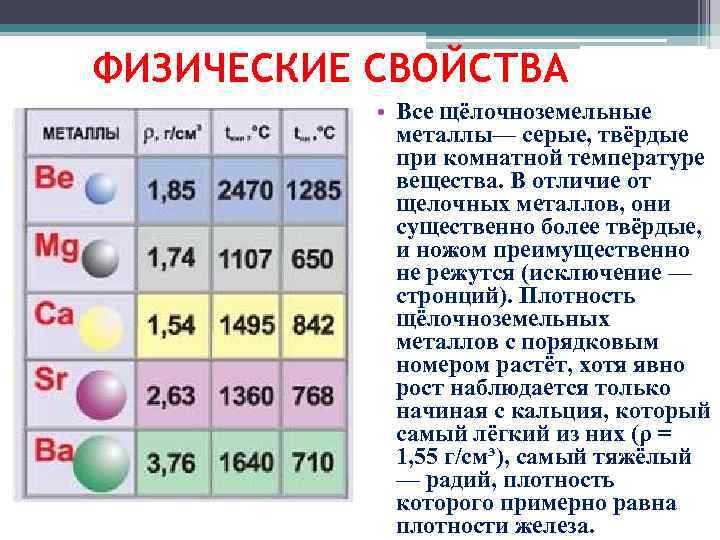 5
5 Реакция с серебром происходит при
высоких температурах, но оксид серебра(II)
практически не образуется, так как он
термически неустойчив. В зависимости
от металла на выходе могут
оказаться оксиды, пероксиды, надпероксиды:
Реакция с серебром происходит при
высоких температурах, но оксид серебра(II)
практически не образуется, так как он
термически неустойчив. В зависимости
от металла на выходе могут
оказаться оксиды, пероксиды, надпероксиды: 07
07 01
01 20
20