Как получить бутан
Газ бутан широко применяется на производстве, в сельском хозяйстве и пищевой промышленности. Из бутана и его изомеров получают масляную кислоту, бутанол и некоторые другие вещества, которые используют как в неизменном виде, так и в качестве сырья для получения других химикатов. Существуют три способа получения этого газа.
Спонсор размещения P&G Статьи по теме «Как получить бутан» Как из этана получить бутан Как из бутана получить бутен Как найти скорость, время, расстояниеИнструкция
1
Бутан представляет собой органическое соединение, принадлежащее к классу алканов. Он является бесцветным горючим газом, который хорошо растворяется в органических растворителях, но нерастворим в воде. Он содержится в нефтепродуктах и природном газе. У бутана имеются изомеры: изобутан и н-бутан. Этот газ применяют в промышленности и сельском хозяйстве. При сгорании он разлагается до углекислого газа и воды. Бутан малотоксичен, но негативно воздействует на нервную и сердечно-сосудистую системы. Поэтому при работе с бутаном нельзя вдыхать его пары и следует избегать его попадания на кожу и слизистые оболочки.
2
Бутан получают тремя способами. Первый из них, самый распространенный — использование реакции Вюрца. Второй способ — гидрирование алкинов до алканов. Третий заключается в дегидратации спиртов в присутствии катализатора до бутена, который затем подвергают гидрированию. Первая из этих реакций позволяет получить бутан напрямую, остальные же являются многоступенчатыми.
3
Для проведения реакции Вюрца требуется взять металлический натрий и добавить его к йодистому этилу. Продуктом реакции сразу станет бутан:
Ch4-Ch3-I+2Na+I-Ch3-Ch4
-2NaI > Ch4-Ch3-Ch3-Ch4
4
Второй способ получения бутана — гидрирование бутина. Первоначально 1-бутин гидрируют до 1-бутена, а затем 1-бутен вторично гидрируют до бутана:
Ch4-Ch3-C CH > Ch4-Ch3-CH=Ch3 > Ch4-Ch3-Ch3-Ch4 (Гидрирование по h3)
1-бутин 1-бутен бутан
5
Третий процесс получения бутана также является многоступенчатым. Первый его этап включает в себя дегидратацию бутилового спирта в присутствии Al2O3 при температуре 300-400оC:
Ch4-Ch3-Ch3-Ch3-OH > Ch4-Ch3-CH=Ch3 (Al2O3; 300 — 400оC)
Дегидратация бутанола заключается в его осушении. Она возможна при высокой температуре и только в присутствии катализаторов (Al2O3; h3SO4).
Получив из предыдущей реакции 1-бутен, его гидрируют по водородному радикалу до бутана:
Ch4-Ch3-CH=Ch3 > Ch4-Ch3-Ch3-Ch4 (Гидрирование по h3)
Все вышеуказанные способы позволяют получить бутан в чистом виде. Чаще всего для получения этого газа используется первый из них, однако, в ряде случаев находят применение и остальные.
Как простоРеферат Бутан (химия)
скачатьРеферат на тему:
План:
- Введение
- 1 Изомерия
- 2 Физические свойства
- 3 Нахождение и получение
- 4 Сероочистка (демеркаптанизация) бутановой фракции
- 5 Применение и реакции
- 6 Биологические эффекты
- 7 Безопасность Примечания
Введение
Бута́н (C4H10) — органическое соединение класса алканов. В химии название используется в основном для обозначения н-бутана. Такое же название имеет смесь н-бутана и его изомера изобутана CH(CH3)3. Название происходит от корня «бут-» (английское название масляной кислоты — butyric acid) и суффикса «-ан» (принадлежность к алканам). Ядовит, вдыхание бутана вызывает дисфункцию лёгочно-дыхательного аппарата. Содержится в природном газе, образуется при крекинге нефтепродуктов, при разделении попутного нефтяного газа, «жирного» природного газа. Как представитель углеводородных газов пожаро- и взрывоопасен, малотоксичен, имеет специфический характерный запах, обладает наркотическими свойствами. [1] Вредно воздействует на нервную систему[2].
1. Изомерия
Бутан имеет два изомера:
| название | формула | структурная формула | температура плавления, °С | температура кипения, °С |
| н-бутан | CH3–CH2–CH2–CH3 | −138,3 | −0,5 | |
| изобутан | CH(CH3)3 | −159,6 | −11,7 |
2. Физические свойства
Бутан — бесцветный горючий газ, с специфическим запахом, легко сжижаемый (ниже 0 °C и нормальном давлении или при повышенном давлении и обычной температуре — легколетучая жидкость). Точка замерзания -138°С (при нормальном давлении). Растворимость в воде — 6,1 мг в 100 мл воды (для н-бутана, при 20 °C, значительно лучше растворяется в органических растворителях
3. Нахождение и получение
Содержится в газовом конденсате и нефтяном газе (до 12 %). Является продуктом каталитического и гидрокаталитического крекинга нефтяных фракций. В лаборатории может быть получен по реакции Вюрца.
- 2 C2H5Br + 2Na → CH3-CH2-CH2-CH3 + 2NaBr
4. Сероочистка (демеркаптанизация) бутановой фракции
Прямогонную бутановую фракцию необходимо очищать от сернистых соединений, которые в основном представлены метил- и этил- меркаптанами. Метод очистки бутановой фракции от меркаптанов заключается в щелочной экстракции меркаптанов из углеводородной фракции и последующей регенерации щелочи в присутствии гомогенных или гетерогенных катализаторов кислородом воздуха с выделением дисульфидного масла.
5. Применение и реакции
При свободнорадикальном хлорировании образует смесь 1-хлор- и 2-хлорбутана. Их соотношение хорошо объясняется разницей в прочности С-Н связей в позиции 1 и 2 (425 and 411 кДж/моль). При полном сгорании на воздухе образует углекислый газ и воду. Бутан применяется в смеси с пропаном в зажигалках, в газовых баллонах в сжиженном состоянии, где он имеет запах, так как содержит специально добавленные одоранты. При этом используются «зимние» и «летние» смеси с различным составом. Теплота сгорания 1 кг — 45,7 МДж (12,72 кВт·ч).
- 2C4H10 + 13 O2 → 8 CO2 + 10 H2O
При недостатке кислорода образуется сажа или угарный газ или то и другое вместе.
- 2C4H10 + 5 O2 → 8 C + 10 H2O
- 2C4H10 + 9 O2 → 8 CO + 10 H2O
Фирмой Дюпон разработан метод получения малеинового ангидрида из н-бутана при каталитическом окислении.
- 2 CH3CH2CH2CH3 + 7 O2 → 2 C2H2(CO)2O + 8 H2O
н-Бутан — сырьё для получения бутена, 1,3-бутадиена, компонент бензинов с высоким октановым числом. Бутан высокой чистоты и особенно изобутан может быть использован в качестве хладагента в холодильных установках. Производительность таких систем немного ниже, чем фреоновых. Бутан безопасен для окружающей среды, в отличие от фреоновых хладагентов.
В пищевой промышленности бутан зарегистрирован в качестве пищевой добавки E943a, а изобутан — E943b, как пропеллент, например, в дезодорантах.
6. Биологические эффекты
Вдыхание бутана вызывает удушье и сердечную аритмию. При попадании на тело сжиженного газа или струи его испарений вызывает охлаждение до −20 °C, что крайне опасно при ингаляциях.
7. Безопасность
Легковоспламеним. Пределы взрываемости 1,9 — 8,4 % в воздухе по обьёму. ПДК 300 мг/м³.
Примечания
- ГОСТ 20448-90. Газы углеводородные сжиженные топливные для коммунально-бытового потребления — www.nge.ru/g_20448-90.htm
- Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, нбутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003) — www.bestpravo.ru/fed2003/data07/tex22892.htm
- Химическая энциклопедия Т1, М. 1988, стр. 331, Статья «Бутаны»
wreferat.baza-referat.ru
Формула бутана в химии
Определение и формула бутана
Химическая формула –
Молярная масса равна г/моль.
Физические свойства – бесцветный горючий газ, со специфическим запахом.
Содержится в газовом конденсате и нефтяном газе (до ). Является продуктом каталитического и гидрокаталитического крекинга нефтяных фракций.
Имеет два изомера: нормальный бутан и изобутан.

Химические свойства бутана
- Бутан имеет химические свойства идентичные с другими алканами:
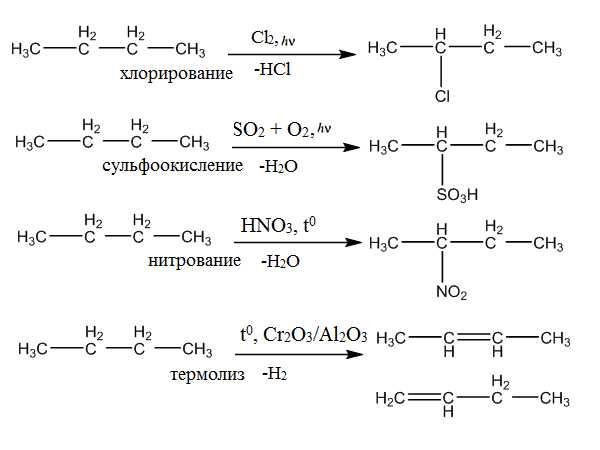
Получение
- В отличие от низших алканов, бутан можно достаточно легко получить в лабораторных условиях с применением синтеза Вюрца.
Применение
н-Бутан применяется в общем и тонком органическом синтезе в промышленности. Является исходным веществом получения бутилена, бутадиена-1,3.
Входит в состав бензинов с высоким октановым числом.
Бутан высокой степени очистки может быть применен в качестве хладагента.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Бутан (химия) Википедия
| Бутан | |
| Общие | |
|---|---|
| Хим. формула | C4H10 |
| Физические свойства | |
| Молярная масса | 58,12 г/моль |
| Плотность | 0,6010 (при 0 °C) г/см³ |
| Энергия ионизации | 10,63 ± 0,01 эВ[1] |
| Термические свойства | |
| Т. плав. | −138,4 °C |
| Т. кип. | −0,5 °C |
| Т. всп. | −76 °F[2] и −60 градус Цельсия[2] |
| Т. свспл. | 372 °C |
| Пр. взрв. | 1,6 ± 0,1 об.%[1] |
| Давление пара | 2,05 ± 0,01 атм[1] |
| Химические свойства | |
| Растворимость в воде | 6,1 мг в 100 мл |
| Классификация | |
| Рег. номер CAS | 106-97-8 |
| PubChem | 7843 |
| Рег. номер EINECS | 203-448-7 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E943a |
| RTECS | EJ4200000 |
| ChEBI | 37808 |
| Номер ООН | 1011 |
| ChemSpider | 7555 |
| Безопасность | |
| ПДК | 300 мг/м³ |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Бута́н (C4H10) — органическое соединение, углеводород класса алканов. В химии название используется в основном для обозначения н-бутана. Такое же название имеет смесь н-бутана и его изомера изобутана CH(CH3)3. Название происходит от корня «бут-» (французское название масляной кислоты — acide butyrique, от др.-греч. βούτῡρον, масло[3]) и суффикса «-ан» (принадлежность к алканам). Вдыхание бутана вызывает дисфункцию лёгочно-дыхательного аппарата. Содержится в природном газе, образуется при крекинге нефтепродуктов, при разделении попутного нефтяного газа, «жирного» природного газа. Как представитель углеводородных газов пожаро- и взрывоопасен, малотоксичен, имеет специфический характерный запах, обладает наркотическими свойствами. По степени воздействия на организм газ относится к веществам 4-го класса опасности (малоопасные) по ГОСТ 12.1.007-76[4]. Вредно воздействует на нервную систему[5].
Изомерия
Бутан имеет два изомера:
| название | формула | структурная формула | температура плавления, °С | температура кипения, °С |
| н-бутан | CH3–CH2–CH2–CH3 | −138,3 | −0,5 | |
| изобутан | CH(CH3)3 | −159,6 | −11,7 |
Физические свойства
Бутан — бесцветный горючий газ, со специфическим запахом, при нормальном давлении легко сжижаем от −0,5 °C, замерзает при −138 °C; при повышенном давлении и обычной температуре — легколетучая жидкость. Критическая температура +152 °C, критическое давление 3,797 МПа.
- Растворимость в воде — 6,1 мг в 100 мл (для н-бутана, при 20 °C), значительно лучше растворяется в органических растворителях[6]). Может образовывать азеотропную смесь с водой при температуре около 100 °C и давлении 10 атм.
- Плотность жидкой фазы — 580 кг/м³[7]
- Плотность газовой фазы при нормальных условиях — 2,703 кг/м³.
- Теплота сгорания 45,8 МДж/кг (2657 МДж/моль (см.[8]).
Нахождение и получение
Содержится в газовом конденсате и нефтяном газе (до 12 %). Является продуктом каталитического и гидрокаталитического крекинга нефтяных фракций. В лаборатории может быть получен по реакции Вюрца:
- 2C2H5Br+2Na→C4h20+2NaBr{\displaystyle {\mathsf {2C_{2}H_{5}Br+2Na\rightarrow C_{4}H_{10}+2NaBr}}}
Сероочистка (демеркаптанизация) бутановой фракции
Прямогонную бутановую фракцию необходимо очищать от сернистых соединений, которые в основном представлены метил- и этил- меркаптанами. Метод очистки бутановой фракции от меркаптанов заключается в щелочной экстракции меркаптанов из углеводородной фракции и последующей регенерации щелочи в присутствии гомогенных или гетерогенных катализаторов кислородом воздуха с выделением дисульфидного масла.
Применение и реакции
При свободнорадикальном хлорировании образует смесь 1-хлор- и 2-хлорбутана. Их соотношение хорошо объясняется разницей в прочности связей С—Н в позиции 1 и 2 (425 и 411 кДж/моль).
При полном сгорании на воздухе образует углекислый газ и воду. Бутан применяется в смеси с пропаном в зажигалках, в газовых баллонах в сжиженном состоянии. Температура кипения бутана −0,5 °C, значительно выше, чем у пропана (−42 °C), поэтому в чистом виде его можно использовать только в теплом климате. Иногда используются «зимние» и «летние» смеси с различным составом (в летних бутана больше, в зимних — меньше). Теплота сгорания 1 кг — 45,7 МДж (12,72 кВт·ч).
- 2C4h20+13O2→8CO2+10h3O{\displaystyle {\mathsf {2C_{4}H_{10}+13O_{2}\rightarrow 8CO_{2}+10H_{2}O}}}
При недостатке кислорода образуется сажа, угарный газ или их смесь:
- 2C4h20+5O2→8C+10h3O{\displaystyle {\mathsf {2C_{4}H_{10}+5O_{2}\rightarrow 8C+10H_{2}O}}}
- 2C4h20+9O2→8CO+10h3O{\displaystyle {\mathsf {2C_{4}H_{10}+9O_{2}\rightarrow 8CO+10H_{2}O}}}
Фирмой DuPont разработан метод получения малеинового ангидрида из н-бутана при каталитическом окислении:
- 2C4h20+7O2→2C4h3O3+8h3O{\displaystyle {\mathsf {2C_{4}H_{10}+7O_{2}\rightarrow 2C_{4}H_{2}O_{3}+8H_{2}O}}}
н-Бутан — сырьё для получения бутилена, 1,3-бутадиена, компонент бензинов с высоким октановым числом. Бутан высокой чистоты и особенно изобутан может быть использован в качестве хладагента в холодильных установках. Производительность таких систем немного ниже, чем фреоновых, но бутан безопасен для окружающей среды, в отличие от фреоновых хладагентов.
В пищевой промышленности бутан зарегистрирован в качестве пищевой добавки E943a, а изобутан — E943b, как пропеллент.
Безопасность
Легковоспламеним. Пределы взрываемости 1,4—9,3 % в воздухе по объёму. ПДК в воздухе рабочей зоны — 300 мг/м³.
См. также
Примечания
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0068.html
- ↑ 1 2 https://pubchem.ncbi.nlm.nih.gov/compound/butane#section=Flash-Point
- ↑ В свою очередь, др.-греч. βούτῡρον «масло» происходит от βοῦς «корова, вол» и τυρός «сыр».
- ↑ ГОСТ 20448-90. Газы углеводородные сжиженные топливные для коммунально-бытового потребления
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, н-бутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003)
- ↑ Химическая энциклопедия Т1, М. 1988, стр. 331, Статья «Бутаны»
- ↑ Физико-химические свойства пропан-бутановой смеси
- ↑ Бутан: химически и физические свойства (недоступная ссылка)
Литература
Ссылки
wikiredia.ru
Бутан (вещество) — это… Что такое Бутан (вещество)?
Бута́н (C4H10) — органическое соединение класса алканов. В химии название используется в основном для обозначения н-бутана. Такое же название имеет смесь н-бутана и его изомера изобутана CH(CH3)3. Название происходит от корня «бут-» (английское название масляной кислоты — butyric acid) и суффикса «-ан» (принадлежность к алканам). В больших концентрациях ядовит, вдыхание бутана вызывает дисфункцию лёгочно-дыхательного аппарата. Содержится в природном газе, образуется при крекинге нефтепродуктов, при разделении попутного нефтяного газа, «жирного» природного газа. Как представитель углеводородных газов пожаро- и взрывоопасен, малотоксичен, имеет специфический характерный запах, обладает наркотическими свойствами. По степени воздействия на организм газ относится к веществам 4-го класса опасности (малоопасные) по ГОСТ 12.1.007-76.[1] Вредно воздействует на нервную систему[2].
Изомерия
Бутан имеет два изомера:
| название | формула | структурная формула | температура плавления, °С | температура кипения, °С |
| н-бутан | CH3–CH2–CH2–CH3 | −138,3 | −0,5 | |
| изобутан | CH(CH3)3 | −159,6 | −11,7 |
Физические свойства
Бутан — бесцветный горючий газ, со специфическим запахом, легко сжижаемый (ниже 0 °C и нормальном давлении или при повышенном давлении и обычной температуре — легколетучая жидкость). Точка замерзания -138°С (при нормальном давлении). Растворимость в воде — 6,1 мг в 100 мл воды (для н-бутана, при 20 °C, значительно лучше растворяется в органических растворителях[3]). Может образовывать азеотропную смесь с водой при температуре около 100 °C и давлении 10 атм.
- Плотность жидкой фазы = 580 кг/м3[4].
- Плотность газовой фазы при нормальных условиях = 2,703 кг/м3.
- Плотность газовой фазы при температуре при 15°С = 2,550 кг/м3.
Нахождение и получение
Содержится в газовом конденсате и нефтяном газе (до 12 %). Является продуктом гася каталитического и гидрокаталитического крекинга нефтяных фракций. В лаборатории может быть получен по реакции Вюрца:
Сероочистка (демеркаптанизация) бутановой фракции
Прямогонную бутановую фракцию необходимо очищать от сернистых соединений, которые в основном представлены метил- и этил- меркаптанами. Метод очистки бутановой фракции от меркаптанов заключается в щелочной экстракции меркаптанов из углеводородной фракции и последующей регенерации щелочи в присутствии гомогенных или гетерогенных катализаторов кислородом воздуха с выделением дисульфидного масла.
Применение и реакции
При свободнорадикальном хлорировании образует смесь 1-хлор- и 2-хлорбутана. Их соотношение хорошо объясняется разницей в прочности С-Н связей в позиции 1 и 2 (425 и 411 кДж/моль). При полном сгорании на воздухе образует углекислый газ и воду. Бутан применяется в смеси с пропаном в зажигалках, в газовых баллонах в сжиженном состоянии, где он имеет запах, так как содержит специально добавленные одоранты. При этом используются «зимние» и «летние» смеси с различным составом. Теплота сгорания 1 кг — 45,7 МДж (12,72 кВт·ч).
При недостатке кислорода образуется сажа или угарный газ или то и другое вместе.
Фирмой DuPont разработан метод получения малеинового ангидрида из н-бутана при каталитическом окислении:
н-Бутан — сырьё для получения бутена, 1,3-бутадиена, компонент бензинов с высоким октановым числом. Бутан высокой чистоты и особенно изобутан может быть использован в качестве хладагента в холодильных установках. Производительность таких систем немного ниже, чем фреоновых. Бутан безопасен для окружающей среды, в отличие от фреоновых хладагентов.
В пищевой промышленности бутан зарегистрирован в качестве пищевой добавки E943a, а изобутан — E943b, как пропеллент.
Биологические эффекты
Вдыхание бутана вызывает удушье и сердечную аритмию. При попадании на тело сжиженного газа или струи его испарений вызывает охлаждение до −20 °C, что крайне опасно при ингаляциях.
Безопасность
Легковоспламеним. Пределы взрываемости 1,9 — 8,4 % в воздухе по объёму. ПДК в воздухе рабочей зоны 300 мг/м³.
Примечания
- ↑ ГОСТ 20448-90. Газы углеводородные сжиженные топливные для коммунально-бытового потребления
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, нбутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003)
- ↑ Химическая энциклопедия Т1, М. 1988, стр. 331, Статья «Бутаны»
- ↑ Физико-химические свойства пропан-бутановой смеси
Ссылки
dic.academic.ru
Бутан получение — Найдите 3 способа получение Бутана.. Эт по химии… — 22 ответа
Получение бутана
В разделе Домашние задания на вопрос Найдите 3 способа получение Бутана.. Эт по химии… заданный автором староста лучший ответ это 1)2 Ch4-Ch3-CL +2Na——> Ch4-Ch3-Ch3-Ch4 +2NaCL
2) Ch4-Ch3-CH=Ch3 +h3——> Ch4-Ch3-Ch3-Ch4
3)C h4-Ch3-C-=CH +2h3——> Ch4-Ch3-Ch3-Ch4
Привет! Вот подборка тем с ответами на Ваш вопрос: Найдите 3 способа получение Бутана.. Эт по химии…
Ответ от Nebelyng[гуру]
ссылка как раз про три способа.
Ответ от Марина Никифорова[гуру]
ссылка
Ответ от Посоловеть[гуру]
Проще и чище всего — по реакции Дюма:
С4H9COONa+NaOH—t—>C4h20+Na2CO3
Ответ от Двутавровый[гуру]
я знаю, что по химии… а если у меня там тройка… зато «пять» по литературе…
не удаляй пока… пусть почитают химики, любящие поэзию…
Как же так же? Жид ты или ты не жид? Ты пан или пропан-бутан? Вот то-то и оно-то: Михаил Сухотин. Из цикла «ЦЕНТОНЫ И МАРГИНАЛИИ» МАРГИНАЛИИ РОЗА ЯАКОВА (маргиналии к Танаху) Памяти Я. А. Сатуновского 1989
Ответ от Егор иванченко[новичек]
бла бла бла
Ответ от V kampon[новичек]
ты что мет варить собрался
Ответ от Анастасия Духнова[новичек]
ясно
Ответ от Елена Алексеева[новичек]
Не ЗНАЮ
Ответ от Илья Ковров[новичек]
1)2 Ch4-Ch3-CL +2Na——> Ch4-Ch3-Ch3-Ch4 +2NaCL
2) Ch4-Ch3-CH=Ch3 +h3——> Ch4-Ch3-Ch3-Ch4
3)C h4-Ch3-C-=CH +2h3——> Ch4-Ch3-Ch3-Ch4
Ответ от Ёултан Тулеугали[новичек]
2 Ch4-Ch3-CL +2Na——> Ch4-Ch3-Ch3-Ch4 +2NaCL Ch4-Ch3-CH=Ch3 +h3——> Ch4-Ch3-Ch3-Ch4
C h4-Ch3-C-=CH +2h3——> Ch4-Ch3-Ch3-Ch4
ВО
Ответ от .[гуру]
Получение бутана 3 способами:
1. дегидрирование бутана
2.дегедрирование с выделением газа
3.фракционная перегонка
Ответ от Егор Лебедев[новичек]
Проще нету — по реакции Дюма:
С4H9COONa+NaOH—t—>C4h20+Na2CO3
Ответ от Omar Abdulov[новичек]
1)2 Ch4-Ch3-CL +2Na——> Ch4-Ch3-Ch3-Ch4 +2NaCL
2) Ch4-Ch3-CH=Ch3 +h3——> Ch4-Ch3-Ch3-Ch4
3)C h4-Ch3-C-=CH +2h3——> Ch4-Ch3-Ch3-Ch4
ну как то так
Ответ от Александор Костин[новичек]
1)2 Ch4-Ch3-CL +2Na——> Ch4-Ch3-Ch3-Ch4 +2NaCL
2) Ch4-Ch3-CH=Ch3 +h3——> Ch4-Ch3-Ch3-Ch4
3)C h4-Ch3-C-=CH +2h3——> Ch4-Ch3-Ch3-Ch4
ссылка как раз про три способа.
Ответ от Галя мошатина[новичек]
кек
Ответ от 2 ответа[гуру]
Привет! Вот еще темы с нужными ответами:
Ответить на вопрос:
22oa.ru
Бутан (вещество) Википедия
| Бутан | |
| Общие | |
|---|---|
| Хим. формула | C4H10 |
| Физические свойства | |
| Молярная масса | 58,12 г/моль |
| Плотность | 0,6010 (при 0 °C) г/см³ |
| Энергия ионизации | 10,63 ± 0,01 эВ[1] |
| Термические свойства | |
| Т. плав. | −138,4 °C |
| Т. кип. | −0,5 °C |
| Т. всп. | −76 °F[2] и −60 градус Цельсия[2] |
| Т. свспл. | 372 °C |
| Пр. взрв. | 1,6 ± 0,1 об.%[1] |
| Давление пара | 2,05 ± 0,01 атм[1] |
| Химические свойства | |
| Растворимость в воде | 6,1 мг в 100 мл |
| Классификация | |
| Рег. номер CAS | 106-97-8 |
| PubChem | 7843 |
| Рег. номер EINECS | 203-448-7 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E943a |
| RTECS | EJ4200000 |
| ChEBI | 37808 |
| Номер ООН | 1011 |
| ChemSpider | 7555 |
| Безопасность | |
| ПДК | 300 мг/м³ |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Бута́н (C4H10) — органическое соединение, углеводород класса алканов. В химии название используется в основном для обозначения н-бутана. Такое же название имеет смесь н-бутана и его изомера изобутана CH(CH3)3. Название происходит от корня «бут-» (французское название масляной кислоты — acide butyrique, от др.-греч. βούτῡρον, масло[3]) и суффикса «-ан» (принадлежность к алканам). Вдыхание бутана вызывает дисфункцию лёгочно-дыхательного аппарата. Содержится в природном газе, образуется при крекинге нефтепродуктов, при разделении попутного нефтяного газа, «жирного» природного газа. Как представитель углеводородных газов пожаро- и взрывоопасен, малотоксичен, имеет специфический характерный запах, обладает наркотическими свойствами. По степени воздействия на организм газ относится к веществам 4-го класса опасности (малоопасные) по ГОСТ 12.1.007-76[4]. Вредно воздействует на нервную систему[5].
Изомерия
Бутан имеет два изомера:
| название | формула | структурная формула | температура плавления, °С | температура кипения, °С |
| н-бутан | CH3–CH2–CH2–CH3 | −138,3 | −0,5 | |
| изобутан | CH(CH3)3 | −159,6 | −11,7 |
Физические свойства
Бутан — бесцветный горючий газ, со специфическим запахом, при нормальном давлении легко сжижаем от −0,5 °C, замерзает при −138 °C; при повышенном давлении и обычной температуре — легколетучая жидкость. Критическая температура +152 °C, критическое давление 3,797 МПа.
- Растворимость в воде — 6,1 мг в 100 мл (для н-бутана, при 20 °C), значительно лучше растворяется в органических растворителях[6]). Может образовывать азеотропную смесь с водой при температуре около 100 °C и давлении 10 атм.
- Плотность жидкой фазы — 580 кг/м³[7]
- Плотность газовой фазы при нормальных условиях — 2,703 кг/м³.
- Теплота сгорания 45,8 МДж/кг (2657 МДж/моль (см.[8]).
Нахождение и получение
Содержится в газовом конденсате и нефтяном газе (до 12 %). Является продуктом каталитического и гидрокаталитического крекинга нефтяных фракций. В лаборатории может быть получен по реакции Вюрца:
- 2C2H5Br+2Na→C4h20+2NaBr{\displaystyle {\mathsf {2C_{2}H_{5}Br+2Na\rightarrow C_{4}H_{10}+2NaBr}}}
Сероочистка (демеркаптанизация) бутановой фракции
Прямогонную бутановую фракцию необходимо очищать от сернистых соединений, которые в основном представлены метил- и этил- меркаптанами. Метод очистки бутановой фракции от меркаптанов заключается в щелочной экстракции меркаптанов из углеводородной фракции и последующей регенерации щелочи в присутствии гомогенных или гетерогенных катализаторов кислородом воздуха с выделением дисульфидного масла.
Применение и реакции
При свободнорадикальном хлорировании образует смесь 1-хлор- и 2-хлорбутана. Их соотношение хорошо объясняется разницей в прочности связей С—Н в позиции 1 и 2 (425 и 411 кДж/моль).
При полном сгорании на воздухе образует углекислый газ и воду. Бутан применяется в смеси с пропаном в зажигалках, в газовых баллонах в сжиженном состоянии. Температура кипения бутана −0,5 °C, значительно выше, чем у пропана (−42 °C), поэтому в чистом виде его можно использовать только в теплом климате. Иногда используются «зимние» и «летние» смеси с различным составом (в летних бутана больше, в зимних — меньше). Теплота сгорания 1 кг — 45,7 МДж (12,72 кВт·ч).
- 2C4h20+13O2→8CO2+10h3O{\displaystyle {\mathsf {2C_{4}H_{10}+13O_{2}\rightarrow 8CO_{2}+10H_{2}O}}}
При недостатке кислорода образуется сажа, угарный газ или их смесь:
- 2C4h20+5O2→8C+10h3O{\displaystyle {\mathsf {2C_{4}H_{10}+5O_{2}\rightarrow 8C+10H_{2}O}}}
- 2C4h20+9O2→8CO+10h3O{\displaystyle {\mathsf {2C_{4}H_{10}+9O_{2}\rightarrow 8CO+10H_{2}O}}}
Фирмой DuPont разработан метод получения малеинового ангидрида из н-бутана при каталитическом окислении:
- 2C4h20+7O2→2C4h3O3+8h3O{\displaystyle {\mathsf {2C_{4}H_{10}+7O_{2}\rightarrow 2C_{4}H_{2}O_{3}+8H_{2}O}}}
н-Бутан — сырьё для получения бутилена, 1,3-бутадиена, компонент бензинов с высоким октановым числом. Бутан высокой чистоты и особенно изобутан может быть использован в качестве хладагента в холодильных установках. Производительность таких систем немного ниже, чем фреоновых, но бутан безопасен для окружающей среды, в отличие от фреоновых хладагентов.
В пищевой промышленности бутан зарегистрирован в качестве пищевой добавки E943a, а изобутан — E943b, как пропеллент.
Безопасность
Легковоспламеним. Пределы взрываемости 1,4—9,3 % в воздухе по объёму. ПДК в воздухе рабочей зоны — 300 мг/м³.
См. также
Примечания
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0068.html
- ↑ 1 2 https://pubchem.ncbi.nlm.nih.gov/compound/butane#section=Flash-Point
- ↑ В свою очередь, др.-греч. βούτῡρον «масло» происходит от βοῦς «корова, вол» и τυρός «сыр».
- ↑ ГОСТ 20448-90. Газы углеводородные сжиженные топливные для коммунально-бытового потребления
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, н-бутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003)
- ↑ Химическая энциклопедия Т1, М. 1988, стр. 331, Статья «Бутаны»
- ↑ Физико-химические свойства пропан-бутановой смеси
- ↑ Бутан: химически и физические свойства (недоступная ссылка)
Литература
Ссылки
wikiredia.ru
