«Бериллий, магний и щелочноземельные металлы»
Конспект по химии № 1
Тема: Бериллий, магний и щелочноземельные металлы
ФИО: Волгунова Ольга Валерьевна
Тип урока: Комбинированный
Цель: Формирование системы знаний о бериллии, магнии щелочноземельных металлах и их соединениях.
Задачи урока:
Дидактические: Обеспечить в ходе урока изучение следующих основных химических понятий: химический элемент, простое вещество, химическая реакция на примере взаимодействия ЩЗМ с простыми и сложными веществами. Продолжать формирование следующие обобщенные умения и навыки (планировать ответ, писать в быстром темпе, извлекать информацию при слушании).
Развивающие: Развивать
у учащихся умения выделять главное, существенное в изучаемом материале; сравнивать,
составлять, обобщать, систематизировать, компактно и логически последовательно
излагать свои мысли. Развивать эмоции и мотивы учащихся, создавая на уроке
эмоциональные и мотивационные ситуации (удивления), используя яркие примеры,
иллюстрации, воздействующие на чувства учащихся.
Воспитательные: Продолжить формирование доброжелательного отношения друг к другу. Совершенствовать коммуникативные навыки при работе в паре.
Ход урока:
1. Актуализация знаний и самоопределение к деятельности
Сегодня мы с вами познакомимся с еще одним семейством металлов. Их гидроксиды, подобно гидроксидам щелочных металлов, растворяются в воде, т.е. являются щелочами.. «В природе они встречаются в состоянии соединений, образующих нерастворимую массу земли и сами в виде окисей имеют землистый вид», -так писал Д. И. Менделеев в «Основах химии». Что это за металлы? (Щелочноземельные металлы)
2. Этап открытия новых знаний
Давайте рассмотрим положение ЩЗМ в ПСХЭ Д.И. Менделеева.
Бериллий
Ве, магний Мg и
щелочноземельные металлы кальций Са, стронций Sr, барий Ва и радий Ra —
элементы главной подгруппы II группы. Атомы этих элементов содержат на внешнем
энергетическом уровне два электрона, которые они отдают при химических
взаимодействиях, и поэтому являются сильнейшими восстановителями.
Физические свойства. Простые вещества — серебристо-белые металлы, более твердые, чем щелочные. Имеют довольно высокую температуру плавления. По плотности все они, кроме радия, относятся к легким металлам. В связи с высокой химической активностью эти металлы хранят под слоем керосина. Поверхность бериллия и магния покрыта пленкой, поэтому они устойчивы по отношению к воде и кислороду воздуха при обычных условиях.
Химические свойства простых веществ.
1. Взаимодействие с простыми веществами
2Mg + O2 = 2MgO,
3Ca + N2 = Ca3N2.
Be + Cl2 = BeCl2,
Mg + S = MgS,
Sr + H2 = SrH2.
2Be + C = Be2C
M + 2C = MC2
1. Взаимодействие
с водой
Взаимодействие
с водой
Бериллий с водой не взаимодействует; магний реагирует с водой и водяным паром; кальций, стронций, барий энергично взаимодействуют с водой при комнатной температуре:
Mg + 2H2O = Mg(OH)2 + H2;
Ca + 2H2O = Ca(OH)2 + H2.
2. Взаимодействие с кислотами
Все металлы реагируют с кислотами:
Mg + 2HCl = MgCl2 + H2;
3. Восстановление металлов из оксидов и солей
Менее активные металлы и некоторые неметаллы могут быть получены восстановлением магнием и щелочно-земельными металлами:
2Mg + ZrO2 = Zr + 2MgO;
2Ca + SiO2 = Si + 2CaO.
Химические свойства оксидов. Типичные основные оксиды. Реагируют с водой (кроме BeO), кислотными оксидами и кислотами
MgO + H2O = Mg(OH)2
3CaO + P2O5 = Ca3(PO4)2
BeO + 2HNO3 = Be(NO3)2 + H2O
Химические свойства гидроксидов.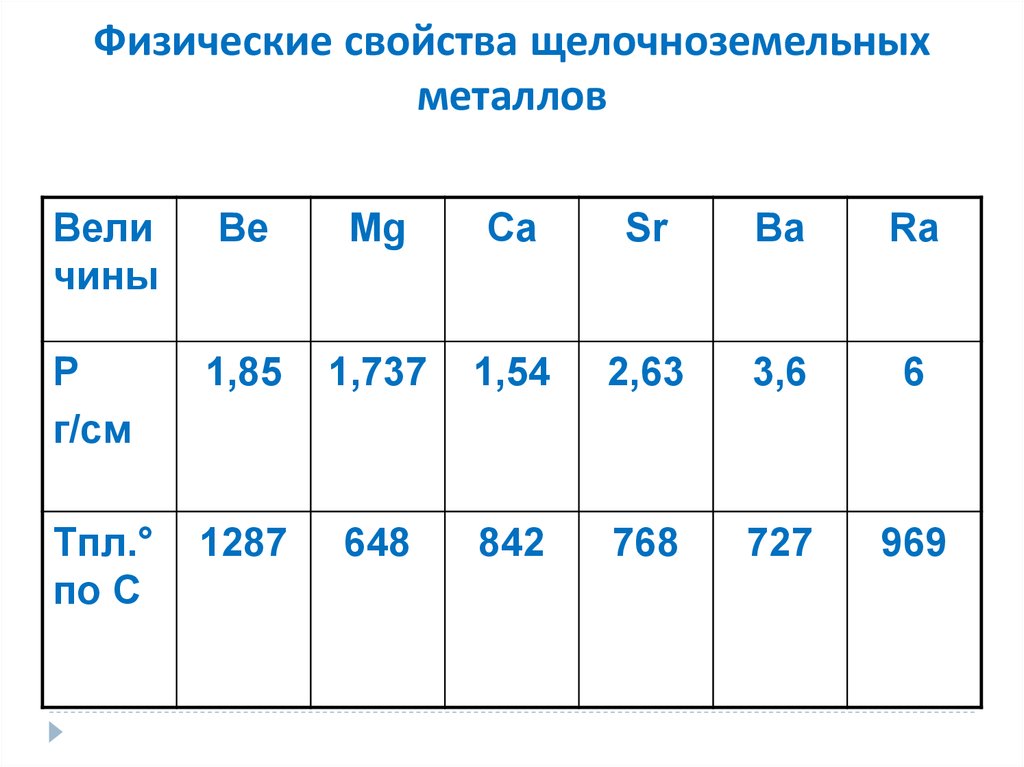
1) Реакции с кислотными оксидами:
Ca(OH)2 + SO2 = CaSO3 + H2O
2) Реакции с кислотами:
3) Реакции обмена с солями:
Ba(OH)2 + K2SO4 = BaSO4 + 2KOH
Эдгар По в рассказе «Небывалый аэростат» приводит перечень предметов в гондоле аэростата. Среди них есть известь и кофейник с приспособлениями для варки кофе.
Задание: Предложите способ варки кофе в этих условиях. Составьте список необходимых реактивов и оборудования. Запишите уравнения реакций.
Предлагаю по такому же принципу сварить яйцо.
В промышленности оксид кальция получают термическим разложением известняка (обжиг карбоната кальция):
CaCO3 = CaO + CO2
Получают путём взаимодействия оксида кальция (негашёной извести) с водой (процесс получил название «гашение извести»):
CaO + H2O → Ca(OH)2
Негашеная
известь — это оксид кальция CaO
Гашеная известь — это гидроксид кальция Ca(OH)2
Гашёная известь — получают путём «гашения» (то есть взаимодействия
с водой) «негашёной» извести оксида кальция. Известковая вода — прозрачный (близкий к насыщенному) водный раствор;известковое молоко — водная суспензия.
Известковая вода — прозрачный (близкий к насыщенному) водный раствор;известковое молоко — водная суспензия.
Опыт №1. (Демонстрационный)
Оборудование и реактивы: фарфоровая чашка, асбестовая сетка, ватман, нож, блюде, ложка; негашеная известь, вода, яйцо.
Яйцо поместить в фарфоровую чашку, засыпать негашеной известью и залить водой. Через минут 5-10 убрать яйцо и охладить.
Опыт №2.
Оборудование и реактивы: пробирка, трубочка, известковая вода.
В пробирку налить 1 мл известковой воды и аккуратно продувать с помощью трубочки до образования осадка.
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Если продолжить барботацию углекислого газа, выпавший осадок растворится, так как образуется кислая соль — гидрокарбонат кальция:
CaCO3 + CO2 + H2O → Ca(HCO3)2
Вы часто могли наблюдать накипь на
электронагревательных элементах в чайнике, стиральной машине, кипятильниках. Как вы думаете что это? Эта соли кальция и магния. Вода с большим
содержанием солей называется жёсткой, с малым содержанием — мягкой. Термин
«жёсткая» по отношению к воде исторически сложился из-за свойств тканей после
их стирки становиться более жёсткой на ощупь. Различают временную (карбонатную)
жёсткость, обусловленную гидрокарбонатами кальция и
магния Са(НСО3)2 и Mg(НСО3) 2, и постоянную
(некарбонатную) жёсткость, вызванную присутствием других солей, не выделяющихся
при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4,
CaCl2, MgSO4, MgCl2 . Жёсткая
вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование
жёсткой воды вызывает появление осадка (накипи) на стенках
котлов, в трубах и т.д. С ней вы подробно познакомитесь при изучении соединений
углерода.
Как вы думаете что это? Эта соли кальция и магния. Вода с большим
содержанием солей называется жёсткой, с малым содержанием — мягкой. Термин
«жёсткая» по отношению к воде исторически сложился из-за свойств тканей после
их стирки становиться более жёсткой на ощупь. Различают временную (карбонатную)
жёсткость, обусловленную гидрокарбонатами кальция и
магния Са(НСО3)2 и Mg(НСО3) 2, и постоянную
(некарбонатную) жёсткость, вызванную присутствием других солей, не выделяющихся
при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4,
CaCl2, MgSO4, MgCl2 . Жёсткая
вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование
жёсткой воды вызывает появление осадка (накипи) на стенках
котлов, в трубах и т.д. С ней вы подробно познакомитесь при изучении соединений
углерода.
3. Первичное закрепление новых знаний и включение новых знаний в систему знаний
Применение и
нахождение.
Где же еще можно встретить и использовать соединения ЩЗМ? Вам будут розданы карточки с определенной областью. Вам необходимо изучить в течении нескольких минут, и рассказать всему классу о том, что вы узнали из этих карточек.
Самый важный из минералов – известняк (карбонат кальция), без которого не обходится ни одно строительство. Во-первых, он сам является прекрасным строительным камнем. Во-вторых, это сырьё для получения цемента, гашёной и негашёной извести, стекла и др. Известковой щебёнкой укрепляют дороги. Природный мел представляет собой остатки раковин древних животных. Мел применяют для побелки, а также и в школе – школьный мел.
Выступление агронома:
Среднего содержания кальция в почвах
(1,37%) вполне достаточно для обеспечения физиологических потребностей
растений. Тем не менее, соединения кальция вносят в почвы для химической
мелиорации: известковым порошком уменьшают кислотность почв, гипсованием
устраняют избыточную щёлочность.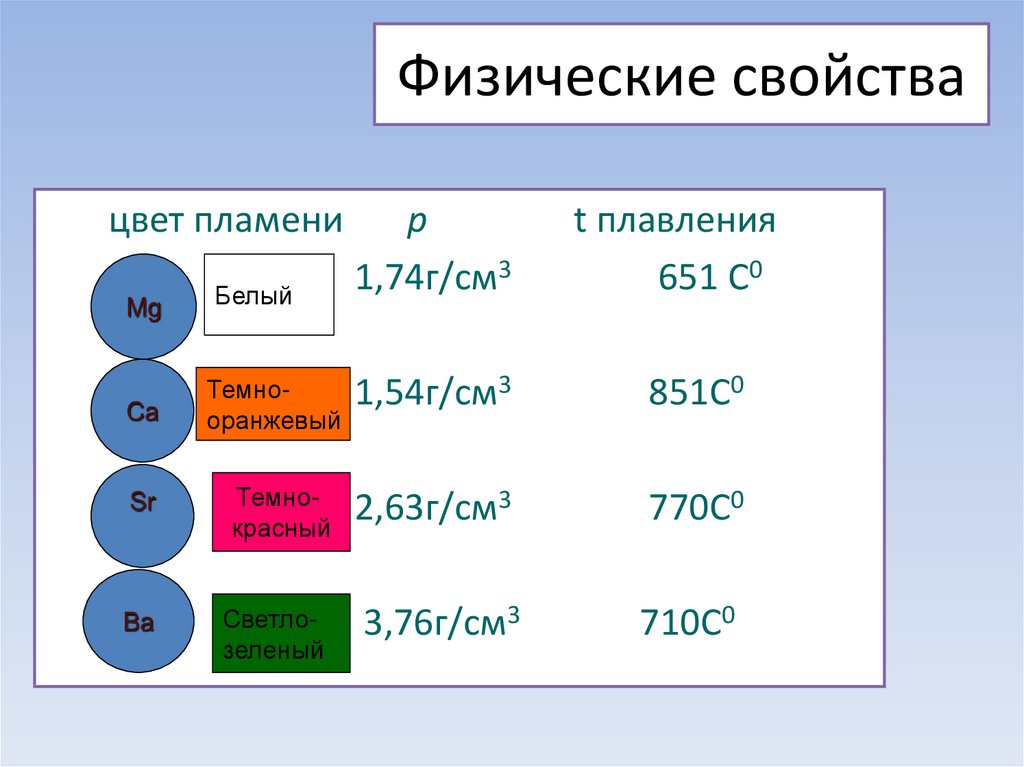 Нитрат и фосфаты кальция используются как
азотные удобрения.
Нитрат и фосфаты кальция используются как
азотные удобрения.
Выступление скульптора:
Минерал скульпторов – мрамор (карбонат кальция). Из него создавал свои прекрасные творения Микеланджело. Сульфат кальция встречается в природе в виде минерала гипса. Его используют для получения слепков. Для этого применяют полуводный гипс – алебастр.
Выступление хирурга:
Гипс используем и мы, медики, для наложения фиксирующих гипсовых повязок. Сульфат магния, известный под названием горькая или английская соль, используют в качестве слабительного средства. Он содержится в морской воде и придаёт ей горький вкус. Сульфат бария благодаря нерастворимости и способности задерживать рентгеновские лучи применяют в рентгенодиагностике («баритовая каша») для диагностики заболеваний желудочно-кишечного тракта. Остальные соединения бария токсичны.
Из всех заболеваний подростков на первом
месте стоят нарушения опорно-двигательного аппарата. Одна из причин –
недостаточное содержание кальция в пище.
Выступление стоматолога:
А сколько соединений кальция в составе
любой зубной пасты! Из зубной пасты доставляются кальций, фосфор и магний.
Кальций и фосфор являются основными строительными элементами эмали зуба. На
протяжении всей жизни человека они участвуют в обменных процессах. Необходимость
такой добавки обусловлена потребностью зубов в этих элементах при кариесе, и в
еще большей степени при некариозных поражениях зубов. Некариозные поражения
зубов чаще всего связаны с нарушениями функции щитовидной, поджелудочной,
половых желез, заболевания ЖКТ и др., а так же с влиянием внешних
неблагоприятных воздействий (ежедневная длительная — более 6 часов — работа с
компьютером, экологические влияния) вызывающих заметную убыль минеральных
компонентов в тканях зуба, ведущих в начале к повышенной чувствительности
зубов, а затем к повреждению в виде кариеса. В связи с этим местное применение
паст, содержащих фосфорно-кальциевые добавки, позволяет не только предупредить,
но и в известной степени компенсировать потери при наличии заболевания.
В связи с этим местное применение
паст, содержащих фосфорно-кальциевые добавки, позволяет не только предупредить,
но и в известной степени компенсировать потери при наличии заболевания.
Выступление биолога:
Соединения кальция входят в состав скелетов и зубов позвоночных животных. Такие скелеты называются внутренними, и образованы они фосфатом кальция. На долю кальция приходится более 1,5% массы тела человека, 98% кальция содержится в костях.
Карбонат кальция кальция входит в состав наружного скелета животных раковинные корненожки, кораллы, моллюски (раковина, жемчуг). Жемчужина образуется внутри раковины моллюска в результате попадания
туда постороннего предмета (песчинки и др.). Далее вокруг предмета
-«затравки» происходит отложение перламутровых слоёв.
Добыча морского жемчуга ведётся главным образом в Красном море и Персидском заливе, а
также у берегов Шри-Ланки и Японии. Пресноводный жемчуг добывается в Германии, России, Китае и странах Северной Америки. В
настоящее время ведётся не только поиск природного жемчуга, но и выращивание
его в промышленных масштабах (особенно в Японии). Внутрь устрицы помещаются
бусинки из прессованных раковин, после чего устрицы возвращаются в воду. Через
определённое время бусины, покрытые слоями перламутра, извлекаются из устриц.
Искусственный жемчуг в последнее время широко используется как популярный
компонент для создания бижутерии и украшений своими руками. Современные
технологии позволяют создать искусственные жемчужины любых размеров, форм и
цветов, при этом стоимость такого жемчуга существенно ниже натурального.
История знает много примеров поистине гигантских жемчужин. Однако ни одна из
них не дошла до наших дней: жемчужины не живут больше 150-200 лет, после этого
срока камень, увы, рассыпается.
Внутрь устрицы помещаются
бусинки из прессованных раковин, после чего устрицы возвращаются в воду. Через
определённое время бусины, покрытые слоями перламутра, извлекаются из устриц.
Искусственный жемчуг в последнее время широко используется как популярный
компонент для создания бижутерии и украшений своими руками. Современные
технологии позволяют создать искусственные жемчужины любых размеров, форм и
цветов, при этом стоимость такого жемчуга существенно ниже натурального.
История знает много примеров поистине гигантских жемчужин. Однако ни одна из
них не дошла до наших дней: жемчужины не живут больше 150-200 лет, после этого
срока камень, увы, рассыпается.
Выступление географа:
У нас в Карелии есть город, на гербе
которого изображён жемчужный венок на голубом поле. Это Кемь. Именно кемский
жемчуг из рек Керети, Кеми и Куземки очень хвалили специалисты, считали его
образцом пресноводного русского жемчуга «по цвету, блеску и форме». Карельский
жемчуг цвет имел серебристый, чуть-чуть голубоватый. Конечно же, самые крупные
жемчужные зерна превращали в бусы. Кроме того, им расшивали одежду и головные
уборы поморских девушек. В них каждая поморка по праздникам выглядела настоящей
царевной. Такими нарядами очень дорожили, берегли их и передавали из поколения
в поколение. Мелким жемчугом украшали оклады икон в монастырях, расшивали
праздничную одежду священников. Во времена его былой популярности много
драгоценных зерен продавалось и за границу. Хитрые иностранные купцы охотно
скупали поморский жемчуг, а иногда ввозили его снова в Россию под видом более
дорогого «восточного». Поморский жемчуг практически перестали добывать в
кемских реках почти 100 лет назад: мало стало перловиц, упали цены на эти
прекрасные дары кемских рек. Но времена меняются: сегодня по подсчетам
специалистов, в одной из рек северной Карелии обитает около 5 миллионов
жемчужниц. Значит, старинный герб Кеми имеет не только историческое значение.
Современная Кемь украшена по-настоящему богатым жемчужным венком!
Конечно же, самые крупные
жемчужные зерна превращали в бусы. Кроме того, им расшивали одежду и головные
уборы поморских девушек. В них каждая поморка по праздникам выглядела настоящей
царевной. Такими нарядами очень дорожили, берегли их и передавали из поколения
в поколение. Мелким жемчугом украшали оклады икон в монастырях, расшивали
праздничную одежду священников. Во времена его былой популярности много
драгоценных зерен продавалось и за границу. Хитрые иностранные купцы охотно
скупали поморский жемчуг, а иногда ввозили его снова в Россию под видом более
дорогого «восточного». Поморский жемчуг практически перестали добывать в
кемских реках почти 100 лет назад: мало стало перловиц, упали цены на эти
прекрасные дары кемских рек. Но времена меняются: сегодня по подсчетам
специалистов, в одной из рек северной Карелии обитает около 5 миллионов
жемчужниц. Значит, старинный герб Кеми имеет не только историческое значение.
Современная Кемь украшена по-настоящему богатым жемчужным венком!
4. ЭТАП
РЕФЛЕКСИИ
ЭТАП
РЕФЛЕКСИИ
Вам предстоит оценить сегодняшнее занятие с помощью свой руки, пальцев. перечислить, загибая их по очереди, следующие моменты:
М (мизинец) – мышление. Какие знания, опыт я сегодня получил?
Б (безымянный) – близость цели. Что я сегодня делал и чего достиг?
С (средний) – состояние духа, настроения. Каким было моё эмоциональное состояние? Настроение? Изменилось ли? В какую сторону?
У (указательный) – услуга, помощь. Чем я сегодня помог, чем порадовал или чему поспособствовал? Или мне в чем-то помогли?
Б (большой) – бодрость, здоровье. Каким было моё физическое состояние? Что я сделал для своего здоровья?
Конспект урока по теме «Бериллий, магний и щелочноземельные металлы» (9 класс)
Муниципальное общеобразовательное учреждение
«Вышеславская основная школа» Гаврилов-Ямский район
Открытый урок химии в 9 классе
по теме:
«Бериллий, магний и щелочноземельные металлы»
Разработала учитель химии
Рыжакова Нина Юрьевна
Цель урока:
Дать общую
характеристику металлов главной подгруппы II
группы периодической системы химических элементов. Рассмотреть основные
физические и химические свойства, выявить сходства и особенности.
Рассмотреть основные
физические и химические свойства, выявить сходства и особенности.
Задачи:
Образовательные: продолжить работу формирования у учащихся умений давать характеристику хим. элемента по его положению в ПС, описывать физические, химические свойства элементов II группы главной подгруппы, расширить представления учащихся о соединениях химических элементов.
Развивающие: повысить познавательный интерес учащихся, развить навыки работы учащихся с учебной литературой, интеллектуального труда, умения логически мыслить, умения выполнять умственные операции: обобщение, сравнение, анализ, делать вывод, навыки познавательной исследовательской деятельности, умения прогнозировать результат.
Воспитательные: прививать постоянный интерес к предмету, навыки коммуникативности, рефлексии, воспитывать нравственные качества: волю, настойчивость, аккуратность, самостоятельность.
Тип урока: изучение новых знаний.
Методы и методические приемы:
Проблемно-поисковый
метод, беседа, самостоятельная работа с учебником, выполнение опытов, выводы,
выполнение упражнений, проверка, взаимопроверка.
Оборудование:
учебник Химия ─ 9 (Габриелян О.С.), дидактический лист – паспорт элементов изучаемой группы (каждому ученику), химическая посуда ─ пробирки, спиртовка, реактивы для демонстрации: магний и карбонаты, сульфаты, фосфаты, хлориды кальция и магния.
Ход урока:
I. Организационный момент
II. Актуализация учебного материала
Формулирование темы и цели урока (слайд 1)
Цель урока: (слайд 2)
1. Давать характеристику химических элементов по плану.
2. Совершенствовать навыки составления уравнений реакций электронного баланса ОВР, проведения и наблюдения химического эксперимента.
3. Продолжить формирование умений анализировать, делать выводы, работать самостоятельно.
Когда знакомились с темой «Щелочные металлы» мы составили план изучения материала. Давайте вспомним этот план.
1. Строение на
основе положения в периодической системе. Предсказание свойств. Физические
свойства металлов главной подгруппы II
группы ПС.
Предсказание свойств. Физические
свойства металлов главной подгруппы II
группы ПС.
2. Химические свойства металлов главной подгруппы II группы ПС.
3. Распространение в природе. Соединения магния и щелочноземельных металлов.
/На каждой парте план характеристики элемента и образованных им веществ
1. Охарактеризуйте положение элементов в ПСХЭ: подгруппа, группа.
2. Назовите элементы подгруппы.
3. Составьте электронные формулы первых трех элементов подгруппы.
4. Определите, что общего в строении атомов элементов, какова степень окисления в соединениях.
5. Назовите физические свойства и условия хранения.
6. Исходя из электронного строения атомов, охарактеризуйте химические свойства элементов главной подгруппы II группы (Восстановительные или окислительные).
7. Сравните количество химических свойств элементов (изменение при увеличении порядкового номера элемента).
8.
Записать уравнения реакций, характеризующие химические свойства металлов
(взаимодействие с другими веществами).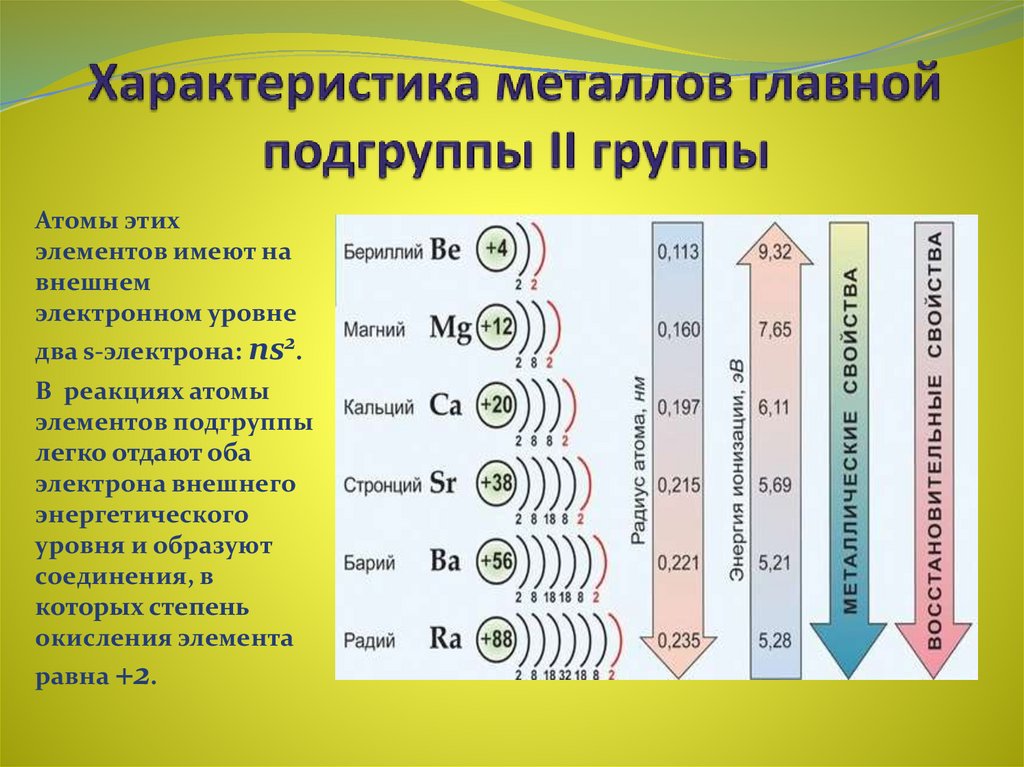 Разобрать в свете ОВР.
Разобрать в свете ОВР.
9. Оксиды и гидроксиды этих элементов, формулы, свойства.
10. Генетические ряды.
11. Соли, применение/ для учащихся
В отличие от металлов главной подгруппы I группы, которые все относятся к группе щелочных металлов, не все элементы главной подгруппы II группы относятся к естественному семейству щелочноземельных металлов. К ЩЗМ относят кальций, стронций, барий, радий. Радий естественно-радиоактивный элемент, но его химические свойства соответствуют свойствам ЩЗМ.
Давайте обратимся к ПСХЭ и назовем все элементы главной подгруппы II группы (бериллий, магний и ЩЗМ).
─ Составьте электронные формулы атомов элементов с порядковыми номерами 4,12, 20:
+4Ве 2е; 2е; +12Mg 2е; 8е; 2е; +20Са 2е; 8е; 8е; 2е;
─ Что общего в атомном строении элементов главной подгруппы II группы?
·
Общим является одинаковое строение
внешнего электронного слоя, у всех этих элементов на последнем слое находится 2
электрона.
─ Поэтому эти элементы будут проявлять постоянную степень окисления + 2.
─ Исходя из электронного строения атомов, охарактеризуйте химические свойства элементов главной подгруппы II группы.
· Атомы этих элементов являются сильными восстановителями, т.к. содержат 2 электрона на внешнем энергетическом уровне, которые они отдают при взаимодействии с другими соединениями.
─ Как изменяются химические свойства элементов главной подгруппы II группы при увеличении порядкового номера элемента.
· С увеличением порядкового номера элемента увеличивается атомный радиус, увеличивается число электронных слоев, следовательно, возрастает легкость отдачи электронов. Поэтому, восстановительные свойства элементов главной подгруппы II группы сверху вниз увеличиваются. Самый сильный восстановитель во II группе ─ радий (слайд 3)
─ Почему металлический магний хранят на воздухе, а ЩЗМ под слоем керосина?
·
Очевидно, химическая активность магния
ниже, чем у ЩЗМ.
─ Сравните химическую активность щелочных и щелочноземельных элементов.
· Химическая активность ЩЗЭ ниже, чем у щелочных металлов.
Физические свойства металлов.
Прочитайте на с. 96 абзац снизу. Слайд № 4.
· Ве ─ светло-серый, достаточно твердый, хрупкий металл;
· Mg ─ относительно мягкий, пластичный и ковкий металл;
· Са ─ достаточно твердый, пластичный металл;
· Sr ─ ковкий; Ва ─ пластичный, ковкий металл.
· На воздухе при обычной температуре поверхность бериллия и магния покрывается защитной оксидной пленкой. Щелочноземельные металлы взаимодействуют с кислородом воздуха более активно, поэтому их хранят под слоем керосина или в запаянных сосудах, как и щелочные металлы.
Посмотрим фрагмент урока (до соединений) по адресу
https://resh.edu.ru/subject/lesson/3124/start/
Химические свойства металлов.
Элементы главной подгруппы II группы взаимодействуют с:
1) неметаллами
(О2, S, Cl2, N2, H2) Слайд 5.
При нагревании на воздухе все рассматриваемые металлы энергично сгорают с образованием оксидов. Для записи уравнений реакций также воспользуемся общим обозначением металлов М:
2М + О2 = 2МО
Реакция сжигания магния сопровождается ослепительной вспышкой, раньше она применялась при фотографировании объектов в темных помещениях. В настоящее время используют электрическую вспышку.
(Видеоролики о горении металлов в кислороде)
Бериллий, магний и все щелочноземельные металлы взаимодействуют при нагревании с неметаллами — хлором, серой, азотом и т. д., образуя соответственно хлориды, сульфиды, нитриды:
2) Из всех
металлов главной подгруппы II группы только бериллий практически не взаимодействует
с водой (препятствует защитная пленка на его поверхности), магний реагирует
с ней медленно, остальные металлы бурно взаимодействуют с водой при обычных
условиях: Рис. 54, с. 98.
Записать уравнения реакций на примере
кальция и разобрать две любые реакции в свете ОВР.
3) Подобно алюминию магний и кальций способны восстанавливать редкие металлы — ниобий, тантал, молибден, вольфрам, титан и др. — из их оксидов.
2Mg + TiO2 = 2MgO + Ti
Такие способы получения металлов по аналогии с алюминотермией называют магниетермией и кальциетермией.
3) Взаимодействуют ли магний и кальций с кислотами?
─ Стружки магния насыпают в пробирку и приливают соляной кислоты, в результате реакции бурно выделяется водород.
Mg +2HCl = MgCl2 +H2
Вывод. Магний взаимодействует с кислотами, вытесняя водород, а кальций взаимодействует с водой, которая содержится в растворе кислоты.
Рефлексия
Самостоятельная работа для закрепления изученного материала (слайды 6, 7, 8)
Взаимопроверка (слайд 9)
Металлы в природе
В каком виде существуют в природе бериллий, магний и ЩЗМ ─ в самородном состоянии или в виде соединений?
·
Содержатся в природе только в виде
соединений. Почему?
Почему?
· Вследствие своей высокой химической активности.
Применение металлов
Магний и кальций применяют для производства редких металлов и легких сплавов. Например, магний входит в состав дюралюминия, а кальций — один из компонентов свинцовых сплавов, необходимых для изготовления подшипников и оболочек кабелей.
─ Генетические ряды бериллия и кальция (слайд 12)
Давайте попробуем составить генетический ряд металла, которому соответствует щелочь на примере кальция и генетический ряд амфотерного металла, которому на примере бериллия:
Ca à CaO à Ca(OH)2 à Ca(NO3)2 à CaSO4
Be à BeO à BeCl2 à Be(OH)2 à BeSO4
Na2BeO2
Задание на дом: п.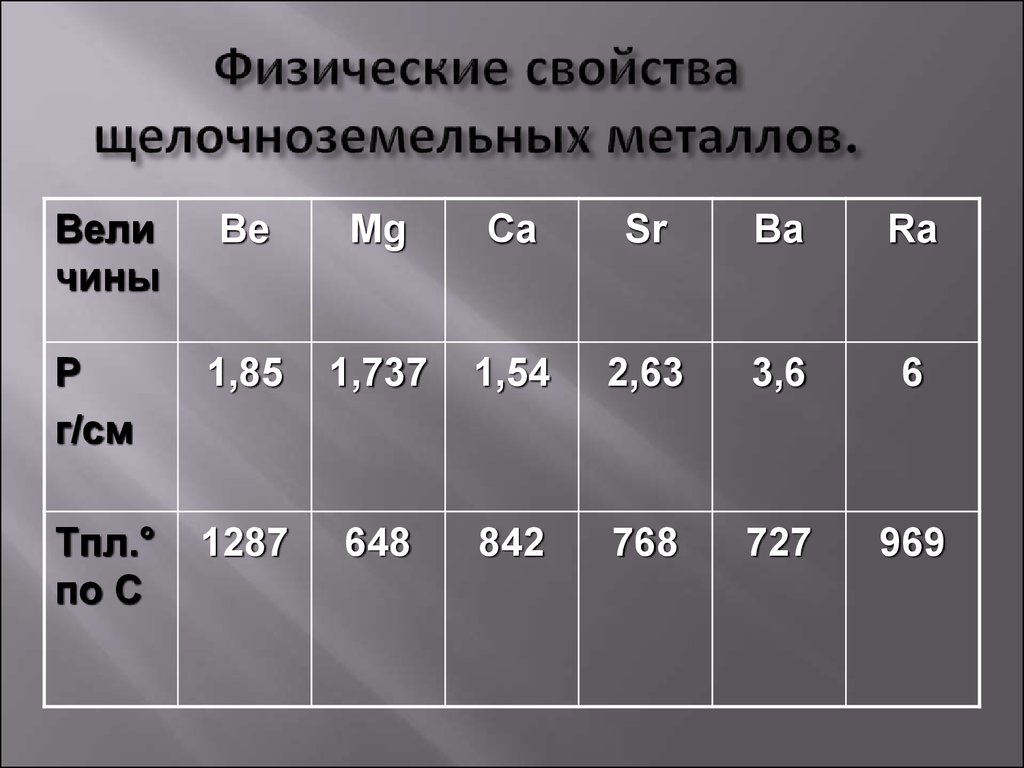 15, с.96-106, № 1, с.106 и записать соответствующие уравнения
реакций для двух генетических рядов.
15, с.96-106, № 1, с.106 и записать соответствующие уравнения
реакций для двух генетических рядов.
Найти интересные сведения о соединениях ЩЗМ и их применении. Составить небольшие сообщения (слайды 10, 11).
Ресурсы:
1. Габриелян О.С. Химия 9 класс: учебник для общеобразовательных учреждений/ Габриелян О.С. – М.:Дрофа, 2019. – 319 с.: ил.
2. Урок 24. Щелочноземельные металлы https://resh.edu.ru/subject/lesson/3124/start/
3. Видеоролики о горении магния и кальция.
https://my.mail.ru/mail/sergei-solodkii/video/chem/110.html
https://ok.ru/video/3197307491
4. Презентация
12.3: Группа II – Щелочные земли
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 49501
- Эд Витц, Джон В.
 Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан
Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан - Цифровая библиотека химического образования (ChemEd DL)
Группа IIA, также известная как щелочноземельных металлов , включает бериллий, магний, кальций, стронций, барий и радий. Последний член группы, Ра, является радиоактивным и здесь не рассматривается. Все щелочноземельные металлы серебристо-серого цвета, пластичные и относительно мягкие. Однако следующая таблица показывает, что они намного плотнее, чем металлы группы IA, и их температуры плавления значительно выше. Они также тверже, чем щелочные металлы. Это может быть связано с общей конфигурацией валентных электронов ns 2 для щелочноземельных металлов, который включает два электрона на атом металла в металлической связи (вместо одного, как в щелочном металле).
| Элемент | Символ | Электронная конфигурация | Обычная степень окисления< | Радиус/м | |
|---|---|---|---|---|---|
| Атомный | Ионная (M 2+ ) | ||||
| Барий | Ба | [Хе]6 с 2 | +2 | 198 | 135 |
| Бериллий | Быть | [Не]2 с 2 | +2 | 89 | 31 |
| Кальций | Са | [Ar]4 с 2 | +2 | 174 | 99 |
| Магний | Мг | [Ne]3 с 2 | +2 | 136 | 65 |
| Стронций | Старший | [Кр]5 с 2 | +2 | 191 | 113 |
| Символ | Энергия ионизации/МДж моль –1 | Плотность/ г см –3 | Электроотрицательность | Температура плавления (в °C) | ||
|---|---|---|---|---|---|---|
| Первый | Второй | Третий | ||||
| Бе | 0,906 | 1,763 | 14,86 | 1,86 | 1,5 | 1278 |
| мг | 0,744 | 1,467 | 7,739 | 1,74 | 1,2 | 651 |
| Ca | 0,596 | 1,152 | 4,918 | 1,54 | 1,0 | 839 |
| Старший | 0,556 | 1,071 | 4,21 | 2,60 | 1,0 | 769 |
| Ба | 0,509 | 0,972 | 3,43 | 3,51 | 0,9 | 725 |
Энергии первой и второй ионизации для щелочноземельных металлов (соответствующие удалению первого и второго валентных электронов) относительно малы, но разрушение октета удалением третьего электрона гораздо сложнее.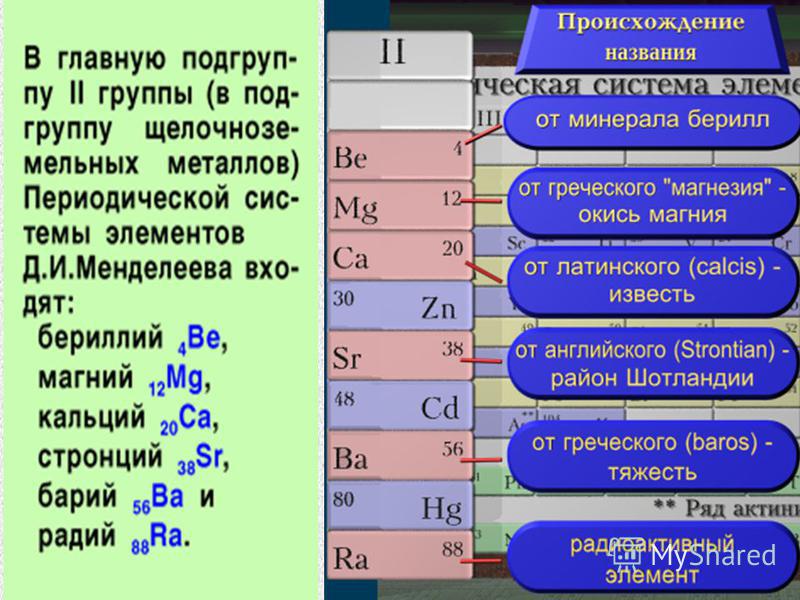 Подобно щелочным металлам, атомы щелочноземельных металлов легко теряют электроны, поэтому они являются хорошими восстановителями. Другие тенденции среди данных в таблице соответствуют нашим ожиданиям. Энергии ионизации и электроотрицательности уменьшаются сверху вниз по группе, а атомные и ионные радиусы увеличиваются. Радиусы щелочноземельных ионов +2 намного меньше, чем у ионов щелочных металлов +1 того же периода, потому что больший заряд ядра более плотно удерживает внутренние оболочки. Этот эффект достаточно велик, поэтому щелочная земля ниже и правее данного щелочного металла в периодической таблице часто имеет почти такой же ионный радиус. Таким образом, Na + (95 пм), может соответствовать точно такому же типу кристаллической решетки, что и Ca 2 + (99 пм), и эти два элемента часто встречаются в одних и тех же минералах. То же самое верно для K + и Ba 2 + . Ниже приведена таблица щелочных металлов для сравнения с таблицей щелочноземельных металлов.
Подобно щелочным металлам, атомы щелочноземельных металлов легко теряют электроны, поэтому они являются хорошими восстановителями. Другие тенденции среди данных в таблице соответствуют нашим ожиданиям. Энергии ионизации и электроотрицательности уменьшаются сверху вниз по группе, а атомные и ионные радиусы увеличиваются. Радиусы щелочноземельных ионов +2 намного меньше, чем у ионов щелочных металлов +1 того же периода, потому что больший заряд ядра более плотно удерживает внутренние оболочки. Этот эффект достаточно велик, поэтому щелочная земля ниже и правее данного щелочного металла в периодической таблице часто имеет почти такой же ионный радиус. Таким образом, Na + (95 пм), может соответствовать точно такому же типу кристаллической решетки, что и Ca 2 + (99 пм), и эти два элемента часто встречаются в одних и тех же минералах. То же самое верно для K + и Ba 2 + . Ниже приведена таблица щелочных металлов для сравнения с таблицей щелочноземельных металлов.
| Элемент | Символ | Электронная конфигурация | Обычная степень окисления | Радиус/м | |
|---|---|---|---|---|---|
| Атомный | Ионный (М + ) | ||||
| Литий | Ли | [Не]2 с 1 | +1 | 122 | 60 |
| Натрий | На | [Ne]3 с 1 | +1 | 157 | 95 |
| Калий | К | [Ar]4 с 1 | +1 | 202 | 133 |
| Рубидий | руб | [Кр]5 с 1 | +1 | 216 | 148 |
| Цезий | Cs | [Хе]6 с 1 | +1 | 235 | 169 |
| Символ | Энергия ионизации/МДж моль –1 | Плотность/ г см –3 | Электроотрицательность | Температура плавления (в °C) | |
|---|---|---|---|---|---|
| Первый | Второй | ||||
| Ли | 0,526 | 7. 305 305 | 0,534 | 1,0 | 179 |
| Нет данных | 0,502 | 4,569 | 0,97 | 0,9 | 98 |
| К | 0,425 | 3,058 | 0,86 | 0,8 | 64 |
| руб | 0,409 | 2,638 | 1,52 | 0,8 | 39 |
| Кс | 0,382 | 2. 430 430 | 1,87 | 0,7 | 28 |
Сходство ионных радиусов также приводит к родственным свойствам Li и Mg. Поскольку эти два элемента соседствуют по диагональной линии из левого верхнего угла в правый нижний в таблице Менделеева, их сходство называется диагональным отношением . Диагональные отношения в основном проявляются во втором и третьем периодах: Be во многом подобен Al, а B во многом подобен Si.
Дальше к правой части таблицы такие связи менее выражены. Наиболее поразительное сходство между Li и Mg заключается в их способности образовывать ковалентные связи с элементами средней электроотрицательности, такими как C, и при этом образовывать довольно ионные соединения с более электроотрицательными элементами, такими как O или F. Два примера ковалентных соединений — этиллитий, CH 3 CH 2 Li и диэтилмагний, (CH 3 CH 2 ) 2 Mg. Такие соединения вероятны в случае Li и Mg, но не щелочных или щелочноземельных металлов ниже их, потому что Li + и Mg 2+ достаточно малы, чтобы сильно поляризоваться и, таким образом, образовывать связи со значительным ковалентным характером.
Такие соединения вероятны в случае Li и Mg, но не щелочных или щелочноземельных металлов ниже их, потому что Li + и Mg 2+ достаточно малы, чтобы сильно поляризоваться и, таким образом, образовывать связи со значительным ковалентным характером.
Щелочноземельные металлы реагируют непосредственно с большинством неметаллических элементов. образуя За исключением бериллия, щелочноземельные металлы реагируют непосредственно с газообразным водородом с образованием гидридов, MH 2 ; M = Mg, Ca, Sr, Ba или Ra. Гидрид бериллия, BeH 2 , также можно получить, но не непосредственно из элементов. Щелочноземельные металлы легко соединяются с кислородом воздуха с образованием оксидов МО. Это соответствует общей реакции:
\[\text{2M}(s) + \text{O}_2(g) \rightarrow \text{2MO}_2(s) \nonumber \] M = Be, Mg, Ca , Sr, Ba или Ra
В следующем видео показана реакция магния с кислородом:
В видео магний сгорает на воздухе и испускает яркое белое пламя. Белый порошок MgO остается после реакции, описываемой уравнением:
Белый порошок MgO остается после реакции, описываемой уравнением:
\[\text{2Mg}(т) + \text{O}_2(г) \rightarrow \text{2MgO}_2(т) \номер \]
Следует также отметить, что хотя MgO является основным продукта, азот также присутствует в воздухе, поэтому некоторое количество нитрида магния также образуется в соответствии с химическим уравнением:
\[\text{Mg}(s) + \text{N}_2(g) \rightarrow \text {Mg}_3\text{N}_2(s) \nonumber \]
Эти оксиды покрывают поверхность металла и предотвращают контакт и реакцию с ним других веществ. Хорошим примером действия такого оксидного покрытия является реакция щелочноземельных металлов с водой. Бериллий и магний реагируют гораздо медленнее, чем другие, потому что их оксиды нерастворимы и препятствуют контакту воды с металлом.
Щелочноземельные металлы реагируют непосредственно с галогенами с образованием солей:
\[\text{M}(s) + \text{Cl}_2(g) \rightarrow \text{MCl}_2(s) \nonumber \ ] M = Be, Mg, Ca, Sr, Ba или Ra
Соль, полученная выпариванием морской воды (морская соль), содержит большое количество хлорида магния и хлорида кальция, а также хлорида натрия. В нем также есть небольшие следы йодистых солей, что объясняет отсутствие простого зоба в сообществах, которые получают соль из океанов. Простой зоб – это увеличение щитовидной железы, вызванное дефицитом йода.
В нем также есть небольшие следы йодистых солей, что объясняет отсутствие простого зоба в сообществах, которые получают соль из океанов. Простой зоб – это увеличение щитовидной железы, вызванное дефицитом йода.
Щелочные земли также образуют сульфиды: MS. Во всех этих соединениях щелочноземельные элементы встречаются в виде двух положительных ионов: Mg 2 + , Ca 2 + , Sr 2 + или Ba 2
Подобные соединения Be могут быть образованы окольными путями, но не прямой комбинацией элементов. Кроме того, соединения Be более ковалентны, чем ионы. Ион Be 2 + имеет очень малый радиус (31 пм) и поэтому способен искажать (поляризовать) электронное облако аниона в своей окрестности. Поэтому все связи с участием Be носят в значительной степени ковалентный характер, и химический состав Be существенно отличается от других членов группы IIA.
Как и в случае щелочных металлов, наиболее важные и распространенные щелочноземельные элементы, Mg и Ca, находятся в третьем и четвертом периодах. Be встречается редко, хотя его прочность и низкая плотность позволяют использовать его в некоторых специальных сплавах. Sr и Ba встречаются в природе в виде относительно нерастворимых сульфатов SrSO 4 (стронтианит) и BaSO 4 (барит), но эти два элемента имеют второстепенное коммерческое значение.
Be встречается редко, хотя его прочность и низкая плотность позволяют использовать его в некоторых специальных сплавах. Sr и Ba встречаются в природе в виде относительно нерастворимых сульфатов SrSO 4 (стронтианит) и BaSO 4 (барит), но эти два элемента имеют второстепенное коммерческое значение.
Наиболее распространенными рудами Mg и Ca являются доломит, MgCO 3 •CaCO 3 , в честь которого назван весь горный массив в Италии, и известняк CaCO 3 , важный строительный материал. Mg также извлекается из морской воды в широких масштабах. Оксиды щелочноземельных металлов обычно получают нагреванием карбонатов. Например, известь CaO получают из известняка следующим образом:
\[\text{CaCO}_3(s) \xrightarrow{\Delta } \text{CaO}(s) + \text{CO}_2(g ) \номер \]
За исключением BeO, который связан ковалентно, оксиды щелочноземельных металлов содержат O 2– и являются сильноосновными. При обработке водой (процесс, известный как гашение ), они превращаются в гидроксиды:
\[\text{CaO}(s) + \text{H}_2\text{O}(l) \rightarrow \ text{Ca(OH)}_2(s) \nonumber \]
Ca(OH) 2 (гашеная известь) является важным прочным основанием для промышленного применения, поскольку он дешевле, чем NaOH.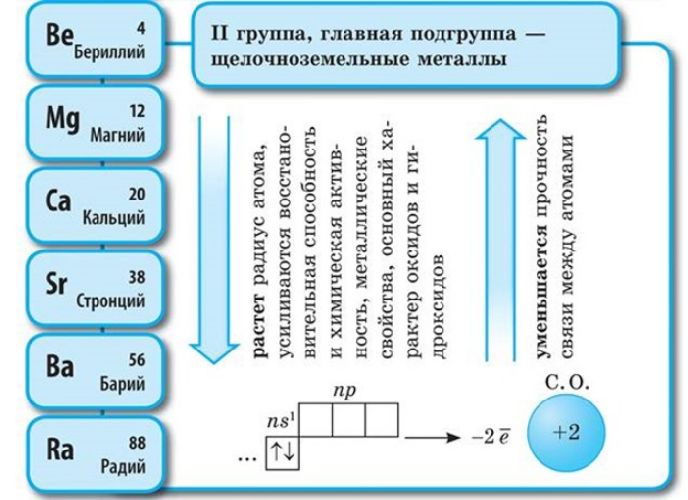
MgO имеет чрезвычайно высокую температуру плавления (2800°C) из-за близкого расположения и больших зарядов входящего в его состав Mg 2 + и O 2– в кристаллической решетке. В твердом состоянии он является хорошим электрическим изолятором, поэтому его используют для окружения нагревательных проводов с металлическим сопротивлением в электрических плитах. MgO также используется для футеровки высокотемпературных печей. При преобразовании в гидроксид Mg находит другое применение. Mg(OH) 2 совершенно нерастворим в воде, поэтому он не дает достаточно высокой концентрации гидроксид-ионов, чтобы быть едким. Однако он является щелочным, и грамм за граммом может нейтрализовать почти в два раза больше кислоты, чем NaOH. Следовательно, суспензия Mg(OH) 2 в воде (молоке магнезии) является отличным антацидом для тех, кто может выдержать его вкус.
Поскольку ион карбоната ведет себя как основание Бренстедта-Лоури, соли карбоната растворяются в кислых растворах. {-}(водн.) \nonumber \]
{-}(водн.) \nonumber \]
Эта реакция часто происходит под землей, когда дождевая вода, насыщенная CO 2 , просачивается сквозь слой известняка. Пещеры, в которых растворился известняк, часто преобладают в районах, где имеются большие залежи CaCO 3 . Кроме того, грунтовые и колодезные воды на таких участках становятся жесткими. Жесткая вода содержит заметные концентрации Ca 2 + , Mg 2 + и некоторых других ионов металлов. Они образуют нерастворимые соединения с мылом, вызывая творожистый, пенистый осадок. Жесткую воду можно смягчить добавлением Na 9.0594 2 CO 3 , стиральная сода, которая осаждает CaCO 3 , или путем ионного обмена , процесс, в котором нежелательные ионы Ca 2 + и Mg + 3 9003 3 9003 заменяются в 3 7 9003 раствор ионами Na + , которые не осаждают мыло. Большинство домашних умягчителей воды работают по последнему принципу.
Эта страница под названием 12.3: Группа II — Щелочные земли распространяется под лицензией CC BY-NC-SA 4.0, ее авторами, ремиксами и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина. , Тим Вендорф и Адам Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ХимПРАЙМ
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- щелочноземельный металл
- отношение диагонали
- Жесткая вода
- Ионный обмен
- Гашение
неорганическая химия. Является ли бериллий щелочноземельным металлом?
спросил
Изменено 11 месяцев назад
Просмотрено 12 тысяч раз
$\begingroup$
Для контекста: я получил вопрос: «Какие из следующих щелочноземельные металлы не окрашивают пламя?». Я быстро отметил $\ce{Be}$ и $\ce{Mg}$ и получил отрицательные оценки.
Я быстро отметил $\ce{Be}$ и $\ce{Mg}$ и получил отрицательные оценки.
Далее цитата из моей книги (курсив в оригинал):
К элементам группы 2 относятся бериллий, магний, кальций, стронций, барий и радий. Эти элементы, за исключением бериллия, широко известны как щелочноземельные металлы . Они так называются, потому что их оксиды и гидроксиды имеют щелочную природу, и эти оксиды металлов находятся в земной коре.
Как видите, сказано, что бериллий не является щелочноземельным металлом!
Является ли бериллий щелочноземельным металлом или нет?
- неорганическая химия
- терминология
- щелочноземельные металлы
$\endgroup$
5
$\begingroup$
Существуют некоторые разногласия в использовании среди авторов, но стандартная номенклатура ИЮПАК одобряет название бериллия щелочноземельный металл , как объяснено на странице 51 последней Красной книги ИЮПАК .
Фактически, все элементы, принадлежащие к группе 2, $\ce{Be,Mg,Ca,Sr,Ba,Ra}$, называются щелочноземельными металлами с одобрения IUPAC.
Другими распространенными традиционными названиями, утвержденными IUPAC, являются щелочных металлов для элементов группы 1, кроме водорода, т.е. $\ce{Li,Na,K,Rb,Cs,Fr}$; галогенов для $\ce{F,Cl,Br,I,At}$ в группе 17, единственный член которой исключен из такого обозначения $\ce{Uus}$ (теперь $\ce{Ts}$), и благородных газов для всех элементов группы 18, кроме $\ce{Uuo}$ (сейчас $\ce{Og}$), т.е. $\ce{He,Ne,Ar,Kr,Xe,Rn}$.
$\endgroup$
$\begingroup$
Если мы будем придираться к тому, что щелочноземельные металлы являются «щелочноземельными» в собственном смысле, то их всего два: кальций и магний. Оксид бериллия не может быть щелочным, а более тяжелые оксиды группы 2 (или гидроксиды, образующиеся при реакции с водой) слишком легко растворимы, чтобы действительно быть «землями».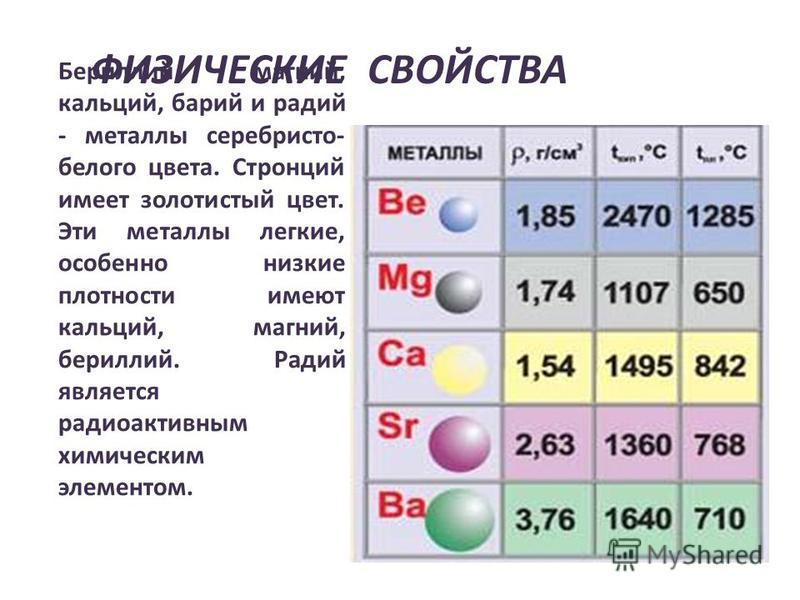
По сравнению с другими металлами группы 2, кальций и магний настолько распространены, что фактически (без каламбура) являются тезками всей группы. Таким образом, как утверждает ИЮПАК, фраза «щелочноземельные металлы» распространилась на всю группу 2.
$\endgroup$
$\begingroup$
Щелочные металлы называются так по двум причинам:
Их получают из земли в виде руд
Их оксиды и гидроксиды имеют основную (щелочную) природу.
Бериллий соответствует первому критерию, но не второму, поскольку его оксиды и гидроксиды проявляют амфотерное поведение, а не щелочное. Таким образом, он не считается щелочноземельным металлом в истинном смысле, хотя и напоминает их по другим свойствам.
Итак, если спросить, какой металл группы 2 не считается щелочноземельным металлом, то ваш ответ должен быть бериллий. В противном случае вам, вероятно, следует рассматривать бериллий как щелочноземельный металл.

 Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан
Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан